嘌呤是由一个嘧啶环和一个咪唑环稠合形成的生物碱类物质,主要包括鸟嘌呤、次黄嘌呤、腺嘌呤和黄嘌呤及其衍生物等[1]。在嘌呤代谢中,鸟苷分别被嘌呤核苷酶和鸟嘌呤脱氨酶代谢为鸟嘌呤和黄嘌呤。肌苷分别被嘌呤核苷酶和黄嘌呤脱氢酶/氧化酶代谢为次黄嘌呤和黄嘌呤[2],尿酸是嘌呤代谢的最终产物,嘌呤类物质代谢失衡将引起高尿酸血症[3],伴发高血压、肥胖症等多种慢性疾病[4]。 因此,控制机体尿酸水平对维持身体健康尤为重要。 肠道是机体尿酸排泄的第二大途径,约占尿酸排泄量的30%~40%,肠道尿酸排泄过程受阻与高尿酸血症的发生发展密切相关[5]。肠道中的尿酸可被肠上皮细胞吸收进入血液,从而升高血尿酸水平,肠液尿酸水平和总尿酸含量呈正相关性[6]。肠上皮细胞高水平表达嘌呤类物质转运相关蛋白,葡萄糖转运蛋白9(glucose transporter 9,GLUT9)在尿酸的重吸收过程中起着关键作用[7],抑制肠道GLUT9的表达,可降低高尿酸血症实验动物的血尿酸水平[8]。浓缩型核苷酸转运蛋白(concentration nucleoside transporters,CNTs)位于肠上皮细胞顶膜,该转运载体是食物来源的嘌呤类物质在肠道吸收的主要蛋白,CNT1转运嘧啶核苷,CNT2转运嘌呤核苷,CNT3两类核苷酸均可转运[9]。当CNT2的活性被抑制后,可降低高尿酸血症大鼠的血尿酸水平[8]。
近年来,食物来源的乳酸菌因具有降解嘌呤类物质的能力,能预防或缓解高尿酸血症[10-11]。李杰等[12]从传统发酵大酱和自制泡菜中筛选出一株植物乳植杆菌,其对鸟苷和肌苷的降解率达到99.33%。红酸汤是贵州凯里地区苗族和侗族传统发酵食品,以西红柿和辣椒为主要原料经自然发酵而来。课题组前期研究结果表明,红酸汤的摄入与黔东南苗族和侗族人群高尿酸血症的发生呈负相关[13]。发酵后红酸汤中嘌呤物质含量(鸟苷、腺苷、鸟嘌呤等)下降,且与短杆菌、乳杆菌等呈负相关[14]。但目前,乳酸菌降解嘌呤类物质对肠上皮细胞代谢核苷的影响鲜见报道。
本研究以从红酸汤中分离得到的鸟苷降解能力强,且嘌呤代谢产物低的乳酸菌ST-11为研究对象,通过形态学观察、分子生物学技术对菌株进行鉴定,采用高效液相色谱(high performance liquid chromatography,HPLC)测定菌株ST-11对核苷和嘌呤类物质的降解能力,利用人结直肠癌细胞(Caco-2细胞)考察菌株对肠上皮细胞代谢核苷及相关转运蛋白的基因表达的影响。以期获得一株具有潜在降尿酸作用的乳酸菌,为预防高尿酸血症提供研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 引物、菌株与细胞
乳酸菌(ST-11):分离于贵州自然发酵的红酸汤;人结直肠腺癌(Caco-2细胞):武汉普诺赛生命科技有限公司。基因引物序列见表1。
表1 基因引物序列
Table 1 Gene primer sequence

目的基因正向引物(5'-3')反向引物(5'-3')CNT1(人)CNT2(人)CNT3(人)GLUT9(人)GAPDH(人)CCTCACCTGTGTGGTCCTCA AGGACTGACGCACAAGGAC GCCTTTGACACTGCCAAATTG CGCCAACCCCAACAGCATCC CAACGGATTTGGTCGTATTGGG AGACCCCTCTTAAACCAGAGC ATAGGCAGCATAGGCCAAACA CGATTCCCCATAAGACAGGTCTC TCCGCCTTCCCGTCGTAGTG AAGGGGTCATTGATGGCAAC
1.1.2 试剂
肌苷、鸟苷、鸟嘌呤、黄嘌呤、次黄嘌呤和尿酸(均为分析纯):上海阿拉丁生化科技股份有限公司;通用基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒D2100:北京索莱宝科技有限公司;青霉素-链霉素双抗、胰蛋白酶-乙二胺四乙酸:南京维森特生物技术有限公司;Trizol、TB Green Premix Ex TaqTM II试剂、反转录试剂盒:日本Takara生物工程有限公司。
1.1.3 培养基
MRS培养基:杭州百思生物技术有限公司;杜氏改良(dulbecco's modified eagle medium,DMEM)培养基:美国Gibco公司。
1.2 仪器与设备
G1311B高效液相色谱(HPLC)仪:安捷伦科技新加坡(国际)有限公司;TG16-WS台式高速离心机:常州朗越仪器制造有限公司;SU8100扫描电子显微镜:日本日立公司;CFX96荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad有限公司。
1.3 方法
1.3.1 菌株ST-11的鉴定
(1)形态学观察
观察单菌落颜色、形状、边缘、表面等特征,参考《常见细菌系统鉴定手册》[15];经革兰染色后观察菌体颜色、形状、排列方式等形态特点;采用扫描电镜观察菌株的表面纹理、表面分布和排列方式。
(2)分子生物学鉴定
DNA提取:使用通用基因组DNA提取试剂盒提取乳酸菌ST-11基因组DNA,作为PCR扩增的模板。
PCR扩增:以提取的DNA作为模板,引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')对菌株16S rDNA序列进行PCR扩增。PCR扩增体系(25 μL):Mix 12.5 μL,模板DNA 2.5 μL,27F 0.5 μL,1492R 0.5 μL,双蒸水(ddH2O)9 μL。PCR扩增条件:95 ℃预变性10 min;94 ℃变性30 s、56 ℃退火30 s、72 ℃延伸90 s,共34个循环;72 ℃再延伸10 min,即得到PCR产物。
PCR产物经2%琼脂糖凝胶电泳后送生工生物工程公司测定序列。将16S rDNA序列提交美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)核酸数据库比对,采用MEGA7软件中的邻接(neighbor-joining,NJ)法构建系统发育树[16]。
1.3.2 菌株ST-11益生特性分析
乳酸菌耐酸、耐胆盐能力:参考LIN J X等[17]的方法,并稍作修改。 在耐酸试验中,按照2%的接种量将菌悬液分别接种于pH 2(1 mol/L的盐酸调节pH)和0.3%胆盐的MRS肉汤培养基中,于37 ℃培养4 h,分别在0 h和4 h用平板计数法测定活菌数。乳酸菌存活率计算公式如下:
式中:N0和Nt分别为酸、胆盐处理前后的乳酸菌活菌数,CFU/mL。
乳酸菌的自聚集能力:参考RODRIGUEZ-SANCHEZ S等[18]的方法,将活化后的菌体,使用磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤2次,重悬于PBS中,混匀调整菌浓度在波长为600 nm处的吸光度值(OD600nm值)为0.55~0.65,涡旋混匀30 s,吸取4 mL调整好的菌悬液加入干净的试管中,于室温静置24 h,取上清液测定OD600 nm值。自聚集率计算公式如下:
式中:A0为0 h吸光度值,At为静置24 h的吸光度值。
乳酸菌的疏水率测定:参考BAUTISTA-GALLEGO J等[19]方法,使用PBS洗涤活化后的菌体2次,重悬于PBS中,OD600nm值记为A0,取4 mL菌悬液向其加入0.8 mL二甲苯后,漩涡混匀2 min,于室温静置30 min,取下层水相,测定其OD600nm值(A1),疏水率计算公式如下:
乳酸菌黏附率:按照方法1.3.2收集菌体,参照RAVESCHOT C等[20]的方法,采用含有20%胎牛血清,1%青霉素-链霉素双抗的DMEM培养基,将菌浓度调整至1×108 CFU/mL,Caco-2细胞以1×104个/mL的密度接种于24孔中,待Caco-2细胞贴壁且密度达到80%时,用PBS润洗2次后,加入1 mL含有菌株的DMEM培养基,于37 ℃、5%CO2培养箱孵育2 h,随后用PBS润洗2次,洗掉未吸附的乳酸菌。 加入100 μL的0.1%(V/V)Triton X-100孵育15 min。随后将含有贴壁乳酸菌的裂解液稀释涂布计数。黏附率计算公式如下:
式中:A0为菌体初始菌落数,CFU/mL;A1为与Caco-2细胞黏附的菌落数,CFU/mL。
1.3.3 菌株ST-11对核苷及嘌呤物质的降解能力测定
乳酸菌对核苷及嘌呤物质的降解能力测定采用高效液相色谱法[21],并稍作修改。
样品预处理:菌株在37 ℃条件下培养24 h后,按2%的接种量将菌悬液接种于MRS液体培养基,于37 ℃条件培养18 h,8 000 r/min离心5 min,收集菌体,使用PBS(pH7.0)洗涤2次,菌浓度调整至1×108 CFU/mL后,于8 000 r/min离心5 min,收集菌体,将菌体分别重悬于含1.21 mmol/L鸟苷、1.21 mmol/L肌苷的磷酸盐缓冲液(PBS)(pH7)、0.05 g/L鸟嘌呤、0.2g/L黄嘌呤、次黄嘌呤和尿酸的反应液中[22]。于37℃、120 r/min孵育2 h,孵育结束后置于沸水浴中煮沸10 min,终止反应。12 000 r/min离心3 min,取上清液,待机测定。
HPLC条件:流动相A为2 mmol/L的磷酸二氢钾,流动相B为甲醇,V(磷酸二氢钾)∶V(甲醇)=95∶5,柱温为35 ℃,流速为1 mL/min,测定波长为254 nm。 分别以各核苷和嘌呤类物质的质量浓度(x)为横坐标,峰面积(y)为纵坐标绘制标准曲线,进行定量分析。 菌株对核苷及嘌呤类物质的降解率计算公式如下:
式中:C0和C分别为反应液处理前和后的核苷及嘌呤类物质浓度,mmol/L。
1.3.4 菌株ST-11不同组分对鸟苷降解能力的影响
参考李婧[23]的方法并稍作修改,对菌株ST-11的活菌体、菌体胞内物、菌体胞外物和死菌体进行制备,按照方法1.3.3收集菌体并测定对鸟苷降解能力的影响。 活菌体:按照方法1.3.3收集的菌体;菌体胞内物:于收集的菌体中加入PBS调整菌浓度至1×108CFU/mL,在冰浴条件下进行超声细胞壁破碎处理(300 W,工作5 s,关闭5 s,工作总时15 min),于4 ℃、12 000 r/min离心3 min,收集菌体胞内物;菌体胞外物:菌株在37 ℃条件下培养24 h后,按2%的接种量将菌悬液接种于MRS培养基中,于37 ℃条件培养18 h,8 000 r/min离心5 min,收集上清液。死菌体:收集的菌体进行高压灭菌(121 ℃、15 min),即死菌体。于菌株ST-11的活菌体、菌体胞内物、菌体胞外物和死菌体中分别加入1.21 mmol/L鸟苷反应液,于37 ℃培养2 h,终止反应,离心(12 000 r/min、3 min)收集上清液,采用方法1.3.3测定鸟苷浓度,按方法1.3.3中公式计算鸟苷降解率。
1.3.5 鸟苷浓度对Caco-2细胞活力的影响
参考LUO M等[24]的方法,稍作修改。将Caco-2细胞以1×104个/mL的密度接种于96孔板中,培养24 h后,去除旧培养基,并用PBS润洗2次,分别加入含有0.325 mmol/L、0.605 mmol/L、1.21 mmol/L和2.42 mmol/L鸟苷的DMEM培养基,对照组为不含鸟苷的DMEM培养基,培养2 h后,加入100 μL的10%CCK-8的DMEM培养基继续孵育1 h,孵育完成后于波长450 nm处测定吸光度值,计算Caco-2细胞存活率。
1.3.6 菌株ST-11对Caco-2细胞代谢鸟苷及转运核苷相关
基因表达的影响
乳酸菌对Caco-2细胞代谢鸟苷的影响:Caco-2细胞以1×104个/mL的浓度接种于6孔中,待细胞贴壁且密度达到80%时,用PBS润洗2次后,活菌组、菌体胞内物组及死菌体组分别加入1 mL含有1×108 CFU/mL的活菌、菌体胞内物、死菌体的DMEM培养基(将分别含有1×108 CFU/mL的活菌体、菌体胞内物及死菌体的PBS菌悬液,于8 000 r/min离心5 min,去除上清,加入相应体积的DMEM培养基),空白组加入含有1.21 mmol/L鸟苷的DMEM培养基,于37 ℃、5%CO2培养箱孵育2 h后,4 ℃、12 000 r/min离心3 min,收集上清液,检测上清液中鸟苷浓度。
实时荧光定量PCR:参考张书灵等[25]的方法,并稍作修改,使用实时荧光定量PCR检测转运鸟苷和嘌呤类物质的蛋白信使核糖核酸GLUT9、CNT1、CNT2及CNT3表达水平。
1.3.7 数据处理与分析
数据采用Excel 2019进行数据整理,采用SPSS 27.0统计软件处理数据并进行方差齐性检验及显著性分析,采用Origin 2024软件绘图。
2 结果与分析
2.1 菌株ST-11的鉴定
2.1.1 形态学观察
菌株ST-11的菌落形态、菌体形态及电镜扫描图见图1。由图1A可知,菌落颜色呈白色或乳白色,呈圆形且菌落较小,菌落边缘光滑;由图1B可知,具有革兰氏阳性菌的特征;由图1C可知,菌体表面及边缘不光滑,且呈典型杆状菌,无鞭毛和荚膜,以单个或成双排列,无分支。
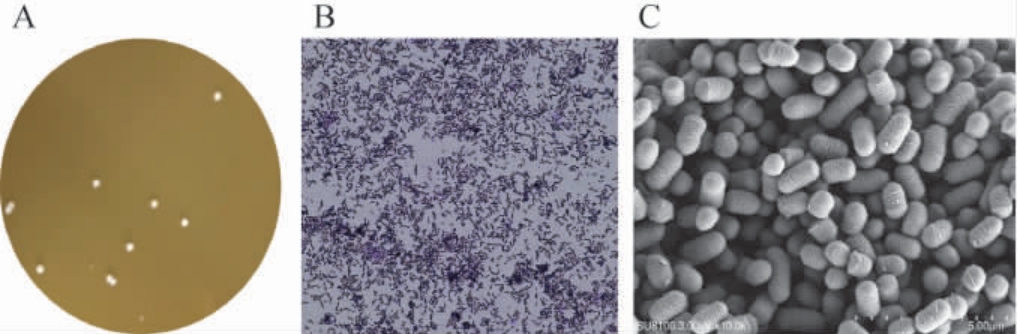
图1 菌株ST-11的菌落形态(A)、菌体形态(B)及电镜扫描图(C)
Fig.1 Colony morphology (A), cell morphology (B) and electron microscope scanning image (C) of strain ST-11
2.1.2 分子生物学鉴定
基于16S rDNA序列构建乳酸菌ST-11的系统发育树,结果见图2。

图2 基于16S rDNA序列菌株ST-11的系统发育树
Fig.2 Phylogenetic tree of strain ST-11 based on 16S rDNA sequence
由图2可知,乳酸菌ST-11与植物乳植杆菌(Lactiplantibacillus plantarum)聚于一支,亲缘关系最近,结合形态学观察结果,该菌株为植物乳植杆菌(Lactiplantibacillus plantarum)。
2.2 菌株ST-11的益生特性分析
植物乳植杆菌ST-11益生特性实验测定结果见图3。乳酸菌对体外耐酸耐胆盐能力是其模拟乳酸菌在人体消化系统中存活率和发挥益生作用的常用指标[26],在人胃液pH值一般为2.0~3.0,肠内胆盐浓度为0.03%~0.30%。 由图3可知,在pH 2、0.3%胆盐条件下,植物乳植杆菌ST-11的存活率分别达85.90%、100.26%,高于LU J等[26]的菌株MY04在pH 3下的存活率。 说明该菌株可在胃酸和胆盐环境具有较好的耐受性。
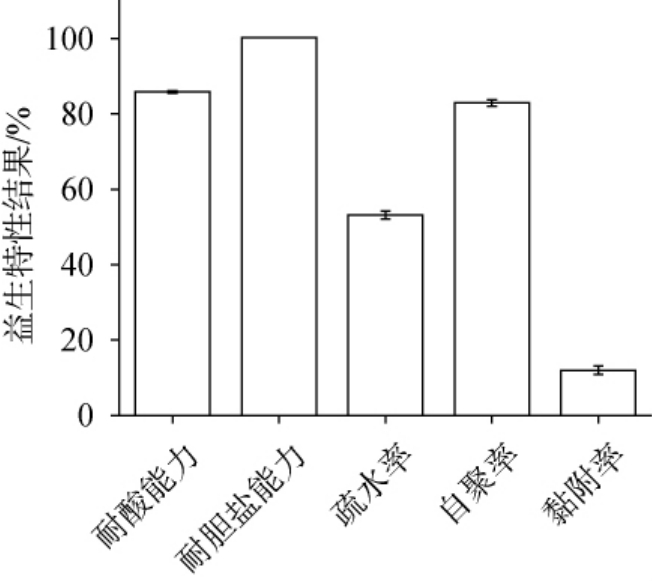
图3 植物乳植杆菌ST-11益生特性实验测定结果
Fig.3 Determination results of probiotics characteristic of Lactiplantibacillus plantarum ST-11
乳酸菌的细胞表面的疏水性及其发挥益生作用有着密切关系[27]。 当疏水性>50%时,菌株被认为是高度疏水性[28],植物乳植杆菌ST-11的疏水率为53.22%,具有良好的疏水性。
乳酸菌的自聚集是体外评估其黏附肠道细胞的一个重要指标[29],植物乳植杆菌ST-11在24 h的自聚集率为82.94%,优于夏海燕等[30]筛选的发酵乳杆菌17-1。
乳酸菌具有良好的黏附性能够黏附肠黏液上层及肠上皮细胞,有助于在肠道的长期定植[31]。 此外,对抑制病原菌定植,维持肠道菌群平衡及提高机体的免疫力[32]。因此,乳酸菌粘附性是评价益生菌的重要指标。植物乳植杆菌对Caco-2细胞的黏附率为12%,高于叶望娟等[33]研究的菌株24E对Caco-2细胞黏附率。
综上,植物乳植杆菌ST-11是具有良好的耐酸耐胆盐,高疏水性,良好的自聚集力及黏附性。可作为益生菌进一步研究。
2.3 菌株ST-11对核苷及嘌呤类物质的降解能力分析
菌株ST-11的活菌体对鸟苷、肌苷、鸟嘌呤、黄嘌呤、次黄嘌呤及尿酸的降解能力测定结果见图4。由图4可知,植物乳植杆菌ST-11对鸟苷和肌苷的降解能力最高,分别达到99.32%和98.42%,优于鼠李糖乳杆菌JY027对鸟苷和肌苷的降解率(分别为80.27%和87.33%)[34]。 菌株对鸟嘌呤、黄嘌呤的降解率分别达38.57%、4.83%,对次黄嘌呤及尿酸的降解率较低,约为1%。因此,该菌株对核苷(鸟苷和肌苷)降解率高于嘌呤类物质(鸟嘌呤、黄嘌呤、次黄嘌呤)及尿酸的降解率。 YAMADA N等[35]研究表明,嘌呤碱基较嘌呤核苷相比不易被肠道吸收。因此,菌株ST-11可以通过间接降低肠道对嘌呤核苷的吸收从而减少尿酸的生成。
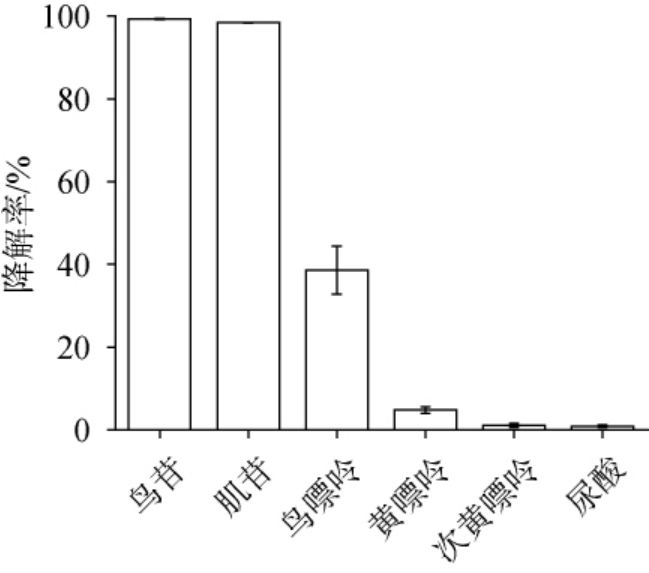
图4 植物乳植杆菌ST-11对不同嘌呤物质的降解率
Fig.4 Degradation rates of different purine substances by Lactiplantibacillus plantarum ST-11
2.4 菌株ST-11不同组分对鸟苷降解能力的影响
由上述结果可知,菌株ST-11的活菌体对鸟苷降解率达99.32%,植物乳植杆菌ST-11不同组分对鸟苷降解率的影响见图5。 由图5可知,菌株ST-11的胞内物、死菌体对鸟苷的降解率分别为51.94%、7.29%,该菌株的胞外物对鸟苷降解率<1%。菌株的不同成分对鸟苷的降解率不同,对鸟苷降解率按高低排序为活菌体>菌体胞内物>死菌体>菌体胞外物。 综上,菌株ST-11的活菌体对鸟苷的降解能力最好。
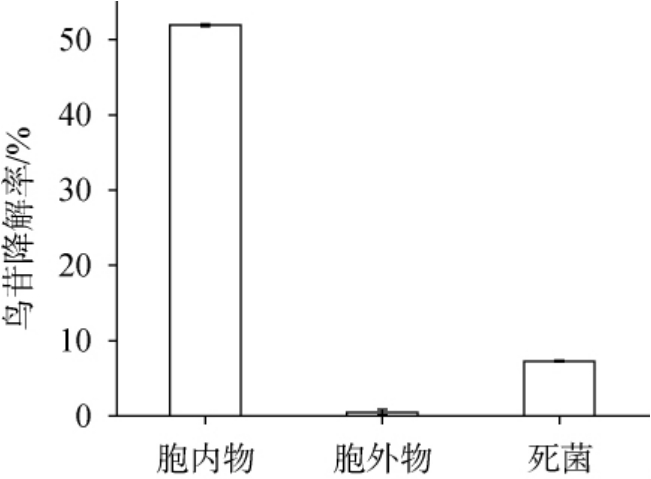
图5 植物乳植杆菌ST-11不同成分对鸟苷降解率的影响
Fig.5 Degradation rate of guanosine by different components of Lactiplantibacillus plantarum ST-11
2.5 菌株ST-11对Caco-2细胞代谢鸟苷的影响
2.5.1 鸟苷对Caco-2细胞活力的影响
由图6可知,鸟苷浓度为0~1.21 mmol/L时,Caco-2细胞的存活率均趋于100%,且各组别存活率差异不显著(P>0.05)。鸟苷浓度为1.21 mmol/L时,Caco-2细胞的存活率为99.09%,而当鸟苷浓度为2.42 mmol/L时,Caco-2细胞存活率下降至92.98%,其对Caco-2细胞活力的显著抑制作用(P<0.05)。因此,选用1.21 mmol/L鸟苷与Caco-2细胞进行共培养。
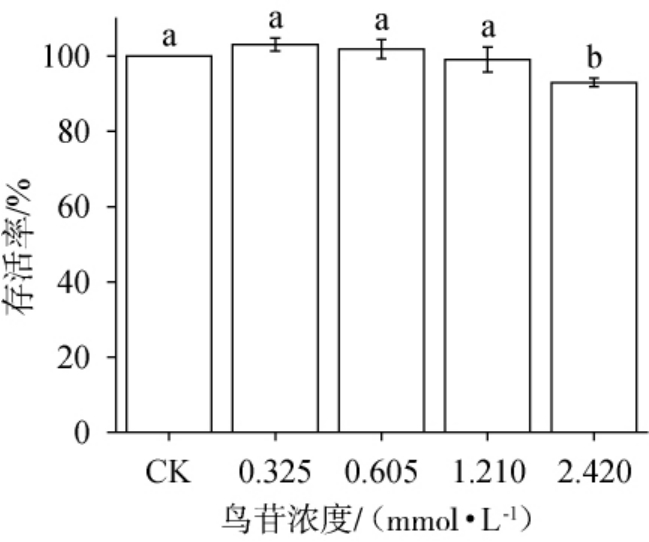
图6 鸟苷浓度对Caco-2细胞活力的影响
Fig.6 Effect of guanosine concentration on Caco-2 cell viability
不同字母代表差异显著(P<0.05)。下同。
2.5.2 菌株ST-11对Caco-2细胞代谢鸟苷及基因表达的影响
乳酸菌的活菌体、死菌体及菌体胞内物对鸟苷均有一定的降解能力。为探索乳酸菌的不同组分对Caco-2细胞代谢鸟苷的影响,将菌株ST-11的活菌体、死菌体和菌体胞内物与Caco-2细胞进行共培养,测定其对Caco-2细胞代谢鸟苷的影响,结果见图7。
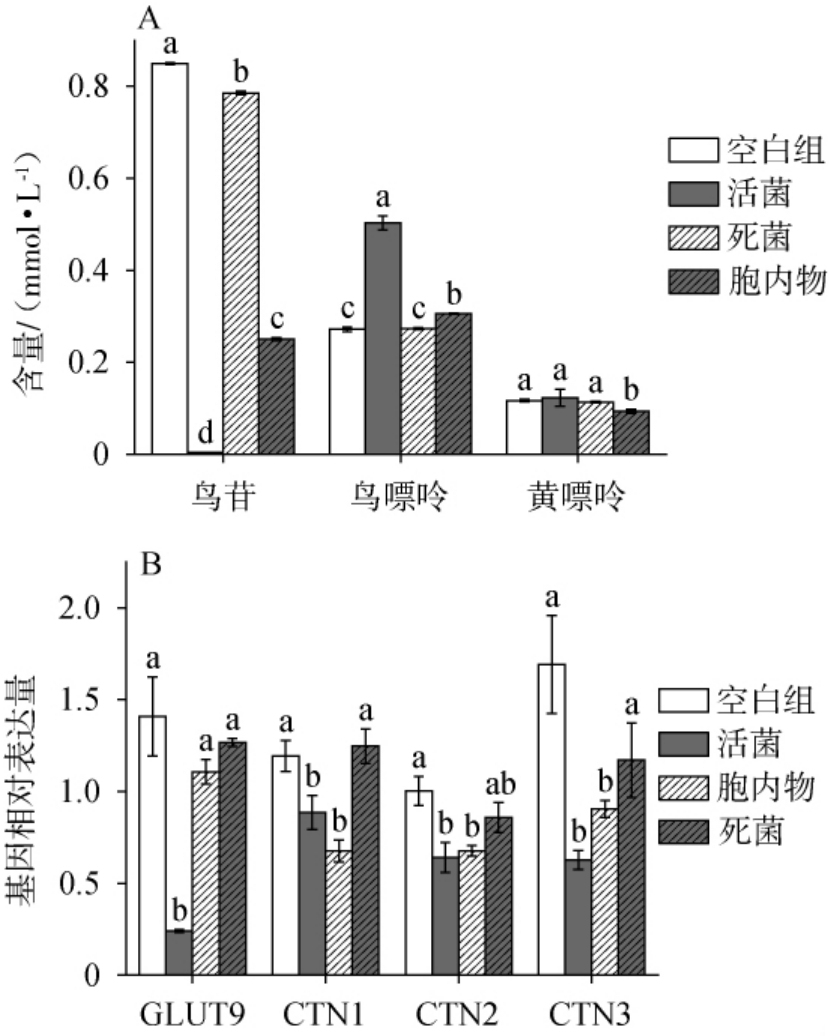
图7 植物乳植杆菌ST-11对Caco-2细胞代谢鸟苷(A)及基因表达(B)的影响
Fig.7 Effect of Lactiplantibacillus plantarum ST-11 on Caco-2 cell metabolism of guanosine (A) and gene expression (B)
由图7A可知,Caco-2细胞培养2 h后,鸟苷浓度由1.21 mmol/L降低至0.85 mmol/L,鸟嘌呤、黄嘌呤浓度分别为0.27 mmol/L、0.12 mmol/L,鸟苷降解率为26.24%;乳酸菌ST-11均能增强Caco-2细胞对鸟苷降解能力,其中活菌体可明显增强Caco-2细胞对鸟苷的降解能力,鸟苷降解率为99.65%,鸟嘌呤浓度增加0.23 mmol/L、而黄嘌呤浓度与空白组差异不显著(P>0.05);菌株ST-11死菌体亦能增强Caco-2细胞对鸟苷的降解能力,鸟苷浓度为0.79 mmol/L,鸟嘌呤和黄嘌呤浓度与空白组差异不显著(P>0.05);菌株ST-11胞内物的鸟苷浓度为0.25 mmol/L,鸟嘌呤增加0.03 mmol/L,黄嘌呤减少0.02 mmol/L,鸟苷降解率达到78.24%。由此可知,菌株ST-11的活菌体能够更好的与肠上皮细胞竞争利用鸟苷,从而减少肠上皮细胞对鸟苷的吸收。
由图7B可知,与空白组相比,乳酸菌活菌体和菌体胞内物Caco-2细胞中的GLUT9、CNT1、CNT2及CNT3的基因相对表达量下降,因此,活菌体和菌体胞内物均可抑制Caco-2细胞中相关基因表达(P<0.05),而菌株ST-11死菌体对Caco-2细胞中的GLUT9、CNT1、CNT2及CNT3的蛋白信使核糖核酸(messenger ribonucleic acid,mRNA)表达差异不显著(P>0.05),而研究表明,抑制肠道GLUT9的表达可降低高尿酸血症实验动物的血尿酸水平[8]。当CNT2的活性被抑制后,可降低高尿酸血症大鼠的血尿酸水平[8]。 因此,乳酸菌活菌体和菌体胞内物能够调节核苷转运蛋白的表达,抑制GLUT9和CNTS转运吸收核苷水平,从而抑制核苷的吸收,减少尿酸的生成,缓解高尿酸血症。
3 结论
本研究以筛选自贵州自然发酵红酸汤中的菌株ST-11为研究对象,经形态学观察、分子生物学技术鉴定为植物乳植杆菌(Lactiplantibacillus plantarum),该菌株益生特性良好,可耐受pH 2、0.3%胆盐条件,疏水率、自聚集率分别为53.22%和82.94%,对Caco-2细胞的黏附率为12%;采用HPLC测定菌株ST-11对对鸟苷和肌苷的降解率分别为99.32%和98.42%; 菌株ST-11的活菌体与Caco-2细胞共培养对鸟苷的降解能力最强(降解率为99.65%),此外,菌株ST-11活菌体可抑制GLUT9、CNTS的mRNA表达。 综上,植物乳植杆菌ST-11具有降尿酸潜力。
[1]刘镇,王灵芝,章姗姗,等.反相高效液相色谱法同时测定黄酒中4种游离嘌呤[J].酿酒科技,2017,38(4):100-102.
[2]BACCOLINI C,WITTE C P.AMP and GMP catabolism in Arabidopsis converge on xanthosine, which is degraded by a nucleoside hydrolase heterocomplex[J].The Plant Cell,2019,31(3):734-751.
[3]方海琴,姜萍,王永俊,等.成人高尿酸血症与痛风食养指南(2024年版)[J].卫生研究,2024,53(3):352-356.
[4]LONG T, LIU L.Research progress on the relationship between dietary patterns and hyperuricemia[J].Appl Bionics Biomechan,2022,2022(1):5658423.
[5]XU X,LI C,ZHOU P,et al.Uric acid transporters hiding in the intestine[J].Pharm Biol,2016,54(12):3151-3155.
[6]YUN Y, YIN H, GAO Z, et al.Intestinal tract is an important organ for lowering serum uric acid in rats[J].Plos One,2017,12(12):e0190194.
[7]NIGAM S K,BHATNAGAR V.The systems biology of uric acid transporters: the role of remote sensing and signaling[J].Curr Opi Nephrol Hypertens,2018,27(4):305-313.
[8]YONG T,CHEN S,XIE Y,et al.Hypouricemic effects of Ganoderma applanatum in hyperuricemia mice through OAT1 and GLUT9[J].Front Pharmacol,2018,8(1):996-1007.
[9]PASTOR-ANGLADA M,PEREZ-TORRA S.Emerging roles of nucleoside transporters[J].Front Pharmacol,2018,9(6):606-614.
[10]ZHU J, LI Y, CHEN Z, et al.Screening of lactic acid bacteria strains with urate-lowering effect from fermented dairy products[J].J Food Sci,2022,87(11):5118-5127.
[11]HSIEH M W,CHEN H Y,TSAI C C,et al.Screening and evaluation of purine-nucleoside-degrading lactic acid bacteria isolated from winemaking byproducts in vitro and their uric acid-lowering effects in vivo[J].Fermentation,2021,7(2):74-87.
[12]李杰,李霜,张鹏霞,等.发酵食品中具有潜在降尿酸功能乳酸菌的筛选及特性分析[J].食品研究与开发,2024,45(7):174-180.
[13]余丽莎,孙晓红,马黔平,等.贵州省少数民族地区部分成人高尿酸血症的相关因素分析[J].中华疾病控制杂志,2015,19(5):443-446.
[14]SONG X,ZHOU Q,LI X,et al.Spontaneous fermentation tunes purine metabolism of tomato by modifying bacterical diversity:Based on metabonomics and microbiomics[J].LWT-Food Sci Technol,2024,191(11):115486-115495.
[15]代道芳,林莹,朱雪琼,等.乳酸菌的分离、鉴定及其稳定性研究[J].食品研究与开发,2013,34(18):5-8.
[16]KUMAR S,STECHER G,LI M,et al.MEGA X:Molecular evolutionary genetics analysis across computing platforms[J].Mol Biol Evol,2018,35(6):1547-1549.
[17]LIN J X,XIONG T,PENG Z,et al.Novel lactic acid bacteria with antihyperuricemia ability:Screening and in vitro probiotic characteristics[J].Food Biosci,2022,49(6):101840-101847.
[18]RODRIGUEZ-SANCHEZ S,FERNANDEZ-PACHECO P,SESENA S,et al.Selection of probiotic Lactobacillus strains with antimicrobial activity to be used as biocontrol agents in food industry[J].LWT-Food Sci Technol,2021,143(5):111142.
[19]BAUTISTA-GALLEGO J, ARROYO-LOPEZ F N, RANTSIOU K, et al.Screening of lactic acid bacteria isolated from fermented table olives with probiotic potential[J].Food Res Int,2013,50(1):135-142.
[20]RAVESCHOT C, COUTTE F, FREMONT M, et al.Probiotic Lactobacillus strains from Mongolia improve calcium transport and uptake by intestinal cells in vitro[J].Food Res Int,2020,133(7):109201.
[21]LEE Y, WERLINGER P, SUH J W, et al.Potential probiotic Lacticaseibacillus paracasei MJM60396 prevents hyperuricemia in a multiple way by absorbing purine, suppressing xanthine oxidase and regulating urate excretion in mice[J].Microorganisms,2022,10(5):851-871.
[22]刘慧敏.乳酸菌嘌呤降解菌株的筛选、基因组特征及其应用研究[D].扬州:扬州大学,2021.
[23]李婧.降尿酸乳酸菌的筛选及其潜在机制研究[D].呼和浩特:内蒙古农业大学,2023.
[24]LUO M,LUO D,LIU J,et al.Ameliorative effect of the probiotic peptide against benzo(α)pyrene-induced inflammatory damages in enterocytes[J].Int Immunopharm,2022,112(11):109255.
[25]张书灵,唐鑫,毛丙永,等.格氏乳杆菌CCFM1346通过调节尿酸代谢和改善肾脏炎症缓解小鼠的高尿酸血症[J].食品与发酵工业,2024,55(4):1-8.
[26]LU J, MAO Y, MA T, et al.Screening and genome analysis of lactic acid bacteria with high exopolysaccharide production and good probiotic properties[J].Food Biosci,2023,56(12):103211.
[27]DAS P, KHOWALA S, BISWAS S. In vitro probiotic characterization of Lactobacillus casei isolated from marine samples[J].LWT-Food Sci Technol,2016,73(11):383-390.
[28]孙世鑫,李科,骆鹏飞,等.制备富含γ-氨基丁酸酸奶的乳酸菌筛选及相关特性分析[J].现代食品科技,2021,37(3):106-114,285.
[29]ANGMO K,KUMARI A,SAVITRI,et al.Probiotic characterization of lactic acid bacteria isolated from fermented foods and beverage of Ladakh[J].LWT-Food Sci Technol,2016,66:428-435.
[30]夏海燕,周思多,张明喆,等.酢辣椒中益生乳酸菌的筛选及其功能特性[J].食品科学,2019,40(6):93-99.
[31]胡爱华,敖晓琳,陈岑,等.乳酸菌耐酸耐胆盐机制的研究进展[J].食品工业科技,2015,36(8):380-383,389.
[32]张英春,张兰威,马微.乳酸菌对免疫系统功能的调节作用[J].食品研究与开发,2003,24(5):80-82.
[33]叶望娟,雷文平,周杏荣,等.乳源乳杆菌的益生特性及抗氧化活性研究[J].中国酿造,2021,40(11):104-108.
[34]苗超,张宇,杨鑫焱,等.降尿酸乳酸菌菌株的筛选及其全基因组分析[J].中国食品学报,2024,24(7):88-99.
[35]YAMADA N,SAITO-IWAMOTO C,NAKAMURA M,et al.Lactobacillus gasseri PA-3 uses the purines IMP,inosine and hypoxanthine and reduces their absorption in rats[J].Microorganisms,2017,5(1):10-20.