茄芯烟叶的品质对雪茄烟叶的香气、吃味及燃烧性具有重要作用,由于技术条件、地理环境和气候因素的限制,国产烟叶风格特征较为薄弱,总体质量与进口烟叶仍存在一定的差距[1-2]。 经过农业及工业两次发酵后,烟叶刺激性和杂气显著减少,内含物质更加协调[3],有效弥补了非优质原料的品质缺陷[4]。目前对烟叶发酵的调控主要通过优化发酵条件或在工业发酵中添加外源添加剂(包括微生物、酶制剂或外源物料)来完成,外源添加剂通过改变烟叶中的化学成分或菌群环境来改善烟叶品质,其中外源物料由于本身具有特殊香味及活性物质,在雪茄烟叶发酵过程中可以丰富烟叶味道而得到广泛应用[5]。如米酒、红酒等酒类及绿茶、普洱等茶类物质已经被证明能够降低烟碱含量,提高烟叶香气量并平衡香气组成[6-7];外源添加蔗糖发酵能够提高烟叶总糖含量,改善烟叶香气、口感和感官品质[8];外源添加糊米水能够增加发酵烟叶中糖类化合物,并降低烟碱、生物碱、总氮和蛋白质的含量,降低烟叶的生理强度和刺激性,提高烟叶的香气品质[9]。 然而,鉴于农业发酵操作规模庞大且技术难度较高,关于添加外源物质优化烟叶发酵的研究仍处于起步阶段[10],这预示着挖掘农业发酵添加剂的巨大潜力。
酒醅富含碳水化合物、蛋白质及风味物质,能通过糖类和氨基酸的非酶促褐化反应增加香气成分[11]。 宋攀等[12]近年来围绕白酒酒醅资源综合利用的研究进行了综合阐述,包括生产生物能源、高饲料蛋白、调味品、有机肥以及生物质燃料等,为白酒酒醅的综合再利用提供了一定的参考。夏秋茶同样含有茶多糖、氨基酸、蛋白质等多种活性成分[13]。 陈向阳等[14]将夏秋茶引入白酒发酵过程,能够影响微生物的生长并促使有利于淀粉及蛋白质分解的酶类生成,从而得到茶香凸显的发酵茶酒。将酒醅和夏秋茶引入茄芯烟叶农业发酵过程,一是提高烟叶中生物活性物质的含量,如糖含量的提升能够进而提高烟叶主流烟雾中酮类、醛类、醇类等物质的含量,突出其特殊的香气[9];二是期望引入添加剂中的曲霉属(Aspergillus)、芽孢杆菌属(Bacillus)和葡萄球菌属(Staphylococcus)等优势菌属[15-16],这些微生物可以产生蛋白酶、淀粉酶和果胶酶等多种高活性酶[17-18],促进淀粉和蛋白质等大分子物质的降解[19],增加茄芯烟叶中的香气成分,优化发酵品质。
基于此,本研究系统地分析了酒醅和夏秋茶两种外源添加剂对发酵茄芯烟叶基本理化指标、游离氨基酸及挥发性风味物质的影响,并结合风味组学和相关性分析揭示基本理化指标和关键差异风味代谢物之间的关系,筛选引入外源添加剂后对烟叶品质提升有重要影响的指标,以期为后续雪茄茄芯烟叶发酵工艺的调控提供科学支撑和理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
供试烟叶(云雪39号中部未发酵茄芯烟叶):由云南香料烟有限责任公司甘庄雪茄烟发酵中心提供;酒醅:由安徽古井贡酒股份有限公司提供,经五粮(高粱、大米、糯米、小麦、玉米)混合得到的千年老窖中的浓香型白酒酒醅,未经过蒸馏过程;夏秋茶:由工大生物科技(黄山)有限公司(中国黄山)提供和加工,采摘日期在6月~9月。
1.1.2 化学试剂
氯化钠、氢氧化钠、硫酸、淀粉、葡萄糖、硫酸铜、硫酸钾、硼酸、5-磺基水杨酸、碘、碘化钾(均为分析纯):国药集团化学试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、乙酸苯乙酯、亚铁氰化钾(均为分析纯):上海源叶生物科技有限公司。
1.2 仪器与设备
DHG-9140A烘箱:上海精宏实验设备有限公司;FiveGo pH计:梅特勒-托利多仪器(上海)有限公司;UV-5500PC紫外分光光度计:上海元析仪器有限公司;K9840自动凯氏定氮仪:海能未来技术集团股份有限公司;S-433D氨基酸全自动分析仪:德国SYKAM公司;PEN3电子鼻:德国Airsense公司;Agilent 8890-7000D型气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)仪、50/30 μm型DVB/CAR/PDMS萃取头:美国安捷伦科技公司。
1.3 方法
1.3.1 茄芯烟叶的农业发酵
酒醅浸提液的制备:称取0.25 kg酒醅,加入2 kg超纯水,浸泡3 h,浸泡的同时不断搅拌,而后进行静置、沉淀、过滤,最终形成1.5 kg酒醅浸提液,酒醅添加量为0.17 kg/kg。
夏秋茶浸提液的制备:操作同酒醅浸提液的制备,最终夏秋茶添加量为0.17 kg/kg。
茄芯烟叶的农业发酵:选择均质化程度较高的茄芯中部烟叶28.8 kg,均分为96把(每把烟叶30片,约0.30 kg,每个处理32把烟叶,共3个不同处理)装入分级框内,将挑选出的烟叶做好标记后放置于发酵堆的中心部位,按照实际生产标准进行加湿回潮操作。将制备好的添加剂溶液(或超纯水)通过喷枪均匀喷洒在茄芯烟叶表面,确保烟叶完全渗透而不形成液滴,控制茄芯烟叶的含水率为(30±1)%。加湿后放置在分级框内平衡水分至24%~25%。参考文献[20]中雪茄烟叶农业发酵条件,发酵时控制环境温度为(32±5)℃,相对湿度为(70±5)%。发酵过程中及时翻垛,翻垛时发现试验烟把需要补水或者水分不均匀,要及时采取补湿措施,具体为:将各处理烟把统一进行控湿操作,待各处理烟把水分均匀一致时,再按照第一次加湿回潮的方式进行补湿和水分平衡,确保烟把水分在24%~25%。 在发酵第4天、32天、60天进行取样并标记,每次取3个样品,每个样品取4把烟叶,每次共取12把烟叶,未发酵样品编号为UF,对照组超纯水发酵样品编号为CK_X,试验组酒醅、夏秋茶外源添加剂发酵样品分别编号为JP_X、XQC_X,其中X分别为对应的发酵时间(第4天、32天、60天),同时也分别对应发酵前期、发酵中期、发酵结束(每次在翻垛前进行取样)。样品及时存放于-20 ℃冰箱内保存以待进一步检测分析。
1.3.2 基本理化指标的测定
将烟叶放入40 ℃烘箱烘至可用手指碾碎,立即取出研磨,持续研磨时间不超过2 min,过40目筛,装入洁净干燥的自封袋中,备用。总酸含量、pH和蛋白质含量的测定分别参照GB12456—2021《食品安全国家标准食品中总酸的测定》[21]、YC/T222—2007《烟草及烟草制品pH的测定》[22]、GB/T5009.5—2016《食品安全国家标准食品中蛋白质的测定》[23]中的方法。总糖、还原糖、淀粉含量的测定参照《烟草品质分析》[24]。
1.3.3 游离氨基酸的测定
参考ZHANG M Z等[25]的方法采用氨基酸自动分析仪检测样品中的游离氨基酸(free amino acid,FAAs)含量。参考王海清等[26]的方法计算各游离氨基酸的味觉活性值(taste activity value,TAV)。
1.3.4 气味分析
参考ZHANG M Z等[25]的方法采用电子鼻测定样品的气味。
1.3.5 挥发性风味物质分析
使用顶空固相微萃取-气相色谱-质谱联用技术(headspace solid-phase microextraction-gas chromatographymass spectrometry,HS-SPME-GC-MS)检测样品中挥发性风味物质(volatile flavor compounds,VFCs)[25]。挥发性风味物质在烟叶中的浓度与其气味阈值的比值即为各物质的香气活性值(odor activity value,OAV)。
1.3.6 数据处理与统计分析
采用SPSS 27.0.1进行单因素方差分析,P<0.05时存在统计学差异。使用WinMuster 1.6.2.22软件处理电子鼻响应值。采用SIMCA 14软件进行偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA),并计算变量重要性投影(variable importance in projection,VIP)值。 利用Origin 2022及在线平台(https://www.omicstudio.cn/home)绘图,并通过在线工具Metware(https://cloud.metware.cn)计算组内和组间的Pearson相关性系数(r),每组实验重复3次。
2 结果与分析
2.1 添加酒醅和夏秋茶茄芯烟叶基本理化指标差异分析
基本理化指标是茄芯烟叶综合品质的内在表现,pH、总酸、还原糖、总糖、淀粉、蛋白质等基本可以反映出烟叶的品质,因此,对茄芯烟叶农业发酵过程中基本理化指标的变化进行测定,结果见表1。
表1 不同处理茄芯烟叶的基本理化指标
Table 1 Basic physiochemical indexes of filler tobacco leaves with different treatments
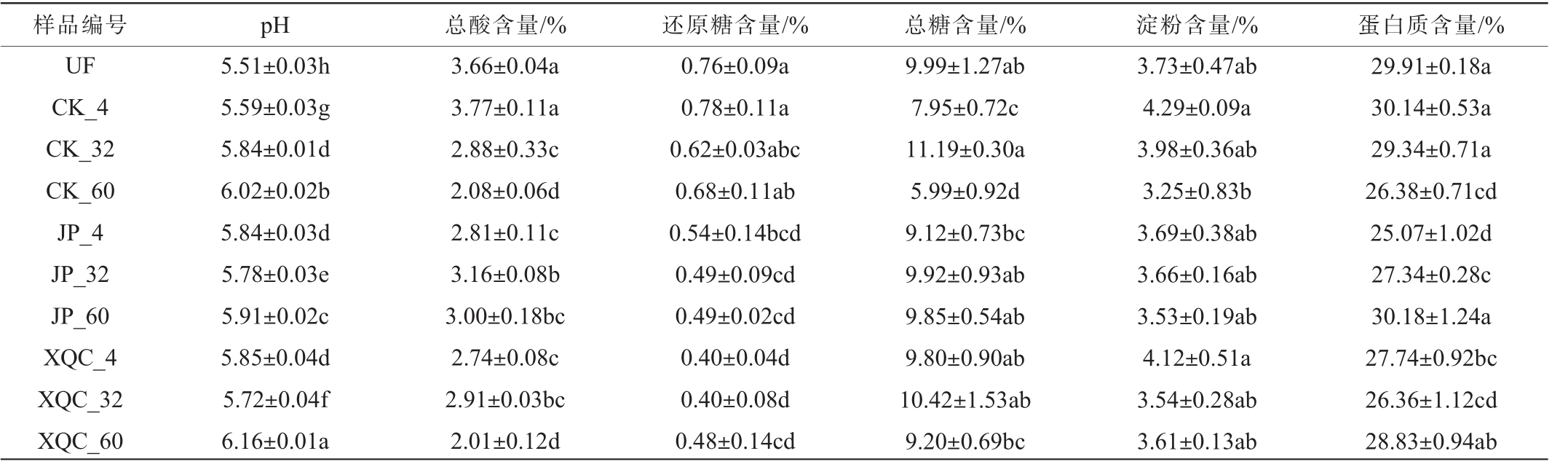
注:同列数据后不同小写字母表示差异显著(P<0.05)。
样品编号pH总酸含量/%还原糖含量/%总糖含量/%淀粉含量/%蛋白质含量/%UF CK_4 CK_32 CK_60 JP_4 JP_32 JP_60 XQC_4 XQC_32 XQC_60 29.91±0.18a 30.14±0.53a 29.34±0.71a 26.38±0.71cd 25.07±1.02d 27.34±0.28c 30.18±1.24a 27.74±0.92bc 26.36±1.12cd 28.83±0.94ab 5.51±0.03h 5.59±0.03g 5.84±0.01d 6.02±0.02b 5.84±0.03d 5.78±0.03e 5.91±0.02c 5.85±0.04d 5.72±0.04f 6.16±0.01a 3.66±0.04a 3.77±0.11a 2.88±0.33c 2.08±0.06d 2.81±0.11c 3.16±0.08b 3.00±0.18bc 2.74±0.08c 2.91±0.03bc 2.01±0.12d 0.76±0.09a 0.78±0.11a 0.62±0.03abc 0.68±0.11ab 0.54±0.14bcd 0.49±0.09cd 0.49±0.02cd 0.40±0.04d 0.40±0.08d 0.48±0.14cd 9.99±1.27ab 7.95±0.72c 11.19±0.30a 5.99±0.92d 9.12±0.73bc 9.92±0.93ab 9.85±0.54ab 9.80±0.90ab 10.42±1.53ab 9.20±0.69bc 3.73±0.47ab 4.29±0.09a 3.98±0.36ab 3.25±0.83b 3.69±0.38ab 3.66±0.16ab 3.53±0.19ab 4.12±0.51a 3.54±0.28ab 3.61±0.13ab
由表1可知,在茄芯烟叶农业发酵过程中大多数化合物并不是单调变化的,而是呈波动趋势。与UF组相比,发酵茄芯烟叶的pH值在发酵过程中波动明显,但整体呈上升趋势,总酸含量与之相对应,呈现下降趋势。 发酵结束后,JP组pH值最低而总酸含量最高,XQC组则相反。pH值及总酸的变化可能是因为茄芯烟叶在堆积发酵时微生物快速代谢还原糖和可用的苹果酸及柠檬酸等,进而导致pH值上升,总酸下降,从而影响烟草的香气和味道[26-27]。与UF组相比,发酵后烟叶的还原糖含量普遍下降,且发酵前期还原糖含量普遍更高。另外,同一发酵时期下,试验组中还原糖含量都低于CK组,这种趋势可能是由于试验组相关微生物的代谢活动更加剧烈,从而引起还原糖的大量消耗。 与CK组相比,试验组发酵前期的总糖含量更高,这归因于酒醅和夏秋茶本身带有一定的糖类物质。 随着发酵的进行,总糖含量呈现先增加后减小的趋势。与发酵前期相比,发酵中期茄芯烟叶中的总糖含量呈上升趋势,可能主要归因于该阶段淀粉等大分子碳源的加速降解与糖类物质的积累,随后部分糖类物质与醇类、酚类等化合物发生反应生成香气物质[28],另一部分糖类与氨基酸发生非酶促棕色化反应,生成糖-氨基酸缩合物[29],导致发酵结束总糖含量明显下降。 到发酵结束时,试验组总糖含量普遍高于CK组,且与发酵前期相比,CK、JP、XQC组总糖含量分别减少了44.83%、9.26%、26.64%,试验组相对消耗较少,说明添加酒醅和夏秋茶能够减缓总糖的消耗,更有利于总糖的积累[30]。相比于UF组,在发酵前期,JP组淀粉含量下降,而CK组和XQC组却有短暂的升高,这种升高的趋势与张蒙蒙[31]的研究结果一致,推测是在发酵前期残留的淀粉合成酶因底物的暂时积累而短暂合成淀粉,而JP组在发酵前期微生物代谢可能更加活跃,淀粉的消耗速率大于生成速率,进而导致淀粉含量下降。之后伴随烟叶持续发酵,淀粉继续被消耗分解为小分子糖、酸或其他化合物,造成雪茄烟叶苦味和涩味的减轻[5]。与CK组单一的下降趋势相比,JP组蛋白质含量持续上升,XQC组蛋白质含量则呈现先下降后上升的波动趋势,XQC组的波动变化与郑霖霖[29]的研究结果一致,蛋白质的变化一方面可能是由于结合蛋白质的单宁等物质在酶的作用下被分解,随后蛋白质被释放[31],另一方面,在蛋白酶等的作用下蛋白质被分解消耗。CK、JP、XQC组蛋白质含量分别在发酵结束、发酵前期及发酵中期达到最低,说明相比于CK组,试验组的蛋白降解提前,这表明添加酒醅和夏秋茶后蛋白质能够更加快速地被分解为氨基酸、酰胺等物质[32],进而有效降低发酵过程中茄芯烟叶蛋白质含量,减少吸烟后的辛辣苦涩感[33]。值得注意的是,与CK组相比,在发酵中期,添加剂的引入能够降低pH、总糖、淀粉、还原糖及蛋白质含量并提高总酸含量,而在发酵结束后淀粉、蛋白质等则呈现相反的趋势,这一现象说明发酵时间的控制在影响茄芯烟叶品质方面也存在重要的作用[34]。
2.2 添加酒醅和夏秋茶茄芯烟叶滋味分析
2.2.1 添加酒醅和夏秋茶茄芯烟叶游离氨基酸组成分析
FAAs是影响发酵烟叶品质的重要非挥发性风味代谢物质,在烟气质量中起双向作用。一方面,在烟叶燃烧过程中,FAAs在酸、碱和酶的作用下分解产生氨;另一方面,FAAs与其他物质发生反应,生成与烟草香气相协调的风味[35]。因此,考察外源添加剂对发酵茄芯烟叶FAAs的影响,结果见图1。由图1可知,从样品中共检测出17种FAAs,根据风味特征分为鲜味、甜味、苦味和无味氨基酸[26],各组样品中甜味氨基酸均占主导地位,约占总FAAs含量的47.19%~66.24%。其次是苦味和鲜味氨基酸,分别约占总FAAs含量的16.52%~28.79%和8.98%~32.17%,无味氨基酸含量最低,仅占总FAAs含量的2.42%~5.49%。
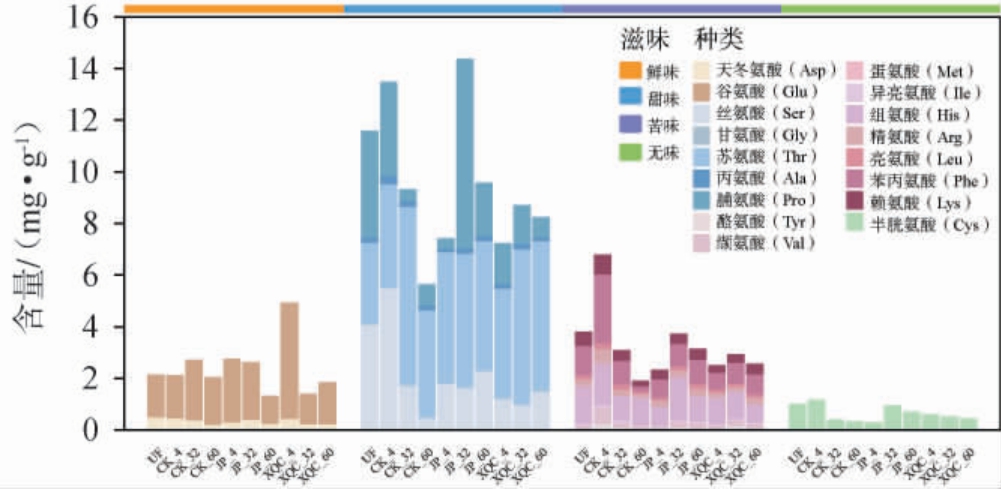
图1 不同处理茄芯烟叶的游离氨基酸含量分析
Fig.1 Analysis of free amino acids contents of filler tobacco leaves with different treatments
2.2.2 添加酒醅和夏秋茶茄芯烟叶游离氨基酸差异分析
为了进一步筛选最具区分度的呈味氨基酸,基于游离氨基酸含量对不同处理茄芯烟叶样品进行PLS-DA,结果见图2A~C。 由图2A可知,模型的R2X、R2Y和Q2值分别为0.999、0.934、0.549,均>0.5,表明PLS-DA模型可靠。由图2B可知,经200次置换检验后,Q2的回归线与Y轴的截距为负值,说明模型不存在过拟合,进一步肯定了模型的拟合优度。由图2A可知,发酵后的烟叶与UF有明显的区分,此外,在完整的发酵周期内,3个发酵阶段的烟叶也有明显的跨越式变化,表明发酵时间推动了烟叶的滋味变化。在同一发酵时间下,试验组与CK组同样具有一定的区分度,说明添加剂对于发酵烟叶的滋味塑造具有一定的意义。由图2C可知,根据P<0.05,VIP≥1,发现导致不同处理下茄芯烟叶滋味差异的主要氨基酸包括3种甜味氨基酸(Pro、Thr、Ala)、3种苦味氨基酸(Met、Tyr、Ile)和1种鲜味氨基酸(Glu)。为了挖掘对样品整体口感有显著贡献的呈味氨基酸,计算了不同处理下茄芯烟叶游离氨基酸的TAV,结果见图2D。由图2D可知,Glu、Thr、His的TAV在所有样品中都>1,它们共同作用赋予雪茄烟叶鲜味、甜味和苦味特征,其中以Glu和His的TAV更为突出。另外,Ser在JP组发酵全阶段中TAV均>1,赋予了JP组烟叶更突出的甜味特征。 值得注意的是,要综合考虑多种FAAs共同作用的结果。如,在UF和CK组中,Phe的作用也不可忽视,此时的茄芯烟叶苦味加强。而在JP组发酵中期,虽然His的TAV更为突出,但这个阶段同样存在较高TAV的Glu、Ser、Pro、Thr等多种鲜味或甜味氨基酸,对烟叶风味有正向贡献的主要FAAs(TAV>1)总TAV(12.93)远大于苦味氨基酸(8.42),这时苦味会被掩盖,使得茄芯烟叶的滋味变得协调而柔和。XQC组也有类似趋势。而在JP组发酵结束后,虽然各类氨基酸更加均衡,但主要鲜味和甜味氨基酸总TAV(7.05)与主要苦味氨基酸(5.85)差距缩小,此时烟叶中苦味氨基酸贡献度增加,鲜甜味风格特征减弱,说明过度发酵不利于雪茄烟叶风格品质的提升。此外,结合P<0.05、VIP≥1和TAV≥1,得到Glu、Pro和Thr是导致不同样品组烟叶之间滋味差异形成的关键呈味氨基酸。
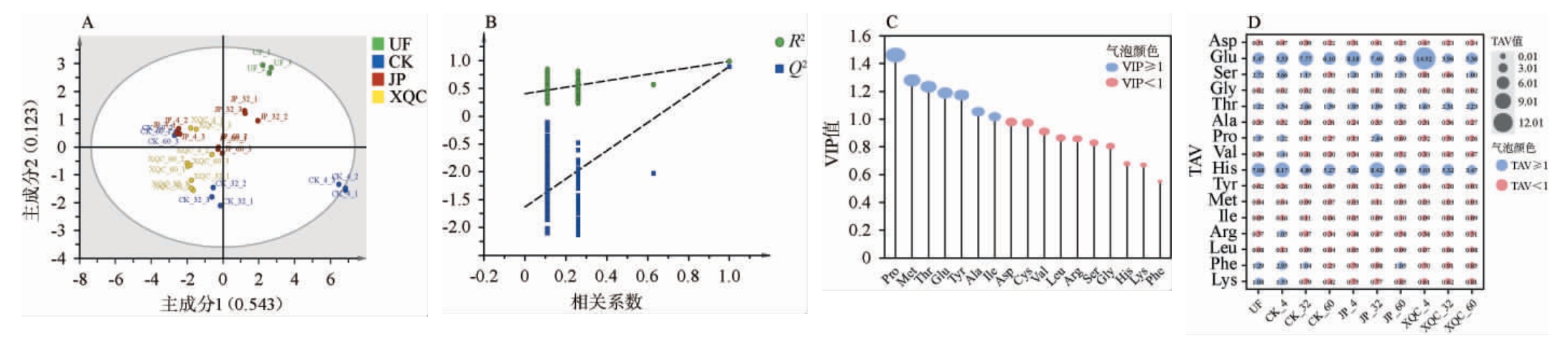
图2 基于游离氨基酸不同处理茄芯烟叶偏最小二乘判别分析得分图(A)、200次置换检验结果(B)、变量重要性投影值(C)及滋味活度值(D)
Fig.2 Partial least squares discriminant analysis score plot (A), 200 permutation test results (B), variable importance in projection values (C),and taste activity value (D) of free amino acids of filler tobacco leaves with different treatments
2.3 添加酒醅和夏秋茶茄芯烟叶气味分析
2.3.1 基于电子鼻技术茄芯烟叶气味差异分析
基于电子鼻分析不同处理茄芯烟叶的气味雷达图见图3。由图3可知,发酵后烟叶的电子鼻传感器响应值与未发酵烟叶(UF)有明显的不同,说明发酵对于烟叶气味的形成有重要的影响。此外,同一发酵时间下不同处理组中茄芯烟叶挥发性风味物质的组成相似,但含量存在明显差异,这意味着不同处理组茄芯烟叶整体风味虽然存在一定的相似性,但仍然存在一定的区分度。值得注意的是,与试验组相比,CK组烟叶在整个发酵周期内对W5S传感器的响应值呈显著上升趋势,且在发酵结束后,其响应值仍高于试验组,表明试验组中氮氧化合物的含量相对较低,说明外源添加剂在促进以烟碱为代表的氮氧化合物降解方面具有积极作用。烟碱含量的降低有助于减弱烟叶的生理强度和刺激性,从而提升其香气品质[36]。 对比不同传感器对应敏感物质[25]的占比,发现氮氧化合物对烟叶气味组成贡献度最大(28.01%~62.26%),而大多数氮氧化合物呈刺激性气味,其次是含硫化合物(8.26%~20.31%)、醇类及部分芳香化合物(5.87%~13.88%)。 相比于CK组,在JP组发酵中期及试验组发酵结束后,响应值最高的W5S传感器占比下降,各类传感器占比更加均衡,表明此时茄芯烟叶中风味成分更加协调,且氮氧化合物比例明显降低,说明外源添加剂的引入有助于降低刺激性风味物质的比例,平衡茄芯烟叶的香气组成。除此之外,随着发酵时间的延长,W5S传感器响应值占比呈现出明显的增加趋势,表明农业发酵是增强茄芯烟叶氮氧化合物生成的一个重要工艺措施。

图3 基于电子鼻分析不同处理茄芯烟叶的气味特征雷达图
Fig.3 Radar maps of odor characteristics of filler tobacco leaves with different treatments based on electronic nose analysis
2.3.2 基于GC-MS技术茄芯烟叶挥发性风味物质组成及特征分析
采用HS-SPME-GC-MS检测样品中的VFCs,结果见表2。由表2可知,共检出49种和VFCs包括酮类化合物27种、酯类化合物6种、醇类化合物6种、醛类化合物3种、酸类化合物2种和其他类化合物5种。不同处理组茄芯烟叶挥发性风味物质种类相似,但是物质含量有明显差异。与UF相比,随着发酵的进行,不同处理组茄芯烟叶挥发性风味物质的总量变化趋势基本一致,都处于先增加后减小的动态变化,说明发酵会提升茄芯烟叶挥发性风味物质含量,但过度发酵会造成香气物质的损耗[29],从而无法呈现出烟叶的最佳品质[33],在后续发酵应用中考虑适当缩短发酵时间。与CK组(78.62~222.11 μg/g)相比,JP组(131.47~263.22 μg/g)挥发性风味物质总量大幅增加,而XQC组挥发性风味物质总量(109.47~142.81 μg/g)虽有所减少,但烟碱含量也得到降低。在发酵结束后,与CK组相比,JP组新植二烯、醇类、醛类物质含量明显增多,XQC组新植二烯含量明显增加,烟碱含量有所降低。 新植二烯属于叶绿素降解产物,在高温燃吸时会发生热裂解,产生大量烃、醇、酮、醛、酯类物质[26],新植二烯的增加能够减少刺激性、降低青杂气、醇和烟气,进而提高烟叶感官品质。 烟碱与烟叶的抽吸劲头有关,适量的烟碱会使烟叶抽吸口感饱满,使人体产生愉悦感[37]。试验组茄芯烟叶中烟碱含量相对降低,这能够使烟叶抽吸劲头减小、刺激性减弱,这与电子鼻检测结果一致。
表2 不同处理茄芯烟叶挥发性风味成分HS-SPME-GC-MS检测结果
Table 2 Detection results of volatile flavor components of filler tobacco leaves with different treatments by HS-SPME-GC-MS

述描味风——-F1、F2 F3————、F7、F6、F2、F5、F3 F4--F 8 F8、F7、F10、F9 F8 F8、F11、F9、F8 F4-F4 F4、F9、F10、F13、F6---F8、F10、F5、F11、F9 F8 F12 XQC_60 2.23±0.11a 0.54±0.03b-0.07±0.06e——---0.49±0.06f 2.06±0.16e 0.26±0.06g 0.85±0.05g---0.87±0.08e--0.34±0.19d-2.84±0.26fg-0.60±0.08e-11.16±1.08e-0.34±0.02g-0.74±0.02de XQC_32 XQC_4 JP_60 JP_32 JP_4 CK_60 CK_32 CK_4 UF-1)·g(μg量/含--4.56±0.43d 0.10±0.04e——-0.55±0.03a 0.23±0.12b--4.23±0.15d 0.17±0.13de---0.11±0.01c-0.24±0.01c---7.36±0.68b 0.29±0.19cd——————--0.33±0.17b——--0.58±0.1b-1.42±0.07b---0.31±0.08b-2.00±0.10b-7.13±0.35b 2.16±0.11a 0.37±0.02b--1.98±0.19a 3.40±0.17a-7.51±0.37a-1.73±0.24a 8.63±1.12a 0.40±0.04c 1.92±0.09a-0.94±0.12b 2.05±0.18a---1.50±0.18c-4.17±0.32d---1.33±0.05a 0.35±0.14b 2.42±0.11b——5.45±0.47c--4.17±0.18a——-酮英-4-酮酮-1-酮噁)乙-1-烯二己基-1,3-基烷-2-环[4.4.0]-5-酮酮双酮酮乙乙酮杂酮-2,4(3H,5H)-二酮-2-环二苯苯基戊氧基-2-烯-9-啶基-1-二炔-3-甲烷基基基-6-环己丁庚羟羟甲二杂葵环1-2,3-2,3-二二-4-亚庚丁氧甲2,6-3,4-基4,6-叔基四)-2-甲并[3,2-d]嘧甲(2-1,3,7,7-咯(R 1-1H-吡3,5,5-三1.56±0.15e 0.63±0.09f 2.25±0.14d 3.05±0.21b 1.29±0.13e 2.56±0.17c 2.15±0.15d 1.45±0.11e 5.29±0.30a酮A烯-3-三豆巨4,7,9-5.93±0.24c 2.93±0.19d 8.12±0.48b 10.35±0.62a 5.60±0.36c 7.97±0.48b 7.78±0.47b 2.80±0.18d 0.90±0.11f酮B烯-3-三豆巨4,7,9-0.92±0.12c 0.43±0.05ef 0.94±0.08c 1.49±0.07b 0.67±0.09d 2.47±0.17a-0.37±0.05fg 0.58±0.07de酮C烯-3-三豆巨4,7,9-3.23±0.23d 1.89±0.18ef 5.23±0.48b 8.63±0.51a 2.10±0.10e 4.43±0.27c 3.50±0.23d 1.71±0.13ef 1.45±0.11f酮D烯-3-三豆巨4,7,9——0.93±0.09e---3.93±0.43b——-0.67±0.03a 2.96±0.15b--0.27±0.01b-2.95±0.18d 0.43±0.02b-3.41±0.17a 3.86±0.28bc---6.88±0.42a---2.93±0.08d 4.25±0.21a--3.48±0.25c酮酮庚-3-酮基-3-戊烯酮苯兰基罗甲-5-庚4-甲4-基紫5-甲β--0.33±0.02c 0.39±0.05d-4.77±0.30a 3.80±0.19a 0.78±0.08c 1.29±0.06b 1.15±0.09b-0.62±0.06c 0.15±0.01d——--酮马酮大β-乙苯0.81±0.19c 1.24±0.24b 1.93±0.21a 1.23±0.37b 0.21b 1.22±1.06±0.27bc 0.70±0.11cd 2.19±0.19a 1.85±0.19a酮香茶---1.56±0.15a--0.44±0.09c-0.89±0.13b酮士马大2.39±0.26g 9.01±0.64c 4.78±0.47e 7.82±0.46cd 6.57±0.42d 4.30±0.3ef 17.44±2.66a 7.00±0.43d 12.03±0.74b酮茄-1.64±0.12d-0.41±0.02c-0.09±0.00b 0.34±0.06cd 6.97±0.47a 0.51±0.03a 1.13±0.09a 6.81±0.38a-0.60±0.07b-0.32±0.02b 0.28±0.02d 4.63±0.25b-1.12±0.04a 4.16±0.29c——---酮丙酮基尔酮叶佛植香异23.18±1.78d 25.7±1.77d 47.31±2.90b 48.09±2.65b 25.05±1.60d 60.71±3.71a 59.85±5.70a 28.21±1.36d 40.34±2.50c计总---2.19±0.11bcd-2.14±0.11e-3.32±0.38ab 4.36±0.22a 5.13±0.25d-3.19±0.25ab-8.39±0.41b-4.04±2.91a-6.74±0.33c-2.62±0.11abc--2.26±0.11a-1.49±0.07b 26.34±1.3a-3.27±0.24ab——-1.26±0.06f 0.15±0.01b 1.22±0.12cde酯酯甲酯酯内酸酸甲桃壬乙酸猴代啉乙猕2-氧喹8-苯氢二类种类酮类酯
续表

注:同行数据后不同小写字母表示差异显著(P<0.05),“-”表示未检出或数据库中未查询到相关风味信息。F1~F14分别代表黄油、烘烤、奶香、果香、青草香、药草、坚果、花香、甜味、蜡质、蜂蜜、麝香、绿色、可可。风味描述来自FEMA(https://www.femaflavor.org/)和Perflavory数据库(https://www.perflavory.com/)。
?
为了评估挥发性风味物质在不同处理组中的气味特征,进一步分析VFCs对茄芯烟叶整体风味特征的影响[38]。由表2可知,共检索到21种挥发性风味物质的气味信息,其中有14种物质风味描述为花香,7种物质描述为果香,6种物质有甜味,4种物质显示为蜂蜜香气。值得注意的是,部分物质表现为多种风味特征并存,例如苯乙酸乙酯和苯乙醛呈现花香、甜味和蜜香,4-甲基-3-庚酮除果香外,还表现出奶香和坚果风味,这使得这些风味成分在茄芯烟叶中表现出复杂但协调的感官特性。与UF相比,发酵后的烟叶苯乙醛、香叶基丙酮、异佛尔酮和β-大马酮含量增加,2,3-丁二酮、4-甲基-3-庚酮含量降低,说明发酵能够增强茄芯烟叶的花香、甜味和果香特征,削弱烟叶的烘烤香。进一步分析不同处理组的风味差异,发现与CK组相比,试验组2,3-庚烷二酮、β-紫罗兰酮含量降低,且JP组苯乙酮、大马士酮、β-大马酮、植酮、香叶基丙酮、二氢猕猴桃内酯和异佛尔酮含量增加,而XQC组2-己基-1-癸醇、乙酸苏合香酯和二氢猕猴桃内酯增加,使得JP和XQC组烟叶的奶香减弱,而花香、果香、甜味、蜡质和麝香风味更加凸显。
2.3.3 基于GC-MS技术茄芯烟叶气味差异分析
为了进一步探究不同外源添加剂对于茄芯烟叶风味差异的影响,基于VFCs对不同处理茄芯烟叶进行PLS-DA,结果见图4。 由图4A可知,模型的自变量解释能力R2X、因变量解释能力R2Y和预测能力Q2值分别为0.651、0.982、0.951,均>0.5,表明PLS-DA模型可靠。由图4B可知,经200次置换检验后,Q2的回归线与Y轴的截距为负值,说明模型不存在过拟合,进一步肯定了模型的拟合优度。由图4A可知,基于VFCs不同处理的茄芯烟叶能够被明显区分。 借助从PLS-DA模型得出的VFCs的VIP值来衡量VFCs组成对茄芯烟叶差异区分的影响程度,以P<0.05、VIP≥1为标准,筛选出18个在不同处理茄芯烟叶区分中起关键作用的VFCs。由图4C可知,UF中含量较高的挥发性风味物质有4-甲基-3-庚酮、2,3-丁二酮和4,7,9-巨豆三烯-3-酮-A,尽管这些挥发性风味成分如2,3-丁二酮具有奶香及烘烤香气,但其他挥发性风味物质含量较少,说明未发酵的烟叶整体风格特征较为薄弱。CK组含量较高的挥发性风味物质除了携带奶香的2,3-庚烷二酮外,还包括2,6-二羟基苯乙酮、3,4-二羟基苯乙酮这类并无明显香气的成分。与CK组相比,JP组含量较高的挥发性风味物质有新植二烯、4,7,9-巨豆三烯-3-酮-B、4,7,9-巨豆三烯-3-酮-D、植酮、异佛尔酮、苯乙醇和邻苯二甲酸二丁酯,而XQC组含量较高的挥发性风味物质有新植二烯、乙酸苏合香酯和邻苯二甲酸二丁酯。这些挥发性风味物质大多具有愉快的香味,新植二烯是烟叶中含量最高的致香成分[26],能够增强烟草的芳香特性并降低刺激性,4,7,9-巨豆三烯-3-酮具有水果甜香味,植酮具有茉莉花香,异佛尔酮具有幽雅的木香、甜味和绿色香气,苯乙醇具有柔和、愉快而持久的玫瑰甜香,能够使烟气更加醇和,邻苯二甲酸二丁酯带有香草味和淡淡的甜香味,乙酸苏合香酯散发出果香和绿色气味,这些差异挥发性风味物质丰度的增加表明外源添加剂在协调和修饰发酵过程中茄芯烟叶的整体风味方面发挥了重要作用。
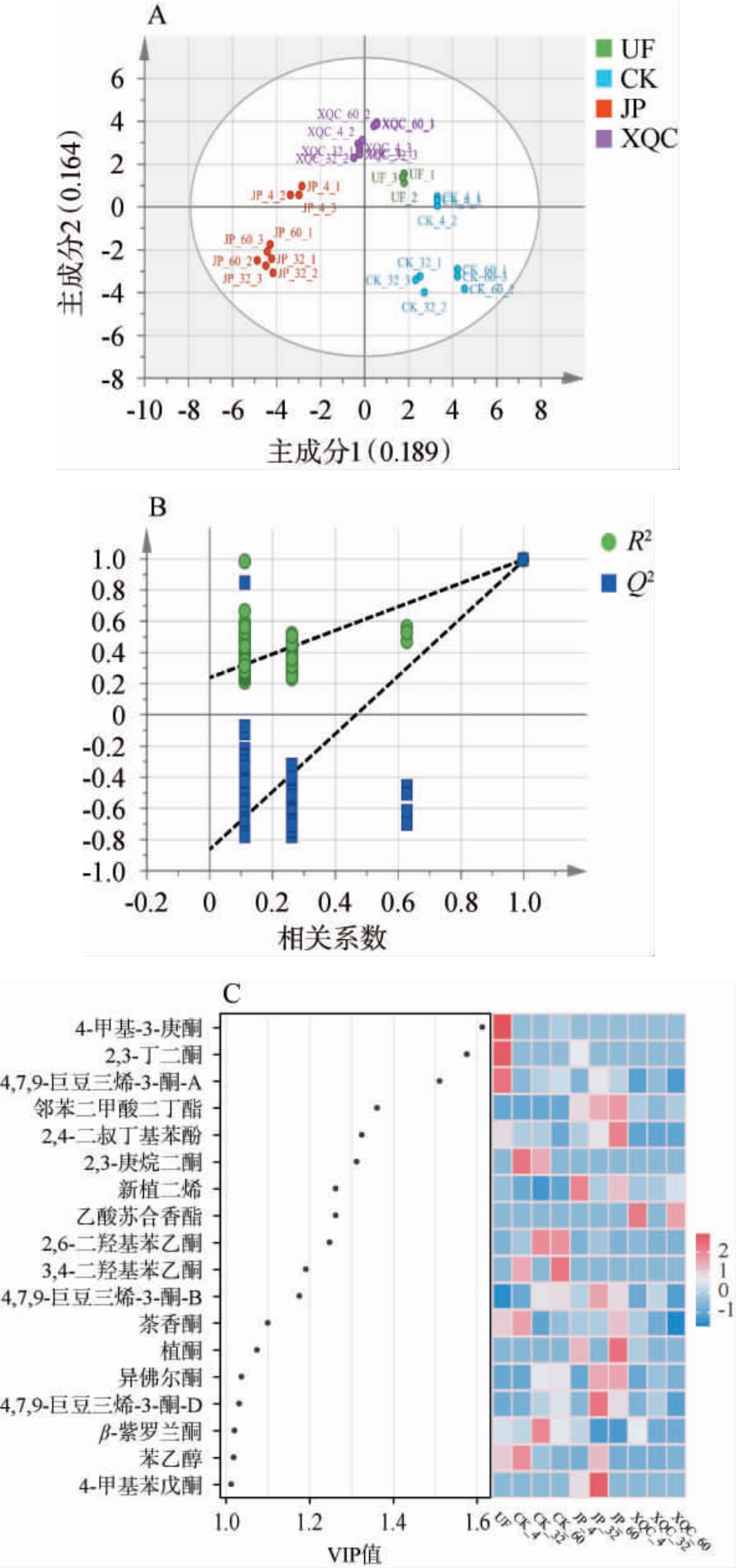
图4 基于挥发性风味物质不同处理茄芯烟叶偏最小二乘判别分析得分图(A)、200次置换检验结果(B)及差异挥发性风味物质的变量重要性投影值和含量热图(C)
Fig.4 Partial least squares discriminant analysis score plot (A), 200 times permutation test results (B), and heatmap of variable importance in projection values and contents of differential volatile flavor compounds (C) based on volatile flavor compounds in filler tobacco leaves under different treatments
一般认为,OAV≥1时,该物质对风味具有一定影响。参考文献[39]已报道的阈值,对49种挥发性风味物质的OAV进行计算,共计算得到18种挥发性风味物质的OAV≥1,结果见表3。
表3 不同处理茄芯烟叶挥发性风味成分香气阈值及气味活度值
Table 3 Aroma thresholds and odor activity values of volatile flavor components of filler tobacco leaves with different treatments
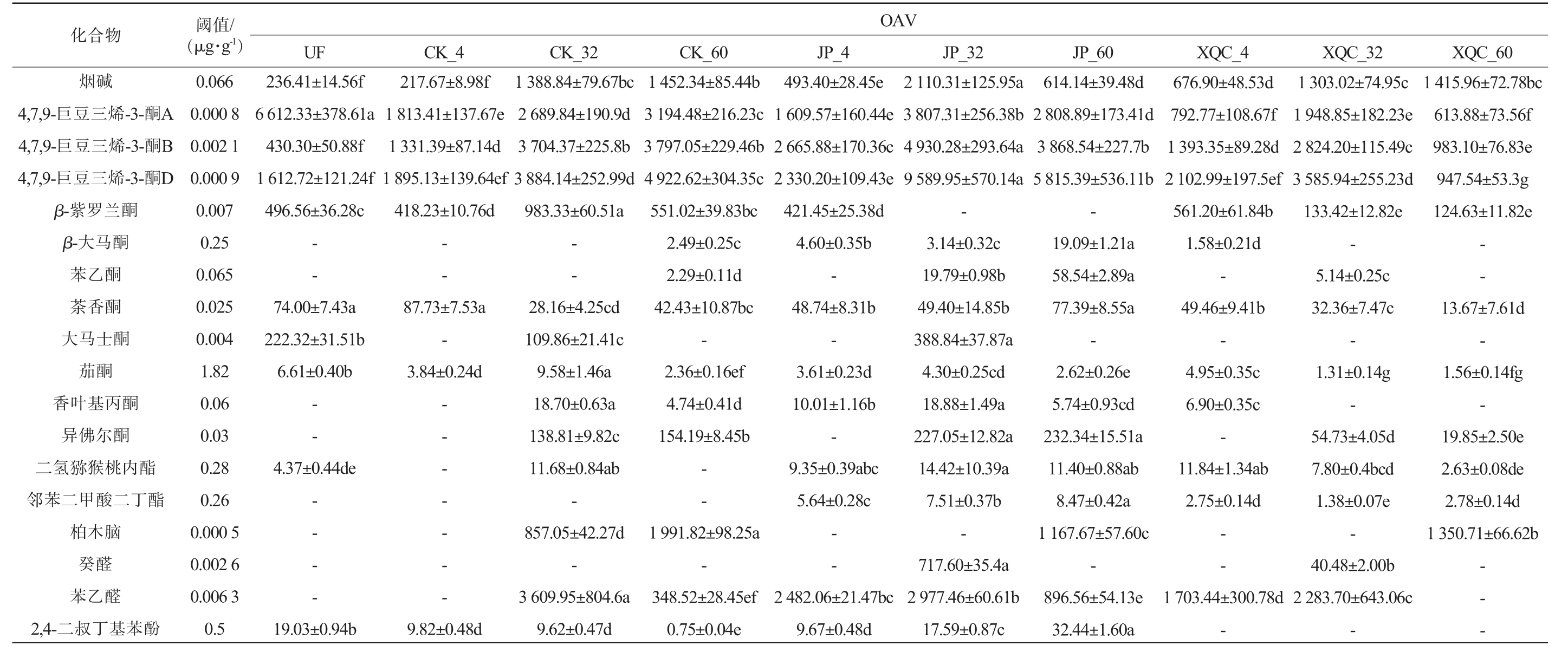
注:同行数据后不同小写字母表示差异显著(P<0.05),“-”表示物质未检出从而无法计算OAV。
XQC_60 1 415.96±72.78bc 613.88±73.56f 983.10±76.83e 947.54±53.3g 124.63±11.82e--13.67±7.61d-1.56±0.14fg-19.85±2.50e 2.63±0.08de 2.78±0.14d 1 350.71±66.62b---OAV XQC_32 XQC_4 JP_60 JP_32 JP_4 CK_60 CK_32 CK_4 UF 1 303.02±74.95c 676.90±48.53d 614.14±39.48d 2 110.31±125.95a 493.40±28.45e 1 452.34±85.44b 1 388.84±79.67bc 217.67±8.98f 236.41±14.56f 1 948.85±182.23e 792.77±108.67f 2 808.89±173.41d 3 807.31±256.38b 1 609.57±160.44e 3 194.48±216.23c 2 689.84±190.9d 1 813.41±137.67e 6 612.33±378.61a 2 824.20±115.49c 1 393.35±89.28d 3 868.54±227.7b 4 930.28±293.64a 2 665.88±170.36c 3 797.05±229.46b 3 704.37±225.8b 1 331.39±87.14d 430.30±50.88f 3 585.94±255.23d 2 102.99±197.5ef 5 815.39±536.11b 9 589.95±570.14a 2 330.20±109.43e 4 922.62±304.35c 3 884.14±252.99d 1 895.13±139.64ef 1 612.72±121.24f 133.42±12.82e 561.20±61.84b--421.45±25.38d 551.02±39.83bc 983.33±60.51a 418.23±10.76d 496.56±36.28c-5.14±0.25c 1.58±0.21d-19.09±1.21a 58.54±2.89a 3.14±0.32c 19.79±0.98b 4.60±0.35b-2.49±0.25c 2.29±0.11d——--32.36±7.47c 49.46±9.41b 77.39±8.55a 49.40±14.85b 48.74±8.31b 42.43±10.87bc 28.16±4.25cd 87.73±7.53a 74.00±7.43a---388.84±37.87a--109.86±21.41c-222.32±31.51b 1.31±0.14g 4.95±0.35c 2.62±0.26e 4.30±0.25cd 3.61±0.23d 2.36±0.16ef 9.58±1.46a 3.84±0.24d 6.61±0.40b-54.73±4.05d 7.80±0.4bcd 1.38±0.07e-40.48±2.00b 2 283.70±643.06c 6.90±0.35c-11.84±1.34ab 2.75±0.14d--1 703.44±300.78d 5.74±0.93cd 232.34±15.51a 11.40±0.88ab 8.47±0.42a 1 167.67±57.60c-896.56±54.13e 18.88±1.49a 227.05±12.82a 14.42±10.39a 7.51±0.37b-717.60±35.4a 2 977.46±60.61b 10.01±1.16b-9.35±0.39abc 5.64±0.28c--2 482.06±21.47bc 4.74±0.41d 154.19±8.45b--1 991.82±98.25a-348.52±28.45ef 18.70±0.63a 138.81±9.82c 11.68±0.84ab-857.05±42.27d-3 609.95±804.6a————-4.37±0.44de——--32.44±1.60a 17.59±0.87c 9.67±0.48d 0.75±0.04e 9.62±0.47d 9.82±0.48d 19.03±0.94b值/阈-1)·g(μg 0.066 0.000 8 0.002 1 0.000 9 0.007 0.25 0.065 0.025 0.004 1.82 0.06 0.03 0.28 0.26 0.000 5 0.002 6 0.006 3 0.5物合化碱烟酮A烯-3-三豆巨4,7,9-B-3-酮烯三豆4,7,9-巨酮D烯-3-三豆巨4,7,9-酮兰罗紫β-酮马大β-酮乙苯酮香茶酮士马大酮茄酮丙基叶香酮尔佛异酯内桃猴猕氢二酯丁二酸甲二苯邻脑木柏醛癸醛乙苯酚苯基丁叔二2,4-
由表3可知,这些挥发性风味物质的OAV在不同烟叶样品中存在着明显差异,这种差异可能是造成不同发酵组质量风格差异形成的主要物质基础。 在这18种物质中,4,7,9-巨豆三烯-3-酮D、4,7,9-巨豆三烯-3-酮B、4,7,9-巨豆三烯-3-酮A、苯乙醛、柏木脑、烟碱和β-紫罗兰酮的OAV甚至高于500,表明它们对发酵雪茄烟叶风味形成具有重要贡献。另外,烟碱、4,7,9-巨豆三烯-3-酮A、4,7,9-巨豆三烯-3-酮B、4,7,9-巨豆三烯-3-酮D、茄酮、茶香酮在所有烟叶样品中的OAV均>1,这些香气成分是烟叶风味的重要组成部分。另外,OAV极高的4,7,9-巨豆三烯-3-酮在JP组发酵中期及发酵结束的样品中格外突出,这可能暗示了此发酵阶段烟叶更为优秀的风味表达。此外,不同于CK和XQC组烟碱的OAV在发酵过程中持续上升的趋势,JP组在发酵中期到发酵结束的过程中出现大幅下降,最终达到相对较低的水平。说明在发酵中期到发酵结束的阶段,对于JP组,烟碱对于烟叶风味的贡献正在减弱,相应的,其他对烟叶香气有正向作用的物质贡献度增长。这反映了酒醅添加剂在烟叶降碱增香方面的突出作用。此外,结合PLS-DA和OAV的分析结果,根据P<0.05、VIP≥1且OAV≥1筛选得到8种导致不同处理烟叶样品之间香气差异形成的关键挥发性风味物质,包括4,7,9-巨豆三烯-3-酮A、4,7,9-巨豆三烯-3-酮B、4,7,9-巨豆三烯-3-酮D、邻苯二甲酸二丁酯、2,4-二叔丁基苯酚、茶香酮、异佛尔酮、β-紫罗兰酮。
2.4 基本理化指标与关键差异风味代谢物相关性分析
茄芯烟叶在感官形成过程中,基本理化指标、FAAs和VFCs的变化具有重要影响。 相关性分析能够阐明烟叶发酵过程中基本理化指标对于关键差异风味代谢物的影响。通过Pearson相关性分析法对发酵过程中烟叶的基本理化指标与关键差异FAAs及VFCs之间的相关性进行分析,结果见图5。 由图5可知,4,7,9-巨豆三烯-3-酮-B与异佛尔酮(r=0.89)、4,7,9-巨豆三烯-3-酮-D(r=0.89)呈现高度显著正相关(P<0.001),且异佛尔酮和4,7,9-巨豆三烯-3-酮-D(r=0.88)也呈现高度显著的正相关(P<0.001),表明这3种关键差异香气物质可能以协同作用共同对烟叶风味做出贡献。另外,邻苯二甲酸二丁酯和β-紫罗兰酮(r=-0.67)、Thr和茶香酮(r=-0.70)存在显著的负相关(P<0.05),2,4-二叔丁基苯酚与茶香酮(r=0.64)存在显著的正相关(P<0.05)。pH与茶香酮(r=-0.65)呈显著负相关(P<0.05),总酸则与茶香酮(r=0.78)呈显著正相关(P<0.05),而其他基本理化指标与关键差异风味代谢物没有显著性相关关系(P>0.05)。结合表1可知,与CK组相比,添加酒醅和夏秋茶能够降低发酵中期茄芯烟叶的pH,相应的提升总酸含量,而发酵结束后JP组仍维持类似的变化,但XQC组则有相反的趋势;对比表2中茶香酮物质的含量,发现在发酵中期,与CK组相比,试验组中茶香酮含量更高,并持续到发酵结束,且JP组茶香酮物质含量仍然更为丰富,说明发酵烟叶的酸性环境变化造就了试验组差异香气代谢物丰度的变化,使得茶香酮携带的花香气味更加凸显,有助于塑造试验组烟叶更强烈的花香特征。结果表明,在茄芯烟叶发酵中期,添加酒醅和夏秋茶可能通过直接影响烟叶中的理化指标,如降低pH及提高总酸含量,进而影响茶香酮等关键差异风味代谢物的产生,强化茄芯烟叶的花香气味,进一步推动茄芯烟叶风味品质的提升,但XQC组发酵时间过长则会起到相反的效果。
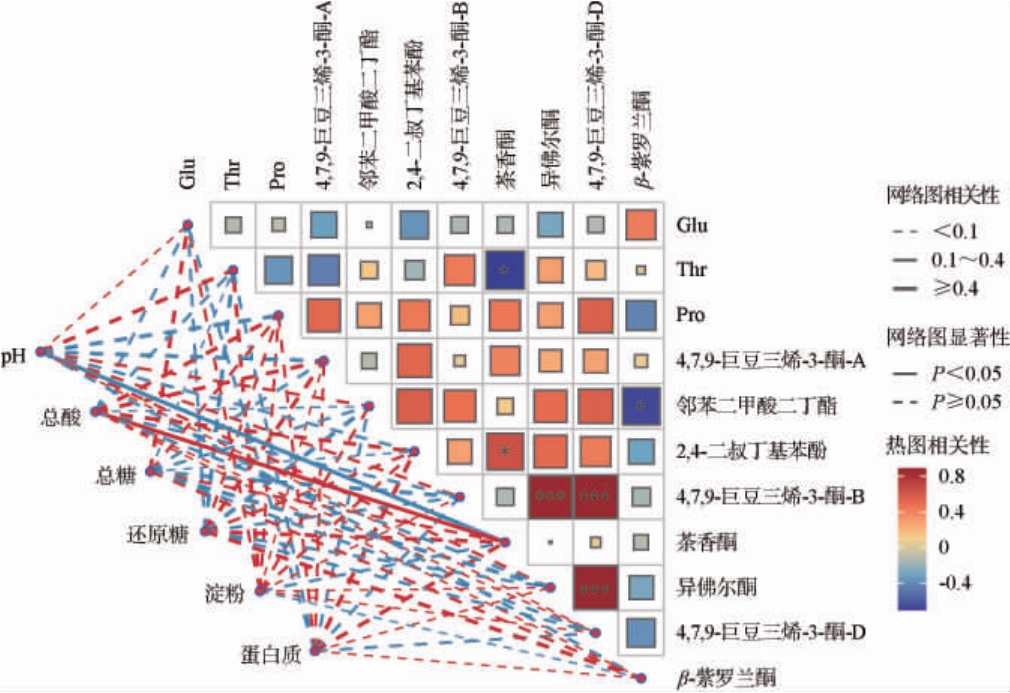
图5 基本理化指标和关键差异风味代谢物之间的相关性分析
Fig.5 Correlation analysis between the basic physiochemical indicators and key differential flavor metabolites
红色线条表示正相关、蓝色线条表示负相关。
“*”表示显著相关(P<0.05),“***”表示高度显著相关(P<0.001)。
3 结论
本研究以云雪39号为研究对象,探究了酒醅和夏秋茶作为外源添加剂对茄芯烟叶农业发酵过程中基本理化指标及风味物质的影响。 结果表明,外源添加剂有助于降解还原糖,延缓总糖消耗,并降低发酵中期pH、淀粉及蛋白质含量,提高总酸含量。 基于TAV≥1、VIP≥1及P<0.05筛选得到谷氨酸、脯氨酸和苏氨酸是导致不同处理烟叶滋味差异的关键呈味氨基酸,共同赋予茄芯烟叶鲜味、甜味和苦味特征。 外源添加剂有助于降解氮氧化合物,平衡香气组成,进一步增强烟叶花香、果香、甜味、蜡质和麝香风味,基于OAV≥1、VIP≥1及P<0.05筛选得到4,7,9-巨豆三烯-3-酮、茶香酮等8种物质是导致不同处理烟叶气味差异的关键挥发性风味物质。通过对基本理化指标和关键差异风味代谢物进行相关性分析,结果表明,外源添加剂通过降低烟叶pH、提高总酸含量进而影响关键差异风味代谢物生成。虽然外源添加剂尤其是酒醅有利于提升茄芯烟叶品质,但具体机制尚未理清,因此未来将进一步探究这两种外源添加剂对农业发酵中茄芯烟叶微生物群落及其代谢途径的影响,为开发和制备茄芯烟叶特色农业发酵技术提供更加科学全面的理论支撑。
[1]李军华,唐杰,梁坤,等.印尼与国内雪茄烟叶主要化学成分差异分析[J].浙江农业科学,2015,56(7):1080-1083.
[2]乔靖宇,宋雯,杨春雷,等.高地芽孢杆菌的筛选鉴定及其对雪茄烟叶发酵产香的影响[J].中国酿造,2023,42(7):114-120.
[3]DAI J C,DONG A J,XIONG G X,et al.Production of highly active extracellular amylase and cellulase from Bacillus subtilis ZIM3 and a recombinant strain with a potential application in tobacco fermentation[J].Front Microbiol,2020,11:1539-1552.
[4]ZHANG G H, YAO H, ZHAO G K, et al.Metabolomics reveals the effects producing region and fermentation stage on substance conversion in cigar tobacco leaf[J].Chem Biol Technol Agr,2023,10(1):2-22.
[5]钟仙韵,叶为民,陈群明,等.雪茄烟叶发酵及其与风味形成关系研究进展[J].中国酿造,2024,43(6):27-31.
[6]李凌,章存勇.不同物料处理对雪茄烟叶发酵后香气成分和抽吸质量的影响[J].南方农业,2016,10(3):254-256.
[7]徐世杰.雪茄茄衣人工发酵过程中的质量变化规律及添加物料对其品质的影响[D].郑州:河南农业大学,2016.
[8]李林林,王荣浩,吴昭,等.外加蔗糖发酵对印尼BESUKI雪茄烟叶品质的影响[J].河南农业科学,2024,53(9):171-180.
[9]REN M J,QIN Y Q,ZHAO Y,et al.Effects of microbes and metabolites on tobacco quality in"Humi"characteristic fermentation of cigar tobacco leaf[J].Process Biochem,2024,143(8):186-197.
[10]ZONG P F,HU W R,HUANG Y,et al.Effects of adding cocoa fermentation medium on cigar leaves in agricultural fermentation stage[J].Front Bioeng Biotech,2023,11:1251413.
[11]YANG L,XIAN C,LI P,et al.The spatio-temporal diversity and succession of microbial community and its environment driving factors during stacking fermentation of Maotai-flavor Baijiu[J].Food Res Int, 2023,167(9):112892-112900.
[12]宋攀,刘淼,林锋,等.全产业链模式下白酒副产物的高效利用技术探讨[J].酿酒科技,2021(7):95-101.
[13]CAO M,CAO Z,TIAN J,et al.Structural characterization and in vitro antioxidant activity of a novel polysaccharide from Summer-Autumn tea[J].Foods,2024,13(6):821-836.
[14]陈向阳,王浩,王梓菲,等.发酵茶酒微生物多样性、品质特性及抗氧化作用分析[J].黄山学院学报,2023,25(5):50-55.
[15]HUANG Z G, ZENG B, DENG J, et al.Succession of microbial community structure in fermented grains during the fermentation of strongflavor Baijiu and its impact on the metabolism of acids, alcohols, and esters[J].Food Sci Biotechnol, 2024,33(15):3501-3513.
[16]ASSAD M, ASHAOLU T J, KHALIFA I, et al.Dissecting the role of microorganisms in tea production of different fermentation levels: A multifaceted review of their action mechanisms, quality attributes and future perspectives[J].World J Microb Biot,2023,39(10):265-280.
[17]贾云,胡婉蓉,吕晋雄,等.雪茄烟叶发酵过程中微生物群落及功能微生物分析[J].轻工学报,2023,38(1):71-78,89.
[18]ZHANG W, DENG Q, ZHU B K, et al.Improving the quality of lowgrade tobacco by enzymatic treatment and co-fermentation with yeast and lactic acid bacteria[J].Appl Biochem Biotech,2025,197(1):613-630.
[19]LIU X G, YUAN L, MA D N, et al.Relationship between microbial protein and amino acid metabolism in fermented grains of long fermentation period strong-flavor Baijiu[J].Syst Microbiol Biomanuf, 2024,4(3):1-15.
[20]周文,刘一兵,曾代龙,等.雪茄茄芯烟叶堆垛发酵技术研究与应用[J].农业科学,2016,6(3):63-70.
[21]国家市场监督管理总局,中华人民共和国国家卫生健康委员会.GB 12456—2021 食品安全国家标准食品中总酸的测定[S].北京:中国标准出版社,2021.
[22]国家烟草专卖局.YC/T222—2007 烟草及烟草制品pH的测定[S].北京:中国标准出版社,2007.
[23]国家食品药品监督管理总局,中华人民共和国国家卫生和计划生育委员会.GB 5009.5—2016 食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2016.
[24]韩富根,赵铭钦.烟草品质分析[M].北京:中国农业出版社,2014:130-135.
[25]ZHANG M Z,GUO D F,WANG H Q,et al.Integrated characterization of filler tobacco leaves:HS-SPME-GC-MS,E-nose,and microbiome analysis across different origins[J].Bioresour Bioprocess,2024,11(1):11-28.
[26]王海清,郭东锋,丁乃红,等.云产雪茄烟叶微生物群落、游离氨基酸及挥发性风味物质特征分析[J].轻工学报,2024,39(4):97-108.
[27]GIACOMO M D,PAOLINO M,SILVESTRU D,et al.Microbial community structure and dynamics of dark fire-cured tobacco fermentation[J].Appl Environ Microb,2007,73(3):825-837.
[28]丁宁,丁松爽,胡捷,等.马杜罗茄衣发酵过程中外观颜色和内在成分的变化及相关性分析[J].中国烟草学报,2021,27(5):110-118.
[29]郑霖霖.不同发酵工艺下茄芯烟叶的微生物群落与品质变化及相关性分析[D].郑州:河南农业大学,2023.
[30]陆岸芷.绞股蓝水提液与生物酶配施对雪茄烟叶发酵中多酚代谢及品质的影响[D].杨凌:西北农林科技大学,2024.
[31]张蒙蒙.单宁降解菌的筛选、鉴定及其在雪茄烟叶发酵中的应用研究[D].郑州:河南农业大学,2023.
[32]张光海,杨海东,夏华昌,等.雪茄烟叶发酵质量变化及工艺研究进展[J].发酵科技通讯,2024,53(2):96-104.
[33]REN M J,QIN Y Q,ZHANG L Y,et al.Effects of fermentation chamber temperature on microbes and quality of cigar wrapper tobacco leaves[J].Appl Microbiol Biot,2023,107(21):6469-6485.
[34]周文,刘一兵,曾代龙,等.雪茄茄芯烟叶堆垛发酵技术研究与应用[J].农业科学,2016,6(3):63-70.
[35]张谊寒,高宪辉,何彬,等.云南典型烟区硃砂烟叶游离氨基酸特征分析[J/OL].分子植物育种,1-11(2024-11-28).http://kns.cnki.net/kcms/detail/46.1068.S.20231228.0908.004.html.
[36]WANG H Q, GUO D F, ZHANG M Z, et al.Correlation study on microbial communities and volatile flavor compounds in cigar tobacco leaves of diverse origins[J].Appl Microbiol Biot,2024,108(1):236.
[37]杨淳婷,张梦玥,赵园园,等.低烟碱品种及栽培模式对烤烟化学成分及感官质量的影响[J].中国烟草学报,2022,28(6):85-93.
[38]ZHANG M Z,GUO D F,WU G L,et al.Analysis of volatile compound metabolic profiles during the fermentation of filler tobacco leaves through integrated E-nose,GC-MS,GC-IMS,and sensory evaluation[J].J Chromatogr A,2024,1737(25):465472-465483.
[39]VEN GEMEGT L J.化合物嗅觉阈值汇编[M].第二版,北京:科学出版社,2018:242-567.