氨基甲酸乙酯(ethyl carbamate,EC)又名乌拉坦、乌来糖、尿烷等,是由尿素、氨甲酰磷酸、精氨酸等前体化合物与乙醇反应形成的一种酯类化合物,其分子质量为89.1,为白色结晶性粉末,沸点为(105.7±23.0)℃(标准大气压下),其对白鼠口服半数致死量(median lethal dose,LD50)为2 700 mg/kg[1]。 有学者们认为,EC是由食品或饮料加工过程或发酵过程中产生的,因此,其被认为是一种过程污染物[1]。 EC主要通过皮肤和肠上皮组织所吸收,大部分进入人体内的EC都会被水解排出,但仍然有0.5%会被细胞色素P450氧化为乙烯基氨基甲酸酯环氧化合物,该物质能破坏人体脱氧核糖核酸(deoxyribonucleic acid,DNA)结构,导致基因突变,最终导致癌症[2],因此,于19世纪70年代被国际癌症研究机构(International Agency for Research on Cancer,IARC)列为2B类致癌化合物后[3],后于2007年重新列为2A类致癌化合物[4]。EC是一种可诱发啮齿类动物出现肺癌、皮肤癌等疾病的致癌化合物,并且在饮料酒中由于乙醇的存在,能够促进EC的致癌性[5]。因此,为了减少该物质的形成,大量学者对黄酒、葡萄酒以及白酒[6-9]中EC的检测方法以及控制节点进行研究。相较于黄酒、葡萄酒等,国内学者对白酒中氨基甲酸乙酯的研究还不够全面,例如在检测以及消减手段方面,且目前研究的消减手段并未应用到实际生产上,未验证其理论的合理性。与此同时,各位学者的研究对象局限于EC本体,并未对其前体物质或来源展开研究,以至于国内并没有对白酒中EC的含量提出准确的限制、稳定的检测方法以及合理的消减手段。 因此,本文在借助其他酒种及其相应生产工艺中EC的形成途径、分析方法的相应研究,对今后白酒中氨基甲酸乙酯的检测手段以及消减手段提出建议,以期对白酒中氨基甲酸乙酯的研究有所进展突破。
1 氨基甲酸乙酯限量相关法规
由于EC致癌性的明确指出以及在各类酒精饮料、面包中均被检出,各国陆续对发酵类食品中的EC含量做出相应的规定,例如加拿大政府率先于1985年对各种酒精饮料中的EC含量进行了限制,规定餐酒、蒸馏酒、白兰地中的EC含量应分别小于30 μg/L、150 μg/L、400 μg/L,其他国家也相继出台相关规定(见表1)[10-12]。 与此同时,我国也对国内各香型白酒原酒中的EC含量做出了系统性的检测(见表2)[13-14]。
表1 各国饮料酒中氨基甲酸乙酯含量的规定
Table 1 Regulations on ethyl carbamate content in alcoholic beverages in various countries

种类酒精度/%vol允许限量/(μg·L-1)清酒蒸馏酒葡萄酒白兰地15~20 40 12 40 200(加拿大),100(日本)125(美国),150(加拿大),210(巴西)15(美国),30(加拿大)400(加拿大、捷克),800(德国),1 000(法国)
表2 不同香型白酒原酒中的氨基甲酸乙酯含量
Table 2 Ethyl carbamate contents in original liquor of different flavor types Baijiu
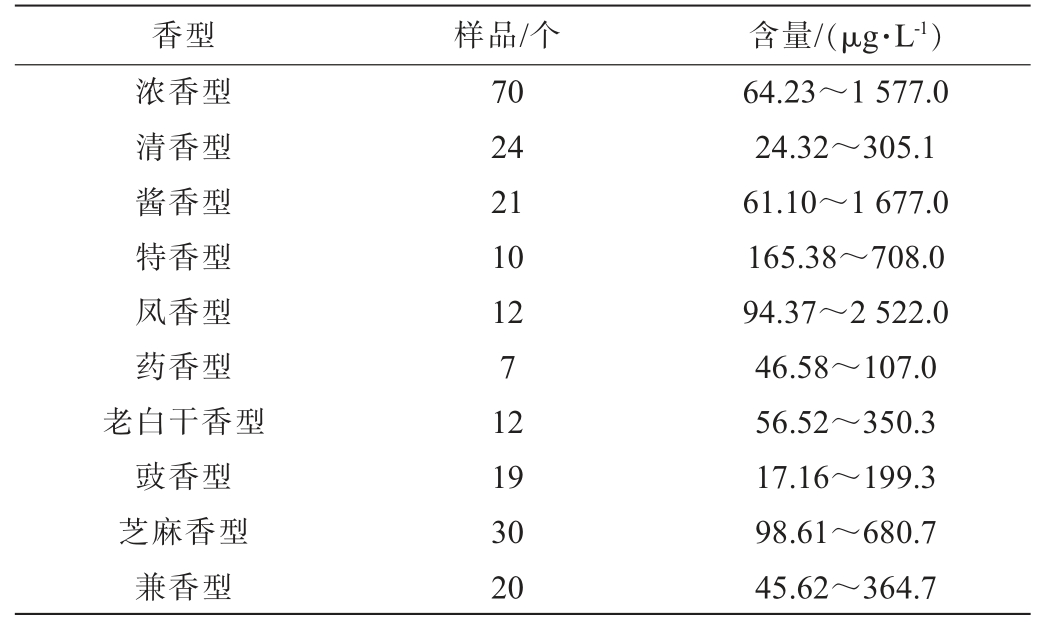
香型样品/个含量/(μg·L-1)浓香型清香型酱香型特香型凤香型药香型老白干香型豉香型芝麻香型兼香型70 24 21 10 12 7 12 19 30 20 64.23~1 577.0 24.32~305.1 61.10~1 677.0 165.38~708.0 94.37~2 522.0 46.58~107.0 56.52~350.3 17.16~199.3 98.61~680.7 45.62~364.7
人体对EC的摄入来源为酒精饮料以及发酵豆类食品[15],而白酒为我国所特有的传统蒸馏酒,在世界蒸馏酒中独树一帜,其独特的香气以及口感受广大饮用者的喜爱,难以避免的使消费者出现健康隐患,但国内标准中对EC含量并没有提出具体要求,因此需要学者们在白酒中氨基甲酸乙酯的含量以及致癌性方面做出更多深入的研究,并根据不同香型白酒制定出具体有效的限制标准以及相应的检测方法。
2 氨基甲酸乙酯的形成机理
EC主要在发酵食品及酒精饮料发酵过程中由多种前体化合物与乙醇,在温度、催化剂、菌株的作用下合成,这些前体化合物主要代谢生成途径一般分为两类,其一是从外界带入或由尿素循环中生成的尿素与乙醇代谢生成,例如瓜氨酸、精氨酸、氨基甲酸酯等;其二是由氢氰酸、氰酸等含氰基化合物代谢生成[16]。 在食品饮料中形成EC的主要途径通常为乙醇与氰酸盐或含有氨基甲酰官能团的化合物(如尿素和瓜氨酸)反应所合成(见图1)。
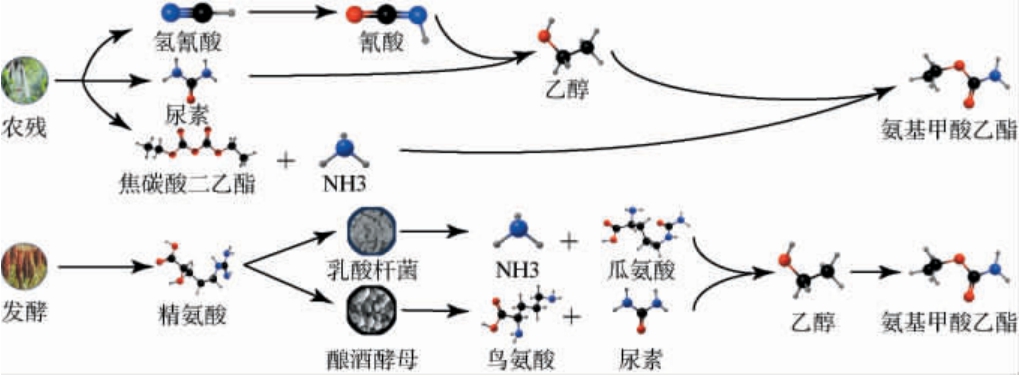
图1 白酒生产中氨基甲酸乙酯的主要生成途径
Fig.1 Main pathways for ethyl carbamate formation in Baijiu production
2.1 农残途径
近年来研究发现,国内白酒发酵中的原料以及曲药中难以避免的存在着氰化物、尿素、焦碳酸二乙酯等EC合成的外源前体物质,例如原料小麦、高粱等作物生长过程中必定会施加农药或农肥,以至于其表面沾染了尿素、蜀黍氰苷、氰化钠等物质。氰化物作为EC的前体物首先被发现于威士忌中,研究发现,氰化物存在多种形式(氰化钠、异氰酸甲酯等)可以与乙醇生成EC[17]。发酵过程中,尿素随着发酵温度的升高,部分分解为氢氰酸以及氰化物等[14],其在高温或酵母产生的蛋白酶作用下自发氧化为氰酸盐,进而与乙醇、氧气等反应[18]生产大量的EC。 也有学者研究发现,高粱中存在的蜀黍氰苷的含量与其水解产生的氰化物成正比,且发现原酒中氰化物初始含量与达到稳定时的EC含量成良好的线性关系(R2=0.966 9)[19-20]。 高粱中的蜀黍氰苷在β-葡萄糖苷酶作用下分解出对羟基-扁桃腈,该物质在碱性条件下进一步分解出氰化物,由于其低沸点,在蒸馏过程中的酒头位置馏出,因此,在蒸馏环节上,通过摘取酒头,能极大的去除氰化物,减少其在老熟过程高温条件下生成EC的可能性。 由于葡萄原料以及发酵环境的影响,人们通过将焦碳酸二乙酯作为微生物抑制剂添加到发酵液中,抑制其余杂菌对发酵过程的影响,后来研究发现,焦碳酸二乙酯能与葡萄酒发酵中产生的氨气反应生成EC。
2.2 发酵途径
尿素循环中精氨琥珀酸在酶的作用下产生的精氨酸可生成尿素以及瓜氨酸,进而与乙醇反应生成EC,在20世纪70年代初期就有研究发现,尿素与乙醇可以在常温下反应生成EC[21]。在葡萄酒的生产过程中,导致EC含量高的原因有很多,其一是可利用精氨酸的乳酸杆菌(Lactobacillus)代谢产生的瓜氨酸可以和乙烯烃反应产生EC[22];其二是酵母发酵过程中,会加入尿素作为氮源,导致其直接与乙醇反应产生EC。同时也有研究表明,发酵后EC的生成量与温度、游离态氮、发酵温度等相关,其中温度对EC的合成至关重要[23-24],发酵温度每上升10 ℃,EC的生成率提高约100%。 因此,XUE S Y等[25]从发酵谷物中筛选出两株可以直接利用EC作为唯一碳源的乙醇念球菌酵母菌株,以此控制葡萄酒及白酒发酵过程中EC的生成。此外,酿酒原料中的尿素可直接引入发酵中导致EC含量提高,因此,可以通过合理施加氮肥以及原料清洗等方式控制尿素含量。但酵母生长代谢过程中产生的尿素才是主要来源,合成的尿素除了满足于自身需求,多余的尿素将会排到胞外,在发酵高温以及乙醇作用下导致EC含量提高,因此,为了控制尿素含量,也需要在酵母菌株以及理化环境方面进行控制,即通过选育或者基因工程技术低产尿素的菌株,以达到降低EC的作用。
3 氨基甲酸乙酯的检测方法
自19世纪70年代EC被国际癌症研究机构列为2B类致癌化合物以来,其在发酵食品及饮料中的检测技术已经发展了几十年,但我国白酒中EC的检测也迎来了新的挑战:白酒不同于其他酒精饮料,是一种风味极其丰富的饮料,其中种类繁多的风味物质极其的影响EC的准确定量分析;中国白酒中的EC含量低,需要合适的前处理方式进行浓缩。近十年以来,已经开发了针对白酒和黄酒样品中EC含量的检测技术,并进行了有效的定量测定(见表3)[26-37]。
表3 近十年白酒和黄酒中氨基甲酸乙酯的检测方法
Table 3 Detection methods for ethyl carbamate in Baijiu and Huangjiu in the past decade
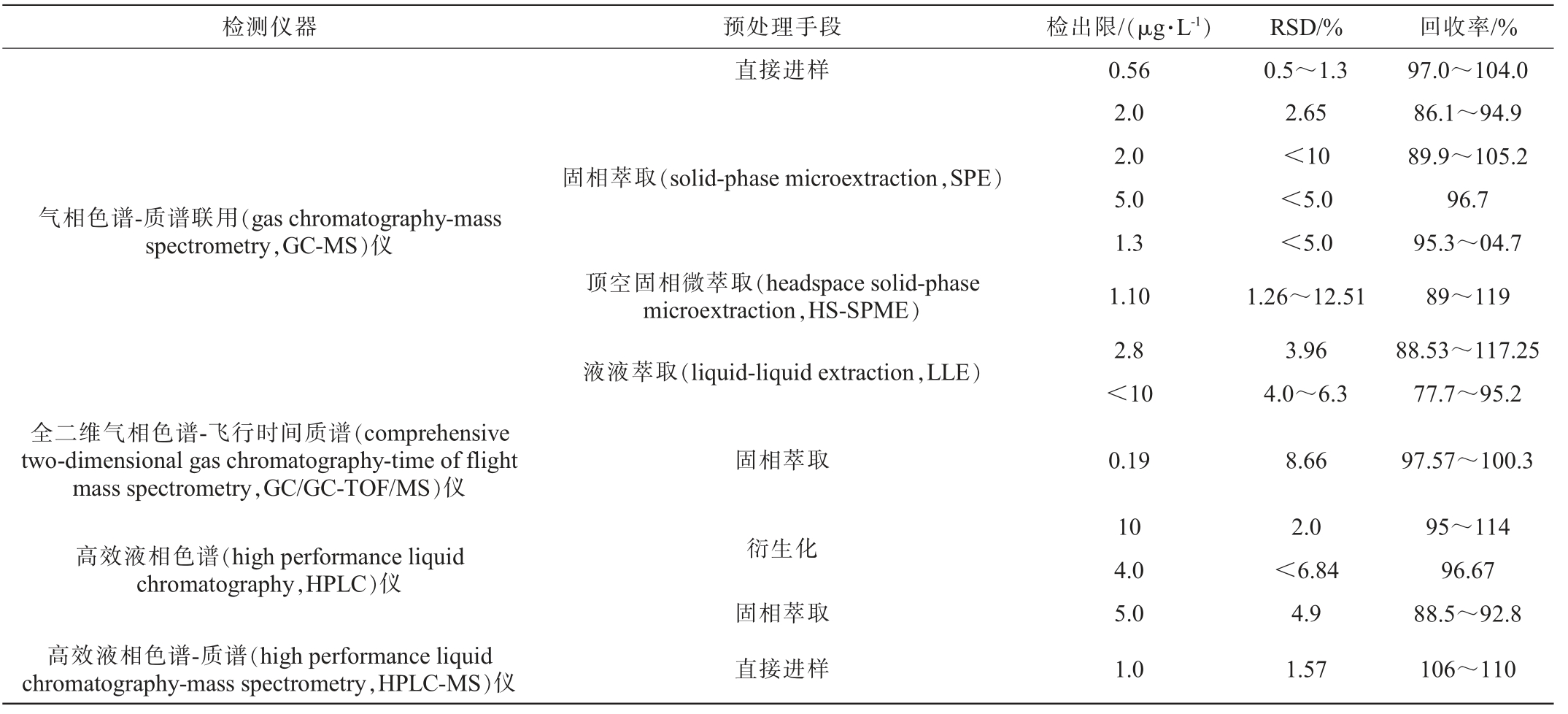
检测仪器预处理手段检出限/(μg·L-1)RSD/%回收率/%气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪全二维气相色谱-飞行时间质谱(comprehensive two-dimensional gas chromatography-time of flight mass spectrometry,GC/GC-TOF/MS)仪高效液相色谱(high performance liquid chromatography,HPLC)仪高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)仪直接进样固相萃取(solid-phase microextraction,SPE)顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)液液萃取(liquid-liquid extraction,LLE)固相萃取衍生化固相萃取直接进样0.56 2.0 2.0 5.0 1.3 1.10 2.8<10 0.19 10 4.0 5.0 1.0 0.5~1.3 2.65<10<5.0<5.0 1.26~12.51 3.96 4.0~6.3 8.66 2.0<6.84 4.9 1.57 97.0~104.0 86.1~94.9 89.9~105.2 96.7 95.3~04.7 89~119 88.53~117.25 77.7~95.2 97.57~100.3 95~114 96.67 88.5~92.8 106~110
3.1 气相色谱-质谱检测
目前,国内白酒中EC的检测方法主要基于GC-MS,基本采用内标法进行定量分析,使用的内标化合物一般为氨基甲酸甲酯(methyl carbamate,MC)、氨基甲酸丙酯(propyl carbamate,PC)以及同位素标记物EC-D5(尿烷-d5)。
由于白酒及黄酒中EC含量较低,绝大多数学者均会对样品进行预处理,一般采用顶空固相微萃取、液液萃取、固相萃取等方式对样品中的EC浓缩处理以保证足够的灵敏度以及重复性。国内学者在此基础上建立了一系列检出限低于GB 5009.223—2014《食品中氨基甲酸乙酯的测定》中规定的5.0 μg/mL的GC-MS法,例如黄卫红等[38]通过SPE法浓缩样品,结合GC-MS检测酱香型白酒中EC的检出限低至1.0 μg/mL,能极好的满足于白酒中痕量氨基甲酸乙酯的定量检测要求。
3.2 全二维气相色谱-飞行时间质谱
现如今国内使用GC/GC-TOF/MS对白酒中EC检测的研究极度缺失,唯有李欣等[28]建立了以EC-D5为内标,采用HS-SPME结合GC/GC-TOF/MS检测白酒样品中EC含量的方法,该方法的检出限和定量限较低,分别为0.19 μg/mL、0.64 μg/mL。GC/GC-TOF/MS相较于GC-MS具有检测时间短的优势。
3.3 高效液相色谱
高效液相色谱一般会结合质谱或者荧光检测器(fluorescence detector,FLD)所使用,是目前用来检测EC的方法中最为高效简便的方法,其结合了LC高效的分离能力以及质谱设备和荧光检测器的高灵敏定量能力,对待测化合物的选择性佳,适合于白酒这种复杂基质样品的检测;与此同时,液相检测方式对样品的前处理都相对简单,不外乎为稀释或者衍生化,具有重现性好、准确性高的特点,如孙贺等[30]采用HPLC-MS,使用多反应监测(multiple reaction monitoring,MRM)模式,选择m/z为90.03以及62.12的离子作为定量离子,建立了相对标准偏差(relative standard deviation,RSD)%<1.64%以及检出限为1.0 μg/mL的定量检测手段。
综上所述,GC-MS以及GC-GC-TOF/MS的检测限以及灵敏性优于液相色谱,能够以极低的检出限检测到白酒中存在的氨基甲酸乙酯,但是这两种仪器并不能直接进入水相,而为了避免水相进入质谱,影响检测稳定性以及仪器的寿命,就需要对样品进行前处理;但是白酒前处理过程极其繁琐,例如液液萃取、固相萃取等,均需要大量的人力、物力,导致检测成本过高,并不适用于酒厂中白酒的直接检测,因此,后续的研究在检测方法上更应该着重于使用高效液相色谱以及联用质谱等手段。 结合各位学者的研究发现,大家的检测目标物均为氨基甲酸乙酯,而白酒发酵是一个长时间的过程,氨基甲酸乙酯的合成途径众多,之后的研究重点可以放在使用HPLC的基础上,对氨基甲酸乙酯的中间合成物质进行监控检测,例如尿素、氰化物等,为找到控制氨基甲酸乙酯的关键发酵控制点提供参考理论。
4 氨基甲酸乙酯的消减方法
目前,国内外降低酒精饮料中EC的方法很多,主要为消减EC前体物质、控制反应程度、直接降解EC,其主要通过发酵菌株的筛选、降低和缩短灭菌的温度和时间、优化工艺、酶法消除、物理吸附等。
4.1 优化生产工艺
白酒中EC的形成分布于酿酒整个过程,主要集中于发酵、蒸馏、储存三个阶段。发酵过程中温度、pH等因素对EC的合成具有较大影响,EC含量随着发酵温度、pH、酒精度的升高不断上升[39-40],但同时这些因素也是促进白酒发酵后酒体品质提升的关键因素,因此,控制入窖温度以及糖化时间极为重要。同时,由于在种植过程中施加的氮肥,会导致尿素以及氰化物等成分存在于原料且带入发酵中,因此,原料的选取以及处理也能一定程度上降低EC的生成。酒厂中通过对高粱、大米、小麦进行漂洗可以降低尿素的含量,但是会导致原料中一些微量成分的损失[41]。“酒是陈的香”,因此白酒自蒸馏后,便会进入存储老熟阶段。有研究发现,低温储存能有效的减少储存过程中EC的生成[42],同时也有研究发现,铜离子从储存容器中的溶出,会催化EC的合成[43-44]。因此,合理的选择存储温度以及容器能有效的减少EC的合成。白酒是通过酒醅蒸馏所得,在蒸馏过程中,不同的蒸馏温度、蒸馏速度等都会影响EC的生成,在蒸馏过程中会产生新的EC,其增长率为30~68%[45]。对此,吴晨岑等[46]通过二次蒸馏(慢火壶式蒸馏)以及掐头去尾将白酒中EC含量减少了92.76%。
4.2 酶法消除
消除EC的酶主要有两种,一种是酸性脲酶,其通过降低发酵酒中EC的前体物质——尿素来降低EC含量;另外一种是氨基甲酸乙酯水解酶,其可以直接作用于EC生成氨、乙醇和二氧化碳[47-48]。孟庆达[49]通过研究罗伊氏乳杆菌(Lactobacillus reuteri)和腐生葡萄球菌(Staphylococcus saprophyticus)脲酶粗酶液对原料中尿素的去除效果,发现腐生葡萄球菌脲酶对原料中尿素的去除率可达14.5%~30.4%,罗伊氏乳杆菌脲酶对原料中尿素的去除率可达30.4%~75.6%。氨基甲酸乙酯水解酶是降解EC最有效、最直接的方法,但目前已经筛选得到的氨基甲酸乙酯水解酶较少,催化活力低。EC有一个酰胺键和一个酯键,能被酰胺酶或者酯酶降解,现在已经发现的对EC有降解能力的酶都是酰胺酶。康婷婷[50]围绕氨基甲酸乙酯水解酶的筛选以及氨基甲酸乙酯水解酶活力的改造展开研究,结果筛选出对EC有较高催化活力的酰胺酶,将其酶活力从原来的97.56 U/L提高至2 442 U/L;同时,方若思等[51]研究发现,通过在黄酒发酵中期添加鸟氨酸氨甲酰基转移酶能显著降低EC的含量,最高可降低15%且对酒体风味影响极小。
4.3 微生物法
EC的前体物质主要为尿素,其代谢反应与酵母息息相关,已有研究发现,不同的酿酒酵母(Saccharomyces cere visiae)的产尿素能力不一,导致EC含量不同。基于酿酒酵母尿素代谢的了解,利用基因工程技术以及菌株的筛选利用,可以有效的降低EC的合成。从菌株选育角度,丁霞等[52-53]采用高通量筛选技术,从浓香型白酒酒醅中筛出一株能降低酒醅中尿素与EC含量的解淀粉芽孢杆菌(Bacillus amyloliquefaciens),分别降低12%和17%,并且对酒醅风味物质影响不显著(P>0.05),但也有研究表明,这类低产EC的酵母菌仅适用于纯种发酵[54]。XUE S Y等[25]将138株分离菌株在以10 mg/L EC为唯一碳源的酵母氮源基(yeast nitrogen base,YNB)固体培养基上进行培养,最后从发酵谷物中筛选出两株可以直接降低EC含量的乙醇念珠菌酵母菌株(J1和J116),菌株J1、J116分别可使白酒中EC含量降低42.27%、91.24%。从基因工程技术角度,可以通过基因敲除法,来阻断EC前体物质的生成,进而减少EC的合成,人工培育出优良的菌株。GUO X W等[55]通过连续删除两个CAR1等位基因来阻断尿素的产生途径,构建了精氨酸酶缺陷的重组菌株YZ1,利用该菌株发酵葡萄酒,可使葡萄酒中尿素和EC含量分别降低77.89%和73.78%。
综上,微生物、物理及化学法均是直接对EC或尿素进行控制消减,但所有的有害物质的积累必然要从源头进行遏制,因此,应该对白酒酿造原料中的EC前体物质进行控制,如酿谷表皮的氰苷类化合物以及粮谷生长过程中施加的农残等,可以通过去皮机或者浸洗的方式去掉一部分,同时可以尝试着在存储过程中更换或定制传统的陶瓷容器,减少金属离子对EC合成的催化作用;亦或者是在不影响白酒风味的情况下加入一定的生物酶来抑制EC的合成。
5 总结与展望
由于市场对白酒的需求愈发扩大,人们对白酒中的有毒有害物质的关注也越发深入,通过国内外研究者对白酒中EC的研究发现,其合成前体主要包括尿素、氰化物、焦碳酸二乙酯、瓜氨酸、氨甲酸磷酸酯等,这些前体物质通过酵母菌以及乳杆菌等的精氨酸代谢而产生,随后与乙醇反应合成EC。由于EC对于人体健康存在潜在性危害,各研究者通过物理、化学、酶法以及微生物代谢途径等方式来降低白酒中的EC含量。化学法并不适用于白酒中EC的消减,更多的是通过物理法降低储存温度来降低EC含量,但该方法处理周期长、处理效率低下;酶法通过直接分解尿素或EC来减低其含量,但花费高昂且不稳定;微生物法通过基因敲除或曲药筛菌等方式得到能降低EC或其前体物质的菌株,但仅停留于理论,未结合曲药生产应用于生产,有可能会出现酒体风味改变的现象。因此,未来的研究中,如何既能保证白酒生产中的产品质量不下滑,又能降低EC的含量仍是难点。 对于未来EC的研究主要提出以下几个展望:①合理制定EC限量标准。EC广泛的存在于各类白酒之中,由于其发酵工艺或制曲工艺的差异,应该制定不同的标准,例如中高温大曲与高温大曲、黄酒与白酒等,为白酒生产行业提供指导依据。 ②白酒及曲药生产工艺非单一过程,发酵体系复杂,且EC的合成途径众多,因此需要对生产工艺各个环节中EC的前体物质及生成途径更加深入的研究,从生产整体控制参数,以达到消减EC的目的。③摸索检出限更低以及操作性更简便的EC前体物质含量液相检测方法,例如将EC衍生化、前处理富集等方式,以达到更加灵敏、快速的检测。
[1]GOWD V,SU H,KARLOVSKY P,et al.Ethyl carbamate:An emerging food and environmental toxicant[J].Food Chem,2018,15(248):312-321.
[2]PARK K K,LIEM A,STEWART B C,et al.Vinyl carbamate epoxide,a major strong electrophilic,mutagenic and carcinogenic metabolite of vinyl carbamate and ethyl carbamate(urethane)[J].Carcinogenesis,1993,14(3):441-450.
[3]IARC.IARC monographs on the evaluation of carcinogenic risks to humans,overall evaluations of carcinogenicity:An updating of IARC monographs[M].Lyon France:IARC,1987.
[4]IARC.IARC monographs on the evaluation of carcinogenic risks to humans.Alcoholic beverage consumption and ethyl carbamate (urethane)[M].Lyon France:IARC,2010.
[5]LACHENMEIER D W, LIMA M C, NOBREGA I C, et al.Cancer risk assessment of ethyl carbamate in alcoholic beverages from Brazil with special consideration to the spirits cachaça and tiquira[J].BMC Cancer,2010,10:266.
[6]秦辉,李涵,熊燕飞,等.蒸馏酒中氨基甲酸乙酯合成途径及控制措施的研究进展及其对中国白酒的借鉴[J].酿酒科技,2018(5):110-116.
[7]叶月华,刘晓艳,白卫东,等.酱油中氨基甲酸乙酯形成机制、检测技术及控制研究进展[J].中国酿造,2020,39(9):7-12.
[8]张群.黄酒酿造中氨基甲酸乙酯控制关键技术研究[J].食品与生物技术学报,2022,41(3):112.
[9]李拥军,陈雯,皮小弟,等.芝麻香型与浓香型白酒固态发酵过程中氨基甲酸乙酯的形成研究[J].现代食品科技,2021,37(8):67-74.
[10]XU Y, LI Y, LI J, et al.Ethyl carbamate triggers ferroptosis in liver through inhibiting GSH synthesis and suppressing Nrf2 activation[J].Redox Biol,2022,53:2213-2317.
[11]LIM H S,LEE K G.Development and validation of analytical methods for ethyl carbamate in various fermented foods[J].Food Chem, 2011,126:1373-1379.
[12]ALBERTS P, STANDER M A, DE VILLIERS A.Development of a novel solid-phase extraction,LC-MS/MS method for the analysis of ethyl carbamate in alcoholic beverages:application to South African wine and spirits[J].Food Addit Contam,2011,28(7):826-839.
[13]范文来,王栋.近10年我国传统饮料酒白酒和黄酒品质安全研究现状与展望[J].食品安全质量检测学报,2019,10(15):4811-4829.
[14]张顺荣,范文来,徐岩.不同香型白酒中氨基甲酸乙酯的研究与风险评估[J].食品与发酵工业,2016,42(5):198-202.
[15]WANG C,WANG M,ZHANG M P.Ethyl carbamate in Chinese liquor:Presence,analysis,formation,and control[J].Appl Microbiol Biot,2021,105(11):4383-4395.
[16]WU P,CAI C,SHEN X,et al.Formation of ethyl carbamate and changes during fermentation and storage of yellow rice wine[J].Food Chem,2014,152:108-112.
[17]王欢,胡峰,胡建锋,等.白酒中氨基甲酸乙酯的研究进展[J].酿酒科技,2014(9):88-91,95.
[18]唐云容,杨军林.中国白酒氨基甲酸乙酯形成的代谢机制及控制技术研究进展[J].酿酒科技,2022(5):108-116.
[19]周韩玲,安明哲,赵东,等.高粱中蜀黍氰苷与浓香型白酒中氰化物及氨基甲酸乙酯关系的研究[J].中国酿造,2022,41(10):25-29.
[20]朱晓春,陈双,徐岩.浓香型白酒酿造过程中不同形态氰化物的含量分布规律[J].食品与发酵工业,2022,48(24):239-244,251.
[21]梁萌萌,薛洁,张敬,等.葡萄酒中氨基甲酸乙酯的分析与控制[J].酿酒科技,2013(3):40-43.
[22]KIM Y G,LYU J,KIM M K,et al.Effect of citrulline,urea,ethanol,and urease on the formation of ethyl carbamate in soybean paste model system[J].Food Chem,2015,189:74-79.
[23]胥小荣,王照友,孔庆岩,等.白酒贮存过程中氨基甲酸乙酯形成影响因素研究[J].食品安全导刊,2023(5):94-97.
[24]黄海.四川浓香型原酒中氨基甲酸乙酯含量的测定以及氨基化磁珠富集白酒中氨基甲酸乙酯的研究[D].南昌:南昌大学,2022.
[25]XUE S Y, DONG N, XIONG K, et al.The screening and isolation of ethyl-carbamate-degrading strains from fermented grains and their application in the degradation of ethyl carbamate in Chinese Baijiu[J].Foods,2023,12(15):28-43.
[26]ARESTA M, BOSCOLO M, FRANCO D W.Copper (II) catalysis in cyanide conversion into ethyl carbamate in spirits and relevant reactions[J].J Agr Food Chem,2001,49(6):2819-2824.
[27]梅云飞,巩子路,刘曼曼,等.GC-MS法测定白酒中氨基甲酸乙酯的研究[J].酿酒,2023,50(3):117-119.
[28]李欣,杜娟,刘阳晴雪,等.SPME结合GC×GC-TOFMS测定白酒中的氨基甲酸乙酯[J].食品与发酵工业,2023,49(7):270-274.
[29]马菊兰,李晓婷,刘墩福,等.青稞酒中氨基甲酸乙酯含量的检测方法[J].酿酒,2023,50(2):112-114.
[30]孙贺,徐君,赵颖,等.超高效液相色谱-串联质谱法测定白酒中氨基甲酸乙酯含量的研究[J].酿酒,2023,50(1):105-107.
[31]马延琴,许尤尤,叶丕平,等.红葡萄酒中氨基甲酸乙酯检测方法的优化[J].中国酿造,2022,41(7):220-224.
[32]陈同强,梁锋,吴海智,等.气相色谱-质谱法测定发酵乳中氨基甲酸乙酯含量[J].乳业科学与技术,2022,45(6):18-21.
[33]常瑞红,刁亚琴,郭亚飞,等.气相色谱-质谱联用法检测酒醅中氨基甲酸乙酯的方法研究[J].酿酒科技,2022(8):131-134.
[34]HUANG Z,PAN X D,WU P G,et al.Validation(in-house and collaboratory) of the quantification method for ethyl carbamate in alcoholic beverages and soy sauce by GC-MS[J].Food Chem,2013,141(4):4161-4165.
[35]YOU X,HU F,ZHONG H,et al.Comparison of two detection methods of ethyl carbamate in Baijiu[J].Liquor-Making Sci Tech,2020,3:75-82.
[36]史斌斌,徐岩,范文来.顶空固相微萃取(HS-SPME)和气相色谱-质谱(GC-MS)联用定量蒸馏酒中氨基甲酸乙酯[J].食品工业科技,2012,33(14):60-63.
[37]尤小龙,胡峰,钟航,等.白酒中氨基甲酸乙酯检测方法比较[J].酿酒科技,2020(3):75-79,82.
[38]黄卫红,耿平兰,程化鹏,等.SPE-GC/MS 法测定酱香型白酒中氨基甲酸乙酯[J].酿酒科技,2014(8):105-108.
[39]吴世嘉,王洪新.发酵食品中氨基甲酸乙酯的研究进展[J].化学与生物工程,2009,26(9):15-19,108.
[40]田夏琼,江华明,关统伟,等.浓香型白酒发酵过程中氨基甲酸乙酯形成的关联因子探究[J].中国酿造,2022,41(1):59-63.
[41]JAUNIAUX J C, URRESTARAZU L A, WIAME J M.Arginine metabolism in Saccharomyces cerevisiae:Subcellular localization of the enzymes[J].J Bacteriol,1978,133(3):1096-1107.
[42]黄庭明,刘盈福,周建明,等.黄酒纯生低温大容量陈酿的研究[J].食品与发酵工业,2015,41(11):106-109.
[43]王博,齐晶瑶.发酵酒中氨基甲酸乙酯的研究进展[J].生物信息学,2014(4):269-275.
[44]王金龙,程平言,熊晓通,等.存储环境对浓香型基酒中氨基甲酸乙酯的影响[J].中国酿造,2021,40(7):189-193.
[45]张温清,司冠儒,刘凤茹,等.小窖芝麻香型白酒蒸馏过程中氨基甲酸乙酯的研究[J].酿酒科技,2016(1):53-55,59.
[46]吴晨岑,范文来,徐岩.不同二次蒸馏方式对浓香型白酒中氨基甲酸乙酯去除率的影响[J].食品与发酵工业,2015,41(6):1-7.
[47]李焱鑫,黄晓媛,白卫东,等.发酵食品中氨基甲酸乙酯的形成途径及消减策略研究进展[J].食品安全质量检测学报,2022,13(14):4551-4558.
[48]梁鑫,张成楠,李秀婷.酶法降解氨基甲酸乙酯及其在白酒中的应用研究进展[J].中国酿造,2023,42(7):1-6.
[49]孟庆达.微生物法减少白酒生产中氨基甲酸乙酯前体物质的研究[D].无锡:江南大学,2018.
[50]康婷婷.氨基甲酸乙酯水解酶的筛选、表达及活力改造[D].杭州:浙江大学,2021.
[51]方若思,陈唐超,梁淑敏,等.短乳杆菌鸟氨酸氨甲酰基转移酶对黄酒发酵中氨基甲酸乙酯的调控作用[J].中国食品学报,2021,21(4):179-184.
[52]丁霞,李巧玉,刘凡,等.降解浓香型白酒中氨基甲酸乙酯菌株的筛选及产酶特性研究[J].食品与发酵工业,2018,44(7):29-36.
[53]丁霞.酒醅中氨基甲酸乙酯及其前体的控制与消除[D].无锡:江南大学,2019.
[54]雷庆子,王博,堵国成,等.诱变育种提高嗜盐四联球菌精氨酸和瓜氨酸利用能力[J].食品与发酵工业,2018,44(6):30-36.
[55]GUO X W, LI Y Z, GUO J, et al.Reduced production of ethyl carbamate for wine fermentation by deleting CAR1 in Saccharomyces cerevisiae[J].J Ind Microbiol Biot,2016,43(5):671-679.