酱香型白酒是中国传统固态发酵蒸馏酒的代表性品类之一,其独特的香气和口感长期以来一直受到研究人员和消费者的广泛关注[1-2]。现代分析技术已从其中鉴定出包括吡嗪类、呋喃酮类及酚类物质在内的1 800余种化合物[3],这些丰富的微量成分可能通过调节乙醇代谢酶活性和维持神经递质平衡,进而影响饮后舒适度[4]。其中四甲基吡嗪(tetramethylpyrazine,TTMP)、γ-氨基丁酸(γ-aminobutyric acid,GABA)等活性成分可通过调节乙醇代谢酶和神经递质平衡影响饮后舒适度[5]。
近年研究发现,相较于纯食用酒精,长期灌胃酱香型、浓香型和清香型白酒均能在一定程度上缓解小鼠的酒精性肝损伤,其中酱香型白酒中较高的有机酸含量可能是其降低酒精负性效应的关键因素[6]。彭斌[7]通过对酱香型白酒醉度检测模型的优化,发现杂醇(尤其是异戊醇)会抑制乙醇代谢并降低小鼠记忆能力,而乙酸则促进乙醇代谢并增强记忆能力。陈江权等[8]研究发现,年份越高的酱香型白酒中杂醇含量越少。马宇[9]通过酱香型白酒典型体基酒比较分析,证实己酸乙酯、四甲基吡嗪等化合物含量与轮次数存在显著正相关。郭雪峰[10]发现吡嗪类物质可穿透血脑屏障调控GABA水平。方程等[11]通过研究进一步揭示,与新酒和酒精组小鼠相比,老酒组小鼠的肝损伤程度更低,醉酒时间更短,并能有效缩短在强迫游泳应激条件下的不动时间,同时增加在旷场实验中的运动路程;老酒干预诱导的海马组织炎性反应程度显著低于新酒和酒精干预。 韩英等[12]通过消费者注意网络测试任务和脑电-事件相关电位研究,推测贮存时间越长的白酒中总酸含量与酸酯比增加,总酯含量降低,乳酸乙酯含量降低,乙缩醛转化量增加,影响饮后舒适度提升。 WU Z等[13]传统发酵酒所含的萜烯类成分可推迟血液乙醇峰值的出现,从而与长期贮存的酱香型白酒带来的柔和饮后体验相吻合。作为成品酒的关键原料,酱香型白酒基酒的贮存时间与其风味特征密切相关[14]。 然而,不同年份基酒的内在化合物组成存在明显差异,其对神经行为的影响机制尚未阐明。
本研究建立不同贮存年份酱香型白酒基酒的小鼠干预模型,并结合旷场行为学实验和超高效液相色谱-串联质谱技术(ultra-high-performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS),分析小鼠行为学变化及脑内神经递质水平,系统考察不同年份基酒对小鼠行为学特征及脑组织神经递质代谢的影响。 旨在为揭示酱香型白酒基酒的健康作用机制提供科学依据,也为白酒品质评价体系的完善提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 白酒样品
不同年份酱香型白酒基酒样品:均采集于贵州省名酒企业(编号为GZJS、GZJF、GZAJ、GZGJ、GZDYT、GZZJ)。分别采集前述6个企业储存1年、3年、5年、7年、9年和11年的1~7轮次酱香型白酒基酒(共6×6×7=252个酒样)各1 000 mL,再将各酒企对应轮次基酒各取50 mL等量混合,分别获得6个年份的最终基酒酒样(Y1、Y3、Y5、Y7、Y9、Y11代表储存1年、3年、5年、7年、9年和11年的基酒最终酒样)和1个6种年份基酒等量混合酒样(YH),基酒酒样最终酒精度均为53%vol。
1.1.2 实验小鼠
本实验共使用了155无特定病原体(specific pathogen free,SPF)级雄性C57BL/6J小鼠[鼠龄为6~8周,体质量为(20±2)g]:湖南普瑞玛药物研究中心有限公司[许可证编号:SYXK(湘)2021-0002]。在实验周期内,实验小鼠被安置于温度20~25 ℃的洁净实验环境中,相对湿度控制在50%~55%,并遵循12 h光照/黑暗周期(08:00-20:00),噪音强度<60 dB。 饲养室内配备有排风扇以确保良好的通风换气[15]。实验开始前,小鼠被给予一周的适应性喂养,期间采用标准基础饲料饲喂,所有动物实验均符合中国实验动物护理和使用的相关法规,并经湖南省药物安全评价研究中心伦理委员会批准。伦理审查编号为:IUCAC-2024(5)035。
1.1.3 试剂
乙腈、甲醇、甲酸、甲醇(均为色谱纯)、多巴胺、γ-氨基丁酸、乙酰胆碱等46种神经递质标准品(纯度均>98%)、同位素(Trp-D5、Glu-13C5)标准品(纯度均>98%):赛默飞世尔(中国)有限公司。
1.2 仪器与设备
ESJ160-5A电子分析天平:奥豪斯仪器(常州)有限公司;PX224ZH-E秒表:上海精密仪器仪表有限公司;注射器、灌胃针:上海医疗器械(集团)有限公司;DigBehv动物自发活动实验分析系统[旷场实验(open field test,OFT)仪]:上海吉量软件科技有限公司;高清摄像头(AverMedia SD Analog Capture):上海圆刚多媒体科技有限公司;QTRAP 6500+超高效液相色谱-串联质谱(UPLC-MS/MS)仪:美国AB SCIEX公司;Wonbio-96E冷冻研磨仪:上海万柏生物科技有限公司。
1.3 方法
1.3.1 小鼠灌胃
将155只健康成年雄性SPF级C57BL/6J小鼠,通过依据质量的分层随机法,被科学合理地分成了10组,且每组均包含15只小鼠。设置53%vol食用酒精(CEt)、超纯水(CW)、空白对照(CN),6个酱香型白酒基酒样品(Y1,Y3,Y5,Y7,Y9,Y11)及6个酱香型白酒基酒等量混合样品(YH)共10组实验体系。 参考郭雪峰[10]的研究方法并确定灌胃剂量均为0.2 mL/20 g·kg体质量,使用灌胃针对每只小鼠进行一次灌胃处理。
1.3.2 小鼠行为学测试
旷场实验是一种广泛应用于评估啮齿类动物(如小鼠)自发活动、焦虑水平及探索行为的经典实验模型[16]。通过观察动物在陌生开放环境中的行为模式, 可揭示其神经状态、药物效应或基因修饰对中枢神经系统的影响[17]。 本研究将旷场模型假设为小鼠可自由活动的“酒吧”,观察小鼠在灌胃不同年份酱香型白酒基酒后在不同时间点(0.5 h、2.0 h和5.0 h)的行为学特征。旷场实验前,小鼠在测试环境中适应30 min,记录灌胃前5 min的自发活动数据(定义灌胃前0 h为基准值)。 行为学测试具体操作如下:在灌胃处理后,分别于0.5 h、2.0 h和5.0 h三个时间点进行行为学测试。每次测试时,将小鼠置于旷场实验仪中,先给予1 min适应期以缓解紧张情绪,随后记录5 min内的小鼠行为表现。所有数据通过行为分析系统自动采集,结合人工校验以确保数据准确性,并以基准值作为参照进行差异分析。
测试指标如下:
①运动能力指标:总运动路程(cm)和平均运动速度(cm/s),用于评估整体活动水平和运动强度,同时观察运动路径形态(如趋壁转圈或无序旋转)以定性分析醉酒或兴奋状态。
②焦虑行为指标:中央区停留时间(s)和中央区运动路程(cm),其中中央区停留时间越短表明焦虑水平越高。
③探索行为指标:爬壁站立次数(次)和爬壁站立时间(s),反映小鼠的垂直探索行为,站立时间越长提示探索意愿越强。
1.3.3 小鼠脑组织关键神经递质含量检测
经过5.0 h的行为测试后,对小鼠实施安乐死处理。基于课题组前期研究发现,酱香型白酒灌胃后2 h小鼠代谢产物含量达到峰值[10],因此本研究选取该时间点进行不同年份基酒的神经递质检测。获取灌胃后2.0 h不同年份酱香型白酒基酒干预组的小鼠新鲜全脑组织[18]。获取后的脑组织被置于EP离心管内,经液氮进行快速冷冻处理,之后转移至-80 ℃的冰箱中进行冷冻保存备用。 采用超高效液相色谱-串联质谱(UPLC-MS)技术检测样本中神经递质含量。
样品前处理:精确称取50 mg脑组织样本,加入10 μL Trp-D5(5 ng/μL)和5 μL Glu-13C5(10 ng/μL)两种同位素内标,以及体积分数为80%的甲醇溶液(总体积为1 mL)。使用冷冻研磨仪(60 Hz,6 min)均质化后,于-20 ℃静置30 min,再于4 ℃、14 000 r/min条件下离心15 min。取上清液,经冷冻干燥后复溶于100 μL80%甲醇溶液中,分为高、低浓度样本分别处理,最终转移至进样小瓶(内标终质量浓度:Trp-D5 0.5 ng/mg组织,Glu-13C5 0.5 ng/mg组织)。 UPLC-MS/MS条件:Waters HSS T3色谱柱(2.1 mm×100 mm,1.8 μm),流动相为A(0.1%甲酸水)和B(0.1%甲酸乙腈),洗脱梯度为0~1.0 min,流动相B维持0;1.0~3.0 min,流动相B从0~5%;3.0~5.0 min,流动相B升至10%;5.0~7.0 min,流动相B升至15%;7.0~10.0 min,流动相B升至60%;10.0~12.0 min,流动相B升至100%;12.00~12.01 min,流动相B降至0;12.01~15.00 min,流动相B维持0。流速为0.3 mL/min,柱温为35 ℃。质谱条件为正/负离子模式切换,离子源电压±5 500 V/-4 500 V,离子源温度550 ℃。使用AB SCIEX OS软件自动积分峰面积并人工复核。
定性定量方法:通过标准品出峰时间定性,采用内标法定量。 以标准品质量浓度(x)为横坐标,以目标物与内标的峰面积比(y)为纵坐标绘制标准曲线,得到标准曲线回归方程(如多巴胺的y=0.015 54x+0.001 77,相关系数R2>0.99)。按照标准曲线方程计算样品中神经递质含量。
1.3.4 数据处理
所有实验均平行测定3次,结果以“平均值±标准差”表示。 采用SPSS 26.0软件对获取的数据进行单因素方差分析(analysis of variance,ANOVA),在此基础上采用最小显著差异法(least significant difference,LSD)进行多重比较检验,明确不同组数据之间的具体差异情况。
2 结果与分析
2.1 小鼠旷场行为学实验
2.1.1 小鼠运动能力分析
小鼠在旷场环境中的总运动路程和运动路径作为评估其运动能力的关键指标[24]。不同年份酱香型白酒基酒灌胃后小鼠的总运动距离和运动路径测定结果见图1。由图1A可知,与CW和CN相比,CEt组对小鼠的运动能力产生抑制作用。CEt组在灌胃后0.5~2.0 h,总运动路程显著下降至(19 782.48±931.32)cm(P<0.05),且持续下降至5.0 h。 由图1B可知,食用酒精组灌胃小鼠的活动路径呈现出原地转圈以及趋壁转圈的现象,在灌胃后0.5~2.0 h,小鼠就已经出现了兴奋或醉酒反应,且至5.0 h时相较于CN和CW较慢恢复清醒状态。 由图1C可知,对于低年份酱香型白酒基酒(Y1、Y3),尤其是Y1组,在灌胃后0.5~2.0 h,总活动距离显著缩短至(17 445.854±802.66)cm(P<0.05)。 由图1D可知,Y3组在灌胃后0.5 h即显现出显著的有序旋转运动特征;在灌胃后2.0 h,旋转行为逐渐消退,行动轨迹趋于无序化;在灌胃5.0 h后,Y1和Y3组小鼠逐步恢复清醒状态。由图1E可知,对于中年份酱香型白酒基酒(Y5、Y7)在灌胃后0.5~2.0 h,Y5组小鼠的总活动距离(10 012.772±878.22)cm显著低于Y7组(P<0.05)。由图1F可知,Y5组小鼠在灌胃后0.5~2.0 h表现出显著的旋转运动行为;而Y7组小鼠在灌胃0.5~2.0 h内,几乎没有在中央区域停留。Y5、Y7组小鼠均在5.0 h后恢复清醒状态。由图1 G可知,对于高年份酱香型白酒基酒(Y9、Y11),在灌胃后0.5~2.0 h,Y11组小鼠的总活动距离显著缩减至(8 011.63±775.29)cm(P<0.05),且该结果表明高年份酱香型白酒基酒进入醉酒状态的进程相对迟缓。由图1H可知,高年份酱香型白酒基酒(Y9、Y11)在实施灌胃后0.5~2.0 h,小鼠的行动轨迹呈现出有序性特征,在灌胃后5.0 h表现为较强的活跃度,恢复清醒状态较快。
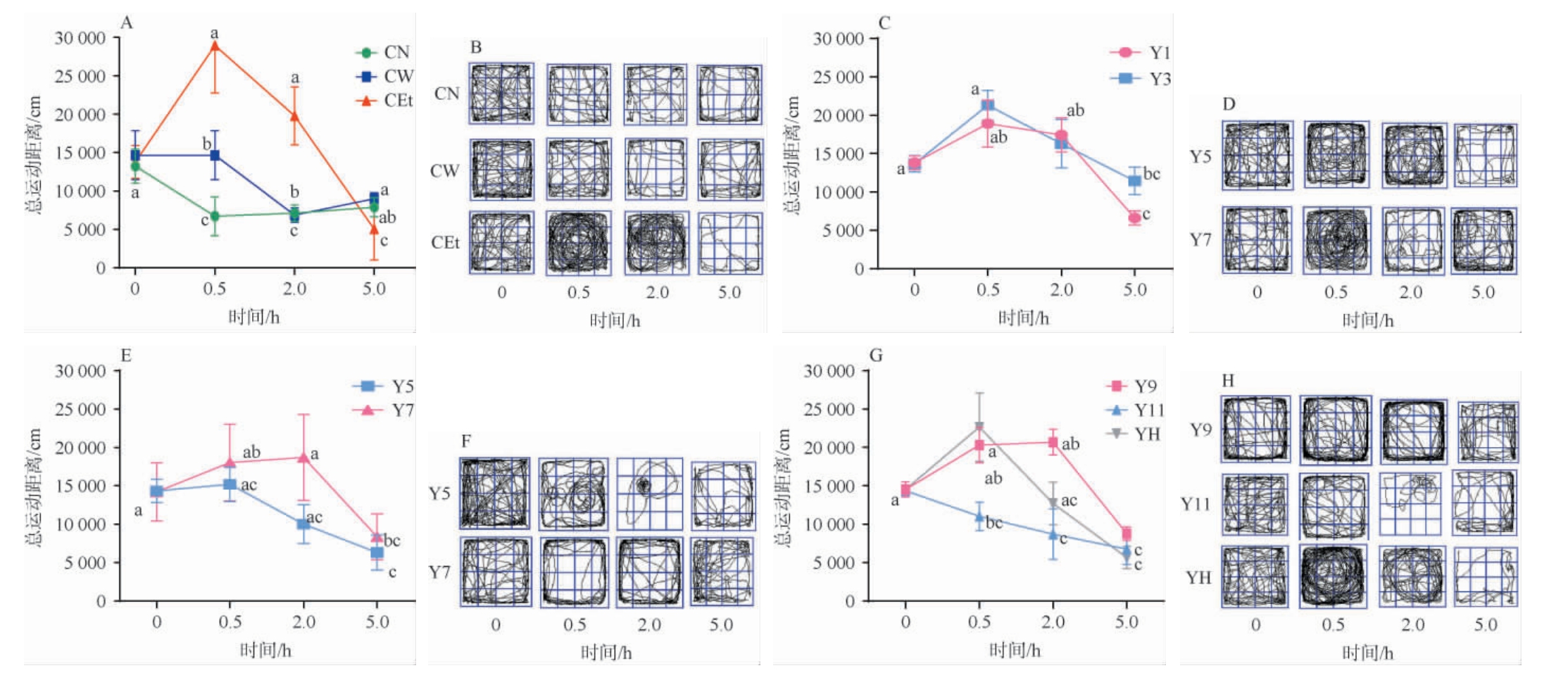
图1 不同年份酱香型白酒基酒灌胃后小鼠的总运动距离和运动路径
Fig.1 Total movement distance and movement paths of mice after gavage with base liquor of sauce-flavor Baijiu with different aging years
小写字母不同代表差异显著(P<0.05)。下同。
结果表明,酱香型白酒基酒灌胃后小鼠总活动路程显著下降(P<0.05),且不同年份基酒灌胃小鼠活动路径不同,Y1和Y3组小鼠灌胃后出现无序旋转;Y5、Y7组小鼠灌胃后表现出渐进抑制特征,但保持部分有序运动轨迹;Y9和Y11组小鼠灌胃后轨迹有序,表现“慢醉快醒”特性。
2.1.2 小鼠认知能力的动态变化
在小鼠旷场实验中,总运动路程通常可以拆分为中央运动路程和四周运动路程之和。中央停留时间、中央活动时间和爬壁站立时间是三个密切相关的行为指标,它们共同反映小鼠的焦虑水平、探索能力和运动兴奋性。为进一步揭示不同年份酱香型白酒基酒致醉时间的差异性,本研究追踪了小鼠灌胃前0 h和灌胃后0.5 h、2.0 h、5.0 h上述主要参数的动态变化规律,结果见图2。

图2 不同年份酱香型白酒基酒灌胃后小鼠认知能力的动态变化
Fig.2 Dynamic changes in cognitive ability of mice after gavage base liquor of sauce-flavor Baijiu with different aging years
(A)中央运动路程;(B)中央停留时间;(C)中央活动时间;(D)爬壁站立时间。
由图2A可知,Y1组在小鼠灌胃2.0 h时,中央运动路程最大[(2 424.742±585.24)cm];在小鼠灌胃2.0~5.0 h,中央运动路程呈下降趋势。Y3组在小鼠灌胃0~0.5 h,中央运动路程呈现上升趋势;在小鼠灌胃0.5 h时,中央运动路程最大(2 102.444±633.44)cm;在小鼠灌胃0.5~5.0 h,中央运动路程呈现下降趋势。Y5组在小鼠灌胃0~5.0h,中央运动路程呈现下降趋势。在小鼠灌胃0 h最高[(2 203.508±531.25)cm]。Y7组在小鼠灌胃0~2.0 h,中央运动路程呈先下降后上升的趋势,并在小鼠灌胃2.0 h时,中央运动路程最大[(1 199.265±593.209)cm];在小鼠灌胃2.0~5.0 h,中央运动路程有所下降。Y9组在小鼠灌胃0~0.5 h,中央运动路程呈现上升趋势;在小鼠灌胃0.5 h时,中央运动路程达到最大[(2 147.756±1 010.69)cm];在小鼠灌胃0.5~5.0 h,中央运动路程呈现下降趋势。Y11组在小鼠灌胃0~5.0 h,中央运动路程持续下降。在小鼠灌胃0 h时,中央运动路程最大[(2 331.452±448.041)cm];YH在小鼠灌胃0~0.5 h,中央运动路程呈现上升趋势;在小鼠灌胃0.5 h时,中央运动路程最大[(1 760.622±440.775)cm];在小鼠灌胃0.5~5.0 h,中央运动路程有所下降。
由图2B可知,Y1、Y3、Y5、Y9、Y11组在小鼠灌胃0~2.0 h,中央停留时间随之增加;Y1、Y3、Y5、Y7、Y9、Y11组在小鼠灌胃2.0 h时,中央停留时间最长,分别为(33.712±10.76)s、(52.064±30.90) s、(86.392±106.28) s、(18.296±6.54) s、(28.840±23.49)s、(87.792±116.65) s;Y7在小鼠灌胃0~2.0 h,中央停留时间呈先下降后上升的趋势;在小鼠灌胃2.0~5.0 h,中央停留时间有所下降。
由图2C可知,Y1、Y3、Y5、Y9、Y11在小鼠灌胃0~2.0 h,中央活动时间随之增加,Y7在小鼠灌胃0~2.0 h,中央活动时间呈先下降后上升的趋势;Y1、Y3、Y5、Y7、Y9、Y11在小鼠灌胃2.0 h时,中央活动时间最长,分别为(33.712±10.76)s、(52.064±30.90) s、(86.392±106.28) s、(17.704±5.35) s、(28.840±10.50)s、(87.792±52.17)s;在小鼠灌胃2.0~5.0 h,中央活动时间有所下降。 YH在小鼠灌胃0 h中央活动时间最长(17.496±2.22)s,随后几乎在中央区域停止活动。
由图2D可知,Y1组在小鼠灌胃0 h时,爬壁站立时间最长[(25.088±3.21)s];在小鼠灌胃0~2.0 h;爬壁站立时间随之下降;在小鼠灌胃2.0~5.0 h,爬壁站立时间随之上升。Y3组在0 h,爬壁站立时间最长[(22.200±2.50)s];在小鼠灌胃0~2.0 h;爬壁站立时间随之下降;在鼠灌胃2.0~5.0 h,爬壁站立时间呈上升趋势。 Y5组在0 h时,爬壁站立时间最长[(29.040±1.90)s],在小鼠灌胃0~2.0 h;爬壁站立时间随之下降;在在小鼠灌胃2.0~5.0 h,爬壁站立时间随之上升。Y7组在小鼠灌胃0 h时,爬壁站立时间最长[(17.704±11.95)s];在小鼠灌胃0~2.0 h,爬壁站立时间随之下降,在小鼠灌胃2.0~5.0 h,爬壁站立时间呈上升趋势。Y9组在小鼠灌胃0~0.5 h,爬壁站立时间呈上升趋势;在小鼠灌胃0.5~2.0 h,爬壁站立时间有所下降;在小鼠灌胃5 h时,爬壁站立时间最大[(7.816±4.47)s]。Y11组在小鼠灌胃0 h时,爬壁站立时间最大[(14.968±7.34)s];在小鼠灌胃0~2.0 h时,爬壁站立时间迅速下降;在小鼠灌胃2.0~5.0 h,爬壁站立时间上升。YH组爬壁站立时间与Y1和Y3变化趋势相似。
酱香型白酒基酒的年份与行为抑制效应呈负相关,即年份越长,致醉作用越缓慢。 低年份组(Y1、Y3)的快速抑制效应可能与乙醛和乙醇的协同作用有关[21];而中高年份组(Y5、Y7、Y9、Y11)的中央停留时间显著延长,其延迟醉酒效应可能源于酯类物质(如乙酸乙酯)含量增加导致的胃排空延缓[22]。 值得注意的是,贮存3年的基酒(Y3)在灌胃后5.0 h仍显著抑制小鼠运动能力,提示低年份酒中可能存在延长醉酒时间的特定成分[23]。 此外,所有组别的小鼠平均爬壁站立时间从0 h的(13.28±8.42)s逐渐降至5.0 h的(3.72±8.31)s,符合啮齿类动物对新环境的适应行为模式[24]。 综上,酒体年份可能通过调控活性成分的代谢动力学,差异化影响小鼠的焦虑水平、运动能力及醉酒进程:低年份酒表现为短时兴奋后快速抑制,而高年份酒则呈现长效舒缓特性。
2.2 不同年份酱香型白酒基酒灌胃小鼠神经递质差异表达
白酒作为传统固态发酵酒精饮料,其在酿造、陈酿过程均会产生复杂的风味化合物,其中酯类、吡嗪类等部分特征化合物(如乙酸乙酯、四甲基吡嗪)已被证实具有独特的神经活性[25]。 郭雪峰等[10]前期研究发现,不同香型、不同年份(不同质量)白酒对小鼠探索行为的抑制强度存在显著差异,且酱香型白酒基酒灌胃小鼠代谢产物含量2.0 h达到峰值。酱香型白酒基酒中丰富的复杂成分及其不同年份基酒是否对灌胃小鼠的神经递质代谢存在干预及其差异化表达,目前鲜见报道。为了更深入揭示不同年份基酒灌胃后对动物神经递质代谢的影响,本研究选取灌胃后2.0 h的乙醇血液浓度峰值窗口,采用UPLC-MS/MS靶向代谢组学技术分析不同贮存年份酱香型白酒基酒灌胃小鼠即时脑组织内关键神经递质(如γ-氨基丁酸、谷氨酸、多巴胺)的浓度变化规律及其差异化表达。本研究从小鼠脑组织中的神经递质选取了其中40种与不同年份酱香型白酒基酒样品显著相关的神经递质进行层次聚类分析,结果见图3。
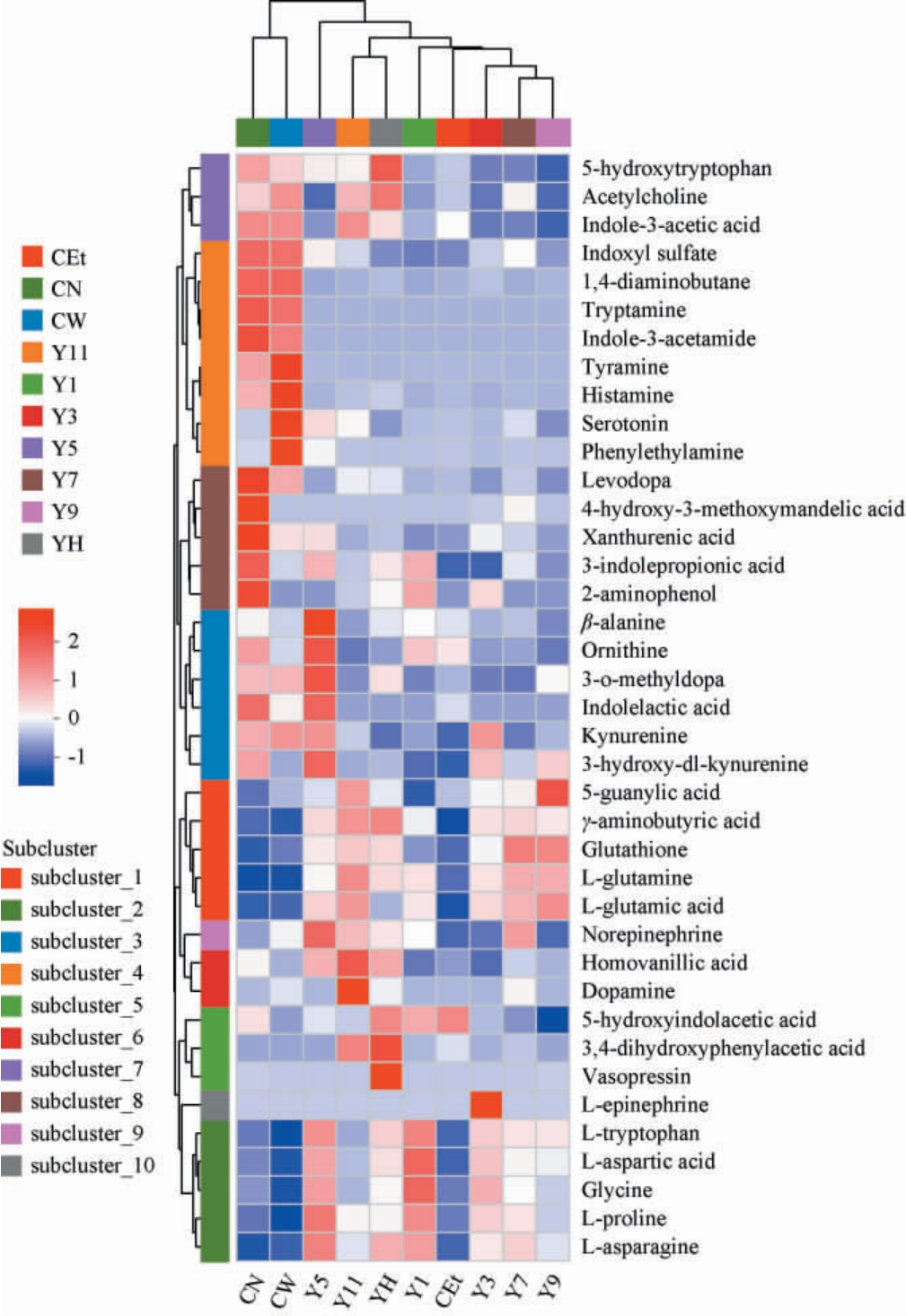
图3 不同年份酱香型白酒基酒与小鼠灌胃后神经递质浓度层次聚类分析热图
Fig.3 Heat map of hierarchical cluster analysis of base liquor of sauce-flavor Baijiu with different aging years and neurotransmitter concentration in mice after gavage
由图3可知,灌胃不同年份酱香型白酒基酒(Y1、Y3、Y5、Y7、Y9、Y11和YH)后的2 h内。酱香型白酒基酒组(Y1、Y3、Y5、Y7、Y9、Y11和YH)与对照组(CN、CW、CEt)在神经递质表达上存在显著差异(P<0.05),这与不同年份酱香型白酒基酒的内在化合物结构差异化及其对神经递质代谢的调控有关。 其中5-羟基色氨酸(5-HT)在YH组中表达含量较高,在其他样本组中表达较低,这反映出Y11导致血液代谢过程色氨酸代谢路径被特异性激活;5-羟基吲哚乙酸在Y1和Y3中表达较高,反映出这两个年份基酒灌胃后加快血液中5-HT代谢,导致5-羟基吲哚乙酸积累。
结果表明,不同年份的酱香型白酒基酒(Y1、Y3、Y5、Y7、Y9、Y11和YH)在神经递质表达上表现出差异,特别是在5-HT、5-羟基吲哚乙酸等特定神经递质的代谢水平上呈现显著分化;且YH的表达模式与其他样本组不同,其特征表现为乙酰胆碱通路的激活与吲哚类代谢物的平衡性,与WANG T等[26]研究结论类似。 本研究进一步选取含量较高的6种关键神经递质数据作箱线图,结果见图4。
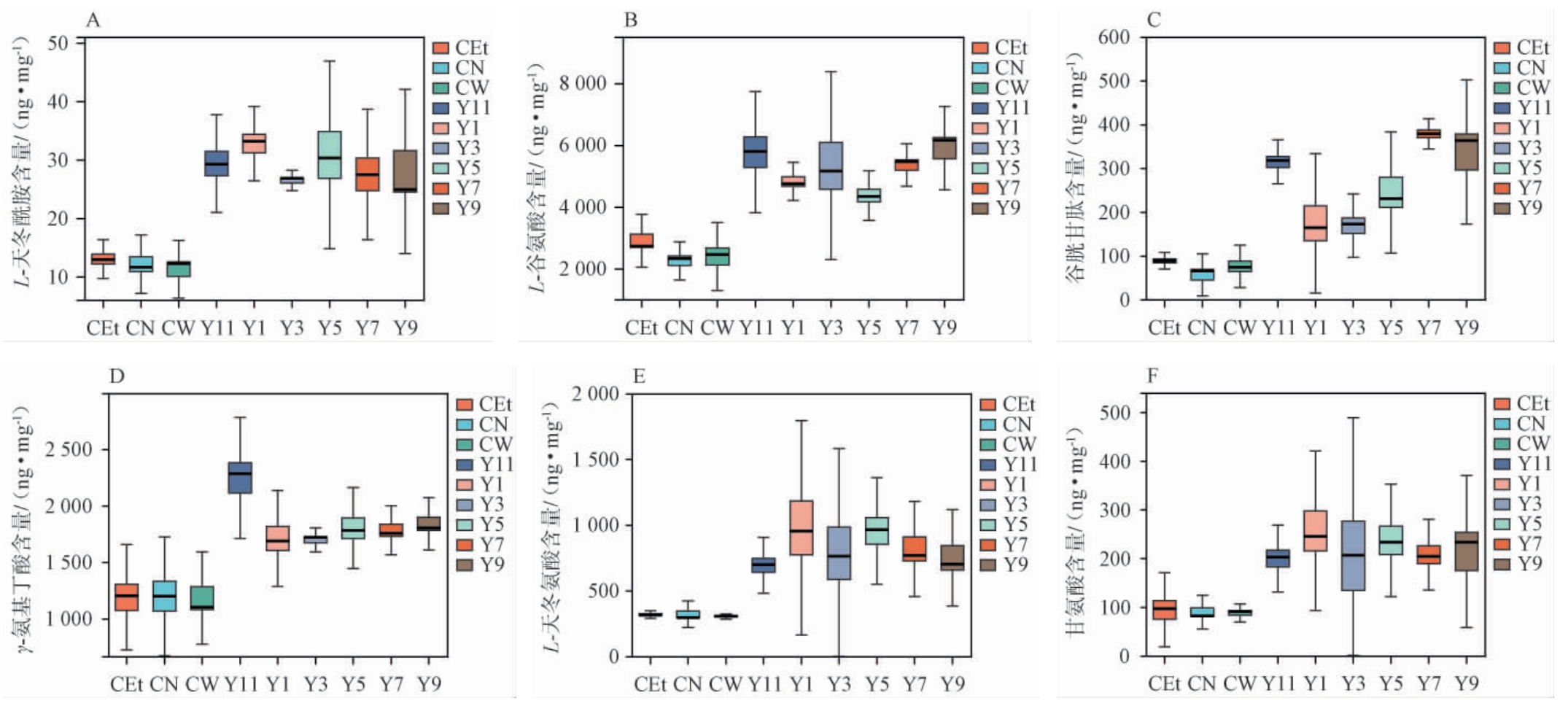
图4 不同年份酱香型白酒基酒灌胃小鼠2 h后的关键神经递质含量箱线图
Fig.4 Box plots of key neurotransmitter contents in mice after gavage with base liquor of sauce-flavor Baijiu with different aging years for 2 h
由图4可知,所有年份酱香型白酒基酒组(Y1、Y3、Y5、Y7、Y9、Y11)中L-天冬酰胺、L-谷氨酸、谷胱甘肽、γ-氨基丁酸(GABA)、L-天冬氨酸、甘氨酸等关键神经递质含量均大于对照组(CN、CW、CEt)。
由图4A可知,年份酱香型白酒基酒组中L-天冬酰胺含量顺序为Y1(33.85 ng/mg)>Y5(31.40 ng/mg)>Y11(29.42 ng/mg)>Y9(27.65 ng/mg)>Y7(27.50 ng/mg)>Y3(24.87 ng/mg)。由图4B可知,年份酱香型白酒基酒组中L-谷氨酸含量顺序为Y9(5 960.16 ng/mg)>Y11(5 746.22 ng/mg)>Y3(5 500.03 ng/mg)>Y7(5 247.62 ng/mg)>Y1(4 900.33 ng/mg)>Y5(4 401.38 ng/mg)。 由图4C可知,年份酱香型白酒基酒组中谷胱甘肽含量顺序为Y7(377.55 ng/mg)>Y9(344.09 ng/mg)>Y11(311.15 ng/mg)>Y5(259.48 ng/mg)>Y1(184.16 ng/mg)>Y3(165.10 ng/mg)。 由图4D可知,年份酱香型白酒基酒组中γ-氨基丁酸含量顺序为Y11(2208.30ng/mg)>Y9(1833.14ng/mg)>Y5(1 820.26 ng/mg)>Y7(1 809.86 ng/mg)>Y1(1 730.05 ng/mg)>Y3(1 676.29 ng/mg)。 由图4E可知,年份酱香型白酒基酒组中L-天冬氨酸含量顺序为Y1(992.10 ng/mg)>Y5(944.39 ng/mg)>Y7(865.19 ng/mg)>Y3(806.57 ng/mg)>Y11(688.37 ng/mg)>Y9(821.58ng/mg)。由图4F可知,年份酱香型白酒基酒组中甘氨酸含量顺序为Y1(267.93 ng/mg)>Y9(234.09 ng/mg)>Y5(240.16 ng/mg)>Y7(210.91 ng/mg)>Y3(204.15 ng/mg)>Y11(196.76 ng/mg)。
L-谷氨酸和γ-氨基丁酸常被用作评估神经元兴奋性的重要指标,以此判定动物的运动状态[27]。结果表明,在Y3和Y5组中L-谷氨酸呈高表达,这源于酱香型白酒基酒灌胃后其代谢过程中产生的氧化应激和神经炎症,能够激活某些信号通路,会间接刺激谷氨酸释放量增加[28],其含量变化与中枢神经系统疲劳的产生以及运动抑制密切相关[29]。低年份基酒可能因刺激性成分多而抑制L-天冬酰胺释放,而高年份基酒则通过调节GABA平衡、抑制谷氨酸过度释放并增加γ-氨基丁酸能神经传递(与抑制小鼠探索行为结果吻合)。潜在机制可能与基酒贮存陈酿过程中酯类、吡嗪类化合物累积调控神经递质受体或转运体功能有关[30]。Y7组中(高谷胱甘肽)可能反映脑内抗氧化需求增加,提示该年份白酒可能诱导轻度氧化应激,但GSH升高可能提供神经保护[31];Y1组中(高甘氨酸)可能影响N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体功能,调节学习记忆[32]。
结果表明,L-天冬酰胺、L-谷氨酸、谷胱甘肽、γ-氨基丁酸(GABA)、L-天冬氨酸、甘氨酸等关键神经递质含量均高于对照组,说明白酒摄入可能影响脑内氨基酸代谢及神经递质平衡。兴奋性神经递质L-谷氨酸在Y9组中最高,L-天冬氨酸、甘氨酸、L-天冬酰胺在Y1组中最高,抑制性神经递质GABA在Y11组中最高。谷胱甘肽在Y7组中最高。高年份白酒(如Y9、Y11)对神经递质的影响更显著,具有潜在镇静作用。
3 结论
本研究通过灌胃不同年份酱香型白酒基酒的小鼠模型,结合行为学测试和神经递质检测,系统研究了其对小鼠神经行为表型及脑组织神经递质代谢的影响。小鼠行为学测试结果表明,酱香型白酒基酒灌胃后小鼠总活动路程显著下降(P<0.05),且不同年份基酒灌胃小鼠活动路径不同,Y1和Y3小鼠灌胃后出现无序旋转;Y5、Y7小鼠灌胃后表现出渐进抑制特征,但保持部分有序运动轨迹;Y9和Y11小鼠灌胃后轨迹有序,表现“慢醉快醒”特性。 小鼠神经递质水平检测结果表明,Y1、Y3、Y5、Y7、Y9、Y11组中L-天冬酰胺、L-谷氨酸、谷胱甘肽、γ-氨基丁酸(GABA)、L-天冬氨酸、甘氨酸等关键神经递质含量均高于对照组,其中兴奋性神经递质L-谷氨酸含量在Y9组中最高,抑制性神经递质GABA含量在Y11组中最高,表明高年份基酒可能通过调节GABA、L-谷氨酸等氨基酸代谢,优化神经递质稳态,降低乙醇带来的负面效应和提升饮后舒适度。 本研究为酱香型白酒基酒品质评价及其对神经行为和递质代谢的影响机制提供了数据支撑,揭示了酱香型白酒基酒贮存时间影响神经递质代谢的规律,为白酒品质和饮用舒适度研究提供了新的科学依据。
[1]唐平,山其木格,王丽,等.白酒风味化学研究方法及酱香型白酒风味化学研究进展[J].食品科学,2020,41(17):315-324.
[2]骆红波,张健,孙优兰,等.白酒风味研究技术及酱香型白酒风味研究进展[J].酿酒科技,2024(7):123-130.
[3]许忠平,郭红莉,张娇娇,等.不同工艺酱香型白酒风味物质特征分析[J].食品工业科技,2025,46(5):209-217.
[4]韩英,刘荣,郭黎媛,等.不同贮存时间清香型白酒饮后注意功能与舒适度差异性[J].食品与发酵工业,2025,51(10):63-69.
[5]胡智慧,陈方,郭雪峰,等.白酒中健康因子2,3,5,6-四甲基吡嗪形成机理的研究进展[J].中国酿造,2024,43(1):27-33.
[6]卢君,皇甫洁,刘雅,等.酱香型白酒对小鼠慢性酒精性肝损伤的影响效应[J].食品与发酵工业,2022,48(16):237-244.
[7]彭斌.白酒醉度检测模型参数改进及微量成分低醉机理研究[D].广州:华南理工大学,2020.
[8]陈江权,罗义,冉思婷,等.不同贮藏年限对酱香型大回酒轮次基酒风味物质的影响分析[J].酿酒科技,2025(6):55-61.
[9]马宇.基于风味组学策略研究酱香型白酒关键成分及其呈香呈味特性[D].贵阳:贵州大学,2019.
[10]郭雪峰.基于多组学策略对不同香型白酒醉酒度及其致醉机制的研究[D].贵阳:贵州大学,2022.
[11]方程,饶家权,邹永芳,等.不同贮存时间白酒摄入对小鼠生物学功能的影响研究[J].食品与发酵工业,2025,64(7):29-35.
[12]韩英,刘荣,郭黎媛,等.不同贮存时间清香型白酒饮后注意功能与舒适度差异性[J].食品与发酵工业,2025,51(10):63-69.
[13]WU Z,TIAN X,HE S,et al.Evaluation of intoxicating effects of liquor products on drunken mice[J].Medchemcomm,2017,8(1):122-129.
[14]时伟,郭举,夏堡,等.基于非靶向代谢组学分析不同年份酱香型白酒二轮次基酒挥发性风味物质差异[J].中国酿造,2025,44(2):95-100.
[15]赵永智,张亦文,罗燕琴,等.基于行为实验的睡眠干扰应激诱发焦虑抑郁共患动物模型的建立[J].中国实验动物学报,2025,33(5):695-703.
[16]格绒泽仁.豉香型白酒饮后舒适感评价模型的建立及相关研究[D].雅安:四川农业大学,2019.
[17]郑天歌,贾靖仪,文睿婷,等.开发梁氏情境应激箱作为新型焦虑相关小鼠行为学测试模型[J].中国药理学与毒理学杂志,2023,37(7):531.
[18]郭松波.酱香型白酒风味和饮用品质特征的研究[D].天津:天津科技大学,2021.
[19]袁斌.Ghrelin对抑郁小鼠的治疗作用及行为学研究[D].济宁:济宁医学院,2021.
[20]方颂平,高纬光,冯盼盼,等.白酒中主要风味成分体外对乙醇代谢关键酶活性的影响及其应用研究[J/OL].食品与发酵工业,1-11[2025-08-01].
[21]秦丹,段佳文,李有明,等.白酒老熟过程中风味成分的变化及人工催陈技术的研究进展[J].食品科学,2021,42(23):260-267.
[22]王川南,吴天祥,雷露.不同年份酱香型白酒对小鼠抗疲劳及肝损伤试验的研究[J].酿酒科技,2019(10):36-40.
[23]胥佳,何朝玖,马浩,等.不同贮存年份的五粮浓香型白酒挥发性风味物质对比分析[J].食品与发酵科技,2023,59(3):23-29.
[24]黄璐.mTORC2信号通路对可卡因诱导的纹状体区神经元结构重塑的调控[D].广州:南方医科大学,2017.
[25]凌与听.不同陈酿时间浓香型皖北名酒挥发性风味特征解析[D].无锡:江南大学,2022.
[26]WANG T,FU X,CHEN Q,et al.Arachidonic acid metabolism and kidney inflammation[J].Int J Mol Sci,2019:20(15):3683.
[27]周洪莉,张祚,周吉银.GABA能神经系统与学习记忆的研究进展[J].国际精神病学杂志,2019,46(6):961-963,970.
[28]ALIKHANI V, MOHEBBATI R, SHAFEI M N.Glutamate receptors within the lateral periaqueductal gray(lPAG):Effects on blood pressure and heart rate in basic and hypotensive hemorrhagic rats[J].Irani J Basic Med Sci,2025,28(4):486-492.
[29]ZUO A, ZHENG Q, ZHAO D, et al.Glutamate boosts IMP production in triploid crucian carp muscle via phosphoribosyl pyrophosphate amido transferase and ATP pathways[J].Aquaculture,2025,603:11.
[30]GILBERT D L, KARKANIAS G B, ATKINSON S D, et al.Effect of ecopipam,a selective dopamine-1 receptor antagonist,on tic characteristics as assessed by the YGTSS:results from the phase 2b randomized,double-blind, placebo-controlled clinical trial in tourette syndrome[J].Ann Neurol,2025,96:S62-S63.
[31]赵源.谷胱甘肽代谢异常引发铁死亡在卒中后抑郁中的作用机制研究[D].重庆:中国人民解放军陆军军医大学,2024.
[32]王俊.双酚A对大鼠脑组织中甘氨酸代谢及转运影响的机制研究[D].沈阳:沈阳医学院,2024.