盐渍菜是我国传统发酵食品,泡菜作为盐渍菜后续发展的结果,是蔬菜发酵加工的主要产品之一。 国内很多地区均有制作泡菜的习惯,以四川泡菜最为著名,四川泡菜也因其突出的风味被誉为“川菜之骨”。四川泡菜主要是以萝卜等新鲜蔬菜为原材料,经中低浓度食盐水(4%~8%左右)浸渍发酵而成。 泡菜发酵过程产生一系列复杂的理化和生物反应,赋予了泡菜独特风味与口感,从而广受消费者喜爱[1]。然而,泡菜多采用自然发酵方式而使品质难以调控,发酵过程中易受基质、盐度、温度及原料等因素影响,使得微生物群落具有高度的复杂性及多样性[2]。其中,温度是影响微生物代谢活动最重要的因素,发酵温度直接影响着泡菜中微生物的菌群结构,进而影响泡菜的品质[3]。乳酸菌作为泡菜发酵过程的主导微生物,在一定温度范围内发酵温度越高,乳酸菌生长代谢速度越快,泡菜成熟时间越短,乳酸菌对泡菜品质影响也越明显[4]。 研究表明,4 ℃发酵泡菜在35 d时达到最佳成熟时间,而20 ℃发酵泡菜只需要2~3 d便可成熟,且20 ℃发酵泡菜能产生更多风味成分[5-6]。在酸肉发酵中,升高温度能加快发酵速度缩短酸肉成熟时间,相比于一直低温发酵(10 ℃和15 ℃),高温发酵酸肉有更高的安全性[7]。 发酵温度变化还可能会影响泡菜质构、色差等感官品质,低温发酵有利于维持泡菜脆嫩的口感和鲜亮色泽,减少泡菜褐变,而高温发酵可能会使泡菜组织软化,色泽褐变甚至发黑[8]。此外,温度也与发酵食品的安全品质有关[9],温度通过影响微生物新陈代谢速度来影响亚硝酸盐的降解[10],高温加速微生物代谢使亚硝峰较早出现,低温对亚硝酸盐积累和亚硝峰有抑制作用[11]。 35 ℃发酵泡菜其亚硝酸盐在发酵2 d后就基本完成降解,而在10 ℃发酵条件下则需要20 d。温度变化会给泡菜品质造成一定影响,增加了泡菜工业化的难度,因此控制温度是把控泡菜品质的重要措施之一。此外,低盐泡菜发酵成熟后通常不进行灭菌处理而直接销售,使泡菜中仍然保持较高的乳酸菌活性,但乳酸菌等微生物可能会在后续不同贮藏条件或运输过程中持续发酵,这可能使泡菜过度发酵缩短保质期。 若运输环境条件不适宜或改变较大不利于维持泡菜的品质,使得泡菜产生异味、质构软烂及色泽变差等,甚至会影响食用安全[4]。 故可用变温发酵来模拟泡菜贮藏过程,探究持续发酵过程中温度变化对于泡菜品质影响,为解决泡菜在实际生产销售过程中遇到的问题提供一定的研究基础。
目前,变温发酵研究主要集中于红茶[12-13]、烟草[14-15]等领域,对于蔬菜变温发酵研究鲜有报道。本研究采用萝卜为原材料制备泡菜,以25 ℃恒温发酵18 d为对照,采用25 ℃发酵3 d,成熟后改变温度为5 ℃继续发酵15 d的方式模拟泡菜贮藏过程中温度变化,探究变温发酵对萝卜泡菜理化、微生物指标、质构及颜色参数的影响,为提高泡菜发酵效率、品质控制等提供参考依据。
1 材料与方法
1.1 材料与试剂
新鲜红皮萝卜:成都锦江区某果蔬市场;泡菜老母水:四川老坛子食品有限公司;食盐:市售。
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):广州和为医药科技有限公司;氢氧化钠标准液、H2SO4(均为分析纯):上海阿拉丁生化科技有限公司;聚酯真空袋(25 cm×17 cm):成都东俊佳名生物科技有限公司;柠檬酸、苹果酸、琥珀酸、乳酸、乙酸(纯度均>99.9%):成都科隆试剂有限公司。
MRS培养基、孟加拉红琼脂培养基、平板计数琼脂(plate count agar,PCA)培养基:海博生物技术有限公司。
1.2 仪器与设备
S210SevenCompact pH计:梅特勒-托利多仪器有限公司;Synergy HTX多功能酶标仪:美国博腾仪器有限公司;DS-100色差仪:杭州彩谱科技有限公司;TA.XT Plus C质构仪:英国stable micro system公司;LRH-150生化培养箱:上海一恒科学仪器有限公司;Agilent 1260高效液相色谱仪(high performance liquid chromatography,HPLC):安捷伦科技有限公司;HPX-87H色谱柱(300 mm×7.8 mm,9 μm):上海希言科学仪器有限公司;聚合酶链式反应(polymerase chain reaction,PCR)仪:赛默飞世尔科技(中国)有限公司;DNeasy PowerSoil Pro Kit脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:德国Qiagen公司;Nextseq 2000测序仪:美国Illumina公司;5424R高速台式冷冻离心机:德国Eppendorf公司。
1.3 方法
1.3.1 萝卜泡菜的制备
将新鲜红皮萝卜洗净晾干,切成1 cm×1 cm×5 cm的条状,取120 g萝卜装入25 cm×17 cm的发酵袋中,按照萝卜与老母水料液比1∶2(g∶mL)添加老母水并封口。由于实验过程中恒温发酵18 d后继续发酵会使萝卜泡菜感官品质劣变而不能食用,因此确定发酵时间为18 d。恒温发酵(H组)指萝卜全程在25 ℃恒温培养箱中发酵18 d,变温发酵(B组)指萝卜先在25 ℃发酵3 d后,随后转移至5 ℃恒温培养箱中继续发酵15 d。
1.3.2 萝卜菜样及水样制备
菜样制备:发酵萝卜样品处理参考ZHAO N等[16]的方法进行。 将发酵萝卜打浆,称取10 g,加入蒸馏水30 mL后移液至100 mL容量瓶中,超声提取20 min后定容并过滤,取上清液得到萝卜泡菜提取液。
水样制备:从发酵袋中取50 mL发酵液,得到测定水样。
1.3.3 质构测定
采用质构仪对萝卜泡菜在发酵0、3 d、6 d、8 d、10 d、13 d、18 d的硬度和咀嚼性进行测定。 质构仪经1 kg标准砝码校正,探头选用P36,质地剖面分析(texture profile analysis,TPA)模式下,测前、测中、测后速度均为1.5 mm/s,压缩形变50%,间隔时间为5 s,固定测试距离为15 mm。测定12次选取平均值。
1.3.4 基本理化指标测定
pH:采用pH计测定;总酸含量:采用酸碱中和滴定法进行测定[17];颜色参数:采用色差仪进行测定[18],其中L*值(明亮度)表示颜色的亮度,a*值(红绿色度)表示颜色在红绿轴上的位置,正值偏向红色,负值偏向绿色,b*值(黄蓝色度)表示颜色在黄蓝轴上的位置,正值偏向黄色,负值偏向蓝色;还原糖含量:采用DNS法测定[19]。
1.3.5 微生物测定
取1.3.2中的红皮萝卜泡菜提取液和发酵液,分别参照GB 4789.2—2022《食品微生物学检验菌落总数测定》、GB 4789.35—2023《食品微生物学检验乳酸菌检验》及GB 4789.15—2016 《食品微生物学检验霉菌和酵母计数》,对其中的菌落总数、乳酸菌及酵母菌活菌数的动态变化进行测定。
1.3.6 酵母菌群结构变化分析
将发酵第0、3 d、6 d、8 d、10 d、13 d、18 d收集的恒温及变温发酵萝卜泡菜,用无菌塑料袋收集并存储在-80 ℃,采用DNA抽提试剂盒对萝卜泡菜样本中微生物的基因组DNA进行提取,将收集到的菌体送至上海美吉生物医药科技有限公司测定。 采用通用引物ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')及ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')对真菌ITS基因的ITS1区进行PCR扩增,用于泡菜中真菌微生物多样性的鉴定分析。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s、50 ℃退火30 s、72 ℃延伸45,共30个循环;72 ℃稳定延伸10 min。 将扩增产物进行回收及纯化,使用Nextseq 2000平台进行测序及处理分析。
1.3.7 有机酸测定
参照ZHAO N等[16]的方法,样品提取液通过离心机10 000 r/min常温离心10 min后,取上清液过0.22 μm滤膜,用于后续高效液相色谱分析。HPLC条件:Aminex HPX-87H色谱柱(300 mm×7.8 mm,9 μm),柱温35 ℃,进样体积5 μL,流速0.6 mL/min,紫外吸收检测波长为215 nm,流动相为0.005 mol/L H2SO4水溶液。 以保留时间定性,外标法定量。
1.3.8 数据处理
采用SPSS 24.0单因素方差分析及Duncan多重比较进行数据处理与差异分析(P<0.05表示具有统计学差异),采用Origin 2021制图。
2 结果与分析
2.1 恒温与变温发酵过程中萝卜泡基本理化指标的变化
pH和总酸可作为萝卜泡菜发酵过程的中成熟度的参考指标,当总酸含量>0.6 g/100 g时萝卜过酸,而总酸含量为0.4 g/100 g左右,或pH<4时,认为泡菜成熟且风味较佳[21-22]。恒温与变温发酵过程中萝卜泡菜pH、总酸及还原糖含量变化见图1。 由图1a可得,发酵0~3 d,各组样品pH均快速下降,第3天时萝卜菜样中pH为3.65,表明此时泡菜已经基本成熟。 发酵3~18 d,各组样品pH变化速度趋缓,可能是乳酸菌在低pH环境下产酸代谢受抑制,发酵体系中缓冲物质如有机酸等也会导致pH变化趋于稳定[23]。 但变温组和恒温组变化趋势出现明显不同,变温组发酵萝卜pH基本稳定在3.63,而恒温组一直呈缓慢下降的趋势,18d时pH降至3.35,从发酵第8天开始两组样品pH存在显著差异(P<0.05)。这可能是由于恒温发酵温度相对较高促使乳酸菌过度产酸。综上, 恒温发酵持续降低的pH可能会破坏发酵体系内微生物菌落的平衡[24],而变温发酵泡菜能够很好的维持发酵环境的pH,避免某些耐酸酵母如酵母属(Saccharomyces)在低pH过度生长使泡菜产生异味和导致泡菜胀气等,更有利于保持泡菜良好的风味。
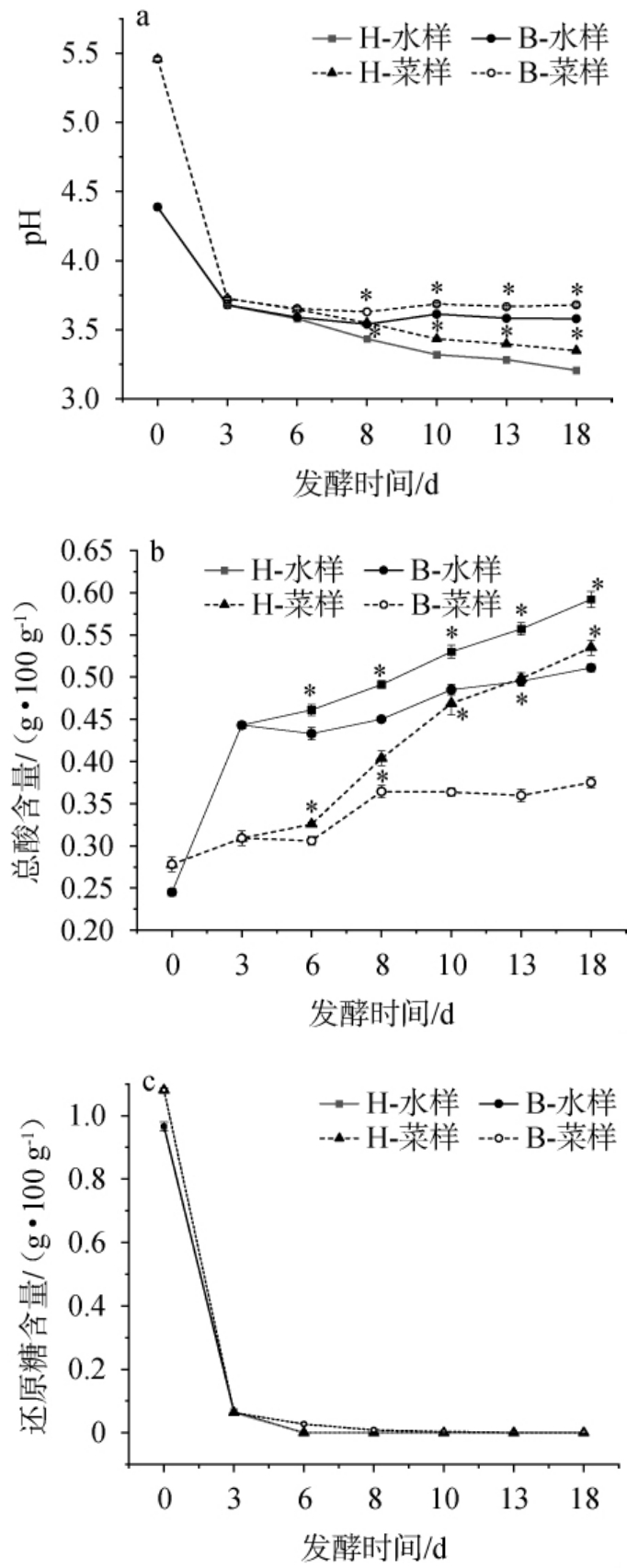
图1 恒温和变温发酵过程中萝卜泡菜的pH(a)、总酸(b)及还原糖(c)含量变化
Fig.1 Changes in pH (a), total acid (b) and reducing sugar (c)contents of radish Paocai under constant- and variabletemperature fermentation process
“*”表示恒温及变温发酵水样、菜样对应指标呈显著差异(P<0.05)。下同。
由图1b可得,发酵0~18 d,除变温组的萝卜泡菜,其他3组样品总酸含量整体呈上升趋势,而变温发酵的萝卜泡菜从8 d之后总酸含量保持相对稳定。 从第6天开始,恒温、变温发酵萝卜泡菜总酸含量具有显著差异(P<0.05),发酵第18天时含量分别为0.54 g/100 g、0.37 g/100 g,表明恒温发酵萝卜泡菜口感可能过酸。综上,先25 ℃后5 ℃的变温发酵模式可使萝卜泡菜快速发酵成熟,缩短发酵周期,同时在后续贮藏发酵过程中保持pH稳定,抑制总酸含量快速上升而避免萝卜泡菜过酸降低泡菜风味、品质及安全性。
还原糖是微生物生长优先利用的碳源[25],糖类经过一系列反应可使泡菜增香。由图1c可知,发酵0~3 d,各组样品中还原糖含量快速下降,第3天时各组样品中还原糖含量均趋近于0,无显著差异(P>0.05)。 泡菜中还原糖几乎耗尽,可认为泡菜基本成熟。
2.2 恒温与变温发酵过程中萝卜泡菜微生物的变化
乳酸菌是发酵萝卜中的优势菌群,在萝卜的口感、风味和贮藏中发挥重要作用,其数量变化可一定程度反映萝卜泡菜发酵的程度[26]。恒温与变温发酵过程中萝卜泡菜微生物的变化见图2。由图2a~c可知,微生物数量在发酵过程中均呈现先增加后下降的趋势,且均在第3天达到峰值。这是由于发酵3 d时泡菜已经成熟,此时萝卜中营养物质糖类代谢反应已基本完成,导致可利用碳源减少使得微生物数量不断下降。
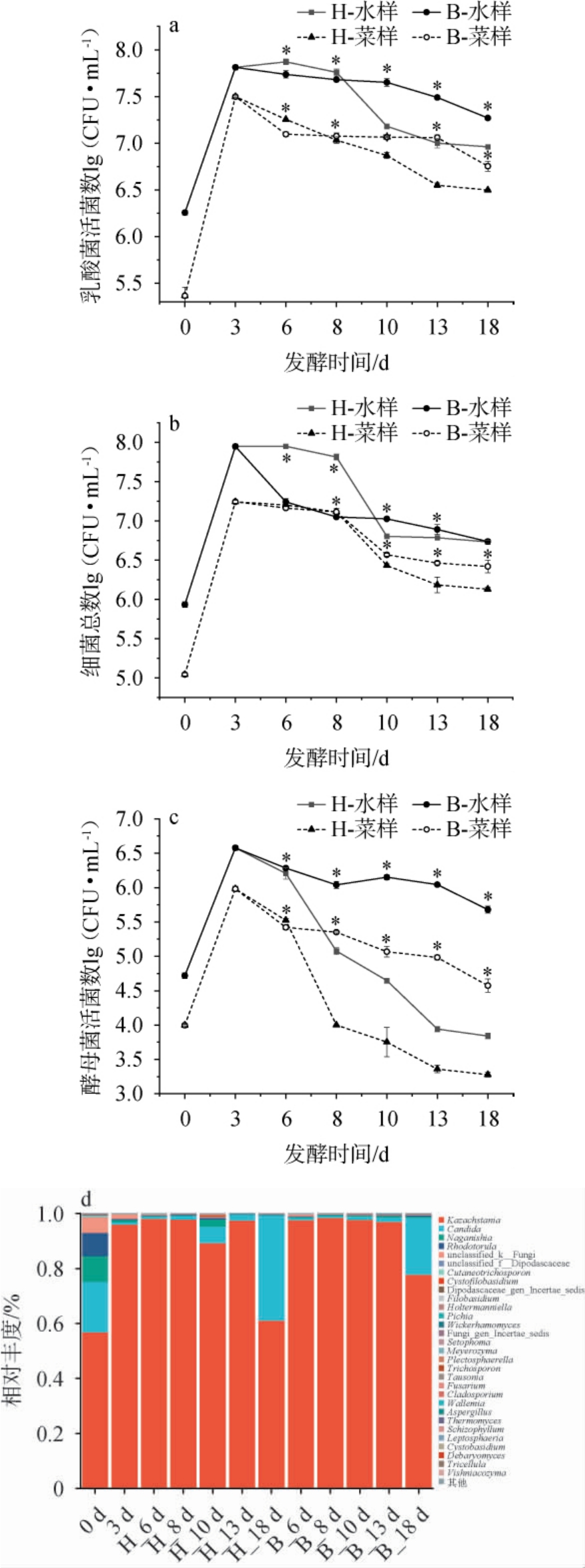
图2 恒温和变温发酵过程中萝卜泡菜的乳酸菌数(a)、菌落总数(b)、酵母菌数(c)及属水平酵母菌菌群结构(d)变化
Fig.2 Changes in lactic acid bacteria counts (a), total colony counts(b), yeast counts (c) and yeast community structure at genus level (d) in radish Paocai under constant- and variable-temperature fermentation process
由图2a可知,恒温组菜样乳酸菌数从第8天开始显著低于变温组(P<0.05),第18天恒温组菜样乳酸菌数量为6.29 lg(CFU/mL),变温组菜样乳酸菌数在8~13 d保持动态平衡随后在18 d下降至6.75 lg(CFU/mL)。说明低温环境有利于保持发酵过程中的乳酸菌数,同时抑制乳酸菌生长代谢避免泡菜过酸。
由图2b可知,菌落总数的变化趋势和乳酸菌基本一致,发酵第18天时,恒温与变温组萝卜菜样菌落总数分别为6.13 lg(CFU/mL)和6.42 lg(CFU/mL)。但恒温与变温发酵中水样的细菌总数无显著差异(P>0.05),均为6.73lg(CFU/mL)左右,表明改变发酵方式对泡菜水样中的菌落总数变化影响较小。
酵母菌可增加泡菜的醇类、酯类等挥发性风味的含量,乙醇可与乳酸菌产生的乳酸发生酯化反应促进泡菜风味形成,提高萝卜泡菜的复合香气,并防止乳酸堆积造成乳酸菌生长减缓[27]。由图2c可知,恒温组水样酵母菌数从发酵第6天开始显著低于变温组(P<0.05),发酵第18天时,变温发酵萝卜泡菜酵母菌数量[4.57 lg(CFU/mL)]显著高于恒温发酵组[3.27 lg(CFU/mL)](P<0.05)。可能是由于恒温组发酵环境pH较低对酵母菌生长抑制作用较强(图1b)。因此,变温发酵较恒温能更好的维持泡菜发酵体系的酵母菌数量,从而赋予发酵蔬菜更多的花果香[28]。由图2d可知,萝卜泡菜发酵过程中酵母菌菌群结构变化与李恒等[29]的研究一致,恒温和变温发酵萝卜泡菜中相对丰度较高的均为哈萨克斯坦酵母属(Kazakhstania),发酵18 d时相对丰度分别为60.9%和77.7%。 两组萝卜泡菜中白色念珠菌属(Candida)相对丰度在发酵第10天时开始有显著差异(P<0.05),第18天时,恒温组白色念珠菌属(Candida)相对丰度为38.4%,而变温组仅有20.5%。 蔬菜发酵过程中白色念珠菌属(Candida)可作为污染菌使泡菜形成白色生物膜降低泡菜感官品质,甚至会影响风味和加速萝卜泡菜软烂腐败[30-32]。 综上,变温发酵方式既可以在发酵前期促进萝卜泡菜挥发性风味的形成,同时在后期5 ℃发酵过程中保留乳酸菌和酵母菌的活性并减少泡菜腐败生花变质的风险。
2.3 恒温与变温发酵过程中萝卜泡菜有机酸含量的变化
对恒温和变温发酵而成的萝卜泡菜进行有机酸分析,结果见表1及图3。由表1及图3可知,在两种不同发酵模式下萝卜泡菜中共检测出5种有机酸,分别为柠檬酸、苹果酸、琥珀酸、乳酸和乙酸。其中柠檬酸、苹果酸、琥珀酸含量均较低,约占有机酸总含量的5.73%。 可能是在发酵过程中被相应微生物酶催化成乳酸[33]。不同的有机酸具有不同的酸味特征,多种有机酸共同作用是形成泡菜酸香可口的重要原因。
表1 恒温和变温发酵萝卜泡菜的有机酸种类及含量变化
Table 1 Changes in type and content of organic acids of radish Paocai under constant- and variable-temperature fermentation
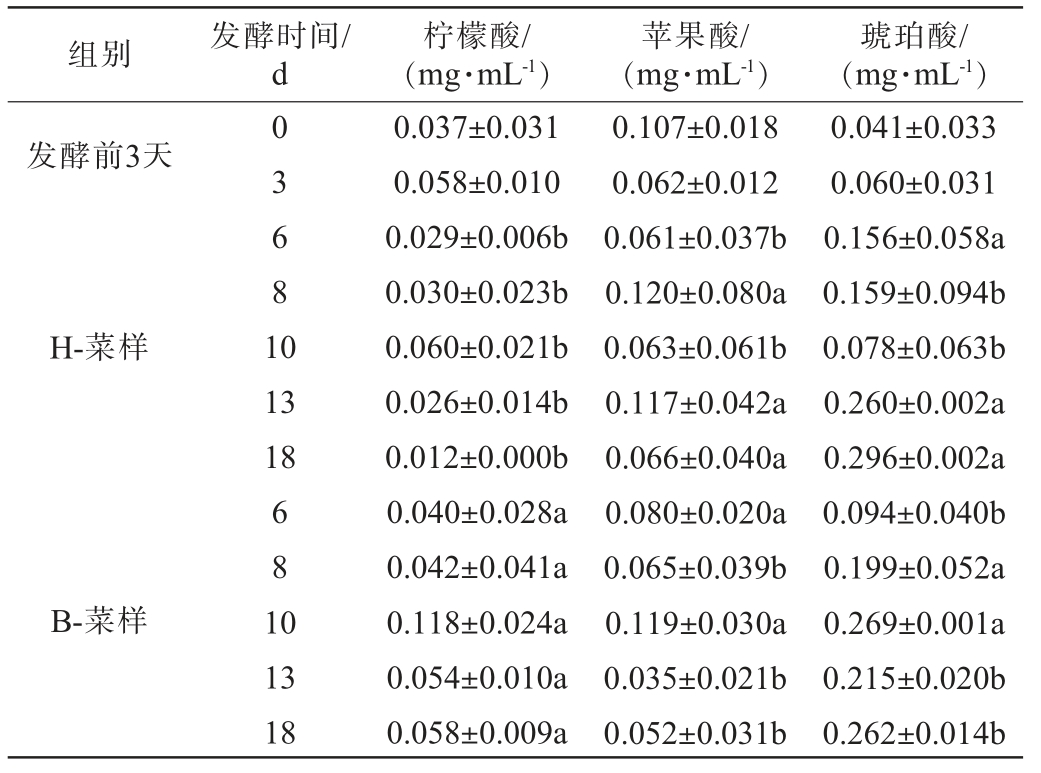
注:同一列不同小写字母表示差异显著(P<0.05)。
组别发酵时间/d柠檬酸/(mg·mL-1)苹果酸/(mg·mL-1)琥珀酸/(mg·mL-1)发酵前3天H-菜样03681 0 13 18 B-菜样681 0 13 18 0.037±0.031 0.058±0.010 0.029±0.006b 0.030±0.023b 0.060±0.021b 0.026±0.014b 0.012±0.000b 0.040±0.028a 0.042±0.041a 0.118±0.024a 0.054±0.010a 0.058±0.009a 0.107±0.018 0.062±0.012 0.061±0.037b 0.120±0.080a 0.063±0.061b 0.117±0.042a 0.066±0.040a 0.080±0.020a 0.065±0.039b 0.119±0.030a 0.035±0.021b 0.052±0.031b 0.041±0.033 0.060±0.031 0.156±0.058a 0.159±0.094b 0.078±0.063b 0.260±0.002a 0.296±0.002a 0.094±0.040b 0.199±0.052a 0.269±0.001a 0.215±0.020b 0.262±0.014b
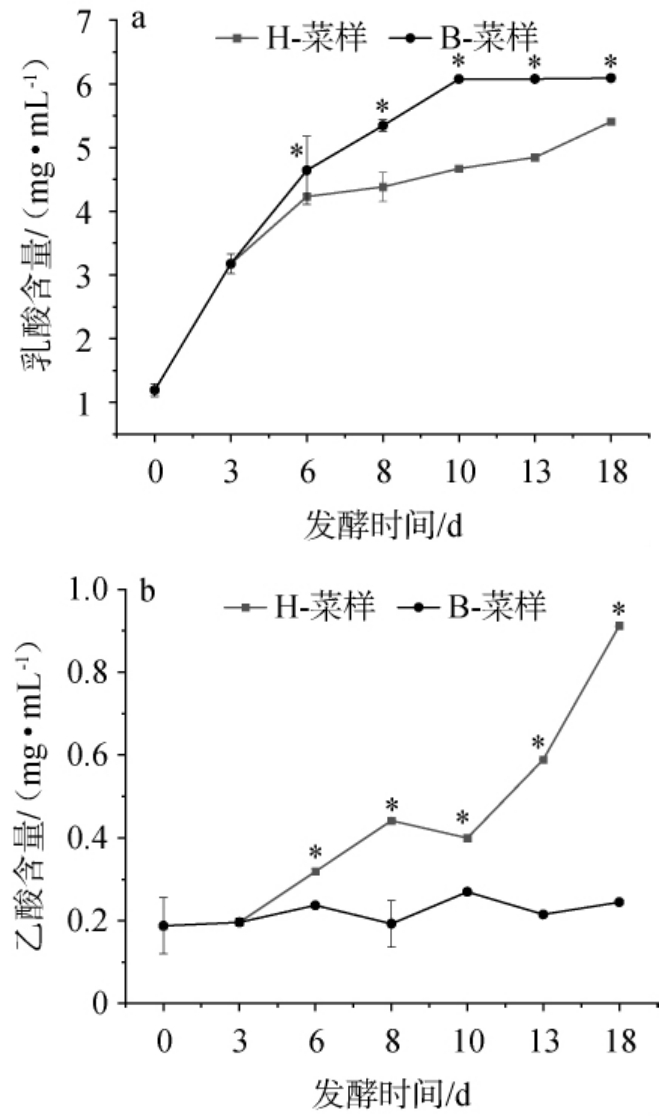
图3 恒温和变温发酵萝卜泡菜乳酸(a)、乙酸(b)的含量变化
Fig.3 Changes in lactic acid (a) and acetic acid (b) contents of radish Paocai under constant- and variable-temperature fermentation
乳酸和乙酸是萝卜泡菜发酵过程中的2种主要有机酸[34],乳酸菌代谢产生的乳酸能为泡菜提供柔和酸味[35]。由图3可知,随着发酵时间的增加,各组样品的乳酸含量不断上升,其中变温组萝卜泡菜乳酸含量从第6天开始显著高于恒温组(P<0.05),在发酵18 d时恒温与变温发酵萝卜泡菜的乳酸含量分别为5.41 mg/mL和6.09 mg/mL。变温组萝卜泡菜0~10 d乳酸含量增长较快,第10天后增长趋势变缓,可能是乳酸含量过高对产乳酸通路产生负反馈调节,亦或是乳酸作为前体物质参与酯化反应生成酯类芳香物质转化为其他次级代谢产物[36-37]。而恒温发酵从第6天开始至18 d乳酸含量增长变缓,可能是在25 ℃恒温发酵下萝卜中乳酸菌数量下降较快引起。乙酸具有刺激性的酸味,整个发酵过程中,恒温发酵萝卜泡菜的乙酸含量呈上升趋势,而变温发酵组趋于平缓。 发酵18 d时,恒温发酵萝卜泡菜的乙酸含量显著高于变温组(P<0.05),分别为0.912 mg/mL和0.245 mg/mL,恒温组是变温组的3.72倍,过高的乙酸含量可能会破坏萝卜泡菜中有机酸的最佳比例,从而降低萝卜泡菜的柔和酸感,增加刺激的尖酸口感[38]。因此,较长时间恒温发酵可能不利于泡菜柔和爽快的酸味形成,还可能降低泡菜的口感品质,而变温发酵模式更有利于促进泡菜形成丰富且适宜的酸感特征。
2.4 恒温与变温发酵过程中萝卜泡菜质构及颜色参数的变化
2.4.1 质构变化由图4可知,恒温和变温发酵的萝卜泡菜硬度及咀嚼性均随着发酵时间增加呈下降趋势,且从第6天开始,恒温发酵萝卜泡菜的硬度和咀嚼性显著低于变温发酵(P<0.05)。可能是由于较高温度下微生物代谢速率较大,产生较多酸性物质加速了果胶的分解和质构软化[39]。发酵第18天时,变温和恒温组萝卜泡菜的硬度分别为(5 265±359) N和(3 606±433) N、咀嚼性分别为(189.2±21) mJ和(124.9±39) mJ。综上,变温发酵可以维持泡菜的质构和口感,避免泡菜长时间贮藏或者发酵后呈现软烂状态。
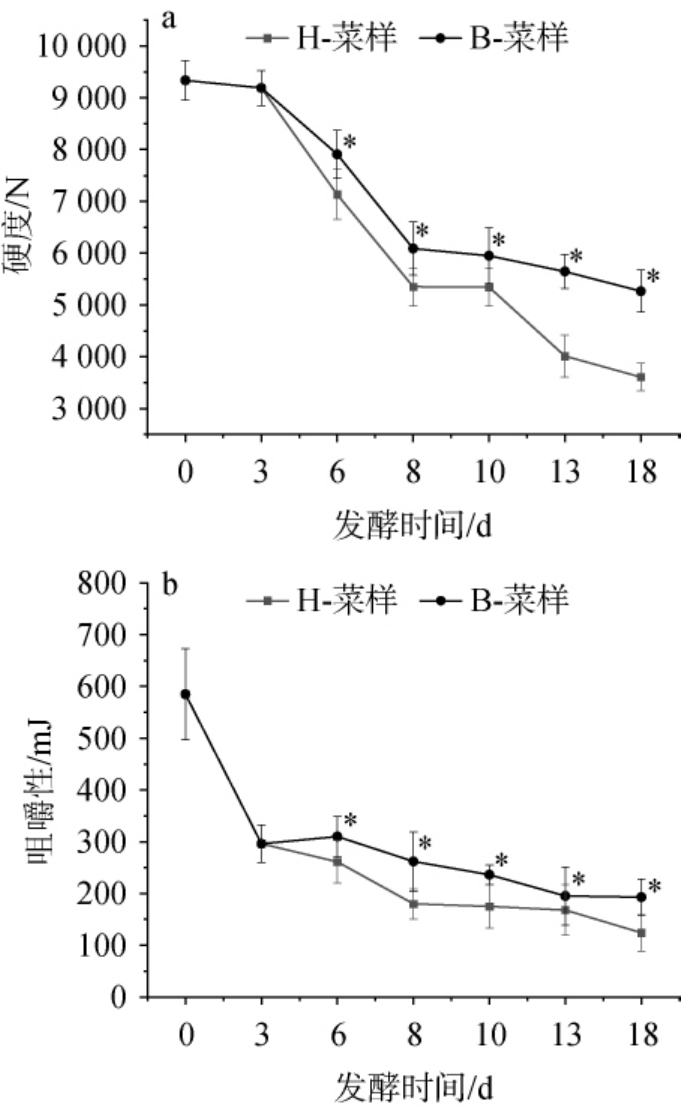
图4 恒温与变温发酵过程中萝卜泡菜的硬度(a)和咀嚼性(b)的变化
Fig.4 Changes in hardness (a) and chewiness (b) of radish Paocai under constant- and variable-temperature fermentation process
2.4.2 颜色参数变化
由表2可知,在发酵第6天开始,恒温发酵萝卜泡菜的L*值、a*值与b*值显著低于变温发酵(P<0.05),表明变温发酵的萝卜泡菜颜色更鲜亮、不暗淡,可能是由于变温发酵的泡菜乳酸菌数量较多,乳酸菌发酵产生更多的抗氧化活性物质从而稳定了萝卜泡菜的色泽[40-41]。 两组萝卜泡菜L*值从6 d到18 d略有下降,可能是发酵体系酸度升高促进萝卜中4-甲硫基-3-丁烯基异硫氰酸酯转化生成黄色素而使得萝卜的亮度发生变化[42-43]。
表2 恒温和变温发酵过程中萝卜泡菜的颜色参数变化
Table 2 Changes in color parameters of radish Paocai under constant- and variable-temperature fermentation process
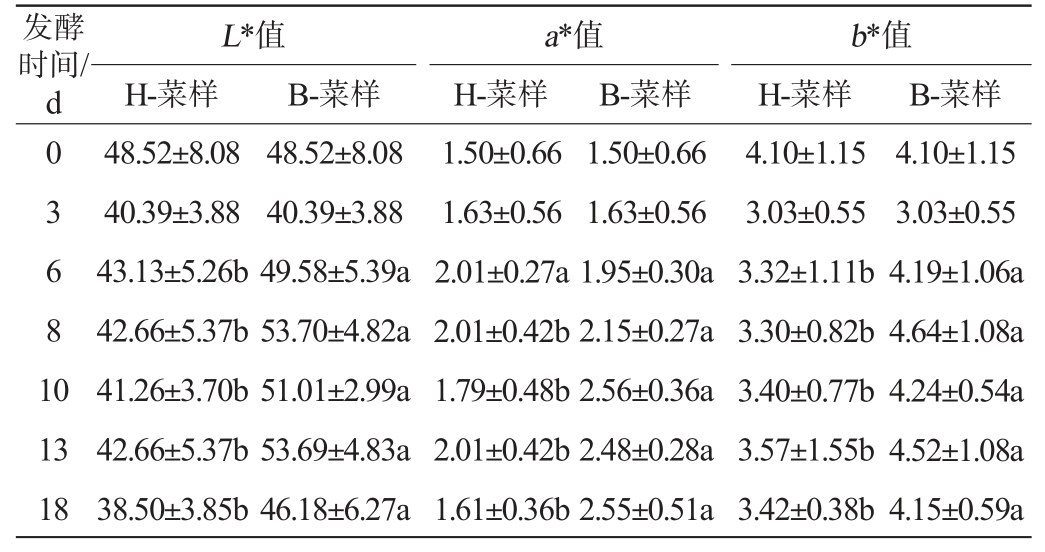
注:同一行不同小写字母表示差异显著(P<0.05)。
发酵时间/d03681 0 L*值H-菜样a*值H-菜样B-菜样B-菜样b*值H-菜样B-菜样13 18 48.52±8.08 40.39±3.88 43.13±5.26b 42.66±5.37b 41.26±3.70b 42.66±5.37b 38.50±3.85b 48.52±8.08 40.39±3.88 49.58±5.39a 53.70±4.82a 51.01±2.99a 53.69±4.83a 46.18±6.27a 1.50±0.66 1.63±0.56 2.01±0.27a 2.01±0.42b 1.79±0.48b 2.01±0.42b 1.61±0.36b 1.50±0.66 1.63±0.56 1.95±0.30a 2.15±0.27a 2.56±0.36a 2.48±0.28a 2.55±0.51a 4.10±1.15 3.03±0.55 3.32±1.11b 3.30±0.82b 3.40±0.77b 3.57±1.55b 3.42±0.38b 4.10±1.15 3.03±0.55 4.19±1.06a 4.64±1.08a 4.24±0.54a 4.52±1.08a 4.15±0.59a
3 结论
本研究采用恒温发酵(25 ℃持续发酵18 d)及变温发酵(25 ℃发酵3 d随后转移至5 ℃继续发酵15 d)两种发酵模式制备萝卜泡菜,通过测定两组萝卜泡菜发酵过程中的理化及微生物指标、质构及颜色参数变化,探究变温发酵对泡菜品质的影响。研究表明,相较于恒温发酵,变温发酵萝卜泡菜pH和乳酸含量更高、总酸和乙酸含量更低。 微生物指标分析中,变温发酵的乳酸菌数、菌落总数及酵母菌数均高于恒温发酵。两组样品优势真菌属均为哈萨克斯坦酵母属(Kazakhstania),但变温组的相对丰度更高,且变温发酵萝卜泡菜中白色念珠菌属(Candida)的相对丰度更低。另外,变温发酵能够更好的维持萝卜泡菜的硬度、咀嚼性及其鲜亮的色泽状态。 综上,先高温(25 ℃)后低温(5 ℃)的变温发酵模式可在前期相对高温的环境下激活微生物代谢活性,缩短泡菜成熟时间,且后期相对低温下抑制微生物生长避免泡菜过酸化,质地和色泽劣变,提升泡菜品质。
[1]赵楠.四川泡菜的主要特性及其成因分析[D].无锡:江南大学,2017.
[2]LI P,LIN W F,LIU X,et al.Environmental factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese Daqu starter[J].Front Microbiol,2016,253(7):1-15.
[3]汪冬冬,鲍永碧,管锐,等.温度对甘蓝泡菜发酵过程中风味的影响[J].食品与发酵工业,2021,47(2):233-240.
[4]ZHANG Q S,CHEN G,SHEN W X,et al.Microbial safety and sensory quality of instant low-salt Chinese paocai[J].Food Control, 2016, 59:575-580.
[5]HONG S P,LEE E J,KIM Y H,et al.Effect of fermentation temperature on the volatile composition of Kimchi[J].J Food Sci,2016,81(11):25-40.
[6]WANG D D,CHEN G,TANG Y,et al.Effects of temperature on paocai bacterial succession revealed by culture-dependent and culture-independent methods[J].Int J Food Microbiol,2020,317:108463.
[7]王雪雅,朱秋劲,胡萍,等.不同发酵温度对酸肉生物胺含量及微生物多样性的影响[J].中国食品学报,2018,18(6):188-195.
[8]关慧,张锡茹,赵强,等.温度对辣白菜发酵及保藏过程中品质的影响[J].中国调味品,2023,48(8):60-65.
[9]赖惠敏.营养配餐中蔬菜菜肴在热链贮藏过程品质变化及加工控制[D].广州:华南理工大学,2021.
[10]燕平梅,王炫月,赵文婧.泡菜中亚硝酸盐形成、还原相关微生物的研究[J].中国调味品,2020,45(9):77-80,94.
[11]LUO Y L,LIU Y L,REN T,et al.Sichuan paocai fermented by mixedstarter culture of lactic acid bacteria[J].Food Sci Nutr,2020,8:5402-5409.
[12]吴亚玲.红条茶加工中滋味品质成分的动态变化及变温发酵工艺对品质的影响[D].长沙:湖南农业大学,2022.
[13]黄浩,余鹏辉,赵熙,等.基于变温发酵技术的黄金茶工夫红茶品质分析[J].现代食品科技,2022,38(2):155-163.
[14]郑霖霖.不同发酵工艺下茄芯烟叶的微生物群落与品质变化及相关性分析[D].郑州:河南农业大学,2023.
[15]贾云,张倩颖,李品鹤,等.恒温发酵和变温发酵对雪茄烟叶品质的影响[J].中国酿造,2023,42(6):212-217.
[16]ZHAO N,GE L H,LAI H M,et al.Unraveling the contribution of presalting duration to microbial succession and changes of volatile and nonvolatile organic compounds in Suancai(a Chinese traditional fermented vegetable)during fermentation[J].Food Res Int,2022,159:111673.
[17]赵楠,葛黎红,郭壮,等.泡辣椒发酵过程中质构劣化规律及其影响因素研究[J].中国酿造,2020,39(1):119-123.
[18]赵江欣.预添加乳酸对泡萝卜品质影响的研究[D].雅安:四川农业大学,2018.
[19]SHAO Y J, LIN H M.Improvement in the quantification of reducing sugars by miniaturizing the Somogyi-Nelson assay using a microtiter plate[J].Food Chem,2018,240:898-903.
[20]GE L H,LAI H M,HUANG Y L,et al.Comparative evaluation of package types in alleviating textural softening and package-swelling of Paocai during storage:Insight into microbial invasion,cell wall pectinolysis and alteration in sugar and organic acid profiles[J].Food Chem,2021,365:130489.
[21]胡容,唐垚,覃书漫.低盐泡菜的贮藏后酸化及其对泡菜品质安全的影响[J].中国调味品,2023,48(8):66-69,76.
[22]申文熹,陈功,唐垚.不同盐质量分数泡白菜发酵过程中乳酸菌群落结构的变化[J].食品科学,2017,38(10):104-110.
[23]XIONG T,LI J B,LIANG F,et al.Effects of salt concentration on Chinese sauerkraut fermentation[J].LWT-Food Sci Technol, 2016, 69:169-174.
[24]KNEZ E,KADAC-CZAPSKA K,GREMBECKA M.Effect of fermentation on the nutritional quality of the selected vegetables and legumes and their health effects[J].LIFE,2023,13(3):24.
[25]史梅莓,伍亚龙,吕鹏军.不同乳酸菌接种发酵对泡白菜理化特征及风味的影响[J].食品与发酵工业,2024,50(1):80-88.
[26]徐清萍,法子柱,李雯.微生物群落结构对泡菜质量的影响研究进展[J].中国调味品,2022,47(6):200-203.
[27]张文娟,陈安特,韩宇琴.酿酒酵母对萝卜泡菜发酵的影响[J].食品与发酵工业,2017,43(8):134-137.
[28]CARRAU F, HENSCHKE P A.Hanseniaspora vineae and the concept of friendly yeasts to increase autochthonous wine flavor diversity[J].Front Microbiol,2021,12:1918.
[29]李恒,陈功,伍亚龙,等.高通量测序方法研究传统四川泡菜母水中微生物群落的动态变化[J].食品科学,2018,39(24):131-138.
[30]XU X X,WU B B,ZHAO W T,et al.Shifts in autochthonous microbial diversity and volatile metabolites during the fermentation of chili pepper(Capsicum frutescens L)[J].Food Chem,2021,335:127512.
[31]RAO Y,QIAN Y,SHE X,et al.Pellicle formation,microbial succession and lactic acid utilisation during the aerobic deteriorating process of Sichuan pickle[J].Int J Food Sci Tech,2018,53(3):767-775.
[32]LU J Y,HU X C,REN L J.Biofilm control strategies in food industry:Inhibition and utilization[J].Trends Food Sci Tech,2022,123:103-113.
[33]陈功,张其圣,余文华,等.四川泡菜挥发性成分及主体风味物质的研究[J].中国酿造,2010,29(12):19-23.
[34]CHOI Y J,YONG S,LEE M J,et al.Changes in volatile and non-volatile compounds of model kimchi through fermentation by lactic acid bacteria[J].LWT-Food Sci Technol,2019,105:118-126.
[35]MOHAMED A A,YUKIHIRO T,KENJI S.Lactic acid production from lignocellulose-derived sugars using lactic acid bacteria: Overview and limits[J].J Biotechnol,2011,156:286-301.
[36]肖阳生.四川泡菜功能微生物代谢调控机理的研究[D].南昌:南昌大学,2020.
[37]CAO J L,YANG J X,HOU Q C,et al.Assessment of bacterial profiles in aged,home-made Sichuan paocai brine with varying titratable acidity by PacBio SMRT sequencing technology[J].Food Control,2017,78:14-23.
[38]马艺荧.东北酸菜发酵过程中细菌多样性及有机酸的变化规律[D].哈尔滨:东北农业大学,2019.
[39]YANG X, et al.Calcium bridging and low-acid processing mitigate pectin degradation in canned peaches: A texture preservation approach[J].LWT-Food Sci Technol,2023,173:114356.
[40]李彩云,李洁,严守雷,等.抗坏血酸处理对鲜榨莲藕汁酶促褐变和品质特征的影响[J].中国食品学报,2021,21(10):151-158.
[41]卢嘉懿,李汴生,阮征.乳酸菌发酵对梨汁的护色作用[J].现代食品科技,2019,35(3):148-153,45.
[42]KOBAYASHI T,KUMAKURA K,TAKAHASHI A,et al.Low pH enhances the glucosinolate-mediated yellowing of Takuan-zuke under low salt conditions[J].Foods,2020,9(11):1524.
[43]曾雪晴,赵楠,杨馨雨,等.不同贮藏方式对黄变发酵萝卜贮藏稳定性的影响[J].中国酿造,2024,43(4):186-191.