乳酸和乙酸作为白酒中最重要的有机酸,对白酒品质具有十分重要的作用[1-2]。乳酸由于其非挥发性,气相色谱法难以直接测定[3]。乙酸等短链脂肪酸,在气相色谱出峰上存在拖尾现象[4],故目前测定乳酸和乙酸等短链脂肪酸,通常采用衍生法或高效液相色谱(high performance liquid chromatogram,HPLC)法测定[5-6]。HPLC法测定乳酸和乙酸,既避免了乳酸利用气相色谱难以测定,也避免了衍生化繁琐的前处理,是目前采用较多的测定方法[7]。但白酒中乙醇的存在使得乳酸和乙酸的液相色谱法测定容易出现出峰时间漂移、峰型差、难以分离等问题[4,8],影响其定性的识别和定量的准确。 为降低和避免乙醇的干扰,研究人员采用稀释[7]、蒸发[9],盐化-减压浓缩[8]等方式处理检测样本,但稀释会导致白酒中有机酸浓度的降低使得低于检测限或定量限,蒸发则造成白酒中挥发性有机酸定量的不准确,盐化-减压浓缩的前处理步骤又较为繁琐,因此,如何对白酒中的乳酸和乙酸进行直接检测并准确定量,一直是行业研究的难点。
近红外光谱主要由低能电子跃迁所产生,用于反应含氢基团振动的倍频和合频吸收[10],由于其快速、无损等特点近年来在白酒行业得到广泛的应用[11],如白酒酿酒原辅料、酒醅等样本的快速检测。目前使用近红外光谱测定白酒中乳酸和乙酸含量的研究较少,鉴于乳酸和乙酸作为白酒中最重要的有机酸,建立白酒中乳酸和乙酸的近红外光谱快速定量分析模型,具有重大的实际意义。 乳酸和乙酸化学建模参考值的准确性,将直接影响其近红外光谱模型的预测准确度[12],已有利用近红外光谱技术快速测定白酒中乳酸和乙酸的研究中,乳酸和乙酸的建模参考值测定,主要有高效液相色谱法、气相色谱法(gas chromatography,GC)和气相色谱-质谱联用法(gas chromatographic-mass spectrometry,GC-MS),郭玉姗等[13]基于C18色谱柱利用液相色谱法测定乳酸,刘建学等[14]采用气相色谱测定白酒中的乙酸,WU J等[15]则利用GC-MS测定白酒中乙酸、丁酸及己酸等风味成分,这些研究中,C18色谱柱测定白酒中的乳酸,需要稀释且基线漂移较大,乙酸的气相色谱测定通常存在峰分叉拖尾等现象,这将导致白酒中的乳酸和乙酸定量结果不准确[4],然而建模参考值的准确性对于建模质量至关重要,因此,基于准确测定乙酸和乳酸的建模参考值,建立其近红外光谱快速检测模型,实现白酒中最重要的乳酸和乙酸的快速检测是十分必要的。
本研究建立液相色谱直接测定白酒中的乳酸和乙酸含量的方法,结合采集的白酒近红外光谱图,通过选择光谱预处理方法和建模变量筛选方法,并结合核偏最小二乘算法(kernel partial least square,KPLS)来建立白酒中乳酸、乙酸的快速定量模型,旨在为白酒中乳酸和乙酸的直接和快速测定提供方法参考。
1 材料与方法
1.1 材料与试剂
白酒样品(2021年生产,酒精度为52%vol):四川泸州某酒厂提供;乳酸、乙酸标准品(均为色谱纯):上海安谱实验科技股份有限公司;甲醇、硫酸、磷酸(均为分析纯):成都市科隆化学品有限公司;乙醇、四氯化碳、氯磺酸(均为分析纯):上海阿拉丁试剂有限公司。
1.2 仪器与设备
1260 Infinity液相色谱系统、SB-AQ色谱柱(2.1 mm×100 mm,1.8 μm)、C18色谱柱、PolarisC18-A色谱柱(4.6 mm×250 mm,5 μm):美国Agilent公司;QuasIR Q4000型傅里叶变换近红外光谱仪:四川威斯派克科技有限公司;Milli-Q Synergy超纯水系统:德国Merck公司;ME型分析天平:瑞士METTLER TOLEDO公司。
1.3 方法
1.3.1 不同乙醇体积分数溶液的配制
准确称量乳酸、乙酸标准品各0.50 g,置于10 mL容量瓶中,以水定容,得到质量浓度为50 000 mg/L的有机酸水溶液。再分别配制乙醇体积分数为0、20%、40%、60%、80%、100%的乙醇水溶液。取20 mL容量瓶6个,先分别加入上述乳酸、乙酸水溶液各50 μL,再分别以配制的不同乙醇体积分数溶液定容,即得系列乳酸和乙酸浓度相同但乙醇体积分数不同的溶液。
1.3.2 样品乳酸和乙酸含量的测定方法
酒样乳酸和乙酸含量的测定采用高效液相色谱法,分别采用不同色谱柱测定:
使用SB-AQ色谱柱、安捷伦C18及PolarisC18-A色谱柱:测定条件参考文献[16],色谱条件为:进样量10 μL;流动相A:0.1%磷酸水溶液,流动相B:甲醇;流速0.5 mL/min;梯度洗脱,0~10 min,0% B;10~10.5 min,0 B~10% B;10.5~16 min,10%B;16~16.5 min,10%B~50%B;16.5~45 min,50% B;45~45.5 min,50% B~0 B;45.5~60 min,0%B;柱温30 ℃;检测波长210 nm。
使用有机聚合物为填充颗粒的色谱柱:制备及测定条件参考文献[17],色谱条件为:进样量10 μL;流动相为0.005 mol/L硫酸水溶液;流速0.15 mL/min;等度洗脱;柱温50 ℃;检测波长210 nm。
1.3.3 样品光谱采集方法
取酒样,置于25 ℃环境中2 h后,先取酒样润洗比色皿2次后,再取酒样1 mL装入石英比色皿2/3,后采用超细纤维无尘擦拭布沿光路垂直方向双向擦拭比色皿,保持器皿外表干燥,无沾染。 采用Q4000型近红外光谱仪,以透射测量的方式获取样品光谱信息。使用NirNet软件采集光谱,光谱采集时样品室温控25 ℃,光程1 mm。 扫描波段4 000~12 000 cm-1,分辨率为8 cm-1,扫描32次获得平均光谱,每个样品重复扫描3次,最终取平均光谱作为样本光谱。
1.3.4 光谱模型的建立
共计201个酒样,按照Kennard-Stone(K-S)方法样本分为训练集、验证集及测试集,验证集和测试集样品比例为各20%,各数据集样本中乳酸和乙酸的实际理化值含量范围宽,能较好的代表白酒中乳酸和乙酸的存在情况。光谱的预处理方法主要采用多元散射校正(multiplicative scatter correction,MSC)、矢量归一化(vector normalization,VN)、一阶导数(first derivative,1st Der)、二阶导数(second derivative,2nd Der)、一阶卷积求导(first derivative S-G,1st Der-S-G)和二阶卷积求导(second derivative S-G,2nd Der-S-G)、标准正态变换(standard normal variate transformation,SNV)、加权散射校正(weighted multi scatter correction,WMSC)、Norris平滑处理(norris smoothing,NS)、S-G平滑(savitzkygolay smoothing,SGS)、均值中心化(mean centering,MC)、Z分数标准化(Z score standardization,ZS)、最大最小归一化(min-max normalization,MMN)等方法中的一种或几种方法的组合,共计13种,并分别附加均指中心化或Z-score标准化为光谱附加预处理方法。波长变量筛选主要采取反向区间偏最小二乘法(backward interval PLS,BiPLS)、无信息变量消除法(uninformative variable elimination,UVE)、蒙特卡洛-无信息变量消除(monte-carlo uninformative variable elimination,MCUVE)、竞争自适应重加权采样法(competitive adaptive reweighted sampling,CARS)四种算法。 模型建立方法为核偏最小二乘算法(kernel partial least squares,KPLS)。
1.3.5 光谱模型的评价
所建立预测模型采用交叉验证均方根误差(root mean square error of cross validation,RMSECV)、预测均方根误差(root mean square error of prediction,RMSEP)、决定系数(R2)进行评价,并使用外部独立样品验证了模型的预测能力,计算公式分别如下:
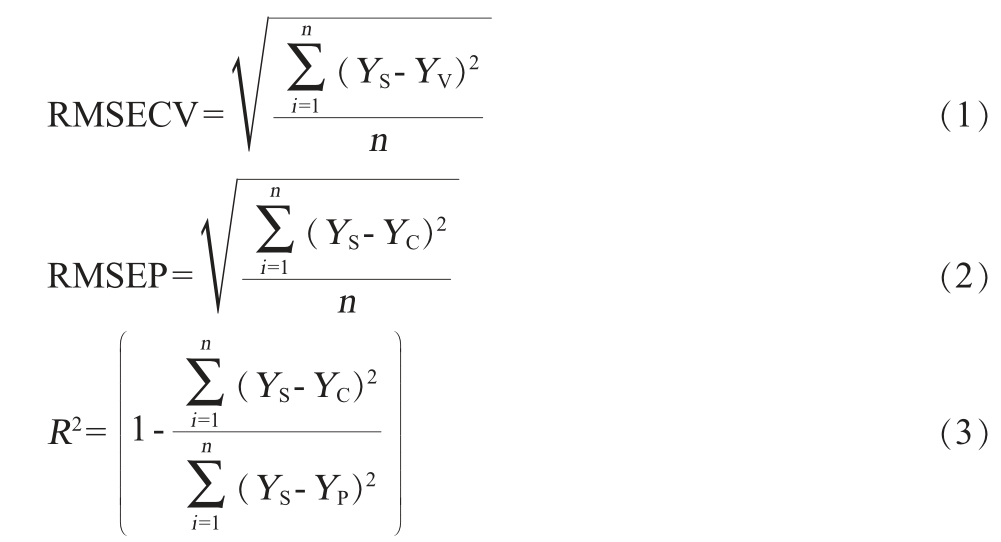
式中:n表示样本个数;YS表示样本的实际分析数值,mg/100mL;YV表示交互验证样品近红外预测值,mg/100 mL;YC表示测试集样本的近红外预测值,mg/100 mL;YP表示所有样本的实际分析数值均值,mg/100 mL。
1.3.6 数据处理
表格采用Excel 2019绘制,绘图采用Origin 2021软件,SpecMC软件对光谱进行赋值、预处理、波段筛选及模型建立,Matlab Release 2014a软件进行部分算法下的波点或波段筛选。
2 结果与分析
2.1 样品的高效液相色谱测定
2.1.1 C18色谱柱测定白酒中的乳酸和乙酸
乳酸和乙酸作为白酒中最重要且含量最高的2种有机酸,对其进行直接、准确的定量是必要的。 由于受乙醇干扰,以高效液相色谱法利用C18(或键合其他基团)色谱柱测定含乙醇白酒样品中的小分子有机酸,一直是行业的难点[18]。 使用Acclaim OA色谱柱时,仅当乙醇体积分数<3%时, 乳酸和乙酸的出峰峰型较好且与标准样品出峰时间<0.1 min[7];使用X Select HSS T3色谱柱时,乙醇体积分数需<10%时,乳酸和乙酸保留时间的差值在0.1 min以内[19],这与PolarisC18-A色谱柱结果相似,这可能是由于乙醇与C18柱(或键合其他基团)的反相色谱柱表面产生氢键等作用, 从而对有机酸在色谱柱上的保留产生较大影响[11,20],对乳酸和乙酸的色谱峰产生较大的影响。C18柱测定酒精度52%vol及20%vol白酒样的乳酸和乙酸结果见图1。 由图1A可知,利用C18色谱柱测定52%vol白酒未稀释样本时,乳酸与乙酸合并为一峰,且存在严重的拖尾现象;由图1B可知,利用C18色谱柱测定酒精度为20%vol酒样时,色谱峰虽初步有双峰特点,但峰型较差。此外,两者都存在出峰时间随乙醇体积分数变化而漂移的现象,利用PolarisC18-A、SB-AQ色谱柱测定上述酒样时,结果类似,这使得利用C18柱(或键合其他基团)的液相色谱柱难以准确、直接的测定白酒中的乳酸和乙酸含量,因此,有必要开发一种不受酒样中乙醇体积分数干扰的,能直接测定白酒中乳酸和乙酸含量的高效液相色谱方法。
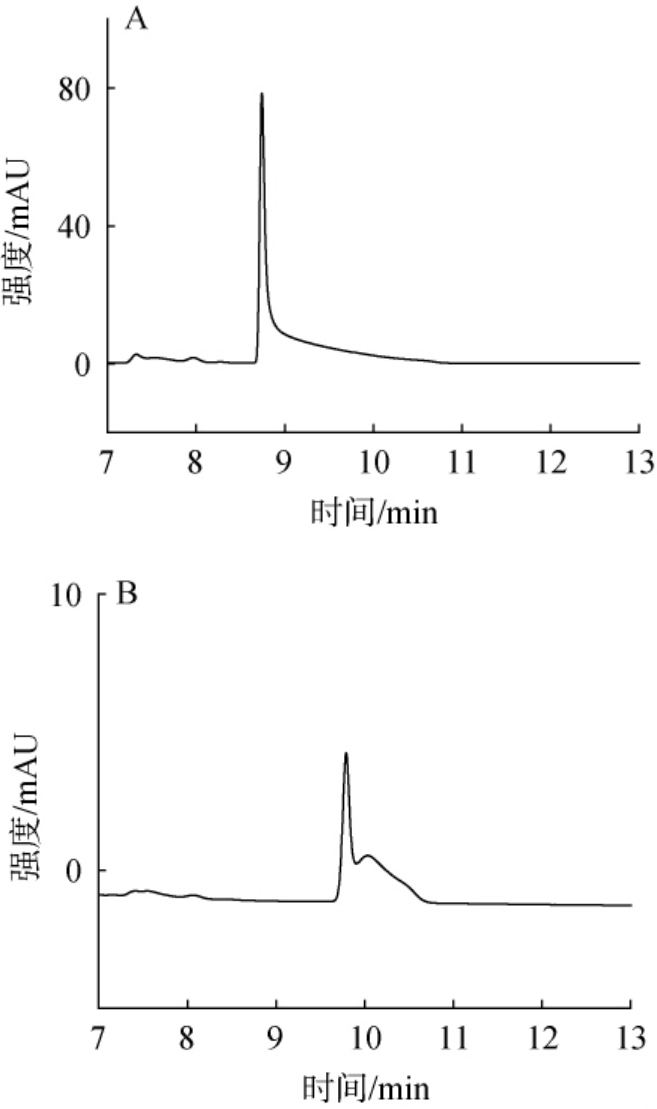
图1 C18柱分析52%vol白酒(A)及20%vol白酒(B)中乳酸和乙酸的高效液相色谱图
Fig.1 High performance liquid chromatography of lactic acid and acetic acid in 52%vol Baijiu (A) and 20%vol Baijiu (B) by C18 column
2.1.2 有机聚合物填充色谱柱测定白酒中的乳酸和乙酸
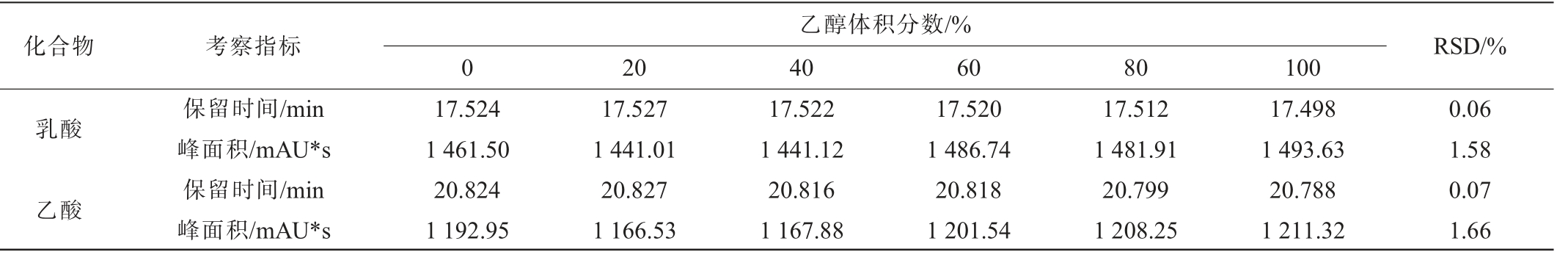
采用有机聚合物为填充颗粒的色谱柱,避免乙醇与色谱柱表面产生氢键等相互作用,降低对色谱柱保留性能的影响,并验证了样本中不同乙醇体积分数下,对于样本中乳酸和乙酸的测定影响,不同乙醇体积分数下的乳酸和乙酸的液相色谱图见图2,样本乙醇体积分数对测定结果及相对标准偏差(relative standard deviation,RSD)的影响见表1。
表1 乙醇体积分数对保留时间、峰面积的影响及其测定结果相对标准偏差
Table 1 Effects of ethanol volume fraction on retention time, peak area, and their relative standard deviations of detection results
乙醇体积分数/%0化合物考察指标RSD/%20406080100乳酸乙酸保留时间/min峰面积/mAU*s保留时间/min峰面积/mAU*s 17.524 1 461.50 20.824 1 192.95 17.527 1 441.01 20.827 1 166.53 17.522 1 441.12 20.816 1 167.88 17.520 1 486.74 20.818 1 201.54 17.512 1 481.91 20.799 1 208.25 17.498 1 493.63 20.788 1 211.32 0.06 1.58 0.07 1.66
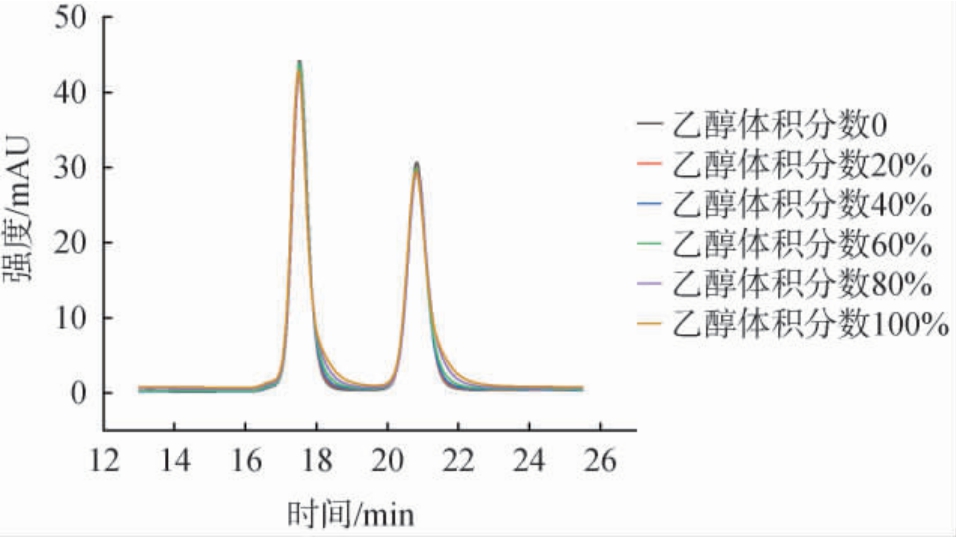
图2 有机聚合物填充色谱柱测定不同乙醇体积分数溶液中乳酸和乙酸的高效液相色谱图
Fig.2 High performance liquid chromatograms of lactic acid and acetic acid in solutions with different ethanol volume fractions using organic polymer filled chromatographic column
由图2可知,利用有机聚合物为填充颗粒的色谱柱测定不同乙醇体积分数样本中乳酸和乙酸含量时,色谱峰型较为对称,且不同乙醇体积分数样本的色谱峰基本重合,表明乙醇体积分数对该方法测定结果的影响较小,有效避免了使用C18柱(或键合其他基团)时,乳酸和乙酸存在的峰合并、峰型不佳、保留时间漂移等问题。由表1可知,在体积分数为0、20%、40%、60%、80%、100%乙醇溶液中,乳酸和乙酸保留时间相对标准偏差(RSD)分别为0.06%与0.07%,峰面积RSD分别为1.58%与1.66%,表明该方法精密性良好。结果表明,利用有机聚合物为填充颗粒的色谱柱测定时不受样本间乙醇体积分数的影响,可以实现白酒中乳酸和乙酸高效液相色谱法的直接、准确测定。
2.1.3 白酒样品中乳酸和乙酸的测定
按上述方法测定52%vol白酒样品的高效液相色谱图见图3。由图3可知,乳酸和乙酸出峰良好,不受酒中其他物质干扰。对白酒样品进行加标回收试验,乳酸和乙酸的加标回收率分别为98.15%与103.28%,表明方法的准确性良好。
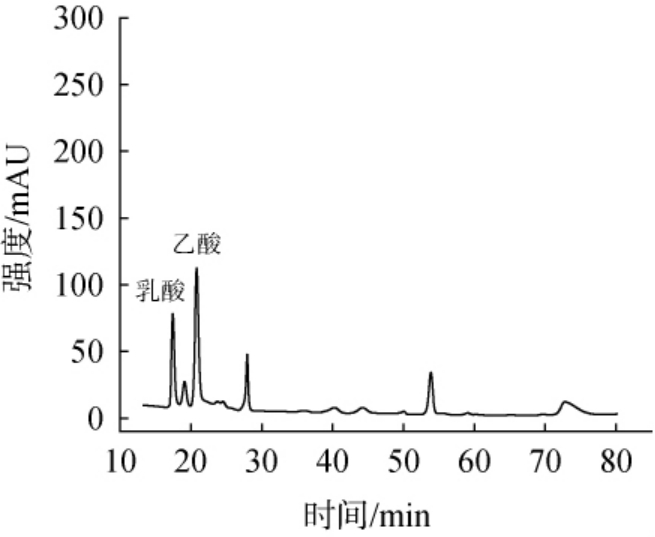
图3 52%vol白酒样品的高效液相色谱图
Fig.3 High performance liquid chromatograms of 52%vol Baijiu samples
2.2 近红外光谱模型的建立
2.2.1 白酒样品的近红外光谱图
近红外光谱图能较好地反映白酒中各物质的近红外信号组成,白酒近红外光谱谱图见图4。 由图4可知,6 878 cm-1左右为水分子的一级倍频吸收,5 169 cm-1附近是水分子的合频吸收,是水分子的特征吸收区域[21],4 340 cm-1为乙醇的特征吸收区域[14],7 518~5 181 cm-1是酸类化合物羰基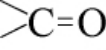 的特征吸收区域,其中5 902 cm-1可能是乳酸的特征吸收区域[22-23]。
的特征吸收区域,其中5 902 cm-1可能是乳酸的特征吸收区域[22-23]。
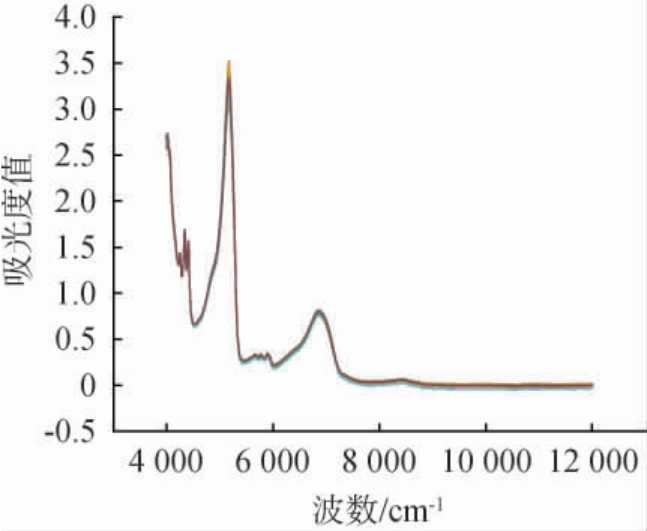
图4 白酒样品的近红外光谱图
Fig.4 Near infrared spectra of Baijiu samples
2.2.2 光谱预处理
对光谱数据进行预处理,以降低光谱的噪音和提高光谱的信噪比,对于近红外光谱建模分析是必须的[24]。 对白酒中乳酸和乙酸含量测定时,对比了无预处理及多种光谱预处理方法组合,并分别附加均值中心化或Z-score标准化,以RMSECV为评价指标,其值越小则模型结构愈加合理,选择最优的光谱预处理方法,不同光谱预处理方法下乳酸和乙酸的主要评价结果见表2。
表2 不同光谱预处理方法条件下乳酸和乙酸的主要评价参数
Table 2 Main evaluation parameters of lactic acid and acetic acid with different spectrum pretreatments
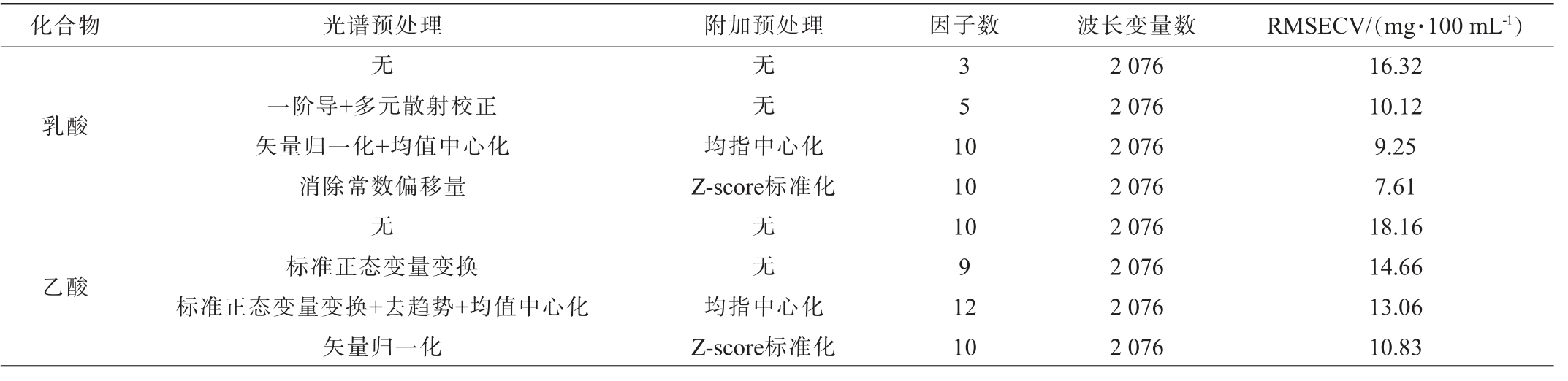
化合物光谱预处理附加预处理因子数波长变量数RMSECV/(mg·100 mL-1)乳酸乙酸无一阶导+多元散射校正矢量归一化+均值中心化消除常数偏移量无标准正态变量变换标准正态变量变换+去趋势+均值中心化矢量归一化无无均指中心化Z-score标准化无无均指中心化Z-score标准化351 0 10 10 9 12 10 2 076 2 076 2 076 2 076 2 076 2 076 2 076 2 076 16.32 10.12 9.25 7.61 18.16 14.66 13.06 10.83
由表2可知,测定乳酸的最佳光谱预处理方法为消除常数偏移量,测定乙酸的最佳光谱预处理方法为矢量归一化,两者最佳附加预处理方法皆为Z-score标准化,相较于均值中心化更能显著地降低RMSECV值,同为尺度缩放类光谱预处理方法,Z-score标准化效果更佳可能与数据的处理方式差异相关[25]。 相较于无光谱预处理,乳酸RMSECV值由16.32 mg/100 mL降低至7.61 mg/100 mL,乙酸RMSECV值由18.16 mg/100 mL降低至10.83 mg/100 mL,表明光谱预处理对于白酒中乳酸和乙酸的近红外光谱技术分析是十分有效的。
2.2.3 模型的变量选择及建立
采用了BiPLS、UVE、MCUVE、CARS四种算法对建模变量进行了筛选,以降低模型的运算复杂程度,并提高模型的相关系数和预测准确性[26]。 BiPLS是将全谱区分为若干等距子区域,寻找最优RMSECV值的区间组合[27],UVE是基于回归系数稳定性的变量选择方法,剔除对建模贡献率小的无信息区域[28],MCUVE则是先采用MC方法对数据进行N次随机采样,建立N个PLS模型的系数矩阵,以矩阵中各变量稳定性评价其重要性结合UVE的方式剔除无信息波长变量[29],CARS通过使用重加权采样(ARS)技术剔除PLS模型中权重小的波长点,选择与建模指标相关的最优波长集合[30]。利用四种变量筛选方法所建立白酒中乳酸和乙酸含量测定模型主要参数信息见表3。
表3 乳酸和乙酸近红外预测模型的主要参数
Table 3 Main parameters of the near infrared prediction model for lactic acid and acetic acid
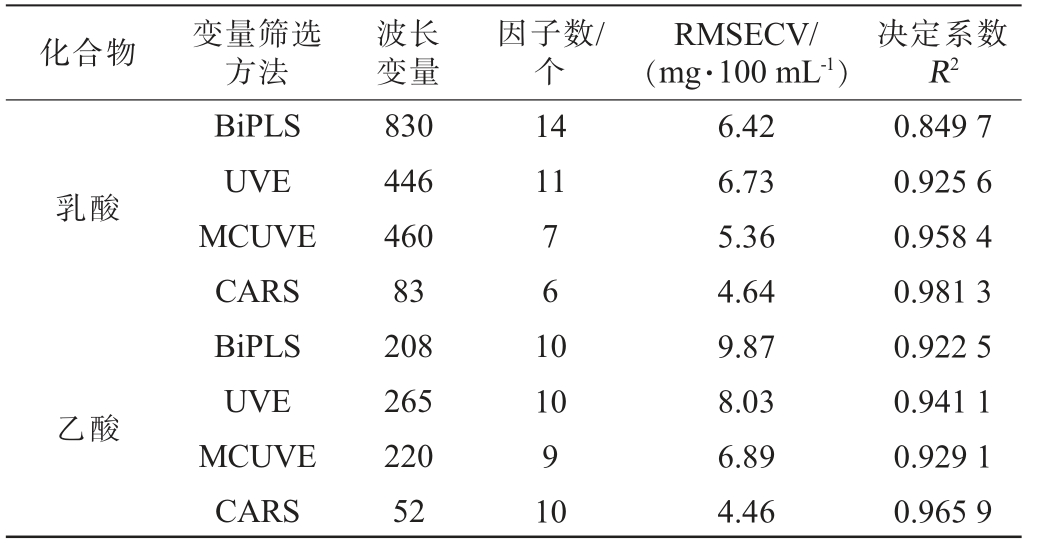
化合物变量筛选方法波长变量因子数/个RMSECV/(mg·100 mL-1)决定系数R2乳酸14 11 761 0乙酸BiPLS UVE MCUVE CARS BiPLS UVE MCUVE CARS 830 446 460 83 208 265 220 52 10 9 10 6.42 6.73 5.36 4.64 9.87 8.03 6.89 4.46 0.849 7 0.925 6 0.958 4 0.981 3 0.922 5 0.941 1 0.929 1 0.965 9
由表3可知,所选四种算法皆能较大幅度的降低模型的波长变量,由全波长区间2 076个波长变量降低至830个波长变量以下,其中CARS算法大幅降低乳酸和乙酸的建模波长变量分别为83和52个,且所建立模型参数最佳,故最终选择CARS为白酒中乳酸和乙酸的近红外建模变量筛选方法。最终模型参数,乳酸模型的因子数为6,RMSECV为4.64 mg/100 mL,决定系数R2为0.981 3;乙酸模型的因子数为10,RMSECV为4.46 mg/100 mL,决定系数R2为0.965 9,所建立模型因子数适中,合理的因子数既较好表达样品的光谱信息,同时避免噪音的引入,相较于全光谱模型,建模变量筛选后模型的RMSECV大幅降低,较优的建模参数表明所建立模型质量良好,可进行后续白酒中乳酸和乙酸的测定工作。所建模型的波长变量及模型见图5。
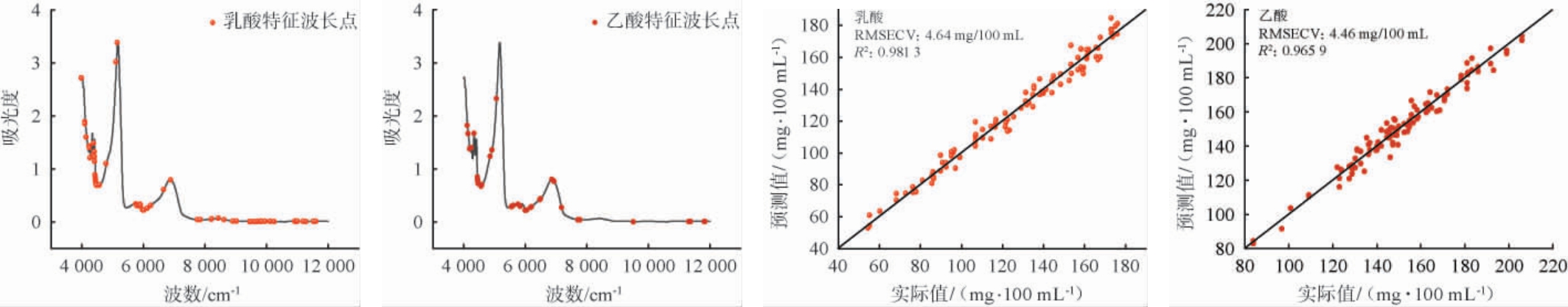
图5 竞争自适应重加权采样法提取特征波长点及所建立定量模型
Fig.5 Characteristic wavelength points extracted by competitive adaptive reweighted sampling and the established quantitative model
由图5可知,经筛选后的特征波长变量相较于全光谱波段显著较少,筛选后乳酸和乙酸建模波长变量仅占全波长变量的4.00%与2.50%,所建立模型乳酸和乙酸指标的实测值与预测值呈对角线分布,样品分布较为均匀,表明模型较为合理。
2.2.4 模型的评价
除内部交叉验证外,为更好地评价模型的预测效果,取样品总数20%的测试集样品,共40个非建模样本验证模型,采用预测均方根误差(RMSEP)、决定系数R2评价模型预测性能,结果见图6。
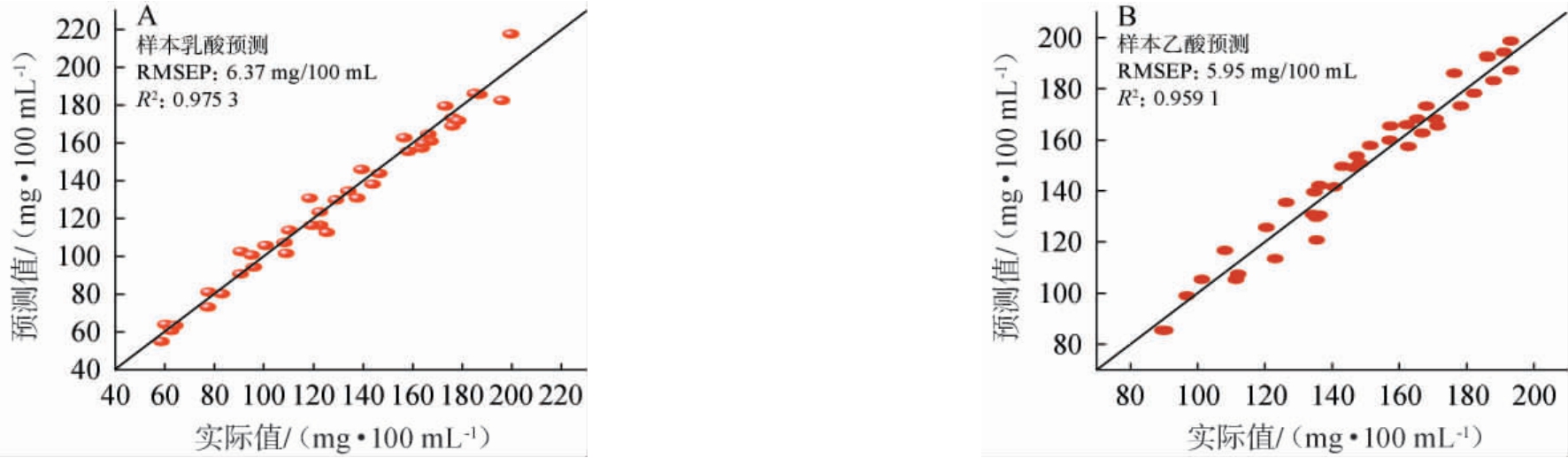
图6 外部独立样品验证乳酸(A)和乙酸(B)的近红外光谱预测模型
Fig.6 Near infrared prediction model for lactic acid (A) and acetic acid (B) verified by external independent samples
由图6可知,40个测试集样品,乳酸和乙酸的RMSEP和决定系数R2分别为6.37 mg/100 mL和0.975 3,5.95 mg/100 mL和0.959 1,表明模型对于非建模样品的预测性良好,与样本的理化实测值较为相符。与前期研究相比较,乳酸方面,利用C18液相色谱柱测定值进行近红外建模,所得近红外模型的RMSECV及RMSEP分别为18.25 mg/100 mL和14.75mg/100mL,本研究参数提升明显,分别为4.64mg/100mL和6.37 mg/100 mL[13];乙酸方面,前期研究利用GC-MS测定化学值建立近红外模型,校正集和验证集决定系数R2分别为0.847 4和0.960 0,本研究参数亦提升明显,分别为0.965 9和0.959 1[15]。上述结果表明,在乙醇影响液相色谱测定白酒中乳酸和乙酸,而短链脂肪酸在气相色谱出峰存在拖尾的研究背景下,利用本研究开发的高效液相色谱测定方法,能有效的避免上述问题,实现酒中乳酸和乙酸含量的直接、准确测定,结合CARS波点筛选方法,能较大的提高所建立近红外模型的参数和预测准确度。
此外,为验证模型预测的精密度,选取样本测定乳酸和乙酸含量,重复测定8次,计算其试验结果RSD,结果见表4。 由表4可知,8次测定样品中乳酸和乙酸含量的测定结果RSD分别为2.28%和2.22%,表明模型重复测定的精密性良好,将实际值与预测值进行单因素方差分析(variance of analysis,ANOVA)检验,组间显著水平分别为0.77与0.73,均>0.05,表明所建立乳酸和乙酸模型,预测值和实际值间不存在显著性差异(P>0.05),即利用该模型测定白酒中的乳酸和乙酸时,模型的精密度和稳定性是可行的。
表4 乳酸和乙酸近红外模型预测样品的精密度和稳定性
Table 4 Precision and stability of samples using near infrared prediction model for lactic acid and acetic acid

化合物12345678RSD实际值显著水平(组间)乳酸乙酸155.59 142.98 162.94 151.27 153.07 148.43 157.79 150.80 160.11 142.59 162.59 147.47 160.47 149.08 162.69 149.16 2.28%2.22%158.22 146.49 0.77 0.73
3 结论
本研究成功构建了高效检测白酒中乳酸与乙酸含量的方法,基于有机聚合物色谱柱的HPLC方法实现了白酒基质的直接测定,方法验证表明:在不同乙醇体积分数(0~100%)下,乳酸和乙酸出峰时间和出峰面积RSD分别为0.06%和1.58%,0.07%和1.66%,证实该方法对样本基质中的乙醇具有较好的抗干扰性,解决了传统利用C18柱(或键合其他基团)时测定乳酸和乙酸时存在的多种问题。进一步结合近红外光谱技术建立了乳酸和乙酸的快速检测模型,最佳模型RMSECV分别为4.64 mg/100 mL和4.46 mg/100 mL,决定系数R2分别为0.981 3和0.965 9,测试集样品的预测结果表明模型的预测值和实际值一致性良好。近红外模型重复预测8次,乳酸和乙酸含量的RSD分别为2.28%和2.22%,且与真值间不存在显著性差异,表明模型预测的精密性、准确性良好,可用于白酒中乳酸和乙酸的快速测定。 本研究所建立高效液相色谱和近红外快速检测方法,皆可实现白酒中乳酸和乙酸的含量快速测定,且不受酒中乙醇体积分数影响,可为白酒行业乳酸和乙酸的测定方法提供参考。
[1]WANG G,SONG X,ZHU L,et al.A flavoromics strategy for the differentiation of different types of Baijiu according to the non-volatile organic acids[J].Food Chem,2022,374:131641.
[2]王梦菡.超高效液相色谱法测定不同香型白酒中乳酸和乙酸的含量[J].食品安全导刊,2021(28):75-76.
[3]WANG G,LI X,SONG X,et al.Optimization and validation of a method for analysis of non-volatile organic acids in Baijiu by derivatization and its application in three flavor-types of Baijiu[J].Food Anal Methods,2022,15(6):1606-1618.
[4]张瑞景,王浩,蔡凤娇,等.高效液相色谱法检测白酒中四种有机酸的方法研究[J].中国酿造,2022,41(3):238-242.
[5]KANG J, SUN Y, HUANG X, et al.Unraveling the microbial compositions, metabolic functions, and antibacterial properties of Huangshui, a byproduct of Baijiu fermentation[J].Food Res Int,2022,157:111320.
[6]ZHANG J,TIAN Z,MA Y,et al.Origin identification of the sauce-flavor Chinese Baijiu by organic acids,trace elements,and the stable carbon isotope ratio[J].J Food Qual,2019,1:7525201.
[7]乔燕燕,东富海,梅怀文,等.高效液相色谱法检测青稞酒中乳酸和乙酸含量[J].酿酒,2024,51(2):80-83.
[8]滕明德,莫新良,王先桂.盐化-减压浓缩-高效液相色谱法测定酱香白酒中乳酸和乙酸的含量[J].理化检验(化学分册),2022,58(10):1225-1227.
[9]赵璇,赵汉鹰,许迎子,等.测定白酒中乳酸和乙酸含量的方法[J].酿酒,2023,50(5):120-122.
[10]OZAKI Y.Infrared spectroscopy-Mid-infrared,near-infrared,and far-infrared/terahertz spectroscopy[J].Anal Sci,2021,37(9):1193-1212.
[11]王凡,乔敏莎,卢君,等.红外光谱技术在白酒生产质控与分析评价中的应用进展[J].中国酿造,2023,42(8):14-19.
[12]何鸿举,王婧茹,刘红,等.近红外光谱技术在甘薯品质检测方面的应用研究进展[J].食品科学,2023,44(21):341-350.
[13]郭玉姗,刘建学,李璇,等.基于近红外光谱技术的白酒基酒中乳酸的快速检测[J].食品工业科技,2018,39(20):212-216
[14]刘建学,张卫卫,韩四海,等.白酒基酒中己酸、乙酸的近红外快速检测[J].食品科学,2016,37(4):181-185.
[15]WU J,PENG H,LI L,et al.FT-IR combined with chemometrics in the quality evaluation of Nongxiangxing Baijiu[J].Spectrochim Acta,2023,284:121790.
[16]余松柏,吴奇霄,黄张君,等.基于HPLC结合多元统计方法分析不同种类酒中有机酸的差异[J].中国酿造,2023,42(2):46-52.
[17]余松柏,黄张君,吴奇霄,等.一种直接测定有机酸的方法、系统及应用:CN118518806A[P].2024-08-20.
[18]王森森,平清伟,盛雪茹,等.国产色谱柱HPLC法测定竹子乙醇精炼液中单糖与小分子脂肪酸[J].大连工业大学学报,2022,41(2):103-107.
[19]张婷,胡来丽,时源,等.基于高效液相色谱测定白酒中乳酸和乙酸的方法研究[J].酿酒科技,2023(11):112-115.
[20]SNYDER L R, KIRKLAND J J, DOLAN J W.Introduction to modern liquid chromatography[M].Amity:John Wiley&Sons,2011:110-111.
[21]CHUNG H,KU M S.Feasibility of monitoring acetic acid process using near-infrared spectroscopy[J].Vib Spectrosc,2003,31(1):125-131.
[22]SIVAKESAVA S, IRUDAYARAJ J, ALI D.Simultaneous determination of multiple components in lactic acid fermentation using FT-MIR,NIR,and FT-Raman spectroscopic techniques[J].Process Biochem,2001,37(4):371-378.
[23]YANO T,MATSUSHIGE H,SUEHARA K I,et al.Measurement of the concentrations of glucose and lactic acid in peritoneal dialysis solutions using near-infrared spectroscopy[J].J Biosci Bioeng,2000,90(5):540-544.
[24]CHEN J,LI M,PAN T,et al.Rapid and non-destructive analysis for the identification of multi-grain rice seeds with near-infrared spectroscopy[J].Spectrochim Acta,2019,219:179-185.
[25]FRIEDMAN L,KOMOGORTSEV O V.Assessment of the effectiveness of seven biometric feature normalization techniques[J].IEEE Trans Inf Forensics Secur,2019,14(10):2528-2536.
[26]LIU X W,CUI X Y,YU X M,et al.Understanding the thermal stability of human serum proteins with the related near-infrared spectral variables selected by Monte Carlo-uninformative variable elimination[J].Chin Chem Lett,2017,28(7):1447-1452.
[27]MA C,ZHAI L,DING J,et al.Raman spectroscopy combined with partial least squares(PLS)based on hybrid spectral preprocessing and backward interval PLS(biPLS)for quantitative analysis of four PAHs in oil sludge[J].Spectrochim Acta, Part A,2024,310:123953.
[28]WU D,CHEN X,ZHU X,et al.Uninformative variable elimination for improvement of successive projections algorithm on spectral multivariable selection with different calibration algorithms for the rapid and nondestructive determination of protein content in dried laver[J].Anal Methods,2011,3(8):1790-1796.
[29]LI C,ZHAO T,LI C,et al.Determination of gossypol content in cottonseeds by near infrared spectroscopy based on Monte Carlo uninformative variable elimination and nonlinear calibration methods[J].Food Chem,2017,221:990-996.
[30]LI Q,HUANG Y,SONG X,et al.Moving window smoothing on the ensemble of competitive adaptive reweighted sampling algorithm[J].Spectrochim Acta, Part A,2019,214:129-138.