1,2-丙二醇,无色粘稠液体,具有吸湿性,几乎无色无味,广泛应用于食品[1-3]、化妆品[4-5]、制药[6-7]和烟草等行业[8-11],在兽药生产和饲料工业[12]中,常被用作溶剂或稳定剂。在食品行业,根据国家明确规定,1,2-丙二醇在糕点和生湿面制品中允许作为添加剂使用,也可以用作香精香料的溶剂,并限定了使用范围[13-14]。 纯牛乳以生牛乳为原料,不添加任何辅料及食品添加剂[15-16]。 随着人们生活水平的不断提高,牛乳已经成为人们日常饮食中的重要组成部分,因此,对其质量安全性的关注度也越来越高。市场监管部门在食品抽检中发现,某品牌生产的纯牛奶中检出丙二醇[17],引起人们和相关部门的高度关注。因1,2-丙二醇在人体内大约有45%会经过肾脏排出体外,其余的则在体内代谢为乳酸,如果长期大量食用含有1,2-丙二醇的牛奶,产生的乳酸不能及时排出,就会在血液和肾脏累积,从而导致中毒,影响神经系统,造成呼吸变缓、心率降低、失去意识等[18-20]。因此,为保障人们的身体健康,对牛乳中1,2-丙二醇的含量进行监控有着重要意义。
目前,1,2-丙二醇的检测方法有核磁共振波谱法(nuclear magnetic resonance,NMR)[21]、气相色谱法(gas chromatography,GC)[22-24]、高效液相色谱法(high performance liquid chromatography,HPLC)[25]、气相色谱-质谱联用法(gas chromatography-mass spectrography,GC-MS)[26-28]。 其中核磁共振仪成本比较高,该仪器的普及率较低,导致核磁共振波谱法不易推广;气相色谱法和高效液相色谱法抗干扰能力差,尤其是牛乳基质比较复杂,存在较多的干扰物质,影响目标物的分析灵敏度;气相色谱-串联质谱法抗基质干扰能力较强,灵敏度较高。本研究在SN/T 5112—2019《进出口食用动物、饲料丙二醇含量测定气相色谱法和气相色谱-质谱法》基础上,通过对不同前处理方法和仪器条件进行优化,旨在建立一种简单高效、准确性高的测定牛乳中1,2-丙二醇的GC-MS方法,以期为乳品质量控制提供一定的技术支持。
1 材料与方法
1.1 材料与试剂
巴氏杀菌乳、灭菌乳:市售。
1,2-丙二醇标准品(纯度≥98.0%):德国Dr.Ehrenstorfe公司;乙腈、乙醇(均为色谱纯)、0.22 μm有机针式滤膜:上海安谱公司;无水硫酸钠(分析纯):天津博迪化工有限公司;无水硫酸镁(分析纯):天津鼎盛鑫化工有限公司;分散固相萃取试剂盒[含150 mg乙二胺-N-丙基硅烷化硅胶(ethylenediamine-N-propylsilane silica gel,PSA)、150 mg十八烷基硅烷键合硅胶(C18)、900 mg无水硫酸镁(MgSO4)]:美国安捷伦科技有限公司。
1.2 仪器与设备
8890-5977C气相色谱-质谱联用仪、VF-1701毛细管色谱柱(30 m×0.25 mm×0.25 μm)、DB-200毛细管色谱柱(30 m×0.25 mm×0.25 μm)、DB-WAX毛细管色谱柱(30 m×0.25 mm×0.25 μm):美国安捷伦科技有限公司;3-20R高速台式冷冻离心机:湖南可成仪器设备有限公司;MS3 basic涡旋振荡器:德国IKA公司。
1.3 方法
1.3.1 标准溶液的配制
1,2-丙二醇标准储备液(10 mg/mL):准确称量0.25 g(精确到0.000 01 g)1,2-丙二醇标准品到25 mL容量瓶中,用无水乙醇溶解并定容至刻度。
1,2-丙二醇标准工作液(100 μg/mL):准确吸取0.1 mL 1,2-丙二醇标准储备液(10 mg/mL)于10 mL容量瓶中,用无水乙醇定容至刻度。
1.3.2 牛乳中1,2-丙二醇含量的测定
(1)样品前处理
取牛乳试样2 g(精确到0.1 mg),加入8 mL提取试剂乙腈,涡旋振荡5 min,超声提取5 min,15 000 r/min、0~4 ℃离心5 min,移取4 mL上清液到15 mL的分散固相萃取试剂盒中,振荡5 min,10 000 r/min、0~4 ℃离心5 min,移取1.0 mL上清液过0.22 μm滤膜,供GC-MS分析。
(2)气相色谱条件
DB-WAX毛细管色谱柱(30 mm×0.25 mm,0.25 μm);进样口温度230 ℃;载气为高纯氦气(He)(纯度>99.999%),流速1.0 mL/min;进样体积1 μL;进样方式为分流进样,分流比10∶1;升温程序为初始温度为50 ℃,保持1 min,然后以15 ℃/min升温至170 ℃,保持3 min,再以20 ℃/min升温至230 ℃,保持3 min。
(3)质谱条件
电子电离(electronionization,EI)源;离子源温度230℃;电离能量70 eV;接口温度240 ℃;扫描方式:选择离子监测(selected ion monitoring,SIM)模式;其他质谱参数见表1。
表1 牛乳中1,2-丙二醇测定质谱参数
Table 1 Mass spectrometry parameters for the determination of 1,2-propanediol in milk
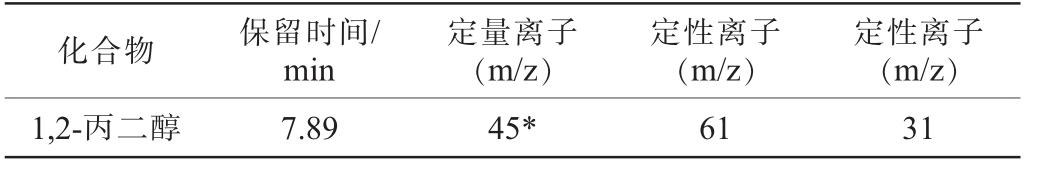
化合物保留时间/min定性离子(m/z)1,2-丙二醇7.8945*6131定量离子(m/z)定性离子(m/z)
(4)定性定量方法
根据目标物的保留时间和离子的相对丰度定性。外标法定量,即测得样液中目标物的峰面积,根据标准曲线计算目标物的质量浓度。
1.3.3 前处理条件优化
依次考察不同提取试剂(乙醇、乙腈)和不同净化方式(无水硫酸钠、无水硫酸镁、固相萃取试剂盒)对牛乳中1,2-丙二醇回收率的影响。
1.3.4 色谱条件优化
依次考察不同色谱柱[VF-1701(30m×0.25mm,0.25μm)、DB-200(30 m×0.25 mm,0.25 μm)、DB-WAX(30 m×0.25 mm,0.25 μm)]和不同分流比(5∶1、10∶1、20∶1、30∶1)对1,2-丙二醇检测结果的影响。
1.3.5 基质效应分析
选择无1,2-丙二醇的牛乳样品,按照1.3.2的方法对样品进行前处理,得到空白基质溶液。 分别使用空白基质溶液和乙腈为稀释液,移取适量的100 μg/mL的1,2-丙二醇标准工作溶液,配制成质量浓度为1 μg/mL、2 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL的系列标准工作液,按上述色谱条件进行测定,以1,2-丙二醇响应峰面积(y)为纵坐标,质量浓度(x)为横坐标分别绘制基质标准曲线和溶剂标准曲线。通过基质标准曲线和溶剂标准曲线的斜率,计算基质效应(matrix effect,ME)[29-30],其计算公式如下:
1.3.6 方法学考察
检出限和定量限:以被测化合物定量离子3倍信噪比(S/N)计算检出限(limit of detection,LOD),10倍信噪比(S/N)计算定量限(limit of quantitation,LOQ)。
回收率及精密度试验:称取无1,2-丙二醇牛乳试样,添加0.010 g/kg、0.020 g/kg、0.100 g/kg 3个水平质量浓度的1,2-丙二醇,每个水平重复试验6次,涡旋混匀后,采用1.3.2中的前处理方法,使用GC-MS测定样液中1,2-丙二醇含量,计算回收率和相对标准偏差(relative standard deviations,RSD),回收率计算公式如下:
式中:X1为试样中1,2-丙二醇检测含量,g/kg;X0为试样中1,2-丙二醇理论含量,g/kg。
1.3.7 实际样品测定
利用本研究建立的前处理方法和仪器方法对100批市售牛乳进行检测。
1.3.8 数据处理使用安捷伦MassHunter12.1软件采集数据,Microsoft Excel 2016软件对回收率及相对标准偏差等数据进行处理,采用Origin 8.0绘图。
2 结果与分析
2.1 前处理方法的选择
2.1.1 提取试剂的选择
1,2-丙二醇分子结构中1,2位上各有一个羟基,使得丙二醇具有显著的极性,能够与水、醇及多种有机试剂混溶,因此选择极性有机试剂更有利于1,2-丙二醇的提取。又因牛乳的基质成分中含有大量的蛋白质、脂肪、碳水化合物等,选用的提取试剂同时需要将这些复杂的基质成分去除,综合以上原因,研究乙醇和乙腈作为提取试剂的提取和净化效果差异,在同等条件下进行相同浓度加标回收率实验。乙醇和乙腈体系均能沉淀蛋白等杂质,离心分离得到澄清的上清液,上清液直接使用GC-MS检测。 结果显示,乙醇为提取试剂时,目标物的回收率为93%,乙腈为提取试剂时回收率为95%,回收率结果并无显著差异。 但是经过连续数日的检测,发现使用乙醇为提取试剂的样品,静置几小时后会有大量白色固体析出(图1),析出的白色固体物质导致仪器和色谱柱污染,尤其进样针污染较严重,甚至导致进样针无法正常抽取样品。与乙醇形成的沉淀相比,乙腈形成的沉淀更为致密,且静置后无任何固体物质析出,更适合日常监督检测。因此选用乙腈作为提取试剂。

图1 不同溶剂提取牛乳基质的析出状态
Fig.1 Precipitation state of milk matrix after extraction with different solvents
乙醇体系(左);乙腈体系(右)。
2.1.2 净化方式的选择
分析对比了无水硫酸钠、无水硫酸镁、固相萃取试剂盒3种常用净化方式对牛乳中1,2-丙二醇回收率结果的影响,结果见图2。 由图2可知,采用无水硫酸钠、无水硫酸镁的净化方式,1,2-丙二醇回收率分别为113.6%和110.0%,其原因可能是无水硫酸钠、无水硫酸镁可以除去共萃取物中的水分及水溶性物质等杂质,但是对于糖类及脂肪酸等净化效果不佳。采用分散固相萃取试剂盒净化方式回收率为100.6%,净化效果最优,分散固相萃取试剂盒包含无水硫酸镁、PSA、C18,可以有效地除去上清液共萃取物中水分、糖类、脂肪酸等杂质,对上清液共萃取物中存在的杂质净化相对比较全面。 因此,选择最优的净化方式为分散固相萃取试剂盒。
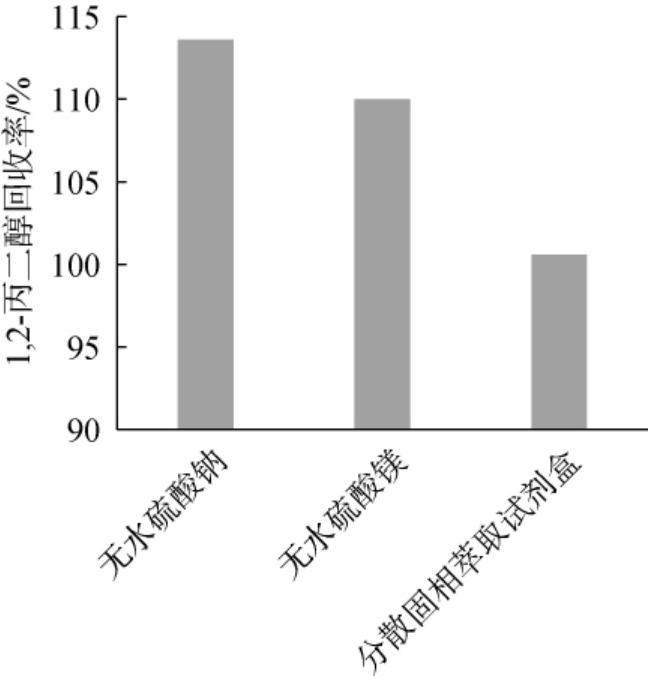
图2 不同净化方式对1,2-丙二醇回收率的影响
Fig.2 Effects of different purification methods on recovery rates of 1,2-propanediol
2.2 色谱柱的选择
1,2-丙二醇为极性化合物,在弱极性HP-1和DB-5色谱柱上基本不出峰,无法保留。 本研究主要考察了VF-1701(30 m×0.25 mm,0.25 μm)、DB-200(30 m×0.25 mm,0.25 μm)、DB-WAX(30 m×0.25 mm,0.25 μm)三种极性色谱柱。VF-1701是由14%氰丙基/苯基和86%聚二甲基硅氧烷固定相组成,主要用于分析农药、除草剂以及芳氯物等。DB-200是一款(35%-三氟丙基)-甲基聚硅氧烷色谱柱,该色谱柱是分析难以分离的位置异构体的理想选择,恒温操作温度上限和程序升温温度上限分别为300 ℃和320 ℃,更有利于高沸点干扰物的去除。 DB-WAX是一款强极性聚乙二醇(polyethylene glycol,PEG)色谱柱,是分析食物、香料以及风味剂的理想选择,高柱间重现性,在柱流失、灵敏度和柱效方面都经过了最严格的行业指标测试。比较3种色谱柱对1,2-丙二醇峰型的影响,结果见图3。 由图3可得,1,2-丙二醇的极性较强,3款色谱柱中极性相对较弱的VF-1701色谱柱可以出峰,但是存在峰型差且灵敏度较低等缺点;中等极性的DB-200色谱柱峰型较VF-1701色谱柱有明显改善,但是色谱峰拖尾严重;耐溶剂冲洗,极性最强的DBWAX色谱柱,可获得尖锐且对称的色谱峰。 因此,选择最适色谱柱为DB-WAX色谱柱。
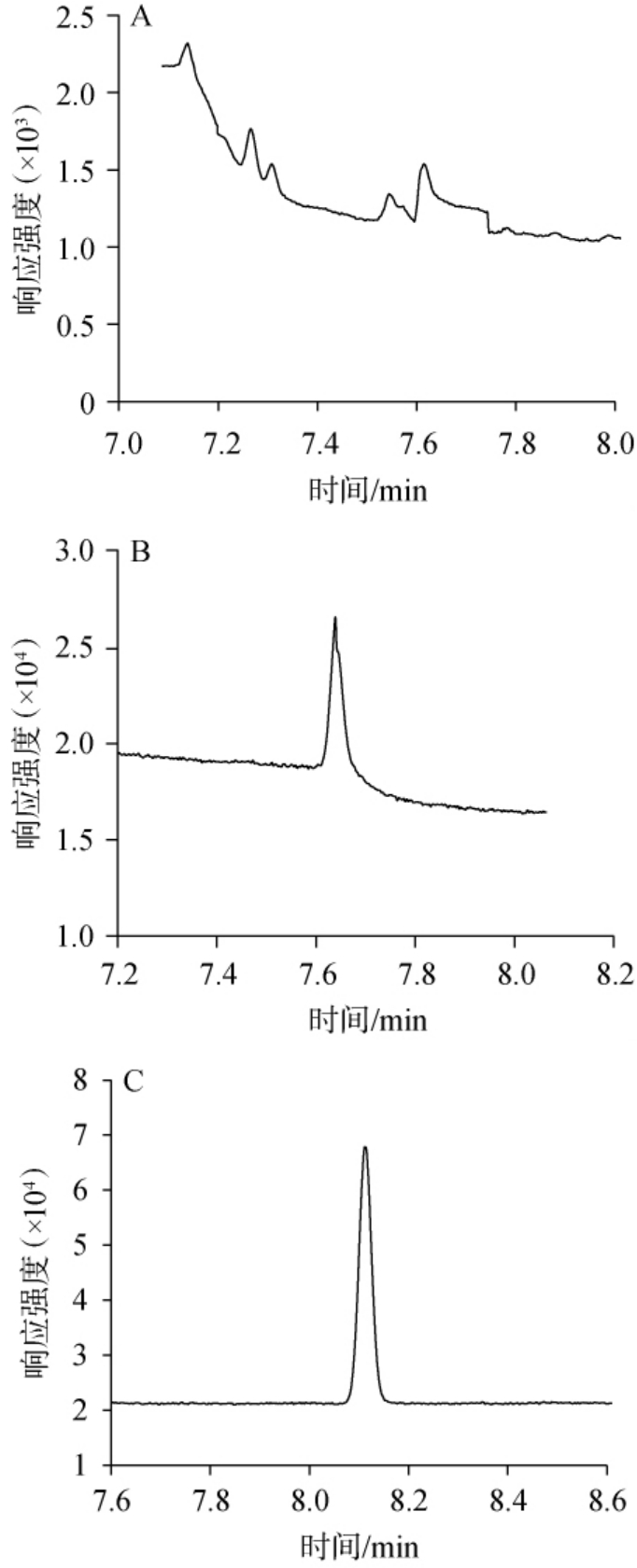
图3 1,2-丙二醇在不同色谱柱条件下的色谱图
Fig.3 Chromatograms of 1,2-propanediol on different columns
A为VF-1701色谱柱;B为DB-200色谱柱;C为DB-WAX色谱柱。
2.3 分流比优化
在检测中获得合适的分流比,需要综合考虑多个因素,包括样品性质、目标物的分离效果和灵敏度、杂质影响等,合适的分流比可以提高分析效率,获得可靠的分析结果。对于高浓度或者高灵敏度的样品,若分流比过小,会出现色谱峰过宽或者重叠的现象,甚至会导致进入色谱柱和质谱检测器的样品量过载。反之,若分流比过大,进入色谱柱的样品量过少,虽然可以获得比较好的分离度,但目标物灵敏度过低,从而影响分析结果的准确性。因此,本研究主要考察了1 μg/mL和50 μg/mL质量浓度下分流比5∶1、10∶1、20∶1、30∶1对1,2-丙二醇检测效果的影响,结果见图4。
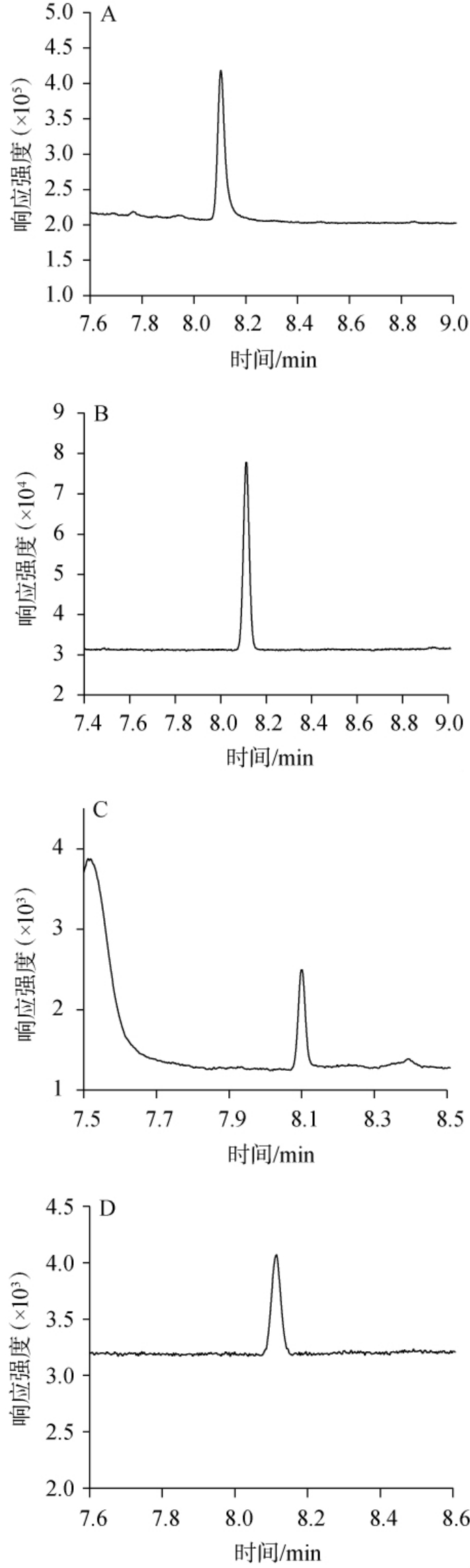
图4 1,2-丙二醇在不同分流比条件下的色谱图
Fig.4 Chromatograms of 1,2-propanediol on different split ratios
A为分流比5∶1;B为分流比10∶1;C为分流比20∶1;D为分流比30∶1。
由图4可知,采用分流比5∶1时,高浓度的1,2-丙二醇色谱峰峰宽较大,峰型对称性较差;采用分流比20∶1时,低浓度的定性离子的色谱峰响应值较小,影响定性判断的准确性;采用分流比30∶1时,不仅定量离子色谱峰响应值太小,而且可能增加分流歧视效应,从而影响定量分析的准确性。当采用分流比10∶1时,质量浓度为1 μg/mL和50 μg/mL的1,2-丙二醇均可以获得尖锐且对称的定量和定性离子色谱峰。因此,确定最优分流比为10∶1。
2.4 基质效应考察
基质效应是在检测分析过程中,除分析物以外的组分对分析过程的影响,使用质谱检测外标法定量,基质效应是一个重要的考察因素。基质效应通过基质抑制或基质增强影响目标化合物的准确性,基质效应越接近100%,则基质效应对检测结果的影响越小[31]。当ME>100%称为基质增强效应,当ME<100%时称为基质抑制效应,当ME在80%~120%之间称为弱基质效应,受基质效应影响不显著;ME在70%~80%之间和120%~130%之间称为较强基质效应,受基质效应影响较显著,在以上范围以外的称为强基质效应,受基质效应影响强显著[32]。 分别对巴氏杀菌乳基质和灭菌乳基质进行了基质效应评价,结果表明,巴氏杀菌乳的ME为92%,灭菌乳的ME为96%,ME均在80%~120%之间,受基质效应影响不显著。因此,可以采用溶剂标准曲线进行外标法定量。
2.5 方法的标准曲线回归方程、线性范围、检出限和定量限
采用乙腈配制质量浓度为1 μg/mL、2 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL的标准系列溶液,以峰面积(y)为纵坐标,1,2-丙二醇质量浓度(x)为横坐标绘制标准曲线,标准曲线回归方程为y=4 394.03x+1 419.85,相关系数R2=0.999 85>0.999,说明1,2-丙二醇在1~50 μg/mL范围内线性关系良好,满足GB/T 27417—2017《合格评定化学分析方法确认和验证指南》[33]中相关要求。方法的LOD为0.005 g/kg,LOQ为0.01 g/kg,可用于牛奶中1,2-丙二醇的定量检测。
2.6 方法的加标回收率和精密度实验
在无1,2-丙二醇的巴氏杀菌乳和灭菌乳样品中分别添加0.010 g/kg、0.020 g/kg、0.100 g/kg 3个水平质量浓度的1,2-丙二醇标准溶液,进行3个质量浓度水平的加标回收率实验,每个水平平行测定6次。计算每个质量浓度水平的平均回收率和精密度实验结果的RSD,结果见表2。
表2 牛乳中1,2-丙二醇的加标回收率和精密度实验结果
Table 2 Experimental results on the spiked recovery rate and precision of 1,2-propanediol in milk
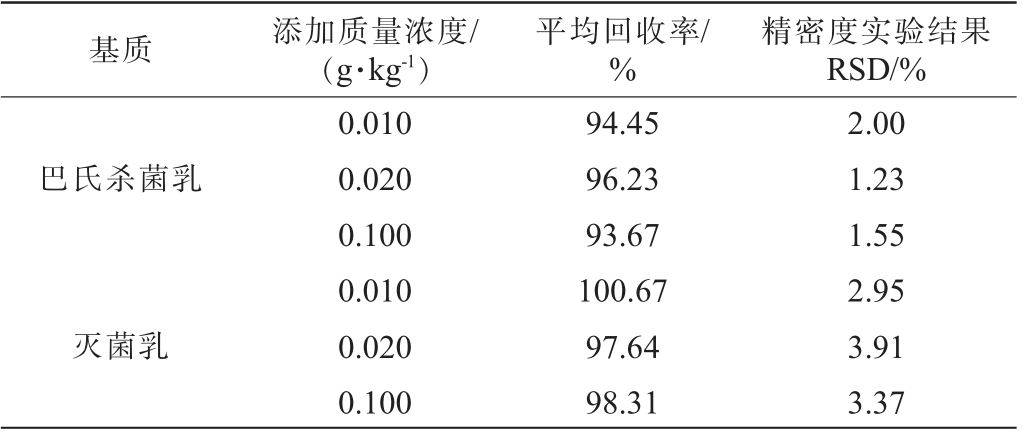
基质添加质量浓度/(g·kg-1)平均回收率/%精密度实验结果RSD/%巴氏杀菌乳灭菌乳0.010 0.020 0.100 0.010 0.020 0.100 94.45 96.23 93.67 100.67 97.64 98.31 2.00 1.23 1.55 2.95 3.91 3.37
由表2可知,巴氏杀菌乳和灭菌乳的平均回收率在93.67%~100.67%,精密度实验结果RSD在1.23%~3.91%,回收率及精密度均满足GB/T 27417—2017《合格评定化学分析方法确认和验证指南》[33]相关要求,表明该方法具有良好的准确性及重复性。
2.7 实际样品测定
利用本研究建立的气相色谱-质谱法对100批市售巴氏杀菌乳和100批市售灭菌乳进行检测,结果发现,1,2-丙二醇均未检出。 虽然当前抽检的样品均没有检出,但是会持续对该项目进行监督检测,以降低食品安全风险。
3 结论
本研究通过对不同提取试剂、净化方式、色谱柱及分流比的优化,建立了GC-MS技术测定牛乳中1,2-丙二醇残留的检测方法。使用乙腈提取、分散固相萃取法净化作为最佳的前处理条件,选择DB-WAX色谱柱(30 m×0.25 mm,0.25)分离,分流比为10∶1,GC-MS检测,外标法定量。 该方法条件下,牛乳中1,2-丙二醇在1~50 μg/mL质量浓度范围内线性关系良好,相关系数(R2)>0.999,检出限为0.005 g/kg,定量限为0.01 g/kg,在0.010 g/kg、0.02 g/kg、0.100 g/kg质量浓度水平下的加标回收率为93.67%~100.67%,精密度实验结果的相对标准偏差为1.23%~3.91%。说明该方法前处理简便、抗基质干扰能力强、准确度高、对仪器的污染损害小,适用于牛乳中1,2-丙二醇的日常检测,具有一定的推广价值。
[1]杜佳依,郭婕,孙成均.气相色谱法快速测定糕点中乙二醇、丙二醇和丙三醇[J].现代预防学,2021,48(21):3955-3959.
[2]玉林市食品药品检验检测中心.气相色谱测定糕点中乙二醇和1,2-丙二醇的方法:CN202110515148.9[P].2021-07-13.
[3]郭金颖,张然.气相色谱法检测食品中的1,2-丙二醇[J].现代食品,2020(14):196-197,206.
[4]潘强.化妆品中丙二醇含量的检测方法研究[J].福建分析测试,2020,29(2):50-55.
[5]成霈,杨悦,靳尧.气相色谱法检测湿巾中丙二醇的含量[J].日用化学工业,2016,46(5):302-304.
[6]北京四环制药有限公司,吉林四环制药有限公司,北京澳合药物研究院有限公司,等.一种气相色谱法分离与检测1,2-丙二醇对映异构体的方法:CN202010593260.X[P].2021-12-28.
[7]代虎,蒋琴,蔡永青.气相色谱法测定重组人胰高血糖素类多肽-1(7-36)注射液中丙二醇含量[J].国际药学研究杂志,2015(2):229-231.
[8]中国烟草总公司郑州烟草研究院.一种电子烟烟液中水分、烟碱、丙二醇和丙三醇的同时测定方法:CN202010194568.7[P].2020-06-12.
[9]肯生叶,温光和,杨雪燕,等.GC-TCD法同时检测加热不燃烧卷烟烟草材料中的水分、1,2-丙二醇、烟碱和丙三醇[J].烟草科技,2020,53(5):41-46.
[10]王康,柳均,肖少红,等.GC-TCD法同时检测加热不燃烧卷烟气溶胶水分,及烟碱、丙三醇、1,2-丙二醇、三乙酸甘油酯和薄荷醇的释放量[J].烟草科技,2019,52(3):63-68.
[11]赵光飞,刘静,屠彦刚,等.气相色谱法同时检测加热不燃烧卷烟芯材中的1,2-丙二醇、烟碱与甘油含量[J].中国测试,2019,45(3):69-74.
[12] 杨希国,杨慧杰,闵国春,等.生牛乳中1,2-丙二醇检测方法研究[J].品牌与标准化,2023(2):84-86.
[13]中华人民共和国国家卫生健康委员会,国家市场监督管理局.GB30616—2020 食品用香精[S].北京:中国标准出版社,2020.
[14]中华人民共和国国家卫生和计划生育委员会.GB 2760—2014 食品添加剂使用标准[S].北京:中国标准出版社,2014.
[15]中华人民共和国卫生部.GB 19645—2010 巴氏杀菌乳[S].北京:中国标准出版社,2010.
[16]中华人民共和国卫生部.GB 25190—2010 食品安全国家标准灭菌乳[S].北京:中国标准出版社,2010.
[17]孙双双.麦趣尔检出丙二醇网红奶变问题奶[J].中国食品工业,2022(13):36-37.
[18]ZHOU Y X,ZHAO X J,HU W P,et al.Acute and subacute oral toxicity of propylene glycol enantiomers in mice and the underlying nephrotoxic mechanism[J].Environ Pollut,2021,290:118050.
[19]LIM T Y, POOLE R L, PAGELER N M.Propylene glycol toxicity in children[J].J Ped Pharmacol Therapeut,2014,19(4):277-282.
[20]孟庆顺,卜媛媛,陈长毅,等.气相色谱法同时测定糕点中的1,2-丙二醇和1,3-丙二醇[J].中国食品添加剂,2021,32(5):113-118.
[21]李玮,耿健强,许华,等.核磁共振波谱法测定液体乳中的1,2-丙二醇[J].分析测试学报,2020,39(9):1131-1136.
[22]中华人民共和国国家卫生和计划生育委员会.GB 5009.251—2016 食品安全国家标准食品中1,2-丙二醇的测定[S].北京:中国标准出版社,2016.
[23]英丽.气相色谱法测定含乳饮料中1,2-丙二醇的不确定度评估[J].生命科学仪器,2015,13(3):50-53,33.
[24]贵州中烟工业有限责任公司.同时测定烟草中水分、1,2-丙二醇和丙三醇含量的方法:CN201710903319.9[P].2019-04-05.
[25]国家烟草专卖局.YC/T 244—2008 烟草及烟草制品1,2-丙二醇、丙三醇和山梨醇的测定高效液相色谱法[S].北京:中国标准出版社,2008.
[26]中华人民共和国海关总署.SN/T 5112—2019 进出口食用动物、饲料丙二醇含量测定气相色谱法和气相色谱-质谱法[S].北京:中国海关出版社,2019.
[27]刘新宇.“一滴香”中乙基麦芽酚和1,2-丙二醇的含量测定及其安全性评价研究[D].成都:西华大学,2012.
[28]广东中烟工业有限责任公司.同时测定烟草中的糖、1,2-丙二醇和甘油的硅烷化GC/MS检测方法:CN201410839827.1[P].2015-04-29.
[29]张立佳,胡雪,文静,等.GC-MS同时检测婴幼儿配方乳粉中氯酸盐和高氯酸盐残留[J].中国酿造,2021,40(6):162-166.
[30]高玉杰,张立佳,刘丽君,等.UPLC-MS/MS测定生乳与豆制饮品中咪唑烟酸残留[J].中国酿造,2023,42(2):235-239.
[31]韩世明,李志,王月霞,等.基于QuEChERS-GC-MS/MS法同时测定猕猴桃中15种有机磷农药残留[J].中国酿造,2022,41(5):223-228.
[32]周雨佳,张菊华,李涛,等.气相色谱法检测辣椒中有机磷农药的基质效应[J].湖南农业科学,2022(6):67-71.
[33]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 27417—2017 合格评定化学分析方法确认和验证指南[S].北京:中国标准出版社,2017.