酵母菌属于真菌,是一群单细胞真核细胞型微生物,广泛分布于自然界中,喜好含糖和偏酸性的环境,在有氧和无氧环境下均可存活。第五版《酵母菌的分类研究》[1]收录了酵母菌有149个属和将近1 500个种。 史料记载我国殷商时期,利用酵母菌在无氧条件下将粮食作物中的糖转化为乙醇的原理进行酿酒。而在面包和馒头等食品的制作中正是利用酵母在有氧环境下快速增殖利用糖产生大量二氧化碳,使得面点食品多空蓬松。 酵母菌由于自身富含活性糖类、蛋白质、氨基酸、多肽、核苷酸及维生素等天然活性成分,不仅在酿酒和面包等领域应用,同时因酵母可产多糖,使得其在化妆品等领域也得到广泛的应用[2]。
由十个以上单糖连接而成的多糖是天然的高分子化合物,广泛存在于动物、植物和微生物组织中,是机体组织的基本结构组成物质和能量储备供给来源,同时也参与到细胞的免疫活动[3]。酵母多糖主要为胞壁多糖和胞外多糖(extracellular polysaccharide,EPS),与胞壁多糖相比较,EPS更容易分离提纯,有利于工业化大规模的生产,酵母菌形成的EPS具有低成本、无毒、环保等优点[4-5]。 LIU L等[6-7]通过优化发酵条件将酿酒酵母EPS的产量提高1.4倍,达到4.52 g/L,提取纯化的EPS分子质量为93 kDa,由甘露聚糖连接着葡萄糖形成的螺旋构象,并研究表明该EPS具有高水溶性、高持水能力、良好乳化能力及抗氧化性能且能凝固脱脂牛奶。 XUE D等[8]研究证明锁掷孢酵母(Sporidiobolus pararoseus)PFY-Z1产生的EPS具有良好的水溶性、持水性、乳化性、凝乳性、抗氧化性、降血糖活性和胆汁酸结合能力。马文锦等[9-10]研究了胶红酵母(Rhodotorula mucilaginosa)CICC33013产生的EPS的强抗氧化能力显示出对肝肿瘤细胞活性的体外抑制效应。 目前的研究表明,酵母EPS产量较高且属于中低分子质量的多糖,表现出很强的抗氧化能力,且具有一定的乳化稳定性及高持水性,为酵母EPS在食品及医药方面[11]的应用奠定了一定的基础。 但是酵母EPS在化妆品领域应用研究鲜少报道,酵母EPS在皮肤上的保湿性能及对皮肤损伤的修护效果几乎空白。
本研究基于从酿酒厂酵池中分离得到的一株酵母菌株,对其进行菌种鉴定,研究其产胞外多糖的影响因素,通过优化培养条件获取最佳产胞外多糖的发酵条件,通过人体功效测试评价胞外多糖的保湿功效,同时通过体外细胞模型评价胞外多糖在修护方面的功效,为胞外多糖在化妆品中的应用奠定基础。
1 材料与方法
1.1 材料与试剂
酵母菌株Y-ESP-7:分离于酿酒厂酵池,本实验室保存;葡萄糖(分析纯):国药集团化学试剂有限公司;硫酸镁、磷酸氢二钾、NaCl、硫酸铵、氯化钙等(均为分析纯):西陇科学股份有限公司;苯酚(分析纯):上海麦克林化学试剂有限公司;浓硫酸(分析纯):永华化学股份有限公司。
杜氏改良Eagle培养基(高糖型)、胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(0.25%):美国gibco公司;胎牛血清:武汉博士德生物工程有限公司;酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基、WL营养琼脂培养基:青岛海博生物技术有限公司。
基础产糖培养基:葡萄糖15 g,硫酸铵15 g,硫酸镁1.8 g,氯化钙0.3 g,磷酸氢二钾0.25 g,氯化钠0.6 g,蒸馏水1 L,pH值7.0,于121 ℃灭菌15 min。
1.2 仪器与设备
LDZX-50KBS灭菌锅:上海申安医疗器械厂;LRH-250微生物培养箱:上海智城有限公司;UV1900紫外可见分光光度计:日本岛津公司;MDD4-Corneometer CM825皮肤水份测试仪、Visioscan VC 20plus皮肤纹理分析系统:德国CK公司;CLM-170B-8-CN CO2培养箱:新加坡艺思高科技有限公司;BSC-1300IIA2生物安全柜:孚夏医疗科技有限公司;Ts2倒置显微镜:日本Nikon公司。
1.3 方法
1.3.1 菌种产糖性能测定
将活化菌株接种(接种量5%)到基础产糖液体培养基中,28 ℃、180 r/min培养5 d,发酵培养完成后4 000 r/min离心10 min去除菌体,提取上清液中胞外粗多糖,采用苯酚-硫酸法测定多糖含量[13]。
1.3.2 菌种鉴定
形态学观察:将实验室保藏菌株接种到YPD液体培养基中于28 ℃培养2 d进行活化,再用三区划线转接于基础产糖和WL营养琼脂培养基,28 ℃培养3 d,观察菌株在基础产糖和WL营养琼脂培养基上的形态,并挑取单菌落制备稀释液后镜检观察细胞形态[12]。
分子生物学鉴定:采用真菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒提取优良菌株的基因组DNA,以基因组DNA为模板,采用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')聚合酶链式反应(polymerase chain reaction,PCR)扩增18S rDNA-ITS基因序列。 PCR扩增体系:10×ExTaq buffer 2.0 μL,ExTaq酶(5 U)0.2 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleo side triphosphate,dNTP)Mix 21 μL,上、下游引物各1 μL,基因组DNA 2 μL。PCR扩增条件:96 ℃预变性5 min;96 ℃变性20 s,56 ℃退火30 s,72 ℃延伸30 s,进行35个循环;72 ℃终延伸10 min。取PCR扩增产物用1.0%琼脂糖凝胶电泳检测,将检测合格的PCR扩增产物委托北京六合华大基因科技有限公司进行测序。 将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)(https://www.ncbi.nlm.nih.gov)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,选取同源性较高的模式菌株的18S rDNA-ITS基因序列,采用MEGA 11.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树[14-15]。
1.3.3 胞外多糖的制备
胞外粗多糖制备:将活化的菌种接种一环到基础产糖培养基,28 ℃培养2 d得到种子液,种子液按照5%(V/V)接种量接种到基础产糖培养基,180 r/min、28 ℃培养5 d,发酵培养完成后4 000 r/min离心10 min,取上清液醇沉(加入3倍体积95%无水乙醇,4 ℃冷藏静置24 h,12 000 r/min离心10 min)得沉淀,沉淀用水溶解,加入三氯乙酸(终浓度10%),8 000 r/min离心20 min,取上清液醇沉[16],取沉淀进行真空冷冻干燥,得到胞外粗多糖。
胞外多糖纯化:胞外粗多糖用去离子水溶解后,采用DEAE纤维素DE-52离子交换柱层析,去离子水、0.1 mol/L NaCl、0.3 mol/L NaCl和0.5 mol/L NaCl溶液进行梯度洗脱,流速为1 mL/min,每个梯度分别收集洗脱液(10 mL/管)20管[9],用苯酚-硫酸法跟踪检测[13],合并相同组分,浓缩,用去离子水透析3 d除去小分子杂质及无机盐,真空冷冻干燥得胞外多糖冻干粉[17]。
1.3.4 胞外多糖含量的测定
采用苯酚-硫酸法测定[13],分别吸取质量浓度为0.2mg/mL的葡萄糖0、0.2 mL、0.4 mL、0.6 mL、0.8 mL和1.0 mL于试管中,补蒸馏水至2 mL,再加入1 mL苯酚(6%)和5 mL浓硫酸。充分混合后静置20~30 min,测量波长490 nm处吸光度值。 以吸光度值(y)和葡萄糖质量浓度(mg/mL)作回归方程[18]。将1 mL样品和1 mL的水加入洁净试管中,再加入1 mL苯酚(6%)和5 mL浓硫酸,测得波长490 nm处的吸光度值,根据回归方程可计算得到样品多糖含量。
1.3.5 培养条件优化单因素试验
参照康雨芳[17]的方法,将种子液按照5%比例接种到基础产糖培养基,28 ℃、180 r/min条件下振荡培养5 d,每组试验重复进行3次。 分别考察接种量(3%、4%、5%、6%、7%)、pH值(4、5、6、7、8)、葡萄糖添加量(15 g/L、30 g/L、45 g/L、60 g/L、75 g/L)、磷酸氢二钾添加量(0.15 g/L、0.20 g/L、0.25 g/L、0.30g/L、0.35g/L)、氯化钙添加量(0.18 g/L、0.24 g/L、0.30 g/L、0.36 g/L、0.42 g/L)、氯化钠添加量(0.4 g/L、0.5 g/L、0.6 g/L、0.7 g/L、0.8 g/L)、硫酸镁添加量(0.6 g/L、1.2 g/L、1.8g/L、2.4g/L、3.0g/L)及硫酸铵添加量(9g/L、12 g/L、15 g/L、18 g/L、21 g/L)对酵母胞外多糖产量的影响。
1.3.6 培养条件优化响应面试验
在单因素试验结果的基础上,采用Design-Expert 13.0设计Box-Behnken试验响应面试验优化发酵条件,以胞外多糖含量(Y)为响应值,以影响胞外多糖产量的3个因素葡萄糖添加量(A)、硫酸镁添加量(B)、磷酸氢二钾添加量(C)为自变量,设计3个水平的响应面试验,每组试验重复3次,响应面试验因素与水平见表1。
表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for fermentation conditions optimization
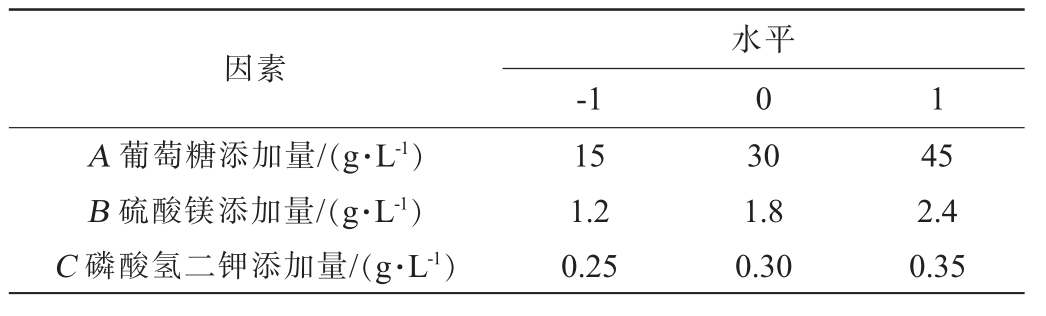
因素-1水平0 1 A 葡萄糖添加量/(g·L-1)B 硫酸镁添加量/(g·L-1)C 磷酸氢二钾添加量/(g·L-1)15 1.2 0.25 30 1.8 0.30 45 2.4 0.35
1.3.7 人体保湿功效评价
制备对照组和试验组两个霜(对照组霜配方组成:0.25%卡波姆、5%丁二醇、2%硬脂醇聚醚-21、0.5%硬脂醇聚醚-2、5%向日葵籽油、1%蜂蜡、0.5%苯氧乙醇及0.5%1,2己二醇;试验霜为对照组霜加0.5%胞外多糖冻干粉),涂抹于人体皮肤手臂内侧,测量皮肤初始及在涂抹样品1 h后的皮肤水分含量和皮肤纹理。皮肤水分测试方法参照甄育等[19]的方法,皮肤纹理测试方法参照李文昭等[20]的方法,与对照组比较,评价胞外多糖的保湿滋润性能。
1.3.8 修护体外功效评价
参照张泽曦等[21]的方法,将人永生化角质形成细胞(HaCaT)加入6孔板中,放入CO2培养箱中孵育24 h。 去除培养液后用1 mL移液器枪头进行划痕,再用磷酸盐缓冲液(phosphate buffer solution,PBS)清洗除去漂浮细胞。 加入受试样品,试验设置空白对照组、阳性对照组与样品组,分别加入无血清培养基、含2.5%血清培养基与无血清培养基的0.007%EPS。 拍摄划痕照片,孵育24 h,再次拍摄相同视野下划痕照片。计算划痕处面积,用24 h划痕相对愈合率评估细胞的增殖迁移能力,计算公式如下:

1.3.9 数据处理
采用Graphpad Prism 5.0软件进行数据统计与分析及绘图,利用Design-Expert 13.0软件进行试验设计及数据分析。人体保湿功效评价测试基于16个有效测试数据,采用Excel 2016进行统计分析。ImageJ软件进行划痕面积的计算。
2 结果与分析
2.1 菌种Y-ESP-7产糖性能测定
菌株Y-ESP-7在基础产糖琼脂培养基上菌落呈现状态为微黄色,大且粘稠,挑起时拉丝感强。胞外多糖的产量为(329±9)mg/L,判定菌株Y-ESP-7具有较强的产胞外多糖的能力。
2.2 菌种Y-ESP-7鉴定
2.2.1 形态学观察结果
菌株Y-ESP-7菌落及细胞形态见图1。如图1a可知,WL培养基上菌落直径较大,菌落最中心微微突起,中间偏透明,四周呈奶白色不透明,边缘不规则有褶皱,且菌落周围培养基颜色发生改变,菌落粘稠挑起有拉丝;由图1b可知,细胞呈圆形或椭圆形,表现出明显的出芽生殖,符合酵母菌的形态特征[12]。
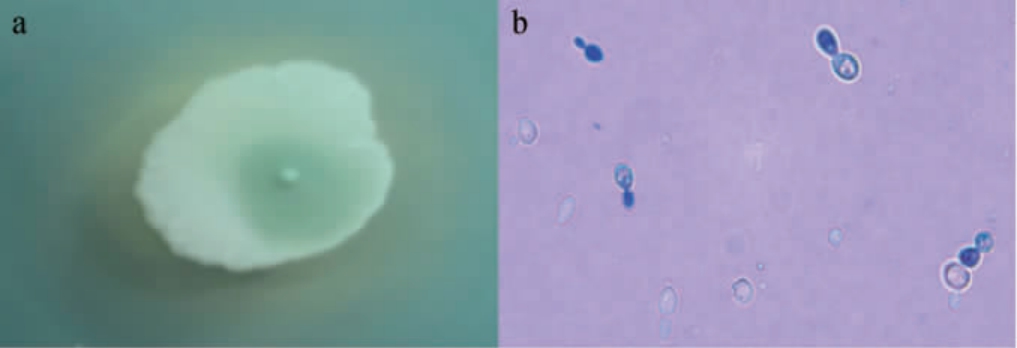
图1 菌株Y-ESP-7在WL培养基上的单菌落形态(a)及细胞形态(b)
Fig.1 Single colony morphology (a) and cell morphology (b) of strain Y-ESP-7 in WL medium
2.2.2 分子生物学鉴定结果
菌株Y-ESP-7的PCR扩增产物结果及构建的菌株系统发育树见图2。

图2 菌株Y-ESP-7的PCR扩增产物电泳结果(a)及基于18S rRNA基因序列构建的系统发育树(b)
Fig.2 Electrophoresis results of PCR amplification products of strain Y-ESP-7 (a) and phylogenetic tree constructed based on 18S rRNA gene sequence(b)
由图2a可知,菌株Y-ESP-7的DNA经过PCR扩增后,PCR扩增产物用1.0%琼脂糖凝胶电泳检测,在500~750 bp之间出现清晰的条带。由图2b可知,菌株Y-ESP-7与数据库已有异常威克汉姆酵母(Wickerhamomyces anomalus)同源性达100%,属同一分支,结合形态特征,确定产EPS的菌株Y-ESP-7为异常威克汉姆酵母(Wickerhamomyces anomalus)。
2.3 单因素试验结果与分析
为了考察菌株最佳的培养条件,考察不同接种量、pH值、葡萄糖、磷酸氢二钾、氯化钙、氯化钠、硫酸镁、硫酸铵对菌株胞外多糖产量的影响,结果见图3。
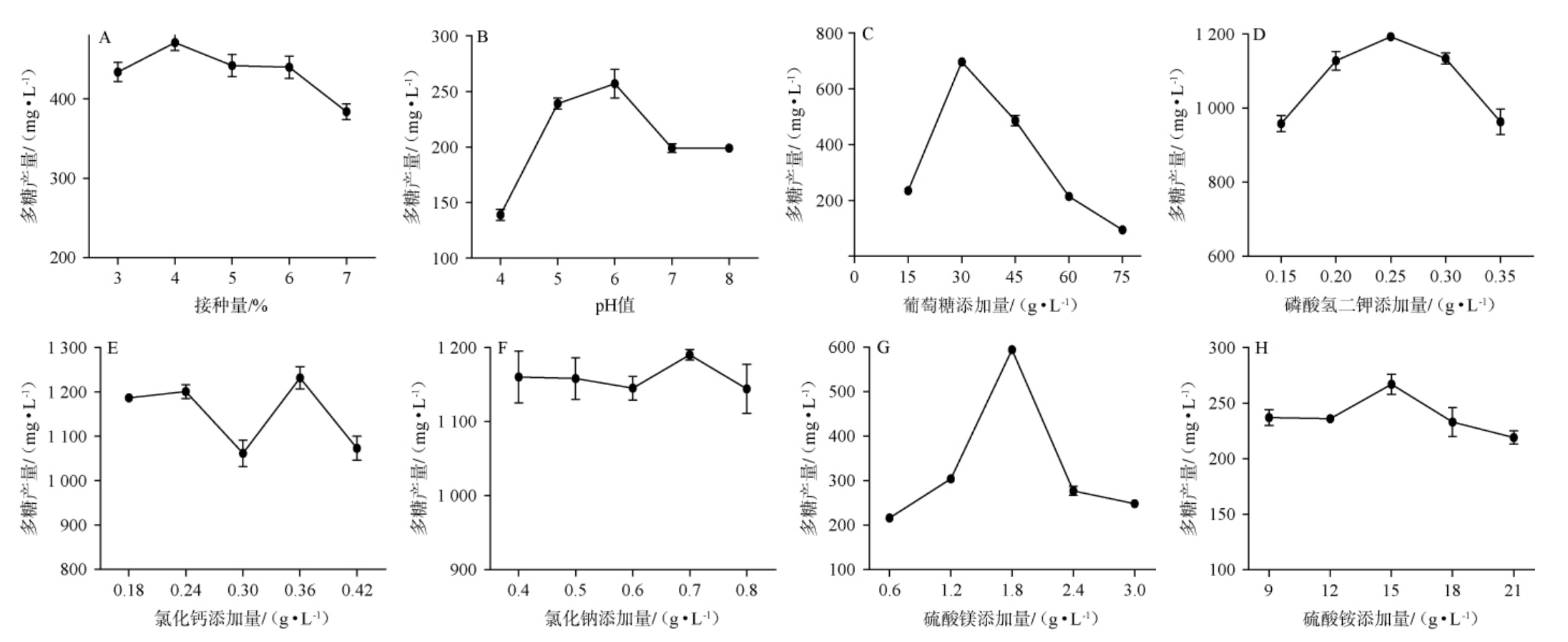
图3 各单因素对多糖产量的影响
Fig.3 Effects of each single factor on polysaccharide yields
由图3A可知,随着接种量的增大,多糖产量呈先上升后下降的趋势,且接种量为4%时胞外多糖(EPS)产量最高,为(471±10)mg/L。接种量为4%~7%之间多糖含量逐步下降,可能是由于随着接种量的增大,培养基体系中的营养物质用来供给菌体的增殖,从而减少了菌体产生胞外多糖等代谢产物。因此,选择最佳接种量为4%。由图3B可知,pH值由4.0上升到8.0,EPS产量呈先上升后下降的趋势,在培养基pH值为6时,EPS产量最高为(257±13)mg/L。因此,选择最佳pH值为6。 由图3C可知,当葡萄糖添加量逐渐增大时,EPS产量呈先上升后下降的趋势,当葡萄糖添加量为30 g/L时,EPS产量最高为(697±7)mg/L。 是葡萄糖添加量为15 g/L时EPS产量的近3倍,是葡萄糖添加量为75 g/L时EPS产量的近7倍。因此,选择最佳葡萄糖添加量为30 g/L。由图3D可知,随着磷酸氢二钾添加量在0.15~0.35 g/L范围内的增大,EPS产量呈先上升后下降,在磷酸氢二钾添加量为0.25 g/L时,EPS产量最高为(1 193±13)mg/L,是磷酸二氢钾添加量为0.15 g/L时的1.25倍。因此,选择最佳磷酸二氢钾添加量为0.25 g/L。由图3E可知,随着氯化钙添加量的增大,EPS产量呈先下降后上升再下降的趋势,当氯化钙添加量为0.36 g/L时胞外多糖产量达到最高值,为(1 232±25)mg/L。因此,选择最佳氯化钙添加量为0.36 g/L。
由图3F可知,随着氯化钠添加量的增大,EPS产量呈先上升再下降的趋势,氯化钠添加量为0.7 g/L时,胞外多糖含量达到最高值为(1 190±3)mg/L。因此,选择最佳氯化钠添加量为0.7 g/L。由图3G可知,随着硫酸镁添加量增大,EPS产量先上升再下降,当硫酸镁添加量为1.8 g/L时,产EPS最多为(594±5)mg/L。 是硫酸镁添加量为0.6 g/L时多糖产量的近3倍。因此,选择最佳硫酸镁添加量为1.8 g/L。由图3H可知,随着硫酸铵添加量在9~21 g/L范围内的增加,EPS产量呈现先上升后下降的趋势,当硫酸铵添加量为15g/L时,胞外多糖含量达到最高值为(267±9)mg/L,因此,选择最佳硫酸铵添加量为15g/L。葡萄糖、磷酸氢二钾和硫酸镁添加量对胞外多糖生成的影响大,因此将其作为响应面试验的自变量。
2.4 响应面试验结果
根据单因素试验结果,以菌株Y-ESP-7产胞外多糖含量(Y)为响应值,以葡萄糖添加量(A)、硫酸镁添加量(B)和磷酸氢二钾添加量(C)为自变量,采用Design-Expert 13.0软件进行3因素3水平响应面优化试验设计,结果见表2,方差分析结果见表3。
表2 发酵条件优化响应面试验设计及结果
Table 2 Design and results of response surface experiments for fermentation condition optimization
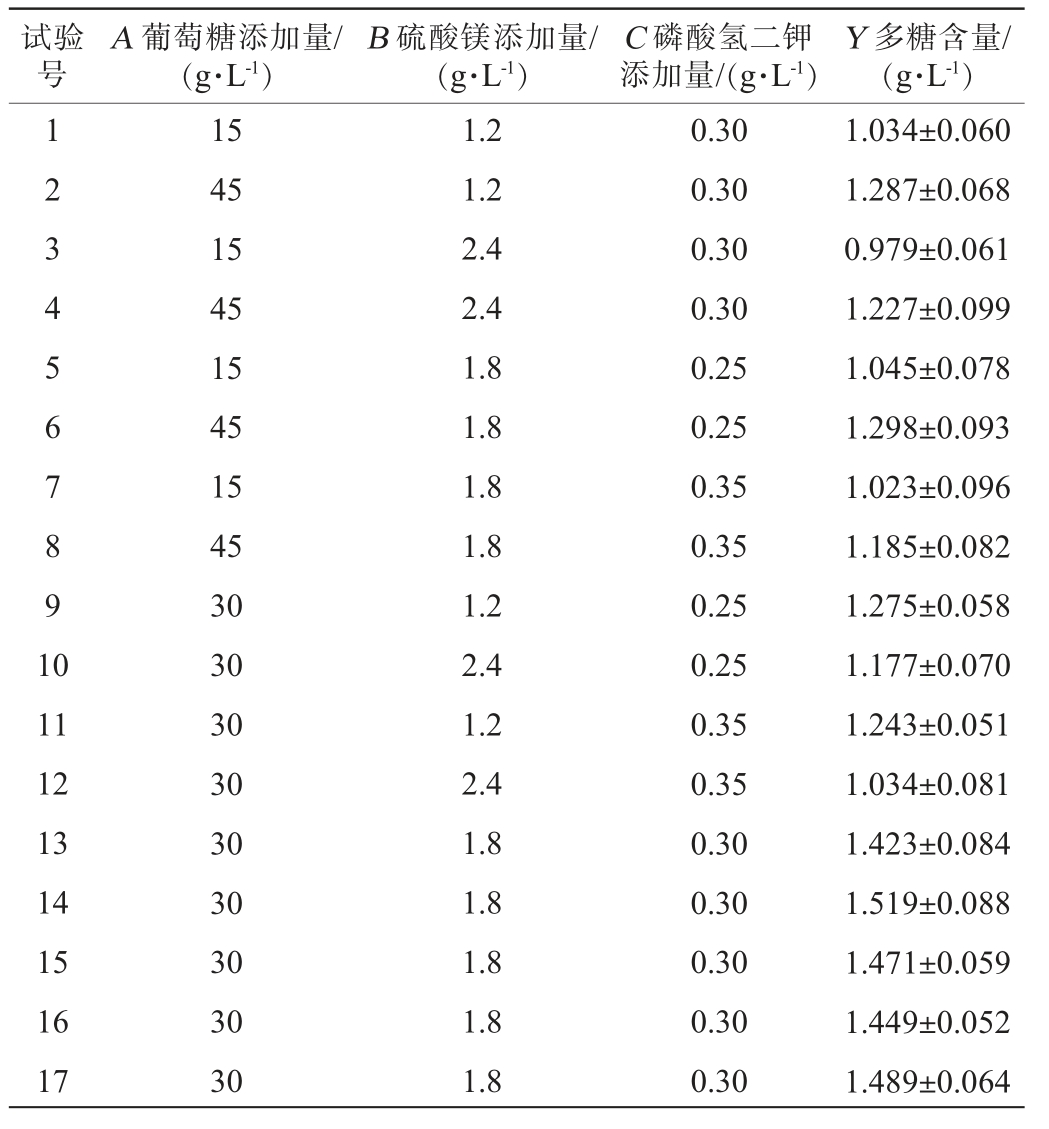
试验号A 葡萄糖添加量/(g·L-1)B 硫酸镁添加量/(g·L-1)C 磷酸氢二钾添加量/(g·L-1)Y 多糖含量/(g·L-1)1234567891 0 11 12 13 14 15 16 17 15 45 15 45 15 45 15 45 30 30 30 30 30 30 30 30 30 1.2 1.2 2.4 2.4 1.8 1.8 1.8 1.8 1.2 2.4 1.2 2.4 1.8 1.8 1.8 1.8 1.8 0.30 0.30 0.30 0.30 0.25 0.25 0.35 0.35 0.25 0.25 0.35 0.35 0.30 0.30 0.30 0.30 0.30 1.034±0.060 1.287±0.068 0.979±0.061 1.227±0.099 1.045±0.078 1.298±0.093 1.023±0.096 1.185±0.082 1.275±0.058 1.177±0.070 1.243±0.051 1.034±0.081 1.423±0.084 1.519±0.088 1.471±0.059 1.449±0.052 1.489±0.064
表3 回归模型方差分析
Table 3 Variance analysis of regression model
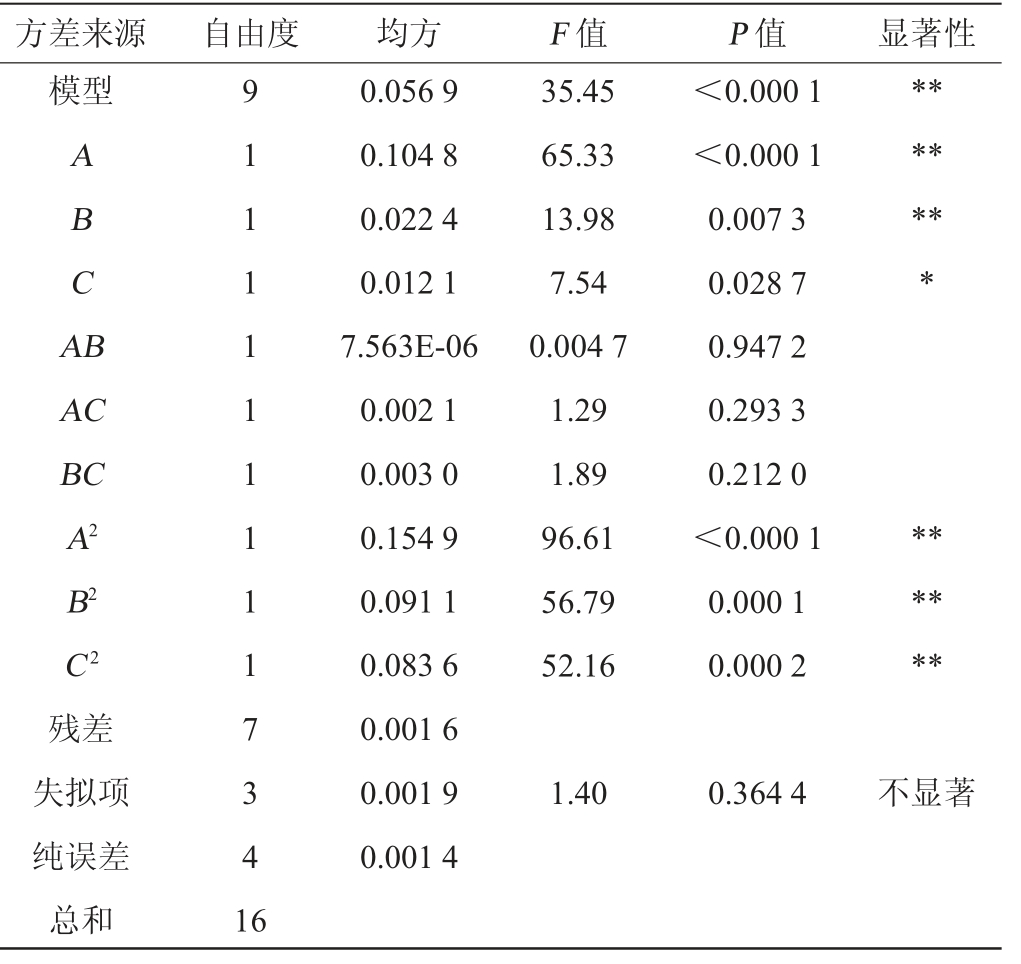
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
方差来源自由度均方F 值P 值显著性模型ABCA B*******AC BC A2 B2 C2残差失拟项纯误差总和91111111117341 6 0.056 9 0.104 8 0.022 4 0.012 1 7.563E-06 0.002 1 0.003 0 0.154 9 0.091 1 0.083 6 0.001 6 0.001 9 0.001 4 35.45 65.33 13.98 7.54 0.004 7 1.29 1.89 96.61 56.79 52.16<0.000 1<0.000 1 0.007 3 0.028 7 0.947 2 0.293 3 0.212 0<0.000 1 0.000 1 0.000 2******1.40 0.364 4不显著
使用Design-Expert 13.0软件对表2中的试验数据及结果进行多元二次回归拟合分析,得到菌株Y-ESP-7产胞外多糖(Y)对葡萄糖添加量(A)、硫酸镁添加量(B)和磷酸氢二钾添加量(C)的二阶多项回归模型方程为:Y=1.47+0.114 4A-0.052 9B-0.038 9C-0.001 4AB-0.022 7AC-0.027 5BC-0.1918A2-0.1471B2-0.1409C2。
由表3可知,总模型极显著(P<0.000 1),说明模型有意义。失拟项不显著(P=0.364 4>0.05),说明该模型误差小、拟合程度好且可靠性高。 决定系数R2=0.978 5,说明97.85%的多糖含量变化可以用回归模型方程来解释。调整决定系数R2Adj=0.950 9>0.9,也表示了该回归模型相关性高,拟合程度好。 通过F值得到,这3个因素对菌株Y-ESP-7胞外多糖产量的影响为葡萄糖添加量>硫酸镁添加量>磷酸氢二钾添加量。通过P值可知,葡萄糖添加量(A)、硫酸镁添加量(B)、二次项A2、B2和C2对EPS产量影响极显著(P<0.01)。磷酸氢二钾添加量(C)对EPS产量影响显著(P<0.05)。
根据回归模型得出最佳发酵条件为:葡萄糖添加量43.756 g/L,硫酸镁添加量1.701 g/L,磷酸氢二钾添加量0.290 g/L,该优化培养条件下预计菌株Y-ESP-7可产生的EPS为1.424 g/L。根据实际操作条件对参数进行了修正:葡萄糖添加量为44 g/L,硫酸镁添加量为1.7 g/L,磷酸氢二钾添加量为0.3 g/L,在此条件下,菌株Y-ESP-7胞外多糖产量实际值为(1.394±0.025)g/L,与预测值基本吻合,表明该模型可靠。
2.5 胞外多糖的纯化
胞外粗多糖经DEAE-52 Cellulose离子交换柱层析分离后,以各洗脱液管在波长490 nm下的吸光度值和NaCl浓度为纵坐标,收集的管数为横坐标绘制洗脱曲线,结果见图4。由洗脱曲线可知,通过NaCl溶液梯度洗脱,分离获得4种组分:EPS1、EPS2、EPS3和EPS4,其中中性多糖EPS1是主要组分[9]。胞外多糖EPS1用于后续的保湿及修护功效测试。
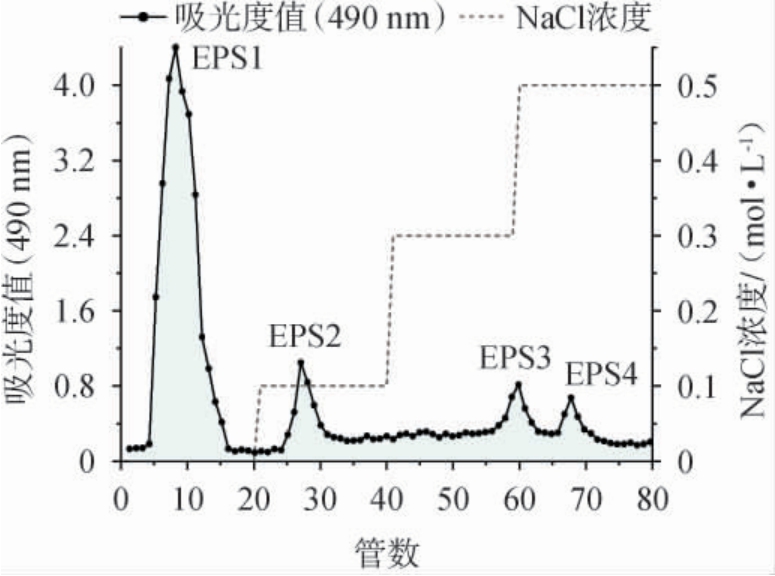
图4 DEAE-52纤维柱洗脱曲线
Fig.4 Elution curve of DEAE-52 fiber column
2.6 胞外多糖的保湿功效
2.6.1 皮肤水分含量
皮肤角质层水分含量可以直接反映皮肤的保湿能力,与皮肤的紧致度、衰老及生理功能密切相关[22]。皮肤角质层水分含量数值越大代表皮肤越保湿,当皮肤角质层的水分含量充足时,皮肤维持柔软有弹性、细嫩光滑且透亮的状态,当皮肤角质层含水量过低时,皮肤会出现粗糙干燥、暗哑甚至起皮屑泛红瘙痒等症状[23]。使用含胞外多糖冻干粉的面霜后人体皮肤水分含量变化测试结果见图5。
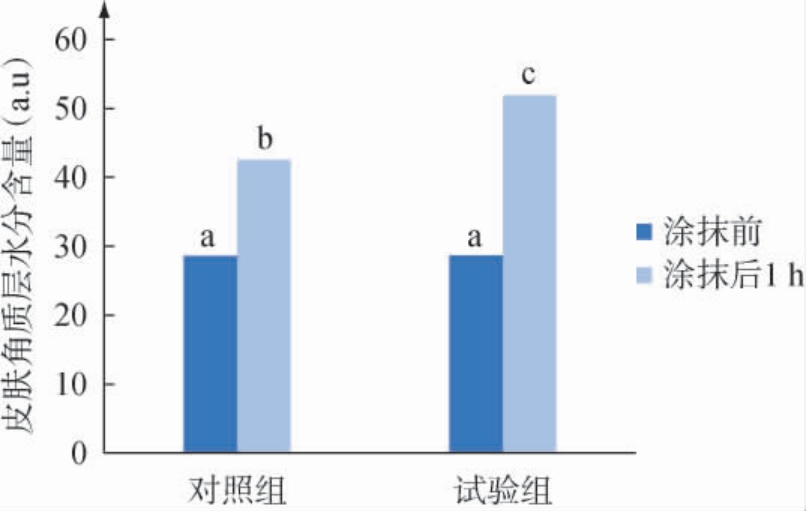
图5 胞外多糖冻干粉面霜对皮肤角质层水分含量的影响
Fig.5 Effect of extracellular polysaccharide freeze-dried powder cream on the moisture contents of the skin stratum corneum
不同字母代表具有显著性差异(P<0.05)。下同。
由图5可知,与使用前比较,使用对照组和试验组样品1 h后,人手臂皮肤角质层水分含量均出现明显提高,且对照组和试验组在未使用样品前手臂皮肤角质层水分含量无显著性差异(P>0.05),提示测试前区域随机分配合理。试验组与对照组相比,涂抹皮肤1 h后平均角质层水分含量提升了22.0%,且组间差异性显著(P<0.05),说明添加0.5%胞外多糖的霜较不添加胞外多糖的霜具有明显的提升皮肤角质层水分含量的功效,即胞外多糖能够提高皮肤角质层保湿能力。
2.6.2 皮肤纹理皮肤纹理可反映出皮肤的光滑程度,即皮肤保湿性越好,皮肤更水润,皮肤细纹更轻微。皮肤纹理参数SEw值越大,皮肤表面越粗糙,即皮肤越不保湿滋润。 使用含胞外多糖冻干粉的面霜后对人体皮肤纹理参数SEw值的影响见图6。
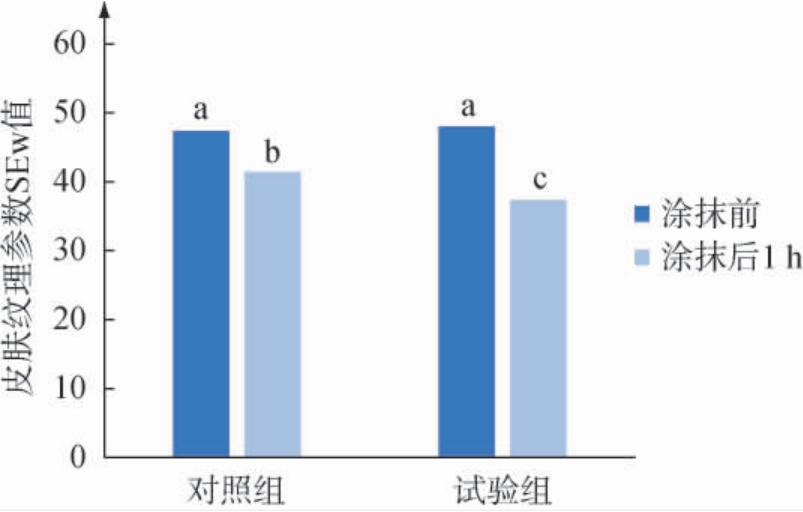
图6 胞外多糖冻干粉面霜对皮肤纹理参数SEw值的影响
Fig.6 Effect of extracellular polysaccharide freeze-dried powder cream on skin texture parameters SEw values
由图6可知,与使用前比较,使用对照组和试验组样品1 h后,人手臂皮肤纹理参数SEw值均出现明显下降,且对照组和试验组在未使用样品前手臂皮肤纹理参数SEw值无显著性差异(P>0.05),提示测试前区域随机分配合理。试验组与对照组相比,皮肤涂抹样品1 h后平均皮肤纹理参数SEw值下降了9.7%,且组间差异性显著(P<0.05),说明添加0.5%胞外多糖的霜较不添加胞外多糖的霜具有明显的降低皮肤纹理参数SEw值的作用,即胞外多糖能够改善皮肤表面粗糙,具有滋润保湿的功效。
2.7 胞外多糖的修护功效
修护是指有助于维持施用部位保持正常状态的功效[24]。细胞迁移在体内的生理活动中包含了对微小伤口的愈合作用,与化妆品淡化皮肤纹理、促进皮肤损伤愈合等修护功效的目的相似,表皮细胞作为皮肤创伤修复过程中重要参与细胞,其增殖、迁移越快,皮肤愈合越快,皮肤修护越强[25]。HaCaT细胞在给药前后的划痕处面积及相对划痕愈合率见表4,各处理组划痕后不同时间点的HaCaT细胞增殖迁移情况见图7。
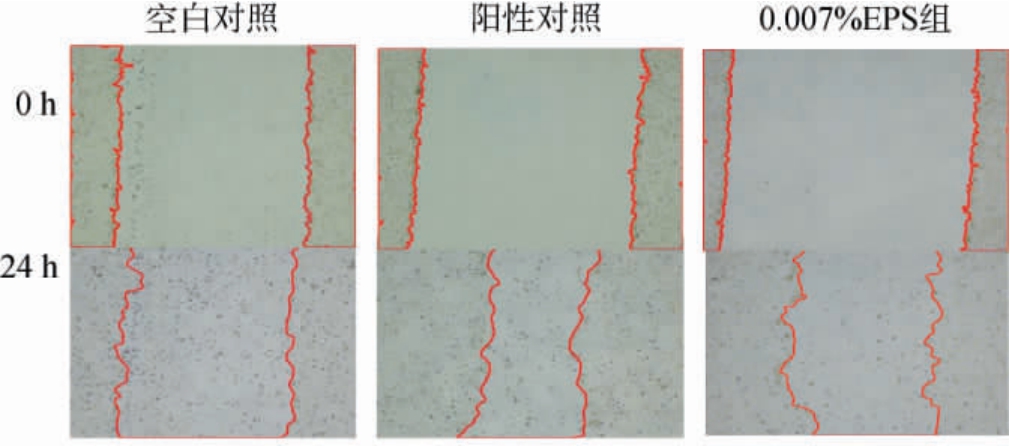
图7 各处理组划痕后不同时间点的HaCaT细胞增殖迁移情况
Fig.7 Proliferation and migration of HaCaT cells at different time points after scratching in each treatment group
表4 HaCaT细胞增值迁移结果
Table 4 Result of HaCaT cell proliferation and migration
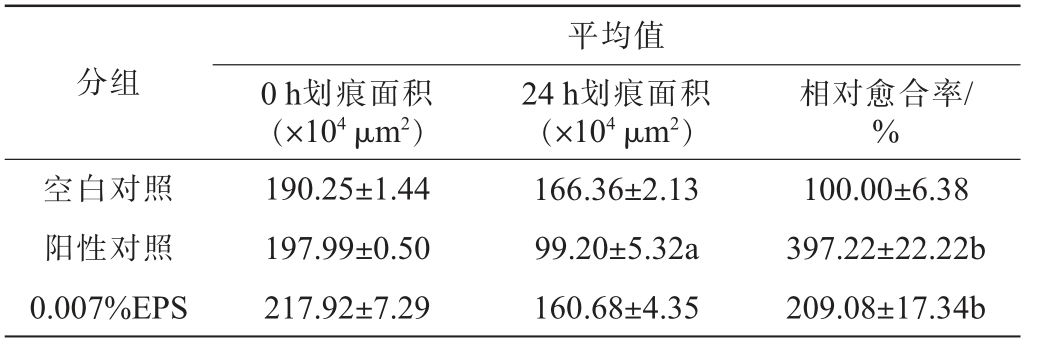
注:a代表与0 h划痕面积相比有高度显著性差异(P<0.001);b代表与空白对照组相比有高度显著性差异(P<0.001)。
分组0 h划痕面积(×104 μm2)平均值24 h划痕面积(×104 μm2)相对愈合率/%空白对照阳性对照0.007%EPS 190.25±1.44 197.99±0.50 217.92±7.29 166.36±2.13 99.20±5.32a 160.68±4.35 100.00±6.38 397.22±22.22b 209.08±17.34b
由表4可知,阳性对照组24 h与0 h相比,划痕面积高度显著减少(P<0.001),且相对于空白对照的愈合率为(397.22±22.22)%,0.007%EPS组相对于空白对照的愈合率为(209.08±17.34)%,与空白对照组高度显著。由图7可知,酵母胞外多糖在24 h内能显著促进HaCaT细胞不断增殖且由划痕边缘向损伤中心处迁移。
3 结论
本研究对菌株Y-ESP-7进行形态学及分子生物学鉴定,通过单因素和响应面试验,获得该菌株产EPS的最佳培养条件。 结果表明,该菌株被鉴定为异常威克汉姆酵母(Wickerhamomyces anomalus),最佳培养条件为葡萄糖添加量44 g/L,硫酸镁添加量1.7 g/L,磷酸氢二钾添加量0.3 g/L,氯化钠添加量0.7 g/L,硫酸铵添加量15 g/L,氯化钙添加量0.36 g/L,EPS的产量为(1 394±25)mg/L。 另外初步研究表明该EPS具有良好的体外修护能力及人体皮肤的保湿滋润效果,异常威克汉姆酵母EPS有作为一种具有保湿滋润、皮肤修护促进创面愈合功效的化妆品活性功能原料的潜力。在此基础上,正在开展该胞外多糖的成分分析、流变性能研究及其它活性功能研究,同时对其在化妆品中的应用特性及在皮肤上使用的安全性进行探究,为酵母胞外多糖的功效挖掘及在功效型化妆品中的应用提供参考和指导。
[1]KURTZMAN C P,FELL J W,BOEKHOUT T.The Yeasts:A taxonomic study definition,classification and nomenclature of the yeasts[M].Amsterdam:Elsevier Science Publishers,2011.
[2]鲍佳生,潘丙珍,乔栖梧,等.酵母生物活性物质及其化妆品功效研究进展[J].生物技术进展,2023,13(3):345-352.
[3]MIZUNO M,SHIOMI Y,MINATO K I,et al.Fucogalactan isolated from Sarcodon aspratus elicits release of tumor necrosis factor-α and nitric oxide from murine macrophages[J].Immunopharmacology,2000,46(2):113-121.
[4]马岩石,刘韩,裴芳艺.产胞外多糖酵母菌的分离鉴定及其发酵条件优化[J].食品研究与开发,2020,41(14):68-76.
[5]刘丽娜,杜仁鹏,徐家菊,等.产胞外多糖酵母菌的筛选鉴定及发酵条件优化[J].黑龙江大学自然科学学报,2023,40(2):199-208.
[6]LIU L, XU J, DU R P, et al.The response surface optimization of exopolysaccharide produced by Saccharomyces cerevisiae Y3 and its partial characterization[J].Prep Biochem Biotech,2021,52(5):11-12.
[7]LIU L,XU J,NA R Y,et al.Purification,characterization and partial biological activities of exopolysaccharide produced by Saccharomyces cerevisiae Y3[J].Int J Biol Macromol,2022,206:777-787.
[8]XUE D,PEI F Y,LIU H N,et al.Evaluation of antioxidation,regulation of glycolipid metabolism and potential as food additives of exopolysaccharide from Sporidiobolus pararoseus PFY-Z1[J].Prep Biochem Biotech,2023,53(10):11.
[9]马文锦,李梅林,王博,等.胶红酵母Rhodotorula mucilaginosa CICC 33013胞外多糖的分离纯化及抗氧化活性研究[J].食品与发酵工业,2019,45(11):65-70.
[10]马文锦,李梅林,王博,等.胶红酵母CICC 33013胞外多糖抑制肝癌细胞活性研究[J].食品与机械,2020,36(2):159-164.
[11]朱金峰,裴芳艺,刘振艳,等.锁掷孢酵母胞外多糖体外抗氧化和调节糖脂代谢的研究[J].中国酿造,2023,42(6):109-115.
[12]胡瑞卿,方善康.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:120-180.
[13]LI Q, LI Y M, HAN S, et al.Optimization of fermentation conditions and properties of an exopolysaccharide from Klebsiella sp.H-207 and application in adsorption of hexavalent chromium[J].Plos One,2013,8(1):e53542.
[14]YU Q,MOU F Y,XIAO J W,et al.Correlational analysis of physicochemical indexes, microbial communities, and volatile components in lightflavor Daqu from north and south regions of China[J].World J Microb Biot,2024,40(2):54.
[15]何夷敏,牟飞燕,张维,等.清香型白酒大曲中产酶产香霉菌的筛选、鉴定及耐受性研究[J].中国酿造,2024,43(11):58-63.
[16]赵英杰,张文平,吴剑梅,等.乳扇中高产胞外多糖酵母菌的筛选及其抗氧化活性[J].食品科学,2019,40(22):134-140.
[17]康雨芳.胶红酵母胞外多糖结构、活性及降解产物的研究[D].西安:陕西科技大学,2018.
[18]叶广彬,陈源红,王长丽,等.柠檬明串珠菌TD1产胞外多糖条件的响应面法优化及其抗氧化性研究[J].中国酿造,2018,37(11):70-75.
[19]甄育,胡晓旭,张璐鸥,等.化妆品皮肤安全检测和功效检测标准方法[J].生态毒理学报,2024,19(4):88-99.
[20]李文昭,蒋晴,唐礼荣.化妆品保湿与皮肤纹理的相关性研究[J].日用化学品科学,2022,45(1):27-31.
[21]张泽曦,李墨灵,杜天乐,等.血清含量对HaCaT细胞生长特性及迁移能力的影响[J].天津中医药大学学报,2015,34(6):369-372.
[22]彭晏,丁文锋,李志林,等.一种含多肽的保湿原料的制备及其在化妆品中的应用[J].香料香精化妆品,2023(5):64-68.
[23]王春晓,赵华.化妆品功效评价(Ⅱ)——保湿功效宣称的科学支持[J].日用化学工业,2018,48(2):67-72.
[24]马嘉.走向规范化妆品进入功效评价时代[J].中国商界,2022(4):100-101.
[25]蒋艳.富组蛋白1促进人表皮细胞,人成纤维细胞增殖和迁移在创伤愈合中的作用及机制研究[D].重庆:第三军医大学,2012.