固态法白酒是指在蒸煮、糖化、发酵、蒸馏等主要过程中采用固态基质形态生产出的白酒。 藜麦酒以藜麦(Chenopodium quinoa Willd.)为原料通过固态法酿造而成[1],但酿造后藜麦酒氧化活性物质损失较大,且风味单一。 因此,需要改良其生产工艺以提高藜麦酒的抗氧化活性,改良后的藜麦酒主要有:藜麦配制酒(在固态法白酒里添加了藜麦提取物)[2]、藜麦配糟酒(在高粱糖化醅中添加藜麦酒糟混合发酵后蒸馏得到)[3]、藜麦串蒸酒(藜麦发酵醅作为上层醅、高粱发酵醅作为底层醅,进行串蒸得到的固态法白酒)[4]。 改良后藜麦酒体中富含多酚[5]、黄酮、皂苷等活性成分[6-7],具有降低血脂、软化血管、防治心血管疾病等作用[8-9]。
目前,有关藜麦酒研究集中在抗氧化活性成分分析及健康功能方面。 针对抗氧化活性检测,比色法为常用的检测方法,即利用某物质,如总氧化法中的钼、自由基清除法中的1,1二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基等在紫外分光光度计的特定波长处产生光密度(optical density,OD)值变化来反映抗氧化活性的强弱[10],此检测方法会受到样品中美拉德反应产物[11]、原料成分本身颜色[12-13]的干扰,影响抗氧化活性检测的准确性。电子自旋共振(electron spin resonance,ESR)是一种快速、简单、直接的检测方法[14-15],能以谱图的形式直接反映自由基的种类及数量[16],相比于其他抗氧化活性检测法,能排除藜麦酒自身颜色对抗氧化活性检测的准确性。BARTOSZEK M等[17]运用ESR技术检测草药抗氧化活性发现,ESR具有高度灵敏性与准确性,使其能精准建立多草药中的多酚与其抗氧化活性的关系,郑坚强等[18]采用ESR技术研究枸杞提取液抗氧化活性时发现,枸杞中的番茄红素等物质会造成紫外法检测抗氧化活性不准确,而使用ESR技术并以抗氧化活性为指标,优化的枸杞提取液的抗氧化活性其理论值与真实值具有高度一致性。目前鲜见ESR技术用于配制酒抗氧化活性检测的相关报道。
该研究采用电子自旋共振(ESR)技术研究藜麦酒对1,1-二苯基-2-三硝基苯肼(DPPH)自由基、超氧阴离子自由基、羟自由基清除能力的影响,并在此基础上对四种工艺的藜麦酒进行抗氧化活性测定,旨在分析比色法检测藜麦酒体样品抗氧化活性的误差来源,为完善藜麦酒产品抗氧化剂的检测方法以及深入研究藜麦活性成分提供参考依据。
1 材料与方法
1.1 材料与试剂
藜麦配制酒、藜麦提取物、藜麦配糟酒、藜麦发酵酒、藜麦串蒸酒(均为50%vol):劲牌有限公司;氢氧化钠、无水乙醇:天津市永大化学试剂有限公司;盐酸、双氧水(30%过氧化氢):烟台市双双化工有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、5,5-二甲基-1-吡咯啉-N-氧化物(5,5-dimethyl-1-pyrroline N-oxide,DMPO):上海麦克林生化科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO):天津市富宇精细化工有限公司;硫酸亚铁:天津市化学试剂三厂;甲醇:天津市致远化学试剂有限公司。所用试剂均为分析纯。
1.2 仪器与设备
E-scan Bruker电子顺磁共振波谱仪:德国布鲁克科技(北京)有限公司;Tecan Spark 20M多功能微孔板读数仪:瑞士泰坎有限公司;KQ3200DA超声波清洗器:昆山市超声仪器有限公司;SQP电子天平:赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 DPPH标准曲线测定(1)ESR法
以无水乙醇作为溶剂,分别配制0.1 mmol/L、0.2 mmol/L、0.3 mmol/L、0.4 mmol/L、0.5 mmol/L DPPH醇溶液,于25 ℃条件下超声(功率为60 W、超声10 min)溶解后,采用ESR进行测定,测定条件:频率9.792 069 GHz,功率5.00 mW,中心磁场3 487 G,扫描宽度100 G,调制幅度2.27 G,调制频率86.00 kHz,时间常数40.96,扫描时间83.88 s(20.97 s(4次),横坐标点数512,接收机增益为3.17×103[19]。并以ESR谱图二重积分信号强度为纵坐标,以DPPH自由基浓度为横坐标,建立DPPH的ESR标准曲线。
(2)比色法
滴加200 μL不同浓度(0.025 mmol/L、0.05 mmol/L、0.075 mmol/L、0.10 mmol/L、0.20 mmol/L、0.30 mmol/L)的DPPH乙醇溶液于96孔板内,采用酶标仪测定吸光度值,参数为:温度25 ℃、波长517 nm。以波长517 nm处的吸光度值(OD517nm值)建立标准曲线。
1.3.2 吸收曲线的测定
滴加200 μL不同工艺的藜麦酒及200 μL DPPH乙醇溶液于96孔板内,设置扫描波长范围为350~600 nm进行全扫描,测试温度为25 ℃,并测定藜麦酒在不同波长处的吸光度值。
1.3.3 不同工艺藜麦酒对DPPH自由基清除能力的测定
(1)DPPH自由基与藜麦酒暗反应时间的确定
将1.0 mL藜麦酒样与0.5 mL DPPH乙醇溶液于棕色具塞刻度管中混匀并计时。调谐后混合2 min后立即采用ESR测定。在方法1.3.1条件的基础上进行测定,扫描时长1 h,间隔2 min扫描一次ESR谱图(单次扫描时间20.97 s、描间隔时间99.03 s、累计扫描次数60次),记录单次扫描谱图的第3个特征峰峰高,建立DPPH第3特征峰峰高(强度)随时间变化关系曲线。
(2)DPPH自由基清除率的测定
吸取0.5 mmol/L的DPPH乙醇溶液0.5 mL加入到具塞棕色带盖试管中,加入1 mL不同藜麦酒样品并涡旋振荡1 min。混匀后暗反应40 min立即放入电子自旋共振(ESR)波谱仪的谐振腔中,待仪器调谐后开始测定,测定条件同上,将扫描的谱图导入至WINEPR-Processing,选取3 450~3 525 G区域对DPPH自由基的ESR谱图进行2重积分,积分值记为As。 在相同操作条件下,以0.5 mL无水乙醇溶液代替藜麦酒作为空白组,并记录其二重积分值,记为Ac。藜麦酒对DPPH自由基清除能力的计算公式如下:
1.3.4 不同工艺藜麦酒对羟自由基清除能力的测定
(1)羟自由基与藜麦酒暗反应时间的确定
参考芬顿反应制备羟自由基[20],于2.5 mL离心管中依次加入20 μL DMPO、420 μL去离子水、20 μL 5 mmoL/L FeSO4并用涡旋仪振荡40 s。 随后添加20 μL 50 mmoL/L H2O2与50 μL藜麦酒并计时,用毛细管虹吸23.77 μL(d=0.93 mm,h=35mm)样品于2min开始测定,测定条件:频率9.790245GHz,调制幅度1.01 G,时间常数20.48,扫描时间10.49 s,扫描间隔时间19.51,接收机增益为1.00×103,中心磁场3 487 G,功率5.00 mW,扫描宽度100 G,调制频率86.00 kHz,横坐标点数512。扫描时长为1 h,每隔2 min扫描一个ESR图谱,记录单次扫描谱图的第2个特征峰峰高,建立羟自由基第2特征峰峰高随时间变化关系曲线。
(2)羟自由基清除率的测定
于2.5 mL离心管中依次加入20 μL DMPO、420 μL去离子水、20 μL 5 mmoL/L FeSO4,并采用涡旋仪振荡40 s后加入50 μL藜麦酒,以等量无水乙醇作为空白组。随后吸取20 μL 50 mmol/L H2O2并计时,暗反应100 min开始测定,测定条件同上,记录第2个特征峰峰高。 空白组记为Ac,实验组记为As。羟自由基清除率计算公式如下:
1.3.5 不同工艺藜麦酒对超氧阴离子自由基清除能力的测定
(1)超氧阴离子自由基与藜麦酒暗反应时间的确定
使用碳点和钯共修饰自掺杂二氧化钛(CDs/Pd/Ti3+-TiO2)纳米材料[21],取20 mg纳米材料加20 mL无水甲醇溶液、50 μL DMPO混合后,加入200 μL,30%H2O2处理25 min,用0.22 μm尼龙膜过滤。用毛细管虹吸23.77 μL滤液于2 min开始测定,ESR测定条件:频率9.793 810 GHz,中心磁场3 487 G,调制幅度2.02 G,时间常数20.48,扫描时间10.49 s,扫描间隔时间19.51 s,接收机增益为1.42×103,氙灯功率300 W,扫描时长为1 h,每隔2 min扫描一次,记录第1个特征峰峰高,建立超氧阴离子自由基第1特征峰峰高随时间变化关系曲线。
(2)超氧阴离子自由基清除率的测定
于2.5 mL离心管中加入250 μL上述滤液、10 μL藜麦酒,以等量无水乙醇作为空白组。暗反应10 min后开始采用ESR测定,采用不间隔扫描,测定条件同上,记录谱图二重积分值。 空白组记为Ac,实验组记为As。 超氧阴离子自由基清除率计算公式如下:
1.3.6 数据处理
所有的试验均做3次平行,采用WINEPR-Processing、Origin 8.0、Mathematics 4.0软件及其相关方法进行处理,并用SPSS软件进行显著性分析(P<0.05为差异显著)。
2 结果与分析
2.1 比色法与ESR法DPPH标准曲线建立
比色法、ESR法DPPH标准曲线拟合图见图1。
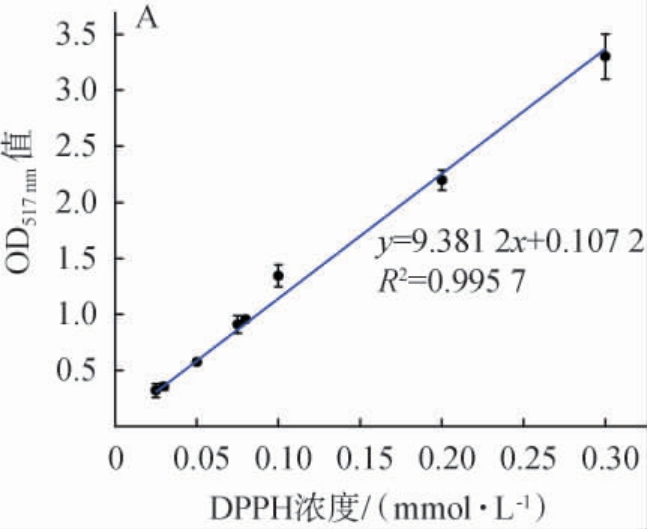
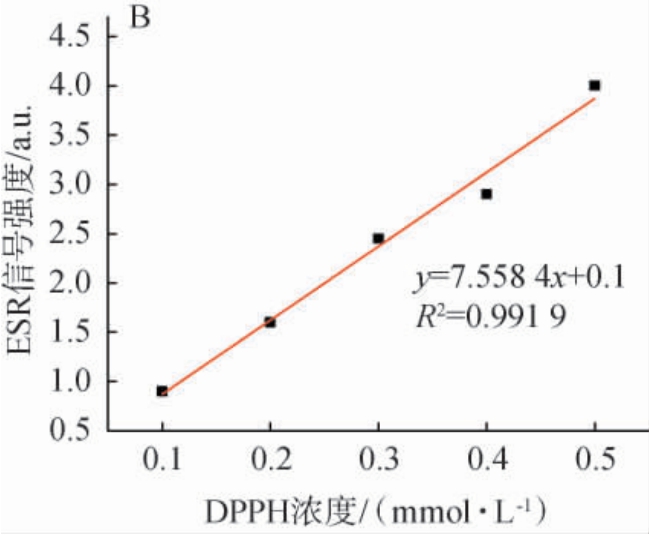
图1 比色法(A)及电子自旋共振法(B)1,1-二苯基-2-三硝基苯肼标准曲线
Fig.1 Standard curve of 1,1-diphenyl-2-picrylhydrazyl based on colorimetric method (A) and electron spin resonance method (B)
由图1A可知,DPPH自由基浓度与其在517 nm波长处的OD517nm值均具有良好的线性关系,相关系数R2>0.99,线性回归方程为y=9.381 2x+0.107 2。 由图1B可知,DPPH自由基浓度与DPPH二重积分强度具有良好的线性关系,相关系数R2>0.99,线性回归方程为y=7.558 4x+0.1。因此,上述2种检测方法均可以用于抗氧化活性检测。
2.2 藜麦酒及DPPH乙醇溶液吸收曲线的建立
藜麦中的藜麦黄酮类物质含量丰富,其特征吸收峰在波长357 nm处。藜麦酒及DPPH乙醇溶液在不同波长处的吸收曲线见图2。
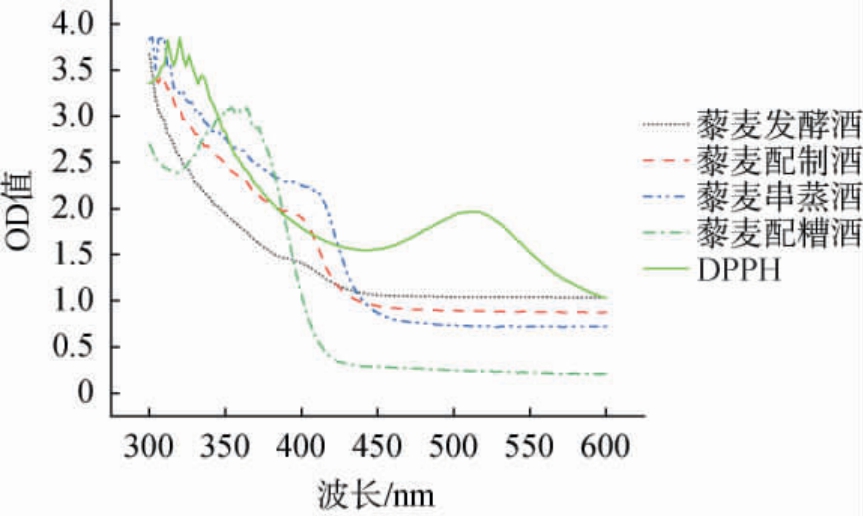
图2 藜麦酒及1,1-二苯基-2-三硝基苯肼乙醇溶液在不同波长处的吸收曲线
Fig.2 Absorption curves of quinoa liquor and ethanol solution with 1,1-diphenyl-2-picrylhydrazyl at different wavelengths
由图2可知,不同藜麦酒均在波长375 nm前后出现特征吸收峰,这一特征吸收峰极有可能是藜麦黄酮产生,但由于藜麦酒中成分复杂,因此可能会造成吸收峰的偏移[22]。藜麦酒自身颜色会干扰比色法对于抗氧化活性检测的准确性,除此之外一些金属离子例如亚铁离子、铝离子等在酒体中能与藜麦黄酮发生络合反应从而影响藜麦黄酮的颜色及抗氧化活性[23]。在DPPH特征吸收峰(517 nm)处,不同工艺的藜麦酒均有吸光度值,从而影响比色法对于藜麦酒体的抗氧化活性检测的准确性。 工艺的差异亦会导致酒体中物质的不同,例如藜麦串蒸酒在串蒸工艺时,藜麦中的糖类物质与氨基酸物质会发生美拉德反应从而导致吸光度值的影响。 因此应用电子顺磁共振技术能排除藜麦酒样亦或是藜麦黄酮自身颜色对抗氧化活性检测的干扰,因此,该方法相比于比色法具有更高效、更简单、更准确的检测特点。
2.3 不同工艺藜麦酒对DPPH自由基的清除结果
2.3.1 DPPH自由基与藜麦酒暗反应时间的确定
DPPH自由基第3个特征峰强度随时间变化曲线图见图3。由图3可知,当藜麦酒体和DPPH醇溶液混合后,DPPH自由基信号强度在0~40 min迅速减弱,在40~120 min内基本维持恒定,这是由于藜麦酒对DPPH自由基具有较强的清除能力,在两者混合时,由于藜麦酒能够清除DPPH自由基,从而导致DPPH自由基信号减弱,而在藜麦酒完全反应后,DPPH自由基短时间在核磁管内信号强度能维持不变。因此在检测藜麦酒对DPPH自由基清除效果时,选择其暗反应时间为40 min。
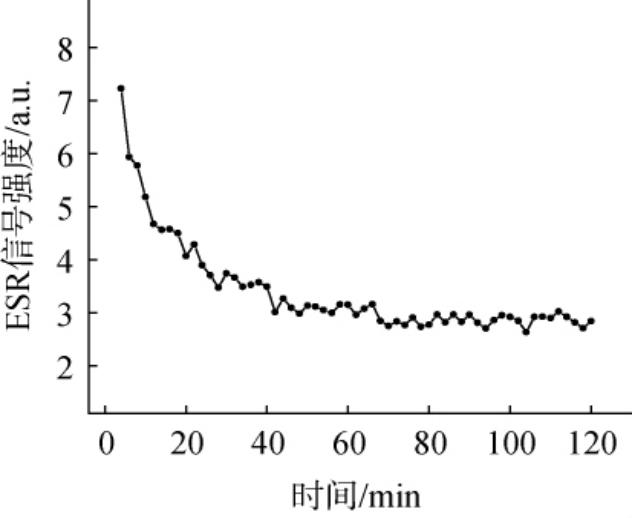
图3 1,1-二苯基-2-三硝基苯肼自由基第3个特征峰强度随时间变化曲线
Fig.3 Change curve of the third characteristic peak intensity of 1,1-diphenyl-2-picrylhydrazyl radicals with time
2.3.2 DPPH自由基清除率的测定结果
藜麦酒体中金属离子、美拉德反应产物、黄酮、多酚、黄酮、皂苷等均会影响藜麦酒体的抗氧化活性[24],影响DPPH自由基清除能力[25],藜麦酒对DPPH自由基影响的ESR谱图见图4。
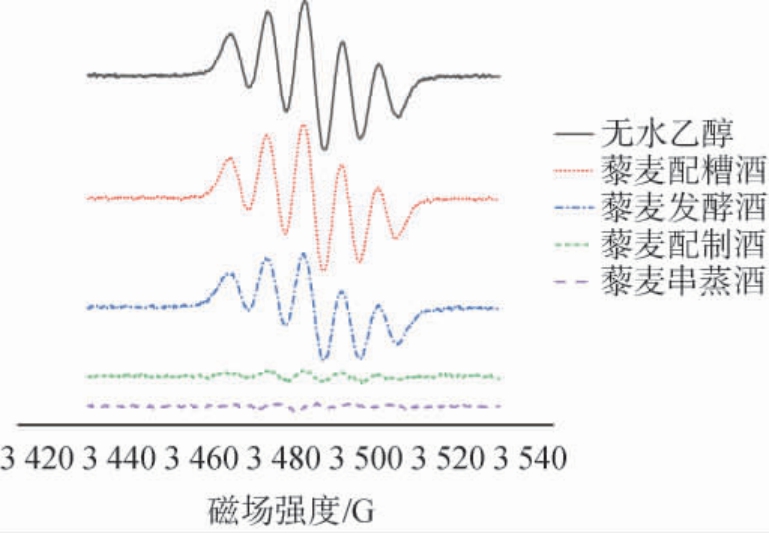
图4 藜麦酒对1,1-二苯基-2-三硝基苯肼自由基影响的电子自旋共振谱图
Fig.4 Electron spin resonance spectrum of the effect of quinoa liquor on 1,1-diphenyl-2-picrylhydrazyl radicals
由图4可知,不同的工艺对藜麦酒中的活性成分具有差异,由ESR谱图观察可知,不同工艺的藜麦酒对DPPH自由基清除能力由大到小依次为:藜麦串蒸酒(94.96%)>藜麦配制酒(90.32%)>藜麦酿造酒(21.35%)>藜麦配糟酒(5.38%)。
2.4 不同工艺藜麦酒对羟自由基清除结果
2.4.1 羟自由基与藜麦酒暗反应时间的确定
羟基自由基第2个特征峰强度随时间变化曲线见图5。由图5可知,藜麦酒与羟自由基反应后其信号强度曲线呈现出先趋于平稳后不断降低,最后又趋于稳定。 当藜麦酒和羟自由基接触后,其信号强度在前40 min变化幅度大但趋于稳定,这可能是由于刚开始时芬顿反应不断产生羟自由基而藜麦酒中活性物质能够及时清除羟自由基所致[21],在40~100 min羟自由基信号强度不断降低,这是由于藜麦酒中的抗氧化活性物质能够清除羟自由基,而在100~120min内,羟自由基信号强度趋于稳定。 因此,可选择100 min作为藜麦酒和羟自由基的暗反应时间。
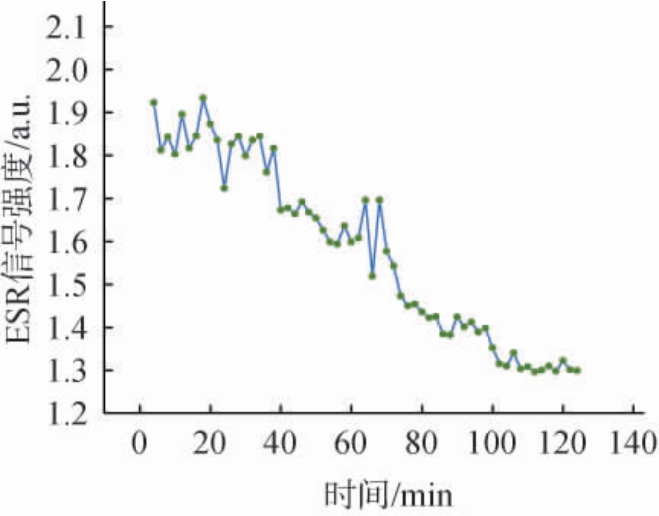
图5 羟基自由基第2个特征峰强度随时间变化曲线
Fig.5 Change curve of the second characteristic peak intensity of hydroxyl radicals with time
2.4.2 羟自由基清除率的测定结果
藜麦酒对羟自由基影响的电子自旋共振谱图见图6。
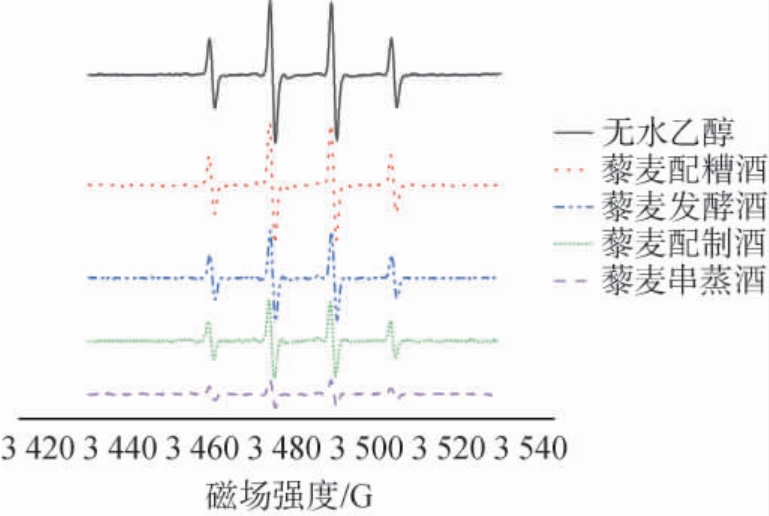
图6 藜麦酒对羟自由基影响的电子自旋共振谱图
Fig.6 Electron spin resonance spectrum of the effect of quinoa liquor on hydroxyl radicals
由图6可知,不同工艺的藜麦酒体对羟自由基清除能力有所差异,其对羟自由基清除能力由强到弱依次为:藜麦串蒸酒(89.67%)>藜麦配制酒(56.73%)>藜麦酿造酒(51.16%)>藜麦配糟酒(4.78%)。 藜麦中黄酮主要成分芦丁、槲皮素等物质沸点较高[26],传统的蒸馏方式难以将有效物质提取,因此藜麦酿造酒和藜麦配糟酒的抗氧化活性低于藜麦配制酒和藜麦串蒸酒,通过串蒸的工艺以及通过添加藜麦天然提取物的方式可以提高酒体中藜麦活性成分的含量,从而提高酒体抗氧化活性[27]。
2.5 不同工艺藜麦酒对超氧阴离子自由基的清除结果
2.5.1 超氧阴离子自由基与藜麦酒暗反应时间的确定
超氧阴离子自由基第1个特征峰强度随时间变化曲线见图7。由图7可知,在0~10 min内,超氧阴离子自由基ESR谱图强度下降迅速,这是由于藜麦酒中抗氧化活性成分清除超氧阴离子自由基所致。在10~60 min内超氧阴离子自由基强度基本维持恒定。 因此,可选择10 min作为藜麦酒和超氧阴离子自由基暗反应时间。藜麦酒能较快的清除超氧阴离子自由基,藜麦酒清除超氧阴离子自由基的速度高于羟自由基和DPPH自由基。
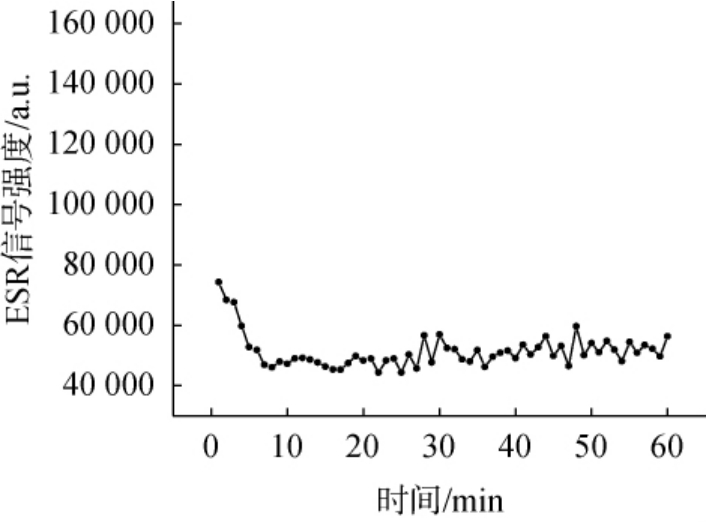
图7 超氧阴离子自由基第1个特征峰强度随时间变化曲线
Fig.7 Change curve of the first characteristic peak intensity of superoxide anion radicals with time
2.5.2 超氧阴离子清除率的测定结果
藜麦酒对超氧阴离子自由基影响的电子自旋共振谱图见图8。
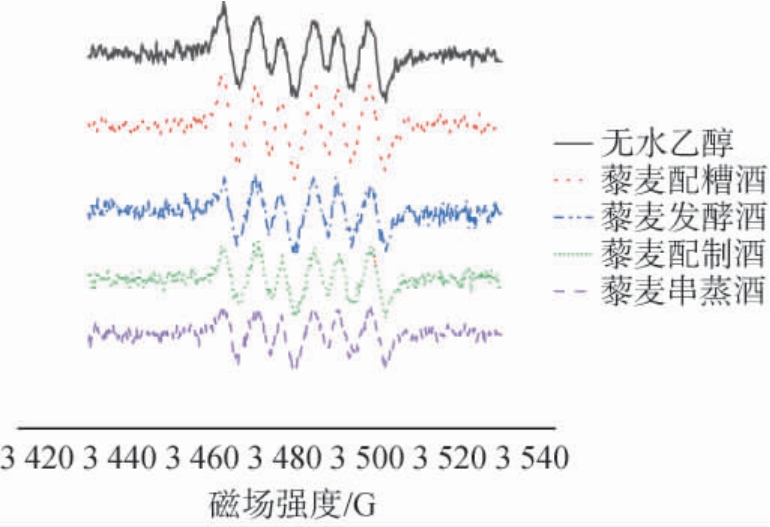
图8 藜麦酒对超氧阴离子自由基影响的电子自旋共振谱图
Fig.8 Electron spin resonance spectrum of the effect of quinoa liquor on superoxide anion radicals
由图8可知,不同工艺的藜麦酒由于其中抗氧化活性物质的差异而导致其对超氧阴离子清除效果具有差异,其清除能力由大到小依次为;藜麦串蒸酒(30.46%)>藜麦配制酒(27.84%)>藜麦酿造酒(25.91%)>藜麦配糟酒(13.12%)。不同工艺的藜麦酒对超氧阴离子均具有清除效果,亦能催化超氧阴离子自由基歧化生成氧和过氧化氢,调控氧化与抗氧化失衡以改善氧化应激水平[28],提高藜麦酒体抗氧化活性,提高乙醛和乙醇的代谢速率[29]。
由以上结果可知,藜麦酒和DPPH自由基、羟自由基、超氧阴离子自由基的最佳暗反应时间分别为40 min、100 min、10 min。 使用等量藜麦酒与不同自由基进行反应,根据暗反应时间长短可判定自由基清除速率[12]。清除速率由大到小依次为:超氧阴离子自由基>DPPH自由基>羟自由基。清除能力强弱由大到小依次为:藜麦串蒸酒>藜麦配制酒>藜麦酿造酒>藜麦配糟酒。
3 结论
ESR谱图强度与自由基浓度相关性良好,且不受样品颜色影响,适用于藜麦酒的抗氧化活性检测,藜麦酒和DPPH自由基、羟自由基、超氧阴离子自由基的最佳暗反应时间分别为40 min、100 min、10 min。 在上述最佳暗反应时间内,4种藜麦酒体对上述自由基均具有清除能力,清除速率由大到小依次为:超氧阴离子自由基>DPPH自由基>羟自由基。清除能力强弱由大到小依次为:藜麦串蒸酒>藜麦配制酒>藜麦酿造酒>藜麦配糟酒。不同工艺的藜麦酒体中抗氧化活性物质的成分及含量具有复杂性,能干扰抗氧化检测结果的准确性,目前尚未有这些呈色物质及影响强弱的相关文献报道,本研究发现黄酮类物质可能会干扰比色法检测的准确性,且干扰强程度与波长375 nm处吸收峰值呈反比,这一结论仍需进一步实验研究。适宜的检测技术能够为深入研究酒体中的抗氧化活性物质提供参考依据,提高藜麦及藜麦酒的应用前景。
[1]姚文俊.藜麦多酚提取物缓解非酒精性脂肪肝的作用机制研究[D].无锡:江南大学,2024.
[2]郭盛源.藜麦酒酿造原粮筛选及特征风味研究[D].成都:成都大学,2024.
[3]陈虎,锁然,刘亚琼,等.GC-MS和GC-IMS分析藜麦酒的特征挥发性风味成分[J].中国食品学报,2023,23(12):268-280.
[4]华艳宏,庞春花,张永清,等.藜麦种子不同溶剂提取物及其抗氧化活性[J].江苏农业科学,2018,46(20):225-228.
[5]CHAO W.Effect of conventional and microwave heating treatment on antioxidant activity of quinoa protein after simulated gastrointestinal digestion[J].Food Chem,2023,415:135763.
[6]CHAUDHARY N,WALIA S,KUMAR R,et al.Functional composition,physiological effect and agronomy of future food quinoa (Chenopodium quinoa Willd.):A review[J].J Food Compos Anal,2023,118:105192.
[7]OLMOS E,ROMAN-GARCIA I,REGUERA M.An update on the nutritional profiles of quinoa(Chenopodium quinoa Willd.),amaranth (Amaranthus spp.), and chia (Salvia hispanica L.), three key species with the potential to contribute to food security worldwide[J].JSFA Rep, 2022,2(12):591-602.
[8]LIU Y J, LIU J, KONG Z Y, et al.Transcriptomics and metabolomics analyses of the mechanism of flavonoid synthesis in seeds of differently colored quinoa strains[J].Genomics,2021,114(1):138-148.
[9]BALAKRISHAN G, SCHNEIDER R G.The role of amaranth, quinoa,and millets for the development of healthy, sustainable food products-a concise review[J].Foods,2022,11(16):2442.
[10]章银良,黄天琪.基于ESR和比色法的美拉德产物抗氧化活性对比研究[J].中国调味品,2022,47(7):36-42.
[11]章银良,黄天琪.基于电子顺磁共振波谱法的美拉德反应产物抗氧化活性研究[J].中国调味品,2022,47(5):55-59,74.
[12]郭学文.电子顺磁共振波谱法测定三种类胡萝卜素抗氧化活性[J].食品工业科技,2020,41(19):260-265.
[13]臧爽.应用紫外可见分光光度法和电子自旋共振法测定不同水果的抗氧化能力[D].长春:吉林大学,2018.
[14]IONITA P.The chemistry of DPPH·free radical and congeners[J].Int J Mol Sci,2021,22(4):1545.
[15]DAVIES M J.Detection and characterisation of radicals using electron paramagnetic resonance (EPR) spin trapping and related methods[J].Methods,2016,109:21-30.
[16]TUBA E L,ANIKA E,WAGNER R M,et al.Free radical scavenging and antioxidant activity of betanin: Electron spin resonance spectroscopy studies and studies in cultured cells[J].Food Chem Toxicol,2014,73:119-126.
[17]BARTOSZEK M,POLAK J.Application of electron paramagnetic resonance spectroscopy for investigating antioxidant activity of selected herbs[J].J AOAC Int,2015,98(4):862-865.
[18]郑坚强,王悦,赵宇,等.基于电子顺磁共振法对枸杞提取液的抗氧化活性研究[J].中国调味品,2023,48(2):51-57.
[19]章银良,黄天琪.利用电子顺磁共振技术研究美拉德产物对不同自由基清除活性的影响[J].中国调味品,2022,47(8):35-40.
[20]李孟昊,张志军.紫苏风味醋的制备及抗氧化活性研究[J].中国调味品,2023,48(4):29-36.
[21]ZHANG J T,LIU S R,WANG X Y,et al.Highly efficient Ti3+self-doped TiO2 co-modified with carbon dots and palladium nanocomposites for disinfection of bacterial and fungi[J].J Hazard Mater, 2021, 413(5):1-10.
[22]李雪涵.榆荚仁黄酮对慢性睡眠剥夺小鼠体内抗氧化酶活性及相关基因表达的影响[J].动物营养学报,2023,35(5):3323-3332.
[23]刘婷,赵良忠,周小虎.酸豆奶发酵过程中大豆异黄酮及风味物质变化规律[J].食品与发酵工业,2022,48(6):181-187.
[24]张琦,高娅,潘鑫.成都平原两季收获的藜麦中氨基酸的组成及其营养评价[J].食品与发酵工业,2023,49(24):290-301.
[25]刘乐,李艳,连加达.藜麦醇溶蛋白的氨基酸组成、抗氧化性与乳化性研究[J].食品与发酵工业,2022,48(13):181-187.
[26]KUN F D,ZHI F Y,WEI G,et al.LC-MS/MS determination and pharmacokinetic study of five flavone components after solvent extraction/acid hydrolysis in rat plasma after oral administration of Verbena officinalis L.extract[J].J Ethnopharmacol,2011,135(2):201-208.
[27]费永涛,周洁莹,肖志如,等.香蕉果酒带皮发酵对其品质和挥发性香气成分的影响[J].现代食品科技,2024,40(2):284-291.
[28]李晨雯,柏珺,赵力.基于Nrf2和NLRP3探讨辣木籽提取物对慢性酒精性肝损伤小鼠肝脏的保护作用[J].现代食品科技,2023,39(10):51-58.
[29]曾允灏.大鲵肝肽酒制备及其对小鼠酒后肝脏保护作用研究[J].中国酿造,2023,42(2):120-125.