多花黄精(Polygonatum cyrtonema)是我国传统药食同源植物,具有补中益气、滋阴养肺等功效,广泛应用于中医药和功能性食品领域。 其主要活性成分包括多糖、黄酮、皂苷等,其中多糖是黄精中含量最高的活性物质,具有抗氧化、抗炎、降血糖、调节免疫力等多种生物活性[1-2]。 然而,黄精直接食用时存在刺激性及麻口感,限制了其的广泛应用。 近年来,微生物发酵技术被引入黄精加工中,通过发酵不仅可以改善黄精的口感,而且能促进活性成分的释放和转化,提升其生物利用度和功能特性。
植物乳植杆菌是一种重要的益生菌,广泛用于食品发酵中。其具有调节肠道菌群、增强免疫力、抗氧化等多种功能,已被应用于泡菜、乳制品及功能性食品的开发中[3-4]。寡糖是由2~10个单糖通过糖苷键连接而成的低聚糖,具有益生元、抗氧化、抗炎等多种生物活性。在黄精发酵过程中,寡糖的积累主要依赖于微生物对多糖的酶解作用。植物乳植杆菌通过分泌外切酶和内切酶,将黄精中的大分子多糖降解为小分子寡糖,从而提高寡糖的含量和生物活性[5]。研究表明,植物乳植杆菌在发酵过程中能够分泌多种酶类,如β-葡聚糖酶和α-半乳糖苷酶,这些酶能够降解多糖为寡糖,从而增加寡糖的积累[5]。 此外,植物乳植杆菌的代谢产物如乳酸和短链脂肪酸还能改善发酵体系的pH环境,进一步促进寡糖的稳定性和功能[4]。
值得注意的是,黄精多糖不仅具有显著的生物活性,还表现出益生元作用,能够促进肠道有益菌的生长,进一步增强了其在益生菌发酵食品中的应用潜力[6-7]。随着大健康产业的快速发展,寡糖的益生功能已被广泛关注,但利用益生菌发酵黄精开发大健康发酵食品的研究较少,且发酵菌种挖掘还处于起步阶段。本研究以不同传统发酵食品来源的植物乳植杆菌(Lactiplantibacillus plantarum)发酵黄精,筛选能够显著降解黄精多糖产寡糖的菌株,并通过单因素和响应面试验优化黄精发酵条件,研究黄精发酵后冻干粉对益生菌生长的影响,以期为黄精发酵食品的开发提供技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和原料
发酵菌种:从酸菜(甘肃、贵州)、酸汤(贵州)、浆水(甘肃)、酸奶(内蒙古)等传统发酵食品中分离的12株植物乳植杆菌,分别编号L1、L2、L3、L4、L5、L6、L7、L8、L9、L10、L11、L12,保藏于本实验室。
益生菌菌株: 植物乳植杆菌(Lactiplantibacillus plan tarum)CICC22213、鼠李糖乳杆菌(Lactobacillus rhamnosus)CICC22175:中国工业微生物菌种保藏中心;干酪乳杆菌(Lactobacillus casei):从贵州酸汤分离。
多花黄精(干品,未炮制):贵州省药业发展有限责任公司。
1.1.2 试剂
葡萄糖、L-半胱氨酸、苯酚、硫酸(均为分析纯):北京市奥博星生物技术有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、乙醇(均为分析纯):北京索莱宝科技有限公司;低聚果糖(生化试剂):广州环凯生物科技有限公司。
1.1.3 培养基
MRS固态培养基:广东环凯微生物科技有限公司。
黄精培养基:黄精2 g,100 mL热水浸泡1 h,打浆3 min,115 ℃灭菌20 min。
基础MRS培养基[8](MRS-L):去除葡萄糖的MRS培养基加0.5 g/L L-半胱氨酸。
阳性对照培养基[8](MRS-OF):基础MRS培养基加10 g/L低聚果糖。
实验培养基[8]:基础MRS培养基分别加10 g/L植物乳植杆菌L5发酵黄精液冻干粉、黄精冻干粉,得到发酵黄精液冻干粉培养基(MRS-FP)和黄精冻干粉培养基(MRS-P)。
1.2 仪器与设备
PBJ-010破壁机:中山市仁亨电器有限公司;TGL-24M高速冷冻离心机:湖南平凡科技有限公司;UV-1780紫外可见分光光度计:岛津仪器(苏州)有限公司;THZ-98A恒温摇床:上海一恒科学仪器有限公司;GT224电子天平:上海佑科仪器仪表有限公司;BSP-100恒温培养箱:上海博讯生物仪器有限公司;SW-2G超净工作台:上海尚道仪器有限公司;LDZF-75L灭菌锅:上海申安医疗器械厂;TGL-25M高速冷冻离心机:上海卢湘仪离心仪器有限公司。
1.3 方法
1.3.1 降解黄精多糖产寡糖菌种筛选
种子液制备:将12株植物乳植杆菌在MRS固体培养基纯种活化2次,单菌种接种到MRS液体培养基,37℃、150r/min摇床培养20~24 h,调OD600nm值为2,作为种子液。
发酵液制备:将12株菌的种子液按5%的接种量分别纯种接种到黄精培养基,37 ℃、150 r/min摇床培养5 d,12 000 r/min离心10 min后取上清液为发酵液。测定发酵液黄精寡糖含量。
发酵液生物量的测定:12株菌种子液按照1%接种量分别接种到黄精培养基,37 ℃条件下,150 r/min摇床培养24 h,取1 mL菌液稀释到合适浓度,取100 μL涂布到固体MRS培养基,37 ℃倒置培养48h,计算菌落数。
菌种筛选:检测发酵液中寡糖含量,选择寡糖含量高的菌种。
1.3.2 发酵液糖含量的测定
总糖含量:取发酵液上清液0.1 mL,稀释50倍,利用苯酚-硫酸法检测样品中多糖含量[9-10]。
多糖含量:发酵液上清液以1∶4(V/V)加入无水乙醇,4 ℃冷藏12 h,12 000 r/min离心10 min,用体积分数80%的乙醇溶液清洗3次,用纯净水复溶,利用苯酚-硫酸法检测样品中多糖含量[9-10]。
还原糖含量:取发酵液上清液0.2 mL,利用DNS方法检测还原糖含量[10]。
寡糖含量=总糖含量-多糖含量-还原糖含量。
1.3.3 降解黄精多糖产寡糖菌株发酵条件优化单因素试验
分别考察发酵时间(1 d、3 d、5 d、7 d、9 d)、菌种接种量(1%、3%、5%、7%、9%)、溶氧条件(摇床转速)(0、50 r/min、100 r/min、150 r/min、200 r/min)和发酵温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)对寡糖含量的影响。
1.3.4 降解黄精多糖产寡糖菌株发酵条件优化响应面试验
根据单因素试验结果,选择对黄精寡糖含量影响显著的3个因素发酵时间(A)、发酵温度(B)、菌种接种量(C)为评价因素,以黄精寡糖含量(Y)为响应值,采用Design-Expert13.0软件,应用Box-Behnken方法设计试验组合,优化黄精发酵条件,响应面试验因素与水平见表1。
表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation conditions optimization
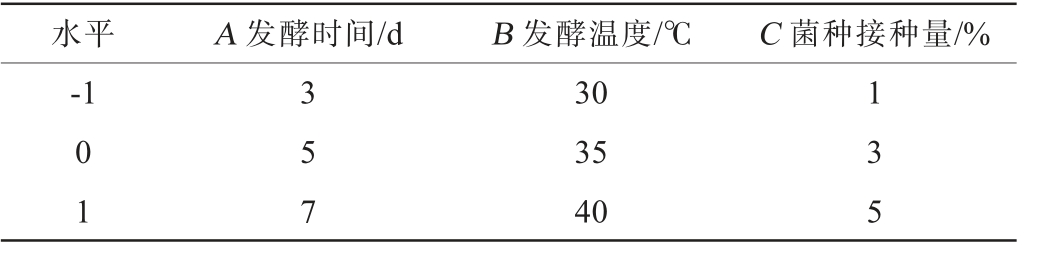
水平A 发酵时间/dB 发酵温度/℃ C 菌种接种量/%-1 01 357 30 35 40 135
1.3.5 发酵黄精冻干粉益生菌生长试验
冻干粉制备:黄精培养基/黄精培养基接种菌株发酵液,10 000 r/min离心20 min,取上清液,减压蒸馏浓缩后分装到培养皿,保鲜膜封口扎孔,放在-80 ℃预冷冻的冷冻干燥机,干燥24 h,4 ℃冷藏备用。
种子液制备[8,12]:将3株益生菌(植物乳植杆菌、鼠李糖乳杆菌、干酪乳杆菌)分别接种到MRS固体培养基中37 ℃活化2 d,接种环挑取少许菌体接种到灭菌MRS液体培养基,37 ℃、150 r/min摇床培养20~24 h,调菌液OD600 nm为2,作为种子液。
菌株生物量检测:3株益生菌种子液按照1%接种量分别接种到基础MRS培养基(MRS-L)、阳性对照培养基(MRS-OF)、黄精冻干粉MRS培养基(MRS-P)和发酵黄精冻干粉MRS培养基(MRS-FP),37 ℃、150 r/min摇床培养48 h测OD600 nm值。
1.3.6 数据处理
每个数据做3个生物学重复,数据采用Origin2024、Excel 2019分析绘图,响应面优化设计用Design-Expert13.0分析和绘制。
2 结果与分析
2.1 降解黄精多糖产寡糖菌种筛选
12株植物乳植杆菌发酵黄精生物量及寡糖含量见图1。由图1a可知,发酵24 h后,发酵液中菌种生物量大部分到1×107 CFU/mL以上,说明植物乳植杆菌都能在含2%黄精的培养基中正常生长,可以作为后续发酵食品开发培养基。文献研究表明,黄精的碳水化合物、蛋白质、灰分、氨基酸总量分别达到83%、7%、2%、6%等[13],一般培养基的碳源和氮源只要达到培养基的1%以上,微生物就可以正常生长。由图1b可知,发酵24 h后,菌株L4和L5发酵液中寡糖含量高于对照(CK)。 这可能与菌种产生的碳水化合物活性酶(carbohydrate-active enzymes,CAZy)有关,CAZy能够降解多糖[14]。此外,乳酸菌在发酵过程中可能产生淀粉酶、纤维素酶、几丁质酶等水解酶,促进糖类物质释放[15]。菌株L5发酵液中寡糖含量最高,因此后续试验选择菌株L5为发酵菌种。
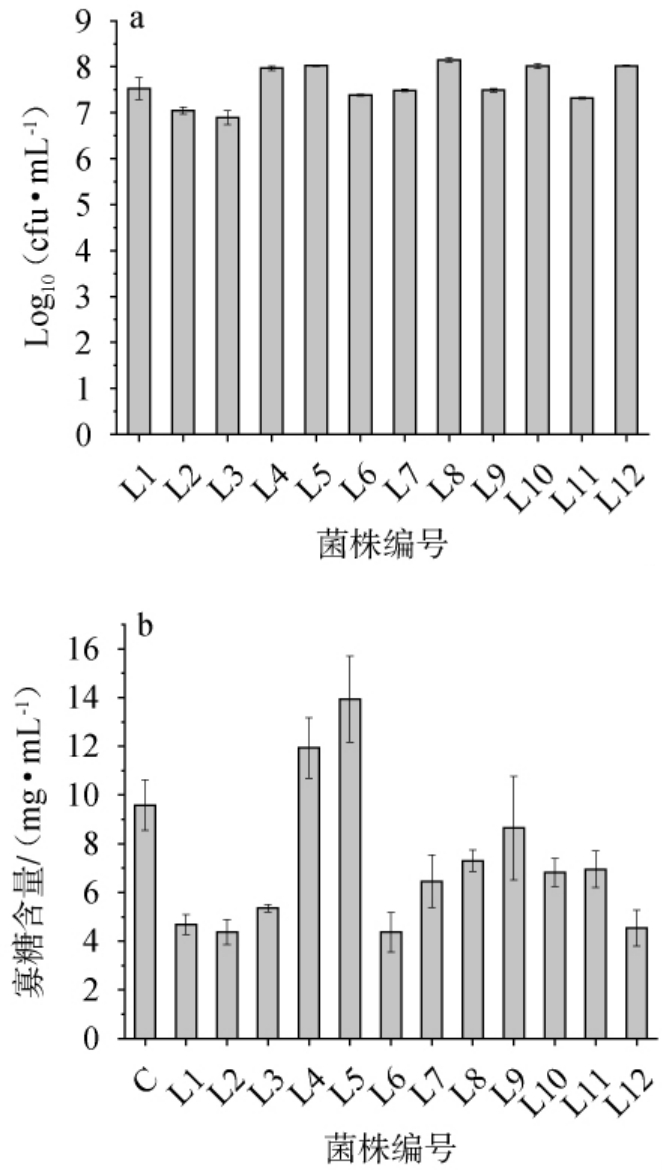
图1 不同来源植物乳植杆菌对发酵黄精生物量(a)及寡糖含量(b)的影响
Fig.1 Effect of Lactiplantibacillus plantarum from different sources on the biomass (a) and oligosaccharide contents (b) of fermented Polygonatum cyrtonema
2.2 降解黄精多糖产寡糖菌株发酵条件优化单因素试验
菌种接种量、发酵时间、摇床转速和发酵温度对黄精寡糖含量的影响见图2。由图2a可知,菌种接种量对黄精寡糖含量具有显著影响,随着菌种接种量的增加,黄精寡糖含量呈现先增加后减少的趋势;菌种接种量为3%时黄精寡糖含量达到最大值,为16.04 mg/mL。这一结果与孙建安等[16]的研究一致,适宜的接种量能够为微生物生长提供充足的初始菌体量,从而促进代谢产物的合成。然而,过高的接种量可能导致营养竞争加剧,抑制菌体生长及产物积累。因此选择最佳菌种接种量为3%。由图2b可知,随着发酵时间的延长,黄精寡糖含量呈现先增加后减少的趋势;发酵时间为5 d时黄精寡糖含量达到最大值,为15.74 mg/mL。由图2c可知,随着摇床转速的升高,黄精寡糖含量呈现先减少后增加再减少的趋势;摇床转速为150 r/min时黄精寡糖含量达到最大值,为17.71 mg/mL。但不同转速间的寡糖含量波动较小,可能是因为植物乳植杆菌为兼性厌氧菌,不同溶氧对菌种的生长和酶代谢无明显影响[17-18]。 因此选择最佳摇床转速为150 r/min。由图2d可知,发酵温度对黄精寡糖含量具有显著影响,随着发酵温度的升高,黄精寡糖含量呈现先增加后减少的趋势; 发酵温度为35 ℃时,黄精寡糖含量达到最大值,为12.99 mg/mL。 在35 ℃条件下,菌株的生长速率和代谢活性达到最佳平衡,既保证了足够的生物量,又促进了寡糖的积累[19-20]。因此选择最佳发酵温度为35 ℃。
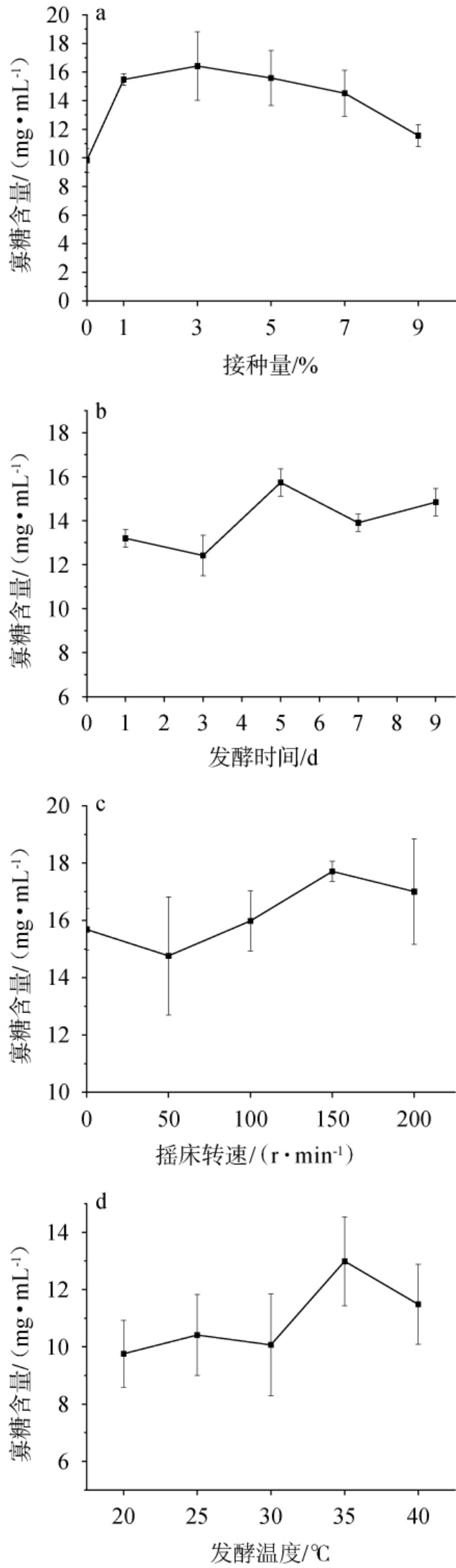
图2 菌种接种量(a)、发酵时间(b)、摇床转速(c)和发酵温度(d)对黄精寡糖含量的影响
Fig.2 Effects of inoculum (a), fermentation time (b), shaker speed(c) and temperature (d) on oligosaccharide contents in Polygonatum cyrtonema
2.3 降解黄精多糖产寡糖菌株发酵条件优化的响应面试验
以发酵时间(A)、发酵温度(B)、菌种接种量(C)为响应面试验优化因素,以黄精寡糖含量(Y)为响应值,通过3因素3水平的Box-Behnken试验设计优化黄精多糖寡糖化发酵条件,响应面试验设计及结果见表2,方差分析见表3。
表2 发酵条件优化响应面试验设计及结果
Table 2 Design and results of response surface tests for fermentation conditions optimization
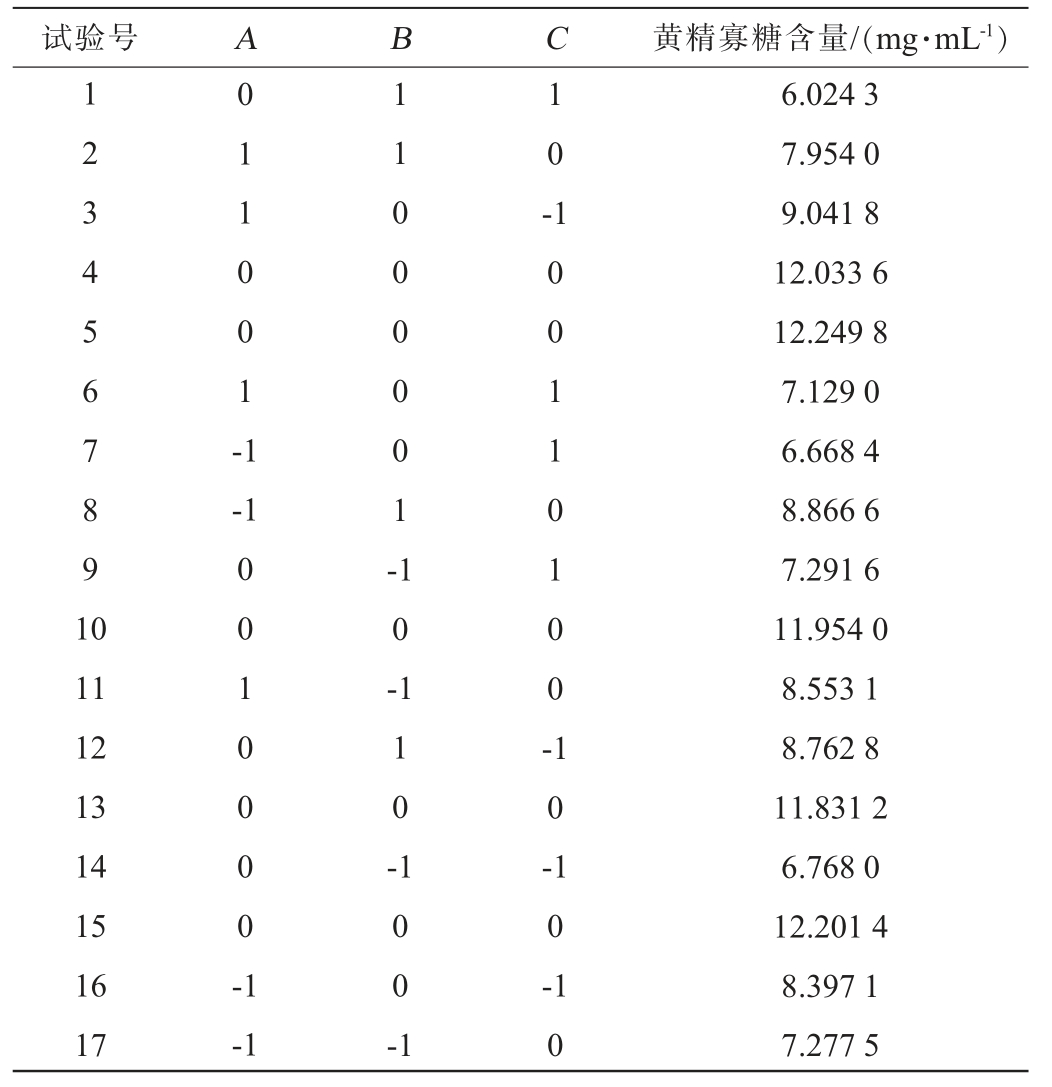
试验号ABC黄精寡糖含量/(mg·mL-1)1234567891 0 011001-1 10--1 11000001-11 12 13 14 15 16 17 0010000-1 10-110-100110100-10-10--1 100-1 10 6.024 3 7.954 0 9.041 8 12.033 6 12.249 8 7.129 0 6.668 4 8.866 6 7.291 6 11.954 0 8.553 1 8.762 8 11.831 2 6.768 0 12.201 4 8.397 1 7.277 5
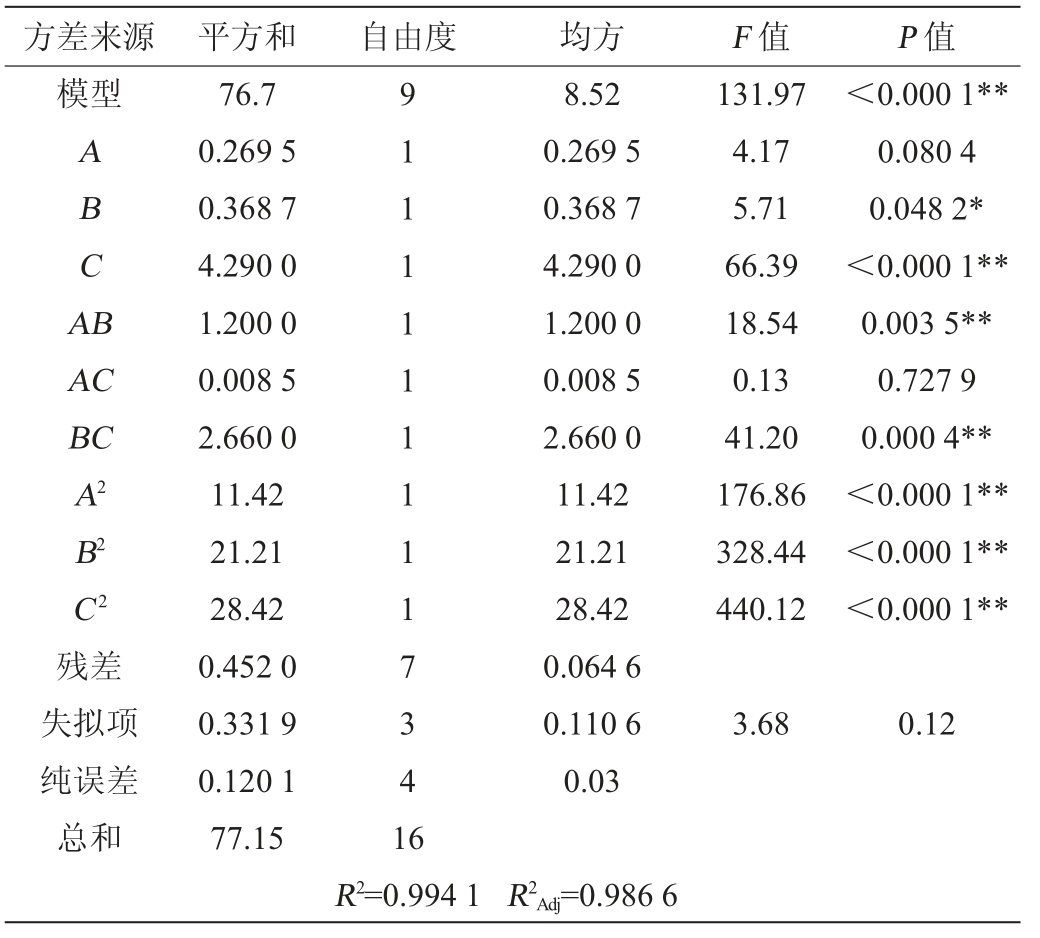
表3 回归模型方差分析
Table 3 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和自由度均方F 值P 值模型ABCA B AC BC A2 B2 C2 131.97 4.17 5.71 66.39 18.54 0.13 41.20 176.86 328.44 440.12<0.000 1**0.080 4 0.048 2*<0.000 1**0.003 5**0.727 9 0.000 4**<0.000 1**<0.000 1**<0.000 1**残差失拟项纯误差总和76.7 0.269 5 0.368 7 4.290 0 1.200 0 0.008 5 2.660 0 11.42 21.21 28.42 0.452 0 0.331 9 0.120 1 77.15 91111111117341 6 8.52 0.269 5 0.368 7 4.290 0 1.200 0 0.008 5 2.660 0 11.42 21.21 28.42 0.064 6 0.110 6 0.03 3.68 0.12 R2=0.994 1 R2Adj=0.986 6
应用Design-Expert13.0软件对表2试验数据进行多元回归拟合分析,得到回归方程:Y=12.05+0.18A+0.21B-0.73C-0.54AB-0.04AC-0.82BC-1.65A2-2.24B2-2.60C2。
由表3可知,模型P<0.000 1,极显著,失拟项P=0.12>0.05,不显著,表明模型可靠,所建立的回归方程能准确反映自变量与因变量之间的真实关系。 模型的决定系数R2=0.994 1,调整后的决定系数R2Adj=0.986 6,两者相差不大,进一步证实模型具有较高的预测精度和可靠性,能够有效预测发酵条件对寡糖含量的影响。由F值可知,3个因素对结果影响的顺序为接种量(C)>发酵温度(B)>发酵时间(A)。由P值可知,一次项C,交互项AB、BC,二次项A2、B2、C2对结果影响极显著(P<0.01),一次项B对结果影响显著(P<0.05)。
各因素交互作用对黄精寡糖含量影响的响应面及等高线见图3。由图3可知,发酵时间(A)与发酵温度(B),发酵温度(B)与菌种接种量(C)之间的交互作用表现出陡峭的斜率,且其等高线图呈明显的椭圆形,表明这些交互作用对寡糖含量具有极显著影响[21],而发酵时间(A)与菌种接种量(C)之间的交互作用较弱[22]。这与方差分析结果一致。通过Design-Expert软件对多元二次回归方程进行求解,并根据实际操作条件进行修正,得到降解黄精多糖产寡糖菌株最佳发酵条件为发酵时间5 d,发酵温度35 ℃,菌种接种量4%。在此条件下重复3次验证试验,发酵液中的黄精寡糖含量达到21.81mg/mL,相较于优化前提高了23.74%。研究表明,黄精在炮制过程中,寡糖类成分(如D-蔗糖、棉子糖、蜜二糖)含量显著降低,而单糖类成分(如D-果糖、D-葡萄糖)含量增加[23],说明利用植物乳植杆菌发酵是积累多糖的有效方式。
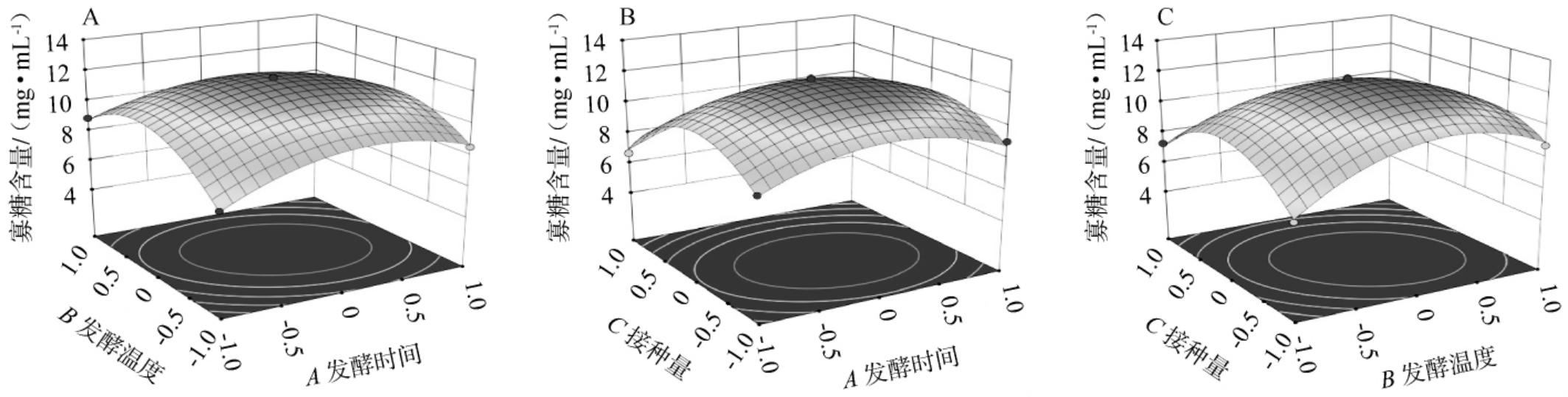
图3 各因素交互作用对黄精寡糖含量影响的响应面及等高线
Fig.3 Response surface plots and contour lines of effect of interaction between various factors on oligosaccharide contents of Polygonatum cyrtonema
2.4 发酵黄精冻干粉对益生菌生长的影响
为考察发酵后黄精寡糖对益生菌生长的影响,以发酵黄精冻干粉和未发酵黄精冻干粉为MRS培养基碳源,接种3种益生菌,检测培养48 h时菌体生物量。结果见图4。
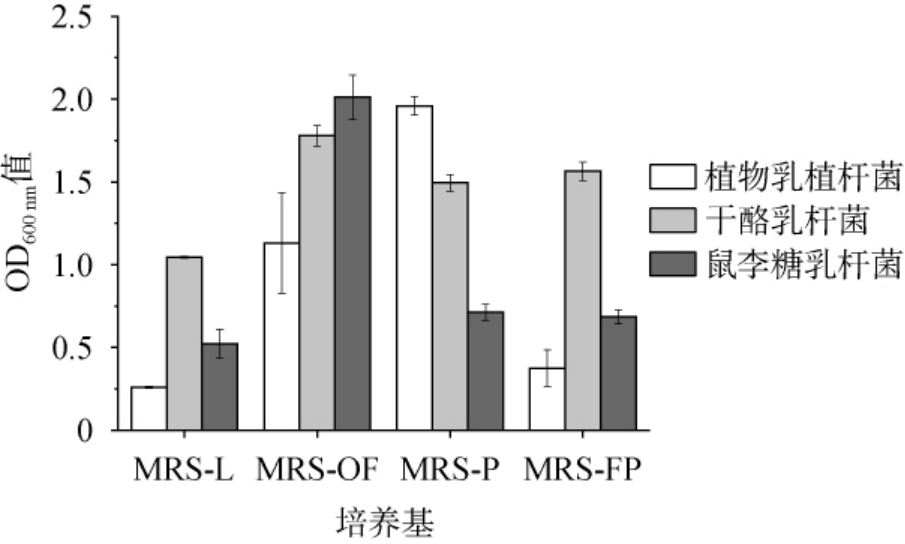
图4 发酵黄精冻干粉对益生菌生长情况
Fig.4 Effect of fermented Polygonatum cyrtonema freeze-dried powder on probiotics growth
由图4可知,3种菌生物量在不同培养基存在明显差异,在去除葡萄糖的MRS培养基3种益生菌生物量较低,当加入低聚果糖后,益生菌明显增殖,表明低聚果糖作为一种典型的益生元,能够有效促进益生菌的生长。与MRS-L相比,当加入等量的黄精和发酵黄精冻干粉后,3株益生菌明显增殖,且不同菌种生物量存在明显差异,说明以发酵黄精冻干粉和未发酵黄精冻干粉为MRS培养基碳源,都能显著促进益生菌生长。表明黄精中的寡糖和多糖成分具有显著的益生元活性,能够被益生菌利用作为碳源,促进其增殖[6-7]。 此外,文献研究发现黄精提取物可以作为益生菌制剂的添加剂,提高益生菌在肠道中的存活率和定植能力,从而增强其健康功效[24-25]。 黄精发酵后能明显降低多糖分子质量,以便于益生菌生长代谢,为后续开发调节肠道菌群工程食品提供保障。
3 结论
本研究成功筛选出1株能够显著降解黄精多糖产寡糖的植物乳植杆菌(Lactiplantibacillus plantarum)L5,通过对发酵时间、摇床转速、温度和接种量等单因素对寡糖含量积累的影响,选择发酵时间、温度和接种量显著影响寡糖含量的单因素进行响应面法优化发酵工艺,确定最佳发酵工艺为发酵时间5 d,发酵温度35 ℃,菌种接种量4%。在此条件下,发酵液中的黄精寡糖含量达到21.81 mg/mL,较优化前提高23.74%。且发酵后黄精发酵液冻干粉对益生菌生长有促进作用。这为开发基于黄精发酵的大健康食品提供发酵菌种和技术支持。
[1]WANG S,HE F,WU H,et al.Health-promoting activities and associated mechanisms of Polygonati rhizoma polysaccharides[J].Molecules,2023,28(3):1350.
[2]HE Y, CHEN Z, NIE X, et al.Recent advances in polysaccharides from edible and medicinal Polygonati rhizoma:From bench to market[J].Int J Biol Macromol,2022,195:102-116.
[3]衡利冰,夏永军,艾连中,等.植物乳植杆菌AR307发酵培养基优化研究[J].工业微生物,2024,54(1):81-86.
[4]CAO P,WU L,WU Z,et al.Effects of oligosaccharides on the fermentation properties of Lactiplantibacillus plantarum[J].J Dairy Sci,2019,102(4):2863-2872.
[5]张文平,赵英杰,罗晟,等.高产胞外多糖植物乳植杆菌筛选及其发酵工艺优化[J].食品与发酵工业,2019,45(21):38-45.
[6]QI Z,GAO T,LI J,et al.Structural characterization and prebiotic potential of polysaccharides from Polygonatum sibiricum[J].Food Science and Human Wellness,2024,13(4):2208-2220.
[7]刘晓丹,肖瀛,周建金,等.基于体外消化与发酵模型的多花黄精多糖对肠道菌群的影响[J].食品工业科技,2024,45(9):115-123.
[8]HUANG F,HONG R,ZHANG R,et al.Dynamic variation in biochemical properties and prebiotic activities of polysaccharides from longan pulp during fermentation process[J].Int J Biol Macromol,2019,132:915-921.
[9]杨勤,谷文超,周浓,等.苯酚-硫酸法与蒽酮-硫酸法测定地参多糖的比较研究[J].食品科技,2020,45(1):343-350.
[10]潘东梅,蔡维珊,梁业婷,等.黄精中糖类成分的含量测定方法比较及其酒蒸工艺优化[J].中国药房,2021,32(24):2994-3000.
[11]徐若愚.九蒸九制工艺对黄精及黄精多糖品质影响的研究[D].合肥:安徽农业大学,2023.
[12]HUANG F,HONG R,ZHANG R,et al.Physicochemical and biological properties of longan pulp polysaccharides modified by Lactobacillus fermentum fermentation[J].Int J Biol Macromol,2019,125:232-237.
[13]罗霜,王剑波,陈柯宇,等.不同产地药食同源黄精的成分及体外抗氧化研究[J].中国调味品,2023,48(6):59-65.
[14]周祉延,徐欣,周媛.人体微生物碳水化合物活性酶的研究进展[J].华西口腔医学杂志,2019,37(6):666-670.
[15]DEGRAIN A,MANHIVI V,REMIZE F,et al.Effect of lactic acid fermentation on color, phenolic compounds and antioxidant activity in African nightshade[J].Microorganisms,2020,8(9):1-12.
[16]孙建安,毛相朝,赵甜宇.米曲霉固态发酵生产壳寡糖的方法:CN201911020275.0[P].2019-12-27.
[17]RICCIARDI A,CASTIGLIONE MORELLI M A,IANNIELLO R G,et al.Metabolic profiling and stress response of anaerobic and respiratory cultures of Lactiplantibacillus plantarum C17 grown in a chemically defined medium[J].Ann Microbiol,2015,65:1639-1648.
[18]KIM S H,SINGH D,KIM S A,et al.Strain-specific metabolomic diversity of Lactiplantibacillus plantarum under aerobic and anaerobic conditions[J].Food Microbiol,2023,116:104364.
[19]HU Y,GANZLE M G.Effect of temperature on production of oligosaccharides and dextran by Weissella cibaria 10 M[J].Int J Food Microbiol,2018,280:27-34.
[20]张宏志,马艳弘,周剑忠,等.植物乳植杆菌β-半乳糖苷酶催化合成低聚半乳糖及其体外乳酸菌增殖活性[J].现代食品科技,2020,36(6):161-171.
[21]程芬,杨长花,宋艳丽,等.响应面法优化侧柏叶精油的超声辅助水蒸气蒸馏提取工艺[J].化学与生物工程,2024,41(7):18-23,29.
[22]杨壮,刘怡琳,李隆熙,等.固态发酵制备黄精多糖的工艺优化、理化特性及抗氧化活性[J].食品与发酵工业,2024,50(7):92-98.
[23]张艳雪,周巧,张学兰,等.黄精炮制前后寡糖与单糖类成分含量变化与转化机制研究[J].中药材,2020,43(2):318-322.
[24]HAN D, ZULEWSKA J, XIONG K, et al.Synergy between oligosaccharides and probiotics: From metabolic properties to beneficial effects[J].Crit Rev Food Sci Nutr,2024,64(13):4078-4100.
[25]SCHEEPENS A, TAN K, PAXTON J W.Improving the oral bioavailability of beneficial polyphenols through designed synergies[J].Genes Nutr,2010,5(1):75-87.