阿魏酰低聚糖(feruloyl oligosaccharides,FOs)是由阿魏酸羧基与低聚糖羟基通过酯键连接形成的一种功能性低聚糖,具有抗氧化、抗肿瘤、调节肠道健康等生理活性,在食品、医药等行业有重要应用价值[1-4]。通过酸水解、酶水解、微生物发酵等方法可以从谷物麸皮中制取FOs。与其他方法相比,发酵是直接利用微生物代谢分泌的胞外酶原位制备FOs,反应条件温和、效率较高、成本较低[5]。目前,已有利用出芽短梗霉(Aureobasidium pullulans)[6]、海鲜菇[7]、好食脉孢霉(Neurospora sitophila)[8]等真菌发酵啤酒糟、麦麸、玉米麸皮等农产品加工副产物生产FOs的报道。
玉米麸皮是玉米工业加工生产玉米淀粉的主要副产品之一,占玉米加工量的5%,主要由玉米粒的外层(果皮、果皮和糊粉)以及10%~25%的淀粉组成。目前玉米麸皮被广泛用作动物饲料,附加值较低[9]。 玉米麸皮含半纤维素、纤维素、蛋白质等成分。其中,阿拉伯木聚糖占玉米麸皮干质量的30%~50%,还含有较高产量的结合型阿魏酸(约5%),显著高于其他谷物麸皮[10-11]。天然状态下玉米麸皮中的阿魏酸及其二聚体与细胞壁多糖发生交联,限制多糖降解酶对底物的可及性,使其酶解效率较低,在动物消化道中几乎无法被消化或发酵,导致摄入的90%玉米麸皮会随着粪便排出,降低了其营养价值[12]。
发酵是一种改善农产品加工副产物理化性质的常用手段,可通过微生物胞外酶的酶解使复杂的有机物转化为具有潜在健康功能的其他小分子化合物[13]。乳酸菌、酵母菌的一些菌株可以产生木聚糖酶、阿魏酸酯酶等水解酶系[14-15]。AKBARI M等[16]研究发现,罗伊氏乳杆菌(Lactobacillus reuteri)固体发酵产生的胞外酶可以破坏麸皮基质的结构,提高玉米麸皮中总酚的产量。发酵可以提高玉米麸皮酚类化合物的生物可及性和生物利用度[17]。SPAGGIARI M等[18]研究发现,鼠李糖乳杆菌(Lactobacillus rhamnosus)通过固态发酵麦麸时向胞外分泌木聚糖酶、阿拉伯呋喃糖苷酶和阿魏酸酯酶降解麦麸释放酚酸。米曲霉是公认安全的微生物,在不同的发酵条件下能选择性地诱导产生纤维素酶,其代谢产物能够促进乳酸菌的生长[19-20]。通过混菌发酵,可以发挥上述微生物的协同酶解作用,提高谷物FOs、膳食纤维等活性成分释放率[21]。但采用混菌发酵玉米麸皮释放FOs,提高其营养价值鲜见报道。
本研究以玉米麸皮、干豆渣为主要原料,利用米曲霉(Aspergillus oryzae)YY21、酿酒酵母(Saccharomyces cerevisiae)2607、植物乳植杆菌(Lactiplantibacillus plantarum)13110混合固态发酵制备FOs,通过对培养基和发酵条件的优化,确定固体发酵玉米麸皮产FOs的工艺条件,以期提高玉米麸皮的营养价值,为延长玉米加工产业链提供基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种和材料
米曲霉(Aspergillus oryzae)YY21、酿酒酵母(Saccharomyces cerevisiae)2607、植物乳植杆菌(Lactiplantibacillus plantarum)13110:齐齐哈尔大学食品与生物工程学院。
玉米麸皮:黑龙江龙凤玉米开发有限公司;干豆渣:市售。
1.1.2 材料与试剂
牛血清白蛋白标准品(纯度>98%):上海蓝季生物试剂有限公司;甘氨酸、氢氧化钠(均为分析纯):国药集团化学试剂有限公司;其余试剂均为分析纯:天津市凯通化学试剂有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g/L、葡萄糖20 g/L,用蒸馏水定容至1 000 mL,pH自然。
PDA液体培养基:马铃薯200 g/L、葡萄糖20 g/L、琼脂20 g/L,用蒸馏水定容至1 000 mL,pH自然。
酵母浸出粉胨葡萄糖培养基(yeast extract peptone dex trose,YPD)培养基:20 g/L胰蛋白胨、20 g/L葡萄糖,用蒸馏水定容至1 000 mL,pH自然。
LB液体培养基:胰蛋白胨10 g/L、酵母粉5 g/L、氯化钠10 g/L,用蒸馏水定容至1 000 mL,pH7.0。
将上述培养基均于121 ℃灭菌20 min。
1.2 仪器与设备
DSX-280B手提式压力蒸汽灭菌器:上海申安有限责任公司;FA1104电子天平:上海良平仪器仪表有限公司;ZHJC2109C超净工作台:上海智城分析仪器有限公司;SPX-150BS-Ⅱ生化培养箱:天津市泰斯特仪器有限公司;722S可见分光光度计:上海佑科仪器仪表有限公司。
1.3 方法
1.3.1 菌株的活化及种子液的制备
菌株的活化[22]:将4 ℃保存的米曲霉(Aspergillus oryzae)YY21接种到PDA培养基、酿酒酵母(Saccharomyces cerevisiae)2607接种到YPD固体培养基、植物乳植杆菌(Lactiplantibacillus plantarum)接种到LB培养基中,进行固体斜面培养,米曲霉、酿酒酵母及植物乳植杆菌培养条件分别为28 ℃培养24 h、28 ℃培养24 h、32 ℃培养24 h。
种子液的制备:将活化后的米曲霉(Aspergillus oryzae)YY21接种到马铃薯葡萄糖培养基、酿酒酵母(Saccharomycescerevisiae)2607接种到YPD液体培养基、植物乳植杆菌(Lactiplantibacillus plantarum)接种到LB液体培养基中,米曲霉、酿酒酵母及植物乳植杆菌分别于32 ℃培养24 h、28 ℃培养24 h、32 ℃培养24 h,即得种子液。
1.3.2 发酵工艺优化
单因素试验:以玉米麸皮为碳源,干豆渣为氮源,玉米麸皮及干豆渣总添加量为4%,分别考察碳氮源质量比(10∶0、8∶2、6∶4、4∶6、2∶8)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)、混菌(1∶1∶1)接种量(4%、6%、8%、10%、12%)、料水比(2∶1、1∶1、2∶3、1∶2、2∶5(g∶mL))、发酵时间(24 h、48 h、72 h、96 h、120 h)对FOs产量的影响。
正交试验:在单因素试验结果基础上,固定碳氮源质量比为8∶2,发酵温度为32 ℃,以接种量(A)、料水比(B)、发酵时间(C)为影响因素,以FOs产量为评价指标,进行3因素3水平正交试验。发酵工艺优化正交试验设计因素与水平见表1。
表1 发酵工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation process optimization

水平A 接种量/%B 料水比(g∶mL)C 发酵时间/h 123 8 10 12 2:3 1:2 2:5 48 72 96
1.3.3 FOs的提取及产量测定
FOs的提取:发酵培养基中玉米麸皮和豆渣质量比为8∶2,玉米麸皮和豆渣添加量为4%,混菌(1∶1∶1)种子液接种量10%,料水比1∶2(g∶mL),在32 ℃培养96 h。发酵结束后将发酵产物在105 ℃烘干至恒质量并粉碎至100目,取干料1 g,与100 mL蒸馏水充分混匀,80 ℃条件下浸提30 min,于5 000 r/min条件下离心10 min后,取上清液测定FOs产量。
FOs产量测定:采用双波长法[8]。取1 mL上清液与9 mL的甘氨酸-NaOH缓冲溶液(0.1 mol/L,pH10)混合并摇匀,分别在波长345 nm和375 nm处测定吸光度值(OD值)。FOs产量计算公式如下:
式中:b为比色皿厚度,1 cm;C1:阿魏酸浓度,mol/L;C2:阿魏酸低聚糖浓度,mol/L;A345为波长345 nm的OD345 nm值;A375为波长375 nm的OD375 nm值;阿魏酸摩尔吸光系数:ε'345=19 662 L/(mol·cm),ε'375=7 630 L/(mol·cm);阿魏酰低聚糖摩尔吸光系数:ε345=23 064 L/(mol·cm),ε375=31 430 L/(mol·cm)。
1.3.4 数据处理
所有试验均重复3次,利用WPS Office v11.24.1和SPSS 25.0进行单因素方差检验,采用多项式对比、方差齐性检验和Duncan氏法进行多重比较。P<0.01表示差异极显著;P<0.05表示差异显著;P>0.05表示差异不显著。
2 结果与分析
2.1 发酵工艺优化单因素试验
2.1.1 玉米麸皮和干豆渣质量比对FOs产量的影响
培养基为菌种生长代谢提供营养物质,碳源和氮源是构成培养基的两类主要营养物质,适宜的碳源、氮源的比例会促进菌体生长或目标产物合成[23]。干豆渣是豆腐或豆浆加工的副产品,来源广泛,价格低廉,营养价值较丰富,其中粗蛋白产量约20%~27%[24-25]。 为满足微生物生长需求,以玉米麸皮为培养基碳源,以豆渣为培养基氮源,玉米麸皮及豆渣总添加量为4%,研究玉米麸皮和干豆渣质量比对FOs产量的影响,结果见图1。
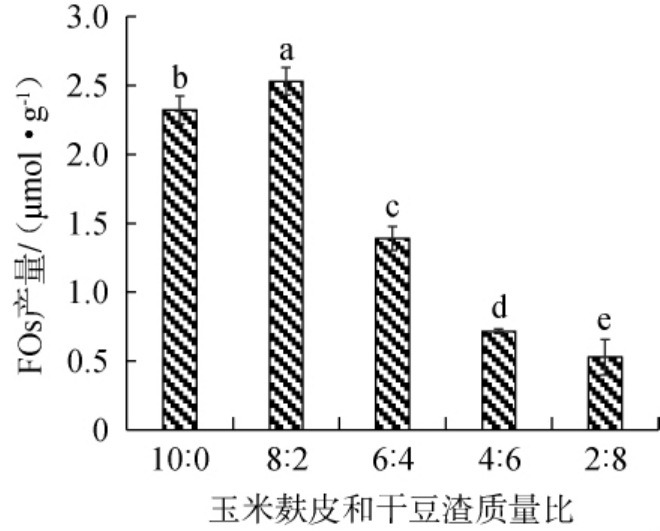
图1 玉米麸皮及干豆渣质量比对阿魏酰低聚糖产量的影响
Fig.1 Effect of mass ratio of corn bran to dry soybean residue on the yield of feruloyl oligosaccharide
不同小写字母表示差异显著(P<0.05)。下同。
由图1可知,当玉米麸皮添加量占培养基干基总添加量的80%、干豆渣添加量占培养基干基总添加量的20%,即碳源、氮源质量比为8∶2时发酵产物中FOs产量显著高于其他组FOs产量(P<0.05)。玉米麸皮中多糖含量高,但是含氮相对不足,影响菌体诱导酶的合成,添加适量豆渣后培养基的氮素产量得到改善,进而提高了FOs产量,但是,豆渣比例过高,培养基透气性变差,影响好氧菌生长代谢,导致FOs产量降低。因此,确定最适玉米麸皮和干豆渣质量比为8∶2。
2.1.2 发酵温度对FOs产量的影响
培养温度影响菌种生长繁殖和代谢产物的生成,温度过低导致菌种生长缓慢甚至停止生长,酶促反应减缓导致产物合成量低;温度升高时,菌体代谢速率提高,产热增加,导致培养基内局部温度升高,抑制菌体的生长和代谢产物的分泌,培养温度过高甚至会引起菌体死亡[26]。混菌发酵时,需要综合考虑各菌株的适宜生长温度范围,本研究中,米曲霉、酿酒酵母和植物乳植杆菌的最适生长温度范围分别为32~35 ℃、28~30 ℃、30~35 ℃,研究不同发酵温度对FOs产量的影响,结果见图2。
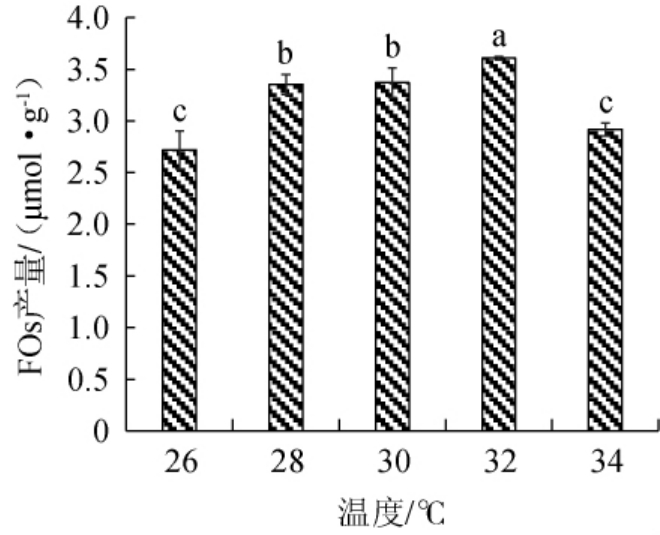
图2 发酵温度对阿魏酰低聚糖产量的影响
Fig.2 Effect of fermentation temperature on the yield of feruloyl oligosaccharide
由图2可知,随发酵温度在26~34 ℃范围内的升高,FOs产量呈先上升后下降趋势。当发酵温度为26~32 ℃时,FOs产量随之升高;当发酵温度为32 ℃时,FOs产量达到最大值,为(3.61±0.02)μmol/g,显著高于其他温度FOs产量(P<0.05);当发酵温度>32 ℃之后,FOs产量显著降低(P<0.05)。其原因可能是因为发酵温度较低时,菌种代谢缓慢,分泌胞外酶不足,导致FOs产量较低;发酵温度较高时(如34 ℃),酶促反应速度加快,菌体代谢速率提高,可能会影响与生长非偶联型的代谢产物生成,导致目标产物产量较低。因此,确定最适发酵温度为32 ℃。
2.1.3 混菌接种量对FOs产量的影响
适宜的混菌接种量有利于微生物代谢产物的积累,有效缩短发酵周期[27]。米曲霉、酿酒酵母、植物乳植杆菌的种子液按体积比为1∶1∶1混合后得到复合种子液,混菌接种量对FOs产量的影响结果见图3。
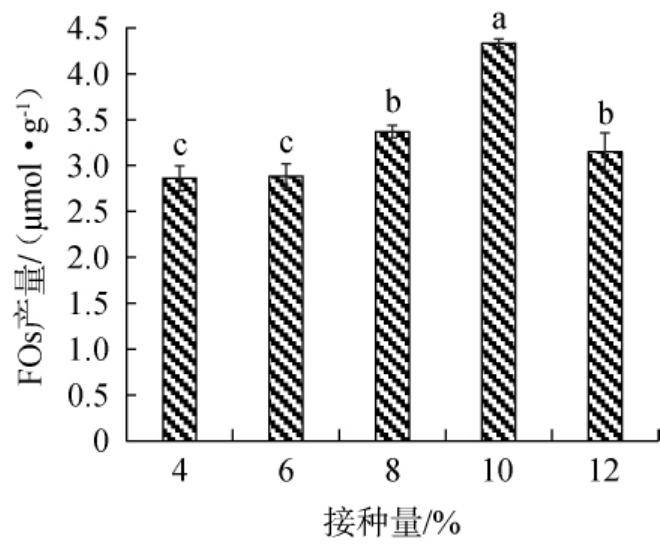
图3 混菌接种量对阿魏酰低聚糖产量的影响
Fig.3 Effect of mixed-strains inoculum on the yield of feruloyl oligosaccharide
由图3可知,随混菌接种量在4%~12%范围内的升高,FOs产量呈先上升后下降趋势;当混菌接种量为4%~10%时,FOs产量随之升高;当混菌接种量为10%时,FOs产量最高,为(4.33±0.05)μmol/g,显著高于其他混菌接种量FOs产量(P<0.05);当混菌接种量>10%之后,FOs产量显著降低(P<0.05)。接种量较低时,菌体生物量低,导致发酵速率缓慢;接种量较高时,菌种对培养基中营养物质需求增大,产生竞争性抑制,同时,菌种可能会消耗产物,导致产物生产量降低[28]。因此,确定最适混菌接种量为10%。
2.1.4 料水比对FOs产量的影响
固体发酵的培养基料水比直接影响培养过程中氧产量、散热速度、营养物质利用的效率,进而影响菌种生长和产物合成[29]。料水比对FOs产量的影响结果见图4。
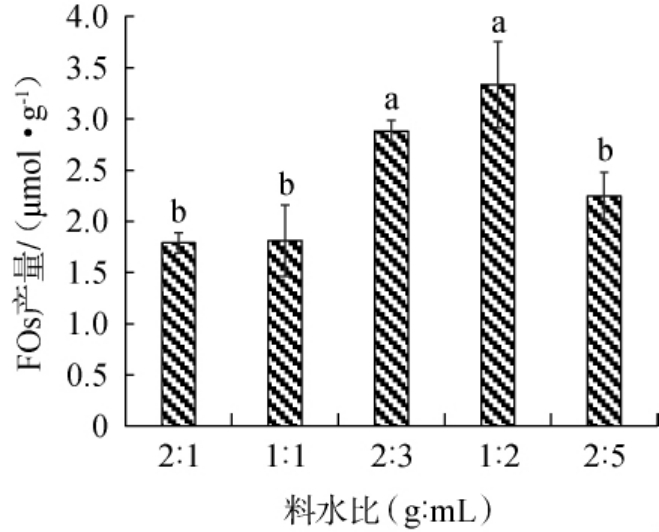
图4 料水比对阿魏酰低聚糖产量的影响
Fig.4 Effect of solid-liquid ratio on the yield of feruloyl oligosaccharide
由图4可知,当料水比为2∶1、1∶1、2∶3、1∶2(g∶mL)时,FOs产量随之升高;当料水比为1∶2(g∶mL)时,FOs产量最高,为(3.34±0.42)μmol/g,显著高于其他料水比FOs产量(P<0.05);当料水比为1∶2、2∶5(g∶mL)时,FOs产量随着含水量的增加而下降。 其原因可能是由于过高的含水量使培养基与氧气的接触面积减小,兼性厌氧菌的代谢产能不足,生长受抑制。因此,确定最适料水比为1∶2(g∶mL)。
2.1.5 发酵时间对FOs产量的影响
菌株代谢产物的积累与培养时间有关[30]。培养时间较短时,微生物主要处于细胞生长繁殖阶段,代谢物的积累相对较少;过长的培养时间不仅增加了成本,而且由于微生物生长和繁殖的环境条件的变化,目标代谢物本身的挥发或转化,以及微生物生长和代谢异常而积累过多的其他代谢物,导致目标代谢物的产量和纯度下降。 因此,有效控制培养时间,以较低的成本获得所需的代谢产物至关重要[31]。发酵时间对FOs产量的影响结果见图5。
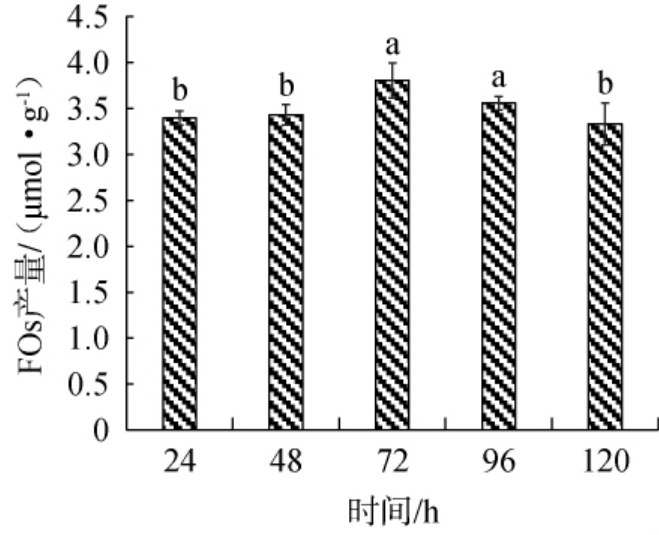
图5 发酵时间对阿魏酰低聚糖产量的影响
Fig.5 Effect of fermentation time on the yield of feruloyl oligosaccharide
由图5可知,随着发酵时间在24~120 h内的延长,FOs产量呈现出先升高后降低的趋势。当发酵时间为在24~72 h时,FOs产量随之升高;当发酵时间为72 h,FOs产量最高,为(3.81±0.19) μmol/g,显著高于其他发酵时间产量(P<0.05);当发酵时间超过72 h之后,FOs产量有所下降。可能是在培养的前期,培养基中营养物质丰富,微生物产酶旺盛,FOs产量呈现上升趋势;在培养的后期,培养基中营养物质逐渐被消耗,不能满足微生物继续生长繁殖,同时,菌株代谢产酸的逐渐积累导致环境pH发生变化,不适宜菌株生长。与此同时,部分产生的FOs被微生物分解利用,FOs产量呈现下降趋势[32]。 据报道,一些乳酸菌,如希氏乳杆菌、短乳杆菌和植物乳杆菌都能够生物转化酚类化合物,并能通过非氧化脱羧基作用将阿魏酸转化为香兰素和香兰醇等化合物[33]。LI Z等[34]利用植物乳杆菌ATCC14917固态发酵提取苹果中酚类化合物时最佳发酵时间是72 h,发酵72 h后总酚产量逐渐减少,可能与植物乳杆菌对简单酚类物质的生物转化和高分子量酚类化合物的解聚有关。因此,确定最适发酵时间为72 h。
2.2 发酵工艺优化正交试验优化
在单因素试验结果基础上,固定碳氮源质量比为8∶2,发酵温度为32 ℃,以接种量(A)、料水比(B)、发酵时间(C)为影响因素,以FOs产量为评价指标,进行3因素3水平正交试验。发酵正交试验设计结果与分析见表2,方差分析结果见表3。
表2 发酵工艺优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for fermentation process optimization
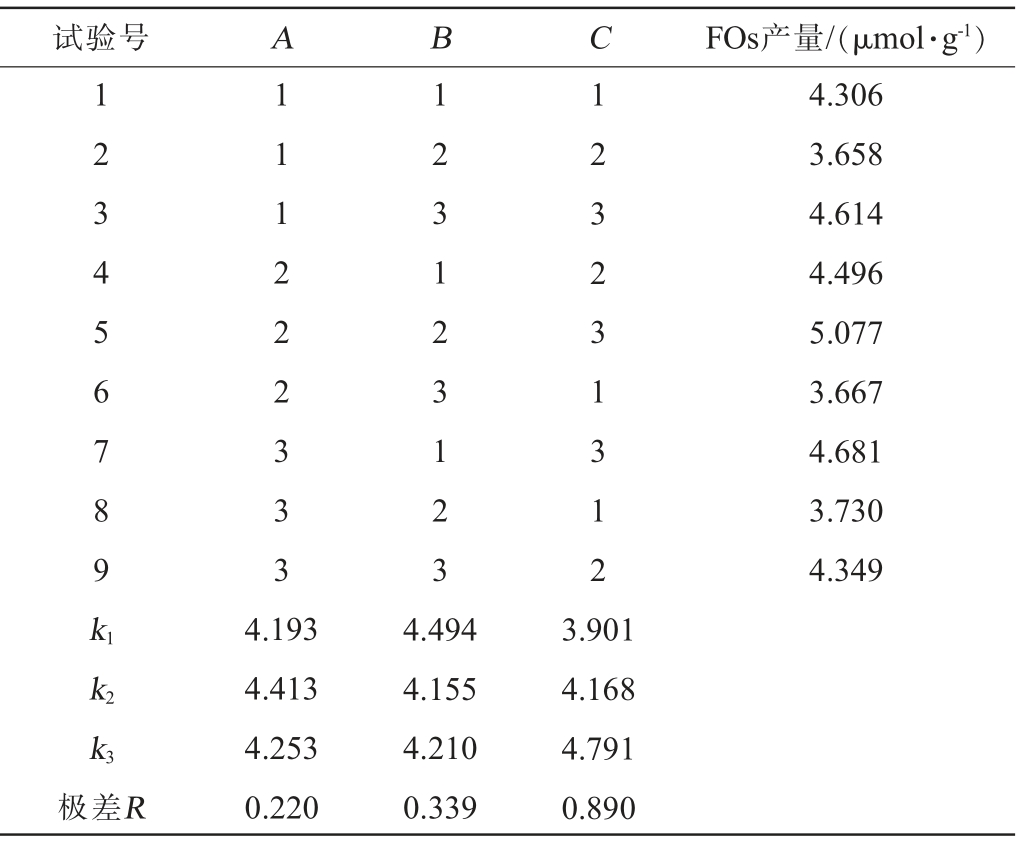
试验号ABCFOs产量/(μmol·g-1)123456789k1 111222333 123123123 123231312 4.306 3.658 4.614 4.496 5.077 3.667 4.681 3.730 4.349 k2 k3极差R 4.193 4.413 4.253 0.220 4.494 4.155 4.210 0.339 3.901 4.168 4.791 0.890
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiments results
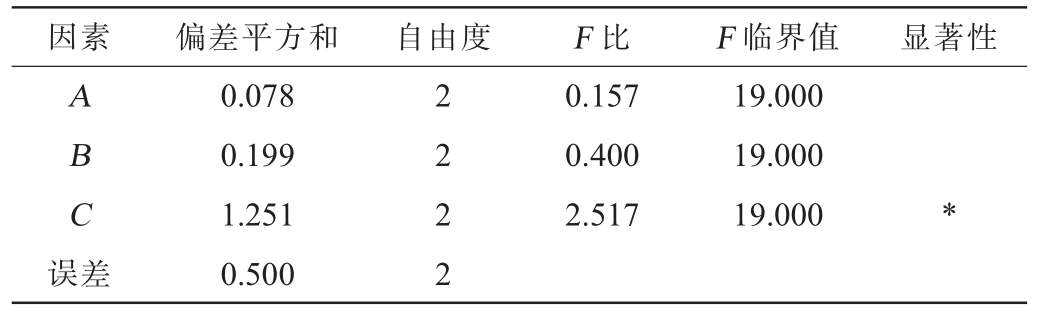
注:“*”表示对结果影响显著(P<0.05)。
因素偏差平方和自由度F 比F 临界值显著性ABC误差0.078 0.199 1.251 0.500 2222 0.157 0.400 2.517 19.000 19.000 19.000*
由表2可知,由极差值可得发酵工艺条件最佳组合为A2B1C3,即接种量10%、料水比2∶3(g∶mL)、发酵时间96 h。基于对极差的分析可以得到对FOs产量影响程度大小的顺序依次为C>B>A,即发酵时间>料水比>接种量。
由表3可知,发酵时间对FOs产量的影响具有显著影响(P<0.05),接种量、料水比对FOs产量无显著影响(P>0.05)。
根据上述研究确定混菌固体发酵玉米麸皮产FOs的条件为:玉米麸皮和豆渣的质量比为8∶2,接种量10%,料水比2∶3(g∶mL),在32 ℃培养96 h。在此优化发酵工艺条件下进行3次平行验证试验,FOs产量达到5.077 μmol/g,较优化前(2.190 μmol/g)提高了131.83%,该产量均高于已报道的出芽短梗霉[6]、海鲜菇[7]、好食脉孢霉[8]等微生物单菌发酵产FOs的产量。
3 结论
本研究以玉米、麸皮分别为碳源、氮源,利用混菌发酵技术生产以FOs,优化了工艺条件。 结果表明,最佳发酵工艺为玉米麸皮和豆渣质量比为8∶2,混菌(1∶1∶1)接种量10%,料水比2∶3(g∶mL),发酵温度32 ℃及发酵时间96 h。在此优化条件下,FOs产量为5.077 μmol/g,较优化前提高了131.83%。 本研究通过工艺优化提高了混菌发酵玉米麸皮生产FOs的产量,为提高玉米麸皮附加值提供了可行的技术,也为延长玉米加工产业链提供了参考。
[1]DENG F H,LUO S J,HU X T,et al.Preparation,structural characterization and properties of feruloyl oligosaccharide-rice protein hydrolysate conjugates[J].Food Rese Int,2024,176:113844.
[2]OU J Y,SUN Z.Feruloylated oligosaccharides:Structure,metabolism and function[J].J Funct Foods,2014,7:90-100.
[3]DENG L J, ZHOU X Y, TAO G, et al.Ferulic acid and feruloylated oligosaccharides alleviate anxiety and depression symptom via regulating gut microbiome and microbial metabolism[J].Food Res Int,2022,162:111887.
[4]杨柳,欧仕益,黄俊卿,等.玉米皮阿魏酰低聚糖调节小鼠肠道菌群及缓解结肠炎的研究[J].食品与生物技术学报,2024,43(5):146-155.
[5]ROSE D J, INGLETT G E.Production of feruloylated arabinoxylooligosaccharides from maize(Zea mays) bran by microwave-assisted autohydrolysis[J].Food Chem,2010,119(4):1613-1618.
[6]卜雯丽,李凤伟,王杰,等.出芽短梗霉固态发酵啤酒糟制备阿魏酰低聚糖和膳食纤维工艺研究[J].中国酿造,2019,38(5):38-43.
[7]杜娟,张紫薇,李梦,等.海鲜菇发酵玉米皮渣制备阿魏酰低聚糖[J].粮食与油脂,2024,37(11):105-110.
[8]肖凯,邓永平,刘宇驰,等.好食脉孢霉固体发酵玉米麸皮产阿魏酰低聚糖工艺优化[J].食品工业科技,2023,44(16):1-7.
[9]JIANG C X,WEI X Y,LIU X L,et al.Multivariate analysis of structural and functional properties of soluble dietary fiber from corn bran using different modification methods[J].Food Chem,2025,462:140989.
[10]GUO Y J,ZHANG Z,DOU J Z,et al.Structural characterization of corn fiber hemicelluloses extracted by organic solvent and screening of degradation enzymes[J].Carbohyd Polym,2023,313:120820.
[11]GALANAKIS C M.Sustainable recovery and reutilization of cereal processing by-products[M].London:Woodhead Publishing,2018:279-317.
[12]JIANG K K, LI L L, LONG L K, et al.Comprehensive evaluation of combining hydrothermal pretreatment (autohydrolysis) with enzymatic hydrolysis for efficient release of monosaccharides and ferulic acid from corn bran[J].Ind Crop Prod,2018,113:348-357.
[13]HUI Y,XIAN X,HAO J X,et al.Mixed fermentation of citrus peel pomace with Trichoderma koningii,Aspergillus oryzae and Lactobacillus casei:Process optimization,antioxidant activities and non-targeted metabolomics analysis[J].Food Biosci,2025,66:106180.
[14]LI Y Q,ZHANG Y Z,DONG L Z,et al.Fermentation of Lactobacillus fermentum NB02 with feruloyl esterase production increases the phenolic compounds content and antioxidant properties of oat bran[J].Food Chem,2024,437:137834.
[15]BYANJU B, LAMSAL B P.Effects of Lactiplantibacillus plantarum and Bacillus subtilis fermentation on the constituents of ground or extruded corn bran[J].Food Res Int,2025,203:115812.
[16]AKBARI M, RAZAVI S H, KHODAIYAN F, et al.Fermented corn bran:A by-product with improved total phenolic content and antioxidant activity[J].LWT-Food Sci Technol,2023,184:115090.
[17]ROCCHETTI G, GREGORIO R P, LORENZO J M, et al.Functional implications of bound phenolic compounds and phenolics-food interaction: A review[J].Compre Rev Food Sci Food Safety, 2022, 21(2):811-842.
[18]SPAGGIARI M,RICCI A,CALANI L,et al.Solid state lactic acid fermentation: A strategy to improve wheat bran functionality[J].LWTFood Sci Technol,2020,118:108668.
[19]MEINI M R,CABEZUDO I,GALETTO C S,et al.Production of grape pomace extracts with enhanced antioxidant and prebiotic activities through solid-state fermentation by Aspergillus niger and Aspergillus oryzae[J].Food Biosci,2021,42:101168.
[20]PUSPITASARI C,PINSIRODOM P,WATTANACHAISAEREEKUL S.Effect of solid-state fermentation using Aspergillus oryzae and Aspergillus niger on bitter and bioactive compounds of Moringa oleifera seed flour[J].LWT-Food Sci Technol,2024,207:116616.
[21]FAN L,MA S,LI L,et al.Fermentation biotechnology applied to wheat bran for the degradation of cell wall fiber and its potential health benefits:A review[J].Int J Biol Macromol,2024,275(Part 1):133529.
[22]邓永平,肖凯,车鑫,等.多菌株发酵农产品加工副产物制备蛋白质饲料的工艺优化[J].中国饲料,2023(3):149-154.
[23]侯亚丽,刘好静,萧犹睿,等.不同料水比对混菌发酵玉米皮品质的影响[J].饲料研究,2024,47(15):108-111.
[24]HENG X Y,CHEN H Y,LU C X,et al.Study on synergistic fermentation of bean dregs and soybean meal by multiple strains and proteases[J].LWT-Food Sci Technol,2022,154:112626.
[25]WANG F, ZENG J, TIAN X L, et al.Effect of ultrafine grinding technology combined with high-pressure, microwave and high-temperature cooking technology on the physicochemical properties of bean dregs[J].LWT-Food Sci Technol,2022,154:112810.
[26]CAO Y, ZHANG H X, DU H, et al.Microorganisms and metabolic characteristics of temperature-dependent fermentation during sauce-flavor Baijiu production[J].Food Biosci,2025,63:105787.
[27]范光森,刘朋肖,吴秋华,等.有氧条件下酿酒酵母YF1914产乙醇发酵条件优化及其产香特性[J].食品工业科技,2019,40(13):52-58.
[28]CARRAU F, MEDINA K, FARIÑA L, et al.Effect of Saccharomyces cerevisiae inoculum size on wine fermentation aroma compounds and its relation with assimilable nitrogen content[J].Int J Food Microbiol,2010,143(1-2):81-85.
[29]XUE W J,SHENG Y R,TAI Y K,et al.Mechanism of improved cellulase production by Trichoderma reesei in water-supply solid-state fermentation[J].Biores Technol,2025,419:132017.
[30]ZHAO L, LI L, HU M, et al.Heterologous expression of the novel dimeric antimicrobial peptide LIG in Pichia pastoris[J].J Biotechnol,2024,381:19-26.
[31]CORIA-HINOJOSA L M, VELÁSQUEZ-REYES D, ALCÁZAR-VALLE M,et al.Exploring volatile compounds and microbial dynamics:Kluyveromyces marxianus and Hanseniaspora opuntiae reduce Forastero cocoa fermentation time[J].Food Res Int,2024,193:114821.
[32]CǍLINOIU LF,CǍTOI A F,VODNAR D C.Solid-state yeast fermented wheat and oat bran as a route for delivery of antioxidants[J].Antioxidants,2019,8(9):372.
[33]KAUR B, CHAKRABORTY D, KUMAR B.Phenolic biotransformations during conversion of ferulic acid to vanillin by lactic acid bacteria[J].Biomed Res Int,2013,2013:590359.
[34]LI Z, TENG J, LYU Y, et al.Enhanced antioxidant activity for apple juice fermented with Lactobacillus plantarum ATCC14917[J].Int J Refrige,2018,89:51-60.