白酒酿造在我国有着悠久的历史,因原料、酒曲和生产工艺以及自然环境等因素的差别,形成了各具特色、风格迥异的多种香型的白酒,其中浓香型白酒具有芳香浓郁、绵柔甘洌、香味协调、入口甜、落口绵、尾净余长等特点,成为白酒行业的主流产品[1]。浓香型白酒窖泥孕育了种类丰富、数量繁多、功能各异的微生物,为产酸呈味、产酯生香提供了良好的生存环境,被称作“微生物黄金”。 在传统固态浓香型白酒酿造过程中,窖泥微生物区系对白酒的风味与品质至关重要,窖泥中微生物的生长代谢活动对白酒风味物质的形成具有重要影响。
通过分子生态学手段,可确定窖泥微生物群落结构中的优势种群均为梭菌纲、芽孢杆菌纲和拟杆菌门[2-5],其中梭菌一直被认为是影响浓香型白酒风味物质形成的重要菌体,对己酸、丁酸、己酸乙酯和丁酸乙酯等典型风味物质的形成具有重要作用,典型的有库氏梭菌(Clostridium kluyveri)、酪丁酸梭菌(Clostridium tyrobutyricum)和丁酸梭菌(Clostridium butyricum)等[6-7]。梭菌作为专营厌氧的微生物,虽通过高通量测序能够确定其为优势菌属,但由于缺乏明确的梭菌培养基和培养条件仅有极少数梭菌被分离筛选得到,其中就包含大量的丁酸菌。丁酸菌含量的多少以及产丁酸能力的高低都直接影响着浓香型白酒酒体风格的形成[8-9],丁酸是浓香型白酒窖泥香的重要组成成分,而且可以与酒曲发酵产生的酒精发生酯化反应,生成浓香型白酒的所特有的主体香成分丁酸乙酯,从而改善浓香型白酒的风味及口感,影响浓香型白酒的风格和质量[10-11]。从代谢途径来看,可发酵底物先被利用生成丁酸后,可以形成己酸,丁酸作为己酸代谢途径的中间产物[12],很大程度上决定了己酸产量的高低。 此外,丁酸不仅是合成香料物质及其他精细化工产品的一种非常重要的原料,目前也已经广泛应用到食品、化学、饲料以及医药等多种行业中,市场需求量巨大[13],高产丁酸菌株的分离筛选受到业界极大关注。
浓香型白酒窖泥微生物群落研究一直是业界研究热点,特别是一些主要功能菌的分离纯化及窖池微生物特征进展迅速[6-7,14]。高文文等[15]从健康成人新鲜粪便中筛选得到一株丁酸梭菌,发酵24 h后丁酸产量达到2.1 g/L;王友玲等[16]在山东地区从人粪便、扳倒井酒厂窖泥和动物肠道内容物分离筛选出3株丁酸梭状芽孢杆菌,产丁酸量分别为2.07 g/L、1.66 g/L、1.97 g/L;袁华伟等[17]从川南某酒厂的老窖泥中筛选得到一株丁酸梭菌,丁酸产量为3.44 g/L;刘瑾等[18]从中国安徽文王酒业的窖泥样品中筛选获得2株丁酸梭菌,产丁酸量分别为0.411 7 g/L、0.004 3 g/L;衡文等[19]从安徽某浓香型白酒厂窖泥筛选获得两株高产丁酸菌株,在最适生长条件下产丁酸量分别为5.29 g/L、5.23 g/L。 然而,对具有北方特色酒厂窖泥中高产丁酸菌株的研究却鲜少有报道。 本研究以河北凤来仪酒业有限公司优质窖泥为研究对象,对其中的丁酸梭菌进行了筛选鉴定,并对一株高产丁酸的菌株进行了培养条件的优化,优化后的菌株具有良好的生长及产丁酸能力。旨在对浓香型白酒窖泥中的产丁酸的菌株进行挖掘,为白酒风味的提升乃至其他精细化工行业提供优质的菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
窖泥样品:采用五点取样法取河北凤来仪酒业有限公司窖池窖泥,装入厌氧袋后,用冰盒迅速运回实验室,于4 ℃冰箱保存待用。
1.1.2 试剂
液体石蜡、氯化钠(均为分析纯),丁酸(色谱纯):国药集团化学试剂有限公司。
1.1.3 培养基
梭菌强化培养基(reinforced clostridium medium,RCM):蛋白胨10 g,酵母浸出粉3 g,葡萄糖5 g,牛肉浸出粉10 g,氯物钠5 g,盐酸半胱氨酸0.5 g,醋酸钠3 g,可溶性淀粉1 g,琼脂粉0.5 g,蒸馏水1 000 mL,115 ℃灭菌20 min;固体培养基需要加入2%(V/V)的琼脂,115 ℃灭菌20 min。
乙醇乙酸钠液体发酵培养基[19]:葡萄糖10 g/L,乙酸钠20 g/L,酵母粉5 g/L,刃天青钠0.1 mg/L,L-半胱氨酸0.002 5 g,KH2PO40.05 g/L,CaCl20.001 g/L,Fe2(SO4)3·3H2O 0.000 1 g/L,K2HPO4 0.05 g/L,(NH4)2SO4 0.1g/L,MgSO4·7H2O 0.02 g/L,调节pH为7.0,去离子水1 L,121 ℃高压灭菌20 min,接菌前需添加2%(V/V)无水乙醇和1%(V/V)经干热灭菌的碳酸钙。
1.2 仪器与设备
JY2002电子天平:上海浦春计量仪器有限公司;PHS-3C型pH计:上海精密科学仪器有限公司;YXQ-LS-50SII立式压力蒸汽灭菌锅:上海博讯实业有限公司;HW326恒温水浴锅:上海一恒科技有限公司;AW300SG厌氧工作站:上海磐麦科技有限公司;OLYMPUS显微镜:北京锐驰恒业仪器科技有限公司;3-30K冷冻离心机:美国Sigma公司;T100TM Thermal Cycler型梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;EPS301琼脂糖凝胶电泳仪,Image Quant 300凝胶成像仪:美国GE公司;TU-19紫外可见分光光度计:北京普析通用仪器有限责任公司;Waters e2695高效液相色谱仪(high performance liquid chromatography,HPLC):美国沃特世公司。
1.3 试验方法
1.3.1 丁酸梭菌的分离筛选和纯化
富集培养:称取10 g窖泥样品加入90 mL无菌生理盐水溶液的锥形瓶中(可在瓶内预置适当数量的无菌玻璃珠),振荡约5 min,使窖泥分散均匀成悬液,然后80 ℃加热10 min以杀死营养细菌细胞。吸取热处理后的悬液,以10%(V/V)的接种量接种至液体强化梭菌培养基中,上层加入5 mL液体石蜡进行液封,于厌氧培养箱中,37 ℃静置培养3~7 d。
分离筛选:将富集培养的液体以10倍逐级稀释至适当稀释度,分别吸取稀释梯度为10-1、10-2、10-3、10-4、10-5、10-6倍的稀释液200 μL涂布于固体梭菌强化培养基(每个稀释度做3个平行),用封口膜封口后倒置于35 ℃培养箱中恒温培养3 d。
纯化:采用三区划线法对得到的黄色菌落划线于固体梭菌强化培养基,连续划线2~3次纯化得到单菌落。在厌氧条件下35 ℃条件下培养3 d,并保存甘油管于-80 ℃冰箱。
1.3.2 菌株产丁酸能力的鉴定
将分离纯化后的菌株以1%(V/V)的接种量接种于5 mL RCM培养基中,35 ℃厌氧静置培养1 d作为种子液,以5%(V/V)的接种量将种子液接种至装有50 mL乙醇乙酸钠液体发酵培养基的锥形瓶中,35 ℃厌氧静置培养7 d。
样品处理:发酵终点取各菌株的发酵液1mL,13000r/min离心2min,转移上清至新的离心管中,煮沸5min,13000r/min离心2 min,吸取上清液,0.22 μm滤膜过滤,采用高效液相色谱法(HPLC)测定丁酸产量。
色谱条件为[20]:BioRadAminexHPX-87H色谱柱(300mm×7.8 mm);流动相0.006 mol/L稀硫酸溶液;流速0.9 mL/min;柱温65 ℃;进样量10 μL;示差折光检测器。
1.3.3 高产丁酸菌株的鉴定
菌株菌落及细胞形态学观察:将筛选出高产丁酸的菌株制成菌悬液,梯度稀释后,选取10-7的稀释度涂布于RCM固体培养基上,置于35 ℃厌氧静置培养72 h,挑取单菌落再次于RCM固体培养基上分离划线,厌氧静置培养72 h后,观察菌落形态,并挑取单个菌落进行革兰氏染色,显微镜下观察细胞形态,并记录。
菌株的分子生物学鉴定:(1)将活化后的菌株取1 mL于1.5 mL离心管中离心,弃去上清液加入TE Buffer 50 μL,混匀,并煮沸8~10 min以暴露细菌的脱氧核糖核酸(deoxyribonucleicacid,DNA),冷却,放入冰盒,备用。细菌引物:27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-GGTTACCTTGTTACGACTT-3'。(2)PCR扩增体系:Premix Taq聚合酶12.5 μL,引物27F和1492R各0.5 μL,双蒸水(ddH2O)11 μL,DNA模板0.5 μL。PCR扩增条件:预变性94 ℃10 min,变性94 ℃30 s,55 ℃退火30 s,72 ℃延伸1 min,循环30次(设29次),72 ℃再延伸10 min。对PCR产物进行琼脂糖凝胶电泳进行DNA验证,并将条带较亮的PCR样品送至公司测序。(3)将测序得到的16S rDNA序列在美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库中,使用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,选择相似度较高的菌株序列约10个。将选择的序列与测序序列用DNAStar软件的MegAlign构建菌株系统进化树,确定菌株的种属。
1.3.4 高产丁酸菌株生长曲线的绘制及丁酸产量变化
经过筛选后保藏的高产丁酸菌株以1%(V/V)的接种量接种于5 mL RCM培养基中,35 ℃厌氧静置培养1 d作为种子液,以5%(V/V)的接种量将种子液接种至装有50 mL RCM液体培养基的锥形瓶中,35 ℃厌氧静置培养10 d。
高产丁酸菌株生长曲线的绘制:取厌氧静置培养48 h内的发酵液样品,每4 h取样一次,每个时间点做3个平行试验。测定其在波长600 nm处的吸光度值(OD600nm值)检测菌体生物量。
高产丁酸菌株丁酸产量变化:对厌氧静置培养10 d的发酵液进行取样,每1 d取一次样,每个时间点做3个平行试验,测定不同时间的丁酸产量。
1.3.5 高产丁酸梭菌的培养条件优化单因素试验
(1)初始pH对菌株产酸的影响
将活化后的菌株JN-14的种子液以5%(V/V)的接种量接种至初始pH值为5、6、7、8、9的乙醇乙酸钠液体培养基内(每组试验3个平行,下同),35 ℃厌氧恒温培养7 d后,测定菌体生物量(OD600nm值)和丁酸产量。
(2)乙醇添加量对菌株产酸的影响
将活化后的菌株JN-14的种子液以5%(V/V)的接种量接种至乙醇添加量分别为0、1%、2%、3%、4%的乙醇乙酸钠液体培养基内,35 ℃厌氧恒温培养7 d后,测定菌体生物量(OD600nm值)和丁酸产量。
(3)菌株接种量对菌株产酸的影响
分别以1%、3%、5%、7%、9%、11%、13%(V/V)的接种量将活化后的菌株JN-14的种子液接入乙醇乙酸钠液体培养基中,35 ℃厌氧恒温培养7 d后测定菌体生物量(OD600nm值)和丁酸产量。
1.3.6 高产丁酸梭菌发酵条件优化响应面试验
在单因素试验的基础上,以培养基的初始pH(A)、乙醇添加量(B)和菌株JN-14的接种量(C)这3个因素为自变量,丁酸产量(Y)为响应值,设计3因素3水平的Box-Behnken试验对高产丁酸梭菌的发酵条件进行优化。响应面试验因素与水平见表1。
表1 高产丁酸梭菌发酵条件优化Box-Behnken试验因素及水平
Table 1 Factors and levels of Box-Behnken tests for fermentation conditions optimization of high-yield butyric acid strains
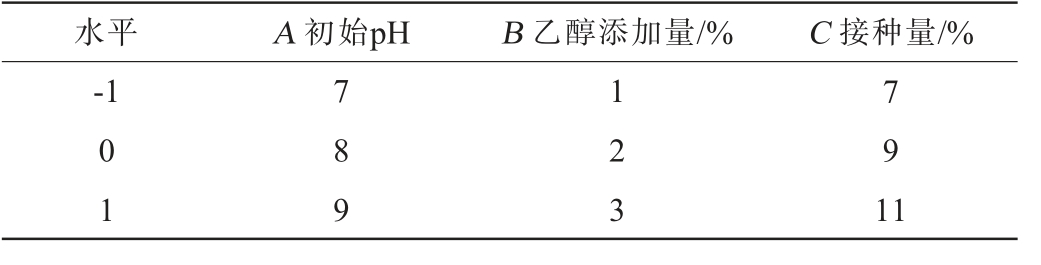
水平A 初始pHB 乙醇添加量/%C 接种量/%-1 01 789 123 791 1
1.3.7 数据处理
所有试验均重复3次取平均值。采用Excel 2003对试验数据进行分析,采用Origin 2018作图,采用Design-Expert 8.0.6进行响应面试验设计与分析。
2 结果与分析
2.1 高产丁酸梭菌的筛选
从窖泥中分离纯化得到20株不同菌落形态的纯种菌株,将这20株菌在乙醇乙酸钠培养基中35 ℃厌氧发酵7 d,测定其丁酸产量,结果见图1。
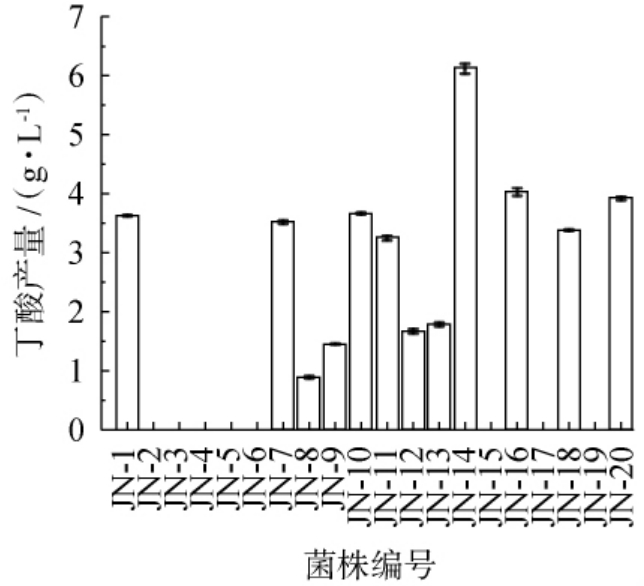
图1 筛选菌株产丁酸能力
Fig.1 Butyric acid production capacities of screened strains
由图1可知,20株菌中有12株菌具有产丁酸的能力,丁酸产量在0.89~6.11 g/L范围内,其中菌株JN-14产丁酸能力最强,丁酸产量为6.11 g/L。因此,将菌株JN-14作为高产丁酸的目标菌株。
2.2 菌株JN-14的鉴定
菌株JN-14形态学观察结果见图2。由图2可知,将菌株JN-14三区划线于RCM固体培养基上厌氧培养36 h后,菌落呈浅黄色,稍凸,直径1~2 mm。在显微镜下,革兰氏染色呈阳性,端圆,单个或成对出现,呈短链状。
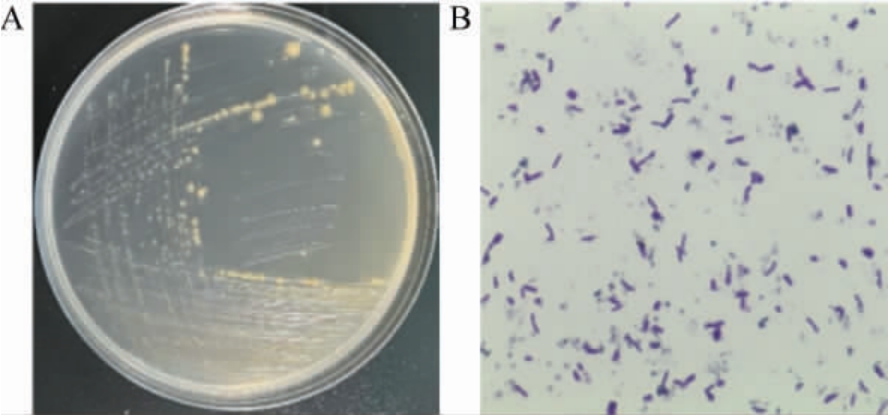
图2 菌株JN-14的菌落(A)及细胞(B)形态
Fig.2 Colony (A) and cell (B) morphology of strain JN-14
将菌株的测序结果在NCBI上进行BLAST比对并构建系统发育树,结果见图3。由图3可知,菌株JN-14与CP111108.1 Caproicibacterium sp.BJN0003同源性最高。因此菌株JN-14被鉴定为Caproicibacterium sp.。
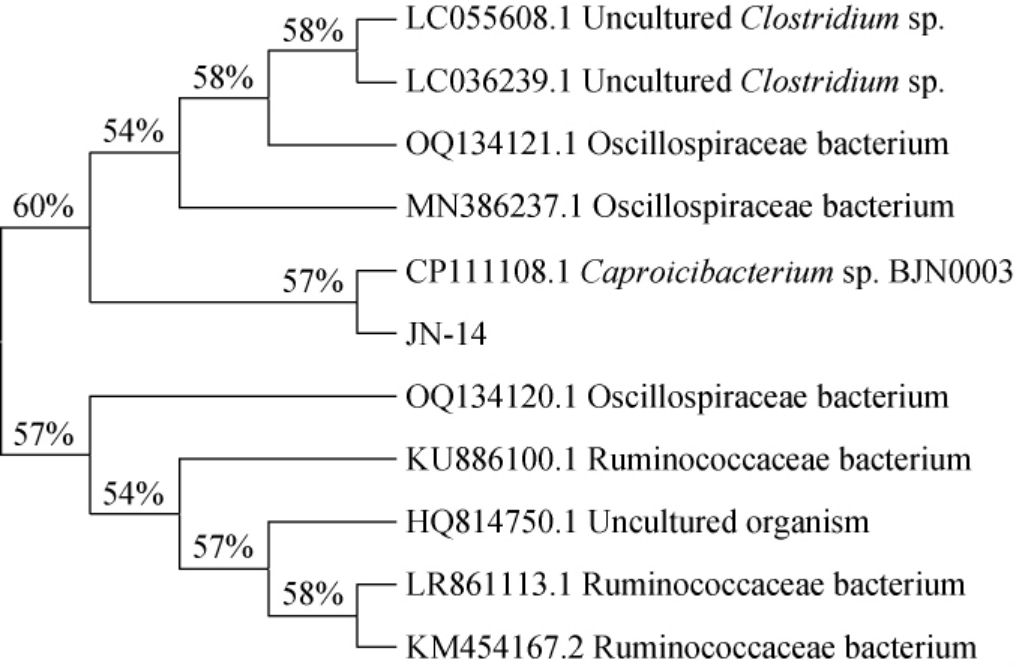
图3 基于16S rDNA基因序列的菌株JN-14系统发育树
Fig.3 Phylogenetic tree of strain JN-14 based on 16S rDNA gene sequences
2.3 菌株JN-14生长特性及发酵过程中丁酸产量变化
菌株JN-14的生长曲线及发酵过程中丁酸产量变化见图4。由图4a可知,菌株JN-14具有良好的生长性能,在0~8 h生长缓慢,为生长延滞期;8~24 h生长迅速,为对数生长期;24 h后菌体生长趋于稳定,细胞浓度变化较小,OD600nm值在0.8左右浮动,达到生长稳定期。相关研究显示,丁酸菌产物形成与菌体生长的关系为非生长偶联性,菌株在细胞生长进入稳定期才开始产生大量丁酸[21]。由图4b可知,菌株JN-14在0~2 d时丁酸产量较低,2~7 d丁酸的合成量迅速提高,第7天时丁酸产量达到(6.01±0.03)g/L,7~10 d丁酸的产量趋于稳定。
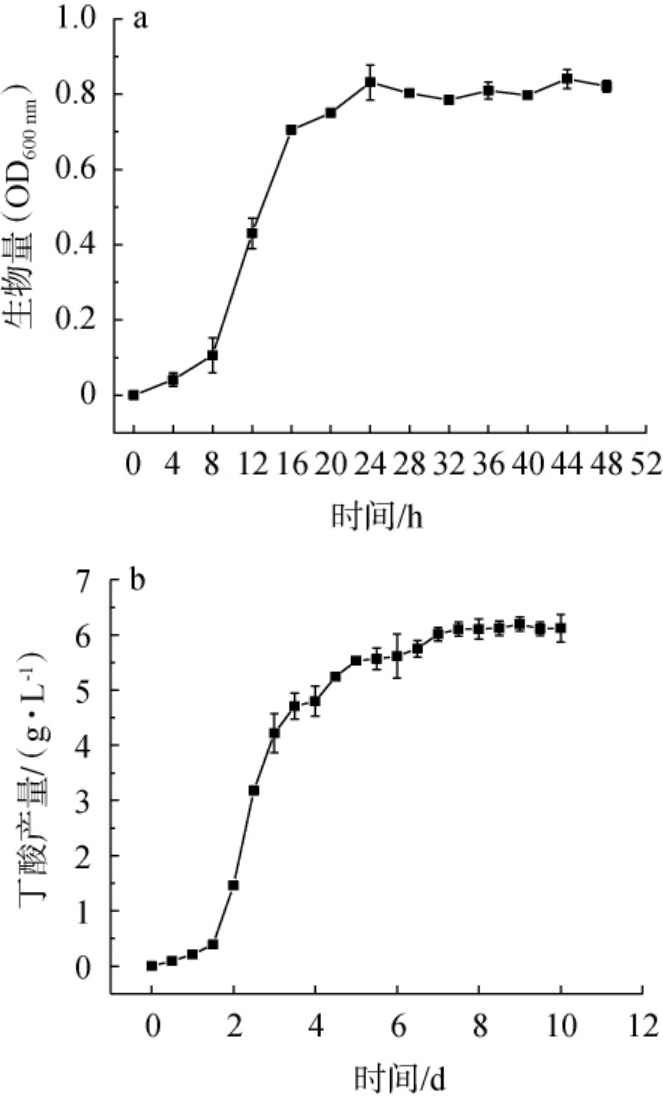
图4 菌株JN-14的生长曲线(a)及发酵过程中丁酸产量变化(b)
Fig.4 Growth curve (a) and butyric acid yield changes in fermentation(b) of strain JN-14
2.4 菌株JN-14发酵条件的优化
2.4.1 高产丁酸梭菌的发酵条件优化单因素试验(1)初始pH对菌株JN-14生长及产酸的影响
在发酵过程中,pH的变化影响菌株JN-14胞内酶活力和溶质溶解度,这对细胞产生了酸胁迫效应,从而影响了细胞的功能和活性,从而直接影响菌体和丁酸的产量[22-24]。
由图5可知,随培养基初始pH值的升高,菌株JN-14生物量及丁酸产量均呈先上升后下降的趋势;当初始pH值为8时,菌株JN-14生物量及丁酸产量生物量及丁酸产量均达到最大值,分别为0.94(OD600nm)、(7.78±0.25)g/L;继续升高初始pH值至9,菌株JN-14生物量及丁酸产量均下降。因此,选择培养基最佳初始pH8。
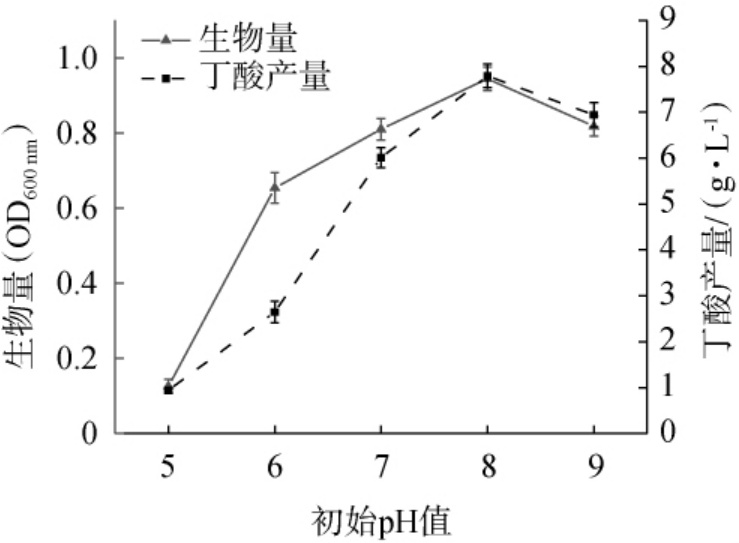
图5 培养基初始pH对菌株JN-14生物量及丁酸产量的影响
Fig.5 Effect of initial pH of medium on biomass and butyric acid yields of strain JN-14
(2)乙醇添加量对菌株JN-14生长及产酸的影响
酒糟酒精度随发酵时间不断变化,大体呈现前期缓慢上升,中期快速上升至最大,后期缓慢下降的趋势[25]。由图6可知,乙醇添加量为0~4%时,随着乙醇添加量不断升高,菌株JN-14的生长呈现先上升后下降的趋势。当乙醇添加量在0~2%时,菌株JN-14生物量及丁酸产量呈上升趋势,在乙醇添加量为2%时,菌株生长能力最佳且能够较好的适应酒糟环境进行生产发酵,产丁酸能力最强,产丁酸量为(6.79±0.14)g/L;继续增加乙醇添加量会导致其生长受到抑制且丁酸产量下降。 研究表明,酒精度越高对菌种毒害性越强,酒糟作为酒精浓度较高的特殊环境,对酒精耐受性差的菌株难以正常生存甚至死亡[19,26]。 因此,选择培养基最佳乙醇添加量为2%。
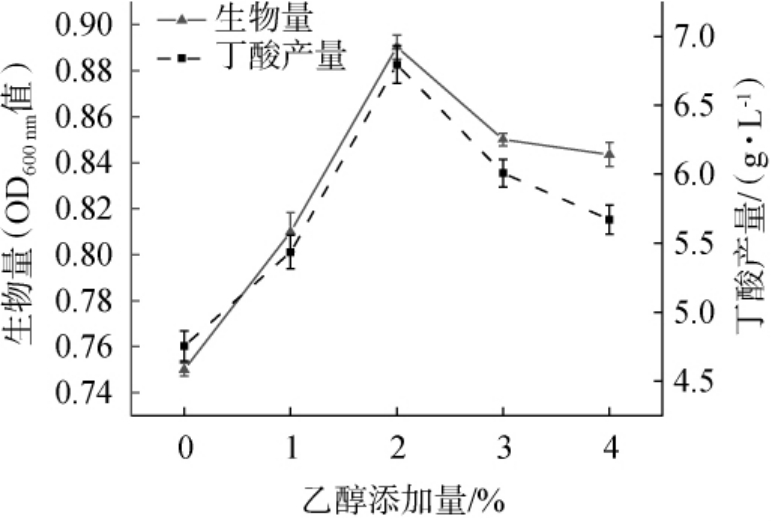
图6 乙醇添加量对菌株JN-14生物量及丁酸产量的影响
Fig.6 Effect of ethanol addition on biomass and butyric acid yields of strain JN-14
(3)接种量对菌株JN-14生长及产酸的影响
接种量对菌株的生物量和丁酸产量具有重要影响,接种量过小会导致菌体生长缓慢,延迟期太长,接种量过大可能导致菌体生长过快,消耗大量营养,进而影响菌株的生长和代谢[17]。由图7可知,随着接种量的增加,菌株JN-14生物量及丁酸产量均呈先上升后下降的趋势;当接种量为9%时,菌株JN-14生物量及丁酸产量生物量及丁酸产量均达到最大值,分别达到0.92(OD600nm)、(6.47±0.02)g/L,继续增加接种量至13%,菌株JN-14生物量及丁酸产量均下降。因此,选择最佳接种量为9%。
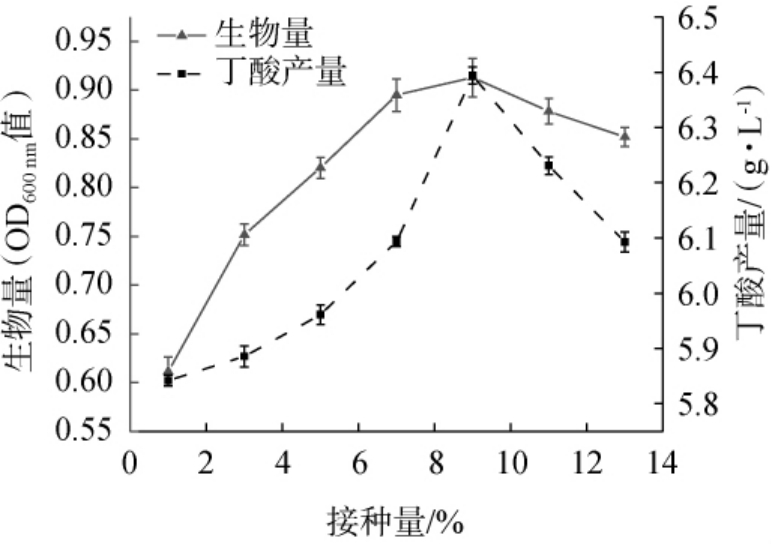
图7 接种量对菌株JN-14生物量及丁酸产量的影响
Fig.7 Effect of inoculum on biomass and butyric acid yields of strain JN-14
2.4.2 高产丁酸梭菌的发酵条件优化响应面试验
在单因素试验的基础上,以培养基的初始pH(A)、乙醇添加量(B)和菌株JN-14的接种量(C)为自变量,以丁酸产量(Y)为响应值,设计3因素3水平的Box-Behnken试验对高产丁酸梭菌的培养条件进行优化。Box-Behnken试验设计及结果见表2,方差分析结果见表3。
表2 高产丁酸菌株JN-14发酵条件优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken tests for fermentation conditions optimization of high-yield butyric acid strain JN-14
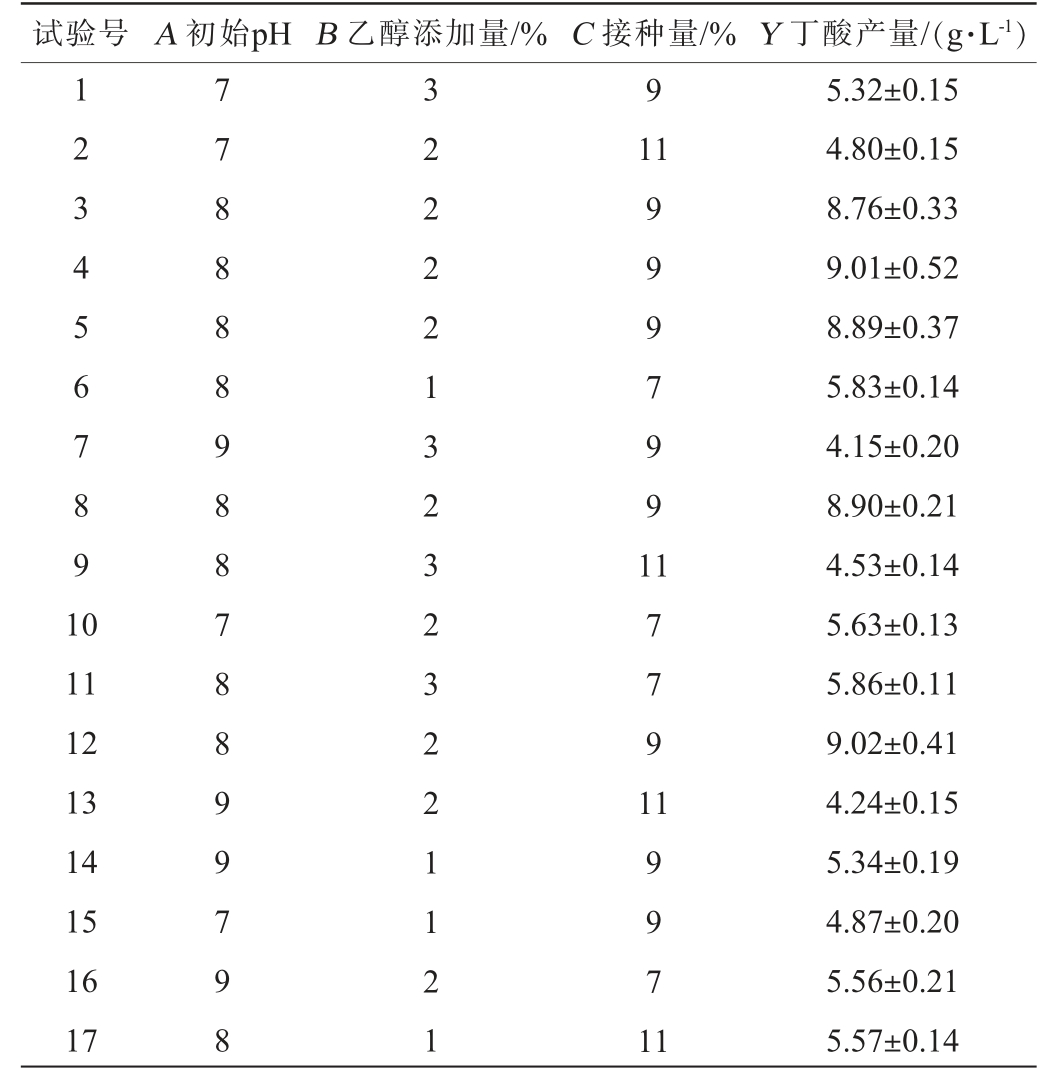
试验号 A 初始pH B 乙醇添加量/% C 接种量/% Y 丁酸产量/(g·L-1)1234567891 0 9 11 9997991 11 12 13 14 15 16 17 77888898878899798 32222132323221121 17791 19971 1 5.32±0.15 4.80±0.15 8.76±0.33 9.01±0.52 8.89±0.37 5.83±0.14 4.15±0.20 8.90±0.21 4.53±0.14 5.63±0.13 5.86±0.11 9.02±0.41 4.24±0.15 5.34±0.19 4.87±0.20 5.56±0.21 5.57±0.14
表3 回归模型方差分析
Table 3 Variance analysis of regression model
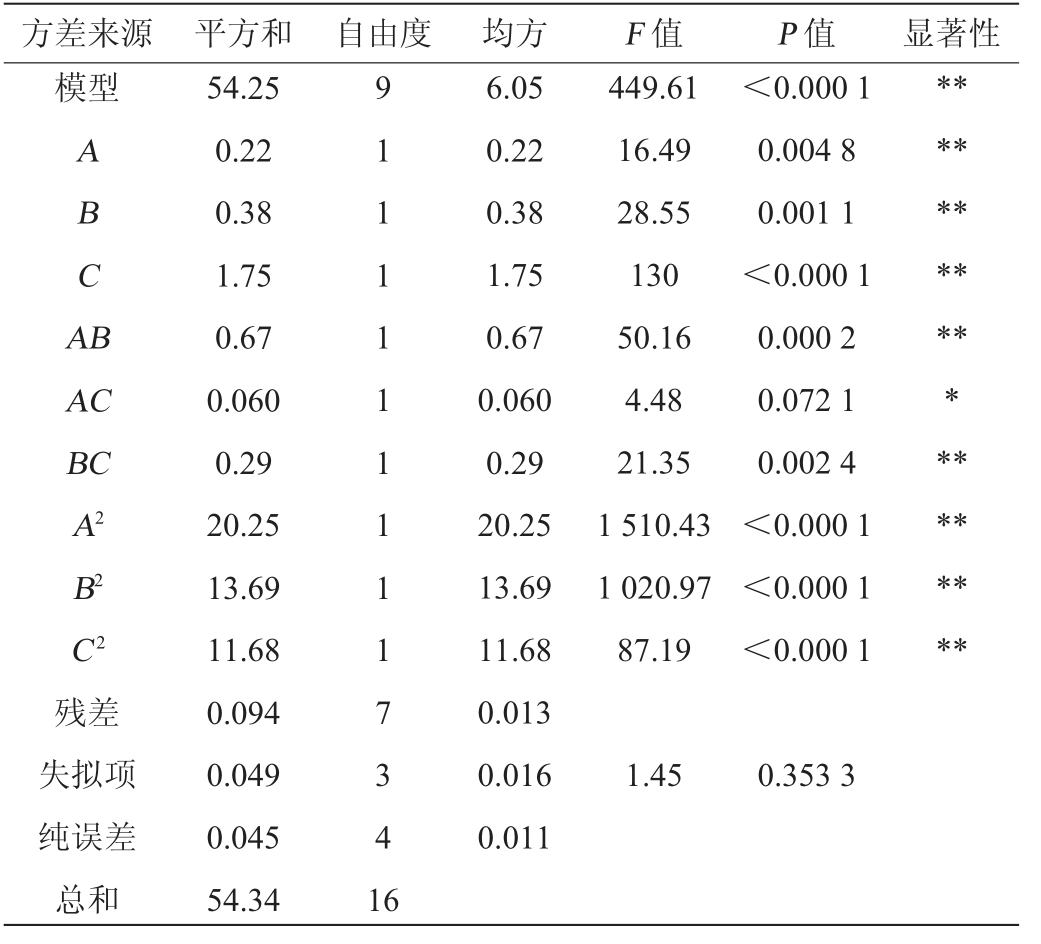
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 平方和 自由度 均方F 值P 值显著性模型ABCA B AC BC A2 B2 C2残差失拟项纯误差总和54.25 0.22 0.38 1.75 0.67 0.060 0.29 20.25 13.69 11.68 0.094 0.049 0.045 54.34 91111111117341 6 6.05 0.22 0.38 1.75 0.67 0.060 0.29 20.25 13.69 11.68 0.013 0.016 0.011 449.61 16.49 28.55 130 50.16 4.48 21.35 1 510.43 1 020.97 87.19<0.000 1 0.004 8 0.001 1<0.000 1 0.000 2 0.072 1 0.002 4<0.000 1<0.000 1<0.000 1*******************1.45 0.353 3
利用Design-Expert 8.0.6软件对表3试验结果进行二次回归拟合分析,得到二次多项式回归方程为Y=8.92-0.17A-0.25B-0.47C-0.41AB-0.12AC-0.27BC-2.19A2-1.80B2-1.67C2
由表3可知,模型极显著(P<0.01),失拟项不显著(P>0.05),该模型回归方程决定系数R2=0.998 3,校正决定系数R2=0.996 1,表明该模型可靠,拟合程度良好,可用此模型和方程来分析和预测此菌株的丁酸产量。 由P值可知,一次项A、B、C,交互项AB、BC及二次项A2、B2、C2对丁酸产量具有极显著影响(P<0.01)。由F值可知,各个因素对丁酸产量(Y)的影响顺序为C>B>A。
利用Design-Expert 8.0.6软件对响应面试验结果分析得出丁酸菌产丁酸的最佳发酵条件为培养基初始pH 7.97、乙醇添加量1.95%、丁酸菌JN-14接种量为8.73%,在此条件下丁酸产量预测值为8.96 g/L;综合考虑到实际操作与方便,修正最佳发酵条件为培养基初始pH 8、乙醇添加量2%、丁酸菌JN-14接种量为9%,在此条件下进行3次验证试验,得到丁酸产量实际值为(8.91±0.25)g/L,与预测值之间偏差率较小,说明优化后处方验证试验的预测值和实测值基本吻合,响应面法的预测效果良好,可以描述响应面和影响因素之间的关系。
响应曲面可以直观地反映各因素间交互作用对丁酸产量的影响,响应面曲线越陡峭、等高线越趋近于椭圆,表明两因素间交互作用对结果影响越显著;反之,响应面曲越平缓、等高线越趋近圆形,表明两因素间交互作用对结果影响越小。3个因素对丁酸产量影响的响应曲面见图8。由图8可知,AB、BC及AC交互作用对丁酸产量(Y)影响的响应面陡峭,等高线呈椭圆形,表明AB、BC及AC交互作用对结果影响显著,这与表3结果一致。
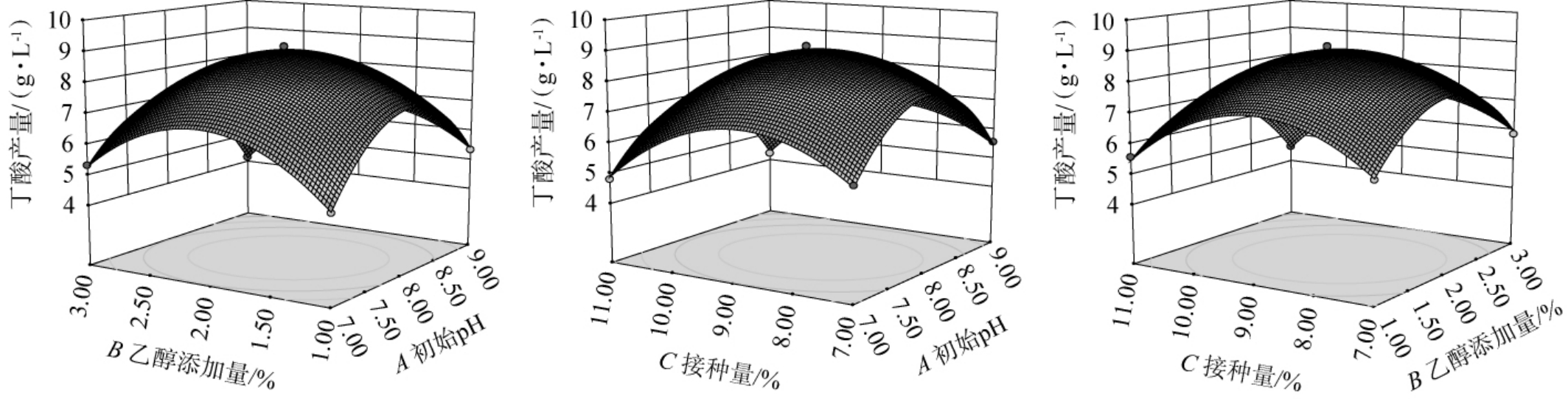
图8 各因素间交互作用对丁酸产量影响的响应曲面及等高线
Fig.8 Response surface plots and contour lines of effect of interaction between various factors on butyric acid yields
3 结论
本试验从河北凤来仪浓香型白酒窖泥中分离筛选得到12株具有丁酸生产能力的菌株,针对其中1株丁酸产量最高的菌株JN-14进行形态学观察、16S rDNA序列同源性比对,被鉴定为Caproicibacterium sp.。通过响应面试验对Caproicibacterium sp.JN-14产丁酸培养条件进行优化,发现该菌株在初始pH 8、乙醇添加量2%、菌株接种量9%(V/V)的条件下发酵培养7 d,丁酸产量最高达(8.91±0.25)g/L。本试验对后期应用于白酒品质提升、风味增强等方面有着积极作用。
[1]徐发.我国白酒行业现状和发展趋势分析[D].合肥:合肥工业大学,2011.
[2]王涛,田时平,赵东,等.宜宾浓香型白酒窖泥中细菌的系统发育多样性[J].食品与发酵工业,2011,37(10):11-18.
[3]胡晓龙.浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D].无锡:江南大学,2016.
[4]叶光斌,罗惠波,杨晓东,等.基于免培养法研究泸州地区浓香型白酒窖泥原核微生物群落结构[J].食品科学,2013,34(17):176-181.
[5]YAN S B,DONG D.Improvement of caproic acid production in a Clostridium kluyveri H068 and Methanogen 166 co-culture fermentation system[J].Amb Express,2018,8:1-13.
[6]郭艺山,镇达,陈茂彬,等.己酸菌工业扩大培养条件的优化[J].酿酒,2010,37(1):39-42.
[7]叶凯.窖泥中产酸微生物的筛选与应用[D].武汉:湖北工业大学,2020.
[8]刘平,孙啸涛,许德富,等.浓香型白酒中主要异嗅味研究进展[J].食品与发酵工业,2024,50(16):396-407.
[9]刘星,刘恩,陈玲,等.丁酸梭菌紫外诱变选育高产丁酸菌株及其耐受性分析[J].饲料工业,2023,44(11):93-97.
[10]胡世伟,王超凡,王景春,等.浓香型白酒窖泥微生物群落及其风味成分研究进展[J].中国酿造,2023,42(12):9-12.
[11]ZOU W,YE G B,ZHANG K Z.Diversity,function,and application of Clostridium in Chinese strong flavor Baijiu ecosystem: a review[J].J Food Sci,2018,83(5):1193-1199.
[12]HUANG J, TANG W, ZHU S Q, et al.Biosynthesis of butyric acid by Clostridium tyrobutyricum[J].Prep Biochem Biotech, 2018, 48(5):427-434.
[13]WANG J F,LIN M,XU M M,et al.Anaerobic fermentation for production of carboxylic acids as bulk chemicals from renewable biomass[J].Adv Biochem Eng Biotechnol,2016,156:323-361.
[14]陈翔,王亚庆,邵海燕.己酸菌纯种培养与混合培养技术在窖泥生产中的应用[J].酿酒,2009,36(3):35-37.
[15]高文文,尚佳萃,周雪,等.一株高产丁酸的丁酸梭菌分离鉴定及其生物学性质研究[J].食品工业科技,2020,41(7):82-88,101.
[16]王友玲,魏竹君,刘青,等.丁酸梭菌与酪丁酸梭菌发酵特性比较[J].食品与机械,2019,35(2):27-32.
[17]袁华伟,赵猛,蒋君,等.窖泥中产丁酸菌的筛选、鉴定及生长性能研究[J].酿酒科技,2017(5):35-40.
[18]刘瑾,赵华.丁酸梭菌的分离鉴定及生物学特性研究[J].饲料研究,2023,46(8):63-67.
[19]衡文,李韬,叶光斌,等.窖泥中高产丁酸梭菌的筛选、鉴定及其生长耐受性研究[J].中国酿造,2021,40(3):134-138.
[20]XU Y Q,WU M Q,NIU J L,et al.Characteristics and correlation of the microbial communities and flavor compounds during the first three rounds of fermentation in Chinese sauce-flavor Baijiu[J].Foods,2023,12(1):207.
[21]孔青.丁酸梭菌培养与发酵动力学以及调节腹泻小鼠肠道菌群平衡的研究[D].杭州:浙江大学,2006.
[22]NICOLAOU S A, GAIDA S M, PAPOUTSAKIS E T.A comparative view of metabolite and substrate stress and tolerance in microbial bioprocessing:from biofuels and chemicals,to biocatalysis and bioremediation[J].Metab Eng,2010,12(4):307-331.
[23]SZYMANOWSKA-POWAŁOWSKA D,KUBIAK P.Effect of 1,3-propanediol,organic acids,and ethanol on growth and metabolism of Clostridium butyricum DSP1[J].Appl Microbiol Biotechnol, 2015, 99(7): 3179-3189.
[24]WANG S H,ZHU Y,ZHANG Y P,et al.Controlling the oxidoreduction potential of the culture of Clostridium acetobutylicum leads to an earlier initiation of solventogenesis, thus increasing solvent productivity[J].Appl Microbiol Biotechnol,2012,93(3):1021-1030.
[25]邢宏观,林建国,钟雪兆,等.响应面法优化丁酸梭菌发酵培养工艺[J].食品工业科技,2016,37(19):237-243.
[26]XU P X, CHAI L J, QIU T, et al. Clostridium fermenticellae sp.nov.,isolated from the mud in a fermentation cellar for the production of the Chinese liquor,Baijiu[J].Int J Syst Evol Microbiol,2019,69(3):859-865.