硒(selenium,Se)是一种重要的非金属化学元素,也是对动物以及人类健康都至关重要的微量元素,人体长时间缺硒会导致克山病、心脏疾病等40余种疾病的发生,还会对免疫系统造成不良影响,从而增加患病几率[1-2];动物缺硒会出现营养性肌肉萎缩,生殖机能紊乱,繁殖力降低,体重严重下降等生理机能异常[2-3]。我国位于全球低硒地带,有72%的县(市)存在着不同程度的土壤缺硒情况[4-5],约有1亿多人口处于低硒状态[6-7]。因此,开发富硒产品对提升居民健康及畜牧业生产意义重大。
硒元素在自然界中存在无机和有机两种形态,无机态的硒包含单质硒(Se0)、硒化物(Se2-)、硒酸盐(Se6+)以及亚硒酸盐(Se4+)等,由于无机硒的毒性高、稳定性差、吸收率较低,因此很难被人与动物直接吸收利用[8]。而有机硒是由生物体经各种代谢产生的,主要存在硒代氨基酸、硒蛋白、甲基化硒等形式,具有生物活性高,易被肠道吸收且无毒、无污染,便于食用等优点[9-10]。 因此,如何把无机硒转化为有机硒,成为对硒充分利用的研究重点。 本文综述了生物转化有机硒的方式,重点介绍了酿酒酵母(Saccharomyces cerevisiae)转化有机硒的机制和富硒酵母菌种选育方面的研究进展,并展望了提高酿酒酵母转化有机硒的策略。
1 生物转化有机硒的方式
有机硒多由生物转化而来,主要包括自然转化和微生物转化两种。 自然转化是在植物和动物生长过程中,通过根部从土壤中吸收或通过食物链摄入无机硒(如硒酸盐或亚硒酸盐),然后在各自的机体内通过一系列生物化学过程将无机硒转化为有机硒[11],如富硒西瓜、富硒鸡蛋等。植物富硒易受土壤、气候等环境因素的影响,导致硒的含量和稳定性难以保证,且植物中可能含有对人体有害的农药残留等杂质,进一步限制了其作为硒补充来源的可靠性;动物富硒则易受动物自身生理状态和饲料品质等因素的影响,导致动物体内的硒分布不均匀,且可能存在因饲料污染或自身代谢问题导致的重金属等有害物质残留,这也限制了动物作为硒补充剂的安全性。而微生物转化则通过微生物的代谢活动实现,该方法具有高效快捷、转化周期短、生物活性高、相对毒性低、培养过程可控、降低无机硒对环境的污染等优势,已成为具有重要应用前景的硒资源利用方式[12]。
酿酒酵母(Saccharomyces cerevisiae)具有生长速度快、繁殖周期短、易于培养、富含营养等优点,是最具有应用价值的食品安全级微生物[10,13]。利用酿酒酵母转化有机硒通常是在培养酿酒酵母的过程中加入亚硒酸钠等无机硒,细胞在生长时吸收利用这些无机硒,并通过与细胞内的蛋白质和多糖结合形成有机硒[14],多数以硒代氨基酸的形态存在。市售富硒酵母产品中存在的有机硒主要是硒代蛋氨酸(selenomethionine,SeMet)和硒代半胱氨酸(selenocysteine,SeCys),其中,硒代蛋氨酸占产品中总提取硒的60%~85%,硒代半胱氨酸则占总提取硒的2%~4%,其他有机硒化合物包括硒代半胱氨酸,其含量不超过总提取硒的10%,无机硒(Se4+和Se6+)含量通常不超过总提取硒的1%[15]。 与受细胞壁结构影响的植物源有机硒相比,富硒酵母产生的硒代蛋氨酸等有机硒与酵母蛋白紧密结合,形成了类似天然氨基酸的结构,这种结构使得硒元素更容易被人体吸收和利用,硒蛋白的生物利用率比无机形式的硒高1.5~2.0倍[16]。富硒酵母在预防肿瘤、心脑血管疾病、提高机体免疫力等方面具有积极效果[15],其因具有硒转化率和有机硒含量高、硒蛋白利用率高、安全性高和富含营养等优势,在功能食品、保健品及动物饲料等多个领域应用广泛,已成为一种营养功能全面的有机硒高效补充剂[17-18]。2019年,卫健委出台的《关于弯曲乳杆菌等24种“三新食品”的公告(2019年第2号)》中,富硒酵母的适用范围进一步扩大到特殊医学用途配方食品[19]。随着国内健康产业、畜牧业和饲料行业的发展,含硒制剂市场需求增加,富硒酵母的市场需求也受到了积极影响[20-21]。目前,我国工业化生产的富硒酵母菌种普遍存在有机硒转化率低、生物量低及稳定性差等问题,限制了富硒酵母产业的高质量发展[15]。要想克服这些瓶颈问题,实现富硒酵母的高效生产和应用,就需要深入了解酿酒酵母转化有机硒的机制。
2 酿酒酵母与硒的结合和积累过程
酿酒酵母对硒的转化是一个复杂且有序的过程,主要分为胞外结合和胞内积累两个关键阶段,硒在酿酒酵母细胞中的积累涉及硒的吸收与转化等步骤。
2.1 硒的胞外结合
酿酒酵母细胞与硒的胞外结合是由于酿酒酵母细胞壁表面存在带负电荷的磷酸二酯、二硫桥、甘露糖磷酸残基、磷酸基等[22],当细胞暴露在含有硒离子的环境中时,这些基团能够与硒离子形成离子键或使其络合,进而通过物理吸附、化学吸附以及可能的离子交换机制,将硒离子固定在酿酒酵母的细胞壁外层[23-24]。 这一吸附效果的强弱受酿酒酵母细胞壁表面多糖、蛋白质及脂质成分的构成与分布的影响[25-28]。
2.2 硒的胞内积累
2.2.1 硒在酿酒酵母细胞内的吸收
酿酒酵母对无机硒(硒酸盐和亚硒酸盐)的吸收是一个复杂而精细的过程,细胞膜上特定的转运蛋白在硒的吸收过程中起着关键作用,它们能够识别并结合硒离子,并将其转运到细胞内部。由于硒元素(Se)与硫元素(S)具有很高的化学/物理相似性,酿酒酵母通过细胞膜上的硫酸盐转运系统(Sul1p和Sul2p)来转运硒,CHEREST H等[22]证实酿酒酵母使用对硫酸盐具有高亲和力的Sul1p和Sul2p特异性转运系统来运输亚硒酸盐;MAPELLI V等[23-24]研究发现,酿酒酵母对硒酸盐的摄取很大程度上取决于培养基中硫酸盐的浓度,仅在硫酸盐缺乏的条件下,酿酒酵母才能完全内化和代谢硒酸盐;唐梦瑶[29]研究发现,酿酒酵母胞内的总硒含量随着硫酸铵添加浓度的上升而增加,当硫酸铵的浓度达到0.3%时,胞内总硒含量达到最大值,此后随着硫酸铵浓度的继续增加,总硒含量反而降低。 LAZARD M等[30-31]研究发现,在磷酸盐稀缺环境下,细胞主要依赖高亲和力的磷酸盐转运蛋白Pho84p和Pho89p转运亚硒酸盐,而当磷酸盐充裕时,细胞则利用低亲和力的磷酸盐转运蛋白(Pho87p、Pho90p以及Pho91p)转运亚硒酸盐。另外,经研究发现Jen1p蛋白也有转运亚硒酸盐的功能[32]。
此外,液泡作为酿酒酵母细胞内的重要细胞器,由单层磷脂膜包裹,内含贮藏物及各种水解酶和碱性氨基酸,其内部独特的环境对硒的吸收和储存也有重要影响。在酿酒酵母中,无机硒是经胞内的氧化还原酶与液泡三磷酸腺苷酶(vacuolar adenosine triphosphatase,V-ATPase)共同催化下还原,被还原后的硒元素在液泡腔内大量积聚,当液泡功能受损或V-ATPase功能缺陷时,酿酒酵母对硒的积累能力显著减弱,从而具有较低的硒含量[33]。
2.2.2 无机硒在酿酒酵母细胞内的转化过程
无机硒进入酿酒酵母细胞后,经历还原、同化、甲基化等过程,最终形成含硒蛋白或硒蛋白。 这些过程涉及到多个步骤和多种化合物的相互转化,共同构成了复杂而精细的硒代谢网络。
(1)硒的还原
硒酸盐或亚硒酸盐进入酿酒酵母细胞后,首先被还原为更易被酿酒酵母利用的形态,如硒化氢(hydrogenselenide,H2Se)或其他还原态的硒化合物。 这些还原态的硒化合物随后参与到细胞的同化过程中,与氨基酸等生物分子结合,形成含硒的氨基酸或中间代谢产物。 因此,硒的还原过程是酿酒酵母对无机硒进行富集和同化的关键步骤。
硒酸盐(Se6+)的还原是通过类似于硫同化途径的机制发生的,即在ATP硫酸化酶的催化下形成腺苷酰硒酸(adenylylselenate,APSe),随后在腺苷酰硫酸激酶的催化下生成3'-磷酸腺苷酰硒酸盐(3'-phospho-adenylyl selenate,PAPSe),最后由磷酸腺苷酰硫酸盐还原酶还原为亚硒酸盐(Se4+)(图1)[34]。亚硒酸盐在细胞内可能通过多种机制被还原,可以在亚硫酸盐还原酶的催化下,以还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)为还原剂,被还原形成硒化氢(图1)[34-36];亚硒酸盐也可以在谷胱甘肽参与下发生自发反应,该转化过程见图1[37-40],亚硒酸盐与还原型谷胱甘肽(glutathione,GSH)通过非酶促反应自发形成硒代二谷胱甘肽(selenodiglutathione,GS-Se-SG)这一不稳定中间体和氧化型谷胱甘肽(glutathione disulfide,GSSG)(见图2,反应1);在过量的谷胱甘肽存在下,硒代二谷胱甘肽进一步与谷胱甘肽反应,转化为谷胱甘肽硒醇(glutathionyselenol,GS-Se-H)和氧化型谷胱甘肽(见图2,反应2);随后谷胱甘肽硒醇继续与谷胱甘肽反应并再转化为硒化氢和氧化型的谷胱甘肽(见图2,反应3)[41]。谷胱甘肽硒醇也可以在超氧化物歧化酶的催化下进一步转化为元素硒(Se0)和还原型谷胱甘肽(见图2,反应4)。硒化氢是挥发性化合物,可根据浓度梯度自由地通过液泡膜被动转运进入细胞质,其也是硒代谢途径中的主要中间代谢物,为后续硒的同化和甲基化提供必要的硒源[27,42-43]。
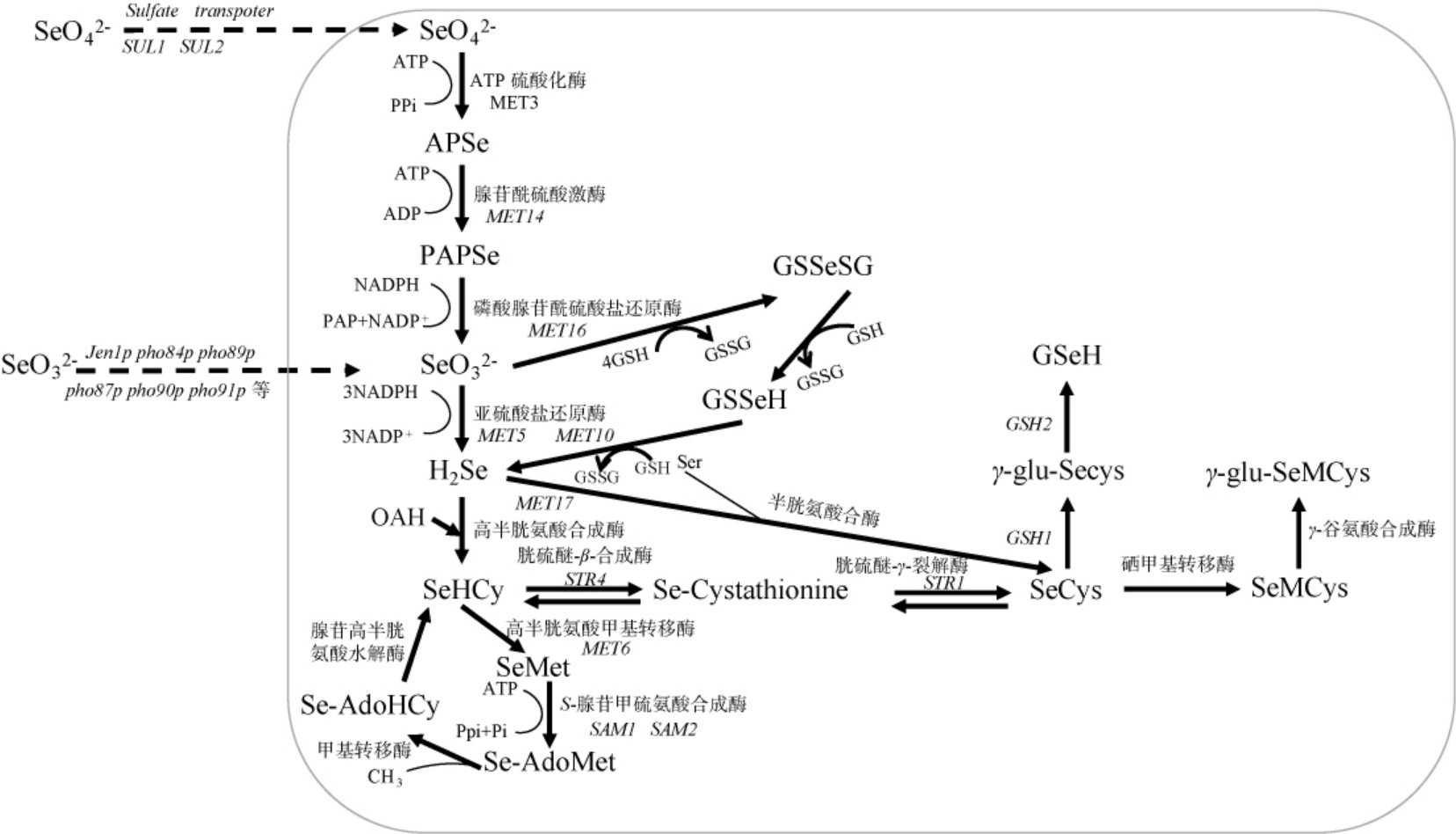
图1 酿酒酵母细胞内不同硒化合物的代谢示意图[45]
Fig.1 Metabolic diagram of different selenium compounds in Saccharomyces cerevisiae cells[45]
APSe:腺苷酰硒酸;PAPSe:3'-磷酸腺苷酰硒酸盐;OAH:O-乙酰高丝氨酸;SeHcy:硒代高半胱氨酸;SeMet:硒代蛋氨酸;Se-AdoMet:硒代腺苷甲硫氨酸;Se-AdoHCy:硒代腺苷高半胱氨酸;Se-cystathionine:硒代胱硫醚;SeCys:硒代半胱氨酸;GSeH:硒代谷胱甘肽;SeMCys:甲基硒代半胱氨酸;γ-glu-SeMCys:γ-谷氨酰-硒甲基-半胱氨酸[43-44]。

图2 谷胱甘肽参与的亚硒酸盐转化过程[41]
Fig.2 Process of selenite conversion involving glutathione[41]
GSH:还原型谷胱甘肽;GS-Se-SG:硒代二谷胱甘肽;GSSG:氧化型谷胱甘肽;GS-Se-H:谷胱甘肽硒醇;H2Se:硒化氢;Se0:元素硒。
(2)硒的同化
酿酒酵母的硒同化是由硒化氢进一步同化合成硒代氨基酸,主要包括硒代蛋氨酸、硒代半胱氨酸的过程(图1)。硒代谢途径中产生中间代谢物硒化氢通过MET17基因编码的高半胱氨酸合成酶催化掺入O-乙酰高丝氨酸(O-acetyl-homoserine,OAH)中,从而得到硒代高半胱氨酸(selenohomocysteine,SeHcy)和乙酸[46-48]。硒代高半胱氨酸是硒代氨基酸生物合成途径中的一个分支点。在随后的步骤中,硒代高半胱氨酸可以转化为硒代蛋氨酸或硒代半胱氨酸。硒代蛋氨酸是通过高半胱氨酸甲基转移酶的催化作用,由硒代高半胱氨酸转化而成的[34,49]。在S-腺苷甲硫氨酸合成酶催化下,硒代蛋氨酸被转化为硒代腺苷甲硫氨酸(Se-adenosylmethionine,Se-AdoMet),随后硒代腺苷甲硫氨酸经历酶促甲基化过程形成硒代腺苷高半胱氨酸(Seadenosylhomocysteine,Se-AdoHCy)[50-51],在腺苷高半胱氨酸水解酶的催化作用下,硒代腺苷高半胱氨酸被转化为硒代高半胱氨酸[34]。 硒代半胱氨酸的合成过程首先由胱硫醚-β-合成酶催化硒代高半胱氨酸生成硒代胱硫醚(Secystathionine),随后在胱硫醚-γ-裂解酶的催化下形成[49,52]。另外,硒代半胱氨酸也可以以丝氨酸(serine,Ser)为前体[50],由硒化氢在半胱氨酸合酶催化下合成,但该途径在酿酒酵母中相对较弱,因此,酿酒酵母中的硒代蛋氨酸和硒代半胱氨酸的合成主要依赖于高半胱氨酸合成酶途径[50,53]。
(3)硒的甲基化
酿酒酵母也可以进行硒的甲基化,例如,硒代半胱氨酸在硒甲基转移酶(selenomethyl transferase,SMT)的催化作用下发生甲基化反应,形成甲基硒代半胱氨酸(selenomethyl-selenocysteine,SeMCys)等甲基化硒化合物[41]。甲基硒代半胱氨酸可以进一步转化为γ-谷氨酰-硒甲基半胱氨酸(γ-glutamyl-Se-methyl cysteine,γ-glu-SeMCys)[53]。硒的甲基化克服了亚硒酸盐等无机硒的毒性作用,产生毒性较小的形态。 研究表明,甲基硒代氨基酸和γ-谷氨酰硒甲基半胱氨酸比无机硒和硒代蛋氨酸在抑制肿瘤或癌症方面具有更高活性[54]。因为人体中富含β-裂解酶,在摄入甲基硒源后,能快速将甲基化的硒代氨基酸分解为抑制肿瘤细胞生长的关键活性物质单甲基化硒化合物甲基硒醇或甲基亚硒酸[55]。
(4)硒蛋白的形成
在细胞内积累的硒代蛋氨酸会在翻译过程中随机取代蛋氨酸,参与含硒蛋白的形成过程。由于硒代蛋氨酸与蛋氨酸在化学结构上的相似性,携带蛋氨酸的转运核糖核酸(transfer ribose nucleic acid,tRNA)既能携带蛋氨酸,又能携带硒代蛋氨酸,当蛋氨酸的摄入量被限制时,大比例的硒代蛋氨酸会在翻译过程中随机替换蛋氨酸,从而被非特异性地掺入到蛋白质中[56]。
硒代半胱氨酸的翻译机制与硒代蛋氨酸不同,它并不是通过随机替换蛋氨酸整合到蛋白质中的,而是通过特定的插入机制特异性地引入蛋白质中的。由于组成人类蛋白质的基本氨基酸约有20种,将硒代半胱氨酸称为人体的第21种氨基酸[57]。硒代半胱氨酸掺入蛋白质的过程依赖于特定的携带硒代半胱氨酸的tRNA,与其他氨基酸不同的是,其没有与之对应的硒代半胱氨酰-tRNA合成酶,因此,硒代半胱氨酰-tRNA的形成不是简单地将硒代半胱氨酸与同源tRNA直接连接,而是在丝氨酰tRNA合成酶(seryltRNA synthetase,SerRS)的催化下,促使tRNA首先与丝氨酸结合形成中间复合物丝氨酰-tRNA[ser](Ser-tRNA[Ser])[44];随后,该复合物通过磷酸丝氨酰-tRNA[ser]激酶(phosphoseryltRNA[ser]kinase,PSTK)的作用,转化为磷酸化的丝氨酰-tRNA[ser](pSer-tRNA[Ser]);然后以硒磷酸(monoselenophosphate,H2PO3SeH)作为活性硒的供体,将丝氨酰-tRNA[Ser]上的羟基氧替换为硒,从而产生硒代半胱氨酰-tRNASec[Ser](Sec-tRNASec[Ser]),产生的硒代半胱氨酰-tRNASec[Ser]复合物通过SEC43p因子运输到细胞核,在细胞核中发生硒代半胱氨酸与蛋白质的结合[58-62]。 而硒磷酸是由硒化氢等硒化物在硒磷酸合成酶2(selenophosphate synthetase 2,SPS2)催化下生成的[44,63]。
硒代半胱氨酸由特定的UGA密码子编码,通常情况下,该密码子是蛋白质合成的终止密码子,当mRNA链中UGA密码子下游存在硒代半胱氨酸插入序列(selenocysteine insertion sequence,SECIS)时,UGA才能被特殊的转录因子识别,从而转变为硒代半胱氨酸的密码子[64]。SECIS是一个顺式作用元件,在多肽链合成过程中,SECIS会与SECIS结合蛋白2(SECIS-binding protein 2,SBP2)形成复合体。 该复合体在核糖体蛋白L30(ribosomal protein L30,RPL30)、SBP2、SECIS的相互作用下能够与硒代半胱氨酸特异性延伸因子(selenocysteine-specific elongation factor,EFsec)以及硒代半胱氨酰-tRNASec[Ser]复合物结合形成翻译复合物[44]。之后,翻译复合物会沿mRNA的3'端方向开始翻译直到读取完UGA密码子后,Sec-tRNASec[Ser]被引导到核糖体的受体位点合成硒蛋白过程见图3[65-66]。
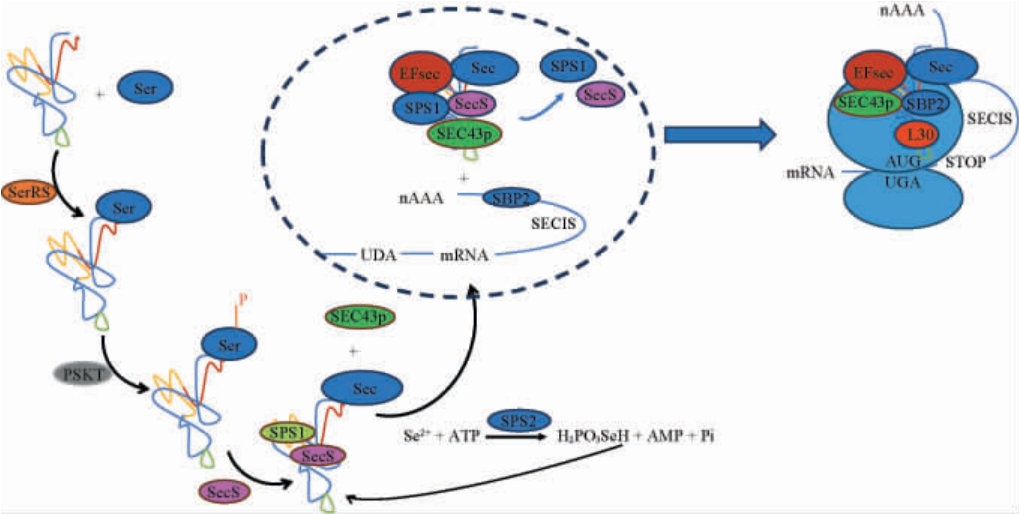
图3 酿酒酵母中硒代半胱氨酸与蛋白质的结合过程示意图[64]
Fig.3 Schematic diagram of incorporation process of selenocysteine into proteins in Saccharomyces cerevisiae
Ser:丝氨酸;SerRS:丝氨酰tRNA合成酶;PSTK:磷酸丝氨酰-tRNA[ser]激酶;Sec:硒代半胱氨酸;SECIS:硒代半胱氨酸插入序列;H2PO3SeH:硒磷酸;SPS1:硒磷酸合成酶1;SPS2:硒磷酸合成酶2;SBP2:硒代半胱氨酸结合蛋白2;EFsec:硒代半胱氨酸特异性延伸因子;L30:核糖体蛋白;SEC43p:RNA结合蛋白。
3 提高酿酒酵母转化有机硒的研究进展
在富硒酵母的生产过程中,提高酿酒酵母将无机硒转化为有机硒的能力至关重要,主要通过两种策略实现,一是通过发酵工艺优化改良现有菌株的培养条件。二是选育富硒能力强的酿酒酵母菌株,在实际育种过程中一般将这两种结合起来提高有机硒的转化效果。
3.1 优化发酵工艺
富硒酵母的生长和有机硒转化受培养基的组分、配比、装液量、无机硒的添加方式及添加量、温度、pH、溶氧及转速等方面影响。 目前,多数富硒酵母培养使用麦芽汁或合成培养基,而糖蜜、麸皮等原料富含糖类、脂肪、核酸、促生长因子、维生素和矿物质等成分,成本低廉且易于获取,是培养富硒酵母的理想碳源[67-68]。 低浓度无机硒对酿酒酵母的生长影响不大,随着无机硒浓度的增加,酿酒酵母的有机硒转化率随之上升,但过高浓度对酿酒酵母生物量和有机硒转化率有较大负面影响,因此,富硒酵母培养通常分批次添加无机硒,培养初期少量添加,发酵中后期逐步增加[69]。 王小波等[70]通过正交试验确定了富硒酵母菌株YR166的最佳发酵培养基配方为10%麦芽汁、1%硫酸铵、0.2%磷酸二氢钾和50 μg/mL亚硒酸钠;确定最佳装液量为60 mL/500 mL,在30 ℃摇瓶培养6 h后添加亚硒酸钠,再继续培养30 h发酵效果最佳,富硒酵母的生物量达到14.9 g/L,较优化前提高了36.7%,硒含量达到2 531.4 μg/g,较优化前提高了74.2%。涂青等[71]确定了酿酒酵母SY2的最佳发酵工艺条件为发酵温度30 ℃,初始pH值5.0,接种量8%,硒添加量30 mg/L以及发酵时间24 h,此外,研究还发现了拟指数补料是最优的补料策略,在培养34 h时,总硒含量达到了1 920.5 μg/g,富硒酵母得率为0.252 g/g,硒的转化率为82.7%。
3.2 利用诱变技术或适应性驯化选育高富硒酵母菌株
选育富硒酵母菌种常用的方法有适应性驯化和诱变筛选等,在实际育种过程中,这两类方法可以单独或结合起来应用。适应性驯化是通过逐步提高培养基中无机硒的浓度,对酿酒酵母菌株进行驯化,筛选出富硒能力提升的菌株。而诱变筛选则是利用物理或化学诱变的方法处理酿酒酵母细胞,然后利用不同筛选条件筛选突变株,按照筛选条件不同,可以细分为:基于无机硒耐受性筛选、基于乙硫氨酸耐受性筛选、基于过氧化氢耐受性筛选和基于谷胱甘肽产量筛选。
3.2.1 基于无机硒耐受性筛选
利用含有无机硒的培养基筛选耐受性显著提升的菌株,是选育富硒酵母的常用方法。张顺涛等[72]利用浓度逐级增加的含有亚硒酸钠培养液对酿酒酵母菌株PT进行适应性驯化,成功筛选出生物量显著提升且具有较高亚硒酸钠耐受性的菌株PT-1,然后采用紫外诱变技术处理该菌株,利用含有亚硒酸钠的平板进一步筛选,得到1株高生物量的富硒酵母UV-PT,进一步通过优化发酵条件,确定该菌株的最适发酵条件为:发酵温度30.3 ℃,转速203 r/min,初始pH值4.52,利用最优发酵条件获得的菌体生物量增加至10.62 g/L,含硒量提升至1 003.26 μg/g,总硒含量为10 654.62 μg/L,为出发菌株的1.62倍。李颖[73]以酿酒酵母CICC31105菌株为出发菌株,通过多次紫外诱变处理和亚硒酸钠抗性筛选,获得了一株能在含有高浓度亚硒酸钠培养基中生长且富硒能力较强的突变菌株MY-02,随后,通过单因素试验对其培养条件进行了优化,确定该菌株的最优培养条件为亚硒酸钠添加质量浓度35 mg/L,添加时间8 h,摇瓶发酵时间30h,在该条件下获得的菌体生物量为6.37g/L,硒含量达到3 129.40 μg/g,是出发菌株的2倍。
3.2.2 基于乙硫氨酸耐受性筛选
除了基于无机硒耐受性筛选之外,还可以基于乙硫氨酸耐受性筛选富硒能力提升的酿酒酵母菌株,这是由于硒代蛋氨酸的硒元素与蛋氨酸的硫元素存在竞争关系,均通过硫代谢途径合成,在酿酒酵母细胞内提升蛋氨酸的含量,硒代蛋氨酸的合成也会提高[74]。蛋氨酸的合成途径受到了产物蛋氨酸的反馈抑制,当细胞内蛋氨酸浓度达到一定水平时,会抑制蛋氨酸的进一步合成,而乙硫氨酸作为蛋氨酸的结构类似物,对乙硫氨酸具有较高耐受性的突变株,其蛋氨酸合成的反馈抑制可能被降低或阻断,促使代谢流向蛋氨酸合成方向,这也有利于硒代蛋氨酸的合成和积累[75-76]。 朱昌雄[77]对酿酒酵母菌株L-11进行多次硫酸二乙酯(diethyl sulfate,DES)诱变处理,经过亚硒酸钠和乙硫氨酸耐受性筛选,最终筛选出一株总硒含量和蛋氨酸含量均较高的酿酒酵母L-11-7-2,其总硒含量为2 452 μg/g,硒代蛋氨酸含量为1 650 μg/g,出发菌株提高了280.2%和369.1%,硒代蛋氨酸在总硒中所占的比例从出发菌株的51.1%提高到67.3%。
在没有硫供应的条件下,细胞会更加倾向于通过改变后的代谢途径来合成含硫氨基酸,因此,在育种过程中筛选到的高乙硫氨酸耐受性突变株,还可以通过在无硫培养基中进行进一步筛选,有利于筛选出富硒能力真正提升的菌株[78]。李玉梅等[78]对经0.05 mg/mL亚硒酸钠培养的酿酒酵母菌株进行紫外诱变处理,筛选获得一株能耐受5 mg/mL亚硒酸钠的菌株,进一步对该菌株进行乙硫氨酸抗性筛选和无硫平板稀释涂布分离,得到一株可耐受5 mg/mL亚硒酸钠和10 mg/mL乙硫氨酸的突变株Y3,其硒含量为22.4 mg/g,随后对该菌株的发酵条件进行了优化,在最佳发酵条件下菌株的总硒含量可达26.75 mg/g,发酵产物中硒的形态以硒代蛋氨酸为主,占总硒量的91.83%,其次是硒代半胱氨酸,占6.88%,而无机硒(Se4+和Se6+)仅占1.28%。
3.2.3 基于过氧化氢耐受性筛选
提升酿酒酵母对过氧化氢(H2O2)的耐受性会提升酿酒酵母的富硒能力。硒蛋白作为有机硒的关键成分,它的产量能体现出酿酒酵母转化有机硒的效率[79]。硒蛋白上的硒元素由硒磷酸供应,而硒磷酸的产生是硒蛋白合成的限速步骤,该步骤由硒磷酸合成酶催化[80-82]。 研究表明,硒磷酸合成酶对H2O2非常敏感[81-82],因此,对过氧化氢耐受性提升的突变体,其硒磷酸合成酶的活性可能会提高,进而促进硒蛋白的合成。孙朝阳等[83]利用叠氮化钠(NaN3)诱变处理酿酒酵母菌株,利用含有2.5%H2O2的液体培养基筛选,获得一株高H2O2耐受性突变株HXS-02,与出发菌株相比,其硒磷酸合成酶的酶活明显上升,总硒含量为2 303.97 μg/g,无机硒含量为2 250.84 μg/g,有机硒占总硒的比例超过97%。
3.2.4 基于谷胱甘肽产量筛选
提高酿酒酵母的谷胱甘肽合成会提高酿酒酵母的富硒能力,谷胱甘肽过氧化物酶是一种含硒的酶,其活性中心为硒代半胱氨酸,能够催化谷胱甘肽变为氧化型谷胱甘肽,将有毒的过氧化物还原为无毒的羟基化合物,从而保护细胞免受氧化应激损伤。当细胞中谷胱甘肽合成增多时,可为谷胱甘肽过氧化物酶提供更多的底物,进而增强该酶的活性,由于谷胱甘肽过氧化物酶的活性依赖于硒代半胱氨酸, 因此增强其活性需要摄取并利用更多的无机硒,从而使得酿酒酵母呈现出更强的富硒能力。柳乐[84]采用斯皮尔曼系数(R)分析了10株酿酒酵母菌的富硒能力与胞内谷胱甘肽含量的相关程度,证实这些菌株的富硒能力与其谷胱甘肽的含量存在一定的相关性。何家伟等[85]通过对19株酿酒酵母菌株进行亚硒酸钠抗性筛选,获得4株能耐受3 000 mg/L亚硒酸钠的菌株,将这些菌株在含50 mg/L亚硒酸钠的培养基中进行90次连续转接培养,获得了一株生物量和有机硒转化能力均显著提高的菌株CMY-1,其生物量达到6.79 g/L,有机硒含量达到1 254.6 μg/g,对该菌株进一步进行DES诱变处理,经过乙硫氨酸平板筛选后,获得突变株CMY-15-1,其有机硒含量为2 663.3 μg/g,谷胱甘肽含量提高了60.4%,硒代谷胱甘肽含量为8.8 μg/L,优化培养基组分及无机硒添加后,硒代谷胱甘肽含量可达33.71 μg/L。
3.3 利用原生质体融合技术选育高富硒酵母菌株
原生质体融合技术无需对双亲的遗传背景有详尽的了解,仅需要根据培育目标有针对性地选择亲本菌株,就能成功培育出理想的融合株,具有不受亲缘关系限制可以传递大量的遗传信息的特点,该技术不仅简单高效,还能够为富硒酵母的遗传育种提供一种高效可行的手段[86]。范秀英等[87]测定了300株酵母菌在150 μg/mL亚硒酸钠条件下的生物量和硒含量,筛选获得了生物量较高的二倍体菌株ZY-67和硒含量较高的二倍体菌株ZY-198,随后对这两株菌株实施了生孢诱导培养和单倍体分离,从筛选的单倍体中,选择了生物量优势明显的菌株ZY-6-18和硒含量优势明显的菌株ZY-21进行亚硝基胍(nitroso-guanidin,NTG)诱变处理,从诱变后的菌株中挑选出带有不同氨基酸缺陷标记的ZY-67-18-34和ZY-198-21-6作为融合亲株,经原生质体融合后,利用含有质量浓度为150 μg/mL的亚硒酸钠的培养基中进行筛选,获得生物量和硒含量均较高的融合菌株ZFF-28,其生物量为5.9 g/L,总硒含量为13 570 μg/L,细胞硒含量为2 300 μg/g。
4 结语与展望
本文综述了生物转化有机硒的方式、酿酒酵母转化有机硒的机制,根据现有研究成果,系统梳理和分析了提高酿酒酵母转化有机硒的研究进展。富硒酵母菌株的有机硒转化能力有了显著提升,具有广阔的应用发展前景,但仍有许多问题需要进一步探讨和解决。可以结合组学测定及分析技术全面解析富硒酵母的遗传背景,挖掘硒代谢关键调控网络或调控元件,发现新的与硒代谢相关的基因,为菌株的改良提供新的靶点;还应加强多学科交叉合作,通过构建反映酿酒酵母胞内有机硒转化情况的生物传感器结合流式细胞分选技术,分选高硒富集能力的菌株,通过开展大规模筛选和验证工作,建立高效育种体系,以进一步提升育种效率;还可以运用先进合成生物学技术精准改造基因组,提高菌株的富硒能力和稳定性;未来研究应关注富硒酵母的工业化生产工艺优化,提高生产效率,降低成本,确保产品质量稳定,推动富硒酵母在食品、医药、农业等领域的广泛应用。 相信随着研究的不断深入,富硒酵母在促进人体健康、预防疾病等方面将发挥更加重要的作用。
[1]张新新.L-硒代蛋氨酸缓解氨暴露诱发猪肠道损伤的作用机制研究[D].哈尔滨:东北农业大学,2023.
[2]余青,秦乐蓉,丽蕊,等.硒的生理功能及其对畜禽动物性能和肉质的影响研究进展[J].肉类研究,2020,34(3):94-99.
[3]陆春秀,陈羽彤,田淑婧,等.微量元素硒增强动物机体免疫力的机制研究进展[J].中国饲料,2023,1(11):1-7.
[4]李毓华,谢建亮,张国坪,等.富硒酵母饲喂生长肥育猪对其猪肉硒含量的影响[J].畜牧兽医杂志,2020,39(2):34-36.
[5]杜小平,魏昌华,张立君,等.陕西安康地区茶叶硒含量空间分布及硒肥后效研究[J].西北农林科技大学学报(自然科学版),2025(2):1-12.
[6]郑雄伟,向武,刘磊,等.鄂中丘陵区土壤硒分布特征及资源量研究——以湖北省钟祥市为例[J].土壤通报,2024,55(2):360-373.
[7]覃建勋,付伟,郑国东,等.广西岩溶区表层土壤硒元素分布特征与影响因素探究——以武鸣县为例[J].土壤学报,2020,57(5):1299-1310.
[8]KIELISZEK M.Selenium[J].Adv Food Nutr Res,2021,96:417-429.
[9]刘晓杰,杨霄,郭玉斐,等.富硒农产品中有机硒形态分析研究进展[J].现代食品,2024,30(13):75-77,87.
[10]WU J,HONG L,SHI M.Production of methylselenocysteine in Saccharomyces cerevisiae LG6 by continuous fermentation[J].Bioresource Teehnol,2021,13:100627.
[11]KLAYMAN D L, GUNTHER W H H.Organic selenium compounds:Their chemistry and biology[M].Hoboken:Wiley-Interscience,1974:571-572.
[12]何永佳,聂健.富硒食品研究进展[J].食品安全导刊,2024(17):143-145.
[13]FARAMARZI S,ANZABI Y,JAFARIZADEH-MALMIRI H.Nanobiotechnology approach in intracellular selenium nanoparticle synthesis using Saccharomyces cerevisiae-fabrication and characterization[J].Arch Microbiol,2020,202:1203-1209.
[14]樊军.富硒食品的研究进展[J].中国食品工业,2023(22):86-89.
[15]王茜,方荣,邓娟娟,等.富硒酵母功能作用研究进展及法规现状[J].中国食品添加剂,2023,34(2):327-335.
[16]时号,李芳宇,肖子路,等.富硒酵母的功能及其在动物生产中应用的研究进展[J].饲料研究,2023,46(16):170-174.
[17]姚鑫,朱倩,魏赛,等.富硒酵母菌及其富硒机理研究进展[J].当代畜禽养殖业,2024,44(4):42-44.
[18]GU X.GAO C Q.New horizons for selenium in animal nutrition and functional foods[J].Anim Nutr,2022,11:80-86.
[19]冯杨,单义琴,杨晓勤,等.香辛料中二氧化硫的本底研究[J].食品安全导刊,2023(15):57-59.
[20]周丽,张宝杰,李一方,等.富硒技术产业化运用研究[J].黑龙江科学,2020,11(10):138-141.
[21]张丽,田密.响应面法优化富硒酵母咀嚼片制备工艺[J].食品工业,2022,43(4):87-91.
[22]CHEREST H,DAVIDIAN J C,THOMAS D,et al.Molecular characterization of two high affinity sulfate transporters in Saccharomyces cerevisiae[J].Genetics,1997,145(3):627-635.
[23]MAPELLI V,HILLESTRØM P R,PATIL K,et al.The interplay between sulphur and selenium metabolism influences the intracellular redox balance in Saccharomyces cerevisiae[J].FEMS Yeast Res, 2012, 12(1):20-32.
[24]郭锦堂,薄少波,张根林.硫酸盐对粘红酵母X-20富硒能力的调控研究[J].新疆:石河子大学学报(自然科学版),2023,41(1):80-86.
[25]何家伟.酿酒酵母发酵产硒代谷胱甘肽研究[D].武汉:湖北工业大学,2021.
[26]CARIDI A.Enological functions of parietal yeast mannoproteins[J].Anton Leeuw,2006,89:417-422.
[27]KLIS F M, MOL P, HELLINGWERF K, et al.Dynamics of cell wall structure in Saccharomyces cerevisiae[J].FEMS Microbiol Rev,2002,26(3):239-256.
[28]KORDIALIK-BOGACKA E.Surface properties of yeast cells during heavy metal biosorption[J].Cent Eur J Chem,2011,9(2):348-351.
[29]唐梦瑶.复合菌种发酵黄浆水合成生物硒的研究[D].太原:山西大学,2016.
[30]LAZARD M,BLANQUET S,FISICARO P,et al.Uptake of selenite by Saccharomyces cerevisiae involves the high and low affinity orthophosphate transporters[J].J Biol Chem,2010,285(42):32029-32037.
[31]费沛雯.锌硒与农药及磷配合喷施对小麦富集锌硒的影响[D].杨凌:西北农林科技大学,2020.
[32]MCDERMOTT J R,ROSEN B P,LIU Z.Jen1p:a high affinity selenite transporter in yeast[J].Mol Biol Cell,2010,21(22):3934-3941.
[33]TECHO T, JINDARUNGRUENG S, TATIP S, et al.Vacuolar H (+) -ATPase is involved in preventing heavy metal-induced oxidative stress in Saccharomyces cerevisiae[J].Environ Microbiol,2020,22(6):2403-2418.
[34]KITAJIMA T,CHIBA Y.Selenomethionine metabolism and its toxicity in yeast[J].Biomol Concept,2013,4:611-616.
[35]HOEFIG C S,RENKO K,KÖHRLE J,et al.Comparison of different selenocompounds with respect to nutritional value vs.toxicity using liver cells in culture[J].J Nutr Biochem,2011,22(10):945-955.
[36]MAPELLI V, HILLESTRØM P R, KÁPOLNA E, et al.Metabolic and bioprocess engineering for production of selenized yeast with increased content of seleno-methylselenocysteine[J].Metab Eng, 2011, 13(3):282-293.
[37]PAINTER E P.The chemistry and toxicity of selenium compounds,with special reference to the selenium problem[J].Chem Rev,1941,28(2):179-213.
[38]杨新.开阳地区桑葚果园富硒酵母菌的筛选及其特性研究[D].贵阳:贵州大学,2020.
[39]TARZE A, DAUPLAIS M, GRIGORAS I, et al.Extracellular production of hydrogen selenide accounts for thiol-assisted toxicity of selenite against Saccharomyces cerevisiae[J].J Biol Chem,2007,282(12): 8759-8767.
[40]聂新玲.富硒酵母的菌种选育及其富硒条件优化[D].淮安:淮阴工学院,2023.
[41]WU B K, CHEN Q H, PAN D, et al.A novel therapeutic strategy for hepatocellular carcinoma:Immunomodulatory mechanisms of selenium and/or selenoproteins on a shift towards anti-cancer[J].Int Immunopharmacol,2021,96:107790.
[42]BÁNSZKY L,SIMONICS T,MARÁZ A.Sulphate metabolism of selenate-resistant Schizosaccharomyces pombe mutants[J].J Gen Appl Microbiol,2003,49(5):271-278.
[43]殷娴,邵蕾娜,廖永红,等.微生物富集有机硒研究进展[J].食品与发酵工业,2021,47(5):259-266.
[44]BIFANO A L,ATASSI T,FERRARA T,et al.Identification of nucleotides and amino acids that mediate the interaction between ribosomal protein L30 and the SECIS element[J].BMC Mol Biol,2013,14:12.
[45]CHEREST H, EICHLER F, ROBICHON-SZULMAJSTER H.Genetic and regulatory aspects of methionine biosynthesis in Saccharomyces cerevisiae[J].J Bacteriol,1969,97(1):328-336.
[46]王梦柯.不同外源硒吸收及木质部和韧皮部转运的差异[D].杨凌:西北农林科技大学,2019.
[47]NIE X L,YANG X R,HE J Y,et al.Bioconversion of inorganic selenium to less toxic selenium forms by microbes: A review[J].Front Bioeng Biotechnol,2023,11:1167123.
[48]SONAL,YUAN A E,YANG X Q,et al.Collective production of hydrogen sulfide gas enables budding yeast lacking MET17 to overcome their metabolic defect[J].PLoS Biol,2023,21(12):e3002439.
[49]ZHANG G C,WANG D H, WANG D H, et al.The mechanism of improved intracellular organic selenium and glutathione contents in selenium-enriched Candida utilis by acid stress[J].Appl Microbiol Biotechnol,2017,101(5):2131-2141.
[50]YAMAGATA S,TAKESHIMA K,NAIKI N.Evidence for the identity of O-acetylserine sulfhydrylase with O-acetylhomoserine sulfhydrylase in yeast[J].Biochem J,1974,75(6):1221-1229.
[51]吴江,洪文荣,苏敏,等.酿酒酵母XM2-9流加发酵生产甲基硒代半胱氨酸[J].食品与生物技术学报,2021,40(7):103-111.
[52]GANTHER H E.Selenium metabolism,selenoproteins and mechanisms of cancer prevention: complexities with thioredoxin reductase[J].Carcinogenesis,1999,20(9):1657-1666.
[53]GANTHER H E.Reduction of the selenotrisulfide derivative of glutathione to a persulfide analog by glutathione reductase[J].Biochemistry,1971,10(22):4089-4098.
[54]ZHANG K.ZHAO Q Y.ZHAN T F, et al.Effect of different selenium sources on growth performance, tissue selenium content, meat quality,and selenoprotein gene expression in finishing pigs[J].Biol Trace Elem Res,2020,196(2):463-471.
[55]曲盛卿,刘新洋,吴查文,等.硒的生物学作用及对猪生产的研究进展[J].养猪,2024(4):25-30.
[56]GOLUBEV V I, GOLUBEV N V.Selenium tolerance of yeasts[J].Mikrobiologiia,2002,71(4):455-459.
[57]ALLMANG C, WURTH L, KROL A.The selenium to selenoprotein pathway in eukaryotes: More molecular partners than anticipated[J].Biochim Biophys Acta,2009,1790(11):1415-1423.
[58]PAPP L V, LU J, HOLMGREN A, et al.From selenium to selenoproteins:synthesis,identity,and their role in human health[J].Antioxid Redox Signal,2007,9(7):775-806.
[59]SQUIRES J E,BERRY M J.Eukaryotic selenoprotein synthesis:mechanistic insight incorporating new factors and new functions for old factors[J].IUBMB Life,2008,60(4):232-235.
[60]YE S H,SHEN F J,JIAO L Y,et al.Biosynthesis of selenoproteins by Saccharomyces cerevisiae and characterization of its antioxidant activities[J].Int J Biol Macromol,2020,164:3438-3445.
[61]MANTA B, MAKAROVA N E, MARIOTTI M.The selenophosphate synthetase family:A review[J].Free Radical Bio Med,2022,192:63-76.
[62]BUBENIK J L, MINIARD A C, DRISCOLL D M, et al.Alternative transcripts and 3'UTR elements govern the incorporation of selenocysteine into selenoprotein[J].Plos One,2013,8(4):e62102.
[63]侯勤堂.硒代半胱氨酸参与合成硒蛋白的翻译机制概述[J].生物学教学,2020,45(3):75-76.
[64]KIELISZEK M, BŁAZ˙EJAK S, GIENTKA I, et al.Accumulation and metabolism of selenium by yeast cells[J].Appl Microbiol Biotechnol,2015,99(13):5373-5382.
[65]DRUTEL A,ARCHAMBEAUD F O,CARON P.Selenium and the thyroid gland: more good news for clinicians[J].Clin Endocrinol, 2013,78(2):155-164.
[66]SMALL-HOWARD A, MOROZOVA N, STOYTCHEVA Z, et al.Supramolecular complexes mediate selenocysteine incorporation in vivo[J].Mol Cell Biol,2006,26(6):2337-2346.
[67]张文芝,郭坚华.微生物发酵工艺优化研究进展[J].广东农业科学,2013,40(6):114-117.
[68]陈雪, 甄玉国, 赵小丽.以糖蜜为碳源的酿酒酵母培养基的优化[J].中国酿造,2014,33(4):35-38.
[69]周洋枝,苏蒙蒙,路栋,等.酵母富硒培养条件研究进展[J].农产品加工,2019(1):74-76.
[70]王小波,柳乐,李学如.高富硒酵母菌种选育研究[J].食品与发酵科技,2011,47(5):6-9.
[71]涂青,杨双全,章之柱,等.富硒酵母发酵工艺的优化[J].中国酿造,2022,41(10):140-145.
[72]张顺涛,李肖,左涛,等.高生物量富硒酵母菌的选育[J].中国酿造,2008,27(11):37-40.
[73]李颖.高生物量富硒酵母的制备和性能改善研究[D].无锡:江南大学,2021.
[74]DE LEÓN C A P,BAY?N M M,PAQUIN C,et al.Selenium incorporation into Saccharomyces cerevisiae cells:a study of different incorporation methods[J].J Appl Microbiol,2002,92(4):602-610.
[75]程丽,闵伟红,贾彦明,等.产蛋氨酸菌株选育研究进展[J].农产品加工学刊,2011(5):73-77,80.
[76]ZHANG L,LI D D, ZHANG J, et al.Excessive apoptosis and ROS induced by ethionine affect neural cell viability and differentiation[J].Acta Biochim Biophys Sin,2020,52(10):1156-1165.
[77]朱昌雄.利用酿酒酵母菌富集硒的研究[D].武汉:华中农业大学,2007.
[78]李玉梅,王根林,刘峥宇,等.富硒酿酒酵母的选育及优化培养[J].中国农学通报,2016,32(26):75-79.
[79]王菲,李梦一,叶淑红,等.富硒酵母中硒蛋白的抗氧化性质[J].大连工业大学学报,2014,33(5):325-327.
[80]王开拓.人类硒代磷酸合成酶及大肠杆菌LepA蛋白的结构生物学研究[D].北京:北京大学,2010.
[81]TOBE R, MIHARA H.Delivery of selenium to selenophosphate synthetase for selenoprotein biosynthesis[J].Biochim Biophys Acta Gen Subj,2018,1862(11):2433-2440.
[82]SANTESMASSES D, GLADYSHEV V N, Selenocysteine machinery primarily supports TXNRD1 and GPX4 functions and together they are functionally linked with SCD and PRDX6[J].Biomolecules,2022,12(8):1049.
[83]孙朝阳,张玉英,潘利华,等.高富硒酵母菌株的筛选及其富硒特性分析[J].中国酿造,2020,39(9):116-120.
[84]柳乐.高生物量富硒酵母的选育及富硒机理的初步研究[D].成都:西南交通大学,2008.
[85]何家伟,蔡俊.合成硒代谷胱甘肽酿酒酵母菌株的筛选与发酵优化[J].食品研究与开发,2022,43(20):91-101.
[86]吕世龙.核糖体工程与原生质体融合选育高产ε-聚赖氨酸菌株[D].南阳:南阳师范学院,2022.
[87]范秀英,郭雪娜,傅秀辉,等.高生物量富硒酵母的选育及培养条件初步优化[J].生物工程学报,2003,19(6):720-724.