作为酱香型白酒的发酵剂和糖化剂,高温大曲以小麦为主要原料,经过粉碎、混合、踩制成型、发酵和贮存制成。高温大曲的培养温度在60 ℃以上,最高温度可达到70 ℃,使得大部分不耐高温的微生物逐渐消亡,形成了独特的微生物菌群,主要包括细菌、霉菌和酵母菌等功能微生物[1]。大曲中的微生物在酿造过程中进入酒醅,分泌淀粉酶、蛋白酶、糖化酶和纤维素酶等多种酶类,分解底物产生苯乙醇、乙酸乙酯、甲基吡嗪和四甲基吡嗪等风味物质,提高酒体品质和出酒率[2]。 此外,有研究表明,酒曲微生物代谢活动产生的乳酸和氨基酸等酸性物质影响酒曲的pH值,pH值的变化影响酶的活性和酒曲发酵环境[3],进一步影响酒曲的微生物生长和理化性质,而理化性质是评估酒曲质量的重要依据[4]。 因此,深入了解高温大曲中微生物的多样性,是探讨酒曲微生物组成及其与理化性质间相关性的前提和基础。
随着分子生物学技术的不断发展,酒曲微生物的研究也在不断深入。研究人员最初通过平板菌落计数法和纯培养技术对酒曲中的微生物进行分析和鉴定[5],并利用选择性培养基,成功地从酒曲中筛选出大量优质微生物菌株[6],揭示了酒曲微生物的多样性,同时也为菌种筛选提供了优质菌株。 基于纯培养技术,李芳香等[7]采用多种培养基从大曲中筛选出一株产量高的蛋白酶菌株,通过观察菌株形态学特征,进行革兰氏染色和芽孢染色,确定该菌株为芽孢杆菌。近年来,以Illumina MiSeq为代表的第二代高通量测序技术已被用于研究不同地区酒曲的微生物多样性。孙羊羊等[8]研究了天津地区高温大曲微生物的多样性,发现优势细菌属为克罗彭斯特菌属(Kroppenstedtia)、芽孢杆菌属(Bacillus)和糖多孢菌属(Saccharopolyspora)等,优势真菌属为嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)和曲霉属(Aspergillus)等。 因此,采用纯培养技术并结合Illumina MiSeq测序技术能够揭示高温大曲中微生物的菌群多样性,并为菌种的选育与改良提供潜力菌株。
本研究选取湖南省常德市某酒厂同一批次成品高温大曲为研究对象,采用纯培养和Illumina MiSeq测序技术解析其微生物多样性,并测定其理化指标,探究优势菌属与各项理化指标的相关性,以期为高温大曲的生产优化、质量控制及微生物资源的开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
高温大曲样品:湖南省常德市(N29°02′,E111°41′)某酒厂酿造车间采集样品,选取同一生产批次的高温大曲,曲坯表面90%以上呈黄褐色,酱香突出,曲香浓郁,无异味,断面90%以上呈灰白色,色泽一致,菌丝明显,共选取了6块符合要求的酒曲,编号为WL1~WL6,将6块大曲进行粉碎过40目筛,获得品质均一的6份平行样品,置于4 ℃保存备用。
氢氧化钠、浓盐酸、浓硫酸、葡萄糖、可溶性淀粉(生化试剂)、碘、碘化钾、无水乙酸钠、冰乙酸、己酸、甲醛(均为分析纯):天津市科密欧化学试剂有限公司;DNeasy mericon Food脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒:德国QIAGEN公司;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、10×聚合酶链式反应(polymerase chain reaction,PCR)缓冲液、rTaq酶:赛默飞世尔科技公司;细菌引物338F与806R和真菌引物ITS1与ITS2:上海赛恒生物科技有限公司;营养琼脂培养基(nutrient agar,NA)、马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):北京奥博星生物技术有限责任公司。
1.2 仪器与设备
CS101-ABN电热鼓风干燥箱:重庆康诚永生试验设备有限公司;KBF170高温箱式炉:南京南大仪器厂;PHS-4C+酸度计:成都世纪方舟科技有限公司;K1100全自动定氮仪:济南海能仪器股份有限公司;VSA水蒸汽吸附分析仪:美国AquaLab公司;DSH-50-1水分测定仪:上海越平科学仪器有限公司;FE28酸度计:梅特勒托利多科技(中国)有限公司;AS-1200马弗炉:郑州安晟科学仪器有限公司;Veriti FAST梯度PCR仪:美国ABI公司;Illumina MiSeq PE300高通量测序平台:美国Illumina公司。
1.3 方法
1.3.1 高温大曲样品DNA提取、PCR扩增和Illumina MiSeq高通量测序
根据DNeasy mericon Food试剂盒的操作指南提取DNA,并对其纯度和完整性进行检测。依据WU X Y等[9]所建立的PCR扩增体系和操作流程,采用细菌特异性引物338F和806R对16S rDNA基因的V3-V4可变区域以及真菌特异性引物ITS1和ITS2对ITS区基因序列进行PCR扩增。确认扩增产物质量合格后基于Illumina MiSeq测序平台进行深度测序。
1.3.2 序列质控和生物信息学分析
对下机序列进行质量控制与拼接处理[10],基于QIIME分析平台对序列进行校准对齐,根据97%和100%相似度划分操作分类单元(operational taxonomic units,OTU),并在数据库中进行同源性比对分析[11],确定分类学地位,统计各样品中细菌和真菌在门和属水平的相对含量,并计算相同测序深度下细菌和真菌的α多样性指数,包括超1(Chao 1)指数和香农(Shannon)指数。
1.3.3 高温大曲中可培养微生物的分离、纯化及鉴定
参照罗小叶等[12]的研究方法,称取10 g粉碎后混合均匀的高温大曲样品,装入已高温灭菌的含90 mL生理盐水的锥形瓶中,37 ℃振荡30 min,吸取1 mL混匀液体加入9 mL灭菌生理盐水试管中混匀获得10-2的稀释液,重复操作直至获得10-4的稀释液,并吸取100 μL 10-2~10-4的稀释液均匀涂布在NA和PDA固体培养基中,分别于30 ℃培养箱倒置培养2 d和28 ℃培养箱正置培养5 d。挑取不同形态的菌落进行三区划线纯化后,观察菌落形态和显微镜形态。 按照GE D Y等[13]的方法对分离菌株进行DNA提取、PCR扩增、连接、鉴定和测序。测序序列与美国国家生物技术信息中心(national center of biotechnology information,NCBI)Genbank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,使用MEG 11.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树,确定分离株的分类学地位。
1.3.4 理化指标的测定
根据轻工标准QB/T 4257—2011《酿酒大曲通用分析方法》测定高温大曲样品的理化指标。水分含量:采用水分测定仪测定;酸度:采用酸度计测定;淀粉含量、液化力、糖化力、酯化力、氨基酸态氮:采用滴定法测定;发酵力:采用二氧化碳失重法测定;灰分:采用马弗炉测定;酒化力:采用酒精计测定;蛋白质含量:采用全自动定氮仪测定;水分活度:采用水蒸汽吸附分析仪测定。 所有理化指标均进行3次重复性实验,取平均值作为最终结果。
1.3.5 数据处理
采用DNAMAN 6.0软件和MEGA 11.0软件绘制系统发育树,采用Graphpad Prism 7.0软件绘制箱型图,采用Origin 2024软件绘制优势门和优势属柱形图,采用SAS 9.4和Cytoscape 3.7.1软件绘制相关性分析网络图。
2 结果与分析
2.1 高温大曲中细菌和真菌菌群的α多样性分析
本研究高温大曲样品中共注释到5 310个细菌OTU和1 339个真菌OTU。基于OTU计算高温大曲样品中细菌和真菌菌群的α多样性指数,在测序量51 010 bp下获得Chao 1指数和Shannon指数,结果见图1。
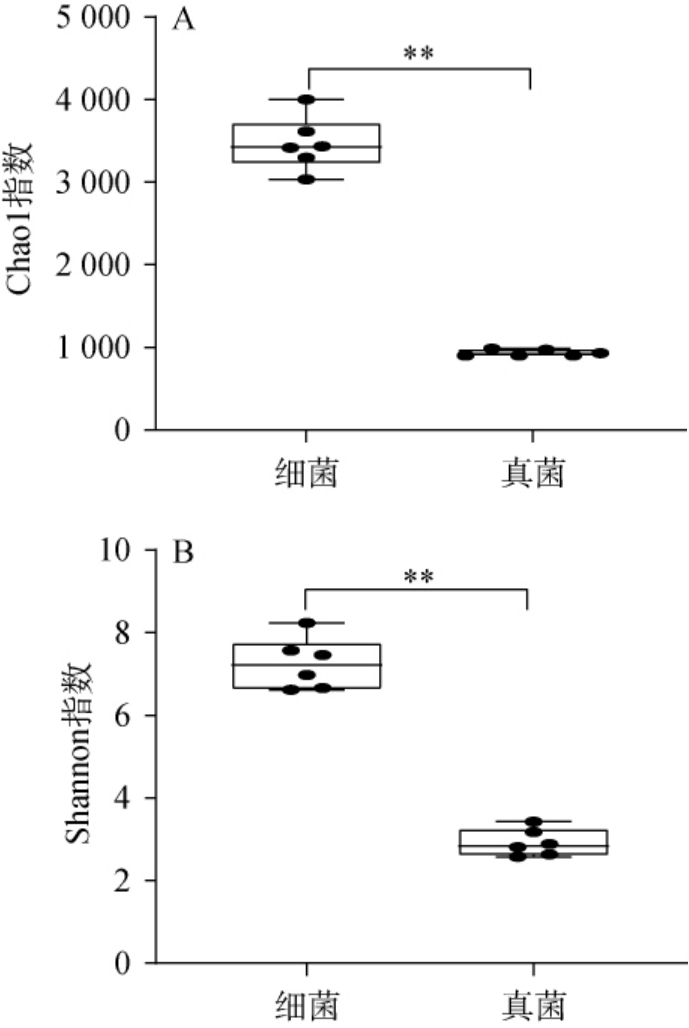
图1 高温大曲中细菌和真菌菌群的超1指数(A)和香农指数(B)
Fig.1 Chao1 indexes (A) and Shannon indexes (B) of bacterial and fungal communities of high-temperature Daqu
“**”表示细菌和真菌菌群Chao 1/Shannon指数差异极显著(P<0.01)。
由图1可知,高温大曲样品细菌和真菌菌群的Chao 1指数平均值分别为3 468和933,Shannon指数平均值分别为7.25和2.92。通过Mann-Whitney检验发现,真菌菌群Chao 1指数和Shannon指数均低于细菌菌群,且差异极显著(P<0.01)。 这说明纳入本研究的高温大曲样品中,真菌菌群的丰富度和多样性极显著低于细菌菌群(P<0.01)。
2.2 高温大曲中细菌菌群结构分析
本研究共获得367 642条16S rRNA序列,经过序列比对分析将其划分为10个细菌门和204个细菌属,其中,将平均相对丰度>1.0%的细菌门和属称为优势细菌门和属,进一步对细菌优势门和属组成进行解析,结果见图2。
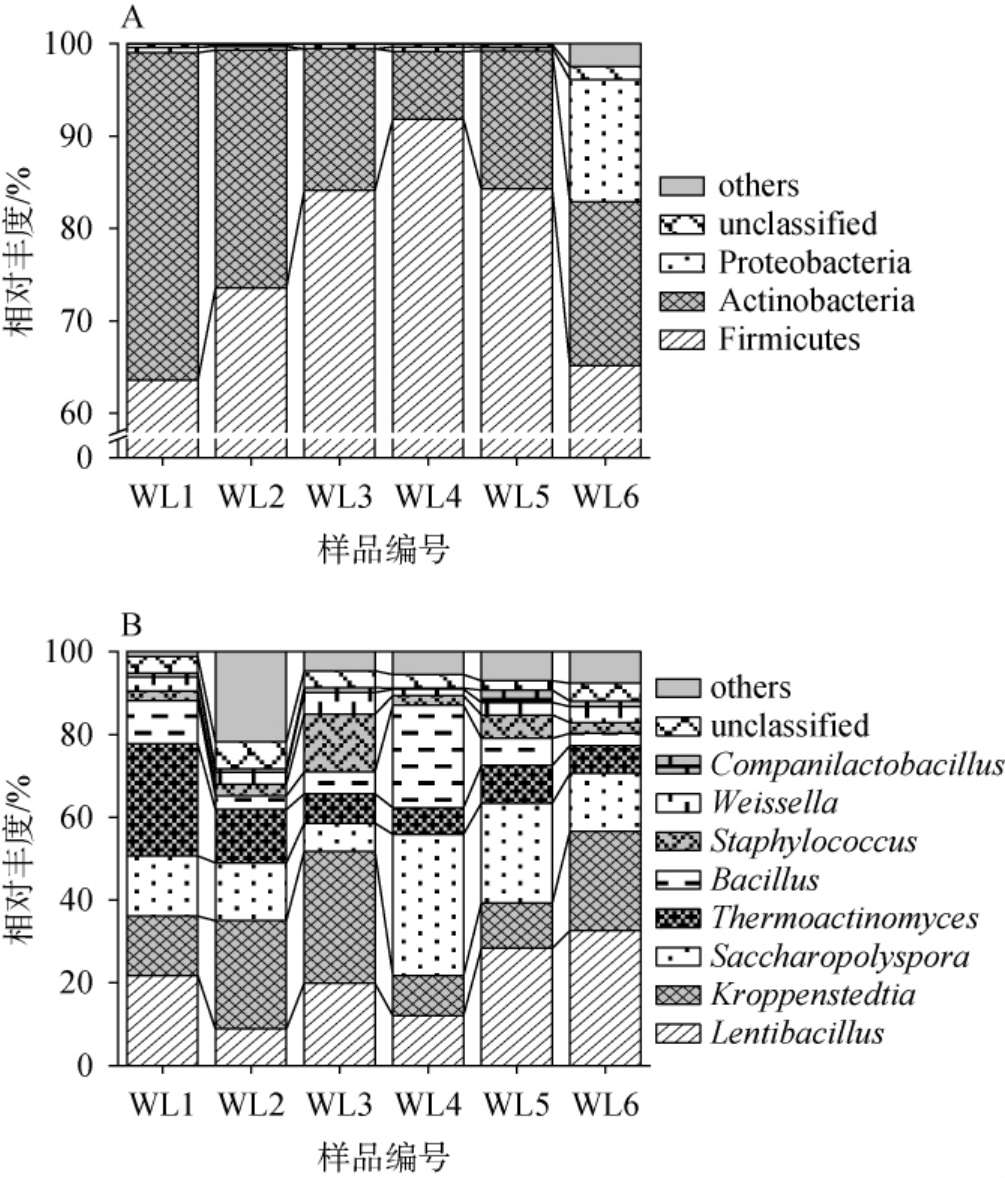
图2 基于门(A)和属(B)水平高温大曲中细菌菌群结构分析结果
Fig.2 Analysis results of bacterial flora structure of high-temperature Daqu at phylum (A) and genus (B) levels
由图2A可知,高温大曲样品中主要优势细菌门为厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria),平均相对丰度分别为65.19%、17.73%和13.19%。 由图2B可知,主要优势细菌属为慢生芽孢杆菌属(Lentibacillus)、克罗彭斯特菌属(Kroppenstedtia)、糖多孢菌属(Saccharopolyspora)、高温放线菌属(Thermoactinomyces)、芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)、魏斯氏菌属(Weissella)和伴生乳杆菌属(Companilactobacillus),平均相对丰度分别为20.60%、19.51%、17.93%、11.53%、8.90%、4.92%、3.32%和1.27%。杨晨等[14]利用高通量测序技术研究了茅台镇高温大曲的细菌群落,发现优势细菌属包括Bacillus、Kroppenstedtia、Lentibacillus、Saccharopolyspora、Thermoactinomyces、Weissella和Staphylococcus,平均相对丰度分别为13.96%、13.52%、11.01%、8.63%、6.72%、4.00%和1.81%,与本研究结果相比,菌群构成虽具有一定的相似性,但平均相对含量受到地域条件等因素的影响存在差异。
在酱香型白酒发酵过程中,Lentibacillus、Kroppenstedtia和Bacillus属于优势菌群和功能菌群[15],其所分泌的多种水解酶在促进大分子化合物水解的同时, 促使吡嗪类、酯类和醇类等多种风味化合物的生成,增强酒体风味的协调性[16]。Saccharopolyspora能够将淀粉、纤维素等多糖类物质分解为可利用的糖类,促进微生物的代谢,提高原料的利用率[17]。Thermoactinomyces作为一种耐热微生物,能在高温环境下生长代谢,产生多种酶类,促进具有酱香型风味的挥发性化合物的合成,有助于提升酒体香气和丰富酒体风味层次[18]。
2.3 高温大曲中真菌菌群结构分析
本研究共获得488 647条ITS序列,经过序列比对分析将其划分为4个真菌门和55个真菌属,其中,将平均相对丰度>1.0%的真菌门和属称为优势真菌门和属,进一步对真菌优势门和属组成进行解析,其分析结果见图3。
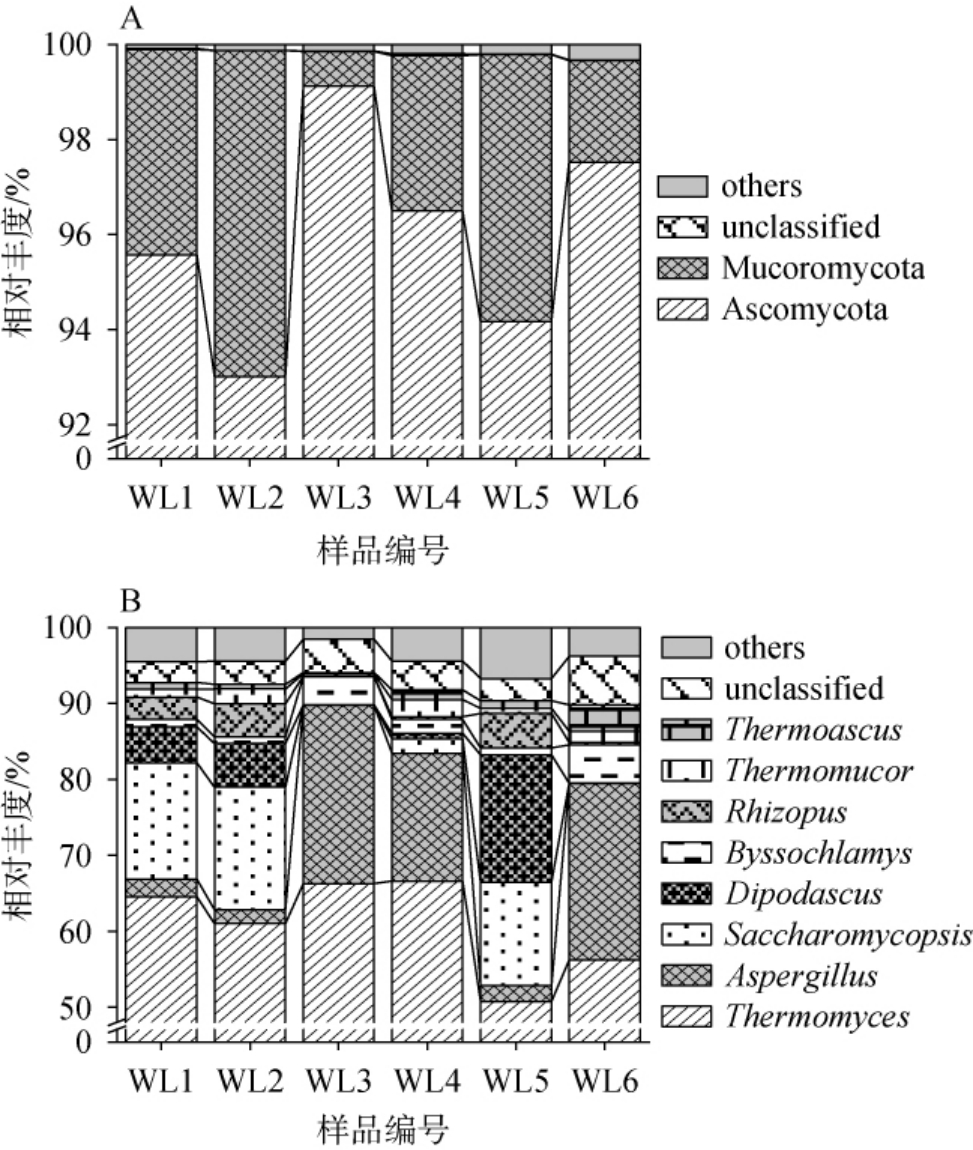
图3 基于门(A)和属(B)水平高温大曲中真菌菌群结构分析结果
Fig.3 Analysis results of fungal flora structure of high-temperature Daqu at phylum (A) and genus (B) levels
由图3A可知,高温大曲样品中主要优势真菌门为子囊菌门(Ascomycota)和毛霉门(Mucoromycota),平均相对丰度分别为95.98%和3.83%。 Ascomycota是本研究中所有样品的绝对优势真菌门,相对丰度均达到了92.00%,究其原因可能是大多数真菌的致死温度范围通常为50~60 ℃[19],但高温大曲的发酵温度高达60~70 ℃,因而只有少量隶属于Ascomycota的耐热和嗜热真菌在高温大曲中表现为优势菌属[20]。
由图3B可知,高温大曲样品中主要优势真菌属为嗜热真菌属(Thermomyces)、曲霉菌属(Aspergillus)、复膜孢酵母属(Saccharomycopsis)、双足囊菌属(Dipodascus)、丝衣霉属(Byssochlamys)、根霉属(Rhizopus)、嗜热毛霉属(Thermomucor)和嗜热子囊菌(Thermoascus),平均相对丰度分别为60.88%、11.64%、7.86%、4.67%、2.23%、2.11%、1.27%和1.24%。 采用高通量测序技术,范恩帝等[21]对不同制曲条件的高温大曲真菌组成进行分析,发现优势真菌属主要为Thermomyces、Byssochlamys、Rhizopus、Saccharomy copsis、Dipodascus和Aspergillus,并且不同组别高温大曲真菌属丰度存在不同程度差异,与本研究结果相似。 作为高温大曲中一种典型的嗜热真菌,Thermomyces在酒体酿造过程中生成淀粉酶和蛋白酶等多种酶类,不仅能够影响高温大曲中酿造微生物的代谢活动,还能够促进酒体生香物质的形成[22]。Aspergillus能够分泌淀粉酶和蛋白酶等多种酶类,有助于提升发酵原料的利用率,提高大曲的发酵性能,改良白酒品质[23]。Saccharomycopsis能够分泌淀粉酶、酸性蛋白酶和β-葡萄糖苷酶,且其生长代谢能够促进酒体中乙酸乙酯和杂醇的生成,进而提升酒体的口感与风味,使酒体更加醇厚细腻,回味悠长[24]。
2.4 高温大曲中可培养微生物的分离鉴定
基于纯培养技术,本研究从6份高温大曲样品中挑取了不同形态的菌落进行划线纯化,通过菌落和细胞形态特征的观察,共分离纯化出11株疑似细菌的分离株和4株疑似酵母菌的分离株,对分离菌株进行分子生物学鉴定,经同源性比对分析发现,分离菌株隶属于5个种,选取具有典型形态特征的5株菌,其菌落形态和细胞形态见图4。
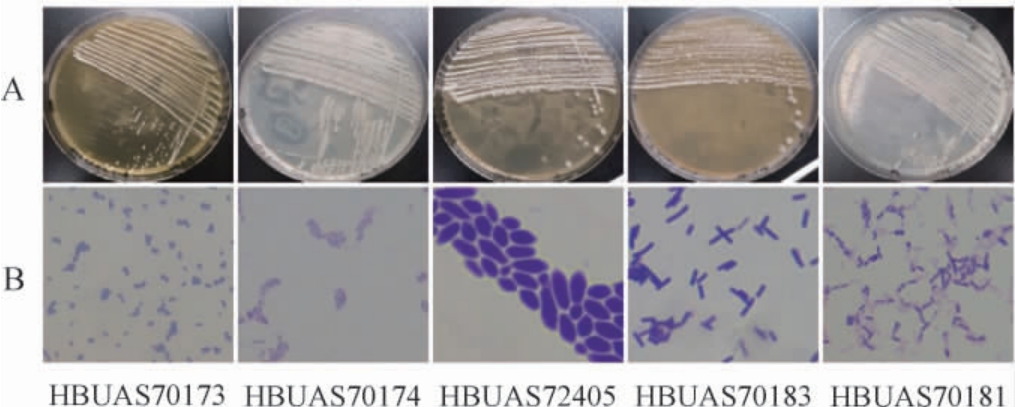
图4 高温大曲中部分分离株的菌落形态(A)和细胞形态(B)
Fig.4 Colony morphology (A) and cell morphology (B) of some isolated strains in the high-temperature Daqu
由图4可知,菌株HBUAS70173菌落为圆形,较小,呈乳白色,为革兰氏染色阳性菌,细胞形态为球状;菌株HBUAS70174菌落为圆形,较小,呈白色,为革兰氏染色阳性菌,细胞形态为短杆状;菌株HBUAS72405菌落为圆形,较大,呈白色,细胞形态为椭圆形;菌株HBUAS70183菌落为椭圆形,较大,边缘不规则,呈黄色,为革兰氏染色阳性菌,细胞形态为杆状;菌株HBUAS70181菌落为近圆形,较小,边缘不规则,呈灰白色,为革兰氏染色阳性菌,细胞形态为杆状。 为了进一步明确分离株的分类学地位,将11株疑似细菌分离株的16S rRNA序列和4株疑似酵母菌分离株的ITS序列上传至NCBI进行同源性比对,并绘制系统发育树,结果见图5。

图5 基于16S rRNA(A)和ITS基因序列(B)高温大曲中分离菌株的系统发育树
Fig.5 Phylogenetic tree of 16S rRNA (A) and ITS gene sequences(B) of isolated strains from high-temperature Daqu
由图5A可知,菌株HBUAS70175、HBUAS70176、HBUAS70177、HBUAS70179、HBUAS70180、HBUAS70181和HBUAS70182被鉴定为地衣芽孢杆菌(Bacillus licheniformis),菌株HBUAS70178和HBUAS70183被鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens),菌株HBUAS70173被鉴定为乳酸片球菌(Pediococcus acidilactici),菌株HBUAS70174被鉴定为弯曲乳杆菌(Lactobacillus curvatus)。 由图5B可知,菌株HBUAS72405、HBUAS72406、HBUAS72407和HBUAS72408被鉴定为扣囊复膜酵母(Saccharomycopsis fibuligera)。 因此,本研究分离筛选到的可培养微生物主要是Bacillus licheniformis和Saccharomycopsis fibuligera。Bacillus licheniformis耐盐、耐酸碱和耐高温能力较好,能够产生淀粉酶、蛋白酶和纤维素酶,提高原料利用率和出酒率[25]。Saccharomycopsis fibuligera除了能产生淀粉酶、糖化酶和β-葡糖苷酶外,还能与酿酒酵母(Saccharomyces cerevisiae)协同作用,提高原料中纤维素的利用率,进而增加酒体中高级醇的含量[26]。目前,已有研究将Bacilluslicheniformis和Saccharomycopsis fibuligera应用于生产强化大曲、改善酒体的风味品质和处理酒糟的研究中,结果表明,Bacillus licheniformis和Saccharomycopsis fibuligera的添加不仅能够提升酒体口感的丰富度,增加酒体风味物质的含量,而且能有效提高酒糟的利用率和附加值,减少酿酒过程中的环境污染,为酿酒行业的可持续发展开辟新路径[26-27]。
2.5 高温大曲理化性质分析
理化性质不仅是监测大曲品质和发酵适宜性的关键指标,亦影响着大曲中的微生物功能[28],因此本研究对高温大曲样品的各项理化指标进行了测定,结果见表1。
表1 高温大曲理化性质分析
Table 1 Analysis of physiochemical properties of high-temperature Daqu
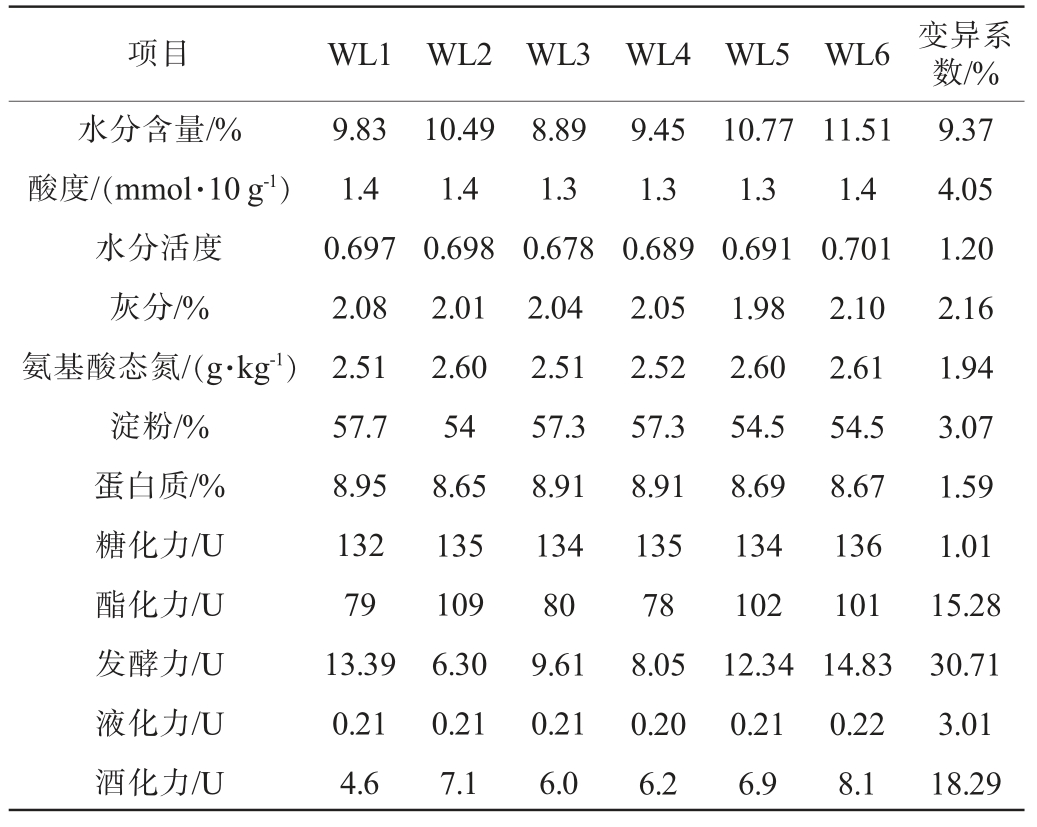
项目WL1 WL2 WL3 WL4 WL5 WL6 变异系数/%水分含量/%酸度/(mmol·10 g-1)水分活度灰分/%氨基酸态氮/(g·kg-1)淀粉/%蛋白质/%糖化力/U酯化力/U发酵力/U液化力/U酒化力/U 9.83 1.4 0.697 2.08 2.51 57.7 8.95 132 79 13.39 0.21 4.6 10.49 1.4 0.698 2.01 2.60 54 8.65 135 109 6.30 0.21 7.1 8.89 1.3 0.678 2.04 2.51 57.3 8.91 134 80 9.61 0.21 6.0 9.45 1.3 0.689 2.05 2.52 57.3 8.91 135 78 8.05 0.20 6.2 10.77 1.3 0.691 1.98 2.60 54.5 8.69 134 102 12.34 0.21 6.9 11.51 1.4 0.701 2.10 2.61 54.5 8.67 136 101 14.83 0.22 8.1 9.37 4.05 1.20 2.16 1.94 3.07 1.59 1.01 15.28 30.71 3.01 18.29
由表1可知,根据DB 52/T 871—2014《酱香型白酒酿酒用大曲》的理化性质范围,即水分≤13%,酸度1.0~3.5 mmol/10 g,淀粉53.0%~60.0%,糖化力100~300 U,纳入本研究的高温大曲样品的水分含量、酸度、淀粉含量和糖化力均符合酱香型高温大曲的理化要求。 高温大曲样品的酯化力、发酵力和酒化力这3项指标数值波动较大,变异系数明显高于其他理化指标,分别为15.28%、30.17%和18.29%,表明纳入本研究的6个高温大曲在酯化力、发酵力和酒化力存在较大的差异。 大曲的理化性质与微生物之间存在着紧密的关联性,因而本研究深入探究了高温大曲理化指标与优势菌属之间的相关性,经过Spearman相关性分析计算后,选取|r|≥0.7的相关对象绘制了相关性网络图,结果见图6。
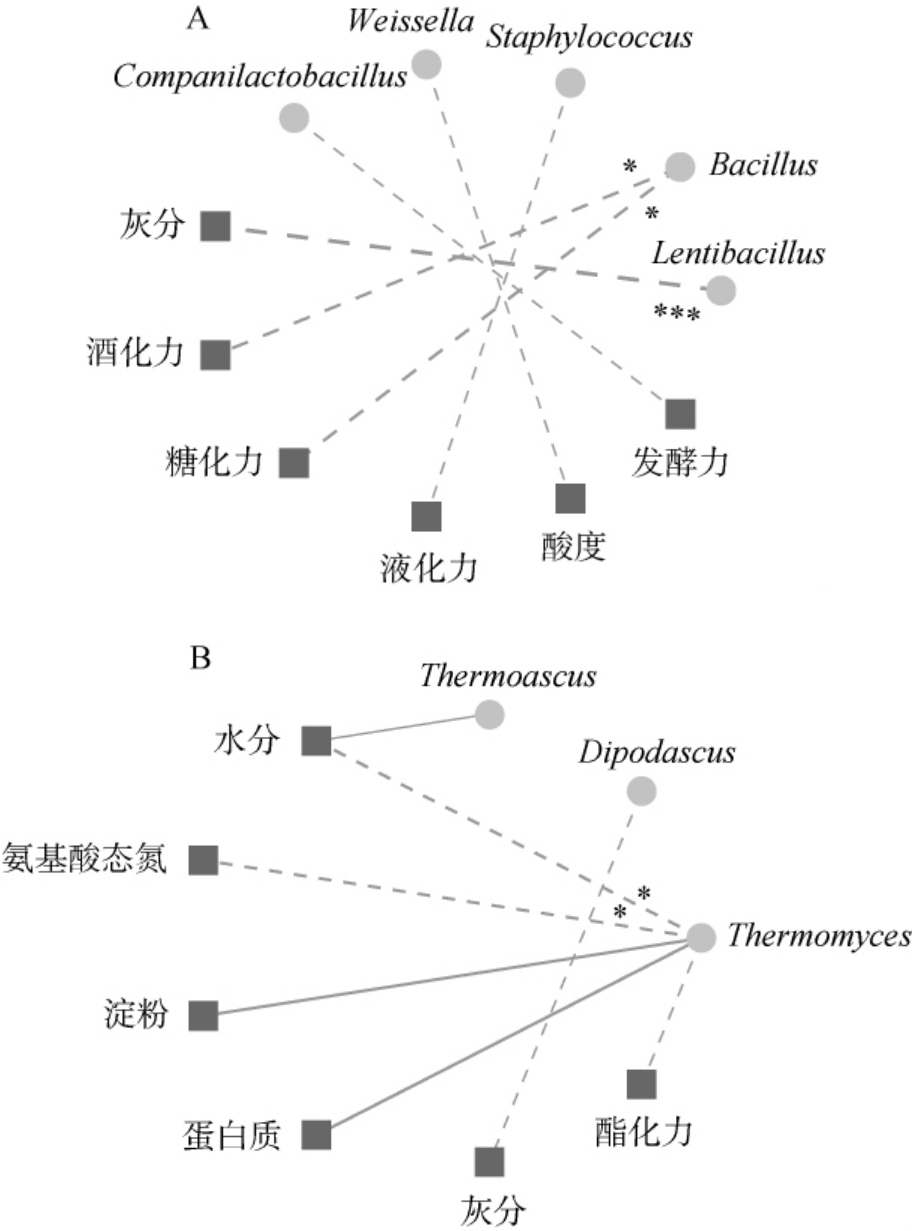
图6 高温大曲中优势细菌属(A)及优势真菌属(B)与理化指标间相关性分析网络图
Fig.6 Network diagram of correlation analysis between dominant bacterial genera (A) and dominant fungal genera (B) and physicochemical indexes in high-temperature Daqu
图中实线表示正相关,虚线表示负相关;“*”表示相关性显著(P<0.05),“***”表示相关性高度显著(P<0.001)。
由图6A可知,优势细菌属与各项理化指标均呈负相关,其中Lentibacillus与灰分呈高度显著负相关(P<0.001),Bacillus与酒化力和糖化力呈显著负相关(P<0.05)。由图6B可知,Thermomyces与水分和氨基酸态氮呈显著负相关(P<0.05)。 有研究指出,Bacillus与糖化力、液化力和发酵力呈正相关,Thermomyces与酸度呈正相关[29],然而在本研究中并未验证这一结论。原因可能在于不同地区高温大曲曲坯疏松度、培菌温度和贮存时间的差异,这些差异导致微生物与理化性质之间的相互作用发生变化, 进而影响大曲的品质和风味特征[30]。因此在后续研究中应设置多个分布广泛的采样点,增加样品的采集数量,更全面地了解高温大曲的微生物组成和理化性质及两者之间的关联性,为优化酒曲的酿造工艺和提升高温大曲的品质提供理论依据。
3 结论
本研究对常德地区高温大曲的微生物多样性及理化指标进行解析,结果表明高温大曲中优势细菌门为Firmicutes、Actinobacteria和Proteobacteria,优势细菌属主要为Lentibacillus、Kroppenstedtia、Saccharopolyspora和Thermoactinomyces,优势真菌门为Ascomycota和Mucoromycota,优势真菌属主要为Thermomyces、Aspergillus和Saccharomycopsis,其中Lentibacillus与灰分呈高度显著负相关(P<0.001),Bacillus与酒化力和糖化力呈显著负相关(P<0.05),Thermomyces与水分和氨基酸态氮呈显著负相关(P<0.05)。经鉴定,高温大曲中可培养微生物主要是Bacillus licheniformis和Saccharomycopsis fibuligera。 本研究为深入认识该地区酒曲微生物多样性和理化性质提供了数据基础。
[1]YANG J G,DOU X,MA Y Y.Diversity and dynamic succession of microorganisms during Daqu preparation for Luzhou-flavour liquor using second-generation sequencing technology[J].J I Brewing,2018,124(4):498-507.
[2]TANG P,WANG L,LU J,et al.Characterization of key aroma compounds and relationship between aroma compounds and sensory attributes in different quality of high temperature Daqu[J].LWT-Food Sci Technol,2024,194(2):115801.
[3]SHI W, CHAI L J, ZHAO H, et al.Deciphering the effects of different types of high-temperature Daqu on the fermentation process and flavor profiles of sauce-flavor Baijiu[J].Food Biosci,2024,61(8):104917.
[4]ZHAO L N, WU X, ZHAO Y L, et al.Deciphering the intra- and interkingdom networks of microbiota in the pit mud of Chinese strong-flavor liquor[J].LWT-Food Sci Technol,2022,165(8):113703.
[5]GOU M,WANG H Z,YUAN H W,et al.Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J].J I Brewing,2015,121(4):620-627.
[6]MARASCO R, GAZZILLO M, CAMPOLATTANO N, et al.Isolation and identification of lactic acid bacteria from natural whey cultures of buffalo and cow milk[J].Foods,2022,11(2):233.
[7]李芳香,郭中欢,张稳,等.酱香型高温大曲中蛋白酶高产菌株的选育[J].酿酒科技,2024(8):43-48.
[8]孙羊羊,尹亚格,吴雨甍,等.基于高通量测序技术分析天津高温大曲微生物菌群多样性[J].中国酿造,2023,42(5):28-34.
[9]WU X Y, JING R, CHEN W, et al.High-throughput sequencing of the microbial diversity of roasted-sesame-like flavored Daqu with different characteristics[J].3 Biotech,2020,10(11):1-11.
[10]彭玺,冯凯,厉舒祯,等.宏基因组学技术与微生物群落多样性分析方法[J].科技导报,2022,40(3):99-111.
[11]WANG Y, XIANG F, ZHANG Z, et al.Characterization of bacterial community and flavor differences of different types of Douchi[J].Food Sci Nutr,2021,9(7):3460-3469.
[12]罗小叶,刘婉琳,郎莹,等.王茅大曲微生物菌群多样性分析[J].食品科技,2024,49(1):9-18.
[13]GE D Y, VAI W C, GUO Z, et al.Comparative analysis of microbial community structure in the peel and core of Houhuo low-temperature Daqu[J].Food Biosci,2024,58(4):103596.
[14]杨晨,杨栩松,郭壮,等.茅台镇某酒厂高温大曲微生物多样性与感官品质关联性分析[J].中国酿造,2023,42(11):48-53.
[15]HE G,HUANG J,WU C,et al.Bioturbation effect of fortified Daqu on microbial community and flavor metabolite in Chinese strong-flavor liquor brewing microecosystem[J].Food Res Int,2020,129(3):108851.
[16]HE G,HUANG J,ZHOU R,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10(1):56.
[17]ZHANG J, LIU S P, SUN H L.Metagenomics-based insights into the microbial community profiling and flavor development potentiality of Baijiu Daqu and Huangjiu wheat Qu[J].Food Res Int, 2022, 152(2):110707.
[18]SHI W,CHAIL J,FANG G Y,et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Res Int,2022,156(6):111298.
[19]侯强川,王文航,徐媛媛,等.徐坊中高温大曲发酵过程中理化品质、风味及真菌群落结构变化规律研究[J].食品工业科技,2024,45(19):133-141.
[20]毛文定,冯文聪,孙威,等.不同香型白酒酿造大曲微生物群落与理化指标关联分析[J].中国酿造,2024,43(7):147-153.
[21]范恩帝,李岭卓,吴成,等.酱香大曲真菌多样性在不同制曲条件下的差异[J].食品科技,2023,48(5):26-33.
[22]DENG L,MAO X,LIU D,et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Front Microbiol,2020,11(11):588117.
[23]张瀚之,席德州,王欢,等.酱香型白酒机械化酿造不同轮次堆积发酵酒醅真菌群落结构多样性研究[J].中国酿造,2021,40(12):64-69.
[24]李静心,王艳丽,何宏魁,等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业,2018,44(12):52-59.
[25]周平,罗惠波,黄丹,等.中高温大曲中一株耐热地衣芽孢杆菌耐受性及产酶特性的初步研究[J].食品科技,2016,41(11):14-20.
[26]王乃军,马美荣.扣囊复膜酵母在白酒生产中的应用研究进展[J].酿酒科技,2023(3):115-119.
[27]ALI A,WU Y,LI W,et al.Insight into microorganisms and flavor substances in traditional Chinese fermented food starter: Daqu[J].Process Biochem,2024,146(9):433-450.
[28]YU Q,MOU F,XIAO J,et al.Correlational analysis of physicochemical indexes,microbial communities,and volatile components in light-flavor Daqu from north and south regions of China[J].World J Microb Biot,2024,40(2):54.
[29]徐锦,冯文聪,朱澳迪,等.不同香型大曲微生态结构及其发酵特性相关性分析[J].食品科学,2024,45(13):104-114.
[30]沈毅,陈波,张亚东,等.影响高温大曲质量的关键控制点[J].酿酒科技,2019(8):17-21.