陶泥窖池发酵是陶融型白酒生产的核心特征,也是其区别于其他香型白酒的关键工艺[1]。窖泥质量是决定白酒品质的核心因素之一。 窖泥由特殊土壤、麸曲粉、黄水、己酸菌液及酒尾等混合而成,富含细菌、古菌和真菌,作为微生物生长繁殖的载体,在固态发酵白酒风味物质合成中起关键作用[2-3]。窖泥中微生物的种类、相对丰度、群落结构及代谢活性所调控的微生态平衡,直接影响白酒的品质与风味[4-5]。若窖泥质量不佳,关键产香微生物的代谢活动将受到抑制,导致风味物质合成不足。 已有研究表明,窖泥中栖息着复杂且稳定的厌氧微生物群落,主要包括梭菌属(Clostridium)[6]、产己酸菌属(Caproiciproducens)[7]、乳酸杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、甲烷菌属(Methanosarcina)[8]等。窖龄与空间位置是影响窖泥微生物群落的关键因素[9-10]。随着窖龄增长,窖泥将逐渐形成具有独特优势的微生物群落[11]。窖底泥的微生物多样性普遍高于窖壁泥。 基于窖池多维分层的研究标明,窖池不同空间位置产出的白酒品质存在差异[12]。
酒醅是白酒固态发酵过程中的核心基质,是由蒸煮后的谷物(如高粱、大米等)与大曲粉混合后形成的发酵物料[15-16],其分层结构与窖池微环境相互作用,成为微生物代谢和风味物质生成的主要载体。 酒醅中的微生物来源多样,包括大曲、窖泥、生产工具及环境中的菌群。酒醅在发酵过程中分为不同的层次,不同层次的理化条件(如温度、湿度、氧气含量)差异显著,导致微生物群落分布和代谢产物的空间异质性[17]。 如下层酒醅因更贴近窖泥,接触窖泥微生物更充分,代谢活动更为活跃,常积累更多酯类物质(如己酸乙酯)[18]。酒醅的理化性质(如酸度、淀粉含量、还原糖浓度)和微生物群落动态变化直接影响白酒的风味特征与品质稳定性[19]。
目前陶融型白酒窖池中微生物群落结构的时空差异和代谢机制还不明确,为了探究不同窖龄窖池对陶融型白酒风味的影响机制,本研究利用多组学研究技术,结合生物信息学分析技术,以新老窖上部和下部的窖泥、酒醅及其蒸馏出来的基酒为研究对象,对其微生物组和代谢物组进行测定并进行相关性分析。 解析陶融型白酒新老窖池内微生物群落空间分布的差异性及其对白酒风味的影响机制,以期对陶融型白酒生产应用和品质提升起指导作用。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
窖泥(4年(新窖泥)和31年(老窖泥)窖龄窖池各3口)、酒醅、基酒(酒精度为62%vol):均取自陶融香型白酒酿造车间。
1.1.2 化学试剂
氯化钠、氢氧化钠、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)、硫酸铜、无水硫酸钠(均为分析纯):北京索莱宝科技有限公司;C7~C40烷烃校准标准液:美国Sigma-Aldrich公司;仲辛醇(色谱纯)、乙酸正戊酯标准品、4-辛醇标准品、2-乙基丁酸标准品:北京麦克林科技有限公司;二氯甲烷(纯度>99.9%):国药集团化学试剂有限公司;热稳定脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、琼脂糖、三羟甲基氨基甲烷-乙酸-乙二胺四乙酸缓冲液:美国英杰生命技术有限公司。
1.2 仪器与设备
WGL-230D电热恒温鼓风干燥箱:深圳市奥宁设备有限公司;PHS-920型pH计:上海游目有限公司;Multiskan FC酶标仪、NC2000 Nanodrop超微量分光光度计、iBright CL1500凝胶成像仪:美国赛默飞世尔公司;Y5002电子天平:天津德安特公司;DB-WAX气相色谱柱(60 m×250 μm×0.25 μm)、8890-7000D型气质联用仪:美国Agilent公司;2720聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;041BR133330琼脂糖凝胶电泳仪:美国Bio-Rad公司;Novaseq PE250高通量测序平台;美国Illumina公司;MX-2800涡旋混合器:德国IKA公司。
1.3 方法
1.3.1 样品采集
窖泥样品:上层窖泥样品取自距窖池表面1 m的窖池壁,下层样品取自距窖池底部1 m的窖池壁,采用五点取样法用定制取样器取样,取样前对取样器进行消毒处理,取样结束后将同一窖池所的样品均匀混合后放入无菌袋做好标记置于-20 ℃条件下保藏备用[1]。用nu表示新窖上层,ou表示老窖上层,nb表示新窖下层,ob表示老窖下层。
酒醅样品:取自与窖泥取样对应位置同一水平位置,采用五点取样法,混合均匀后放入无菌袋内-20 ℃保存。
基酒样品:为新、老窖池相对应的基酒。
1.3.2 理化指标测定
水分:采用恒温干燥法测定;淀粉含量:参考GB5009.9—2016《食品中淀粉的测定》中的酸水解法测定;还原糖含量:参考GB 5009.7—2016《食品中还原糖的测定》中DNS法测定;pH值:采用pH计测定;可滴定酸:采用酸碱中和法测定。
1.3.3 微生物基因组提取及高通量测序
对窖泥和酒醅样品中的总DNA进行提取,对提取后所得的DNA采用1%的琼脂糖凝胶电泳进行质检,检测合格后委托广东美格基因科技有限公司完成建库及Illumina MiSeq双端测序。 其中细菌16S rRNA引物为338F(ACTCCTACGGGAGGCAGCA)和806R(GGACTACHVGGGTWTCTAAT);真菌ITS引物为3-F(GCATCGATGAAGAACGCAGC)和ITS4-R(TCCTCCGCTTATTGATATGC)。PCR扩增体系为50μL,其中包括25μLTaq酶,前端引物(10μmol/L)2 μL,后端引物(10 μmol/L)2 μL,50 ng DNA样品,再用ddH2O补全反应体系。扩增条件如下:真菌PCR扩增条件为:95 ℃条件下预变性3 min,95 ℃变性20 s,56 ℃退火20 s,72 ℃延伸30 s,共进行34个循环,然后在72 ℃保持5 min;细菌PCR扩增条件为:95 ℃条件下预变性3 min,95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s,共进行31个循环,然后在72 ℃保持5 min。
1.3.4 挥发性风味物质的测定
对基酒样品进行液-液微萃取(liquid-liquid microextraction,LLME)前处理,酒醅样品采用顶空固相微萃取(solid-phase microextraction,SPME)前处理,具体参考文献[20]的方法。
用配有DB-WAX(60 m×250 μm×0.25 μm)色谱柱的气相色谱与四极杆-飞行时间质谱(gas chromatography quadrupole-time of flight mass spectrometry,GC-Q-TOF-MS)分离和检测酒醅和基酒样品中的挥发性风味物质。 载气使用高纯氦气(He),恒流模式,柱流速为1 mL/min,升温程序:初始温度为40 ℃,以10 ℃/min的速度升至50 ℃,保持5 min;再以3 ℃/min速度升至80 ℃,保持5 min;再以5 ℃/min的速度升至230℃,保持10min。 进样口和检测器温度250℃。进样量1 μL,不分流进样。 在电子轰击离子(electron impactionization,EI)源下记录质谱,电子能量70 eV。离子源和四级杆温度分别为230 ℃和150 ℃。 质谱扫描范围为35~350 m/z。
所得香气物质采用美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)2.0谱库检索进行初步定性;将样品和C7~C40的正构烷烃标准品在相同的气相色谱-质谱条件下分析,根据待测物质的保留时间,计算保留指数(retention index,RI)值以对各化合物进行定性分析[21]。鉴定得到的挥发性化合物通过内标化合物质量浓度(仲辛醇520 μg/L)进行定量分析得到基酒中挥发性化合物的含量。
1.3.5 数据处理与统计分析
通过QIIME v1.9.1和R Studio两个软件对原始测序数据进行处理,基于美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库对细菌扩增子序列变体(amplicon sequence variant,ASV)序列进行注释,同时利用UNITE真菌ITS数据库对真菌ASV序列进行注释。用SIMCA 14.1软件进行挥发性代谢物的偏最小二乘法-判别分析(partial least squares-discriminant analysis,PLS-DA)。 基于Bray-Curtis距离算法的挥发性化合物差异分析,用R Studio的vegan包进行主坐标分析(principal coordinates analysis,PCoA);用非参数Kruskal-Wallis秩和检验、Wilcoxon秩和检验以及线性判别分析(linear discriminant analysis,LDA)进行线性判别分析效应大小(LDA effect size,LEfSe)分析。用pheatmap包进行热图的绘制;用Hmisc、dplyr和igraph包对窖泥和酒醅的微生物与基酒中的挥发性风味物质进行Spearman相关性分析以及网络分析,用Gephi软件进行绘图。
2 结果与分析
2.1 新老窖酒醅理化性质差异分析
对不同窖龄酒醅的理化指标进行了测定并进行显著性差异分析,结果见图1。
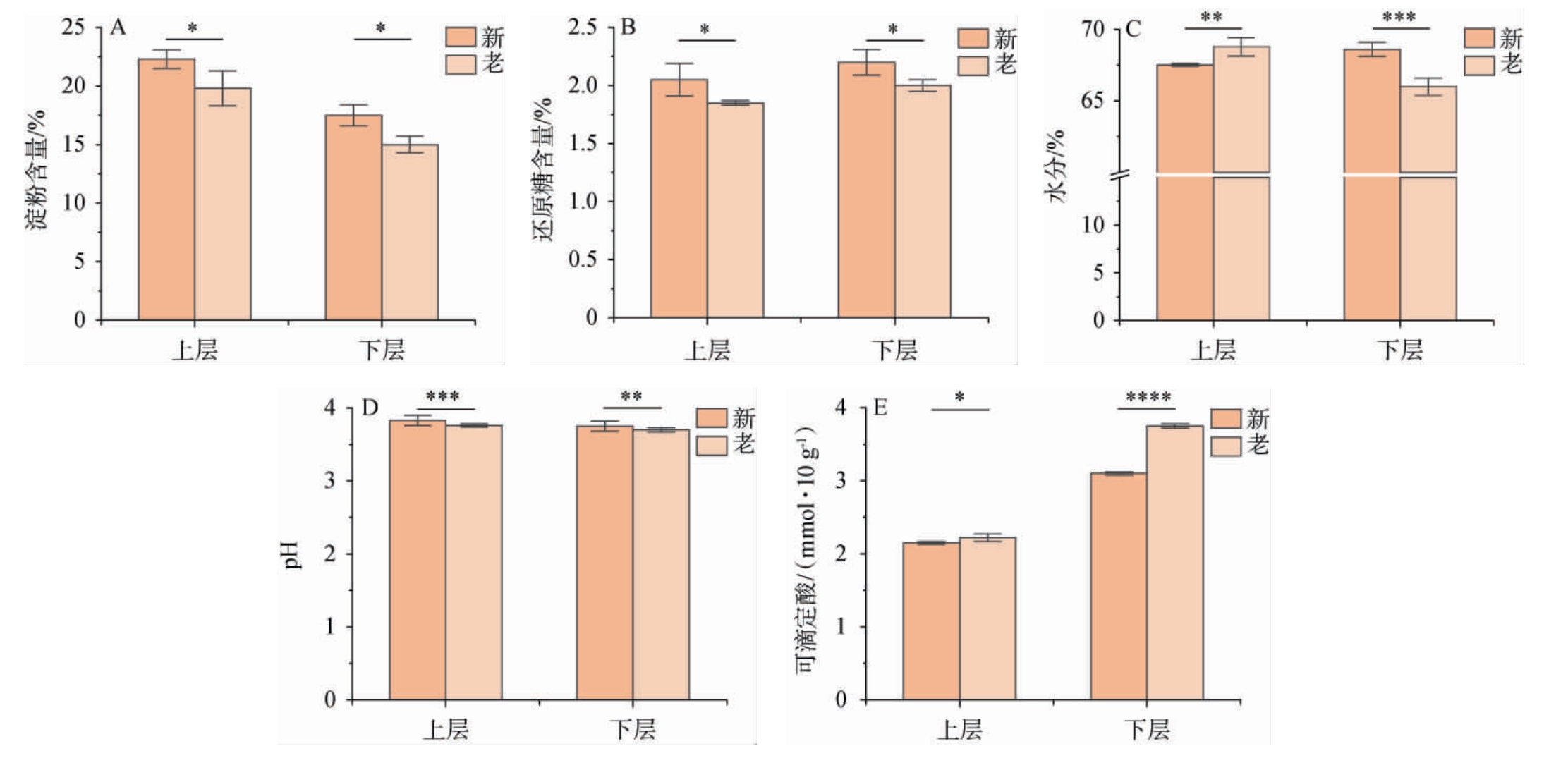
图1 不同位置、不同窖龄酒醅理化参数
Fig.1 Physicochemical parameters of fermented grains at different positions and with different pit ages
“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01),“***”表示差异非常显著(P<0.001),“****”表示差异高度显著(P<0.000 1)。
由图1A和图1B可知,从整体上来说,窖池下层酒醅的淀粉含量稍低于上层,而还原糖的含量则相反。 淀粉与还原糖的动态变化反映了发酵进程及微生物活性。老窖酒醅的淀粉和还原糖含量均显著低于新窖(P<0.05),说明老窖微生物对淀粉的降解更为彻底,与其长期驯化的功能微生物(如梭菌属、芽孢杆菌属)具有更强的淀粉酶活性有关。同时,老窖稳定的厌氧环境有利于淀粉的持续水解,因此淀粉残留量较少。 而新窖微生物群落结构不稳定,淀粉酶系尚未完全建立,导致淀粉降解不彻底。此外,新窖酒醅中较高的残余还原糖可能与其微生物群落功能不完善,糖化与发酵过程不同步,出现“糖积累”现象有关[19]。
在浓香型白酒酿造过程中,水分含量是影响发酵效率的关键因素之一[22]。适宜的水分含量能够有效调控窖内温度环境,并抑制发酵酒醅的酸性物质积累,进而对酒醅发酵质量产生显著影响。由图1C可知,新、老窖酒醅水分含量存在极显著或非常显著差异(上层酒醅P<0.01,下层酒醅P<0.001),老窖下层酒醅水分含量较低。分析造成差异的可能原因是由于老窖中微生物群落的代谢调控作用,如梭菌属、乳酸菌的长期定植,能够促进有机酸和酯类合成,这个过程中可以消耗部分水分。而新窖窖泥由于未充分活化,窖泥微生物群落未完全建立,吸水性和代谢活性较弱,导致酒醅游离水滞留[19]。
酸度是评估酒醅发酵状态的重要指标,适宜的酸度可抑制杂菌生长,促进有益菌的生长,并为酯类合成提供前体物质[23]。由图1D可知,老窖上层酒醅pH值非常显著低于新窖(P<0.001),老窖下层酒醅pH值极显著低于新窖(P<0.01),这与其长期积累的乳酸菌、己酸菌等产酸微生物群落密切相关。由图1E可知,老窖中积累了更多的有机酸,尤其是在下层酒醅中,可滴定酸的含量高度显著高于新窖(P<0.000 1),老窖上层酒醅中可滴定酸含量显著高于新窖(P<0.05)。
综上,窖池上层和下层的酒醅理化特性有一定差异,尤其是淀粉的降解和可滴定酸的积累,下层酒醅的指标显示了更丰富的微生物代谢活动。老窖酒醅表现出了更优的理化特性,包括较低的水分含量、更高的酸度及更彻底的淀粉降解,这些特征与其成熟的窖泥微生物群落及稳定的发酵微环境密切相关。而新窖酒醅的理化指标波动较大,可能与其窖泥微生物群落尚未完全建立及工艺适应性不足有关。
2.2 新老窖窖泥细菌和真菌的群落结构时空分布差异分析
为探究不同窖龄窖泥微生物群落结构的差异性,采用高通量扩增子测序分析对新老窖窖泥微生物群落进行分析,微生物群落结构PCoA分析结果见图2。
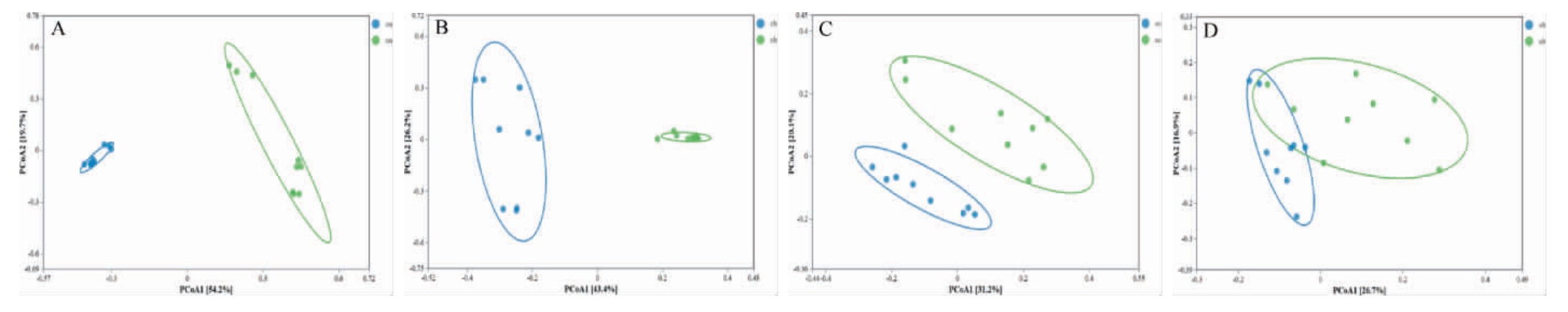
图2 不同位置、不同窖龄窖泥细菌(A,B)和真菌(C,D)群落的主坐标分析
Fig.2 Principal coordinate analysis of bacterial (A,B) and fungal (C,D) communities in pit mud at different locations and ages
由图2A和图2B可知,主坐标1和主坐标2累计方差贡献率为43.6%~73.9%,新窖池和老窖池的上层窖泥和下层窖泥细菌群落存在显著差异,能通过PCoA将其进行区分;由图2C和图2D真菌群落组间差异分析结果显示,新老窖池上层窖泥的真菌群落结构差异明显,能通过PCoA将其进行区分;下层窖泥真菌群落结构差异分析的结果显示有明显重叠区域,意味着两组样本在主成分空间中部分特征重叠,组间差异较小。
LEfSe分析是通过线性判别分析(LDA)计算不同组间微生物类群的差异效应量(LDA Score),筛选出对组间差异贡献显著的生物标志物,可以用于识别不同组别中具有显著差异的微生物类群[24]。对高通量扩增子测序结果进行分析并对窖泥微生物进一步进行LEfSe分析,取LDA阈值>4,讨论新、老窖微生物群落的差异。不同位置不同窖龄的窖泥中细菌和真菌的群落结构组成见图3。
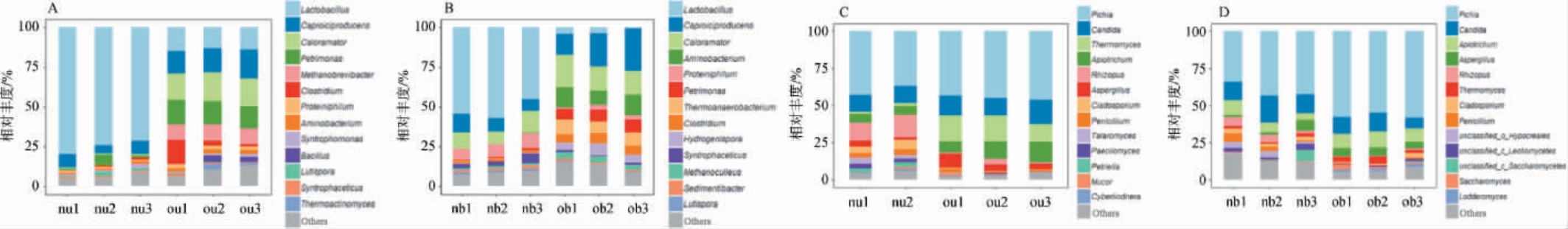
图3 新老窖池窖泥的细菌(A,B)及真菌(C,D)的属水平群落结构
Fig.3 Community structure of bacteria (A, B) and fungi (C, D) in the pit mud of new and old pits at the genus level
由图3A和图3B可知,老窖池窖泥(ou,ob)的细菌群落丰富度高于新窖池(nu,nb),在新窖池中,乳酸菌属(Lactobacillus)为绝对优势菌,占整个群落结构相对丰度的50%以上。 而老窖池中以乳酸杆菌属(Lactobacillus),产己酸菌属(Caproiciproducens),喜热菌属(Caloramator)等多菌属为主。 研究表明,产己酸菌属(Caproiciproducens)广泛分布于高温厌氧环境和发酵系统中,能够将果糖等底物转化为乳酸、乙酸、丁酸、己酸、氢气和二氧化碳,是正常窖池窖泥中的优势菌属之一[25]。 由图3C和图3D可知,毕赤酵母属(Pichia)为新老窖池上下层窖泥中的绝对优势菌,相对丰度为30%~55%,整体看窖池上层的真菌群落结构丰富度要高于下层。 上述差异表明,老窖通过长期发酵已建立稳定的功能菌群体系,特别是下层富集的产己酸菌群为风味物质合成提供了基础,而新窖菌群仍处于演替阶段。
进一步对新老窖池微生物组成差异LEfSe分析,结果见图4。LDA得分越高,代表该微生物类群在分组间的差异越显著,图中列出的是从门、纲、目、科到属等不同分类层级的微生物。由图4A和图4B可知,造成新老窖池上层酒醅细菌群落结构差异的主要菌属为乳酸菌属(Lactobacillus),下层的主要为乳酸杆菌属(Lactobacillus)和氨基酸杆菌属(Aminobacterium)等;由图4C和图4D可知,对新老窖池上层酒醅中微生物群落结构差异贡献最大的真菌属为嗜热真菌属(Themomyces)和根霉菌属(Rhizopus),下层的主要真菌属为毕赤酵母属(Pichia)、根霉菌属(Rhizopus)。
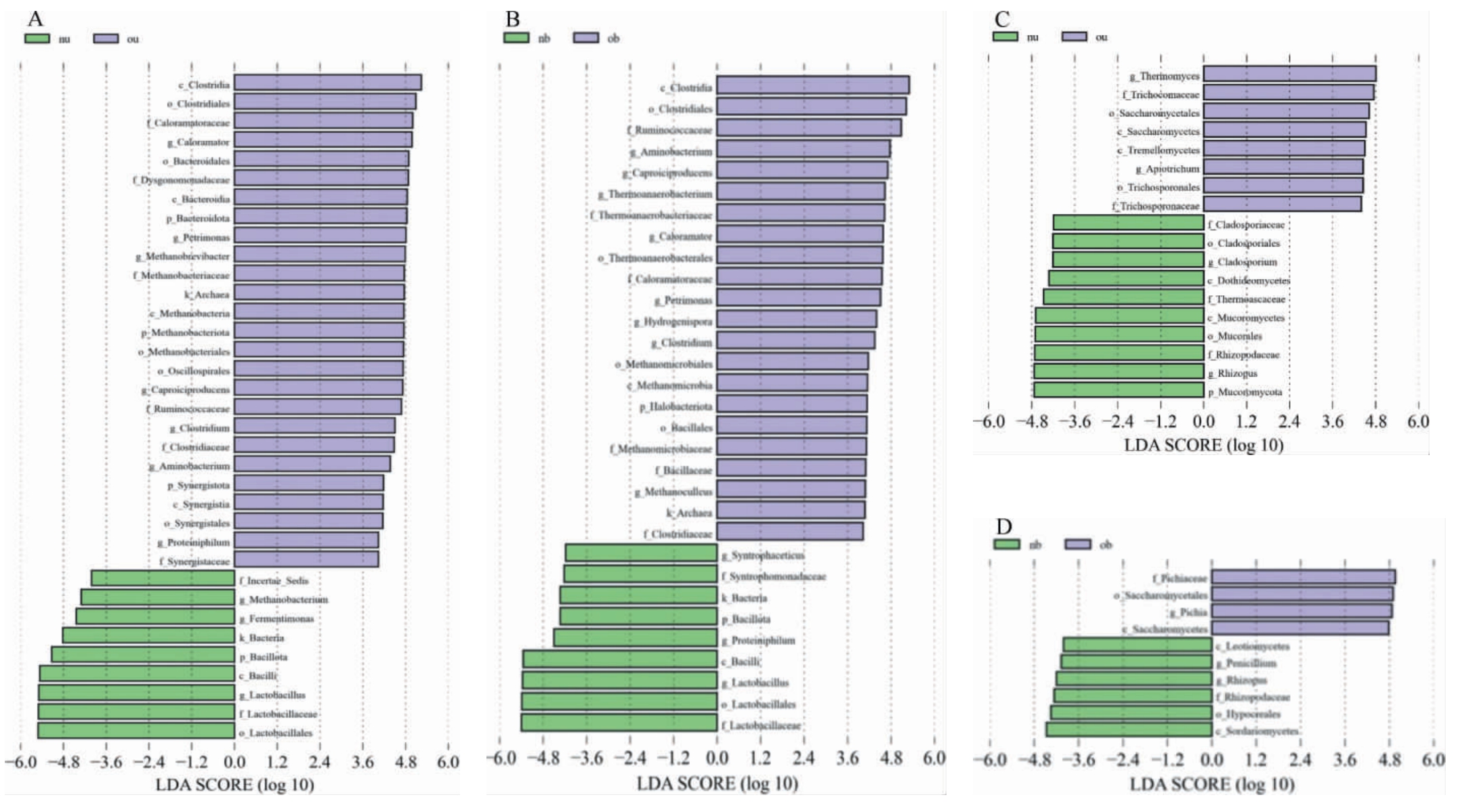
图4 新老窖池窖泥的细菌(A,B)及真菌(C,D)的微生物群落组成差异线性判别分析效应大小分析
Fig.4 Linear discriminant analysis effect size of differences of microbiol community composition of bacteria (A, B) and fungi (C, D) in the pit mud of new and old pits
2.3 新老窖酒醅和基酒主要挥发性风味物质差异
2.3.1 酒醅挥发性风味物质的测定
对不同位置、不同窖龄酒醅样品挥发性风味物质进行测定,结果见图5。由图5A可知,新老窖上层酒醅中共鉴定出63种挥发性风味物质,其中包括33种酯类,15种醇类,9种酸类,2种醛类,4种酚类;由图5B可知,新老窖下层酒醅中共鉴定出75种挥发性风味物质,其中包括46种酯类,11种醇类,12种酸类,1种醛类,1种醚类,4种酚类。其中,己酸乙酯、乳酸乙酯、乙酸乙酯、丁酸乙酯、丁酸、己酸、乙酸、戊酸、丁醇、戊醇、己醇以及4-甲基愈创木酚等为陶融香型白酒的主要挥发性风味物质。整体来说,不管是上层还是下层,老窖酒醅中检测的挥发性风味物质含量要高于新窖;而对于空间位置来说,下层酒醅检出的挥发性风味物质种类更多。

图5 新老窖池上层(A)及下层(B)酒醅样品的挥发性风味化合物含量热图
Fig.5 Heat map of volatile flavor compounds contents of fermented grains samples in upper (A) and lower (B) layer of new and old pits
为了进一步比较新老窖酒醅的挥发性化合物的结构特征,对新老窖酒醅测得的挥发性化合物进行了PCA分析,并以共有挥发性化合物为因变量,窖池的窖龄为自变量,进行了PLS-DA分析,从新老窖酒醅中筛选出VIP>1.0,P<0.05的差异挥发性化合物,结果见图6A。
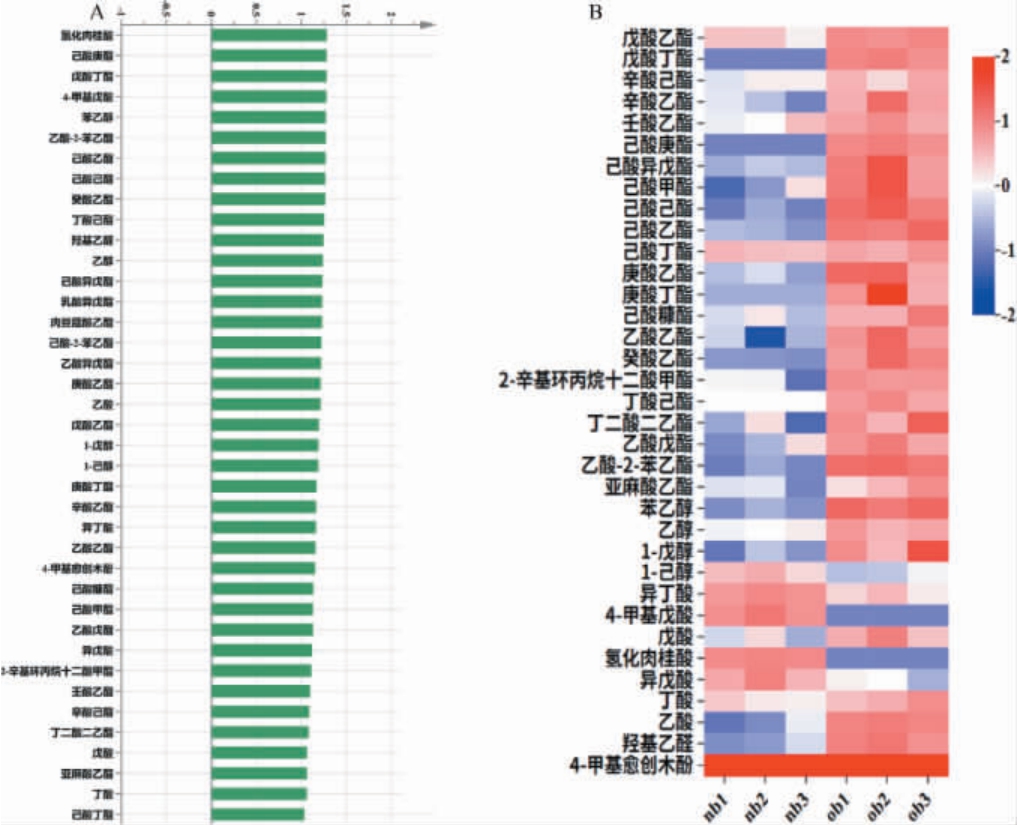
图6 基于偏最小二乘法判别分析新老窖酒醅中的差异挥发性化合物(A)及下层酒醅中差异挥发性化合物含量热图(B)
Fig.6 Differential volatile compounds in the fermented grains of new and old pit based on partial least squares discriminant analysis (A) and heat map of differential volatile flavor compounds contents in the lower fermented grains (B)
由图6A可知,上下层共筛选出差异性化合物39种,其中上层酒醅中筛选出30种差异挥发性化合物,下层酒醅中共筛选出35种差异挥发性化合物,下层酒醅样品检测出的风味物质种类更多,对酒体风味的贡献更大,因此重点分析下层酒醅的数据,对下层酒醅的差异挥发性化合物含量热图分析结果见图6B。由图6B可知,大部分差异挥发性化合物在老窖中含量均高于新窖,新窖酒醅中挥发性酸类物质含量高于老窖。
2.3.2 基酒挥发性风味物质的测定
对基酒样品进行液-液微萃取(LLME)前处理,经GCQ-TOF-MS结合内标定量分析得到基酒主要挥发性化合物的含量,绘制挥发性风味化合物含量热图,结果见图7。
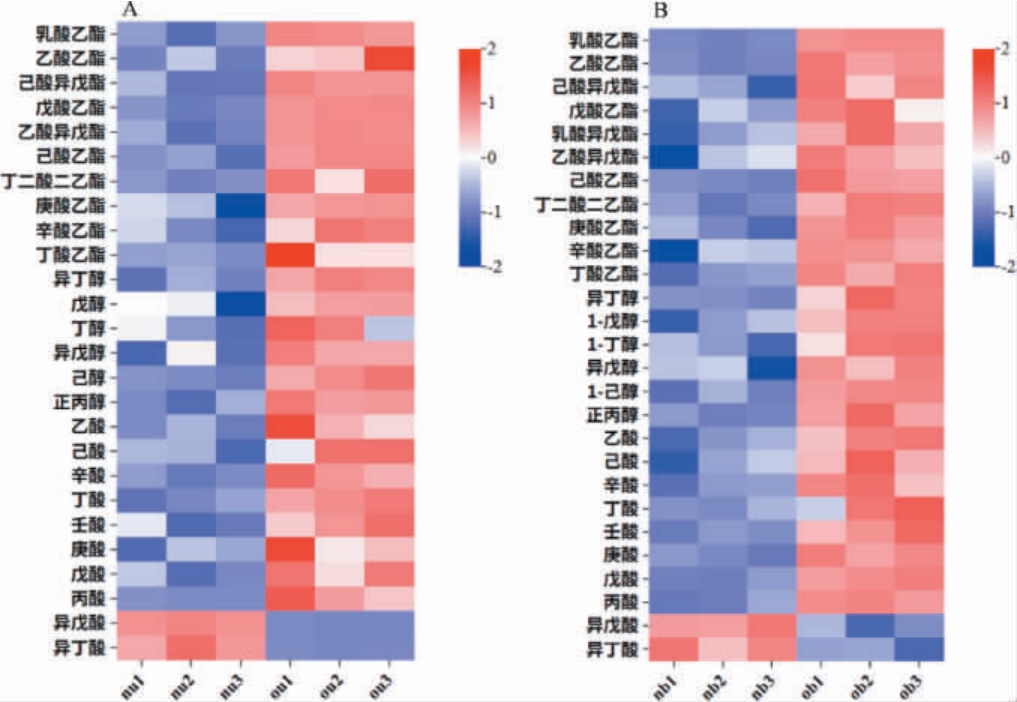
图7 新老窖池基酒样品主要挥发性风味化合物含量热图
Fig.7 Heat map of main volatile flavor compounds contents in base liquor samples from new pits and old pits
由图7可知,酯类、醇类、酸类为新老窖基酒中主要挥发性风味物质,新窖池基酒检出26种挥发性风味物质,老窖池基酒检出27种挥发性风味物质,包括乳酸乙酯、乙酸乙酯、己酸异戊酯、戊酸乙酯、乙酸异戊酯、己酸乙酯、丁二酸二乙酯、庚酸乙酯、辛酸乙酯、丁酸乙酯、乳酸异戊酯共11种酯类,丁醇、戊醇、己醇、丙醇、异丁醇、异戊醇在内的6种醇类以及乙酸、己酸、辛酸、丁酸、壬酸、庚酸、戊酸、丙酸、异戊酸、异丁酸在内的10种酸类。老窖所得基酒中酯类、醇类除异戊酸、异丁酸以外的绝大部分会挥发性酸类物质和的含量显著高于新窖,而新窖所得基酒中、异丁酸和异戊酸的含量高于老窖。该结果与酒醅中挥发性化合物的结果一致。
2.4 新老窖窖泥微生物组和风味物组相关性分析结果
将LEfSe分析得到的窖泥差异微生物(图4中展示的属水平差异微生物)与基酒主要挥发性化合物(图7中展示的主要挥发性代谢物)进Spearman相关性分析,选择系数(|r|)>0.7和显著性P<0.05的强相关节点,构建相关性网络,结果见图8。
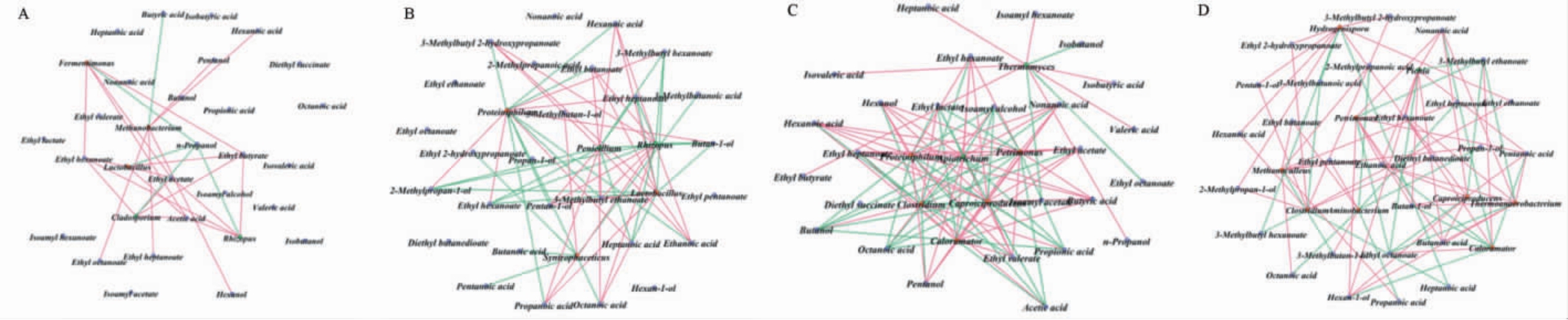
图8 新老窖泥差异细菌属和真菌属与基酒主要挥发性风味物质相关性分析
Fig.8 Correlation analysis between differential bacterial and fungal genera in new and old pit mud and main volatile flavor compounds in base liquor
A:新窖上层,B:新窖下层;C老窖上层;D:老窖下层。
紫色点代表风味化合物,橙色点代表细菌,绿色点代表真菌,正相关关系用粉色线条表示,负相关关系用绿色线条表示。
由图8可知,老窖窖泥中的微生物群落与基酒中主要风味化合物的相关性关系对更强,与之相反,新窖窖泥中含有更弱的相关性关系。另外,细菌群落与基酒中挥发性风味化合物大多呈现正相关,真菌群落与基酒中主要挥发性风味化合物大多呈负相关。由图8A可知,对于新窖上层窖泥与基酒之间,乙酸乙酯、己酸乙酯、丁酸乙酯、己醇、乙酸与根霉菌属(Rhizopus)和枝孢菌属(Cladosporium)呈正相关,正丙醇与乳酸杆菌属(Lactobacillus),发酵单胞菌属(Fermentimonas),根霉菌属(Rhizopus)和枝孢菌属(Cladosporium)均呈负相关,丁酸与甲烷杆菌属(Methanobacterium)呈负相关。由图8B可知,对于新窖下层窖泥与基酒之间,根霉菌属(Rhizopus)和青霉属(Penicillium)两个真菌属与己酸、丁酸、辛酸等酸类物质呈正相关,互营单胞菌属(Syntrophaceticus)、乳酸杆菌属(Lactobacillus)以及Proteiniphilum与己酸乙酯、庚酸乙酯等酯类以及辛酸、乙酸、戊酸等呈负相关。由图8C可知,对于老窖上层窖泥与基酒之间,嗜热真菌属(Thermomyces)与异丁醇、乙基辛酸酯等物质呈负相关,与庚酸、丁酸、异丁酸、异戊酸等呈正相关。产己酸菌属(Caproiciproducens)与己酸、己酸乙酯等呈正相关,梭菌属(Clostridium)与己酸、丁酸等主要酸以及己酸乙酯、丁酸乙酯、乙酸乙酯呈正相关,而与戊醇、己醇等醇类呈负相关。 由图8D可知,对于老窖下层窖泥与基酒之间,产己酸菌属(Caproiciproducens)、热厌氧杆菌属(Thermoanaerobacterium)和毕赤酵母菌属(Pichia)与乙酸、戊酸、壬酸等多种有机酸呈正相关,梭菌属(Clostridium)与己酸、乙酸乙酯等主要风味物质呈正相关。
上述结果说明窖泥中的细菌群落与基酒中挥发性风味化合物大多呈现正相关,真菌群落与基酒中挥发性风味化合物大多呈现负相关。 对于窖泥中的主要功能菌属(Caproiciproducens、Caloramator、Clostridium等)与酸类及大多数酯类物质都呈均正相关关系,对白酒风味特征的形成有重要的作用。
3 结论
本研究以新老窖池窖泥、酒醅以及所得基酒为研究对象,分析讨论了新老窖窖泥、酒醅微生物与酒醅、基酒挥发性风味化合物之间的差异,并分析了酒醅和基酒差异与窖泥微生物差异之间的关系。结果显示,老窖中酒醅表现出了更优的理化特性,包括较低的水分含量、更高的酸度及更彻底的淀粉降解。 新老窖窖泥微生物群落组成差异明显,老窖通过长期发酵已建立稳定的功能菌群体系。产己酸菌属(Caproiciproducens),Petrimonas和嗜热菌属(Caloramator)等厌氧功能菌占比较高,为风味物质合成提供了基础;而新窖菌群以乳酸杆菌属占优势地位,新窖窖泥的微生物群落仍处于演替阶段。新老窖酒醅的风味轮廓具有显著差异,老窖酒醅的大部分挥发性风味物质的含量更高,新窖酒醅含有更多的支链脂肪酸,而老窖酒醅含有更多的直链脂肪酸。窖泥细菌群落与基酒中挥发性风味化合物大多呈现正相关,真菌群落与基酒中主要挥发性风味化合物大多呈负相关。窖泥中的主要功能菌属(Caproiciproducens,Caloramator,Clostridium等)与酸类及大多数酯类物质都呈现正相关关系,但这些微生物与醇类物质则呈现负相关关系。本研究从一定程度上深化了对陶融型白酒生产过程中微生物组和代谢物组的认识,对窖池的养护和促进风味物质的正向累积有一定的指导意义。
[1]黄润娜,侯建光,崔璐芸,等.陶融型白酒正常和退化窖泥细菌群落多样性解析及其理化影响因素[J].中国酿造,2022,41(8):25-31.
[2]魏云.优质人工窖泥的培养及其在应用中质量变化趋势[J].酿酒,2021,48(4):68-70.
[3]张文学,高占争,吴正云.浓香型白酒窖泥微生物群落研究进展[J].中国酿造,2020,39(6):1-7.
[4]倪兴婷,孙细珍,刘怀臣,等.基于理化、风味物质和化学计量学的窖泥质量分级方法[J].食品与发酵工业,2024,50(20):335-340.
[5]HOU Q, WANG Y, NI H, et al.Deep sequencing reveals changes in prokaryotic taxonomy and functional diversity of pit muds in different distilleries of China[J].Ann Microbiol,2022,72(1):1-14.
[6]ZOU W,YE G,ZHANG K.Diversity,function,and application of Clostridium in Chinese strong flavor Baijiu ecosystem:A review[J].J Food Sci,2018,83(5):1193-1199.
[7]JIN X,WANG H,TIAN H X,et al.Caproiciproducens converts lactic acid into caproic acid during Chinese strong-flavor Baijiu brewing[J].Int J Food Microbiol,2025,426:110931.
[8]柴丽娟,钱玮,钟小忠,等.浓香型白酒发酵过程中窖内古菌群落分布特征[J].生物工程学报,2020,36(12):2635-2643.
[9]张会敏,王艳丽,孟雅静,等.浓香型白酒新、老窖池池壁泥与池底泥原核菌群结构分析[J].食品科学,2020,41(18):180-187.
[10]ZHANG H M,MENG Y J,WANG Y L,et al.Prokaryotic communities in multidimensional bottom-pit-mud from old and young pits used for the production of Chinese strong-flavor Baijiu[J].Food Chem,2020,312:126084.
[11]GONG Y,TANG H,MA N.Analysis of microbial community diversity and physicochemical factors in pit mud of different ages based on highthroughput sequencing[J].Can J Microbiol,2022,68(11):674-686.
[12]WANG X J, ZHU H M, REN Z Q, et al.Characterization of microbial diversity and community structure in fermentation pit mud of different ages for production of strong-aroma Baijiu[J].Pol J Microbiol,2020,69(6869):1-14.
[13]LI K,ZHANG Q,ZHONG X T,et al.Microbial diversity and succession in the Chinese Luzhou-flavor liquor fermenting cover lees as evaluated by SSU rRNA profiles[J].Ind J Microbiol,2013,53(4):425-431.
[14]XIANG W L,LI K,LIU S,et al.Microbial succession in the traditional Chinese Luzhou-flavor liquor fermentation process as evaluated by SSU rRNA profiles[J].World J Microb Biot,2013,29(3):559-567.
[15]王阳,李德林,贾俊杰,等.不同比表面积窖池出窖糟醅微生物群落与其基酒品质相关性分析[J].中国酿造,2025,44(2):56-64.
[16]敖灵,梅军兰,郎召伟,等.泸型酒酿造过程中各层酒醅挥发性物质变化规律[J].中国酿造,2022,41(5):28-33.
[17]田瑞杰,张勇,冯大鸿,等.基于宏转录组学的浓香型白酒酒醅活性微生物群落空间异质性研究[J].轻工学报,2022,37(1):1-11.
[18]王轩,张鲲,秦辉,等.浓香型白酒窖内不同空间位置原酒风味物质初步分析[J].中国酿造,2023,42(11):67-72.
[19]曾波,饶家权,邹永芳,等.浓香型白酒酒醅发酵过程中微生物群落结构演替及其与理化指标相关性[J].食品科学,2024,45(7):111-118.
[20]郑杨.芝麻香型白酒关键香气成分研究[D].广州:华南理工大学,2017.
[21]程伟,郭乐乐,陈雪峰,等.基于感官品评和挥发性组分差异解析复合香型白酒的品质特征[J].食品安全质量检测学报,2024,15(24):200-210.
[22]常勇勇,林一心,尉军强,等.浓香型白酒糟醅质构及微生物菌群研究进展[J].中国酿造,2024,43(10):6-12.
[23]周晓阳,姚毅,贾金玲,等.基于信息融合的浓香型白酒发酵入窖条件研究[J].四川理工学院学报(自然科学版),2017,30(6):61-65.
[24]KHLEBORODOVA A, TUZ G D S, RAMOS M, et al.Lefser: Implementation of metagenomic biomarker discovery tool, LEfSe, in R[J].Bioinformatics (Oxford, England),2024,40(12):btae707.
[25]WANG H L,GU Y,ZHOU W C, et al.Adaptability of a caproate-producing bacterium contributes to its dominance in an anaerobic fermentation system[J].Appl Environ Microbiol,2021,87(20):AEM0120321.