黑色素(melanin)是由吲哚或酚类化合物氧化聚合而成的一类结构复杂的大分子化合物[1-2],呈黑色或褐色,具有抗氧化[3-4]、抗病毒[5]、抗菌[6]、防辐射[7]等多种生物活性[8-9]。真菌通过次生代谢可以产生黑色素,是获得黑色素的重要来源,真菌黑色素的研究已成为一个热点[10]。目前已从黑木耳[10]、烟曲霉[11]、粗毛纤孔菌[3]及桔青霉菌[12]等提取得到黑色素。黑木耳(Auricularia heimuer)作为一种重要的黑色素来源,具有重要的研究价值[13-15]。 然而,黑色素难溶于水,严重限制其在工业、食品和医药行业的应用,因此提高黑色素的水溶性有重要意义。
目前,提高黑色素的水溶性主要采用物理改性方法和化学修饰方法。物理改性方法是将黑色素分散成更小的颗粒,从而提高黑色素的水溶性[16],不会破坏黑色素的分子结构,能够保留天然黑色素的原有性能,但物理方法可能难以达到理想的水溶性提升效果[17]。化学修饰方法是通过将天然黑色素与亲水性基团结合,促进黑色素单体与水分子形成氢键,呈现溶解性增强的现象[16],但化学修饰可能会改变黑色素的天然结构,从而影响其原有的功能特性。化学修饰主要包括氨基酸修饰、氨基葡萄糖修饰、羧甲基化修饰和硫酸酯化修饰等。 其中氨基酸修饰具有成本低,操作简便,修饰效果好等优点。高莉等[18]研究发现,L-精氨酸修饰对从山杏核壳中提取的黑色素的效果最好,修饰后的黑色素水溶性明显改善,并较好地保留了黑色素的生物活性。常明昌等[19]研究发现,赖氨酸修饰后的梯棱羊肚菌黑色素溶解性和色价优于未修饰的黑色素。 然而,鲜见关于黑木耳黑色素的氨基酸修饰的研究报道。
本研究采用黑木耳发酵液中提取的黑色素,通过氨基酸修饰黑木耳黑色素制备黑木耳氨基酸黑色素,对修饰前后的黑木耳黑色素进行结构表征,并对其溶解性、稳定性和体外抗氧化活性进行分析,以期提高其溶解性及抗氧化活性,为黑木耳黑色素改性修饰提供科学依据。
1 材料与方法
1.1 材料与试剂
黑木耳1703菌株:黑龙江省科学院微生物研究所提供;黑木耳黑色素(后文简称黑色素):团队前期从黑木耳1703发酵液中提取纯化获得[20];精氨酸、甘氨酸、赖氨酸、天门冬氨酸、色氨酸、苏氨酸、组氨酸(均为分析纯):北京博奥拓科技有限公司;二甲亚砜(分析纯):天津市永大化学试剂有限公司。
1.2 仪器与设备
QuickDrop超微量分光光度计:美谷分子有限公司;NicoletSummitLITE傅里叶变换红外光谱(Fourier Transform infraredspectroscopy,FTIR)仪:赛默飞世尔科技公司;TGL-16高速冷冻离心机:四川科蜀仪器有限公司;SB-5200DT超声波清洗机:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 黑木耳氨基酸黑色素的制备
于0.010 g黑色素样品中分别添加精氨酸、甘氨酸、赖氨酸、天门冬氨酸、色氨酸、苏氨酸、组氨酸(蒸馏水配制成质量浓度5 g/L的溶液),以未添加氨基酸的黑木耳黑色素作为对照(CK)超声(30 ℃、360 W)30 min结束后冷却至室温,12 000 r/min离心5 min,取上清液测定其在波长500 nm处的吸光度值,通过吸光度值判断不同氨基酸对黑木耳黑色素的修饰效果,吸光度值越高,溶解越完全,修饰效果越好[19]。同时收集修饰后的黑色素上清液,将其在40 ℃干燥处理至质量保持恒定即获得黑木耳氨基酸黑色素 (后文简称氨基酸黑色素)。
选取修饰效果较好的3种氨基酸,进一步确定黑色素与氨基酸的质量比。参考LI S L等[21]的方法,并稍作修改,准确称取0.010 g黑色素样品于10 mL蒸馏水中,按黑色素与氨基酸的质量比为1.0∶0.5、1.0∶1.0、1.0∶1.5、1.0∶2.0、1.0∶2.5、1.0∶3.0分别加入氨基酸,将其混匀后,超声(30 ℃、360 W)30 min结束后冷却至室温,12 000 r/min离心5 min,取上清液测其在波长500 nm处的吸光度值。
1.3.2 黑木耳黑色素及氨基酸黑色素的结构表征
(1)紫外光谱分析
参考李晓敏等[22]的方法,采用QuickDrop超微量分光光度计对黑木耳黑色素及氨基酸黑色素进行全波长扫描,扫描波长为200~600 nm。
(2)傅里叶红外光谱分析
参考SHI Q W等[23]的方法,采用傅里叶变换红外光谱仪对黑色素及氨基酸黑色素进行红外光谱扫描,扫描区间为4 000~500 cm-1。
1.3.3 溶解性测定
参考李俊[24]的方法,并稍作修改。准确称取0.01 g黑色素与氨基酸黑色素,分别与10 mL的蒸馏水、无水乙醇、体积分数75%乙醇、1 mol/L NaOH、1 mol/L HCl、氯仿和二甲亚砜混合均匀, 室温静置30 min,8 000 r/min离心5 min后测定波长500nm处的吸光度值。
准确称取一定量的黑色素及氨基酸黑色素样品于10mL的蒸馏水中,混匀后,8 000 r/min离心5 min,将沉淀冷冻干燥后称质量,计算黑色素及氨基酸黑色素的溶解度[25]。其计算公式如下:
1.3.4 稳定性测定
将黑色素与氨基酸黑色素分别采用二甲亚砜、水配制成质量浓度为1 mg/mL的溶液,分别考察温度(20 ℃、40 ℃、60 ℃、80 ℃),光照(自然光、紫外、黑暗)和金属离子(Mg2+、Ca2+、Cu2+、Fe3+、Mn2+(浓度为0.01 mol/L))在不同时间下对样品稳定性的影响[23],测定波长500 nm处的吸光度值,计算黑色素和氨基酸黑色素的保存率。保存率>80%为实验条件对黑木耳黑色素影响不显著[24]。其计算公式如下:
1.3.5 抗氧化活性测定
参考姚秀鸽等[20]的方法进行1,1二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 自由基清除能力测定,黑木耳黑色素溶液(二甲亚砜溶解)及氨基酸黑色素溶液(蒸馏水溶解) 的质量浓度分别为4 g/L、2 g/L、1 g/L、0.5 g/L、0.25 g/L、0.125 g/L、0.0625 g/L,将样品与2 mL DPPH工作液混合,室温下避光反应30 min,测定波长517 nm处反应体系的吸光度值(A1);以无水乙醇代替DPPH溶液反应体系的吸光度值为A2;以溶剂代替黑色素溶液反应体系的吸光度值为A0。 维生素C(vitaminC,VC)为阳性对照,计算DPPH自由基清除率。其计算公式如下:
参考姚秀鸽等[20]的方法进行超氧阴离子自由基清除能力测定,取50 mmol/L的Tris-HCl缓冲液4.6 mL于试管加入1 mL不同浓度的黑色素溶液及氨基酸黑色素溶液,于25 ℃水浴中保温20 min,移取7 mmol/L邻苯三酚溶液0.4 mL,混匀于25 ℃恒温水浴中反应5 min,立即加入10 mmol/L的盐酸1.0 mL终止反应,以Tris-HCl缓冲液调零,测定波长318 nm处的吸光度值(A1)。体积分数75%乙醇1 mL代替样品测吸光度值为A0,蒸馏水代替邻苯三酚溶液测吸光度值为A2。VC为阳性对照,计算超氧阴离子自由基清除率。其计算公式如下:
参考隋昕怡等[26]的方法并稍作修改,进行羟基自由基清除率测定,将样品与1 mL 6 mmol/L的FeSO4,6 mmol/L的水杨酸无水乙醇溶液及3%的H2O2溶液混合摇匀,37 ℃避光反应30 min后,测定波长510 nm处反应体系的吸光度值(A1);以蒸馏水代替H2O2溶液反应体系的吸光度值为A2;以溶剂代替样品溶液反应体系的吸光度值为A0。VC为阳性对照,计算羟基自由基清除率。其计算公式如下:
参考姚秀鸽等[20]的方法进行铁离子还原力的测定,准确吸取1mL不同浓度的黑色素溶液及氨基酸黑色素溶液,与2.5 mL pH 6.6的磷酸缓冲液和1%铁氰化钾溶液混合均匀,在50 ℃水浴反应20 min后急速冷却至室温,再加入2.5 mL 10%三氯乙酸终止反应。静置10 min后吸取上清液2.5 mL,加入2.5mL去离子水和0.5 mL0.1%FeCl3溶液,混匀后室温放置10 min,测定波长700 nm的处吸光度值。VC为阳性对照。
1.3.6 数据分析
所得数据采用Graphpad Prism10.1.2软件作图,采用IBM SPSS Statistics软件进行数据分析,通过t检验,确认差异的显著性,以P<0.05表示差异显著有统计学意义。
2 结果与分析
2.1 黑木耳氨基酸黑色素的制备
不同氨基酸对黑木耳黑色素修饰效果的影响见图1。
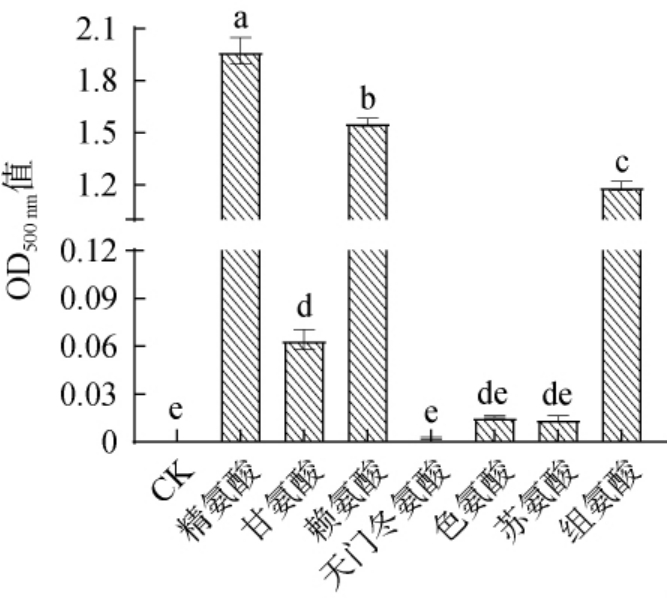
图1 不同氨基酸对黑色素修饰效果的影响
Fig.1 Effect of different amino acids on the melanin modification effect
不同字母代表差异显著(P<0.05)。下同。
由图1可知,与未添加氨基酸的黑木耳黑色素(CK)吸光度值相比,精氨酸、赖氨酸、组氨酸修饰黑木耳黑色素的吸光度值显著提高(P<0.05),其中精氨酸对黑色素的修饰效果最好,吸光度值最高,为1.970,赖氨酸和组氨酸黑色素次之,吸光度值分别为1.560、1.193。甘氨酸、天门冬氨酸、色氨酸和苏氨酸修饰的黑木耳黑色素的吸光度值较低,分别为0.064、0.002、0.016、0.0147。 XU L J等[27]研究表明,灵芝黑色素的氨基酸修饰中精氨酸修饰效果最好,赖氨酸和组氨酸次之,与本研究结果一致。刘文婷[28]研究表明,短梗霉黑色素的氨基酸修饰中赖氨酸修饰效果最好,精氨酸和组氨酸次之,与本研究结果略有差异。 但修饰效果较好的氨基酸均为精氨酸、赖氨酸和组氨酸。 因此,选取精氨酸、赖氨酸和组氨酸3种氨基酸修饰黑木耳黑色素。
黑色素与氨基酸的质量比对黑木耳黑色素修饰效果的影响见图2。由图2可知,随着氨基酸添加量的增加,精氨酸、组氨酸及赖氨酸修饰的黑木耳黑色素OD500 nm值均呈先增加后降低的趋势;当黑色素与精氨酸、组氨酸及赖氨酸的质量比分别为1.0∶2.0、1.0∶1.5、1.0∶1.5时,OD500nm值均达到最高值,分别为3.475、3.250、2.860。 因此,选择黑色素与精氨酸、组氨酸、赖氨酸质量比分别为1.0∶2.0、1.0∶1.5、1.0∶1.5制备3种氨基酸黑色素。
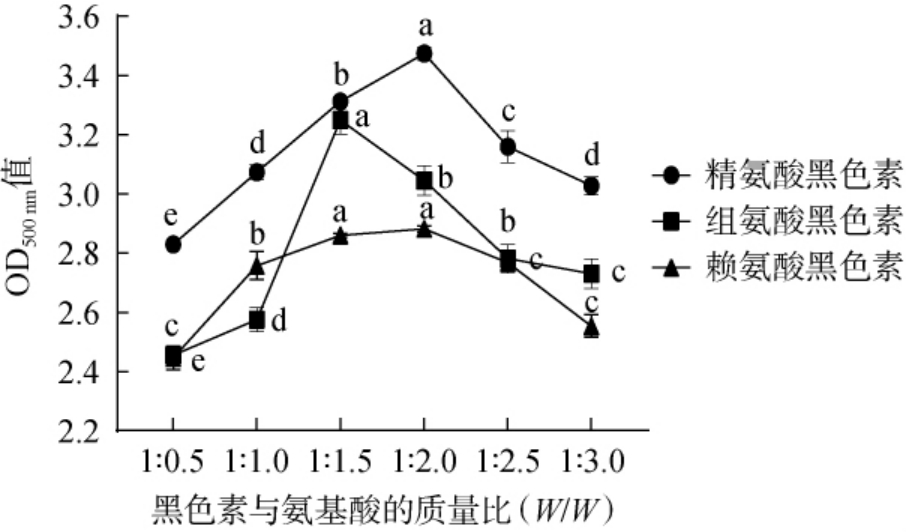
图2 黑色素与氨基酸的质量比对黑色素修饰效果的影响
Fig.2 Effect of mass ratio of melanin to amino acid on the melanin modification effect
2.2 黑木耳黑色素及黑木耳氨基酸黑色素的结构表征
2.2.1 紫外光谱分析
黑木耳黑色素及氨基酸黑色素在200~600 nm的紫外全波段扫描光谱见图3。
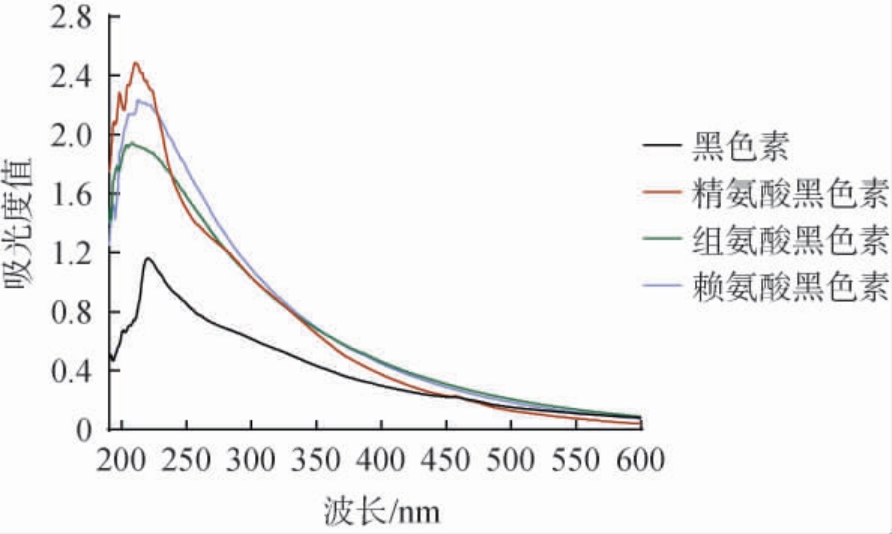
图3 黑色素及氨基酸黑色素的紫外全波段扫描光谱图
Fig.3 Ultraviolet full-band scanning spectra of melanin and amino acid melanin
由图3可知,黑色素、精氨酸黑色素、组氨酸黑色素和赖氨酸黑色素分别在波长220 nm、210 nm、208 nm和212 nm处有最大吸收峰,之后均随着波长的增加,吸光度值呈下降趋势。修饰后的氨基酸黑色素最大吸收波长降低。研究表明,梯棱羊肚菌黑色素经赖氨酸修饰前后的最大吸收峰分别为230 nm和219 nm,修饰后的最大吸收峰向短波方向移动[19],与本研究结果趋势一致。虽然经过氨基酸修饰后最大吸收峰发生改变,但随着波长增加,吸光度均呈下降趋势,无峰形变化,因此氨基酸修饰的黑色素未改变其紫外光谱特性[18,29]。
2.2.2 红外光谱分析
黑色素及氨基酸黑色素的红外光谱图见图4。由图4可知,黑色素在3 400 cm-1处有吸收峰,由O-H和吲哚的N-H伸缩振动产生,是黑色素的一个特征吸收峰[30];黑色素与氨基酸黑色素在1 640cm-1处存在的强烈吸收峰是典型的真菌黑色素的特征吸收峰,由芳香族C=C键的拉伸与-COOH的对称拉伸振动或N-H的弯曲振动引起[27,30],表明存在羰基,是黑色素典型的苯醌类结构;黑色素及氨基酸黑色素在3 010~2 930 cm-1处的小吸收峰由C-H基团的拉伸振动和弯曲振动引起,推测为烷烃结构的C-H吸收区。氨基酸黑色素与黑色素相比,存在2 200~2 000 cm-1的吸收峰,是由于存在氨基酸和胺的氢卤化物,说明氨基酸已经与黑色素结合在一起。这与徐灿[31]的研究结果一致。修饰后的氨基酸黑色素的红外光谱特性发生改变。
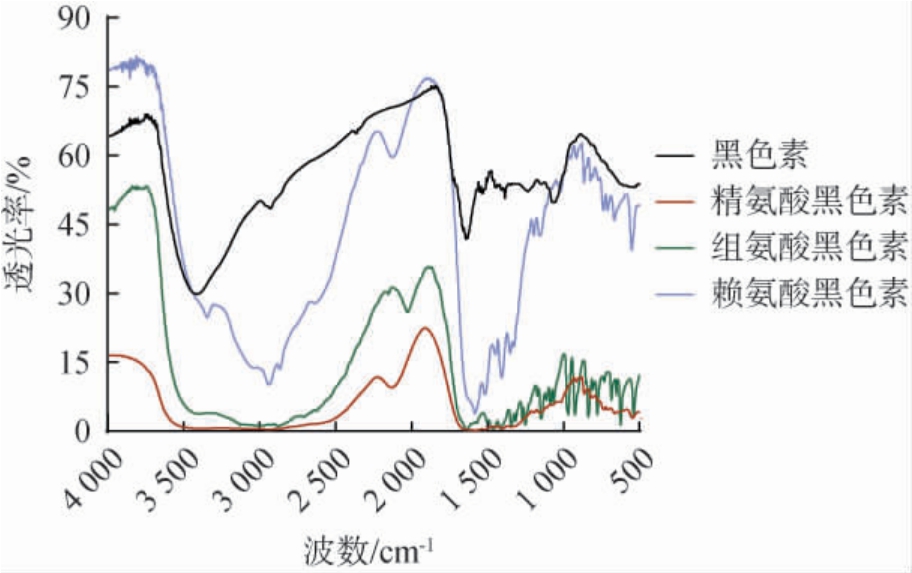
图4 黑色素及氨基酸黑色素的红外光谱图
Fig.4 Infrared spectra of melanin and amino acid melanin
2.3 溶解性分析
黑色素及氨基酸黑色素在不同溶剂中的吸光度值见表1。由表1可知,黑色素几乎不溶于蒸馏水和1 mol/L HCl,仅溶于1 mol/LNaOH和二甲亚砜溶液,微溶于体积分数75%乙醇。与黑色素相比,精氨酸黑色素、组氨酸黑色素和赖氨酸黑色素在1 mol/L NaOH和二甲亚砜溶液吸光度值得到提高,而且在蒸馏水中吸光度值较黑色素明显提高。精氨酸黑色素、组氨酸黑色素和赖氨酸黑色素的溶解性排序为:1 mol/L NaOH>蒸馏水>二甲亚砜>体积分数75%乙醇。黑色素难溶于水,溶解度近似为0,精氨酸黑色素、组氨酸黑色素和赖氨酸黑色素在水中的溶解度分别为5.62 g/L、5.43 g/L、5.39 g/L。因此,黑色素经过氨基酸修饰后,3种氨基酸黑色素在水中的溶解度明显提高。徐灿[31]对粒毛盘菌黑色素进行精氨酸修饰后的溶解度为5.01 mg/mL,与本研究结果相近。
表1 黑色素及氨基酸黑色素在不同溶剂中的吸光度值
Table 1 Absorbance values of melanin and amino acid melanin in different solvents
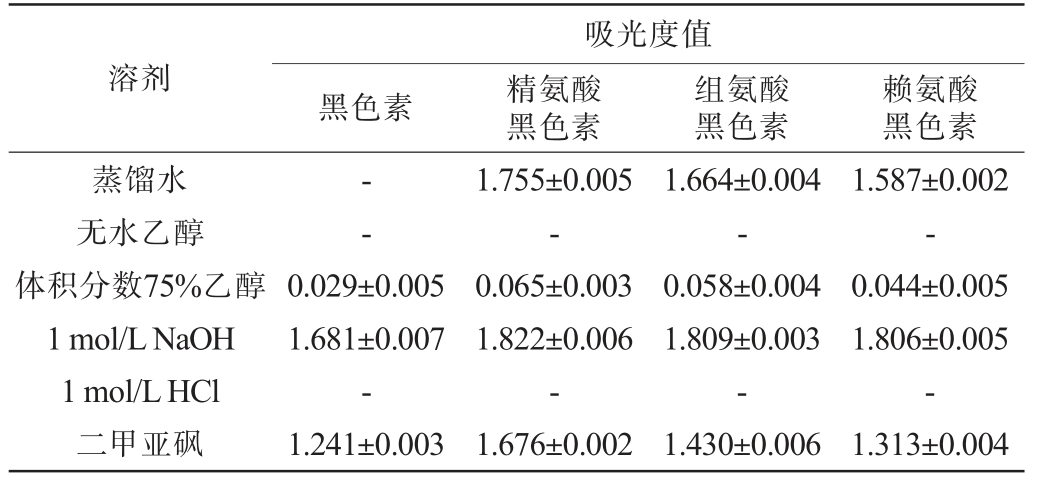
注:“-”示不溶。
溶剂吸光度值黑色素精氨酸黑色素组氨酸黑色素赖氨酸黑色素蒸馏水无水乙醇体积分数75%乙醇1 mol/L NaOH 1 mol/L HCl二甲亚砜--0.029±0.005 1.681±0.007-1.241±0.003 1.755±0.005-0.065±0.003 1.822±0.006-1.676±0.002 1.664±0.004-0.058±0.004 1.809±0.003-1.430±0.006 1.587±0.002-0.044±0.005 1.806±0.005-1.313±0.004
2.4 稳定性分析
2.4.1 温度稳定性
不同温度条件下黑色素及氨基酸黑色素的保存率见表2。由表2可知,在不同温度条件下,随着时间在0~120 min内的延长,黑色素及氨基酸黑色素的吸光度值变化均不明显,120 min时,不同温度条件下黑色素及氨基酸黑色素的保存率均>97.11%。 结果表明,黑色素及氨基酸黑色素对温度的稳定性良好。
表2 不同温度条件下黑色素及氨基酸黑色素的保存率
Table 2 Retention rates of melanin and amino acid melanin under different temperature conditions
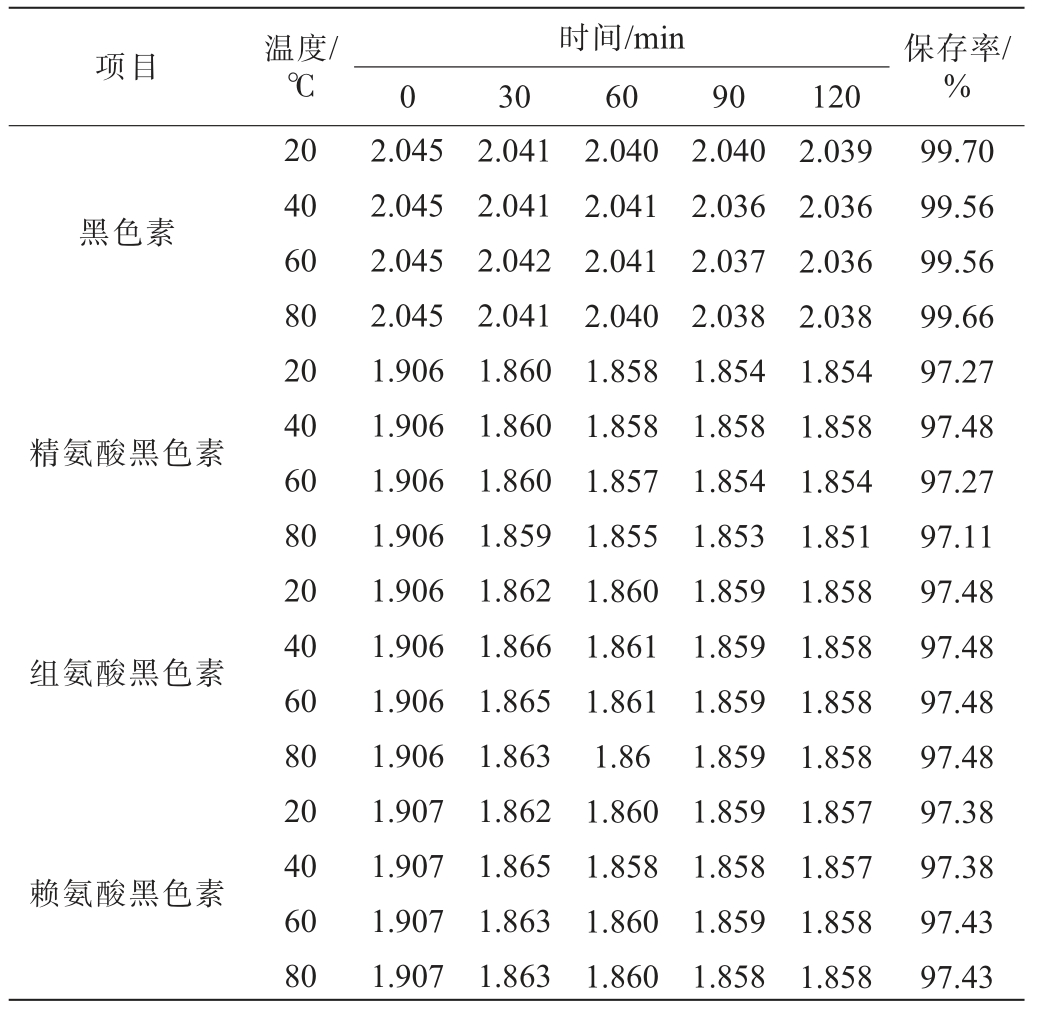
项目温度/℃时间/min 0306090120保存率/%黑色素精氨酸黑色素组氨酸黑色素赖氨酸黑色素20 40 60 80 20 40 60 80 20 40 60 80 20 40 60 80 2.045 2.045 2.045 2.045 1.906 1.906 1.906 1.906 1.906 1.906 1.906 1.906 1.907 1.907 1.907 1.907 2.041 2.041 2.042 2.041 1.860 1.860 1.860 1.859 1.862 1.866 1.865 1.863 1.862 1.865 1.863 1.863 2.040 2.041 2.041 2.040 1.858 1.858 1.857 1.855 1.860 1.861 1.861 1.86 1.860 1.858 1.860 1.860 2.040 2.036 2.037 2.038 1.854 1.858 1.854 1.853 1.859 1.859 1.859 1.859 1.859 1.858 1.859 1.858 2.039 2.036 2.036 2.038 1.854 1.858 1.854 1.851 1.858 1.858 1.858 1.858 1.857 1.857 1.858 1.858 99.70 99.56 99.56 99.66 97.27 97.48 97.27 97.11 97.48 97.48 97.48 97.48 97.38 97.38 97.43 97.43
2.4.2 光照稳定性
不同光照条件下黑色素及氨基酸黑色素的保存率见表3。由表3可知,在不同光照条件下,随着时间在0~48 h内的延长,黑色素及氨基酸黑色素的吸光度值均变化不明显,48 h时,黑色素及氨基酸黑色素的保存率均>96.80%。 结果表明,黑色素及氨基酸黑色素对光照的稳定性良好。
表3 不同光照条件下黑色素及氨基酸黑色素的保存率
Table 3 Retention rates of melanin and amino acid melanin under different light conditions
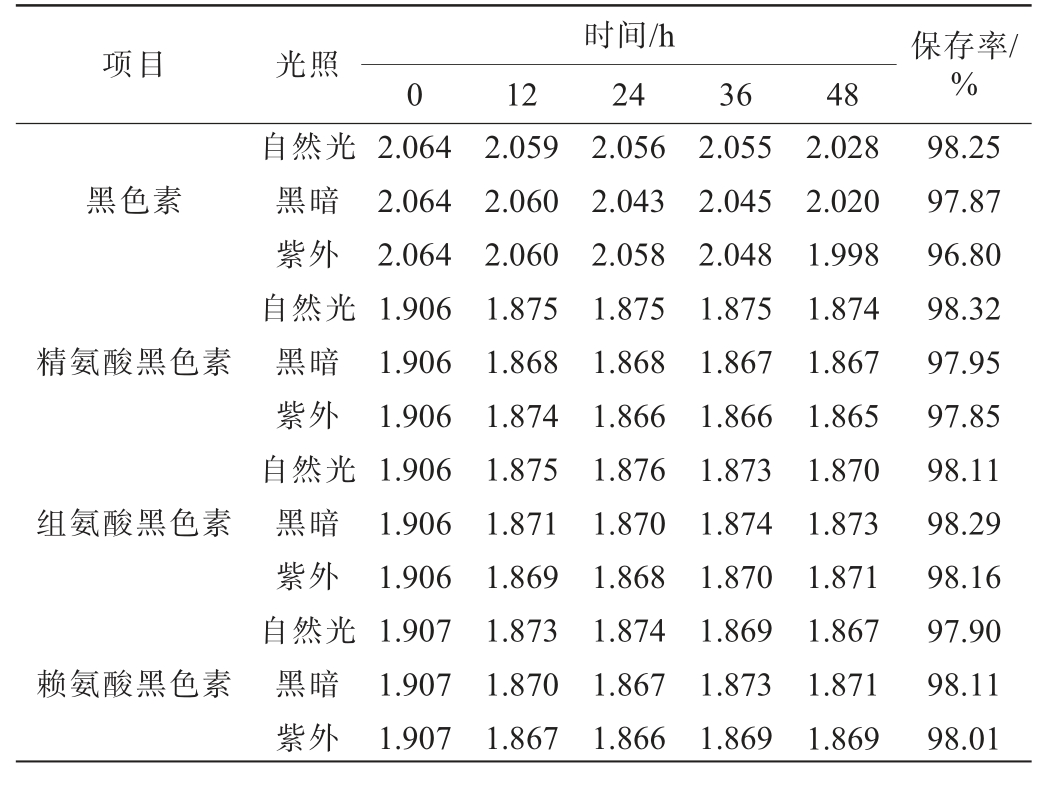
项目光照保存率/%时间/h 012243648黑色素精氨酸黑色素组氨酸黑色素赖氨酸黑色素自然光黑暗紫外自然光黑暗紫外自然光黑暗紫外自然光黑暗紫外2.064 2.064 2.064 1.906 1.906 1.906 1.906 1.906 1.906 1.907 1.907 1.907 2.059 2.060 2.060 1.875 1.868 1.874 1.875 1.871 1.869 1.873 1.870 1.867 2.056 2.043 2.058 1.875 1.868 1.866 1.876 1.870 1.868 1.874 1.867 1.866 2.055 2.045 2.048 1.875 1.867 1.866 1.873 1.874 1.870 1.869 1.873 1.869 2.028 2.020 1.998 1.874 1.867 1.865 1.870 1.873 1.871 1.867 1.871 1.869 98.25 97.87 96.80 98.32 97.95 97.85 98.11 98.29 98.16 97.90 98.11 98.01
2.4.3 金属离子稳定性
金属离子对黑色素及氨基酸黑色素稳定性的影响见表4。
表4 不同金属离子条件下黑色素及氨基酸黑色素的保存率
Table 4 Retention rates of melanin and amino acid melanin under different metal ion conditions
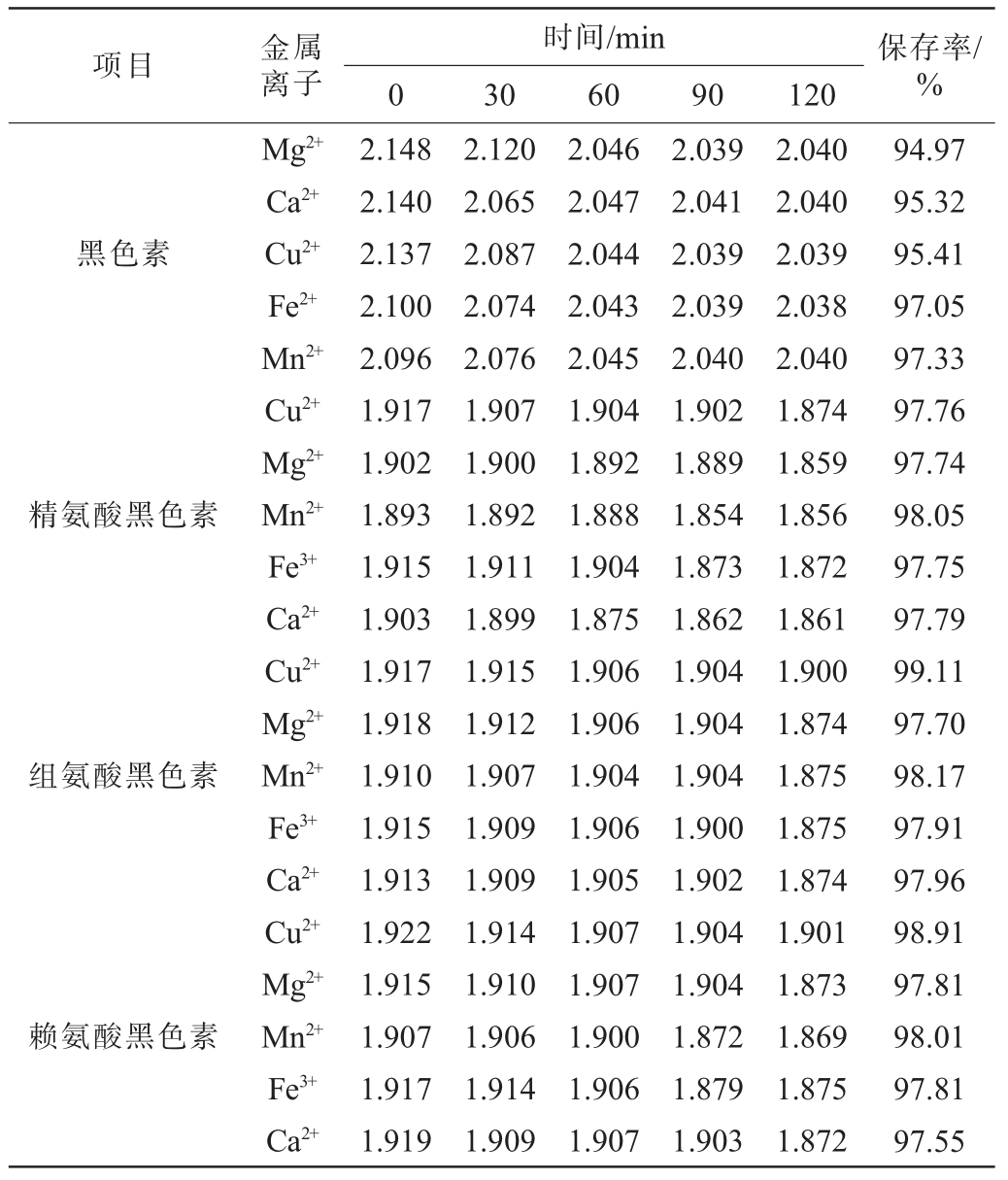
项目金属离子时间/min 0306090120保存率/%黑色素精氨酸黑色素组氨酸黑色素赖氨酸黑色素Mg2+Ca2+Cu2+Fe2+Mn2+Cu2+Mg2+Mn2+Fe3+Ca2+Cu2+Mg2+Mn2+Fe3+Ca2+Cu2+Mg2+Mn2+Fe3+Ca2+2.148 2.140 2.137 2.100 2.096 1.917 1.902 1.893 1.915 1.903 1.917 1.918 1.910 1.915 1.913 1.922 1.915 1.907 1.917 1.919 2.120 2.065 2.087 2.074 2.076 1.907 1.900 1.892 1.911 1.899 1.915 1.912 1.907 1.909 1.909 1.914 1.910 1.906 1.914 1.909 2.046 2.047 2.044 2.043 2.045 1.904 1.892 1.888 1.904 1.875 1.906 1.906 1.904 1.906 1.905 1.907 1.907 1.900 1.906 1.907 2.039 2.041 2.039 2.039 2.040 1.902 1.889 1.854 1.873 1.862 1.904 1.904 1.904 1.900 1.902 1.904 1.904 1.872 1.879 1.903 2.040 2.040 2.039 2.038 2.040 1.874 1.859 1.856 1.872 1.861 1.900 1.874 1.875 1.875 1.874 1.901 1.873 1.869 1.875 1.872 94.97 95.32 95.41 97.05 97.33 97.76 97.74 98.05 97.75 97.79 99.11 97.70 98.17 97.91 97.96 98.91 97.81 98.01 97.81 97.55
由表4可知,在不同金属离子条件下,随着时间在0~120 min内的延长,黑色素及氨基酸黑色素的吸光度值均无明变化,120 min时,黑色素及氨基酸黑色素的保存率均>94.97%。结果表明,黑色素对金属离子的稳定性良好。高莉等[18]研究表明,山杏核壳黑色素及L-精氨酸和DL-精氨酸修饰后的山杏核壳黑色素具有较好的温度稳定性。李俊[24]研究表明,灵芝黑色素及精氨基黑色素对黑暗和自然光及金属离子具有较好的稳定性,与本研究结果一致。
2.5 抗氧化活性分析
黑色素及氨基酸黑色素对DPPH自由基、超氧阴离子和羟基自由基的清除率见图5。 由图5A可知,VC溶液质量浓度为0.0625~0.5 mg/mL时,DPPH自由基清除率逐渐增加;质量浓度>0.5 mg/mL时,DPPH自由基清除率趋于平稳。 黑色素及氨基酸黑色素溶液质量浓度为0.062 5~2.0 mg/mL,DPPH自由基清除率逐渐增加;质量浓度>2.0 mg/mL时,DPPH自由基清除率趋于平稳;质量浓度为4.0 mg/mL时,黑色素、精氨酸黑色素、组氨酸黑色素和赖氨酸黑色素的DPPH自由基清除率分别为96.84%、98.73%、98.67%、98.35%。
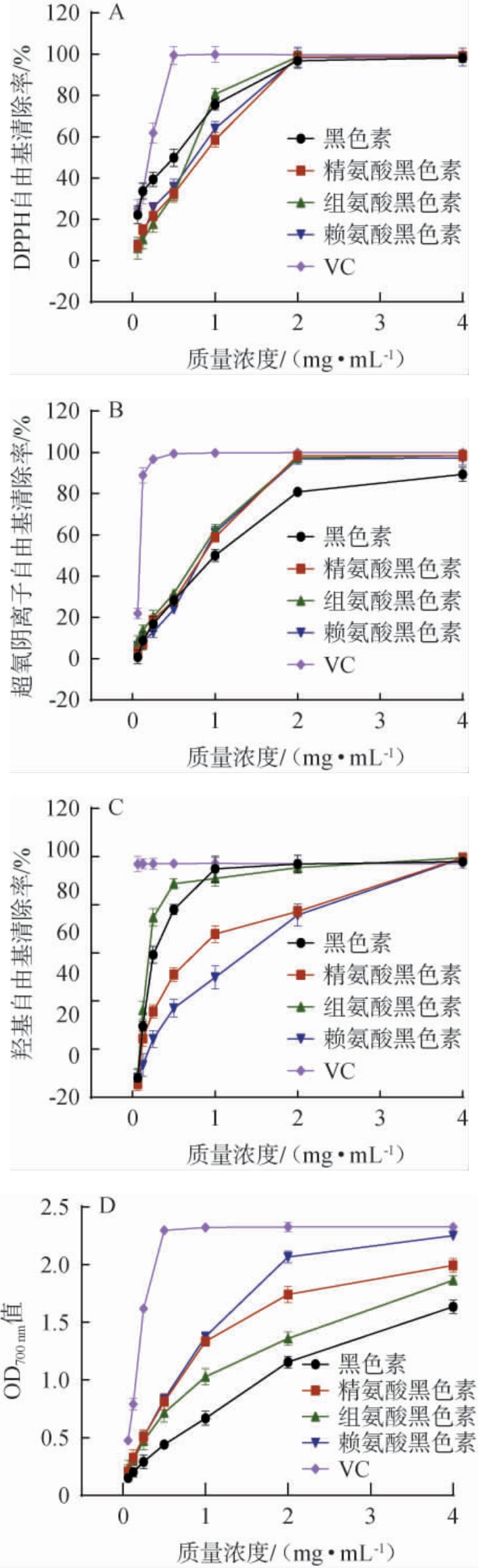
图5 黑色素及氨基酸黑色素的抗氧化活性测定结果
Fig.5 Determination results of antioxidant activities of melanin and amino acid melanin
由图5B可知,VC溶液质量浓度为0.062 5~0.5 mg/mL时,超氧阴离子自由基清除率快速增加;VC溶液质量浓度>0.5 mg/mL时,超氧阴离子自由基清除率趋于平稳;而黑色素及氨基酸黑色素溶液质量浓度为0.062 5~2 mg/mL时,超氧阴离子自由基清除率逐渐增加;质量浓度>2.0 mg/mL时,超氧阴离子自由基清除率趋于平稳;质量浓度为4.0mg/mL时,黑色素、精氨酸黑色素、组氨酸黑色素和赖氨酸黑色素的清除率分别为80.90%、98.30%、97.34%、96.86%。
由图5C可知,VC溶液质量浓度为0.062 5~4.0 mg/mL时,羟自由基清除率趋于平稳;质量浓度为4.0 mg/mL时,羟自由基清除率为97.28%。 黑色素和组氨酸黑色素质量浓度为0.062 5~2.0 mg/mL时,羟自由基清除率逐渐增加,之后趋于平稳;质量浓度为4.0 mg/mL时,羟自由基清除率为96.99%、95.46%。精氨酸黑色素及赖氨酸黑色素质量浓度为0.0625~4.0 mg/mL时,羟自由基清除率逐渐增加;质量浓度为4.0 mg/mL时,羟自由基清除率分别为99.50%、99.36%。
样品吸光度值越大,还原能力越强[32]。 由图5D可知,VC溶液质量浓度为0.0625~0.5 mg/mL时,铁离子还原力逐渐增加;VC溶液质量浓度>0.5 mg/mL时,铁离子还原力趋于平稳。而黑色素和氨基酸黑色素质量浓度为0.062 5~4.0 mg/mL时,吸光度值逐渐增长;质量浓度为4 mg/mL时,黑色素、组氨基酸黑色素、精氨酸黑色素、赖氨酸黑色素吸光度值分别为1.634、1.863、1.992、2.252。
综上所述,氨基酸黑色素与黑色素均表现出良好的抗氧化活性,氨基酸黑色素抗氧化活性高于黑色素,但低于对照VC。
3 结论
本研究发现精氨酸、组氨酸和赖氨酸对黑色素的修饰效果较好,并在黑色素与氨基酸的质量比为1.0∶2.0、1.0∶1.5、1.0∶1.5时制备精氨酸黑色素、组氨酸黑色素、赖氨酸黑色素。紫外光谱分析显示修饰后的氨基酸黑色素的最大吸收锋向短波方向偏移。红外光谱分析显示修饰后的氨基酸黑色素与黑色素相比存在特定的吸收峰,可能是由于存在氨基酸和胺的氢卤化物,说明氨基酸已与黑色素发生化学反应结合在一起。 氨基酸修饰后的黑色素水溶性明显提高,修饰前后的黑色素均存在较好的光照、温度及金属离子稳定性及抗氧化性。本研究制备的黑木耳氨基酸黑色素具有良好的水溶性及抗氧化活性,为黑木耳黑色素的开发和利用提供了技术支持。
[1]CORDERO R,CASADEVALL A.Melanin[J].Curr Biol,2020,30(4):142-143.
[2]王振娟,刘思婕,王杰.黑牛肝菌黑色素抗氧化活性和稳定性及染发效果[J].食用菌学报,2023,30(4):67-77.
[3]李晓敏,袁源,薛帆正,等.粗毛纤孔菌产胞外黑色素发酵条件优化及其抗氧化活性研究[J].核农学报,2023,37(3):531-539.
[4]ELNAGGAR N E, SABER W I A.Natural Melanin: current trends, and future approaches,with especial reference to microbial source[J].Polymers,2022,14(7):1339.
[5]ABDELAZIZ A S, ABED N N, MAHFOUZ A Y, et al.Production and characterization of melanin pigment from black fungus Curvularia soli AS21 ON076460 assisted gamma rays for promising medical uses[J].Microb Cell Fact,2024,23(1):68.
[6]刘雅玫.基于贻贝壳黑色素光热效应的抗菌活性对耐药性金黄色葡萄球菌感染伤口愈合的影响[D].青岛:青岛大学,2020.
[7]TRANLY A N,REYES C,SCHWARZE F,et al.Microbial production of melanin and its various applications[J].World J Microb Biot,2020,36(11):170.
[8]MATTOON E R,CORDERO R J B,CASADEVALL A.Fungal melanins and applications in healthcare, bioremediation and industry[J].J Fungi,2021,7(6):488.
[9]LIU R,MENG X, MO C, et al.Melanin of fungi: From classification to application[J].World J Microb Biot,2022,38(12):228.
[10]郭燕,韩闯,田爽,等.3种来源黑木耳黑色素的性质及其体外抗氧化活性比较[J].食品研究与开发,2024,45(13):63-69.
[11]林杨轩,陈芳艳,韩黎.烟曲霉黑色素的研究进展[J].微生物学通报,2023,50(8):3688-3702.
[12]RUDRAPPA M,KUMAR R S,BASAVARAJAPPA D S,et al.Penicillium citrinum NP4 mediated production, extraction, physicochemical characterization of the melanin,and its anticancer,apoptotic,photoprotection properties[J].Int J Biol Macromol,2023,245:125547.
[13]SUN X, YANG C H, MA Y P, et al.Research progress of Auricularia heimuer on cultivation physiology and molecular biology[J].Front Microbiol,2022,13:1048249.
[14]杨亚楠,张素琴,刘于嘉.黑木耳的营养成分及功能[J].农产品加工,2024(15):91-93.
[15]朱雨馨,王文斌,王佳婧,等.富锗木耳菌丝体不同溶剂提取物的体外抗氧化能力[J].食品工业科技,2024,45(8):21-28.
[16]周建良,王怀雨,童丽萍.天然黑色素的提取、改性和应用[J].科学通报,2023,68(11):1406-1420.
[17]LIU S J,LIU X W,ZHANG X Q,et al.Exploring the potential of watersoluble squid ink melanin: Stability, free radical scavenging, and Cd2+adsorption abilities[J].Foods,2023,12(21):3963.
[18]高莉,刘琳琳,王瑞琪,等.山杏核壳黑色素氨基酸修饰物的制备及性能分析[J].精细化工,2022,39(7):1393-1401.
[19]常明昌,曹群珞,刘文婷,等.赖氨酸修饰对梯棱羊肚菌黑色素结构和理化特性的影响[J].农业工程学报,2024,40(5):297-306.
[20]姚秀鸽,郭燕,韩闯,等.提高黑色素得率的黑木耳发酵配方优化及黑色素的理化性质研究[J].菌物学报,2024,43(12):241-254.
[21]LI S L,YANG L Q,LI J L,et al.Structure,molecular modification,and anti-radiation activity of melanin from Lachnum YM156 on ultraviolet B-induced injury in mice[J].Appl Biochem Biotech, 2019, 188(2):555-567.
[22]李晓敏,谢颂钰,陶永新,等.基于Py-GC/MS分析黑木耳新品种‘农黑2号’木耳黑色素的热裂解产物[J].菌物学报,2023,42(8):1766-1774.
[23]SHI Q W,YANG Z E, FAN R H, et al.Isolation, characterization, and antioxidant activity of melanin from Auricularia auricula(Agaricomycetes)[J].Int J Med Mushrooms,2023,25(6):55-73.
[24]李俊.灵芝黑色素衍生物的制备以及性质研究[D].晋中:山西农业大学,2020.
[25]罗星,李晓敏,薛帆正,等.银耳菌糠黑色素的理化性质及抗氧化和抑菌活性[J].菌物学报,2023,42(2):539-552.
[26]隋昕怡,逄梦玉,刘丹,等.超声辅助低共熔溶剂法提取蛹虫草多糖工艺优化及其抗氧化活性研究[J].粮食与油脂,2024,37(9):92-96.
[27]XU L J,LI J,CHANG M C,et al.Comparison of physicochemical and biochemical properties of natural and arginine-modified melanin from medicinal mushroom Ganoderma lucidum[J].J Basic Microbiol,2020,60(11-12):1014-1028.
[28]刘文婷.梯棱羊肚菌黑色素的提取优化及其衍生物性质研究[D].晋中:山西农业大学,2020:
[29]SUTHAR M,DUFOSSE L,SINGH S K.The enigmatic world of fungal melanin:A comprehensive review[J].J Fungi,2023,9(9):891.
[30]刘增虎,杨伟克,胡昌雄,等.琥珀蚕茧黑色素的理化性质及其抗氧化活性研究[J].蚕业科学,2024,50(6):522-530.
[31]徐灿.粒毛盘菌黑色素及其衍生物结构、生物活性与作用机制[D].合肥:合肥工业大学,2017.
[32]朱秀红,武佳佳,李宁,等.表面活性剂协同超声波提取泡桐花总黄酮及其抗氧化活性研究[J].化学与生物工程,2023,40(4):35-41.
[33]GUO L L,LI W,GU Z,et al.Recent advances and progress on melanin:From source to application[J].Int J Mol Sci,2023,24(5):4360.