丙酸是一种挥发性短链有机酸,广泛存在于发酵食品中。 丙酸有刺激性,其含量对食品的风味和品质有较大的影响,如丙酸含量过高时,会加重果酒的涩味;丙酸含量适中时,会给果酒带来柔顺的口感[1]。 研究显示,在酸性条件下,丙酸对霉菌、需氧芽胞菌和革兰氏阴性杆菌有较好的抑制作用,GB 2760—2024《食品安全国家标准食品添加剂使用标准》规定丙酸及其盐类,包括丙酸钙、丙酸钠可作为新型防腐剂用于面包、糕点、酒类等食品中[2-3]。除此之外,丙酸还能直接参与多种人体的代谢途径,被结肠上皮细胞吸收后,可在不同器官的代谢过程中发挥作用,如参与葡萄糖和脂肪的代谢、调节免疫系统和肠道功能等,对调节人体健康有着重要作用。
目前,针对挥发性短链有机酸的研究多集中在丁酸[4]和乙酸等[5]生理作用,而较少关注丙酸的形成机制以及生物学功能。 本文系统地阐述了近年来发酵食品中丙酸的含量、形成机制以及其生物学功能研究进展,旨在更好地发挥丙酸的潜在价值,为丙酸在食品等领域的研究与应用提供参考依据。
1 发酵食品中丙酸的含量
1.1 食醋
中国食醋多以小麦、小米、高粱等谷物为原料经微生物发酵酿造而成,其风味主要由酯类、醛类、酮类及杂环类等呈香物质形成,除此之外,丙酸等酸类化合物也可使食醋风味更佳[6]。研究发现,酿造食醋中的丙酸含量范围比配制食醋中的丙酸含量范围更宽泛。王贵双等[7]利用离子色谱(ion chromatography,IC)法对150个食醋样本中丙酸的含量进行分析,结果表明,酿造食醋和配制食醋中的丙酸含量分别为0~0.28 g/L和0~0.14 g/L。此外,在食醋酿造过程中,酿造时间、pH和氧气等条件的改变可导致食醋中丙酸含量的差异。 李永丽等[8]分析食醋固态发酵过程中丙酸含量的变化,结果显示,丙酸含量在发酵前期随着发酵时间的延长而增加,而在发酵后期和陈酿期,丙酸含量出现降低的趋势。分析这可能是由于在发酵后期和陈酿期的有氧发酵阶段,pH值的上升和温度的下降抑制了丙酸杆菌属(Propionibacterium)的生长和产酸。
1.2 酱油
酱油是由大豆、小麦等通过米曲霉(Aspergillus oryze)、酵母菌等微生物发酵而成的具有独特鲜美滋味的一种调味品。在酱油酿造过程中,由微生物和复合生物酶的协同作用分解产生的有机酸类物质构成了酱油独特风味和香气,有机酸的种类和含量会直接影响到酱油的风味和品质。研究发现,酱油中的丙酸平均含量为0.89 μg/L[9],适量的丙酸等有机酸可增加酱油的风味,但丙酸的含量过高会导致酱油的酸味明显,质量降低[10]。因此,在酱油酿造过程中可通过监测丙酸等有机酸的含量变化控制其质量。
1.3 鱼类调味品
鱼类调味品是指以低值鱼为主的海鲜下脚料经盐渍防腐、本身自溶作用以及微生物分解作用,再经长时间自然条件下的发酵,制成的具有独特风味的酱类和调味汁。 鱼类调味品的主要香味组成成分为氨味、干酪味和肉香味[6],其中,干酪味主要来自丙酸、丁酸等低分子质量有机酸,这些有机酸主要是在发酵后期产生[11-12]。目前,市面上常见的鱼类调味品主要为鱼酱、鱼露和虾酱。 在鱼酱中的丙酸含量为19.1 mg/L,鱼露中的丙酸含量为16.0 mg/L,腌制虾酱的丙酸含量为20.7 mg/L[3]。
1.4 酱类调味品
酱类调味品是以粮食为主要原料经微生物发酵而制成的半固态调味品。 研究发现,大豆酱中丙酸的平均含量为0.004 mg/kg[13],面酱中丙酸的含量为0.003 7 mg/kg[14],二者丙酸的含量无明显差异。此外,在酱类物质的原料中检测到较高含量的丙酸,而经发酵后丙酸的含量有所增加,如毛霉型豆豉发酵过程,在大豆中检测出丙酸含量为32.14 mg/kg,制曲2 d后丙酸含量逐渐增加,当发酵215 d时,丙酸含量增加至37.14 mg/kg[15]。
1.5 发酵乳制品
发酵乳制品是将原料乳主要经乳酸菌发酵,制成的具有特殊风味物质的酸性乳制品。 传统发酵乳制品中含有少量的丙酸,如在半硬奶酪检测到丙酸的平均含量为18.78 mg/kg,软奶酪中为6.80 mg/kg[16]。 研究发现,丙酸等挥发性酸类化合物是发酵乳制品中重要的风味物质。干佳丽等[17]通过对发酵乳制品的挥发性风味成分进行分析,发现丙酸对于淡味、中味、浓味三种特征风味均有贡献,其中对浓味特征风味贡献排序靠前。 此外,传统发酵乳制品的制造过程较长,至少有一种以上的微生物参加反应,并且还有各种酶的作用。由于微生物产生的脂酶再次参加反应,游离脂肪酸含量更高。在瑞士奶酪中的丙酸含量非常高,是其特征风味的贡献者[18]。
1.6 其他
除上述之外,在雪菜[19]、面包[20]和果酒[1]中也检测到了丙酸的存在。食品或食品原料在加工或贮藏中难免存在各种微生物的污染以及脂质的氧化等影响,而丙酸杆菌的生长代谢和脂质的氧化均会产生丙酸,从而使终产品中存在少量的丙酸。有研究报道,随着鲜度的下降,短链脂肪酸含量增加[3]。
2 发酵食品中丙酸的形成机制
发酵食品中的丙酸主要由微生物的代谢产生,目前国内外用于丙酸发酵研究的菌株多集中在费氏丙酸杆菌(Propionibacterium freudennreichii)、谢氏丙酸杆菌(Propionibacterium shermanil)、特氏丙酸杆菌(Propionibacterium thoenii)和詹氏丙酸杆菌(Propionibacterium jensenii)等丙酸杆菌属[21],其中还有多种酶参与。利用丙酸杆菌生产丙酸时,葡萄糖、乳酸、乳糖、甘油等均可作为其碳源,在厌氧条件下,还会伴随乙酸、琥珀酸、CO2等副产物的产生。丙酸杆菌以不同底物作为碳源进行发酵的理想反应式如下:
葡萄糖作为碳源:1.5C6H12O6→2C3H6O2+C2H6O2+CO2+H2O
乳酸作为碳源:3C3H6O3→2C3H6O2+C2H6O2+CO2+H2O
乳糖作为碳源:3C3H4O3→2C3H6O2+C2H4O2+CO2+H2O
甘油作为碳源:C3H8O3→C3H6O2+H2O
由上述代谢反应式可知, 丙酸是丙酸杆菌的主要代谢产物。当以葡萄糖、乳糖作为碳源时,对丙酸的转化率均为54.8%,而对乙酸的转化率分别为22.2%和22.25%,其发酵产物主要为丙酸、乙酸的混合物,只有以甘油作为碳源时,其发酵产物只有丙酸而无乙酸[22]。但在实际生产中,丙酸得率通常在25%~40%。除丙酸本身会对微生物的代谢有一定抑制作用,副产物、营养等多种因素也会影响丙酸杆菌的代谢,导致丙酸得率降低[23]。此外,在丙酸杆菌生产丙酸的过程中也需要酶的参与。 研究发现,丙酰辅酶A(propionylcoenzyme A,propionyl-CoA)转移酶在合成丙酸的过程中起着关键作用,它能够催化propionyl-CoA与特定受体分子之间的转移反应,将丙酰基转移到合适的底物上,从而促使丙酸的生成。propionyl-CoA转移酶的活性对于维持整个丙酸生产代谢途径的通量平衡至关重要,但其活性普遍较低,严重限制了丙酸的生产与发展[24]。 针对这一问题,LIU X T等[23]利用定点突变技术对propionyl-CoA转移酶的基因序列进行替换,筛选出活性显著提高的突变体,这使得丙酸产量提高数倍。
发酵食品中丙酸杆菌生物合成丙酸的主要途径如图1所示[25],此途径中主要包含糖酵解途径(embden-meyerhofparnas pathway,EMP)、三羧酸(tricarboxylic acid,TCA)循环和伍德-沃克曼(Wood-Werkmman)循环。葡萄糖及其他碳源,经EMP途径生成磷酸烯醇式丙酮酸,在磷酸烯醇式丙酮酸羧化酶的作用下生成两分子丙酮酸和还原型辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH)。 其中,一分子丙酮酸经Wood-Werkman循环途径转化为丙酰辅酶A(propionyl-CoA),最后通过硝酸盐或硫酸盐还原成丙酸;而另一分子丙酮酸首先转化为草酰乙酸,进入TCA循环,草酰乙酸先后转化为苹果酸和富马酸,再被还原成琥珀酸,在这个过程中,CoA发生转移,辅酶转移酶将其由丙酰CoA转移到琥珀酸后生成丙酸和琥珀酸CoA。此外,草酰乙酸还可经柠檬合酶缩合生成柠檬酸和乙酰CoA,再经顺乌头酸酶脱水、水合后生成异柠檬酸,最后经过氧化脱羧后,CoA被辅酶转移酶转到琥珀酸并生成丙酸和琥珀酸CoA,此过程的中间产物α-酮戊二酸还可参与维生素B12的合成[26],至此完成整个循环。
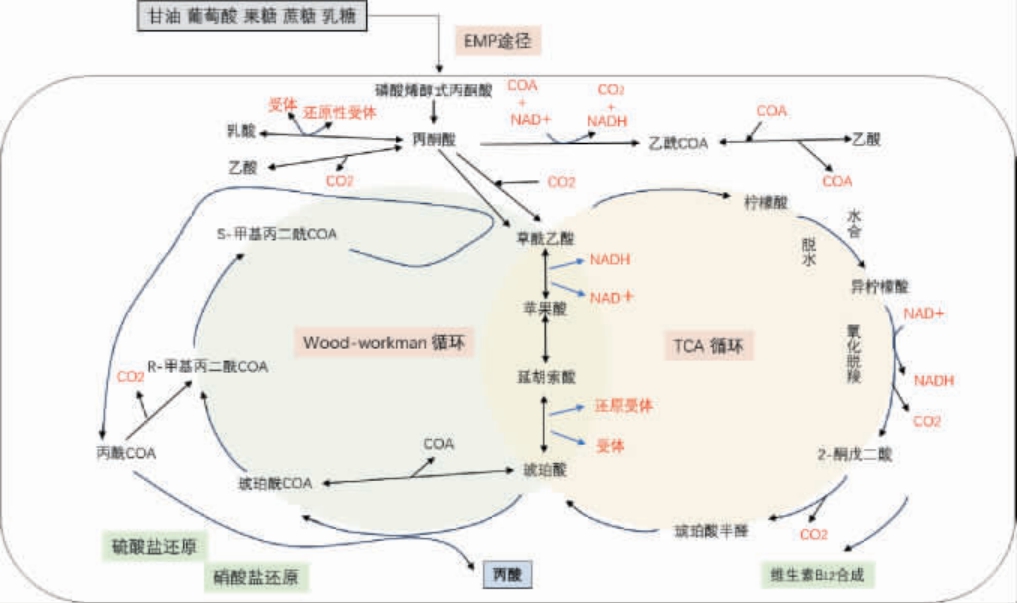
图1 发酵食品中丙酸杆菌生物合成丙酸的途径
Fig.1 Pathway for the biosynthesis of propionic acid by Propionibacterium in fermented foods
除上述之外,在微生物和内源酶协同作用下,也可以脂质、蛋白质等其他大分子营养物质为碳源,产生游离脂肪酸和游离氨基酸等初级代谢产物,并进一步代谢可产生丙酸。如脂质在脂酶作用下生成脂肪酸。其中,不饱和脂肪酸易发生自动氧化,其二级氧化产物主要为酮类、醛类和烷烃类等,醛类又可经还原和氧化作用生成丙酸,而饱和脂肪酸经微生物不完全β-氧化代谢生成发酵食品中重要风味物质甲基酮和内酯,同时还可有效抑制脂肪酸过度氧化,避免不良风味的生成[15]。 多肽可经微生物氨肽酶分解为游离氨基酸(如L-丙氨酸、L-丝氨酸、L-半胱氨酸),通过转氨酶和脱氢酶的协同作用生成α-酮酸,进而在一系列的转氨、脱氨以及脱羧反应生成丙酮酸,再经丙酸菌代谢也可生成丙酸[27]。
3 丙酸的生物学功能
丙酸被人体肠上皮细胞吸收后,经线粒体内β-氧化后产生能量,为结肠细胞、黏膜上皮细胞及肌肉等供能。丙酸能直接参与人体多种生理代谢[28],研究表明,一定剂量的丙酸对人体有益,可调节机体免疫、抗肿瘤、促进肠上皮细胞增殖分化和防御、治疗动脉粥样硬化以及调节胰岛素抵抗等。但长期摄入过量的丙酸,会危害人体健康,如对自闭症谱系障碍、胰岛素和肥胖及丙酸血症等产生影响。
3.1 丙酸的有益作用
3.1.1 抗炎
丙酸作用于单核吞噬细胞、淋巴细胞等免疫细胞,通过影响炎症因子的释放、抑制免疫效应细胞增殖及免疫应答等参与人体免疫调节,在抵御致病菌、抑制肠道炎症中起重要作用[29]。 一定剂量的丙酸对沙门氏菌(Salmonella)等致病菌在胃肠道的增殖具有抑制作用,例如,丙酸能通过抑制鼠伤寒沙门菌(Salmonella typhimurium)中入侵基因的表达[30],从而起到抗炎作用。也有研究显示,丙酸可通过抑制核因子-κB(nuclear factor kappa-B,NF-κB)通路,抑制炎症因子的表达,从而发挥抗炎作用。如图2所示[31],其具体机制为丙酸盐通过抑制组蛋白去乙酰化酶(histone deacetylase,HDAC),从而减少核转录因子NF-κB活动,继而抑制中性粒细胞和巨噬细胞释放白细胞介素-8(interleukin-8,IL-8)、白细胞介素-1β(interleukin-1β,IL-1β)等炎症因子,并抑制中性粒细胞对炎症部位的趋化,最终减轻炎症部位局部的炎症反应。 FILIPPONE A等[32]通过体外实验研究发现,一定剂量的丙酸钠可显著抑制NF-κB信号通路减少炎症因子的释放,用低浓度的丙酸钠处理大鼠,结果显示,大鼠爪子的水肿体积显著减少。 ALI I等[33]研究发现,使用丙酸钠可改善脂多糖介导的细胞损伤和抑制炎症反应,部分丙酸钠可通过维持血乳屏障的完整性,抑制HDAC活性和NF-κB信号通路,显著降低炎症因子的产生。此外,丙酸在肠内可激活T细胞分泌T细胞表面G蛋白偶联受体(G protein-coupled receptors 43,GPR43),从而激活其信号通路,使细胞因子和趋化因子水平上升,减少肠道炎症疾病的发生[34]。丙酸也可诱导T细胞分化为调节T细胞,通过抑制炎症因子白细胞介素-10(interleukin-10,IL-10)的释放,进而抑制效应T细胞增殖而减弱炎症反应[35]。
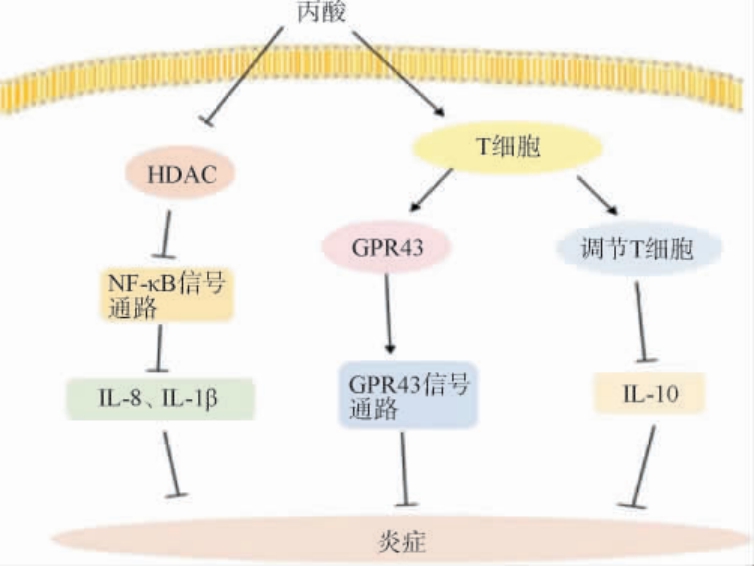
图2 低剂量丙酸抗炎通路示意图
Fig.2 Schematic diagram of anti-inflammatory pathway for low doses of propionic acid
3.1.2 抗癌
大量研究发现,丙酸主要通过蛋白酪氨酸激酶/信号转导器和转录激活因子3(signal transducer and activator of transcription 3,STAT3)/活性氧自由基/P38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路诱导癌细胞凋亡,从而发挥抗癌作用[33]。Janus激酶2(Janus kinase 2,JAK2)、STAT3信号通路是通过诱导细胞周期停滞和抑制抗凋亡基因的表达,最终诱导肿瘤细胞凋亡[36],P38MAPK的活性快速增加也可诱导癌细胞凋亡[37]。 此外,由于癌细胞繁殖和缺氧代谢,导致癌细胞内活性氧簇(reactive oxygen species,ROS)水平升高,从而产生氧化应激,从而使癌细胞组织损伤或凋亡。 具体机制如下:丙酸盐可以激活JAK2和STAT3传导信号磷酸化,进而激活G蛋白偶联受体,使G处癌细胞周期停滞,并激活P38MAPK通路和提高ROS水平,最终诱导癌细胞破损或凋亡。 BILOTTA A J等[38]研究发现,丙酸钠可诱导乳腺癌细胞的细胞周期停滞和凋亡发挥抗癌作用,丙酸钠抑制了JAK2-STAT3介导的丙酸钠在乳腺癌细胞中的增殖作用,导致细胞内ROS的产生,进而造成氧化应激,抑制癌细胞增长。
3.1.3 促进肠上皮细胞增殖、分化和防御
肠道上皮是将宿主与外部环境隔离开来,形成肠道感染的第一道防线,它由单层上皮细胞组成。上皮层依赖于大量的生长信号和能源来增殖、分化和迁移来维持人体内的平衡。始于隐窝基部的干细胞每2~3 h分裂一次,再由底层间充质成纤维细胞分泌生长因子,进而驱动干细胞分裂后产生瞬时扩增细胞,然后在宿主和微生物因子(如丙酸)的作用下分化这些细胞向绒毛轴移动,最后被挤进肠腔[39]。肠上皮修复是一个复杂的过程,对炎症性肠病组织再生的相关研究表明,在受伤后的最初几个小时内,来自相邻隐窝的细胞迁移到伤口床上,形成一个临时屏障,保护底层干细胞不暴露于腔内内容物,这一过程独立于细胞增殖,常见于皮肤等其他器官中。在这个过程中,信号因子在上皮恢复中发挥重要作用,包括前列腺素、转化生长因子和肠道微生物来源的短链脂肪酸(如丙酸)[40]。 研究发现,丙酸在肠道上皮细胞中起重要作用。首先,丙酸可以作为肠道上皮细胞的能量来源,肠道上皮细胞对丙酸具有较高的摄取和利用能力,能通过丙酸代谢产生丰富的腺苷三磷酸(adenosine triphosphate,ATP),从而维持其功能[41]。 其次,丙酸可以通过抑制I类组蛋白去乙酰化酶和G蛋白偶联受体,并需要信号转导和STAT3增强细胞的扩散和极化,进而促进肠上皮细胞的迁移,最终导致细胞增殖和分化[38]。此外,丙酸对增强肠道上皮屏障有重要作用。 丙酸可通过增加黏液层分泌、营养肠上皮细胞、增加紧密连接蛋白等增强肠机械屏障,或通过免疫调节作用增强肠免疫屏障等影响肠化学屏障[42]。
3.1.4 治疗动脉粥样硬化
动脉粥样硬化型心血管疾病是导致冠心病、脑梗死的主要因素,低密度脂蛋白(low-density lipoprotein,LDL)的增加对形成动脉粥样硬化的过程中起关键作用[43]。研究发现,丙酸对肠道胆固醇代谢的肠道具有免疫调节作用,丙酸可有效降低血液总胆固醇和低密度脂蛋白胆固醇水平[44],从而减少动脉粥样硬化型心血管疾病的发生。CENTNER A M等[45]通过对载脂蛋小鼠喂食高脂肪饮食发现,丙酸可降低肠道胆固醇吸收和减少主动脉粥样硬化病变的区域。另外,丙酸增加了肠道微环境中的调节性T细胞数量和白细胞介素IL-10水平,这反过来又抑制主要的肠道胆固醇转运蛋白的表达,阻断IL-10受体信号传导,使高脂肪饮食喂养的动脉硬化模型小鼠中与丙酸相关的总胆固醇和LDL胆固醇水平降低,从而降低了动脉粥样硬化病变的严重程度。此外,肠道微生物产生的吲哚-3-丙酸可促进胆固醇反向转运来抑制动脉粥样硬化。XUE H等[46]研究发现,吲哚-3-丙酸可作为膳食补充剂缓解动脉硬化模型小鼠动脉粥样硬化斑块的发育。在小鼠和人源性巨噬细胞中,吲哚-3-丙酸通过促进巨噬细胞反向胆固醇转运,进而促进微小核糖核酸-142-5p(microrna ribonucleic acid-142-5p,miR-142-5p)/三磷酸腺苷结合盒转运体A1基因的表达,而减少的吲哚-3-丙酸会导致miR-142-5p在巨噬细胞中的异常表达,进而抑制了动脉粥样硬化的形成。
3.1.5 对神经保护作用
帕金森病(parkinson's disease,PD)是一种神经退行性疾病,没有绝对的治愈方法。 通过对肠道微生物代谢物的相关研究发现,丙酸具有治疗PD的潜力。HOU Y F等[47]研究肠道微生物群衍生的丙酸盐介导的骨钙素在帕金森病小鼠模型中的神经保护作用发现,调节肠道微生物组和增加丙酸盐水平可以提高骨钙素对PD神经保护作用,且在肠神经系统中,丙酸盐的主要作用位点为游离脂肪酸受体3[48]。研究发现,肠道微生物群代谢产生的吲哚-3-丙酸可在保护小胶质细胞免受炎症方面发挥作用,从而促进神经元功能。KIM C S等[49]研究发现,使用5 μmol/L的吲哚-3-丙酸体外处理可显著降低活化小胶质细胞中炎症因子的浓度,并且用吲哚-3-丙酸处理的小胶质细胞条件培养基培养的神经元细胞和神经生长因子数量均有显著增加。
3.2 丙酸的潜在不良影响
3.2.1 对胰岛素和肥胖的影响
Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)是以高血糖为特征的代谢性疾病[50]。T2DM的发病机制复杂,与遗传、环境因素等联系紧密。近年来,许多研究发现,高剂量的丙酸会导致人体代谢异常,CHAMBERS E S等[51]研究发现,血浆丙酸盐含量高与体质量呈正比关系。摄入高剂量的丙酸能通过调节食欲、影响胰岛素分泌以及改变T2DM患者的血糖影响胰岛素水平[52]。丙酸能穿过人体血液屏障,通过增加血浆中胰高血糖素和脂肪酸结合蛋白4的浓度来促进糖原的溶解,从而导致高血糖。 TIROSH A等[53]研究发现,长时间食用含高剂量丙酸的混合膳食可使餐后的血浆胰高血糖素、脂肪酸结合蛋白4和去甲肾上腺素升高,最终导致胰岛素抵抗和代偿性高胰岛素血症。 综上所述,丙酸可以激活胰岛素反调节信号,从而导致胰岛素抵抗和高胰岛素血症,且随着时间的推移,最终会导致代谢异常和肥胖。
3.2.2 对自闭症谱系障碍影响
自闭症谱系障碍(autism spectrum disorder,ASD)是一种神经发育障碍,包括语言和社交技能的发育缺陷、重复和无序运动的出现、多动、感觉障碍、兴趣限制,有时还会自残[54]。 有研究发现,通过注射高剂量丙酸对孕妇有不利影响,可增加婴儿患ASD的风险。 SHARMA A R等[55]研究发现,高剂量丙酸可在产前和新生儿阶段改变磷酸酶和张力蛋白同源物基因/丝氨酸苏氨酸蛋白激酶、雷帕霉素靶蛋白/糖原合酶激酶(glycogen synthase kinase,GSK)、细胞因子和生长因子等发育分子途径,是导致ASD发病的主要诱因,其具体机制如图3所示[56],丙酸通过抑制糖原合酶激酶3β(GSK3β)影响神经元发育过程中神经元轴突的重塑,而GSK3β可直接诱导Wnt(wingless/integrated,Wnt)信号通路,Wnt信号通路的上调会导致神经元细胞向皮质神经元的分化,也会损害大脑皮层正常功能。丙酸抑制GSK3β的活性,进而上调肾素-血管紧张素系统(renin-angiotensin system,Ras)和重组蛋白β1导致细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)磷酸化,再通过上调细胞周期抑制蛋白P21诱导祖神经细胞分化,抑制神经细胞增殖。 另一项研究表明,丙酸可抑制γ-氨基丁酸(gamma-aminobutyric acid,GABA)转氨酶活性,导致患者出现焦虑相关行为。GABA是神经网络发育中起重要作用的重要因子,通过抑制钙和钠离子通道,进而减少神经递质的活动和神经元回路的早期发育,从而减少神经元活动,最终导致ASD的发生。另外,通过MEEKING M M等[57]研究发现,向小鼠脑室内注射高剂量(0.26 mol/L,pH 7.5,4 μL/次输注)丙酸会改变大脑的脂肪酸代谢,从而导致大鼠的行为和大脑异常,与自闭症患者的行为和大脑异常类似。高剂量的丙酸也可以诱导不同脑区氧化应激,对大鼠脑室内注射高剂量丙酸,会导致大鼠的某些脑区(新皮层、海马、丘脑和纹状体)显示脂质和蛋白质氧化增加,同时大脑皮层大多数过氧化氢酶活性下降,抗氧化酶活性降低[58],最终导致小鼠睁眼的时间显著延迟。因此,在早期给药(如丙酸)可致使发育异常并诱发长期行为缺陷。
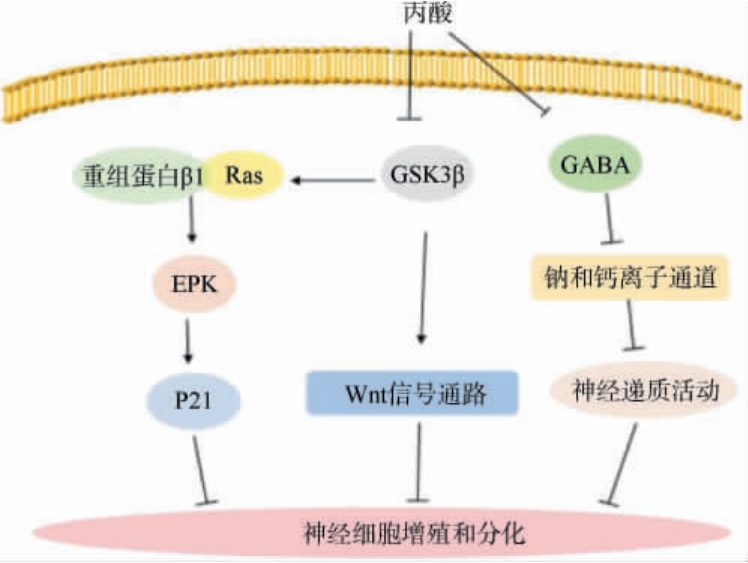
图3 高剂量丙酸对自闭症谱系障碍的影响通路示意图
Fig.3 Schematic diagram of pathway for effects of high doses of propionic acid on autism spectrum disorder
3.2.3 丙酸血症
丙酸血症是由特定氨基酸的分解代谢缺陷引起的先天性代谢缺陷,导致丙酸血症最常见的原因是丙酰-CoA羧化酶缺乏。 当该酶缺乏时,丙酰-CoA不能正常转化为甲基丙二酰-CoA,导致丙酸及其前体物质(如丙酰-CoA)在体内蓄积[59]。 研究显示,丙酸等代谢产物过量易导致心肌细胞线粒体能量代谢紊乱、氧化应激损伤和离子通道受损等心血管受累等[60]。目前,还没有针对丙酸血症有效的治疗药物,只能通过肝移植等技术手段改善这些症状[51]。
4 总结与展望
丙酸可通过调节机体代谢、维护肠道屏障功能和强化免疫应答等途径达到抗炎、调节癌细胞凋亡、促进肠上皮细胞增殖和分化以及治疗动脉粥样硬化等作用,改善人体的健康。虽然国内外研究人员以产酸杆菌为基础研究对丙酸的调节人体健康的作用取得一定成果,但目前的研究多集中在小鼠、大鼠、马和细胞模型上,在其作用剂量上还缺乏深入系统的探讨。此外,在近来的研究中发现,高剂量丙酸会导致丙酸血症、胰岛高血症或对自闭症等。通过研究丙酸的生物学功能,发现在不长期摄入过量丙酸的前提下,丙酸对人体健康有益。因此,在研究丙酸的生物学功能时,针对不同肠道结构和菌群组成特点深入研究和明确丙酸的剂量范围及作用时间等是当前需要解决的问题。
[1]于杰,韩菁,张卓睿,等.桤叶唐棣果酒发酵工艺及有机酸和挥发性成分分析[J].北华大学学报,2021,22(5):588-593.
[2]王夫杰,鲁绯,赵俊平,等.酱油风味及其检测方法的研究进展[J].中国酿造,2010,11(8):1-5.
[3]王瑞,何涛.食品中的丙酸本底含量及产生机理研究进展[J].中国调味品,2015,40(9):104-108.
[4]王强,万发春,刘磊,等.丁酸的生理功能及其在反刍动物中的应用研究进展[J].动物营养学报,2023,35(9):5513-5522.
[5]GOMES S D,OLIVEIRA C S,AZEVEDO-SILVA J,et al.The role of diet related short-chain fatty acids in colorectal cancer metabolism and survival:prevention and therapeutic implications[J].Curr Med Chem,2020,27(24):4087-4100.
[6]LEE H J,AHN H J,KANG C S,et al.Naturally occurring propionic acid in foods marketed in South Korea[J].Food Control,2010,21(2):217-220.
[7]王贵双,高丽华,赵俊平,等.酿造食醋与配制食醋中有机酸的分析研究[J].中国酿造,2011,4(11):146-148.
[8]李永丽,潘中乔亚,于刚,等.食醋固态发酵中丙酸含量变化及生成机理研究[J].检验检疫学刊,2019,29(6):18-19.
[9]李杨,李明达,刘军,等.酱油酿造过程中风味物质的形成与鉴定[J].食品工业科技,2019,40(4):251-256.
[10]谷宝英.离子色谱在酱油组分分析中的应用[J].山西化工,2023,43(4):54-56.
[11]黄紫燕,晁岱秀,朱志伟,等.鱼露快速发酵工艺的研究[J].现代食品科技,2010,26(11):1207-1211,1228.
[12]陈剑,王婉婉,李欢,等.多组学技术解析发酵水产食品风味形成机理研究进展[J].肉类研究,2022,36(9):43-50.
[13]庞惟俏,曲鹏宇,魏程程,等.黑龙江地区6种大豆酱挥发性成分及理化特征分析[J].中国酿造,2017,36(6):81-88.
[14]张玉玉,孙宝国,陈海涛,等.顶空-固相微萃取两种传统面酱挥发性成分的气相色谱-质谱联用分析[J].食品科技,2012,37(3):255-260.
[15]沈祥森.传统毛霉型豆豉中苯甲酸、丙酸形成机理的初步研究[D].重庆:西南大学,2012.
[16]PARK S Y,HAN N,KIM S Y,et al.Evaluation of natural food preservatives in domestic and imported cheese[J].Korean J Food Sci Anim Resour,2016,36(4):531-537.
[17]干佳俪,谭励,王蓓,等.切达奶酪挥发性特征风味物质的多典型相关融合分析[J].中国乳品工业,2021,49(9):12-18,27.
[18]杨小琪,黎源倩,邹晓莉.高效液相色谱法同时检测酸奶中9种有机酸[J].现代预防医学,2014,41(19):3510-3512.
[19]陈淑钧,吴祖芳,刘亚楠,等.基于ROAV法确定雪菜不同发酵条件下的关键挥发性风味物质[J].宁波大学学报(理工版),2024,37(2):18-27.
[20]刘若诗,万晶晶,张坤,等.燕麦酸面团发酵剂的冻干和储藏对面包风味的影响[J].食品科学,2010,31(21):15-19.
[21]叶文彬.产酸丙酸杆菌FS1026丙酸发酵的研究[D].福州:福建师范大学,2016.
[22]赵紫华,仪宏,朱文众,等.丙酸发酵的研究进展[J].中国食品添加剂,2004,11(6):14-18,13.
[23]LIU X T, FENG X J, DING Y M, et al.Characterization and directed evolution of propionyl-CoA carboxylase and its application in succinate biosynthetic pathway with two CO2 fixation reactions[J].Metab Eng,2020,62(6):42-50.
[24]WANG Z Q, EHAB M A, ZHANG A, et al.Engineering Propionibacterium freudenreichii subsp.shermanii for enhanced propionic acid fermentation: Effects of overexpressing propionyl-CoA: Succinate CoA transferase[J].Metab Eng,2015,27(6):46-56.
[25]诸葛鑫.代谢工程改造詹氏丙酸杆菌和过程优化提高丙酸产量[D].无锡:江南大学,2015.
[26]魏立全.丙酸/维生素B12耦合发酵工艺集成及代谢产物组分控制[D].保定:河北大学,2018.
[27]陈倩,李永杰,扈莹莹,等.传统发酵食品中微生物多样性与风味形成之间关系及机制的研究进展[J].食品工业科技,2021,42(9):412-419.
[28]张惠华,梁亚楠,张蕾.短链脂肪酸的检测方法、生理作用及其与疾病的相关性研究[J].当代医药论丛,2019,17(15):97-99.
[29]蒙丹丽,梁列新,宋怀宇.短链脂肪酸在肠道中的生理作用[J].中国临床新医学,2018,11(2):198-202.
[30]JACOBSON A,LAM L,RAJENDRAM M,et al.A gut commensal-produced metabolite mediates colonization resistance to Salmonella infection[J].Cell Host Microbe,2018,24(2):296-307.
[31]王卫,王媛媛,年娟娟.谷氨酰胺薁磺酸钠颗粒联合丙酸氟替卡松雾化吸入治疗儿童支气管肺炎的临床效果[J].中国妇幼保健,2023,38(16):3014-3018.
[32]FILIPPONE A,LANNA M,CAMPOLO M,et al.The anti-inflammatory and antioxidant effects of sodium propionate[J].Int J Mol Sci,2020,21(8):3026-3039.
[33]ALI I,YANG M,WANG Y,et al.Sodium propionate protect the bloodmilk barrier integrity, relieve lipopolysaccharide-induced inflammatory injury and cells apoptosis[J].Life Sci,2021,270(7):119-138.
[34]PARK H S,HAN J H,PARK J W,et al.Sodium propionate exerts anticancer effect in mice bearing breast cancer cell xenograft by regulating jak2/stat3/ros/p38 mapk signaling[J].Acta Pharmacol Sin,2021,42(8):1311-1323.
[35]门操.丙酸氟替卡松乳膏治疗湿疹和皮炎类皮肤病的临床效果观察[J].中国冶金工业医学杂志,2023,40(4):368-374.
[36]MA J H,QIN L,LI X.Role of stat3 signaling pathway in breast[J].Cell Com Signal,2020,18(10):33-42.
[37]WAKE M S,WATSON C J.Stat3 the oncogene-still eluding therapy[J].The FEBS J,2015,282(4):2600-2611.
[38]BILOTTA A J,MA C,YANG W,et al.Propionate enhances cell speed and persistence to promote intestinal epithelial turnover and repair[J].Cell Mol Gastroenter,2021,11(4):1023-1044.
[39]MARTIN G C,MARINELLI L,BLOTTIERE H M,et al.SCFA:mechanisms and functional importance in the gut[J].Pro Nutr Soc,2021,80(1):37-49.
[40]PARADA V D,DE L,FUENTE M K,et al.Short chain fatty acids-mediated gut epithelial and immune regulation and its relevance for inflammatory bowel diseases[J].Front Immunol,2019,10(5):277-281.
[41]HE J,ZHANG P,SHEN L,et al.Short-chain fatty acids and their association with sgnalling pathways in inflammation, glucose and lipid metabolism[J].Int J Mol Sci,2020,21(17):6356-6373.
[42]LI J,ZHANG L,WU T,et al.Indole-3-propionic acid improved the intestinal barrier by enhancing epithelial barrier and mucus barrier[J].J Agr Food Chem,2021,69(5):1487-1495.
[43]KONOPELSKI P,MOGILNICKA I.Biological effects of indole-3-propionic acid,a gut microbiota-derived metabolite,and its precursor tryptophan in mammals health and disease[J].Int J Mol Sci,2022,23(3):1222-1225.
[44]HAGHIKIA A, ZIMMERMANN F, SCHUMANN P, et al.Propionate attenuates atherosclerosis by immune-dependent regulation of intestinal cholesterol metabolism[J].Eur Heart J,2022,43(6):518-533.
[45]CENTNER A M,KHALILI L,UKHANOV V,et al.The role of phytochemicals and gut microbiome in atherosclerosis in preclinical mouse models[J].Nutr,2023,15(5):121-125.
[46]XUE H,CHEN X,YU C,et al.Gut microbially produced indole-3-propionic acid inhibits atherosclerosis by promoting reverse cholesterol transport and its deficiency is causally related to atherosclerotic cardiovascular disease[J].Circ Res,2022,131(5):404-420.
[47]HOU Y F,SHAN C,ZHUANG S Y,et al.Gut microbiota-derived propionate mediates the neuroprotective effect of osteocalcin in a mouse model of Parkinson's disease[J].Microbiome,2021,9(1):34-41.
[48]FUNG C, COOLS B, MALAGOLA S, et al.Luminal short-chain fatty acids and 5-HT acutely activate myenteric neurons in the mouse proximal colon[J].Neurogastroent Motil,2021,33(12):141-186.
[49]KIM C S,JUNG S,HWANG G S,et al.Gut microbiota indole-3-propionic acid mediates neuroprotective effect of probiotic consumption in healthy elderly:A randomized,double-blind,placebo-controlled,multicenter trial and in vitro study[J].Int J Mol Sci,2023,42(6):1025-1033.
[50]党崇舒,赵可新,李华文,等.肠道短链脂肪酸与2型糖尿病相关性研究进展[J].中国微生态学杂志,2021,33(12):1471-1475.
[51]CHAMBERS E S,BYRNE C S,MORRISON D J,et al.Dietary supplementation with inulin-propionate ester or inulin improves insulin sensitivity in adults with overweight and obesity with distinct effects on the gut microbiota,plasma metabolome and systemic inflammatory responses:a randomised cross-over trial[J].Gut,2019,68(8):1430-1438.
[52]LEIVA T,COOKE R F,BRANDAOO A P,et al.Effects of supplemental calcium salts of palm oil and chromium-propionate on insulin sensitivity and productive and reproductive traits of mid-to late-lactating Holstein×Gir dairy cows consuming excessive energy[J].J Dairy Sci,2018,101(1):491-504.
[53]TIROSH A, CALAY E S, TUNCMAN G, et al.The short-chain fatty acid propionate increases glucagon and FABP4 production, impairing insulin action in mice and humans[J].Sci Transl Med,2019,11(489):141-153.
[54]HIROTA T,KING B H.Autism spectrum disorder:A review[J].Res Dev Disa,2023,329(2):157-168.
[55]SHARMA A R,BATRA G,SAINI L,et al.Valproic acid and propionic acid modulated mechanical pathways associated with autism spectrum disorder at prenatal and neonatal exposure[J].CNS Neurol Disord Drug Targets,2022,21(5):399-408.
[56]HOU Q, WANG Y, LI Y, CHEN D, et al.A development study of abnormal behaviors and altered gabaergic signaling in the VPA-treated rat model of autism[J].Front Behav Neurosci,2018,12(10):173-182.
[57]MEEKING M M,MACFABE D F,MEPHAM J R,et al.Propionic acid inducedbehavioural effectsofrelevance to autism spectrum disorder evaluated in the hole board test with rats[J].Prog Neuro-Psychoph,2020,97(5):1097-1114.
[58]MACFABE D F, RODRIGUEZ-CAPOTE K, HOFFMAN J E, et al.A novel rodent model of autism: intraventricular infusions of propionic acid increase locomotor activity and induce neuroinflammation and oxidative stress in discrete regions of adult rat brain[J].J Biochem Biotechnol,2008,4(2):146-166.
[59]ALFADHEL M, NASHABAT M, SALEH M, et al.Long-term effectiveness of carglumic acid in patients with propionic acidemia(PA)and methylmalonic acidemia(MMA):a randomized clinical trial[J].Orphanet J Rare Dis,2021,16(1):422-437.
[60]刘鹰,武育蓉,孙锟.丙酸血症的心血管受累表现及机制[J].上海交通大学学报(医学版),2021,41(6):799-802.