作为浓香型白酒酿造的基石,窖泥主要由特殊土壤、麸曲、黄水、己酸菌培养液以及酒尾等多种成分混合而成,蕴含着丰富的细菌、古菌与真菌等微生物菌群,主要包括乳酸菌、梭菌属(Clostridium sp.)、产己酸菌属(Caproiciproducens sp.)、芽孢杆菌属(Bacillus sp.)和产甲烷菌等功能菌群[1]。在发酵过程中,窖泥蕴含的微生物会进入酒醅,参与糖化发酵等关键环节[2],利用酒醅中的有机物质进行代谢,产生乙酸、丙酸、乳酸、己酸和丁酸等挥发性脂肪酸及醇类、醛类和酯类等多种风味物质,赋予酒体独特的口感和风味[3]。研究表明,窖泥中微生物群落的多样性因窖龄、产地和质量等因素的不同而存在明显差异,窖泥微生物的差异进一步对浓香型白酒的风格产生影响[4]。因此,对窖泥中微生物多样性的全面解析,是揭示浓香型白酒质量和风味特征的基础和关键。
MiSeq高通量测序技术具有测序时间短、测序通量高和准确度较高的优势,可以完整地测定微生物群落[5],被广泛应用于窖泥微生物的研究。LIU Y等[6]通过MiSeq高通量测序技术对陶融型白酒窖泥的微生物多样性进行解析,发现窖泥优势细菌属由氢孢菌属(Hydrogenispora)、理研菌属(Petrimonas)和Caproiciproducens等组成,优势真菌属由嗜热子囊菌属(Thermomyces)、根霉菌属(Rhizopus)和曲霉菌属(Aspergillus)等组成。本研究团队曾对湖北古襄阳酒业有限公司浓香型白酒窖泥[7]和人工窖泥[8]的细菌菌群多样性进行了解析,发现两种窖泥中均含有优势细菌属芽孢杆菌属,刘燕梅等[9]进一步采用纯培养技术从窖泥中分离鉴定得到解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和枯草芽孢杆菌(Bacillus subtilis)等多种芽孢杆菌菌株,同时发现这些菌株能够代谢生成大量3-羟基-2-丁酮、2-3-丁二醇和微量的2-戊酸、愈创木酚等风味物质,对浓香型白酒的风味有调节作用。由此可见,采用MiSeq测序解析窖泥微生物多样性和采用纯培养技术挖掘窖泥中芽孢杆菌资源是可行的。
本研究从老河口光化特酒业有限公司采集了3份窖泥样品,通过MiSeq高通量测序技术分析其微生物多样性,并结合纯培养技术从窖泥样品中分离、纯化和鉴定芽孢杆菌,以期对窖泥微生物多样性进行全面解析,并为窖泥品质的提升提供理论依据和菌株支持。
1 材料与方法
1.1 材料与试剂
1.1.1 窖泥
从老河口光化特酒业有限公司窖泥车间的70年窖龄窖池中采集样品。抽干窖池黄水后,从窖壁的上层(距地面20 cm)、中层(距地面90 cm)和下层(距窖底10 cm)3个位置采集窖泥,每一层级中,分别自四个角落及窖壁中间位置采集窖泥样品并混合均匀,装入无菌采样袋中,低温运送回实验室,3份样品分别命名为G1、G2和G3。
1.1.2 试剂
QIAGENDNeasymericonFoodKit试剂盒:德国QIAGEN公司;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)、10×聚合酶链式反应(polymerase chain reaction,PCR)缓冲液、pMD18-T Vector、2×Taq PCR Master Mix:宝生物工程(大连)有限公司;引物338F/806R和ITS3F/ITS4R:上海赛恒生物科技有限公司。
1.1.3 培养基
营养琼脂(nutrient agar,NA)培养基:上海展云化工有限公司;MiSeq高通量测序配套试剂:美国Illumina公司。
1.2 仪器与设备
SE-CJ-2D型双人单面净化工作台:苏州安泰空气技术有限公司;DHP-9032电热恒温培养箱:上海一恒科学仪器有限公司;ECLIPSE Ci生物显微镜:日本Nikon公司;Veriti FAST梯度PCR仪:美国ABI公司;MiSeq PE300高通量测序平台:美国Illumina公司;R930机架式服务器:美国DELL公司。
1.3 方法
1.3.1 宏基因组DNA的提取及PCR扩增
依照QIAGEN DNeasy mericon Food Kit试剂盒使用说明书对窖泥样品中微生物宏基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)进行提取,以其为模板,使用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌16SrRNAV3-V4区基因序列进行PCR扩增,使用引物ITS3F(5'-GCATCGATGAAGAACGCAGC-3')和ITS4R(5'-TCCTCCGCTTATTGATATGC-3')对真菌ITS区基因序列进行PCR扩增,PCR扩增体系和扩增程序参照HOU Q等[10]的方法。
1.3.2 高通量测序及生物信息学分析
使用1.0%琼脂糖凝胶电泳检测PCR扩增产物,将检测合格的PCR扩增产物送至上海美吉生物医药科技有限公司进行MiSeq高通量测序。基于QIIME(v1.9.0)分析平台,参照WANG Y等[11]的方法将下机序列进行生物信息学分析,确定微生物菌群分类学地位,并计算窖泥中微生物α多样性指数。
1.3.3 芽孢杆菌的分离及鉴定
分离:采用倍比稀释涂布法将10-4、10-5和10-9梯度窖泥稀释液涂布于NA培养基上,37 ℃好氧培养2 d,根据《常见细菌系统鉴定手册》挑选疑似芽孢杆菌的菌株进行初步分离,经3次平板划线纯化后进行革兰氏染色镜检,使用30%甘油将镜检结果为纯种的菌株于-80 ℃超低温冰箱中冷冻保存。
鉴定:使用十六烷基三甲基溴化铵法提取分离菌株的基因组DNA,使用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1495R(5'-CTACGGCTACCTTCTTACGA-3')对其进行PCR扩增,经过1%琼脂糖凝胶电泳检验合格后委托上海桑尼生物科技有限公司进行测序。返回序列经拼接和去引物后,在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,选取序列相似度≥99%的模式菌株的16S rRNA基因序列,采用MEGA 7.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.4 数据处理
使用Origin 2024软件绘图,使用MEGA 7.0和R语言软件绘制系统发育树。
2 结果与分析
2.1 基于MiSeq高通量测序技术窖泥微生物菌群的α多样性分析
Chao1指数常用于表示微生物的丰富度,其值越大,表明群落的丰富度越高。Shannon指数常用于表示微生物的多样性,其值越大,表明群落的多样性越高[12]。3个窖泥样品的细菌和真菌群落的α多样性指数见图1。
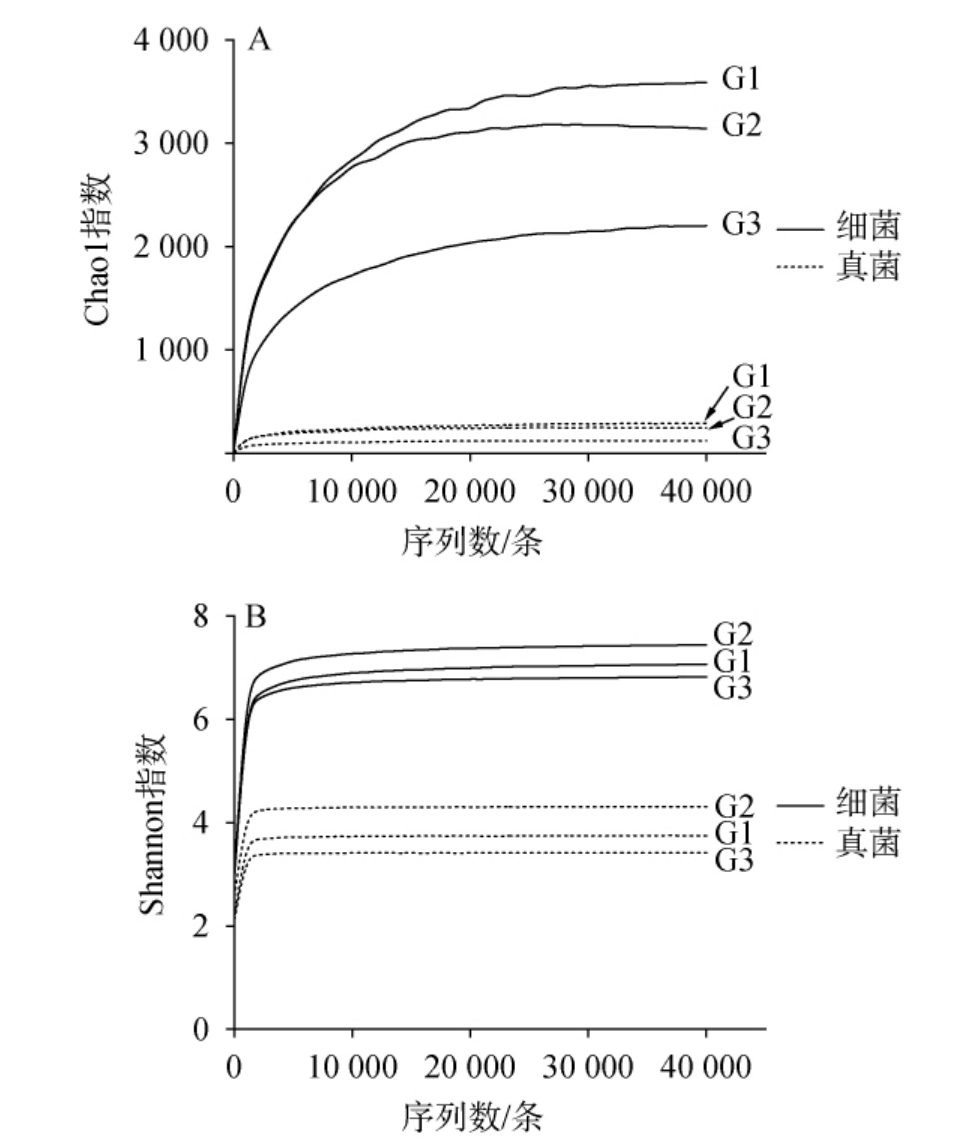
图1 窖泥样品中细菌(A)和真菌(B)群落的α多样性分析结果
Fig.1 Alpha diversity analysis results of bacterial (A) and fungus (B)communities in pit mud
由图1A可知,3个窖泥样品细菌群落的Chao1指数分别为3 586、3 141和2 200,真菌群落的Chao1指数分别为291、245和122。由图1B可知,窖泥样品细菌群落的Shannon指数分别为7.07、7.44和6.82,真菌群落的Shannon指数分别为3.75、4.31和3.42。经Mann-Whitney检验发现,窖泥样品细菌和真菌群落的α多样性指数之间存在极显著差异(P<0.01),说明窖泥样品的细菌群落丰富度和多样性均极显著高于真菌群落。
2.2 基于MiSeq高通量测序技术窖泥微生物菌群结构分析
经数据库比对后172848条16SrRNA序列被鉴定为20个细菌门和283个细菌属,191 052条ITS序列被鉴定为6个真菌门和75个真菌属。将3份窖泥样品中平均相对丰度>1.0%的门和属分别定义为优势门和属,基于门和属水平窖泥样品中细菌及真菌菌群结构分别见图2和图3。
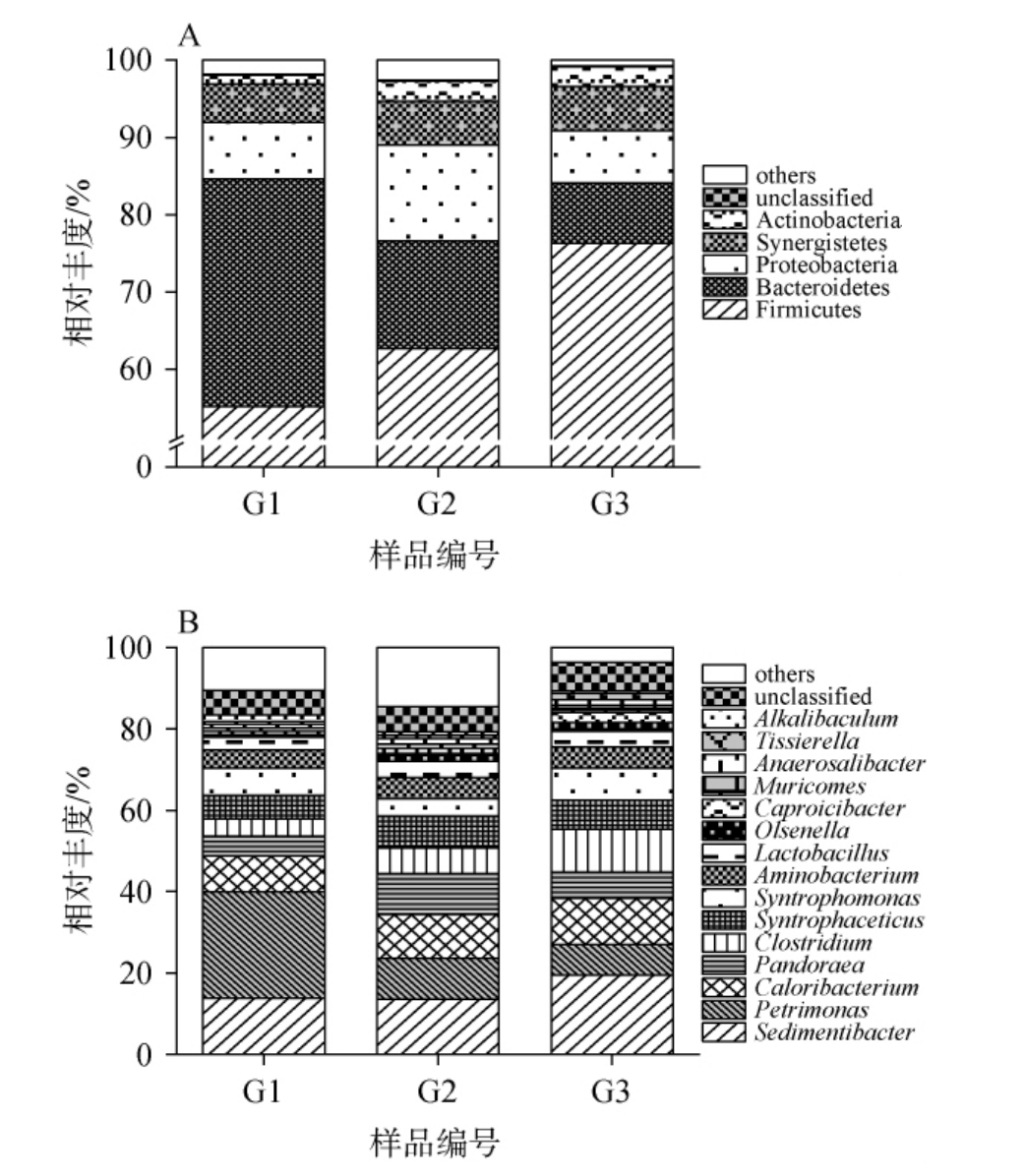
图2 基于门(A)和属(B)水平窖泥样品中细菌菌群结构
Fig.2 Bacterial flora structure in pit mud samples based on phylum(A) and genus (B) levels
others表示平均相对丰度≤1.00%的门或属。下同。
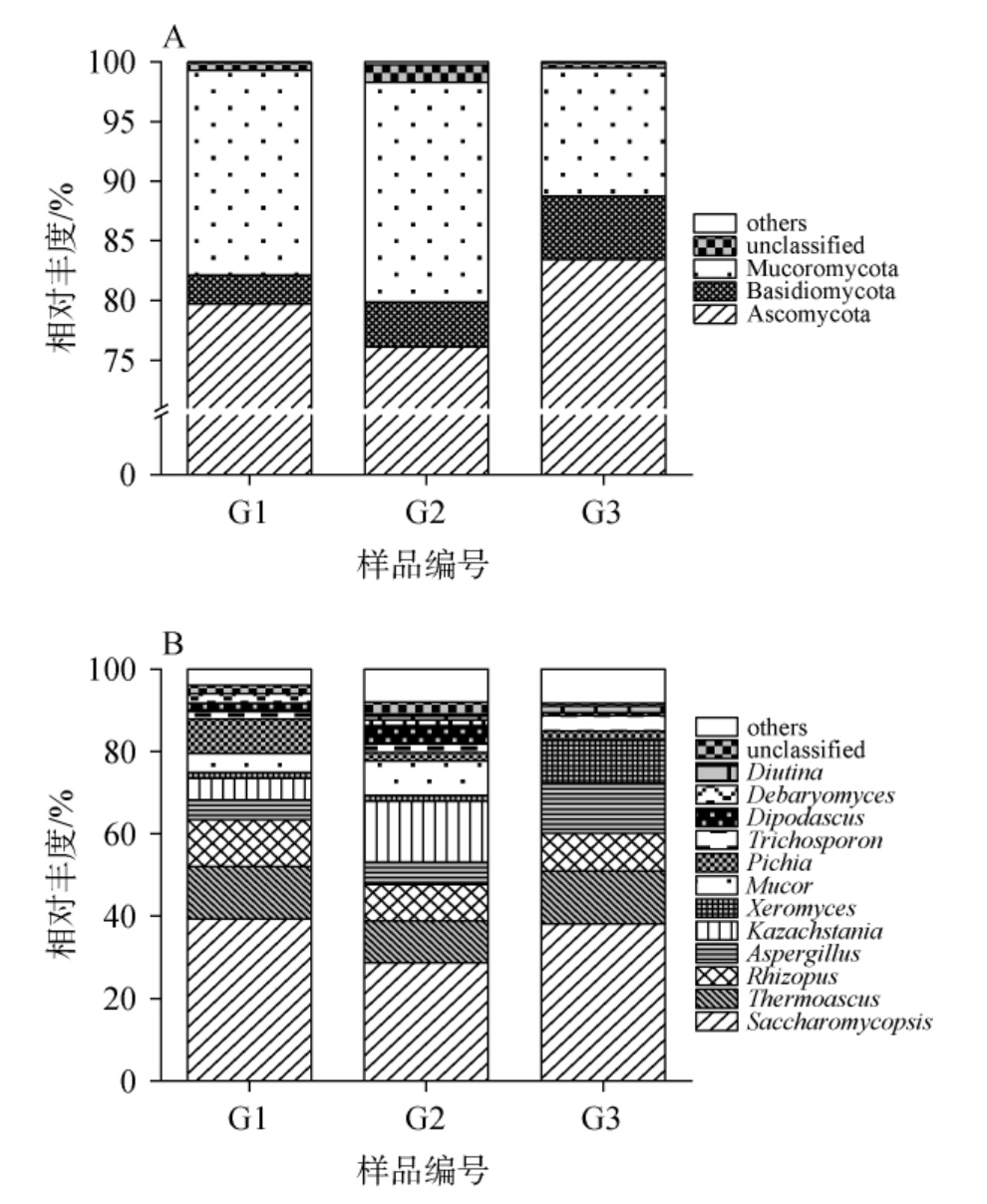
图3 基于门(A)和属(B)水平窖泥样品中真菌菌群结构
Fig.3 Fungus flora structure in pit mud samples based on phylum(A) and genus (B) levels
由图2A可知,从窖泥样品中共鉴定出5个优势细菌门,分别为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形杆菌门(Proteobacteria)、互养菌门(Synergistes)和放线菌门(Actinobacteria),其平均相对丰度分别为64.72%、17.05%、8.84%、5.44%和2.09%。其中,Firmicutes是第一细菌优势门,究其原因可能是由于隶属于Firmicutes的部分细菌可以产生芽孢或者孢子,抵抗脱水和高温环境,具有很强的环境适应性,能够在相对极端的条件下维持生长和代谢[13]。
由图2B可知,从窖泥样品中共鉴定出15个优势细菌属,分别为沉淀杆菌属(Sedimentibacter)、理研菌属(Petri-monas)、热量杆菌属(Caloribacterium)、潘多拉菌属(Pandoraea)、梭菌属(Clostridium)、施林克乙酸互营菌属(Syntrophaceticus)、互营单胞菌属(Syntrophomonas)、氨基杆菌属(Aminobacterium)、乳酸杆菌属(Lactobacillus)、欧氏菌属(Olsenella)、卡普罗西杆菌属(Caproicibacter)、鼠伴菌属(Muricomes)、厌氧杆菌属(Anaerosalibacter)、泰式菌属(Tissierella)和碱杆菌属(Alkalibaculum),其平均相对丰度分别为15.62%、14.58%、10.28%、7.10%、7.05%、6.96%、6.23%、4.99%、3.67%、1.57%、1.50%、1.23%、1.17%、1.08%和1.01%。基于高通量测序技术,TAN G等[14]对采集自湖北省宜昌市窖泥中的细菌菌群多样性进行解析,发现核心细菌属为Syntrophaceticus、Clostridium、Syntrophomonas、Petrimonas、Sedimentibacter和Aminobacterium等,与本研究结果一致。Sedimentibacter和Clostridium属于产氢、产酸细菌种属,能够降解氨基酸生成丁酸、乙醇、乙酸和乳酸等酸性物质,有助于酒体风格的调整和口感的提升[15]。 Petrimonas能够利用葡萄糖、半乳糖和乳糖产生乙酸和丙酸等风味化合物,且该菌能够与己酸菌相互作用产生戊酸和庚酸,赋予酒体香气,减轻酒体的刺激性[16]。Caloribacterium能够以葡萄糖为发酵底物,产生乙酸、氢气和二氧化碳等前体物质,进一步发酵产生乙酸乙酯等香气物质,改善酒体的香气[17]。值得一提的是,在G1和G2样品中有10.51%和14.50%的细菌序列未鉴定到属水平,说明窖泥样品中的细菌资源仍有待发掘。
由图3A可知,从窖泥样品中共鉴定出3个优势真菌门,分别为子囊菌门(Ascomycota)、毛霉菌门(Mucoromycota)和担子菌门(Basidiomycota),其平均相对丰度分别为79.75%、15.44%和3.85%。由图3B可知,从窖泥样品中共鉴定出12个优势真菌属,分别为复膜孢酵母属(Saccharomycopsis)、嗜热子囊菌属(Thermoascus)、根霉菌属(Rhizopus)、曲霉菌属(Aspergillus)、卡扎斯坦酵母属(Kazachstania)、耐干霉菌属(Xeromyces)、毛霉菌属(Mucor)、毕赤酵母 属(Pichia)、丝 孢 酵 母 属(Trichosporon)、双 足 囊 菌 属(Dipodascus)、德巴利氏酵母属(Debaryomyces)和Diutina,其平均相对丰度分别为35.40%、11.86%、9.81%、7.45%、6.64%、4.47%、4.43%、4.11%、2.49%、2.47%、1.17%和1.00%。基于高通量测序技术,GONG Y等[18]对采集自四川省宜宾五粮液集团窖泥的真菌多样性进行解析,发现优势真菌属为Aspergillus、Thermoascus和Pichia,这与本研究结果相同。
Aspergillus属于产酶真菌属,能够分泌糖化酶和蛋白酶等多种酶,将淀粉等大分子物质转化为葡萄糖和氨基酸等小分子物质,进一步产生苯乙酸乙酯和苯甲醛等风味物质,提升酒体的风味品质[19]。 Thermoascus作为具有较强热稳定性的菌属,能够产生多种耐热的水解酶和高热稳定性的木聚糖酶等,提升高温发酵的原料利用率[20]。此外,窖泥中亦含有大量Saccharomycopsis和Rhizopus。Saccharomycopsis作为白酒发酵的重要产酶菌种,能高效分泌α-淀粉酶、β-葡萄糖苷酶和酸性蛋白酶,进一步发酵产生酸类、酯类和醇类等风味物质,赋予酒体不同的风味特征[21]。Rhizopus能够产生糖化酶和淀粉酶,降解淀粉产生葡萄糖,进一步发酵产生柠檬酸、琥珀酸和乳酸等有机酸,提升酒体口感的丰满度[22]。
2.3 基于纯培养技术窖泥中芽孢杆菌的分离与鉴定
作为白酒酿造的重要组成部分,芽孢杆菌的次级代谢产物能与窖泥中众多物质相互作用和反应,维持窖泥酸碱度环境的稳定[23],因而进一步对窖泥中的芽孢杆菌进行分离鉴定,结果从窖泥中共分离得到7株疑似芽孢杆菌菌株,编号为G1-1、G1-2、G2-1~G2-3、G3-1、G3-2,其菌落和细胞形态见图4。
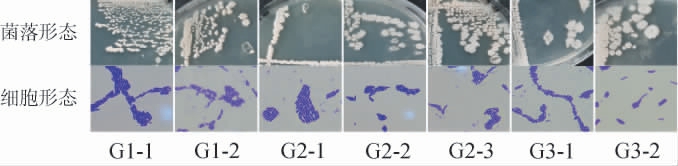
图4 窖泥中芽孢杆菌分离株的菌落形态和细胞形态
Fig.4 Colony morphology and cell morphology of isolated Bacillus strains in pit mud
由图4可知,菌株G1-1和G1-2的菌落形态小,呈现黄白色,突起有光泽,边缘不规则。菌株G2-1、G2-2和G2-3的菌落形态大,呈现微白色,表面粗糙有隆起,边缘不规则。菌株G3-1和G3-2的菌落形态大,呈现黄白色,表面扁平粗糙,有褶皱。所有菌株均为革兰氏阳性菌,细胞形态呈现长短不一的杆状。进一步基于16S rRNA基因序列构建分离菌株的系统发育树,结果见图5。
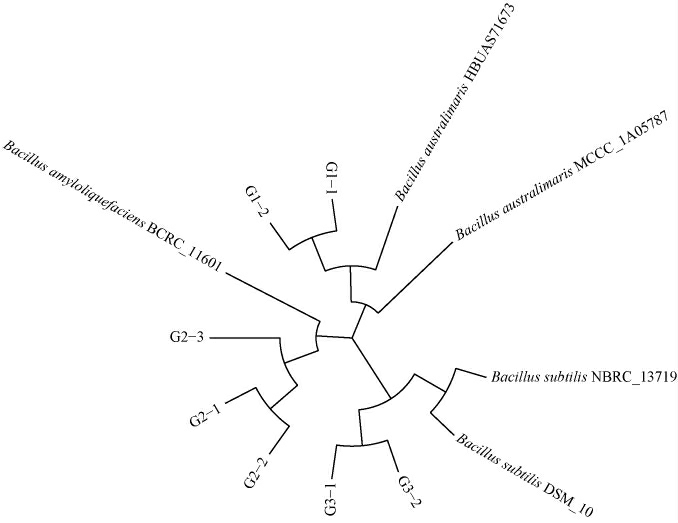
图5 基于16S rRNA基因序列窖泥中芽孢杆菌分离株的系统发育树
Fig.5 Phylogenetic tree of isolated Bacillus strains in pit mud based on 16S rRNA gene sequences
由图5可知,结合形态学特征,7个分离株分别被鉴定为3个种,其中菌株G2-1、G2-2和G2-3被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),菌株G1-1和G1-2被鉴定为澳洲芽孢杆菌(Bacillus australimaris),菌株G3-1和G3-2被鉴定为枯草芽孢杆菌(Bacillus subtilis)。由此可见,3份窖泥样品中可培养的芽孢杆菌以B.amyloliquefaciens、B.australimaris和B.subtilis为主。作为主要增香细菌,芽孢杆菌具有很强的产酶能力,例如:Bacillus amyloliquefaciens能分泌蛋白酶、纤维素酶、淀粉酶、木聚糖酶和果胶酶等,有利于淀粉利用率和白酒产量的提升[24];Bacillus subtilis可以产生α-淀粉酶、糖化酶和脂肪酶等,参与白酒发酵,产生琥珀酸,降低酒体中乳酸的含量[25];Bacillus australimaris能够分泌高水平的木聚糖酶,将木聚糖分解为果糖和葡萄糖,进而提高酒体中高级醇的含量[26]。因此,在后续研究中应进一步扩大样本的采集区域和数量,从优质窖泥中分离并筛选有益芽孢杆菌,并对该菌株的代谢特性和酿酒生产应用等方面进行更深入的研究,以期为窖泥强化提供菌株支撑。
3 结论
使用MiSeq高通量测序技术对老河口光化特酒业有限公司窖泥微生物多样性进行解析发现,窖泥细菌菌群丰富度和多样性均极显著高于真菌(P<0.01),从中共鉴定出15个优势细菌属(平均相对丰度>1%),包括沉Sedimentibacter(15.62%)、Petrimonas(14.58%)和Caloribacterium(10.28%)等;共鉴定出12个优势真菌属,包括Saccharomycopsis(35.40%)、Thermoascus(11.86%)、Rhizopus(9.81%)和Aspergillus(7.45%)等。采用纯培养技术从窖泥中共分离鉴定得到7株芽孢杆菌,分别为3株解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、2株澳洲芽孢杆菌(Bacillus australimaris)和2株枯草芽孢杆菌(Bacillus subtilis)。本研究结果能够了解窖泥微生物的多样性,并挖掘窖泥中的芽孢杆菌,为后续窖泥功能微生物的筛选提供一定的菌株支撑。
[1]龚虎程,王宇,罗静,等.窖泥中酯化菌的筛选鉴定及协同发酵条件优化[J].中国酿造,2023,42(12):81-86.
[2]LIU M K,TANG Y M,GUO X J,et al.Structural and functional changes in prokaryotic communities in artificial pit mud during Chinese Baijiu production[J].mSystems,2020,5(2):101128.
[3]周晓静,周文,杨官荣,等.浓香型白酒窖泥功能微生物对风味物质形成的影响研究[J].酿酒,2022,49(5):29-33.
[4]张应刚,许涛,郑蕾,等.窖泥群落结构及功能微生物研究进展[J].微生物学通报,2021,48(11):4327-4343.
[5]DRITSOULAS A, CAMPOS-HERRERA R, BLANCO-PEREZ R, et al.Comparing high throughput sequencing and real time qPCR for characterizing entomopathogenic nematode biogeography[J].Soil Biol Biochem,2020,145(6):107793.
[6]LIU Y,SUN M,HOU P,et al.Analysis of microbial community structure and volatile compounds in pit mud used for manufacturing Taorong-type Baijiu based on high-throughput sequencing[J].Sci Rep,2022,12(5):7347.
[7]杨小丽,尚雪娇,余海忠,等.基于Miseq高通量测序技术的古襄阳酒窖泥细菌多样性评价[J].中国酿造,2018,37(7):26-30.
[8]杨少勇,贺子豪,李娜,等.人工培养窖泥中微生物菌群多样性解析[J].中国酿造,2023,42(12):99-103.
[9]刘燕梅,王艳丽,汪文鹏,等.浓香型白酒窖泥中芽孢杆菌的分离鉴定及代谢产物分析[J].中国酿造,2017,36(7):76-79.
[10]HOU Q, WANG Y, NI H, et al.Deep sequencing reveals changes in prokaryotic taxonomy and functional diversity of pit muds in different distilleries of China[J].Ann Microbiol,2022,72(1):1-14.
[11]WANG Y, SHE M, GUO Z, et al.Determination of fungal diversity of acidic gruel by using culture-dependent and independent methods[J].Food Sci Nutr,2020,8(11):5832-5840.
[12]ZHANG M,WU X,MU D,et al.Profiling the effects of physicochemical indexes on the microbial diversity and its aroma substances in pit mud[J].Lett Appl Microbiol,2020,71(6):667-678.
[13]车丽娜,赵良忠,周晓洁.基于高通量测序的湘派卤牛肉细菌多样性分析[J].食品与机械,2023,39(2):113-119,197.
[14]TAN G,HU Y,HUANG Y,et al.Analysis of bacterial communities in pit mud from Zhijiang Baijiu distillery using denaturing gradient gel electrophoresis and high-throughput sequencing[J].J I Brewing,2020,126(1):90-97.
[15]翟磊,刘瑞娜,张京涛,等.浓香型白酒窖池中细菌群落结构的研究[J].食品与发酵工业,2023,49(13):78-84.
[16]郑慧珍,王慧琳,高江婧,等.窖泥优势拟杆菌纲微生物Petrimonas sulfuriphila的分离及其功能解析[J].微生物学报,2022,62(9):3373-3386.
[17]SLOBODKINA G B, KOLGANOVA T V, KOSTRIKINA N A, et al.Caloribacterium cisternae gen.nov.sp.nov.,an anaerobic thermophilic bacterium from an underground gas storage reservoir[J].Int J Syst Evol Microbiol,2012,62(7):1543-1547.
[18]GONG Y,MA N,TANG H.Analysis of microbial community diversity and physicochemical factors in pit mud of different ages based on highthroughput sequencing[J].Can J Microbiol,2022,68(11):674-686.
[19]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and microbial communities: A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121(7):422-432.
[20]ZHANG M, PURI A K, WANG Z X, et al.A unique xylose reductase from Thermomyces lanuginosus:Effect of lignocellulosic substrates and inhibitors and applicability in lignocellulosic bioconversion[J].Biores Technol,2019,102(2):374-381.
[21]XIE Z B,ZHANG Z K,KANG Z,et al.Saccharomycopsis fibuligera in liquor production:A review[J].Eur Food Res and Technol,2021,247(4):1569-1577.
[22]JIANG Q,WU X,XU Y,et al.Microbial composition and dynamic succession during the Daqu production process of Northern Jiang-flavored liquor in China[J].3 Biotech,2021,11(5):1-15.
[23]胡世伟,王超凡,王景春,等.浓香型白酒窖泥微生物群落及其风味成分研究进展[J].中国酿造,2023,42(12):9-12.
[24]蒋倩儿,陈文浩,孙金沅,等.酱香型白酒大曲微生物研究进展[J].中国酿造,2021,40(12):1-5.
[25]郭学武,范恩帝,马冰涛,等.中国固态发酵白酒中功能细菌研究进展[J].食品与发酵工业,2020,46(1):280-286.
[26]DUTTA P D,NEOG B,GOSWAMI T.Xylanase enzyme production from Bacillus australimaris P5 for prebleaching of bamboo (Bambusa tulda)pulp[J].Mater Chem Phys,2020,243(3):122227.