“以曲酿酒”是我国白酒酿造工艺的典型特征,大曲为酒醅发酵提供了微生物和相关酶以及香味前体物质,对中国白酒香味物质的形成发挥重要作用[1-3]。大曲采用传统自然发酵技术生产,首先将谷物磨碎后与水混匀,压成砖块,在控制温度和通风的条件下,将砖块一层一层地堆积在发酵房中自然发酵30~40 d,然后经过3~6个月的储藏后即可使用[4]。根据香味的特征,大曲可以分为3种主要类型,即清香型、浓香型和酱香型白酒大曲[5]。清香型白酒大曲通常是由豌豆和大麦在温度低于50 ℃条件发酵形成的,浓香型白酒大曲是由豌豆和大麦或纯小麦在温度低于60 ℃条件发酵形成的,而酱香型白酒大曲是由小麦或小麦与豌豆混合在温度低于70 ℃条件发酵形成的[6-8]。
在大曲发酵过程,来自谷物和环境中的微生物可以在大曲中繁殖。而微生物的繁殖和代谢会产生大量的热量,导致大曲升温,这种升温反过来又会影响大曲中微生物群落的更替。目前由于缺乏统一的机械化工艺,大曲的生产还主要是依赖工人的经验,不同原料、制曲工艺的差异,以及区域小环境的不同,都会导致不同酒企大曲微生物群落多样性的差异。
研究大曲微生物群落是研究大曲发酵机理的重要步骤之一。目前,采用不依赖分离培养的方法研究大曲中微生物多样性和群落研究较多,但主要聚焦在同一香型不同发酵阶段大曲微生物多样性和群落的变化[9-11],关于比较3种香型(浓香型、清香型、酱香型)白酒大曲中微生物群落差异的研究鲜见报道[12-14]。因此,为了全面地揭示3种香型白酒大曲中微生物群落的多样性,该研究从全国17个企业采集20份(3种香型)大曲样本,利用高通量测序技术分析其群落组成及多样性,并基于多元统计分析比较不同香型白酒大曲微生物群落的差异,为进一步解析大曲微生物及微生物筛选等工作提供基础数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
从全国17个企业收集了20份大曲样品,其中清香型大曲9份(QX1~QX9)、浓香型大曲6份(NX1~NX6)、酱香型大曲5份(JX1~JX5),大曲样品具体信息见表1,将收集后的大曲研磨成粉末并在4 ℃和-80 ℃保存备用。
表1 20份大曲样品信息
Table 1 The information of 20 Daqu samples

型 制曲温度 样品编号 原料 产地清香型白酒大曲40~50 ℃浓香型白酒大曲50~60 ℃酱香型白酒大曲60~70 ℃QX_1 QX_2 QX_3 QX_4 QX_5 QX_6 QX_7 QX_8 QX_9 NX_1 NX_2 NX_3 NX_4 NX_5 NX_6 JX_1 JX_2 JX_3 JX_4 JX_5豌豆、大麦豌豆、大麦豌豆、大麦豌豆、大麦豌豆、大麦豌豆、大麦豌豆、大麦、小麦豌豆、大麦豌豆、大麦豌豆、大麦豌豆、大麦小麦豌豆、大麦、小麦豌豆、大麦、小麦豌豆、大麦、小麦小麦小麦小麦豌豆、大麦豌豆、大麦山西山西山西山西福建黑龙江北京北京河北四川四川四川四川四川江苏贵州贵州贵州山东山东
1.1.2 化学试剂
三氯甲烷(99%)、月桂酸钠(99%)、异戊醇(98%)、异丙醇(98%):上海生工生物工程有限公司;乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)(99%)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(99%)、三羟甲基氨基甲烷(99%)、Tris饱和酚(分析纯):北京索莱宝科技有限公司;2×Taq Plus Master Mix:南京诺唯赞生物科技股份有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
1-14k高速冷冻离心机:德国Eppendorf公司;C1000快速梯度基因聚合酶链式反应(polymerase chain reaction,PCR)扩增仪、Powerpac Basic基础型水平电泳仪、GelDoc XR+BIO-RAD全自动凝胶成像仪:美国BIORAD公司:Illumina MiSeq测序仪:北京奥维森基因科技有限公司。
1.3 方法
1.3.1 微生物宏基因组DNA的提取及高通量测序
参考文献[15]提取大曲样品中微生物的宏基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)。将DNA检测合格后,以其为模板,采用引物338F(5'-ACTCCTACGGGAGGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')PCR扩增细菌16S rDNA V3-V4区基因序列,采用引物ITS1(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2(5'-TGCGTTCTTCATCGATGC-3')PCR扩增真菌ITS1-ITS2区基因序列。PCR扩增体系(30 μL):2×Taq Plus Master Mix 15 μL、上下游引物(10 μmol/L)各1 μL、DNA模板1.5 μL、双蒸水(ddH2O)11.5 μL。PCR扩增程序:95 ℃预变性5 min;94 ℃变性50 s,50 ℃退火1 min,72 ℃延伸45 s,共30个循环;72 ℃再延伸10 min。委托北京奥维森公司利用Illumina MiSeq测序平台对大曲细菌16S V3-V4区、真菌ITS1-ITS2区基因序列进行高通量测序。
1.3.2 数据处理与生物信息学分析
下机数据经拼接、过滤、剔除嵌合体,舍弃低质量序列等得到clean tags,利用USEARCH(v11.0.667)对clean tags进行过滤和分析,按97%的相似性划分操作分类单元(operational taxonomic unit,OTU),提取OTU代表序列获得丰度表,其中真菌利用UNITE数据库(https://unite.ut.ee/analysis.php),细菌利用Silva 132数据库(https://www.arb-silva.de)对代表序列进行比对,得到OTU的物种分类信息(界、门、纲、目、科、属)。测序数据利用Mothur(v1.42.1)进行均一化处理,计算Alpha多样性指数(Chao1指数、Shannon指数等)。
1.3.3 统计分析
利用R软件绘制Chao1指数、Shannon指数的直方图,并用t检验确定不同香型大曲之间的差异显著性。利用R软件中的Vegan包基于Bray-Curtis距离对每个样品的OTU进行主坐标分析(principal co-ordinates analysis,PCoA),利用R软件中的ggplot2包绘制菌门、属组成柱状图。利用网址http://huttenhower.sph.harvard.edu/lefse/对所有注释的OTU进行线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)分析。
2 结果与分析
2.1 3种香型白酒大曲中微生物群落Alpha多样性的差异
经过Illumina MiSeq平台高通量测序和一系列质控后,共获得可分类的16S rDNA基因序列1 837 432条和ITS rDNA基因序列3 952 505条,根据97%的相似性将序列共划分到920个细菌OTUs和471个真菌OTUs。为了比较不同香型白酒大曲中微生物丰度和多样性的差异,进一步根据OTU计算得到Chao1指数和Shannon指数,结果见图1。
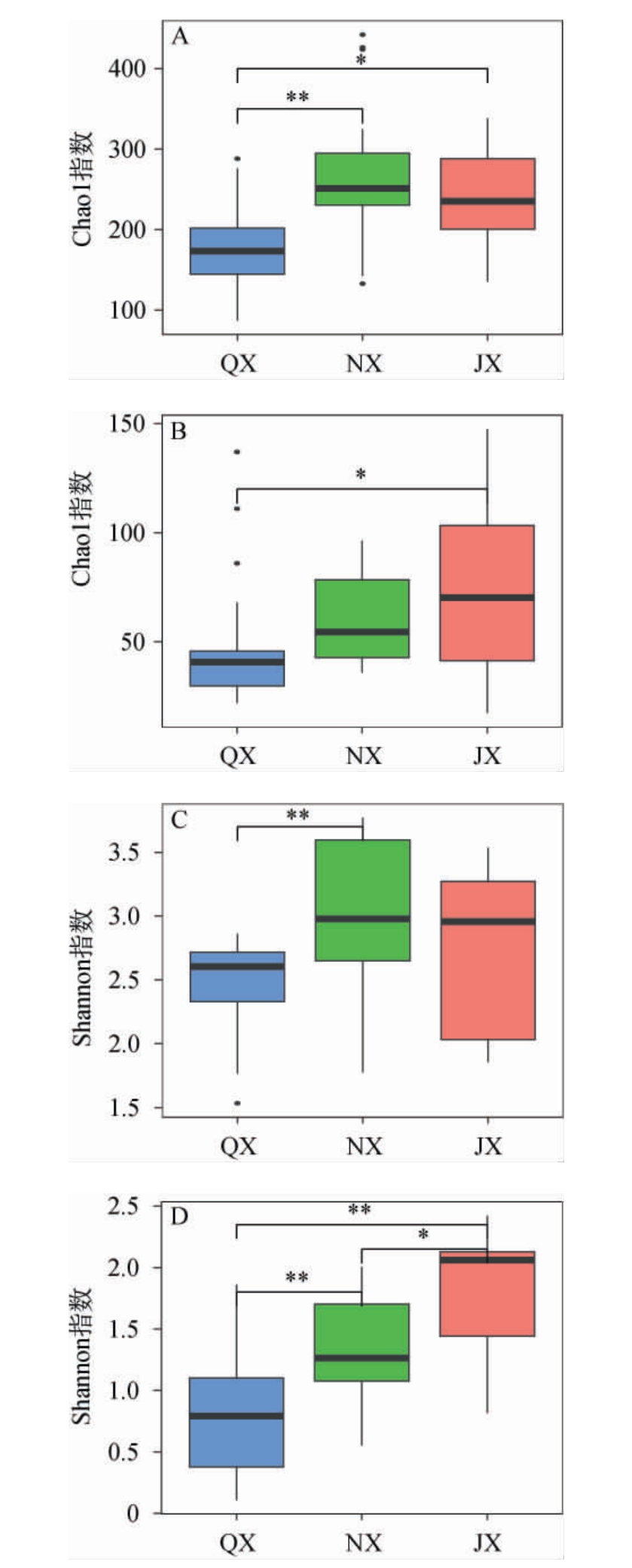
图1 3种香型白酒大曲样品微生物群落Alpha多样性分析结果
Fig.1 Alpha diversity analysis results of microbial community in 3 flavor types Baijiu Daqu samples
A和B分别为3种大曲细菌、真菌菌群的Chao1指数分析;C和D分别为3种大曲细菌、真菌菌群的Shannon指数分析。“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
由图1A和1C可知,对于细菌菌群而言,清香型白酒大曲的Chao1指数极显著低于浓香型白酒大曲(P<0.01)、显著低于酱香型白酒大曲(P<0.05),清香型白酒大曲的Shannon指数极显著低于浓香型白酒大曲(P<0.01)、低于酱香型白酒大曲(P>0.05),然而浓香型与酱香型白酒大曲的Chao1指数与Shannon指数无显著差异(P>0.05)。对真核菌群而言,清香型白酒大曲的Chao1指数显著低于酱香型大曲(P<0.05)、低于浓香型白酒大曲(P>0.05),浓香型白酒大曲的Chao1指数低于酱香型白酒大曲(P>0.05);清香型白酒大曲的Shannon指数极显著低于浓香型和酱香型白酒大曲(P<0.01),浓香型白酒大曲的Shannon指数显著低于酱香型白酒大曲(P<0.05)。结果表明,在3种香型白酒大曲中,清香型白酒大曲中微生物群落的丰富度和多样性最低,而酱香型白酒大曲中真菌群的丰富度和多样性最高,浓香型白酒大曲中细菌菌群的丰富度和多样性最高。
2.2 3种香型白酒大曲中微生物群落Beta多样性的差异
2.2.1 3种香型白酒大曲细菌菌群多样性分析
从3种香型白酒大曲样品中共注释到18个门、33个纲和351个属,基于门和属水平大曲样品中细菌菌群结构见图2。

图2 基于门(A)和属(B)水平3种香型白酒大曲样品中细菌群落结构
Fig.2 Bacterial community structure of 3 flavor Baijiu Daqu samples based on phylum (A) and genus (B) levels
others表示相对丰度<1%及无法归类的门或属。下同。
由图2A可知,厚壁菌门(Firmicutes)在清香型白酒大曲(27.52%~92.91%)、浓香型白酒大曲(29.6%~79.81%)和酱香型白酒大曲(66.72%~77.61%)相对丰度较高,可认为是3种香型白酒大曲的优势细菌门。除厚壁菌门外,变形菌门(Proteobacteria)(QX_1 71.52%、QX_5 45.11%、NX_1 69.02%)和放线菌门(Actinobacteria)(QX_4 18.33%、QX_5 21.11%、JX_3 24.23%、JX_4 17.21%)在个别样品中相对丰度较高,其余细菌门相对丰度较低。
由图2B可知,清香型白酒大曲中乳酸菌主要包括乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus),相对丰度之和为18.54%~85.81%,呈优势地位。泛菌属(Pantoea)在部分清香型白酒大曲中相对丰度较高,如在样品QX_1中相对丰度为62.96%,样品QX_2和QX_5中相对丰度分别为28.89%和29.12%。其余细菌属仅在个别样品中呈较高相对丰度,如克雷伯氏菌属(Klebsiella)在样品QX_6中相对丰度达到33.47%,糖多孢菌属(Saccharopolyspora)在样品QX_4中相对丰度为17.11%。与清香型白酒大曲相比,浓香白酒大曲细菌种类复杂多样,细菌属各不相同且无明显规律性。如样品NX_1中细菌属以泛菌属为主,相对丰度为60.29%;样品NX_3中细菌属以不动杆菌属(Acinetobacter)和芽孢杆菌属(Bacillus)为主,相对丰度分别为24.85%和19.06%;样品NX_2、NX_4、NX_6以乳杆菌属、魏斯氏菌属、明串珠菌属和片球菌属为主,相对丰度之和分别为53.23%、74.38%、42.18%。与清香型白酒大曲和浓香型白酒大曲相比,酱香型白酒大曲中乳杆菌属、魏斯氏菌属、明串珠菌属和片球菌属相对丰度呈下降趋势,相对丰度之和仅在2.86%~25.95%之间,具有一定耐热能力的芽孢杆菌属和克罗彭施泰特氏菌属(Kroppenstedtia)逐渐呈现了优势地位,相对丰度之和达到11.91%~70.33%,成为样品JX_1、JX_2、JX_4、JX_5的优势细菌属。除上述细菌属外,葡萄球菌属(Staphylococcus)在样品JX_3、JX_4中相对丰度分别为34.43%和10.30%,糖多胞菌属(Saccharopolyspora)在样品JX_1中相对丰度为12.14%,枝芽孢菌属(Virgibacillus)在样品JX_1、JX_2中相对丰度分别为11.86%和14.19%、短杆菌属(Brevibacterium)在样品JX_3、JX_4中相对丰度分别为20.25%和10.35%。为了确定不同香型大曲差异细菌物种,进一步对3种香型白酒大曲样品的细菌属进行PCoA,并对其差异细菌菌群进行LEfSe分析,结果见图3。

图3 3种香型白酒大曲样品细菌属主坐标分析(A)及细菌菌群线性判别分析效应大小(B、C)分析结果
Fig.3 Principal coordinate analysis of bacterial genera (A) and linear discriminant analysis effect size analysis results of bacterial community (B, C) in 3 flavor types Baijiu Daqu samples
由 图3A 可 知,PCoA1 和PCoA2 的 方 差 贡 献 分 别 为28.78%和15.66%,累计方差贡献率为44.44%,说明前两个主成分能代表样品中大部分细菌属的信息。清香型白酒大曲样品与浓香型白酒大曲样品存在交集,但均与酱香型白酒大曲样品相聚较远,说明清香型白酒大曲与浓香型白酒大曲样品细菌菌群组成存在一定的相似性,但均与酱香白酒大曲细菌组成存在一定差异。由图3B和3C可知,清香型白酒大曲中差异细菌主要集中在乳酸菌,其中归属于乳杆菌目(Lactobacillales)的乳杆菌科(Lactobacillaceae)和明串珠菌科(Leuconostocaceae)的lg(LDA得分)>5;浓香型白酒大曲中差异细菌较少,lg(LDA得分)>5的主要为变形菌门(Proteobacteria),其余粘球菌科(Myxococcaceae)和明串珠菌属(Leuconostoc)的lg(LDA得分)>4,可认为是影响力较高的差异细菌;酱香型白酒大曲中差异细菌较多,其中归属于芽孢杆菌目(Bacillales)的高温放线菌科(Thermoactinomycetaceae)中的克罗彭施泰特氏菌属(Kroppenstedtia)lg(LDA得分)>5,是酱香型白酒大曲区别于清香白酒大曲和浓香白酒大曲的影响力最大的差异细菌。
2.2.2 3种香型白酒大曲真菌菌群多样性分析
从3种香型白酒大曲样品中共注释到5个门、19个纲和166个属,基于门和属水平大曲样品中真菌菌群结构见图4。
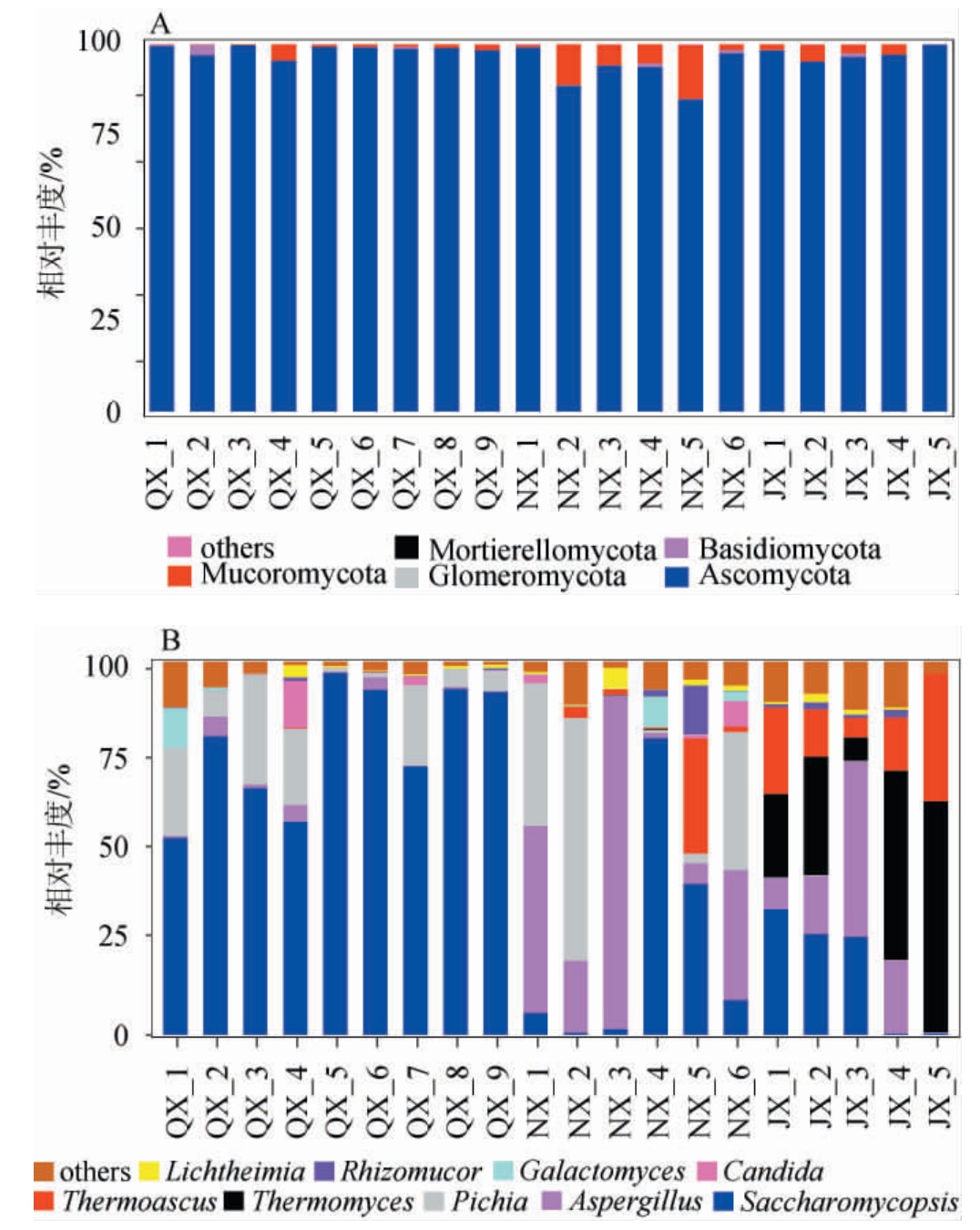
图4 基于门(A)和属(B)水平3种香型白酒大曲样品中真菌群落结构
Fig.4 Fungal community structure of 3 flavor types Baijiu Daqu samples based on phylum (A) and genus (B) levels
由图4A可知,5个真菌门分别为子囊菌门(Ascomycota)、毛霉门(Mucoromycota)、球囊菌门(Glomeromycota),担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)。其中,3种香型白酒大曲样品中的优势真菌门均为子囊菌门,相对丰度为85.10%~99.97%。此外,除毛霉门在样品NX_2(11.10%)和样品NX_5(14.63%)中具有较高相对丰度外,其余真菌门相对均较低。
由图4B可知,3种香型白酒大曲优势真菌属存在差异,清香型白酒大曲以酵母为主,优势真菌属为复膜孢酵母属(Saccharomycopsis),相对丰度在56.32%~97.15%之间,同时含有一定的毕赤酵母属(Pichia),相对丰度在0.47%~29.48%之间。浓香型白酒大曲真菌菌群组成差异较大,样品NX_4与清香型白酒大曲真菌菌群组成较为一致,复膜孢酵母属相对丰度为79.69%;样品NX_1、NX_2、NX_6主要由毕赤酵母属和曲霉属(Aspergillus)组成,相对丰度之和为71.73%~88.28%;样品NX_3主要由曲霉属组成,相对丰度为89.42%;样品NX_5则由嗜热子囊菌属(Thermoascus)和复膜孢酵母属组成,相对丰度之和为71.52%。酱香型白酒大曲以丝状真菌为主,嗜热真菌属(Thermomyces)、嗜热子囊菌属和曲霉属是酱香型白酒大曲的优势真菌属,相对丰度之和达到53.90%~96.29%。为了确定不同香型大曲差异物种,进一步对3种香型白酒大曲样品的真菌属进行PCoA,并对其差异真菌菌群进行LEfSe分析,结果见图5。
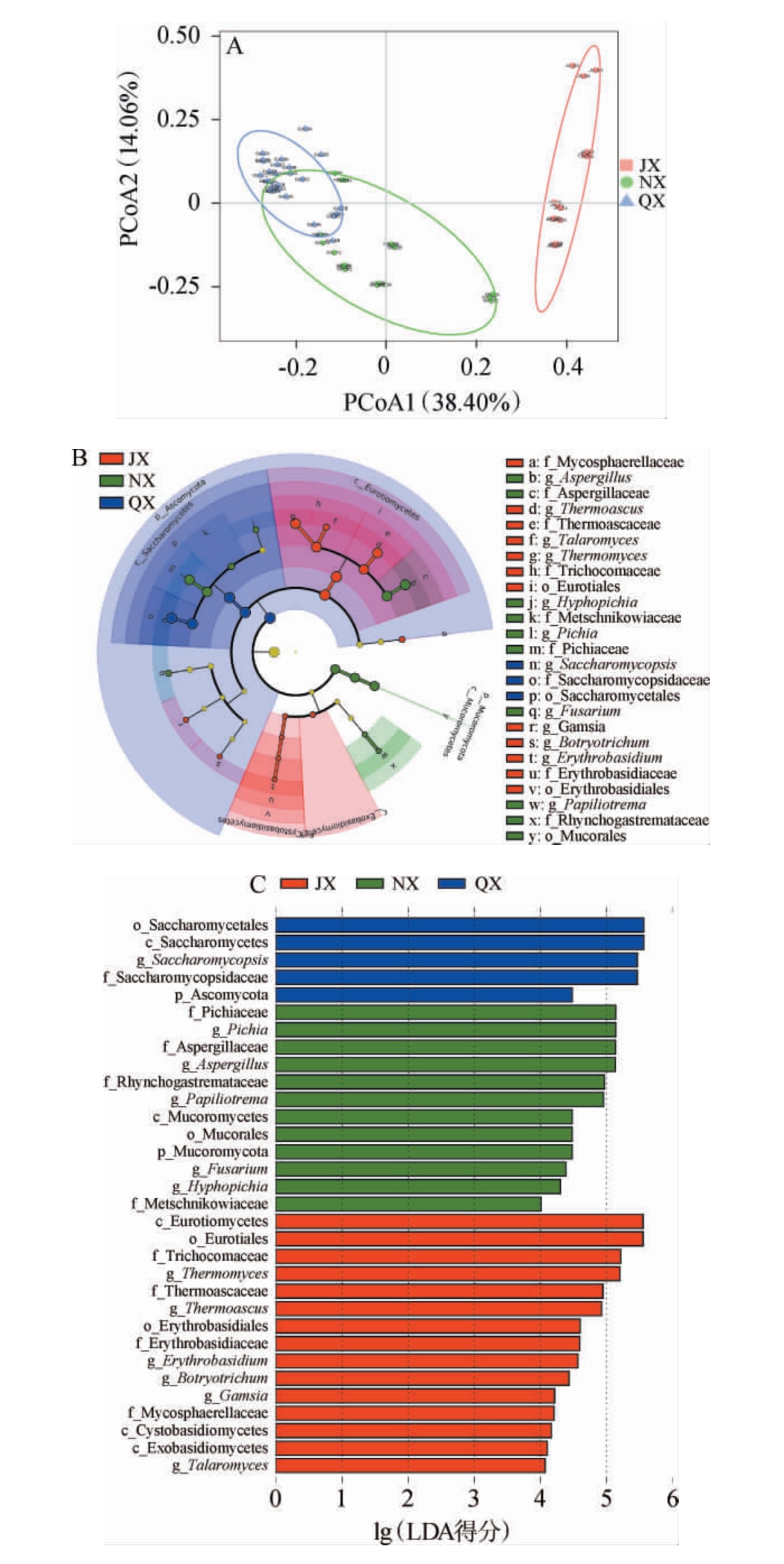
图5 3种香型白酒大曲样品真菌属主坐标分析(A)及真菌菌群线性判别分析效应大小(B、C)分析结果
Fig.5 Principal coordinate analysis of fungal genera (A) and linear discriminant analysis effect size analysis results of fungal community (B, C) in 3 flavor types Baijiu Daqu samples
由图5A可知,PCoA1和PCoA2的方差贡献率分别为38.40%和14.06%,累计方差贡献率为52.46%,说明前两个主成分能代表样品中大部分真菌属的信息。清香型白酒大曲样品与浓香型白酒大曲样品存在交集,但均与酱香型白酒大曲样品相聚较远,说明清香型白酒大曲与浓香型白酒大曲样品真菌菌群组成存在一定的相似性,但均与酱香白酒大曲真菌组成存在一定差异。由图5B和5C可知,清香型白酒大曲中差异真菌主要集中在酵母菌,其中酵母纲(Saccharomycetes)、酵 母 目(Saccharomycetales)、酵 母 科(Saccharomycopsidaceae)、复膜孢酵母属的lg(LDA得分)>5;浓香型白酒大曲差异真菌在酵母和丝状真菌中均有分布,其中毕赤酵母科(Pichiaceae)、毕赤酵母属、曲霉科(Aspergillaceae)、曲霉属的lg(LDA得分)>5;酱香型白酒大曲中差异真菌集中在丝状真菌中,其中散囊菌纲(Eurotiomycetes)、散囊菌目(Eurotiales)、发菌科(Trichocomaceae)、嗜热真菌属的lg(LDA得分)>5。
3 讨论
温度是大曲微生物生长的重要条件之一,3种香型白酒大曲物种多样性变化更能反映出大曲的物种组成受温度所调控。通常认为,制曲温度越高,微生物多样性越低,但在本研究中,清香型白酒大曲细菌和真菌菌群的多样性和丰富度最低,浓香型白酒大曲真菌菌群多样性和丰富度最高,酱香型白酒大曲细菌菌群多样性和丰富度最高。分析认为高通量测序鉴定的是成品大曲中的总微生物,在制曲过程中,高温大曲比低温大曲具有更宽的温度范围,不同温度范围内都有相应的微生物生长,从而导致高温曲中微生物多样性反而更高的现象[16]。
清香型白酒大曲属中低温大曲,其微生物群落组成明显有别于酱香型白酒大曲。50 ℃以下的制曲温度有利于常温微生物生长,因此清香型白酒大曲中主要以不耐高温的乳酸菌(乳杆菌属、魏斯氏菌属、明串珠菌属、片球菌属)、泛菌属、复膜孢酵母属和一定量的毕赤酵母属组成。研究表明,复膜孢酵母属和毕赤酵母属是清香型白酒大曲中常见的优势真菌[17],能够在发酵过程中通过降解原料糖苷键而产生芳香化合物,也可直接参与到发酵过程中通过生化反应调节风味物质的生成,赋予酒体独特的香气成分[18-19]。毕赤酵母属具有较强产酯功能,能够通过酯酶生成大量酯类物质,被认为是白酒酿造中重要的产香功能微生物[20]。乳杆菌属是乳酸发酵的主要微生物,并且乳杆菌属、片球菌属和魏斯氏菌属能够促进酯类、酸类、醇类和芳香族化合物的形成,是白酒中重要的风味功能菌[21-22]。泛菌属通常能够从环境、植物中分离获得,在郎酒酱香大曲,四川浓香大曲、堡子酒酿酒大曲等多种大曲中均有发现的报道,并且相对丰度较高[23-26],但该菌在白酒酿造中尚未有明确功能报导。
酱香型白酒大曲属于高温大曲,70 ℃以上的顶温抑制了多数酵母及常温细菌的生长,虽然酱香型白酒大曲也含有一定量的覆膜孢酵母属,但相对丰度远低于清香型白酒大曲,具有较强耐热能力或嗜热类的曲霉属、嗜热真菌属、芽孢杆菌属和高温放线菌是酱香型白酒大曲的优势菌群[27]。研究表明,曲霉属能产生多种蛋白酶及其他分解酶类,能够将曲料中的蛋白质、淀粉等物质水解为多肽、糖类、氨基酸等,对大曲糖化力、液化力和生香作用都有很大的影响[28-29]。嗜热真菌属能够合成具有热稳定性的纤维素酶、蛋白酶、淀粉酶、脂肪酶等,能够在较高的温度条件下保持稳定的催化效率,同时也对大曲酯类风味的形成具有一定贡献作用,是高温大曲制作中不可或缺的重要菌属[30-31]。大部分芽孢杆菌属微生物具有耐盐、耐高温、耐高渗等特性,因此能够适应酱香型白酒大曲较高的制曲温度,并且能够通过代谢多种水解酶类在制曲过程中促进曲料降解,生成醇、酸、酯等风味物质。另外,有些芽孢杆菌属所产风味具有酱香香气,香气物质中吡嗪类、酸类、酯类、醇类、酮类以及四甲基吡嗪、愈创木酚等芳香族化合物含量较高,常被认为是酱香风味的来源之一[32]。克罗彭施泰特氏菌属于高温放线菌,研究发现高温放线菌能够产纤维素酶、淀粉酶、几丁质酶等酶类,其所产生的次级代谢产物往往具有复杂多样的结构和生理活性[33],但该菌在白酒酿造中尚未有明确功能报导。
浓香白酒大曲属于中高温大曲,制曲温度介于清香和酱香型白酒大曲之间,因此浓香型白酒大曲微生物组成较为复杂多样化,部分样品与清香白酒大曲类似。
4 结论
通过高通量测序对3种香型白酒大曲样品中微生物多样性进行分析发现,清香型白酒大曲中细菌和真菌菌群多样性和丰富度最低,酱香型白酒大曲中真菌菌群多样性和丰富度最高,而细菌菌群在浓香型白酒大曲中最高。从3种香型白酒大曲样品中共注释到18个细菌门、351个细菌属以及5个真菌门和166个真菌属,清香型白酒大曲与浓香型白酒大曲样品微生物组成存在一定的相似性,但均与酱香白酒大曲真菌和细菌组成存在一定差异。清香型白酒大曲中主要差异微生物为覆膜孢酵母属(Saccharomycopsis),浓香白酒大曲中主要差异微生物为毕赤酵母属(Pichia)、曲霉属(Aspergillus)、明串珠菌属(Leuconostoc),酱香白酒大曲中主要差异微生物为嗜热真菌属(Thermomyces)和克罗彭施泰特氏菌属(Kroppenstedtia)。
[1]丁子元,陈玉红,孙玉婷,等.白酒大曲的微生物多样性及其酶类研究进展[J].食品科技,2023,48(3):17-23.
[2]徐千惠,饶家权,邹永芳,等.浓香型大曲贮存期微生物群落演替及代谢产物的变化机制[J].食品科学,2023,44(22):225-234.
[3]何佳欢.中温大曲曲香物质分析及重构研究[D].无锡:江南大学,2022.
[4]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2007:58-81.
[5]毛文定,冯文聪,孙威,等.不同香型白酒酿造大曲微生物群落与理化指标关联分析[J].中国酿造,2024,43(7):147-153.
[6]LI W, HAN M, ZHANG H, et al.Exploring the differences in sauceflavour Daqu from different regions and its contribution to Baijiu brewing based on microbial communities and flavours[J].Int J Food Sci Technol,2024,59(10):7357-7371.
[7]龙树瑺,葛东颖,蔡文超,等.长治地区清香型大曲理化特性与细菌类群的关联性分析[J].食品工业科技,2023,44(17):115-120.
[8]JIANG X, PENG Z, ZHU Q, et al.Exploration of seasonal fermentation differences and the possibility of flavor substances as regulatory factors in Daqu[J].Food Res Int,2023,168:112686.
[9]GAN S H,YANG F,SAHU S K,et al.Deciphering the composition and functional profile of the microbial communities in Chinese moutai liquor[J].Front Microbiol,2019,10:1540-1553.
[10]CHENG W, CHEN X, ZENG H, et al.Association between microbial community composition and quality indicators of strong-flavor Daqu of different producing regions in China[J].CyTA-J Food,2023,21(1):82-92.
[11]CAI W, XUE Y, WANG Y, et al.The fungal communities and flavor profiles in different types of high-temperature Daqu as revealed by highthroughput sequencing and electronic senses[J].Front Microbiol,2021,12:784651.
[12]LING Y,LI W,TONG T,et al.Assessing the microbial communities in four different Daqus by using PCR-DGGE, PLFA, and biolog analyses[J].Poli J Microbiol,2020,69(69):1-11.
[13]WANG Y, GAI J, HOU Q, et al.Ultra-high-depth macrogenomic sequencing revealed differences in microbial composition and function between high temperature and medium-high temperature Daqu[J].World J Microb Biot,2023,39(12):3772-3774.
[14]张清玫,赵鑫锐,李江华,等.不同香型白酒大曲微生物群落及其与风味的相关性[J].食品与发酵工业,2022,48(10):1-8.
[15]周森,王成,朱绍宾,等.基于高通量测序技术分析浓香型白酒大曲真菌菌群多样性[J].中国酿造,2021,40(11):55-59.
[16]WANG Y,HOU Q,NI H,et al.Multi-method joint analysis reveals differences in the quality and microbial composition of high-temperature and medium-high-temperature Daqu[J].LWT-Food Sci Technol,2024,209:116804.
[17]甄攀,韩英,王军燕,等.不同时期及不同区域汾酒大曲微生物群落结构分析研究[J].中国酿造,2023,42(6):140-145.
[18]王乃军,马美荣.扣囊复膜酵母在白酒生产中的应用研究进展[J].酿酒科技,2023(3):115-119.
[19]王浩,黄丹,余东,等.扣囊复膜酵母菌对固态混菌发酵体系微生物菌群结构及代谢的影响[J].食品与发酵工业,2021,47(11):45-52.
[20]赵港国,李晓晓,张婧靖,等.基于响应面法优化库德毕赤酵母强化发酵工艺生产清香型白酒[J].中国酿造,2024,43(8):224-229.
[21]刘冲冲,冯声宝,吴群,等.青稞酒发酵过程中的风味功能微生物及其风味代谢特征解析[J].微生物学通报,2020,47(1):151-161.
[22]WANG SL, WU Q, NIE Y, et al.Construction of synthetic microbiota for reproducible flavor metabolism in Chinese light aroma type liquor produced by solid-state fermentation[J].Appl Environ Microbiol,2019,85(10):e03090-18.
[23]沈毅,陈波,王西,等.酱香型郎酒高温大曲、酒醅和窖泥中细菌群落结构分析[J].中国酿造,2020,39(2):89-93.
[24]陈莹琪,陈杰,周耀进,等.浓香型大曲微生物菌群演替与吡嗪类物质合成的关系[J].食品科学,2023,44(2):222-230.
[25]陈勇,林涵瑞,陈晓茹,等.川派浓香型白酒大曲的典型产区差异性分析[J].中国酿造,2024,43(11):34-40.
[26]罗爱国,杨牛恬,郑同庆,等.清香型白酒酿酒大曲微生物菌群多样性解析[J].中国酿造,2022,41(4):73-79.
[27]杨晨,杨栩松,郭壮,等.茅台镇某酒厂高温大曲微生物多样性与感官品质关联性分析[J].中国酿造,2023,42(11):48-53.
[28]YI Z,JIN Y,XIAO Y,et al.Unraveling the contribution of high temperature stage to Jiang-flavor Daqu,a liquor starter for production of Chinese Jiang-flavor Baijiu, with special reference to metatranscriptomics[J].Front Microbiol,2019,10:472.
[29]WANG B,WU Q,XU Y,et al.Specific volumetric weight-driven shift in microbiota compositions with saccharifying activity change in starter for Chinese Baijiu fermentation[J].Front Microbiol,2018,9:2349.
[30]DONG W,ZENG Y,CUI Y,et al.Unraveling the composition and succession of microbial community and its relationship to flavor substances during Xin-flavor Baijiu brewing[J].Int J Food Microbiol,2022,372:109679.
[31]XIAO C, YANG Y, LU Z M, et al.Daqu microbiota exhibits speciesspecific and periodic succession features in Chinese Baijiu fermentation process[J].Food Microbiol,2021,98:103766.
[32]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and microbial communities: A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121:422-432.
[33]田浩杰,李豆南,邱树毅,等.酱香大曲中高温放线菌的筛选及基因组解析[J].食品科学,2023,44(18):68-76.