豌豆(Pisum sativum L.)属于豆科豌豆属植物的种子[1],在我国的种植区域较为广泛,涵盖了四川、河南、湖北、江苏、云南以及黑龙江、吉林、辽宁等地区[2-3]。豌豆蕴含丰富的多元维生素及矿物质组群,各类成分比例协调,对人体造血功能的维持、骨骼的正常发育以及新陈代谢的平稳运行均发挥着积极作用。豌豆淀粉含量丰富,约占干质量的24%~49%,在蛋白质组成上,豌豆蛋白的氨基酸配比相对均衡,且来源广泛,致敏原较少,是一种极具潜力且优质经济的蛋白质资源[4-6]。豌豆作为一种重要的豆类作物,除了作为常见食材直接食用外,在医药保健和食品酿造领域也具有重要价值,其在调控高血压、抑制肿瘤细胞增殖等方面展现出潜在功效[7-8]。豌豆是酿制大曲的关键原料之一[9],在制曲工艺的复杂体系中,豌豆经过一系列的生化反应,其内部的蛋白质、碳水化合物等大分子物质,通过酶解、发酵等多种生物化学反应途径,逐步发生降解,生成氨基酸、糖类等一系列小分子化合物,这些氨基酸作为重要的反应底物,可参与美拉德反应,赋予酒独特的烤面包、坚果般香气,丰富酒的风味物质组成,对提升酒的整体风味品质和独特性具有不可或缺的作用。内生菌在植物微生态系统中占据着极为重要的地位,它们广泛且稳定地定殖于健康植物的根、茎、叶、花、果实及种子等组织及各个器官内部[10-11]。植物内生菌与植物在长期协同演化过程中构建了独特且复杂的共生模式,对植物的营养吸收、代谢调节、抗逆性提升以及抵御病虫害侵袭等方面均发挥着关键作用,进而对维持植物生态系统的平衡与稳定具有深远意义[12]。研究发现,植物内生菌作为一类极具探索价值的新型微生物资源,在医药研发与农业植保领域具有广阔应用前景[13]。目前,关于豌豆内生细菌多样性的探究工作仍处于相对匮乏的状态,并且关于不同品种豌豆对大曲风味物质影响的相关探索也处于认知较为薄弱的阶段。
传统内生菌培养方法难以准确获取植物内生菌的完整信息[14]。李铂等[15]采用细菌16S rRNA基因序列扩增技术,联合高通量测序平台进行深度测序,以及生物信息学分析等手段鉴定了植物内生细菌及真菌菌种。通过进行系统的群落结构分析与功能预测,深度解析了内生菌群的物种多样性特征及其潜在的生物学功能,为深入理解植物-微生物互作机制及植物健康调控提供了关键的理论依据。
酒厂选择作曲用的豌豆品种极为考究,汾酒制曲选用的是麻豌豆,产地主要来自河北张北和甘肃永登。麻豌豆、绿豌豆和白豌豆因品种特性与生长环境差异,其内生菌存在差别。本研究旨在探究汾酒制曲所用麻豌豆MW1和其他品种的麻豌豆之间是否存在内生菌组成的差异,同时以绿豌豆和白豌豆作为对照样本,基于高通量测序技术,对豌豆内生细菌的16S rRNA基因V3-V4可变区序列进行特异性扩增,深入解析豌豆内生细菌在物种多样性层面的丰富度、均匀度和在群落结构方面的组成特征及差异。为深入研究豌豆内生菌的组成成分、探究内生菌生物活性功能机制以及高效筛选具有特定应用价值的功能性内生菌群等相关研究工作提供参考依据,并且为后续制定汾酒曲用麻豌豆的质量体系标准奠定一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
本研究选取3个不同品种麻豌豆为研究对象,同时选取绿豌豆与白豌豆作为参考进行比较分析,相关样本信息见表1。
表1 豌豆类别、名称与分组信息
Table 1 Category, name and grouping information of pea
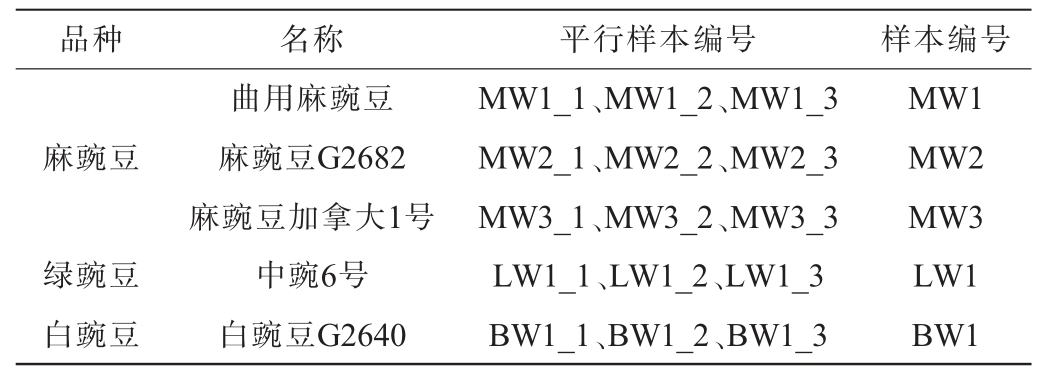
品种 名称 平行样本编号 样本编号麻豌豆绿豌豆白豌豆曲用麻豌豆麻豌豆G2682麻豌豆加拿大1号中豌6号白豌豆G2640 MW1_1、MW1_2、MW1_3 MW2_1、MW2_2、MW2_3 MW3_1、MW3_2、MW3_3 LW1_1、LW1_2、LW1_3 BW1_1、BW1_2、BW1_3 MW1 MW2 MW3 LW1 BW1
1.1.2 试剂
E.Z.N.ATMMag-Bind Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒:美国Omega Bio-Tek公司;Qubit dsDNA HS分析试剂盒:美国Thermo Fisher公司;2×Hieff R Robust聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、Hieff NGSTM DNA Selection Beads:翌圣生物科技(上海)股份有限公司。
1.2 仪器与设备
Pico-21型台式离心机、Q33238型Qubit® 4.0荧光计:美国ThermoFisher公司;GL-88B型漩涡混合器:海门市其林贝尔仪器制造有限公司;TND03-H-H混匀型干式恒温器:深圳拓能达科技有限公司;FR-1000型凝胶成像系统:上海复日科技有限公司;ETC 811型PCR仪:北京东胜创新生物科技有限公司。
1.3 方法
1.3.1 样本前处理
将豌豆置于超净工作台中,使用体积分数70%乙醇溶液冲洗3次,1×磷酸盐缓冲液(phosphate buffered saline,PBS)溶液冲洗3次,晾干样本,置于无菌离心管中常温保存备用。
1.3.2 DNA提取与PCR扩增
采用OMEGA试剂盒提取豌豆内生菌总脱氧核糖核酸(DNA)。使用通用引物341F和805R对序列进行扩增。第一轮PCR扩增体系(30 μL):15 μL Hieff ® Robust PCR Master Mix(2×),1 μL Bar-PCR primer F,1 μL Primer R,10~20 ng PCR products,9~12 μL双蒸水(ddH2O)。PCR扩增程序:94 ℃预变性3 min;94 ℃变性30 s、45 ℃退火20 s、65 ℃延伸30 s,共5个循环;94 ℃变性20s、55℃退火20s、72 ℃延伸30 s、72℃终延伸5min,共20个循环。第二轮PCR扩增体系(30μL):15μLHieff® Robust PCR Master Mix(2×),1 μL Primer F,1 μL Index-PCR Primer R,20~30 ng PCR products,9 ~12 μL H2O。PCR扩增程序:95 ℃预变性3 min;94 ℃变性20 s、55 ℃退火20 s、72 ℃延伸30 s、72 ℃终延伸5 min,共5个循环[16]。采用2%琼脂糖凝胶电泳检测PCR产物质量,使用Qubit3.0荧光定量仪精确测定文库浓度,随后将所有样本按1∶1比例混合,委托上海生工生物工程公司对混合样本进行测序。
1.3.3 数据分析处理
使用Cutadapt软件V 1.18去除引物接头序列;二代测序结束后,使用PEAR软件V0.9.8拼接双端测序读长(PE reads)之间的重叠区域;在对样本完成区分操作后,借助PRINSEQ软件V 0.20.4开展序列质量的控制、过滤以及去噪工作,使用USEARCH软件V 11.0进行操作分类单元(operational taxonomic unit,OTU)筛选代表序列;使用R软件的VennDiagram(V 1.6.20)、UpsetR package(V 1.4.0)制作物种分布韦恩图;使用mothur软件(V 1.43.0)进行rarefaction分析和Alpha多样性分析;使用R软件(V 3.6.0)绘制稀释性曲线图、Rank Abundance曲线图及相对丰度图,并进行Beta多样性分析;使用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)软件(V 1.1.0)分析不同品种豌豆内生菌生物标志物差异;使用基于标记基因的群落功能预测工具PICRUSt 2(V 2.5.2)软件进行样本京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)代谢通路分析。
2 结果与分析
2.1 样本Venn图分析
对豌豆核糖体16S rRNA基因的V3-V4区序列进行PCR扩增和测序操作。将样本优化后,共得到1 224 149条有效序列,按照97%相似水平划分OTU。Venn图可直观且准确地分析各样本的OTU数量,并清晰呈现样本间重叠关系,为深入分析样本数据及关系提供有力支撑[17-18]。不同品种豌豆内生细菌OTUs分布Venn图见图1。由图1可知,3个品种豌豆样本共获得了1 187个细菌OTUs,共有内生细菌OTUs数为262个,占比较低。MW、LW、BW特有内生细菌OTUs分别为698、53、57个,占比为65.48%、14.29%、14.58%。研究结果显示,三个品种的豌豆内生细菌群落组成具有一定的相似性和特异性,其中MW特有的细菌OTUs数最多。
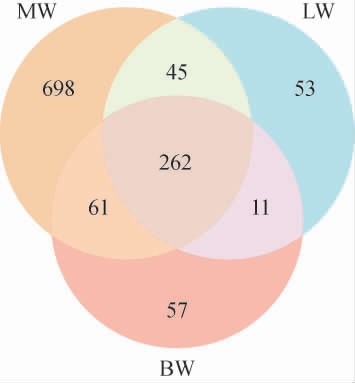
图1 不同品种豌豆基于内生细菌操作分类单元分布Venn图
Fig.1 Venn diagram of endophytic bacterial operational taxonomic units distribution based on different varieties of pea
2.2 稀释性曲线分析
样本稀释性曲线可对不同样本中物种多样性是否处于饱和状态进行判别,同时能够揭示不同样本在微生物组成方面的差异。不同品种豌豆样品基于内生细菌群落的稀释性曲线见图2。由图2可知,随着测序深度的增加,样本的物种数量呈现出显著上升趋势。当测序深度数值>1 000时,MW1、MW2、MW3、LW1和BW1细菌稀释曲线均逐渐趋于平稳状态。表明当前测序深度已充分地覆盖了样本内的物种信息,可准确反映样本中物种的真实分布情况,即便后续通过增加测序通量和提升测序读长数量等方式来提高测序深度,能够检测到新物种的可能性较低,难以显著增加所检测到的物种数量[19]。
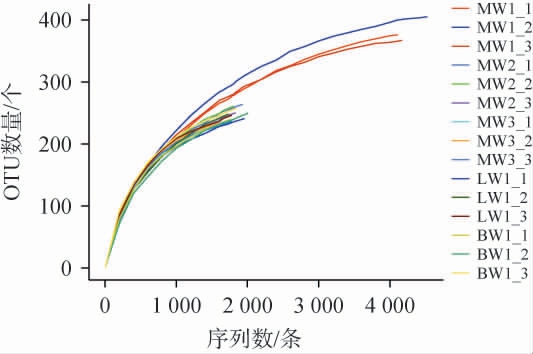
图2 不同品种豌豆样品基于内生细菌操作分类单元的稀释性曲线图
Fig.2 Dilution curves of endophytic bacterial operational taxonomic units based on different varieties of pea samples
2.3 丰度等级曲线分析
丰度等级曲线可研究群落内物种的相对丰富程度及其分布的均匀性,在水平维度上,曲线宽度与物种的相对丰度呈现显著的正相关关系,即曲线在横轴上的跨度越大,表明样本中的物种种类数量越多,物种丰度越高。在垂直维度上,曲线的平滑程度可作为衡量样本内物种均匀性的有效指标,曲线越平滑,就表明物种在样本中的分布更为均匀[20]。不同品种豌豆样品基于内生细菌群落的丰度等级曲线见图3。由图3可知,随着OTU数量的增加,MW1样品内生细菌OTU丰度等级曲线跨度最大且更平滑,说明其细菌丰富度及均匀度高于MW2、MW3、LW1和BW1。
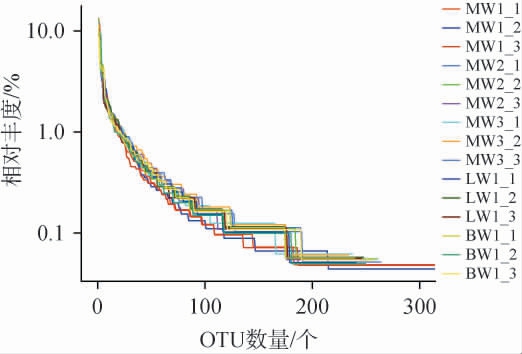
图3 不同品种豌豆样品基于内生细菌群落的丰度等级曲线
Fig.3 Rank Abundance curves of endophytic bacterial communities based on different varieties of pea samples
2.4 Alpha多样性分析
Alpha多样性分析可对样本间物种的多样性与丰富程度进行评估。基于OTUs丰度,使用香农(Shannon)指数、Chaol指数、ACE指数、辛普森(Simpson)指数和Coverage指数对群落物种组成的丰富度及多样性进行综合性评价[21]。其中Chao1指数或Ace指数越大,表明群落物种组成的丰富度越高[22],Shannon指数越大,表明微生物群落多样性越高,Simpson指数则相反[23],Coverage指数越高,则说明样本中序列被测出的概率越高,而没有被测出的概率越低。不同品种豌豆样品内生细菌群落的Alpha多样性分析结果见表2。
表2 不同品种豌豆样品内生细菌群落的Alpha多样性分析结果
Table 2 Alpha analysis results of endophytic bacterial communities of different varieties of pea samples
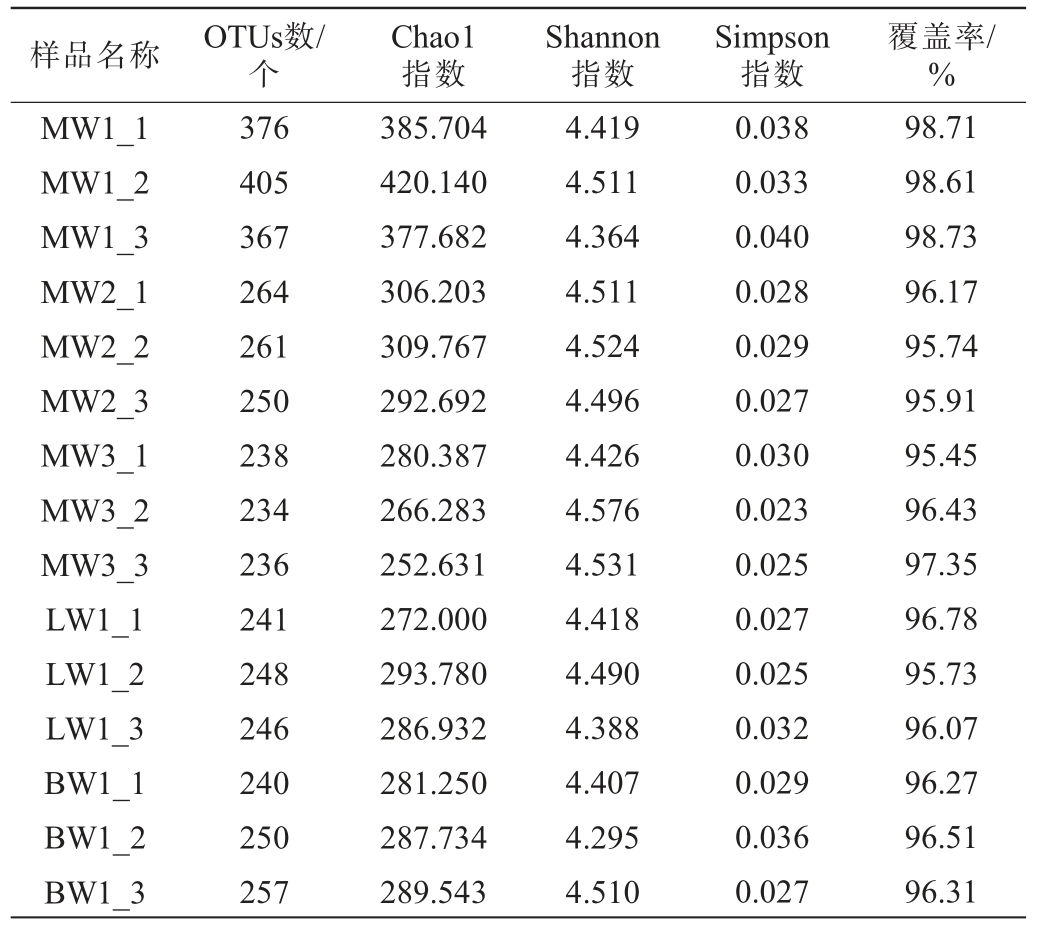
样品名称 OTUs数/个Chao1指数Shannon指数Simpson指数覆盖率/%MW1_1 MW1_2 MW1_3 MW2_1 MW2_2 MW2_3 MW3_1 MW3_2 MW3_3 LW1_1 LW1_2 LW1_3 BW1_1 BW1_2 BW1_3 376 405 367 264 261 250 238 234 236 241 248 246 240 250 257 385.704 420.140 377.682 306.203 309.767 292.692 280.387 266.283 252.631 272.000 293.780 286.932 281.250 287.734 289.543 4.419 4.511 4.364 4.511 4.524 4.496 4.426 4.576 4.531 4.418 4.490 4.388 4.407 4.295 4.510 0.038 0.033 0.040 0.028 0.029 0.027 0.030 0.023 0.025 0.027 0.025 0.032 0.029 0.036 0.027 98.71 98.61 98.73 96.17 95.74 95.91 95.45 96.43 97.35 96.78 95.73 96.07 96.27 96.51 96.31
由表2可知,MW1样品细菌群落的Chao1指数与Ace指数最高,MW3样品细菌群落的Shannon指数最大,Simpson指数最小,表明MW1的细菌群落物种丰富度最大,MW3细菌群落的物种多样性最高。三个不同品种豌豆样品的OTUs数覆盖率均>90%,说明本次取样合理[24]。
2.5 内生细菌群落结构组成分析
利用高通量测序技术,可探究不同样本中细菌群落组成的差异性。不同品种豌豆样品基于内生细菌群落门水平及属水平的相对丰度分布结果见图4。
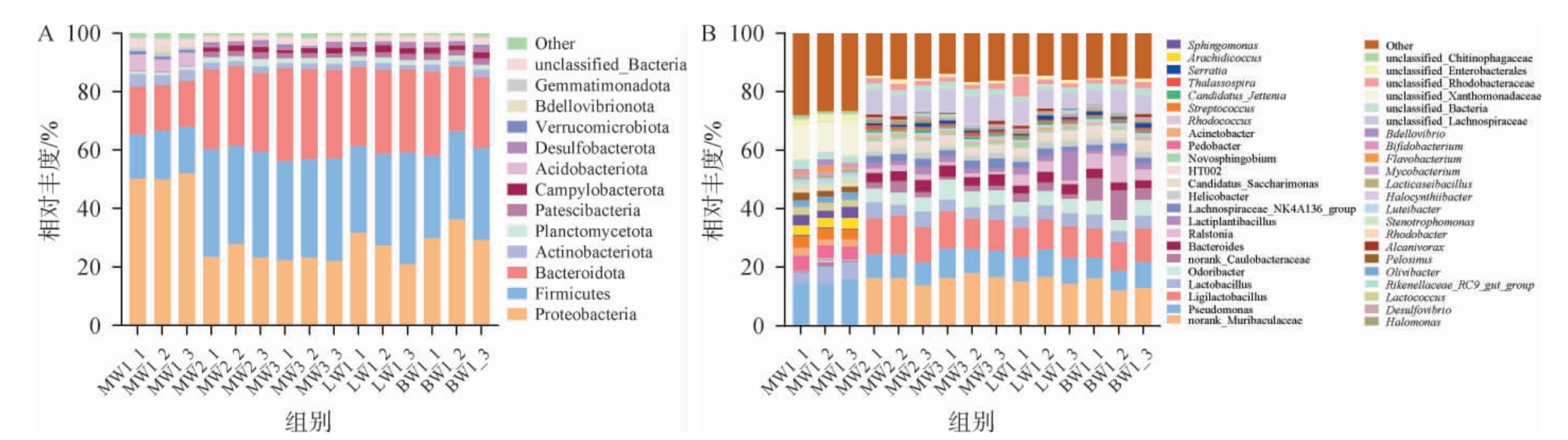
图4 不同品种豌豆样品内生细菌群落基于门水平(A)及属水平(B)相对丰度
Fig.4 Relative abundance of endophytic bacterial communities of different varieties of pea samples based on phylm level (A) and genus level (B)
由图4A可知,在不同品种豌豆中共鉴定出14个门,其中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)为所有样本内生细菌群落的共有门和优势菌门。变形菌门相对丰度为20.93%~52.03%;厚壁菌门相对丰度为15.14%~38.22%;拟杆菌门相对丰度为15.61%~31.69%。基于门水平,MW1鉴定出的门水平数量最多,涵盖了其他13个不同品种豌豆中已检出的细菌门。王雪山[25]发现变形菌门包含丰富的细菌种类,具有广泛的代谢途径,其在清香型白酒酿造过程中的物质转化、风味物质合成以及环境适应性等方面发挥着关键的生态功能。胡小霞等[26]发现厚壁菌门的细菌具有较强的生存能力和代谢活性,其在发酵过程中的生长繁殖和代谢活动对发酵效率、发酵产物的质量和风味特征具有重要影响。拟杆菌门在酿造环境中参与了酿造原料的分解、营养物质的循环以及与其他微生物的相互作用等过程[27]。由此可见,变形菌门、厚壁菌门和拟杆菌门构成了中国传统白酒酿造环境中细菌微生态的核心组成部分[28]。在研究内生细菌群落组成时,发现均存在未鉴定细菌门,这可能是由于其易在环境中生存,但无法通过具体手段进行培养及繁殖,因此这类菌群在数据库中无法得到准确注释,这些细菌门的潜在功能仍值得进一步研究[29]。
由图4B可知,在属水平中共鉴定出46个属,除其他菌属外,相对丰度>1%的菌属为优势菌属,其中MW1优势菌属有17个,排名前3的分别是假单胞菌属(Pseudomonas)、unclassified_Xanthomonadaceae和乳杆菌属(Lactobacillus),相对丰度分别为14.22%~15.72%、10.15%~11.61%和3.60%~6.01%,MW2优势菌属有22个,排名前3的分别是norank_Muribaculaceae、联合乳杆菌属(Ligilactobacillus)、假单胞菌属 (Pseudomonas),相对丰度分别为13.64%~16.30%、11.95%~13.18%、7.97%~8.14%,MW3和LW1优势菌属均为18个,排名前3的是norank_Muribaculaceae、联合乳杆菌属(Ligilactobacillus)和假单胞菌属(Pseudomonas),MW3优势菌属的相对丰度分别为16.19%~17.98%、10.29%~12.58%和8.23%~10.21%,LW1优势菌属的相对丰度分别为14.25%~16.67%、10.18%~10.77%和8.29%~9.34%,BW1优势菌属有17个,排名前3的分别是norank_Muribaculaceae、联合乳杆 菌 属(Ligilactobacillus)和 假 单 胞 菌 属(Pseudomonas),相对丰度分别为12.05%~16.10%、9.76%~11.49%和6.72%~8.83%。黄瑜等[30]在大曲中发现假单胞菌属是小麦原料微生物群落的重要组成部分,并推测假单胞菌可能通过参与小麦原料的微生物群落构建,与其他微生物相互作用,影响大曲发酵过程中的代谢途径,进而对大曲的风味物质形成产生一定的影响。MW1与MW2、MW3、LW1和BW1样品优势菌属差异较大,除假单胞菌属,MW1中的乳杆菌属同样是白酒发酵体系中的关键微生物类群,是乳酸乙酯及乳酸等风味物质合成的主要微生物基础[31],其代谢活动对白酒风味物质的动态演替具有显著推动作用。综上,MW1作为大曲的主要原料,其含有的优势菌群占比更高,可能对提升大曲品质和发酵性能具有重要意义。
2.6 Beta多样性分析
2.6.1 主成分分析
主成分分析(principle component analysis,PCA)能够直观地呈现出不同样本以及样本组之间的差异程度。样本之间距离越接近,表明其在物种构成方面的相似度越高[32],不同品种豌豆基于内生细菌群落的PCA结果见图5。
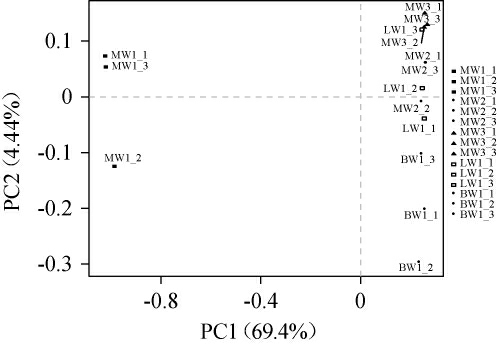
图5 不同品种豌豆样品内生细菌群落的主成分分析结果
Fig.5 Principle component analysis results of endophytic bacterial communities of different varieties of pea samples
由图5可知,主成分1方差贡献率为69.4%,主成分2方差贡献率为4.44%,二者累计方差贡献率高达73.84%,表示该模型能够反映样品中大部分的信息,MW2、MW3、LW1和BW1相距较近,说明不同品种豌豆内生细菌群落组成具有一定的相似性,而MW1与其他样品相距较远,PCA能将MW1样品与其他样品区分,说明曲用麻豌豆内生细菌群落组成与其他样品细菌群落组成差异较大。
2.6.2 主坐标分析
主坐标分析(principal co-ordinates analysis,PCoA)可以用来探究样本之间的相似性和差异性及不同组样本之间的分离程度等[33],点间距与菌群差异呈正相关,距离越大则差异越大[34],结果见图6。
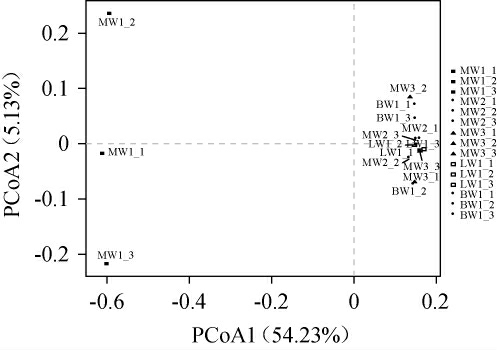
图6 不同品种豌豆样品内生细菌群落的主坐标分析结果
Fig.6 Principal coordinate analysis results of endophytic bacterial community of different varieties of pea samples
由图6可知,主坐标第一轴和主坐标第二轴方差贡献率分别为54.23%和5.13%,累计方差贡献率为59.36%,表示该模型能够反映样品中大部分的信息。样品MW2、MW3、LW1和BW1距离较近,甚至出现重叠现象,说明样品MW2、MW3、LW1和BW1 内 生 细 菌 群 落 组 成 相 似,PCoA 能 将MW1样品与其他样品区分,样品MW1与其余样品距离较远,且未出现聚类,说明曲用麻豌豆与其他样品内生细菌菌落组成之间存在一定差异性。
2.6.3 非度量多维尺度分析
采用β多样性分析法探究不同品种豌豆内生菌群落组成的差异。使用Bray-Curtis距离计算方法,对不同品种豌豆进行非度量多维尺度(nonmetric multidimensional scaling,NMDS)分析,Stress值可用于检验NMDS分析结果的可靠性[35],结果见图7。
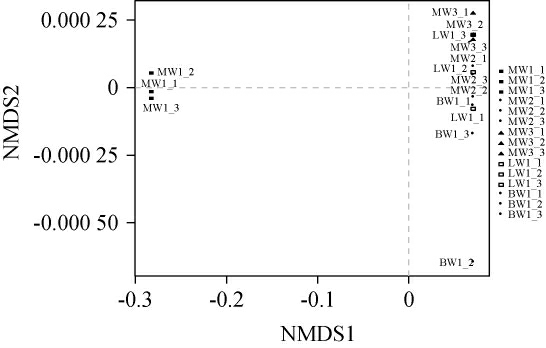
图7 不同品种豌豆样品内生细菌群落的非度量多维尺度分析结果
Fig.7 Nonmetric multidimensional scaling analysis results of endophytic bacterial community of different varieties of pea samples
通过分析样本细菌群落测序所得数据可知,其stress值为0.000 06,充分表明本次排序结果具由高度代表性,能精准、可靠地反映细菌群落的实际特征,由图7可知,MW2、MW3、LW1、BW1均分布在第1、4象限,交叠在一起,表示细菌群落组成具有一定的相似性,而MW1分布在第2、3象限,与其余样本细菌群落分开,不重叠,表明MW1与其他样本的细菌菌落组成具有一定的差异性。
2.7 豌豆内生细菌生物标志物的鉴定
LEfSe分析将非参数检验和线性判别分析相结合,基于相对丰度表开展分析,适用于检测菌群丰度差异。LEfSe分析可识别每个分组内的特征微生物,线性判别分析(linear discriminant analysis,LDA)得分高于预先设定的阈值,所在分组中的丰度明显高于其他分组。此外,该分析方法还用于探究在不同分组间表现出显著差异的微生物的进化关系。在LEfSe分析结果的可视化展示中,每条横向柱代表一个不同的物种。横向柱的长度与对应的LDA值相关,LDA值越高,表明该物种在不同分组间的差异越显著。不同品种豌豆基于内生细菌群落LEfSe分析结果见图8。
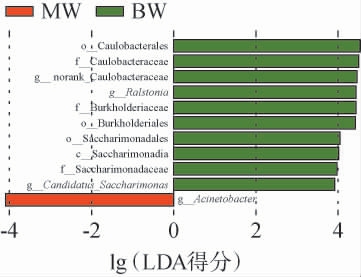
图8 不同品种豌豆样品内生细菌群落LEfSe分析结果
Fig.8 LEfSe analysis results of endophytic bacterial community of different varieties of pea samples
由图8可知,在LDA得分>2时,只有BW和MW中具有起重要作用的内生细菌类群,其中BW优势菌群有10个,分别是柄杆菌目(Caulobacterales),柄杆菌科(Caulobacteraceae),norank_Caulobacteraceae,罗尔斯通菌属(Ralstonia),伯克氏菌科(Burkholderiaceae),伯克氏菌目(Burkholderiales),糖单胞菌目(Saccharimonadales),子囊菌纲(Saccharimonadia),酵母菌科(Saccharimonadaceae),Candidatus_Saccharimonas,MW优势菌群为不动杆菌属(Acinetobacter)。由此可见,柄杆菌目(Caulobacterales)为BW中最重要的差异菌群,不动杆菌属(Acinetobacter)为MW中最重要的差异菌属。
2.8 不同品种豌豆内生细菌群落功能分析
利用Picrust2软件对豌豆样本中细菌菌群的基因功能进行预测。豌豆内生细菌群落共注释到新陈代谢、遗传信息处理、细胞过程、环境信息处理、有机系统和人类疾病6个一级代谢系统,其中豌豆内生细菌群落在新陈代谢功能的占比最高,为77.74%~79.45%。进一步对一级代谢通路进行分析,结果见图9。
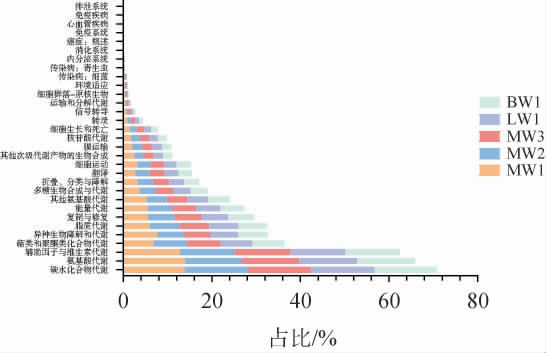
图9 不同品种豌豆样品内生细菌群落的KEGG代谢通路
Fig.9 KEGG metabolic pathways of endophytic bacterial community of different varieties of pea samples
由图9可知,发现共涉及到31个二级代谢通路中,其中碳水化合物代谢和氨基酸代谢为主要二级代谢通路,占比为13.80%~14.64%和12.68%~13.94%。ZHANG Y D等[36]研究发现,大曲发酵过程中,碳水化合物代谢和氨基酸代谢作为核心KEGG途径,对微生物生存及功能维持至关重要,这与本研究结果相符。
氨基酸代谢在酿酒中至关重要:一方面,其作为酯类合成的关键前体,通过酶促反应生成不同香气的酯类,丰富白酒香气层次;另一方面,氨基酸代谢与碳水化合物代谢在大曲发酵阶段起到了至关重要的作用[37],氨基酸作为微生物生长必需氮源,为微生物生长和繁殖提供关键的营养物质,产生的代谢产物会影响微生物生长和代谢活动和大曲的香气形成。由图9可知,对于不同品种豌豆而言,碳水化合物代谢途径在LW1的占比最高,氨基酸代谢途径在MW1的占比最高,由此推测,碳水化合物代谢通路与氨基酸代谢通路相关基因数量上的差异,可能是影响后续酒曲品质形成的重要因素[38]。
3 结论
不同品种豌豆,其内生细菌群落组成可能会对大曲的发酵效率与品质产生不同的影响,本研究采用Illumina Miseq高通量测序技术对不同品种豌豆样品内生细菌群落结构进行了分析。由Alpha多样性分析可知,MW1的物种组成丰富度最高,MW3的群落多样性最高。从细菌群落结构分析来看,不同品种豌豆的优势细菌门均为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota),基于属水平,除未分类和其他菌属外,假单胞菌属(Pseudomonas)、联合乳杆菌属(Ligilactobacillus)和乳杆菌属(Lactobacillus)相对丰度较高,其中,假单胞菌属为MW1曲用麻豌豆中绝对优势菌属,其在酿酒中发挥着重要作用,能提升白酒的风味品质。Beta多样性分析结果表明,MW2、MW3、LW1和BW1内生细菌群落组成相似,MW1与MW2、MW3、LW1和BW1内生细菌群落组成差异较大。
采用LEfSe对不同样品间的差异指示菌进行分析,结果显示,BW中最重要的差异指示菌为Caulobacterales,MW中最重要的差异指示属为Acinetobacter。KEGG 代谢通路分析结果表明,豌豆内生细菌群落组成以碳水化合物代谢和氨基酸代谢的占比最高,且MW1的碳水化合物代谢与氨基酸代谢占比明显高于MW2、MW3、LW1和BW1,这两类代谢是大曲风味物质的主要来源,说明MW1的细菌群落结构对大曲风味物质的形成可能是最有利的。
[1]尹乐斌,何平,刘桠丽,等.豌豆抗性淀粉制备工艺优化及理化性质研究[J].中国酿造,2022,41(2):198-203.
[2]翟清华,张宇航,李小侠,等.不同品种豌豆对凤型大曲质量的影响研究[J].酿酒科技,2025(1):60-64.
[3]COJOCARU A, CARBUNE V R, TELIBAN C G, et al.Physiological,morphological and chemical changes in pea seeds under different storage conditions[J].Sci Rep,2024,14(1):28191.
[4]PLAZZOTTA S,BERARDINIS D L,SCHROETER B,et al.Development of novel microaerogel particles from pea protein and their application as ingredient for low-saturated fat cocoa spreads[J].J Food Eng,2025,391:112413.
[5]ZHOU D, MA Z, YIN X, et al.Structural characteristics and physicochemical properties of field pea starch modified by physical, enzymatic,and acid treatments[J].Food Hydrocolloid,2019,93:386-394.
[6]CAMPOS-VEGA R, LOARCA-PINA G, OOMAH B D.Minor components of pulses and their potential impact on human health[J].Food Res Int,2010,43(2):461-482.
[7]JAGDISH S,PARTHA S B.Non-nutritive bioactive compounds in pulses and their impact on human health:An overview[J].Food Nutr Sci,2012,3(12): 1664-1672.
[8]HAN X M,LEONID A,PAULA A,et al.Comprehensive compositional assessment of bioactive compounds in diverse pea accessions[J].Food Res Int,2023,165:112455-112455.
[9]张英,鄢定波,胡景辉,等.清香型白酒发展概述[J].中国酿造,2024,43(9):1-8.
[10]翟凯辉,张影影,高夕全.种子内生菌促生机制和抗病机理研究进展[J].农业生物技术学报,2023,31(9):1965-1979.
[11]WANI Z A,ASHRAF N,MOHIUDDIN T,et al.Plant endophyte symbiosis,an ecological perspective[J].Appl Microbiol Biot,2015,99(7):2955-2965.
12]SHANKER S P,RAHUL J,PRIYANKA B,et al.Plant probiotics-endophytes pivotal to plant health[J].Microbiol Res, 2022, 263: 127148-127148.
[13]陈柯璇,李海燕.植物种子内生菌及其应用前景的研究进展[J].中国野生植物资源,2021,40(11):40-44.
[14]许明双.番茄和水稻种子可培养内生细菌的多样性分析及促生菌功能研究[D].北京:中国农业大学,2014.
[15]李铂,高晓敏,王楠,等.不同产地沙棘种子内生菌群落组成与多样性分析[J].北方园艺,2024(8):94-101.
[16]杨睿.猕猴桃溃疡病菌的鉴定及其胁迫下根际土壤细菌群落结构的解析[D].吉首:吉首大学,2022.
[17]PANG Y, MA D, WANG B, et al.Application of high-throughput sequencing in research on plant endophytes[J].Chin J Biotechnol,2024,40(10):3395-3406.
[18]MCCALL M N,KENT O A,YU J S,et al.MicroRNA profiling of diverse endothelial cell types[J].BMC Med Genomics,2011,4(1):78.
[19]WANG Y,SHENG H F,HE Y,et al.Comparison of the levels of bacterial diversity in freshwater,intertidal wetland,and marine sediments by using millions of illumina tags[J].Appl Environ Microbiol, 2012, 78(23):8264-8271.
[20]罗爱国,杨牛恬,郑同庆,等.清香型白酒酿酒大曲微生物菌群多样性解析[J].中国酿造,2022,41(4):73-79.
[21]李斌,胡俊杰,张兰兰,等.基于高通量测序浓香型和芝麻香型白酒酒曲真菌群落结构的分析[J].中国酿造,2019,38(10):96-100.
[22]王秀秀,吕志远,刘玉涛,等.大曲微生物群落结构及其风味组分相关性研究[J].酿酒科技,2025(2):31-38.
[23]刘延波,王琳琳,金尚萍,等.不同储藏期浓香型白酒大曲的微生物多样性分析[J].中国酿造,2022,41(4):105-110.
[24]曹云,黄雪莲,卢飞羽,等.不同产区酱香大曲的微生物群落差异分析[J].酿酒科技,2025(4):59-64.
[25]王雪山.不同环境清香类型白酒发酵微生物种群结构比较及溯源解析[D].无锡:江南大学,2018.
[26]胡小霞,黄永光,蒋想,等.清酱香型白酒陶坛发酵细菌群落结构多样性研究[J].食品科学,2020,41(8):130-138.
[27]XU Y Q,WU M Q,NIU J L,et al.Characteristics and correlation of the microbial communities and flavor compounds during the first three rounds of fermentation in Chinese sauce-flavor Baijiu[J].Foods,2023,12(1):207.
[28]周金虎,董孝元,余楒瑶,等.黄鹤楼酒生态洞酿细菌群落多样性研究[J].酿酒,2017,44(5):13-18.
[29]张艳峰,张晓云.原料预处理对柿子酒发酵过程中微生物群落演替的影响[J].食品工业科技,2023,44(14):111-120.
[30]黄瑜,杨帆,李江华,等.小麦原料微生物组成对高温大曲风味的影响[J].食品与发酵工业,2021,47(20):22-29.
[31]余苗,马叶胜,刘晓静,等.新建曲房春冬两季中高温大曲微生物群落结构的差异性[J].食品研究与开发,2025,46(6):161-168.
[32]庞春霞,李艺,虞任莹,等.基于Illumina Miseq技术比较不同地区传统发酵大豆制品细菌多样性[J].食品工业科技,2022,43(8):133-140.
[33]周森,王成,朱绍宾,等.基于高通量测序技术分析浓香型白酒大曲真菌菌群多样性[J].中国酿造,2021,40(11):55-59.
[34]WANG D Q,CHEN L Q,YANG F,et al.Yeasts and their importance to the flavour of traditional Chinese liquor:A review[J].J I Brewing,2019,125(2):214-221.
[35]王礼霄.半人工湿地植物香蒲根系微生物群落的时空分异及构建过程[D].太原:山西大学,2022.
[36]ZHANG Y D,XU J G,JIANG Y L,et al.Microbial characteristics and metabolite profiles of high-temperature Daqu in different maturation stages[J].World J Microb Biot,2022,38(12):234-245.
[37]CAI W C,WANG Y R, NI H, et al.Diversity of microbiota, microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150(12):110734.
[38]任海伟,李云帆,阿丽米热·克热穆,等.不同等级金徽酒大曲贮藏过程中的细菌群落演替规律和组装机制[J].食品科学,2025,46(10):108-119.