中国白酒是世界六大蒸馏酒之一,以粮谷为原料,经发酵、蒸馏、陈酿、勾调而成[1]。在生产中,酿酒原料的理化组分是影响白酒质量的源头要素[2-3]。酿酒原料的理化组分主要包括淀粉、蛋白质、脂肪、水分等[2,4]。其中蛋白质是酿酒微生物生长代谢的重要氮源,其经水解而成的各类氨基酸可经过脱羧、脱氨作用及美拉德反应产生风味物质,影响白酒质量[4]。研究认为,原料蛋白质的含量在8%~10%较好,适宜优质白酒的酿造[2,4],但原料蛋白质的种类繁多[5-6],其结构组成及与白酒生产的关系尚有待进一步解析。
水稻是我国最主要的粮食作物之一,也是酿造白酒的重要原料,可单独、也能与高粱、玉米等其他原料组合用于白酒生产[2]。稻米籽粒主要由淀粉、蛋白质、脂肪、矿物质、维生素和水分等组成,蛋白质含量占比约10%,是除淀粉外含量最高的组分[7]。目前已有关于不同品种、产地和存储方式的稻米蛋白质组成的文献报道,但重点关注的是蛋白质组成差异对稻米食用品质和营养价值的影响[8-11],在酿酒品质方面鲜有涉及。前期,本课题组对5个稻米品种开展清香型白酒酿造试验,揭示了不同稻米品种的酒质差异。根据酒质分析结果,本研究选择其中酒质差异较大的两个品种,采用数据非依赖采集(data independentacquisition,DIA)定量蛋白质组技术分析蛋白质组成及其与白酒酿造的潜在关系,旨在为利用酿酒水稻品种资源提升白酒品质提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
稻米(品种为JKY和PXY):由本研究所选育,于2022年9月收割于四川省泸县。经国家一级酒质评委鉴定,JKY酿造白酒的质量优于PXY,对JKY酿造白酒酒质的评价为“清香突出纯正,味较醇和,有甜感,尾净”;对PXY酿造白酒酒质的评价为“清香突出,放香大,有醇厚感,涩味苦味明显”。
1.1.2 试剂
甲酸(色谱纯)、乙腈(色谱纯)、超纯水、蛋白Marker、二辛可宁酸测定(bicinchoninic acid assay,BCA)蛋白质定量试剂盒:美国Thermo Fisher Scientific公司;甲醇、蔗糖、氯化钾、二硫苏糖醇、聚乙烯吡咯烷酮、聚丙烯酰胺、四乙基溴化铵(均为分析纯):生工生物工程(上海)股份有限公司;胰蛋白酶(酶活2 500 U/mg)、碘代乙酰胺(色谱纯):美国Sigma-Aldrich 公司。
1.2 仪器与设备
反相色谱柱RP-C18(25 cm×75 μm,1.6 μm):澳大利亚IonOpticks公司;EASY-nLCTM 1200液相色谱仪:美国Thermo Fisher Scientific 公司;Tims TOF pro质谱仪:德国Bruker Daltonics 公司;5810R台式冷冻离心机:德国Eppendorf 公司;JY1600E型十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)仪:美国Bio-Rad公司。
1.3 方法
1.3.1 稻米蛋白质提取
将两个品种的稻米样品各取10 g分别置于液氮充分研磨,将粉末转移至EP管,加入20 mg 聚乙烯吡咯烷酮,再加入10 mL提取液(0.7 mol/L蔗糖,0.1 mol/L氯化钾,50 mmol/L乙二胺四乙酸二钠,0.5 mol/L三羟甲基氨基甲烷盐酸缓冲液,pH 7.5)进行提取,方法参考文献[10]进行。
1.3.2 稻米蛋白质定量分析及SDS-PAGE
采用BCA试剂盒进行蛋白质定量分析。每个样品取10 μg蛋白质进行SDS-PAGE[12]。
1.3.3 酶解及肽段除盐
分别取适量稻米蛋白质,加入二硫苏糖醇使其终浓度为5 mmol/L,55 ℃孵育30 min。冷却后加入碘代乙酰胺使其终浓度为10 mmol/L,避光放置15 min。加入6 倍体积的丙酮(99.5%)于-20 ℃过夜。4 ℃、8 000×g离心10 min收集沉淀。加入100 μL 5 mmol/L的四乙基溴化铵复溶沉淀,以1/50的质量比(胰蛋白酶∶蛋白质)加入胰蛋白酶并置于37 ℃过夜,随后加入磷酸调节pH为3终止反应,酶解后采用SOLATMSPE 96孔板脱盐[13]。
1.3.4 蛋白质肽段测定
使用EASY-nLCTM 1200液相色谱仪对脱盐后的肽段进行分离。液相色谱条件:色谱柱RP-C18;流动相A为0.1%甲酸水溶液(V/V);流动相B为含0.1%甲酸的乙腈溶液(乙腈80%);流速300 mL/min;洗脱条件:0~45 min,5%~27%B;45~50 min,27%~46%B;50~55 min,46%~100%B;55~60 min,100%B。质谱条件:毛细管电压1.4 kV;干燥气温度180 ℃;流速3 L/min;扫描范围100~1 700 m/z;离子范围0.7~1.3 m/V;碰撞能量20~59 eV。
1.3.5 蛋白质鉴定与数据质控
原始数据的处理使用Spectronaut Pulsar 17.5软件,搜库序列文件为uniprot-Oryza sativa-4530-2023.02.21.fasta。检索参数:漏切位点数(Missed Cleavage)2,固定修饰为Carbamidomethyl Ⓒ;可变修饰为Oxidation(M);酶为Trypsin和Acetyl(Protein N-term);前体Q值为0.01;蛋白质Q值为0.01。有效蛋白质筛选标准:特异性肽段≥1;保留至少在一个组50%以上的样品中具有检测值的蛋白质。若同组样品有空值,用同组均值填充,剩下的空值用样本最小值的一半填充,经中位数标准化及log2对数转换得到有效蛋白质表达量[14]。
1.3.6 数据分析
将不同品种稻米蛋白质表达丰度进行比较,将倍数变化(fold change,FC)>2或<0.5,且t检验的P<0.05的蛋白质作为差异表达蛋白质[15]。采用基因本体论(GeneOntology,GO)数据库(http://geneontology.org/)将差异表达蛋白质进行生物过程、细胞组分、分子功能3个方面的分类和富集分析。采用京都基因和基因组百科全书(KyotoEncyclopedia of Genes and Genomes,KEGG)(https://www.kegg.jp/)进行代谢通路富集分析。
2 结果与分析
2.1 稻米蛋白质的SDS-PAGE
采用BCA试剂盒对两种稻米进行蛋白质定量,得到PXY和JKY稻米提取的蛋白质含量分别为(3.19±0.19)g/L和(3.04±0.03)g/L,差异不显著(P>0.05)。两种稻米蛋白质SDS-PAGE图谱见图1。由图1可知,两种稻米中提取的蛋白质电泳条带清晰,质量较高,符合开展蛋白质组学试验的质量要求。
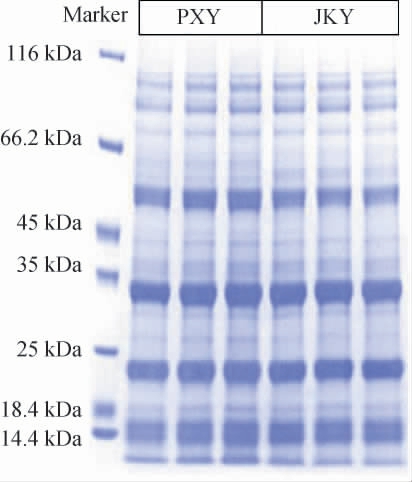
图1 两种稻米蛋白质十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果
Fig.1 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis results of two types of rice proteins
2.2 蛋白质鉴定结果
从PXY和JKY两种稻米中鉴定出肽段52 336条,归属于蛋白质5 153个。每个蛋白质的短肽数量为1~96条,蛋白质分子质量范围为3.26~521.93 kDa。两种稻米蛋白质分子质量及肽段数量分析结果见图2。由图2可知,共有3 015个蛋白质的分子质量位于20~60 kDa,2 932个蛋白质的鉴定肽段数量≤5条。
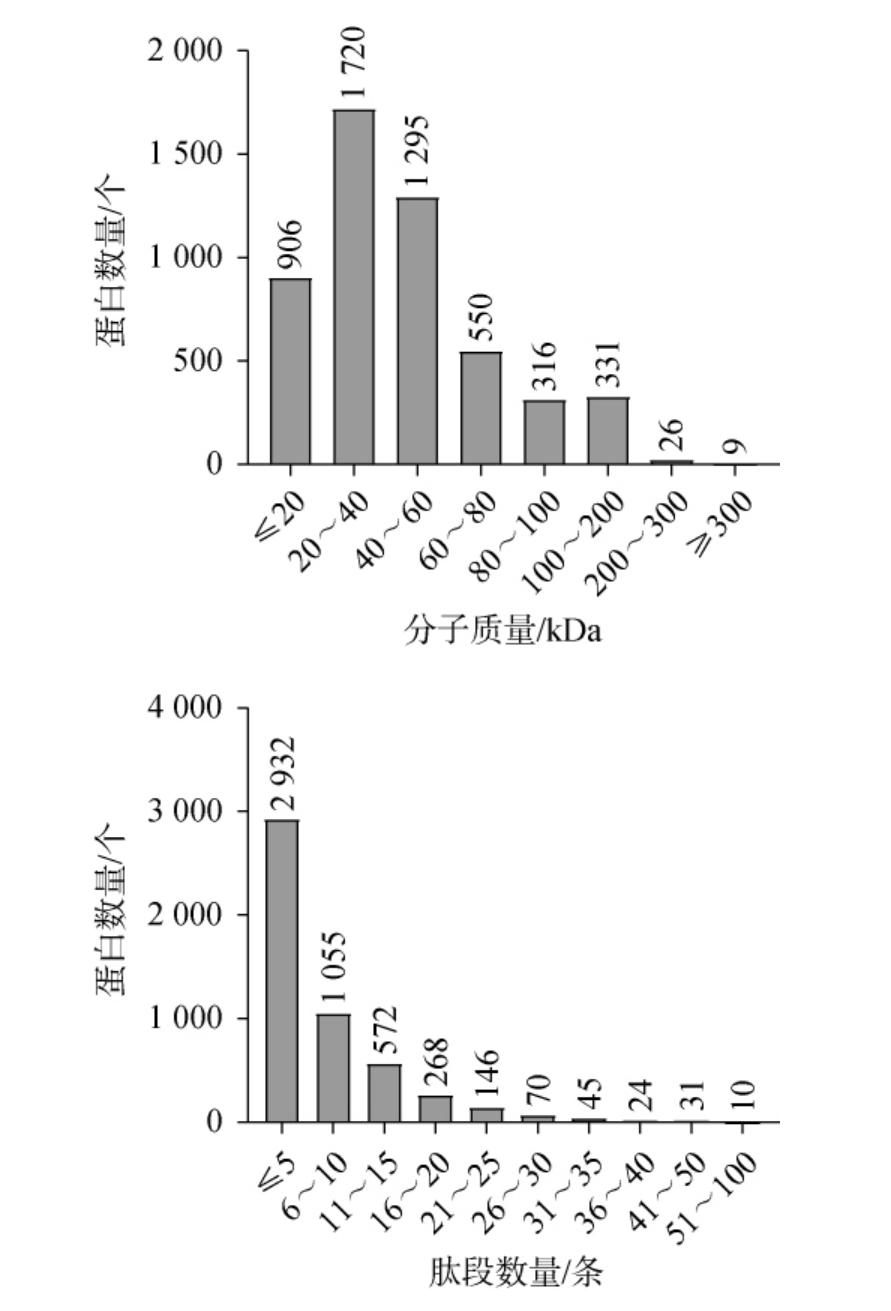
图2 两种稻米蛋白质分子质量及肽段数量
Fig.2 Molecular weight and peptide counts of two types of rice proteins
两种稻米蛋白质主成分分析(principal component analysis,PCA)结果见图3。由图3可知,前两个主成分(PC1、PC2)代表约85.53%的总变异,主成分分析可将两种稻米样品较好地区分开。
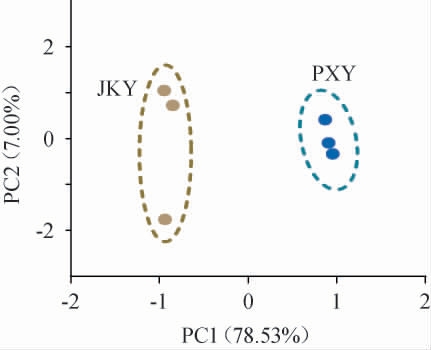
图3 两种稻米蛋白质主成分分析结果
Fig.3 Principal components analysis result of two types of rice proteins
根据蛋白质组学数据进行分析处理,以FC>2或FC<0.5且P<0.05为标准筛选出差异表达蛋白质,两种稻米差异表达蛋白质火山图见图4。由图4可知,从PXY和JKY两种稻米中检测出差异表达蛋白质223个,在PXY中上调117个,下调106个,表明供试稻米品种的蛋白质组成具有较大差异。
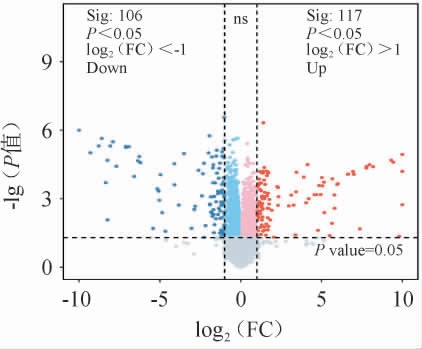
图4 两种稻米差异表达蛋白质火山图
Fig.4 Volcano plot of differentially expressed proteins of two types of rice proteins
“ns”表示无显著差异(P>0.05)。
2.3 GO富集分析
将两种稻米所有差异表达蛋白质进行GO富集分析,从生物学过程、细胞组分和分子功能3大分支分别富集到20、6和22个条目具有显著差异(P<0.05)(生物学过程和分子功能分支只列出前10个条目)。综合差异表达蛋白质的数量以及P值大小(图5)可知,差异表达蛋白质在生物学过程中涉及的前三个条目是热响应、淀粉生物合成过程、化学响应;在细胞组分分析中主要涉及淀粉质体、胞外区、非原质体;在分子功能分析中主要涉及糖原(淀粉)合成酶活性、谷胱甘肽转移酶活性、三磷酸腺苷(adenosine triphosphate,ATP)依耐性蛋白质折叠伴侣。进一步分别利用在稻米PXY中上调和下调的差异表达蛋白质进行富集分析,在生物学过程中分别获得22和19条具有显著差异的条目(P<0.05),结果见图6。
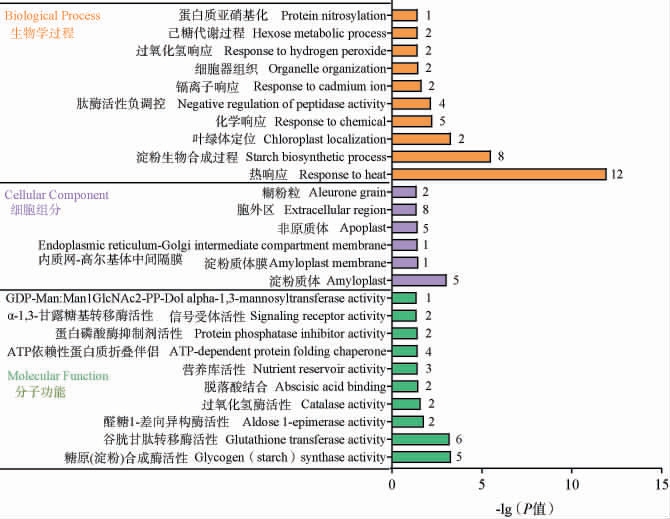
图5 所有差异表达蛋白质的基因本体论富集分析结果
Fig.5 Gene Ontology enrichment analysis results of all differentially expressed proteins
图中数值代表差异表达蛋白质的数量,下同。
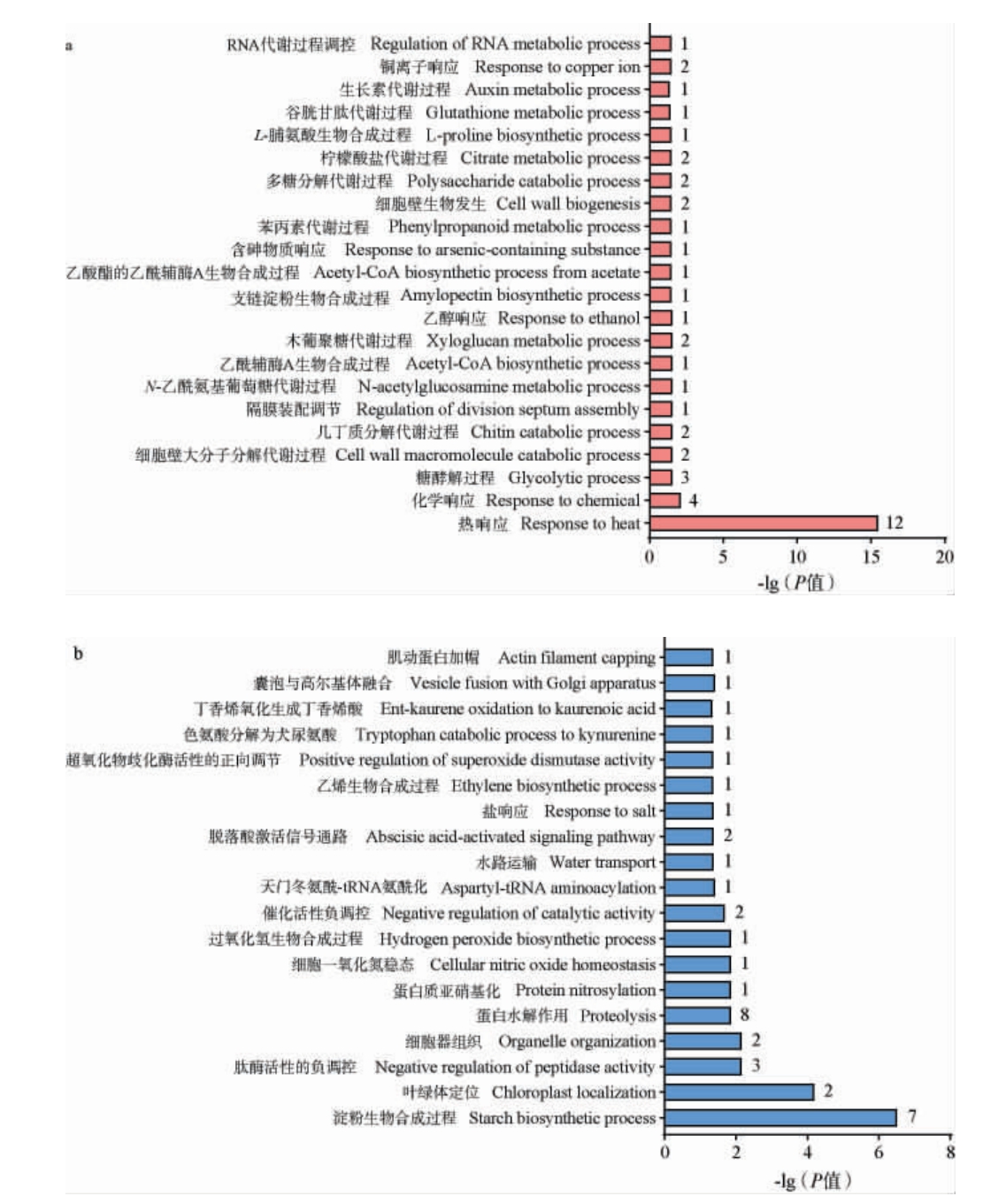
图6 稻米PXY上调(a)和下调(b)蛋白质的基因本体论富集分析结果
Fig.6 Gene Ontology enrichment analysis results of up-regulated (a)and down-regulated (b) proteins in PXY rice
由图6可知,综合差异表达蛋白质的数量以及P值大小,上调蛋白质参与的生物学过程主要是热响应、化学响应、糖酵解过程;下调蛋白质主要涉及淀粉生物合成过程、蛋白水解作用、肽段活性的负调控。
2.4 KEGG富集分析
KEGG 数据库是研究代谢途径的主要数据库,一级功能层包括新陈代谢、基因信息处理、环境信息处理、细胞进程、有机体系统、人类疾病、药物开发[16]。其中,新陈代谢是与白酒发酵关联最紧密的功能层级[17-19]。将所有差异表达蛋白质进行KEGG富集分析,获得6条具有显著差异的代谢通路(P<0.05)。其中5条与新陈代谢相关,包括与碳水化合物代谢有关的淀粉和蔗糖代谢、糖酵解/糖异生、戊糖磷酸途径、乙醛酸和二羧酸代谢,以及与氨基酸的代谢相关的谷胱甘肽代谢(图7a)。
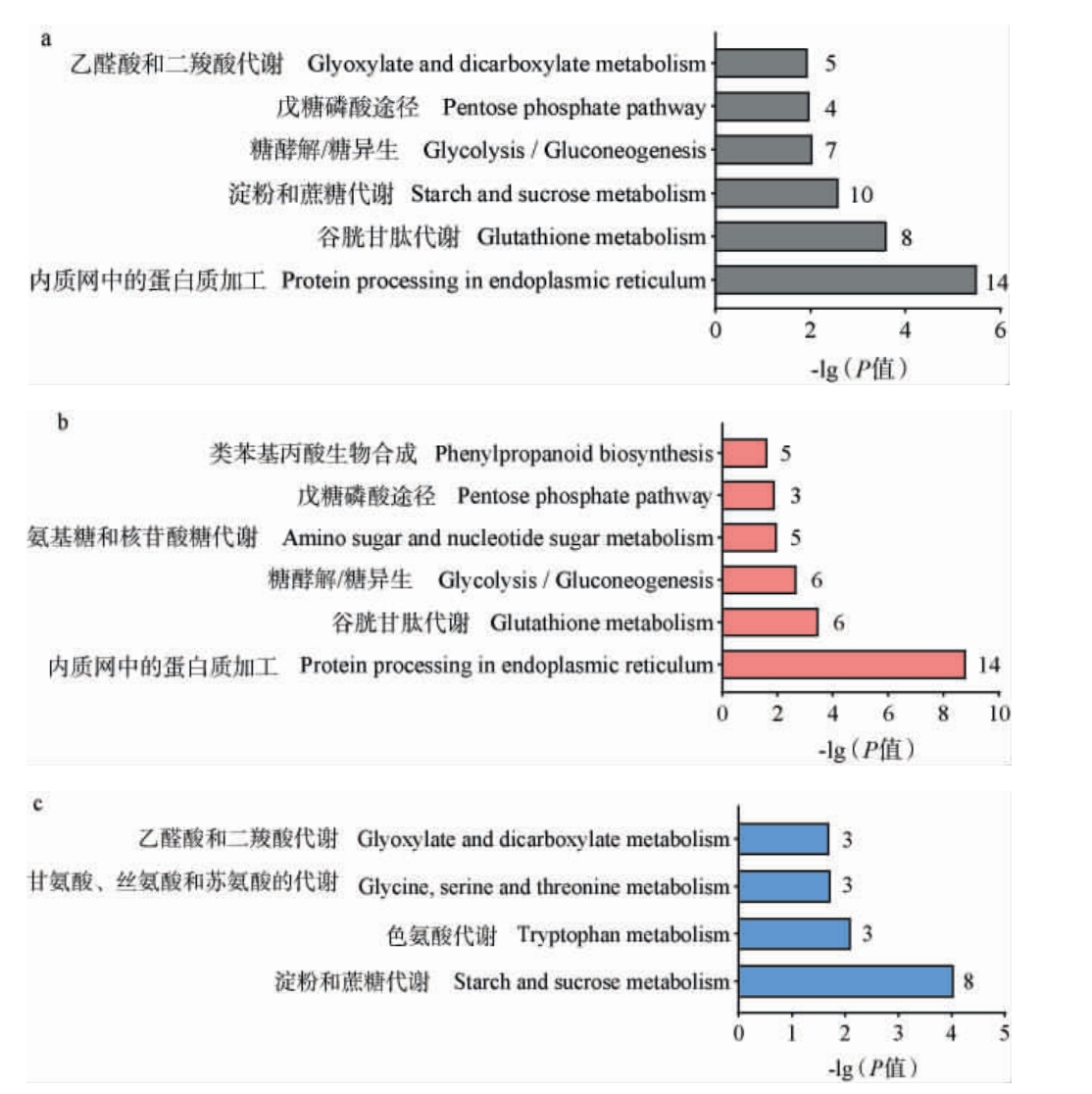
图7 差异表达蛋白质的京都基因和基因组百科全书富集分析结果
Fig.7 Kyoto Encyclopedia of Genes and Genomes enrichment analysis results of differentially expressed proteins
a 所有差异表达蛋白质;b 上调蛋白质;c 下调蛋白质。
参与上述代谢通路的29个差异表达蛋白质信息见表1。由表1可知,在PXY中上调15个、下调14个。差异表达蛋白质中有部分是由不同基因编码的相同蛋白质,表明可能存在不同的蛋白质亚型。葡萄糖-6-磷酸异构酶参与的差异代谢通路较多,分别是糖酵解/糖异生(osa00010)、戊糖磷酸途径(osa00030)、淀粉和蔗糖代谢(osa00500);果糖-二磷酸醛缩酶、乙酰辅酶A合成酶分别参与2条差异代谢通路,果糖-二磷酸醛缩酶参与糖酵解/糖异生、戊糖磷酸途径,乙酰辅酶A合成酶参与糖酵解/糖异生、乙醛酸和二羧酸代谢。
表1 与代谢功能相关的差异表达蛋白质
Table 1 Differential expressed proteins related to metabolic function

注:osa00010(糖酵解/糖异生);osa00030(戊糖磷酸途径);osa00480(谷胱甘肽代谢);osa00500(淀粉和蔗糖代谢);osa00630(乙醛酸和二羧酸代谢)。
登录号 蛋白质名称 编码基因 分子质量/kDa 特异肽段数量 含量倍数变化 差异代谢通路B3VDJ3 D0TZE6 B8XEK5 B3VDJ2 Q508U7 A0EQG8 A2YCP9 A0A0P0V353 B8ALI5 B8BCL1 A0A6F8FJC4 B8AME2 A0A0P0W806 A2Y261 A2Y4N3 A1XBB7 B8AY35 A2WQ51 B8B0B0 P0C5D0 A2WWV4 A2YL42 B8AUQ0 Q6H798 A2Y0W3 A2Z556 B8AJA8 A0A8J8XYT7 A0A8J8Y114蜡质(片段)淀粉合成酶,叶绿体/淀粉体淀粉合成酶,叶绿体/淀粉体淀粉合成酶,叶绿体/淀粉体淀粉合成酶(片段)淀粉合成酶,叶绿体/淀粉体丝氨酸羟甲基转移酶谷胱甘肽转移酶含GST n端结构域的蛋白α-淀粉酶过氧化氢酶过氧化氢酶同工酶C转酮醇酶醛糖1-差向异构酶谷胱甘肽转移酶蛋白IN2-1同源物B果糖-二磷酸醛缩酶谷胱甘肽转移酶葡萄糖-6-磷酸异构酶1-Cys过氧化物氧化还原酶B三磷酸异构体酶谷胱甘肽转移酶醛糖1-差向异构酶乙酰辅酶A合成酶含结构域的蛋白质醛糖1-差向异构酶柠檬酸合成酶过氧化物酶疑似6-磷酸葡萄糖酸内酯酶—GBSSII GBSS1——w x OsI_22888 Os01g0369700 OsI_11052 OsI_31647 CatA OsI_09857 Os04g0266900 OsI_19092 OsI_19958 GSTZ5 OsI_19907 OsI_01983 OsI_22416 OsI_026085 OsI_04384 OsI_25933 OsI_16152 Os02g0525900 OsI_18641 OsI_32784 OsI_06215 OsJ_25291 OsJ_30091 7.84 67.36 66.48 66.44 6.01 66.06 58.23 26.97 29.04 48.90 56.70 56.76 77.65 37.32 29.53 27.36 36.25 24.23 75.04 24.20 27.20 26.35 40.35 77.59 91.41 36.45 53.85 24.04 29.02 1 1 1 1 1 1 3 3 1 7 8 1 1 6 1 1 2 1 6 1 1 2 4 1 1 1 3 1 2 1 0.00 0.00 0.03 0.03 0.06 0.06 0.12 0.25 0.30 0.30 0.36 0.45 0.48 0.49 2.02 2.05 2.32 3.22 3.42 4.16 10.74 33.21 50.09 64.92 250.33 292.46 633.87 895.88 1256.39 osa00500 osa00500 osa00500 osa00500 osa00500 osa00500 osa00630 osa00480 osa00480 osa00500 osa00630 osa00630 osa00030 osa00010 osa00480 osa00480 osa00010,osa00030 osa00480 osa00010,osa00030,osa00500 osa00480 osa00010 osa00480 osa00010 osa00010,osa00630 osa00500 osa00010 osa00630 osa00480 osa00030
分别利用在PXY中上调和下调的差异表达蛋白质进行富集分析,分别获得6和4条具有显著差异的通路(P<0.05)(图7b和7c)。在新陈代谢功能层上,上调蛋白质参与的通路有谷胱甘肽代谢、糖酵解/糖异生、氨基糖和核苷酸糖代谢、戊糖磷酸途径、类苯基丙酸生物合成;下调蛋白质参与的通路包括淀粉和蔗糖代谢、色氨酸代谢、甘氨酸、丝氨酸和苏氨酸代谢,以及乙醛酸和二羧酸代谢。
3 讨论
目前已有关于稻米蛋白质组学的文献报道,显示不同品种、产地和存储方式的稻米蛋白质组成具有差异。但这些研究主要关注的是蛋白质组成差异对稻米食用品质和营养价值的影响[8-11],在酿酒加工方面鲜有涉及。本实验采用定量蛋白质组学技术解析两种酿酒稻米的蛋白质组成,揭示它们与白酒生产之间的潜在关系。
结果显示,两种稻米之间的差异表达蛋白质参与了很多与白酒生产直接相关的生物学过程和代谢通路,如GO富集分析中的糖酵解过程、乙醇响应、淀粉生物合成、蛋白水解作用、多糖分解代谢过程、丁香烯氧化生成丁香酸,以及KEGG富集分析中的糖酵解/糖异生、淀粉和蔗糖代谢、甘氨酸、丝氨酸和苏氨酸代谢等[18]。白酒发酵生产是将原料淀粉、蛋白质、脂肪等理化组分分解产生乙醇和风味物质的过程[4]。淀粉是白酒发酵的重要基础,主要由葡萄糖分子聚合而成[4]。在酿酒初期,淀粉在淀粉酶的作用下开始分解,再经糖化作用被进一步转化为可发酵的葡萄糖和麦芽糖等糖类物质,最后糖类物质经过无氧呼吸被转化为乙醇和二氧化碳[4]。蛋白质是白酒发酵的重要氮源,其经水解而成的各类氨基酸可经过脱羧、脱氨作用及美拉德反应产生风味物质[4]。其中,丁香酸是白酒中的一类芳香族化合物,常在以茅台酒为代表的酱香型白酒及其发酵酒醅中检出[20-22]。在所富集到的通路中,糖酵解在白酒发酵中的作用尤为重要[18,23-24],包括将葡萄糖等单糖分解为丙酮酸并产生三磷酸腺苷为细胞功能;产生的还原型烟酰胺腺嘌呤二核苷酸参与乙醇生成;提供丙酮酸为乳酸、乙酸、己酸等香味物质的生成提供前体;与其他代谢途径(如氨基酸代谢、脂肪酸代谢等)相互关联,构成复杂代谢网络产生多样化的香味物质,为白酒独特的风味和品质提供物质基础。
需指出的是在酿酒生产中,原料一般会经浸泡、蒸煮、冷却等工艺处理后制成酒醅用于白酒发酵[1]。在高温浸泡和蒸煮(约80 ℃)环节,原料部分蛋白质会变性,但其后续的冷却环节也为变性蛋白质恢复其天然构象和生物活性创造了条件。蛋白质变性和复性的机制高度复杂,与蛋白质种类、结构以及外部条件等因素有关[25]。总之,为深入揭示酿酒原料蛋白质组成对白酒生产的影响,还需结合原料籽粒及尤其制成的酒醅样品开展联合研究。
4 结论
本研究基于定量蛋白质组技术解析两种酿酒稻米的蛋白质组成,共检测到蛋白质5 153个,差异表达蛋白质223个。基于基因本体论(GO)、京都基因和基因组百科全书(KEGG)的富集分析结果显示,差异表达蛋白质参与白酒发酵的多种生物学过程和代谢通路,包括糖酵解/糖异生、淀粉生物合成、淀粉和蔗糖代谢、多糖分解代谢过程、蛋白水解作用、丁香烯氧化生成丁香酸等,表明原料蛋白质组成对白酒生产具有重要影响。目前,对酿酒原料的品质评价主要以淀粉、支链淀粉、脂肪、蛋白质等指标的含量为依据,今后应进一步加强对原料蛋白质组学研究,以完善评价体系,指导优质酿酒原料的品种选育与推广。
[1]ZHENG X F,HAN B Z.Baijiu,Chinese liquor:History,classification and manufacture[J].J Ethn Foods,2016,3(1):19-25.
[2]牛姣,沈毅,张贵虎,等.白酒酿造原料与酒体品质关系的研究进展[J].食品与发酵工业,2023,49(9):322-328.
[3]刘茂柯,田新惠,刘成元,等.不同品种高粱酿造浓香型白酒的香味物质组成差异及其影响因素[J].食品工业科技,2023,44(8):107-115.
[4]蒋力力,尹艳艳,杨军林,等.酿酒原料高粱对白酒品质影响的研究进展[J].中国酿造,2022,41(8):6-11.
[5]LABUSCHAGNE M T.A review of cereal grain proteomics and its potential for sorghum improvement[J].J Cereal Sci,2018,84:151-158.
[6]ABDELBOST L, MOREL M H, NASCIMENTO T P D, et al.Sorghum grain germination as a route to improve kafirin digestibility:Biochemical and label free proteomics insights[J].Food Chem,2023,424:136407.
[7]周丽慧,刘巧泉,张昌泉,等.水稻种子蛋白质含量及组分在品种间的变异与分布[J].作物学报,2009,35(5):884-891.
[8]曾睿,张果,郑腾达,等.基于iTRAQ技术的天然富硒与非富硒水稻差异蛋白分析[J].中 国粮油学报,2019,34(11):1-9.
[9]王有伟,苗燕妮,江鹏,等.水稻产量、蛋白质及食味特性的关联研究[J].中国农学通报,2017,33(5):1-5.
[10]孙术国,王若晖,林亲录,等.利用蛋白质组学技术研究不同储藏条件稻谷陈化机制[J].农业工程学报,2017,33(18):277-284.
[11]王颖姮,谢鸿光,陈飞鹤,等.籼稻福香占耐储藏性的蛋白质组学分析[J].科学通报,2023,68(28):3857-3868.
[12]郭长明,袁橙,朱善元,等.ITRAQ技术分析无乳链球菌牛源株与人源株差异表达蛋白[J].中国兽医学报,2018,38(6):1119-1125.
[13]郭小蛟,唐玉明,田新惠,等.基于两种预处理方法的白酒酒醅微生物宏蛋白质组学比较[J].食品科学,2022,43(20):216-221.
[14]HAMID Z,ZIMMERMAN K D,GUILLEN-AHLERS H, et al.Assessment of label-free quantification and missing value imputation for proteomics in non-human primates[J].BMC Genomics,2022,23(1):496.
[15]李琳,王磊,王文静,等.基于串联质谱标签法和平行反应监测技术的氟喹诺酮耐药沙门菌蛋白质组学分析[J].微生物学通报,2018,45(7):1535-1545.
[16]KANEHISA M,GOTO S,HATTORI M,et al.From genomics to chemical genomics: New developments in KEGG[J].Nucleic Acids Res, 2006,34:354-357.
[17]LIU M K,TANG Y M,LIU C Y,et al.Variation in microbiological heterogeneity in Chinese strong-flavor Baijiu fermentation for four representative varieties of sorghum[J].Int J Food Microbiol,2023,397:110212.
[18]LIU M K,TANG Y M,GUO X J,et al.Structural and functional changes in prokaryotic communities in artificial pit mud during Chinese Baijiu production[J].mSystems,2020,5(2):e00829-19.
[19]LIU M K, LIU C Y, TIAN X H, et al.Bioremediation of degraded pit mud by indigenous microbes for Baijiu production[J].Food Microbiol,2022,108:104096.
[20]TU W, CAO X, CHENG J, et al.Chinese Baijiu: The perfect works of microorganisms[J].Front Microbiol,2022,13:919044.
[21]NIU Y,YANG Y,MAO C,et al.Effects of gallic acid on the release of aroma compounds in Moutai Baijiu[J].Food Res Int,2024,176:113655.
[22]钟江,黄永光,周蝶,等.酱香型和清香型白酒糟多酚类物质解析及对短链脂肪酸调节作用研究[J].食品与发酵工业,2024,50(3):110-118.
[23]DAI Z, ZHU Y, DONG H, et al.Enforcing ATP hydrolysis enhanced anaerobic glycolysis and promoted solvent production in Clostridium acetobutylicum[J].Microb Cell Fact,2021,20(1):149.
[24]LI Z,CHEN Y,LIU D,et al.Involvement of glycolysis/gluconeogenesis and signaling regulatory pathways in Saccharomyces cerevisiae biofilms during fermentation[J].Front Microbiol,2015,6:139.
[25]邹灵,任丽琨,李笑梅,等.变性蛋白在复性过程中的结构变化研究进展[J].食品安全质量检测学报,2020,11(7):2037-2043.