小曲白酒,作为中国主要的白酒品种之一,其最显著的工艺特点是用曲量少,出酒率高,年产量约占据了国内白酒总产量的三分之一[1-2]。在小曲白酒的酿造过程中,培菌糖化环节至关重要,它是将小曲与熟粮混合均匀后,在一定温度下培养,使小曲中的根霉、酵母等微生物在熟粮上生长繁殖,它不仅将原料中的淀粉分解为糖,以提供适量的糖进行酒精发酵,而且促进了曲霉、酵母等微生物的增殖[3-4],共同形成了复杂的菌系、物系和酶系[5-6]。培菌糖化是白酒酿造的核心工艺,其效果直接影响白酒的出酒率和基酒品质。在培菌糖化过程中,精准把握糖化过程的终止时间,对于提升白酒品质和产量至关重要。而这一判断受到诸多因素的制约,包括糖化温度的调控、小曲的种类选择以及接种量的优化调整。若糖化时间管理不当,尤其是时间过长,不仅会导致淀粉的不必要损耗,增加配糟入池的成本,还会导致糟醅酸度升高,从而降低酒精的转化效率,对其出酒率和品质造成负面影响[7-8]。在保证酵母充分增殖和酶活性最大化的基础上,适当缩短糖化时间,可以显著提升糟醅中的酵母数量和还原糖含量,进而提高白酒的品质和产量[9]。糖化酶活力、还原糖含量和酵母数等指标是对培菌糖化效果进行评估的重要参数,它们的量化分析结果为确定糖化过程的终止时间提供了科学依据[10]。然而,在实际生产实践过程中,由于采样时效性、设备限制和技术挑战,要迅速且准确地监测这些指标以反映糖化效果仍存在困难[11-12]。
传统糖化工艺主要依赖人工在自然环境中进行操作,其中温度是糖化过程中容易监测的物理指标,但受季节和环境影响大。在不同季节,初始环境温度差异大,即使采用配糟保温,粮层厚度有限且环境条件不确定,导致难以精确控制糖化温度,进而影响对糖化过程的准确判断。这种情况下,糖化开箱时间的确定往往基于生产者的经验判断[13],如糟醅的气味、手感、色泽等。由于其主观因素强,不同生产者经验不同,判断标准差异大,难以保证糖化效果的稳定性和一致性,而且经验判断缺乏科学量化依据,新从业者难以快速掌握,不利于生产的标准化和规模化发展。同时随着机械化酿造技术的发展,通过精确控制糖化的升温曲线,实现定时定温,可以减少人工对糖化效果的影响,从而有助于提升糖化效率和质量[14]。因此,深入研究糖化过程并确定最佳开箱时机显得尤为重要,这对于指导糖化过程的生产控制,提高出酒率具有重要意义。培菌糖化的过程中伴随着糟醅的质量损失,糟醅质量损失与其微生物的生长代谢活动密切相关[15]。目前,国内外对白酒糟醅质量损失的研究主要集中在糟醅理化特性的解析、糟醅微生物调控、原料优化等方面。WANG B W等[16]研究表明,白酒糟醅的体积重量、含水量、酸度以及糖化酶活性与微生物的生长密切相关,较高的体积重量有助于维持糟醅适宜的含水量和酸度,从而促进糟醅微生物的生长和糖化酶的活性;而适宜的含水量和酸度又反过来影响微生物生长和代谢活动。苏占元等[17]研究表明,白酒糟醅中的微生物通过糖化酶和液化酶等将淀粉转化为还原糖,进一步代谢生成乙醇和CO2,在代谢过程中也消耗了一定量的水分,导致糟醅质量的减少。随着淀粉、水分的消耗,糟醅的硬度、回复性、内聚性逐渐增加,而黏着性下降[18],导致微生物生长繁殖和代谢活动减慢[19],并最终导致了糟醅质量的损失。在原料优化方面,唐贤华等[20-21]通过调节原粮配比和辅料添加量,优化糟醅的质构参数,从而确保了微生物的均匀代谢活动,实现糟醅质量损失和产酒效率的稳定性。ZHU H等[22]研究表明,川南糯红高粱因物理结构疏松和化学成分多样,能显著提升糟醅的微生物多样性及代谢效率,减少了淀粉的残留,从而减少了糟醅的质量损失。
为开发一种能够快速、准确表征小曲白酒糟醅糖化过程的方法,该研究选取了两种小曲(编号为1#和2#),采用常规理化方法检测糟醅糖化过程中酵母数、糖化酶活力、还原糖含量和失重率,通过相关性分析及多元线性回归分析研究这些指标在糟醅糖化过程中的变化规律及其互相关系。旨在确定培菌糖化的最佳出箱时间,并对优化小曲白酒生产过程和提高白酒质量具有重要的指导价值。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和小曲
糯高粱(黑龙江):市售;1#小曲:安琪酵母股份有限公司;2#小曲:重庆市合川区鑫星曲药厂。
1.1.2 试剂
氢氧化钠、葡萄糖、盐酸、硫酸铜、亚甲基蓝、酒石酸钾钠、亚铁氰化钾、磷酸二氢钾、乙酸、乙酸钠、酚酞等(均为分析纯)、可溶性淀粉(生化试剂):成都市科龙化工试剂厂。
1.1.3 培养基
麦芽浸膏琼脂(malt extract agar,MEA)培养基:麦芽浸粉20 g/L,蛋白胨3 g/L,琼脂20 g/L,蒸馏水定容至1 L,自然pH值,121 ℃灭菌20 min,添加氯霉素100 mg/L。
1.2 仪器与设备
JE2002电子分析天平:上海浦春计量仪器有限公司;CI54DS立式自动压力蒸汽灭菌锅:致微(厦门)仪器有限公司;LS-1201生化培养箱:上海三发科学仪器有限公司;JJ-CJ-2FD超净工作台:苏州净化设备厂;Labserv-LS-0610电热恒温干燥箱:上海一恒科仪器有限公司;AR2140电子秤:梅特勒托利多仪器(中国)有限公司;DK-98-2恒温水浴锅:天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 高粱前处理
取1 000 g高粱以沸水浸泡,将粮食刮平,水位淹过粮食表面20 cm左右,在室温(约20 ℃)条件下浸泡8 h。然后将高粱淘洗干净并装入甑中初蒸20 min,初蒸后用60 ℃左右的热水没过粮食闷30 min,放出闷粮水,将高粱复蒸40 min。蒸粮完成后,将高粱搅拌打散冷却至30 ℃,同时补充含水量至55%。
1.3.2 培菌糖化
将摊凉后的高粱接种不同的小曲,小曲用量为高粱质量的0.5%。接种后混匀,盖上纱布,于30 ℃条件下糖化24 h。在糖化开始后的12~24 h之内每隔2 h取样一次,通过记录取样前后使用容器的质量,计算糟醅糖化过程中失重率。糟醅失重率计算公式如下:
式中:X为失重率,g/(kg·2 h);M1为取样前糖化容器的质量,g;M2为取样后糖化容器的质量,g;M0为糖化前糟醅总质量,kg。
1.3.3 不同小曲接种量对糟醅糖化的影响
将摊凉后的高粱分别接种0.3%、0.5%、0.7%的1#、2#小曲,接种后混匀,盖上纱布,于30 ℃条件下糖化24 h,考察不同小曲接种量对糖化过程中糟醅失重率、酵母数、还原糖含量以及糖化酶活力等指标的影响。
1.3.4 不同温度对糟醅糖化的影响
将摊凉后的高粱接种0.5%的小曲,接种后混匀,盖上纱布,分别置于25 ℃、30 ℃、35 ℃条件下糖化24 h,考察不同温度对糖化过程中糟醅失重率、酵母数、还原糖含量以及糖化酶活力等指标的影响。
1.3.5 糟醅理化指标的测定
(1)还原糖含量
还原糖含量测定:参照地方标准DB34/T 2264—2014《固态发酵酒醅分析方法》[23]中的葡萄糖标准溶液反滴定法。
(2)酵母数和霉菌数
酵母菌数测定:采用平板计数法[24-25]。称取10 g样品于90 mL无菌水,30 ℃水浴锅中摇匀30 min,稀释涂布为10-3、10-4、10-5共3个梯度,每个梯度分别涂布于相应培养基平板上,重复3个平行,30 ℃倒置培养2 d后进行计数。选择菌落形成单位(CFU)在30~300之间的平板进行计数。
霉菌数测定:采用平板计数法[24-25]。称取10g样品于90mL无菌水,30 ℃水浴锅中摇匀30 min,稀释涂布为10-3、10-4、10-5共3个梯度,每个梯度分别涂布于相应培养基平板上,重复3个平行,28 ℃倒置培养3~5 d后进行计数。选择菌落形成单位(colony-forming units,CFU)在30~300之间的平板进行计数。
(3)糖化酶活力
糖化酶活力测定:采用次碘酸钠法[26]。称取10 g糟醅于250 mL锥形瓶中,加90 mL蒸馏水和10 mL乙酸-乙酸钠缓冲液(pH值为4.6),混匀后于35 ℃水浴锅中水浴1 h,过滤,得到滤液测定糖化酶活力。
糖化酶活力定义:1 g糟醅在35 ℃、pH 4.6条件下,1 h分解可溶性淀粉生成1 mg葡萄糖,为1个酶活力单位(U/g)。
1.3.7 数据处理
所有样品采集设置3个平行,每个样品重复测定3次,试验结果用“平均值±标准差”表示。利用Excel 2019、Origin 2022进行数据的处理及图表的绘制,用SPSS 20.0进行相关性分析[27]及多元线性回归分析[28]。
2 结果与分析
2.1 两种小曲白酒糟醅糖化关键指标的测定结果
采用两种小曲进行糟醅糖化实验,小曲添加量为0.5%,糖化温度为30 ℃,糖化时间为24 h。糖化酶活力、酵母数及霉菌数测定结果见表1。由表1可知,1#小曲糖化酶活力较高,达到1 921.11 U/g,酵母数也相对较高,为3.157 5×108CFU/g,表明其在将淀粉转化为可发酵糖方面有较高的效率,有利于后续的酒精发酵过程[29]。2#小曲虽然糖化酶活力较低,为621.59 U/g,但霉菌数所占比例较高,霉菌数达到了5.226×106 CFU/g,有利于其在糖化时积累大量的酶类,将底物分解为还原糖和有机酸[19]。小曲作为小曲白酒酿造的关键糖化发酵剂,其糖化发酵功能主要取决于微生物群落[30]。小曲中的微生物群落复杂多样,其中酵母和霉菌在糖化发酵过程中起关键作用[31]。选择适合的小曲进行培菌糖化实验需要综合考虑多种因素,而不能仅仅依据其初期的表现[32]。经过筛选,本研究选择在酵母数和霉菌数上具有显著特征的两种小曲,进行后续的糟醅糖化实验,以深入探究其糖化效果。
表1 两种小曲白酒糟醅糖化关键指标的测定结果
Table 1 Determination results of key indicators for saccharification of two kinds of Xiaoqu Baijiu fermented grains

小曲样品编号霉菌数/(×103 CFU·g-1)1#2#糖化酶活力/(U·g-1)酵母数/(×104 CFU·g-1)1 921.11±76.52 621.59±31.25 31 575±1 3.16248 34 200±861 654±71 5 226±646
2.2 糟醅糖化过程中理化指标的变化
培菌糖化过程的核心在于将原料中的淀粉通过酶的作用转化为可发酵的糖类,不仅促进了微生物的增殖[33],而且为后续的酒精发酵奠定了基础。在这一过程中,形成了对酒精发酵至关重要的微生物群落、酶类和代谢物质[34-36]。因此,糟醅的酵母数、糖化酶活力、还原糖含量可以作为反映糖化效果的主要指标[27-29]。不同小曲白酒糟醅糖化过程中理化指标的变化见图1。由图1可知,在培菌糖化12 h后,糟醅的酵母数、糖化酶活力和还原糖含量随糖化过程的进行而逐渐增加。由图1a可知,当糖化时间为12~18 h时,糟醅的酵母数、糖化酶活力随之上升;当糖化时间为18 h时,糟醅的酵母数、糖化酶活力最大,分别为611×104 CFU/g、90.95 U/g;当糖化时间>18 h之后,糟醅的酵母数、糖化酶活力随之下降。这与王海燕等[31]研究结果相符,表明在该阶段微生物经历了快速增殖后,由于环境因素如营养物质的消耗、代谢产物的积累等,导致其数量和活性逐渐降低。当糖化时间为12~22 h时,糟醅的还原糖含量随之上升;当糖化时间为22 h时,糟醅的还原糖含量最大,为3.73%;当糖化时间>22 h之后,糟醅的还原糖含量随之下降。这与陈帆等[15]研究结果相一致。由图1b可知,当糖化时间为12~20 h时,糟醅的酵母数、糖化酶活力随之上升;当糖化时间为20 h时,糟醅的酵母数、糖化酶活力最大,分别为810×104 CFU/g、112.60 U/g;当糖化时间>20 h之后,糟醅的酵母数、糖化酶活力随之下降。当糖化时间为12~22 h时,糟醅的还原糖含量随之上升;当糖化时间为22 h时,糟醅的还原糖含量最大,为3.9%;当糖化时间>22 h之后,糟醅的还原糖含量随之下降。本研究结果与TIE Y等[40-41]关于糖化过程中微生物生长、糖化酶活力变化的研究基本一致,都表明糖化过程存在微生物快速增殖、糖化酶活力上升和下降的阶段。因此,两种小曲白酒糟醅的糖化时间应为18~22 h。
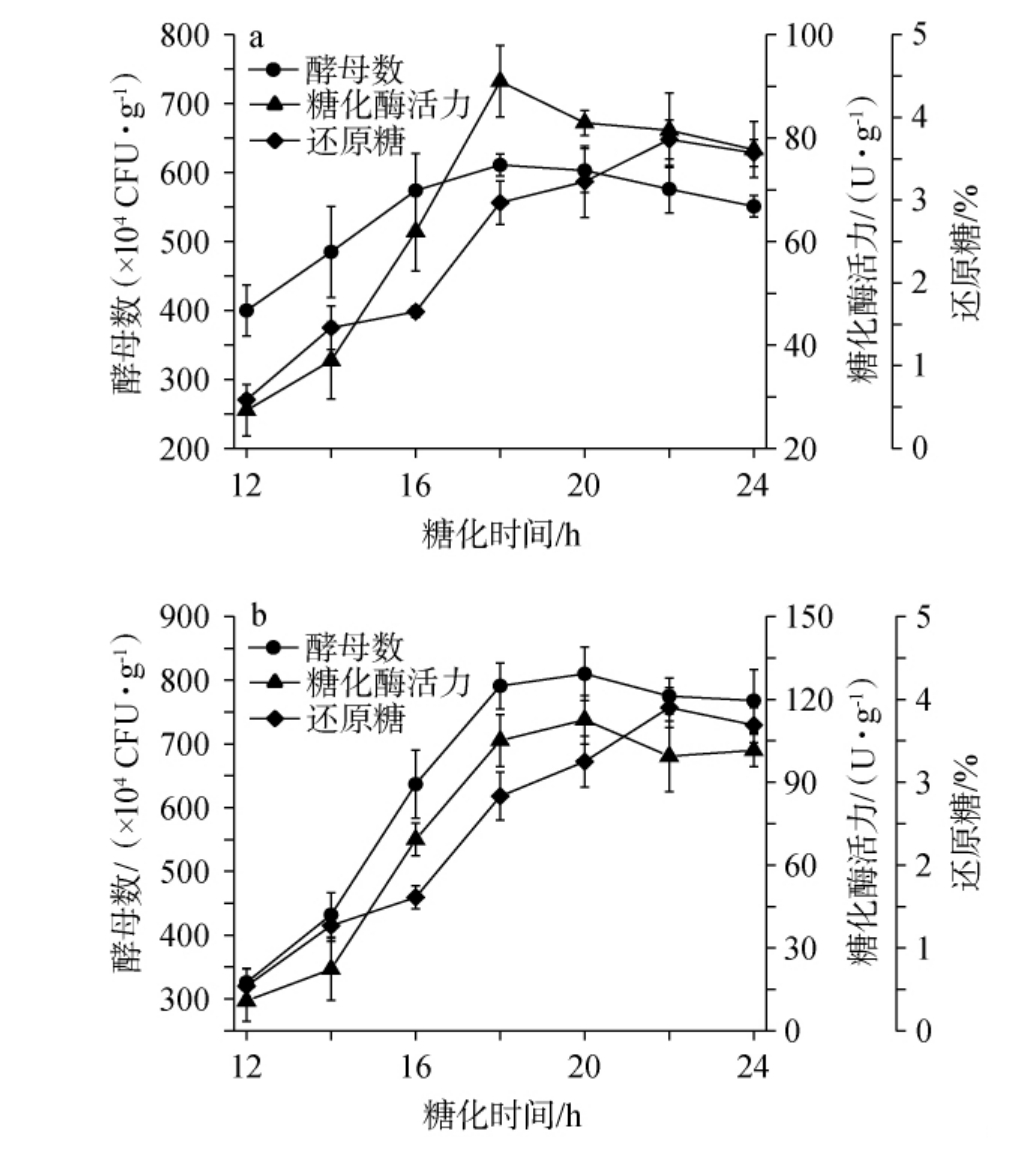
图1 1#(a)和2#(b)小曲白酒糟醅糖化过程中理化指标的变化
Fig.1 Changes of physicochemical indexes of 1# (a) and 2# (b) Xiaoqu Baijiu fermented grains during saccharification process
2.3 小曲白酒糟醅糖化过程中的失重率变化
不同小曲白酒糟醅糖化过程中糟醅失重率的变化见图2。由图2可知,1#小曲在糟醅糖化时间为12~24 h时,糟醅总质量损失达到21.44 g/kg。在糖化时间为12~20 h时,1#小曲糟醅的失重率随之逐渐增加;在糖化时间为20 h时失重率最高,为3.81 g/(kg·2 h);在糖化时间>20 h之后,糟醅的失重率有所下降。2#小曲糟醅在糖化时间为12~24 h时,糟醅总质量损失达到了22.19 g/kg。在糖化时间为12~18 h时,2#小曲糟醅的失重率逐渐增加;在糖化时间为18 h时,失重率最高,为3.87 g/(kg·2 h);在糖化时间>18 h之后,糟醅失重率有所下降。
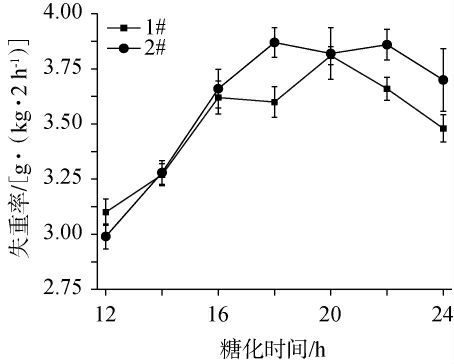
图2 两种小曲白酒糟醅糖化过程中失重率的变化
Fig.2 Changes of weight loss rates of two kinds of Xiaoqu Baijiu fermented grains during saccharification process
从糟醅失重率的角度分析,糖化初期微生物数量较少,且处于萌发和缓慢生长阶段,呼吸作用较弱,所消耗的水分和养分也较少,因此糟醅的失重率不明显;随着糖化的进行,在糖化开始后的16~22 h左右,微生物迅速增殖,酶活力高,大量消耗水分和养分,呼出二氧化碳,导致糟醅的失重率加快;然而,继续糖化,由于糟醅培养空间氧含量的下降、糟醅酸度的增加以及由高糖浓度引起的渗透压增高,微生物的增殖和酶活性受到抑制,表现为糟醅的失重率降低[32-33]。
2.4 糟醅主要糖化指标与失重率的相关性分析和多元线性回归分析
2.4.1 糟醅失重率的正态性检验分析
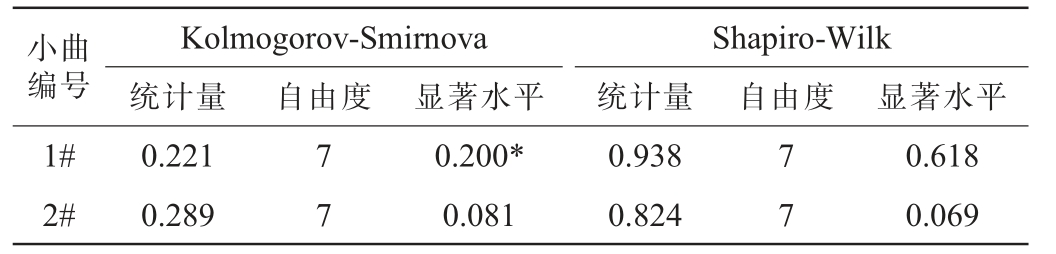
为了进行相关性和多元线性回归分析,要先对失重率的数据进行正态性检验,以确保结果的有效性和准确性。两种小曲糟醅失重率的正态性检验结果见表2。由表2可知,1#小曲糟醅失重率Kolmogorov-Smirnova检验的统计量为0.221,显著水平sig.=0.200>0.05;2#小曲糟醅失重率Kolmogorov-Smirnova检验的统计量为0.289,显著水平sig.=0.081>0.05。1#小曲糟醅失重率Shapiro-Wilk检验的统计量为0.938,显著水平sig.=0.618>0.05;2#小曲糟醅失重率Shapiro-Wilk检验的统计量为0.824,显著水平sig.=0.069>0.05。结果表明,两种小曲糟醅失重率数据均服从正态分布,因此可对其进行相关性和多元线性回归分析。
表2 糟醅失重率正态性检验结果
Table 2 Normality test results of weight loss rate of fermented grains
注:“*”表示真实显著水平的下限。
小曲编号1#2#Kolmogorov-Smirnova统计量 自由度显著水平0.221 0.289 7 7 Shapiro-Wilk统计量 自由度 显著水平0.200*0.081 0.938 0.824 7 7 0.618 0.069
2.4.2 糟醅主要糖化指标与失重率的相关性分析
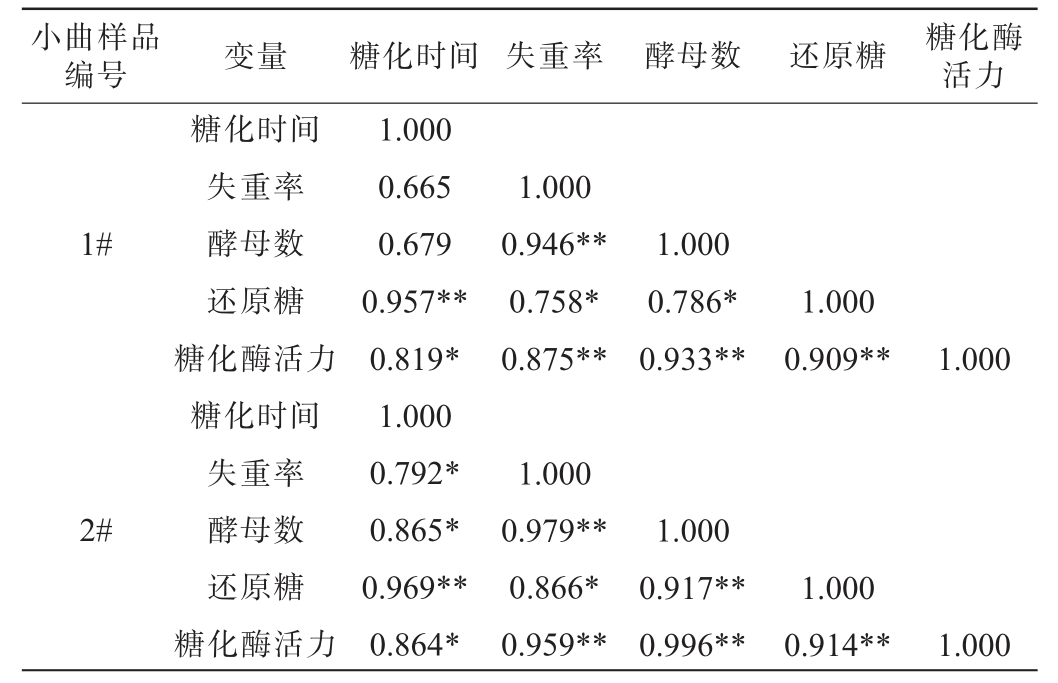
为进一步探究糟醅的失重率和糟醅的主要糖化指标的相关性,进行了相关系数的分析计算,结果见表3。由表3可知,1#小曲白酒糟醅酵母数、糖化酶活力与糟醅失重率呈极显著正相关(P<0.01),糟醅的还原糖含量与糟醅的失重率呈显著正相关(P<0.05),相关系数从大到小排序依次为酵母数(0.946)>糖化酶活力(0.875)>还原糖含量(0.758);2#小曲白酒糟醅也得到相似的相关性模式,酵母数、糖化酶活力与糟醅失重率呈极显著正相关(P<0.01),糟醅的还原糖含量与糟醅的失重率呈显著正相关(P<0.05),相关系数从大到小排序依次为酵母数(0.979)>糖化酶活力(0.959)>还原糖含量(0.866)。糟醅是微生物菌群繁殖与代谢的培养基,同时,微生物菌群与代谢产物是改变糟醅质构参数、理化指标的主要原因[44]。因此,糟醅的失重情况与微生物的生长、繁殖及代谢活动紧密相连,微生物代谢会消耗糟醅中的水分和营养物质,同时产生各种代谢产物,从而导致糟醅的质量逐渐减少。
表3 糟醅主要糖化指标与失重率的相关性分析
Table 3 Correlation analysis between main saccharification indicators and weight loss rate of fermented grains
注:“*”和“**”分别表示在P<0.05水平显著相关和P<0.01水平极显著相关。
小曲样品编号 变量 糖化时间 失重率 酵母数 还原糖 糖化酶活力1#1.000 0.946**0.758*0.875**1.000 0.786*0.933**1.000 0.909**1.000 2#糖化时间失重率酵母数还原糖糖化酶活力糖化时间失重率酵母数还原糖糖化酶活力1.000 0.665 0.679 0.957**0.819*1.000 0.792*0.865*0.969**0.864*1.000 0.979**0.866*0.959**1.000 0.917**0.996**1.000 0.914**1.000
2.4.3 糟醅主要糖化指标与失重率的多元线性回归分析
通过多元线性回归分析,建立了培菌糖化过程中糟醅失重率与酵母数、糖化酶活力、还原糖含量之间的关系,结果见表4。由表4可知,1#小曲糟醅的失重率(y1)与酵母数(X11)、糖化酶活力(X12)、还原糖含量(X13)的回归方程为y1=0.004X11-0.003X12+0.034X13+1.706(相关系数R2=0.901);2#小曲糟醅的失重率(y2)与酵母数(X21)、糖化酶活力(X22)、还原糖含量(X23)的回归方程为y2=0.005X21-0.014X22-0.05X23+1.528(相关系数R2=0.990)。
表4 多元线性回归分析结果
Table 4 Results of multivariate linear regression analysis
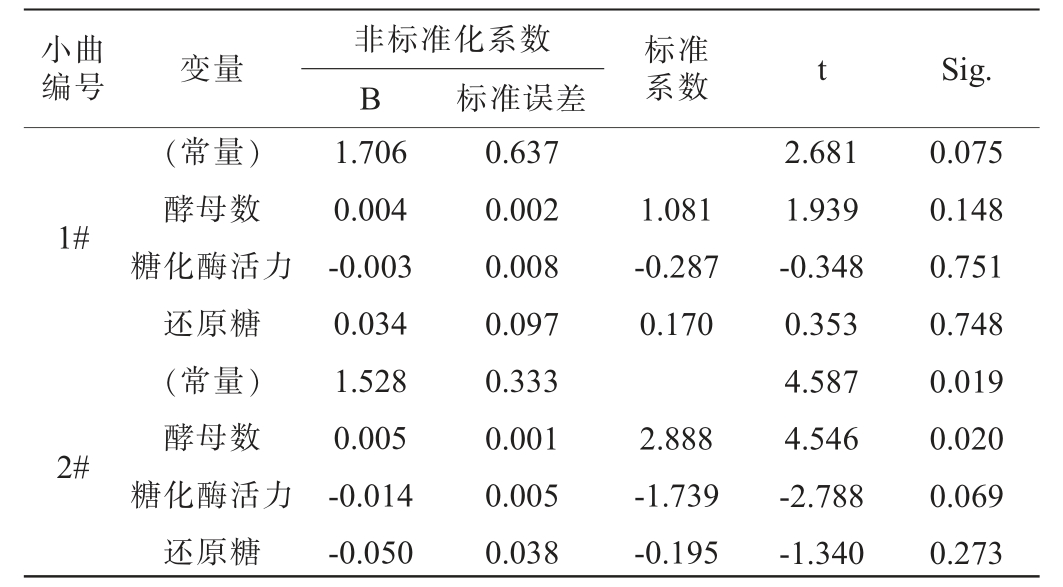
小曲 非标准化系数B 标准误差编号 变量 标准系数 t Sig.1#1.081-0.287 0.170 2#(常量)酵母数糖化酶活力还原糖(常量)酵母数糖化酶活力还原糖1.706 0.004-0.003 0.034 1.528 0.005-0.014-0.050 0.637 0.002 0.008 0.097 0.333 0.001 0.005 0.038 2.888-1.739-0.195 2.681 1.939-0.348 0.353 4.587 4.546-2.788-1.340 0.075 0.148 0.751 0.748 0.019 0.020 0.069 0.273
综合上述相关性和多元线性回归分析的结果,研究发现小曲糟醅的失重率与酵母数、糖化酶活力和还原糖含量呈正相关。具体而言,失重率的增加通常伴随着酵母数、糖化酶活力和还原糖含量的提高,这表明培菌糖化过程的推进是有效的。由此可知,在小曲糟醅的培菌糖化过程中,当失重率不再上升并达到最大值时,此时糟醅的酵母数、糖化酶活力和还原糖含量达到了较高水平,标志着培菌糖化过程达到了理想的效果,是糖化过程的最佳终止时间点。
2.5 不同条件下糟醅最大失重率与主要糖化指标的关系
2.5.1 不同接种量条件下糟醅失重率与主要糖化指标的关系
小曲接种量过高和过低都会对糖化过程和发酵过程产生较大的影响[32]。1#、2#小曲不同接种量对糟醅失重率、酵母数、糖化酶活力和还原糖含量影响结果分别见图3和图4。
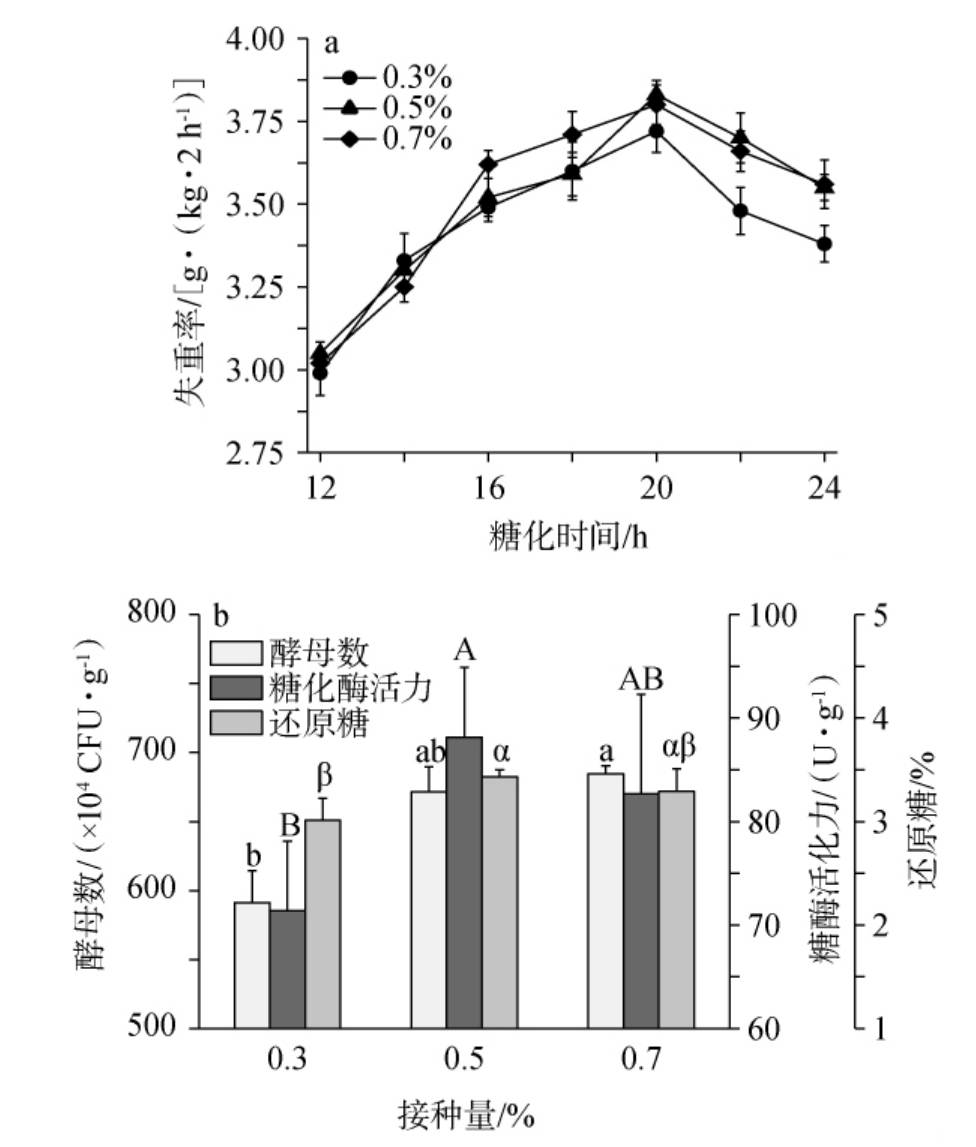
图3 1#小曲不同接种量对糟醅失重率(a)和酵母数、糖化酶活力、还原糖含量(b)的影响
Fig.3 Effect of different 1# Xiaoqu inoculum on weight loss rates (a)and yeast counts, saccharifying enzyme activity, reducing sugar contents (b) of fermented grains
不同小写字母表示酵母数差异显著(P<0.05),不同大写字母表示糖化酶活力差异显著(P<0.05),不同希腊字母表示还原糖差异显著(P<0.05)。下同。
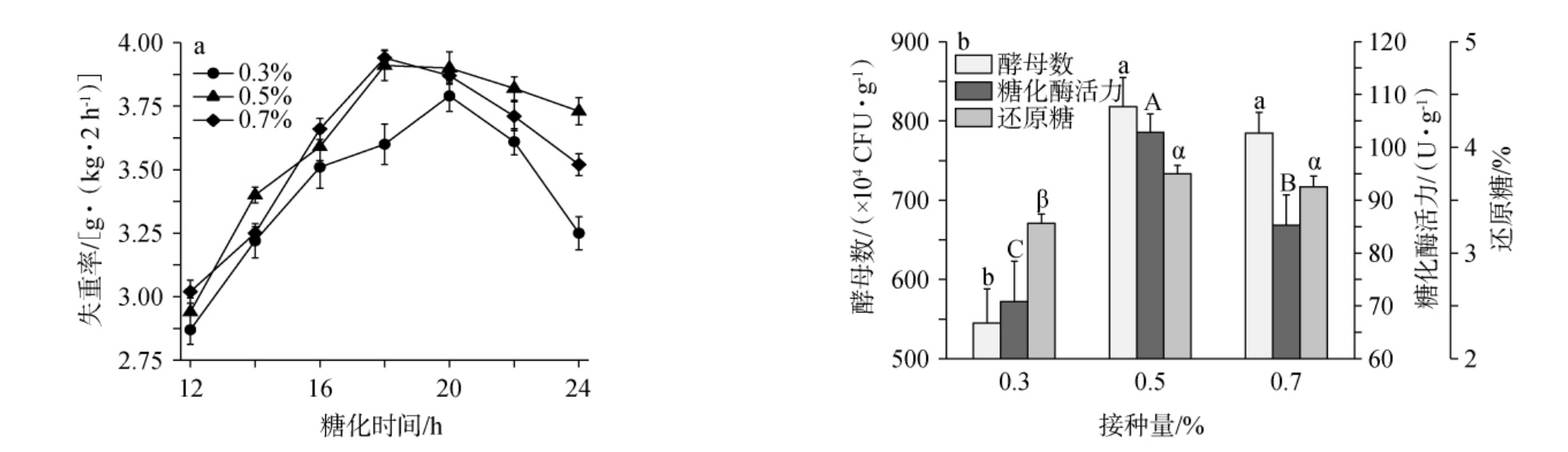
图4 2#小曲不同接种量对糟醅失重率(a)和酵母数、糖化酶活力、还原糖含量(b)的影响
Fig.4 Effect of different 2# Xiaoqu inoculum on weight loss rates (a) and yeast counts, saccharifying enzyme activities,reducing sugar contents (b) of fermented grains
由图3a可知,1#小曲糟醅在糖化时间为20 h时,不同接种量的小曲糟醅均达到了最大的失重率,且从大到小最大失重率依次为0.5%>0.7%>0.3%;由图3b可知,在接种量为0.5%和0.7%时,糟醅酵母数、糖化酶活力和还原糖含量相对较高,且接种量为0.5%时,糟醅的糖化酶活力、还原糖含量略高于接种量为0.7%时糟醅的相应指标。
由图4a可知,2#小曲糟醅在糖化时间为18~20 h时,不同接种量的小曲糟醅均达到了最大的失重率,且从大到小最大失重率依次为0.7%>0.5%>0.3%;且在接种量为0.5%和0.7%时,糟醅的酵母数、糖化酶活力和还原糖含量显著高于接种量为0.3%时的相应指标(P<0.05),尤其是在接种量为0.5%时,糟醅的糖化酶活力显著高于接种量为0.7%时糟醅的相应指标(P<0.05)。
在小曲接种量为0.3%~0.7%时,1#和2#小曲糟醅在培菌糖化过程中出现最大失重率的糖化时间均符合上述探讨的结果,且糟醅最大失重率和主要糖化指标具有较好的一致性,符合上述多元线性回归方程结果。综上,小曲接种量0.5%为宜。
2.5.2 不同温度条件下糟醅失重率与主要糖化指标的关系
温度也是影响培菌糖化过程的重要因素之一,在一定范围内,适宜的温度有助于微生物生长和酶发挥活性,促进糖化反应进行[45]。1#、2#小曲不同糖化温度对糟醅失重率、酵母数、糖化酶活力和还原糖含量影响结果分别见图5和图6。
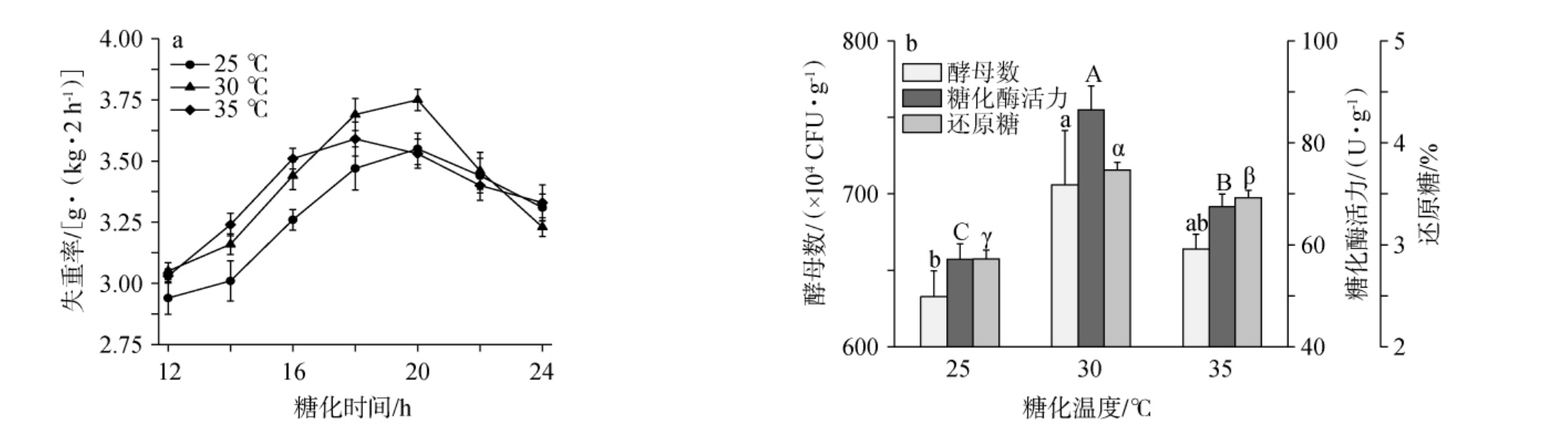
图5 1#小曲不同糖化温度对糟醅失重率(a)和酵母数、糖化酶活力、还原糖含量(b)的影响
Fig.5 Effect of different saccharification temperature of 1# Xiaoqu on weight loss rates (a) and yeast counts, saccharifying enzyme activities, reducing sugar contents (b) of fermented grains
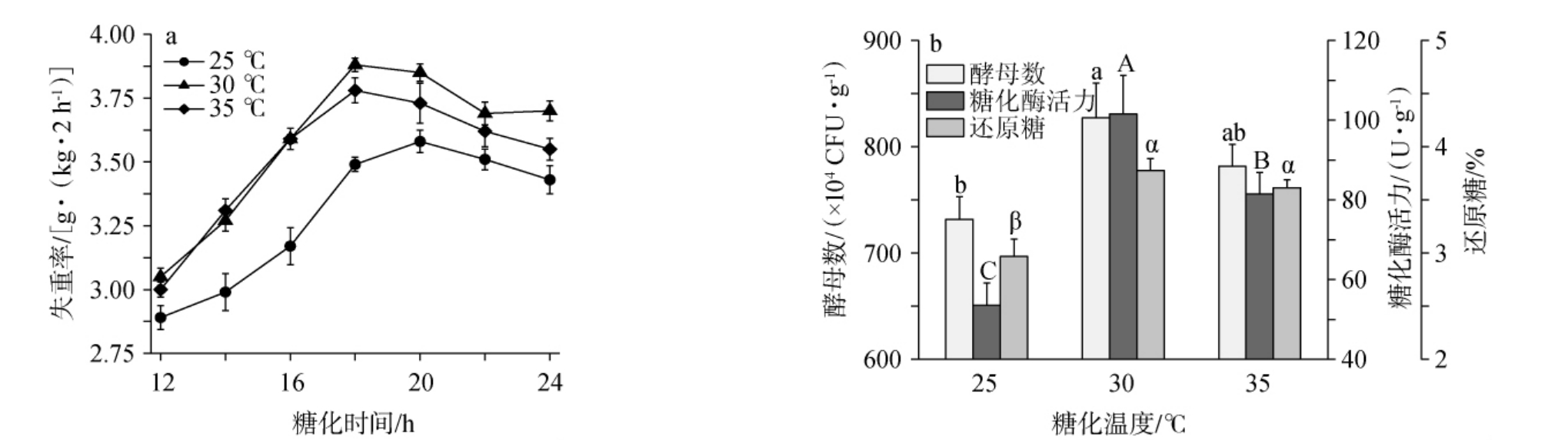
图6 2#小曲不同糖化温度对糟醅失重率(a)和酵母数、糖化酶活力、还原糖含量(b)的影响
Fig.6 Effect of different saccharification temperature of 2# Xiaoqu on weight loss rates (a) and yeast counts, saccharifying enzyme activities, reducing sugar contents (b) of fermented grains
由图5a可知,1#小曲糟醅在糖化时间为18~20 h时,不同糖化温度的小曲糟醅均达到了最大失重率,且从大到小依次为30 ℃>35 ℃>25 ℃。由图5b可知,在糖化温度为30 ℃时,糟醅的糖化酶活力、还原糖含量显著高于糖化温度为35 ℃时糟醅的相应指标(P<0.05),而35 ℃时糟醅的糖化酶活力和还原糖含量显著高于糖化温度为25 ℃时糟醅的相应指标(P<0.05)。
由图6a可知,2#小曲糟醅在糖化时间为18~20 h时,不同糖化温度的小曲糟醅均达到了最大失重率,且从大到小依次为30 ℃>35 ℃>25 ℃;由图6b可知,在糖化温度为30 ℃和35 ℃糖化时,糟醅的酵母数、糖化酶活力和还原糖含量较高,且糖化温度为25 ℃糖化时,糟醅的酵母数、糖化酶活力、还原糖含量显著低于前两者(P<0.05)。
在糖化温度为25~35 ℃时,1#和2#小曲糟醅在培菌糖化过程中出现最大失重率的糖化时间均符合上述探讨的结果,且糟醅最大失重率和主要糖化指标具有较好的一致性,符合上述多元线性回归方程结果。综上,糖化温度30 ℃为宜。
3 结论
在小曲白酒的酿造过程中,培菌糖化环节对白酒的出酒率和基酒品质起着决定性作用。精准把握糖化过程,确定最佳开箱时间,是提升产品质量与产量的关键。本研究聚焦于糟醅失重率的变化,将失重率与糖化过程中酵母数、糖化酶活力、还原糖含量等主要参数进行偶联分析。结果显示,在糖化12 h后,糟醅失重率逐渐上升,1#小曲在糖化时间20 h、2#小曲在糖化时间18 h分别达到最大失重率3.81g/(kg·2 h)和3.87g/(kg·2 h),之后开始下降。通过相关性和多元线性回归分析,建立了培菌糖化过程中糟醅失重率与酵母数、糖化酶活力、还原糖含量之间的关系。1#小曲回归方程为y1=0.004X11-0.003X12+0.034X13+1.706,相关系数R2=0.901;2#小曲回归方程为y2=0.005X21-0.014X22-0.05X23+1.528,相关系数R2=0.990。且在不同糖化条件下,小曲糟醅的最大失重率与酵母数、糖化酶活力、还原糖含量变化趋向一致。因此,糟醅失重率可作为表征糖化过程的一个有效指标,糟醅的失重率越大,培菌糖化效果越好。当糟醅失重率达到最大值时,可确定为糟醅培菌糖化的终点。本研究为判断培菌糖化的出箱时间提供依据,在小曲白酒的机械化酿造中具有一定的应用前景。
[1]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2007:90-93.
[2]李大和,李国红.川法小曲酒生产技术的传承创新[J].酿酒,2015,42(1):2-9.
[3]王春晓,唐佳代,吴鑫颖,等.酿酒小曲中功能微生物的研究进展[J].食品科学,2019,40(17):309-316.
[4]傅其旭,车经纬,张怀山,等.小曲酿酒的研究进展[J].轻工科技,2018,34(5):1-2,16.
[5]华南工学院.酒精与酒工艺学[M].北京:中国轻工业出版社,1990:431-438.
[6]XUAN Y, YUMIKO Y, MAKOTO I, et al.Manufactural impact of the solid-state saccharification process in rice-flavor Baijiu production[J].J Biosci Bioeng,2020,129(3):315-321.
[7]LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[8]江建军,杨官荣,黄志瑜.四川小曲白酒技术的继承与创新(上)[J].酿酒,2011,38(5):7-11.
[9]丁子元,叶力,郑晓卫,等.小曲培菌糖化研究进展[J].中国酿造,2023,42(6):7-11.
[10]张大鑫,黄润娜,韩素娜,等.陶融型调味酒培菌糖化工艺研究[J].酿酒科技,2022(4):38-42,47.
[11]车利伟.苦荞小曲酒生产工艺研究及工厂工艺设计[D].天津:天津科技大学,2015.
[12]林晓婕,梁璋成,黄飞,等.红曲米糖化酶提取工艺及其糖化力测定方法选优[J].福建农业学报,2016,31(8):892-896.
[13]杨再懿,殷泽培,冯亮,等.馥郁香型白酒机械化车间糖化入箱温度工艺优化[J].现代食品,2024,30 (23):98-102.
[14]黄志久,赵金松,刘莎,等.小曲清香白酒生产工艺现状及发展趋势[J].酿酒,2018,45(6):17-19.
[15]陈帆,沈永祥,刘怀臣,等.小曲酒新工艺糖化培菌规律研究[J].酿酒科技,2017(8):47-54.
[16]WANG B W, WU Q, XU Y, et al.Specific volumetric weight-driven shift in microbiota compositions with saccharifying activity change in starter for Chinese Baijiu fermentation[J].Front Microbiol,2018,9:2349.
[17]苏占元,张良,张宿义,等.生物反应器中糟醅发酵动态的研究[J].酿酒科技,2015(6):61-64.
[18]赵东,牛广杰,彭志云,等.TPA分析技术测定参数的确定及对不同层次入窖糟醅物性的初步测定[J].酿酒,2012,39(1):18-21.
[19]HU Y L,YANG Q,CHEN D,et al.Study on microbial communities and higher alcohol formations in the fermentation of Chinese Xiaoqu Baijiu produced by traditional and new mechanical technologies[J].Food Res Int,2021,140:109876.
[20]唐贤华,张崇军,隋明,等.不同粮食用量糟醅的质构特性和理化参数相关性研究[J].酿酒,2020,47(1):84-88.
[21]唐贤华,张崇军,隋明,等.不同糠壳用量糟醅的质构特性与理化指标的相关性研究[J].中国酿造,2019,38(9):138-142.
[22]ZHU H,LI Q,SAPPAH E H A,et al.Influence of two sorghum varieties on metabolic factors,microbial community, and flavor component precursors of strong-flavor Baijiu Zaopei[J].Food Chem,2025:143079.
[23]安徽省质量技术监督局.DB34/T2264—2014 固态发酵酒醅分析方法[S].合肥:安徽科学技术出版社,2014.
[24]龚军辉,王晶.稀释涂布平板法计数活菌的方法简介[J].生物学教学,2018,43(2):70-71.
[25]国家卫生和计划生育委员会.GB 4789.15—2016 食品安全国家标准食品微生物学检验霉菌和酵母计数[S].北京:中国标准出版社,2016.
[26]周斐成,吴生文,朱庆圣,等.特香型大曲发酵过程中曲块不同部位理化指标及主要酶系动态分析[J].中国酿造,2019,38(4):58-64.
[27]张占阳,周铭辉,高艳龙,等.基于Pearson相关系数分析唐山台断层CO2浓度与地温相关性及其与地震的关系[J].内陆地震,2022,36(3):227-236.
[28]刘振洋,赵家松,胡仁傑,等.基于关联规则与多元线性回归的云南省甘蔗产量预测模型[J].广东农业科学,2022,49(12):160-166.
[29]WANG C X,TANG J D,QIU S Y.Profiling of fungal diversity and fermentative yeasts in traditional Chinese Xiaoqu[J].Front Microbiol,2020,11:2103.
[30]王柏文.小曲糖化酶谱形成机制及其对白酒发酵过程的影响[D].无锡:江南大学,2020.
[31]王海燕,唐洁,徐岩,等.清香型小曲白酒中微生物组成及功能微生物的分析[J].酿酒科技,2012(12):48-52.
[32]陆其刚,李喆,张广松,等.不同小曲对清香型小曲酒生产的影响[J].酿酒科技,2017(12):73-77.
[33]WU H C,ZHANG S Y,MA Y Y,et al.Comparison of microbial communities in the fermentation starter used to brew Xiaoqu liquor[J].J I Brewing,2017,123(1):113-120.
[34]王旭亮,王异静,王德良,等.白酒发酵高糖化性能霉菌的筛选及鉴定[J].酿酒科技,2012(9):22-28.
[35]李俊俊,唐湘华,段永忠,等.复合酶在云南小曲白酒生产中的应用研究[J].食品工业科技,2009,30(1):178-179,182.
[36]WANG J,ZHONG Q P,YANG Y Y,et al.Comparison of bacterial diversity between two traditional starters and the round-koji-maker starter for traditional cantonese chi-flavor liquor brewing[J].Front Microbiol,2018,9:1053.
[37]吕义俊,孙齐,郭唐芳,等.清香型小曲酒糖化发酵过程微生物及色谱指标变化规律研究[J].酿酒科技,2022(3):31-34,46.
[38]CHENG W,CHEN X F,ZHEN H W,et al.Association between microbial community composition and quality indicators of strong-flavor Daqu of different producing regions in China[J].CyTA-J Food,2023,21(1):82-92.
[39]易良键.小曲白酒的生产工艺及质量控制[J].中国科技信息,2012(7):122-130.
[40]TIE Y,WANG L,DING B,et al.Investigating the main contributors to esterification activity and identifying the aqueous-phase ester synthases in Daqu[J].Food Biosci,2025,66:106227.
[41]ZHU M,DENG Z,WANG M Y,et al.Decoding the synergistic mechanisms of functional microbial agents on the microecology and metabolic function in medium-high temperature Daqu starter for enhancing aromatic flavor[J].Food Chem X,2025,26:102304.
[42]王鹏,蒋超,常强,等.绵甜型白酒酿造过程中酒醅理化指标的变化规律[J].酿酒科技,2019(3):59-64.
[43]杨磊,程铁辕,吴树坤,等.沉香型白酒酒醅理化特性及细菌群落结构研究[J].中国酿造,2020,39(2):109-114.
[44]常勇勇,林一心,尉军强,等.浓香型白酒糟醅质构及微生物菌群研究进展[J].中国酿造,2024,43(10):6-12.
[45]邱增钰,王亚平,李博艺,等.温度对高温大曲液态培菌过程菌群结构的影响[J].中国酿造,2017,36(5):30-35.