浓香型白酒是我国四大香型白酒之一,历史悠久,具有独特的风味和香气,年产量占中国白酒的70%以上[1-2]。浓香型白酒以高粱为酿酒原料,采用泥窖固态发酵,续糟配料,混蒸混烧的独特酿造工艺,以己酸乙酯、乙酸乙酯、乳酸乙酯、丁酸乙酯为主体香,具有“窖香浓郁、甘冽清爽、饮后尤香、回味悠长”的风格特征[3-5]。
酒醅作为固态发酵的载体,包含霉菌、细菌、酵母菌、产甲烷菌等丰富的酿造微生物区系,这些微生物主要来自于酒曲、窖泥和生产环境,还受到发酵条件及参数等的影响[6-7],因此,发酵过程中酒醅中的群落结构及演替规律相对来说更为复杂。曾波等[8]利用通过高通量测序技术解析酒醅发酵过程中微生物群落的动态变化。结果表明,厚壁菌门(Firmicutes)是酒醅中的优势菌门,乳杆菌属(Lactobacillus)、哈萨克斯坦酵母属(Kazachstania)、威克汉姆酵母属(Wickerhamomyces)在属水平上占绝对优势。钟娟等[9]通过高通量测序技术对浓香型白酒酒糟堆积发酵过程中的细菌、真菌菌群进行分析。结果表明,自然堆积发酵过程中优势细菌属为芽孢杆菌(Bacillus)、肿块芽孢杆菌属(Tuberibacillus)、醋酸杆菌属(Acetobacter);优势真菌属为嗜热菌属(Thermus)、棒孢酵母属(Clavispora)和丝衣霉菌属(Byssochlamys)。韩兴林等[10]利用高通量测序技术解析了浓香型白酒酒醅中微生物群落的组成及变化规律,结果发现,不同发酵阶段的酒醅中微生物群落组成差异较大,在属水平上,Lactobacillus是贯穿整个发酵过程的绝对优势菌属。
本研究采用常规检测方法实时检测不同窖龄浓香型白酒发酵过程酒醅理化指标的变化规律,结合高通量测序技术解析发酵过程酒醅的细菌和真菌群落结构,探究发酵过程中酒醅的微生物群落结构变化,并对酒醅发酵过程中微生物与理化因子进行相关性分析,以期剖析发酵过程中理化指标对微生物群落的影响机制,为白酒生产提供一定的指导及理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醅:泸州老窖股份有限公司。
1.1.2 化学试剂
NaOH、酚酞、次甲基蓝、HCl、葡萄糖、CuSO4·5H2O、酒石酸钾钠(均为分析纯):成都市科龙化工试剂厂;Fast脱氧核糖核酸(deoxyribonucleic acid,DNA)SPIN Kit:美国MP Biomedicals公司;NEXTFLEX TM Rapid DNA-Seq Kit建库试剂盒:美国Bioo Scientific公司。其他试剂均为国产分析纯。
1.2 仪器与设备
E.Z.N.A. soil DNA kit:美国Omega Bio-tek公司;eAmp R 9700聚合酶链式反应(polymerase chain reaction,PCR)仪、ABI7300型荧光定量PCR仪:美国ABI公司;NanoDrop2 000核酸微量测定仪:美国Thermo Fisher Scientific公司;QuantusTM Fluorometer微型荧光计:美国Promega公司;Illumina Miseq PE300高通量测序仪:美国Illumina公司。
soil DNA kit:美国Omega Bio-tek公司;eAmp R 9700聚合酶链式反应(polymerase chain reaction,PCR)仪、ABI7300型荧光定量PCR仪:美国ABI公司;NanoDrop2 000核酸微量测定仪:美国Thermo Fisher Scientific公司;QuantusTM Fluorometer微型荧光计:美国Promega公司;Illumina Miseq PE300高通量测序仪:美国Illumina公司。
1.3 方法
1.3.1 样品的采集与保存
根据实际生产工艺,选取窖池窖龄为5年酒醅(a5)和50年酒醅(a50),取发酵期前60 d的酒醅样品,分别在0 d、7 d、14 d、21 d、28 d、45 d、60 d这7个时间点取样,在窖池对角线以及中心处设置5个取样点,于窖坎下方20~30 cm处取样,不同位置分别取样后置于无菌取样袋中立即密封混合均匀,样品根据取样时间进行编号,a5(a5_1、a5_2、a5_3、a5_4、a5_5、a5_6、a5_7)、a50(a50_1、a50_2、a50_3、a50_4、a50_5、a50_6、a50_7),共计14个酒醅样品。
1.3.2 理化指标及温度的检测
温度:将温度计插入糟醅层核心区域进行实时监测;水分:采用热风干燥质量恒定法测定[9];酸度:采用酸碱电位滴定法测定[10];淀粉含量:采用酸水解法测定[10]。
1.3.3 DNA提取、PCR扩增及高通量测序
使用E.Z.N.A. soil DNA kit基因组提取试剂盒提取微生物群落的基因组DNA,采用1%琼脂糖凝胶电泳检测其完整性。以提取的基因组DNA为模板,使用携带Barcode序列的引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌菌群的16S rRNA基因V3-V4区基因序列进行PCR扩增;采用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2(5'-GCTGCGTTCTTCATCGATGC-3')对真菌菌群ITS1可变区进行PCR扩增。PCR扩增体系:5×TransStart FastPfu缓冲液4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,TransStart FastPfu DNA聚合酶0.4μL,模板DNA 10 ng,双蒸水(ddH2O)补足至20μL。PCR扩增条件:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存。PCR扩增产物使用2%琼脂糖凝胶电泳进行检测,将检测合格的产物委托上海美吉生物医药有限公司采用IlluminaNextseq2000高通量测序平台进行测序。
soil DNA kit基因组提取试剂盒提取微生物群落的基因组DNA,采用1%琼脂糖凝胶电泳检测其完整性。以提取的基因组DNA为模板,使用携带Barcode序列的引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌菌群的16S rRNA基因V3-V4区基因序列进行PCR扩增;采用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2(5'-GCTGCGTTCTTCATCGATGC-3')对真菌菌群ITS1可变区进行PCR扩增。PCR扩增体系:5×TransStart FastPfu缓冲液4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,TransStart FastPfu DNA聚合酶0.4μL,模板DNA 10 ng,双蒸水(ddH2O)补足至20μL。PCR扩增条件:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存。PCR扩增产物使用2%琼脂糖凝胶电泳进行检测,将检测合格的产物委托上海美吉生物医药有限公司采用IlluminaNextseq2000高通量测序平台进行测序。
1.3.4 生物信息学分析
根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样本数据,截去Barcode和引物序列后,使用FLASH(Version 1.2.11)对样品序列进行拼接。使用fastp软件(Version 0.23.1)进行过滤处理得到高质量的数据。使用Silva ribosomal database去除数据嵌合体序列,得到最终的有效序列(Effective Tags)。利用Uparse v7.0.1090中的Uparse算法对所有样本的全部有效序列进行聚类,以97%的一致性将序列聚类成为操作分类单元(operational taxonomic units,OTUs),采用Mothur1.30.2进行α多样性分析。
1.3.5 数据分析
采用Excel 2016软件处理数据及绘图,结果用“平均值±标准差”表示;通过上海美吉生物医药科技有限公司的多样性云分析平台(https://cloud.majorbio.com/)进行相关性网络图的绘制。
2 结果与分析
2.1 不同窖龄窖池酒醅发酵过程中理化指标及温度的变化
不同窖龄窖池酒醅发酵过程中理化指标及温度的变化见图1。
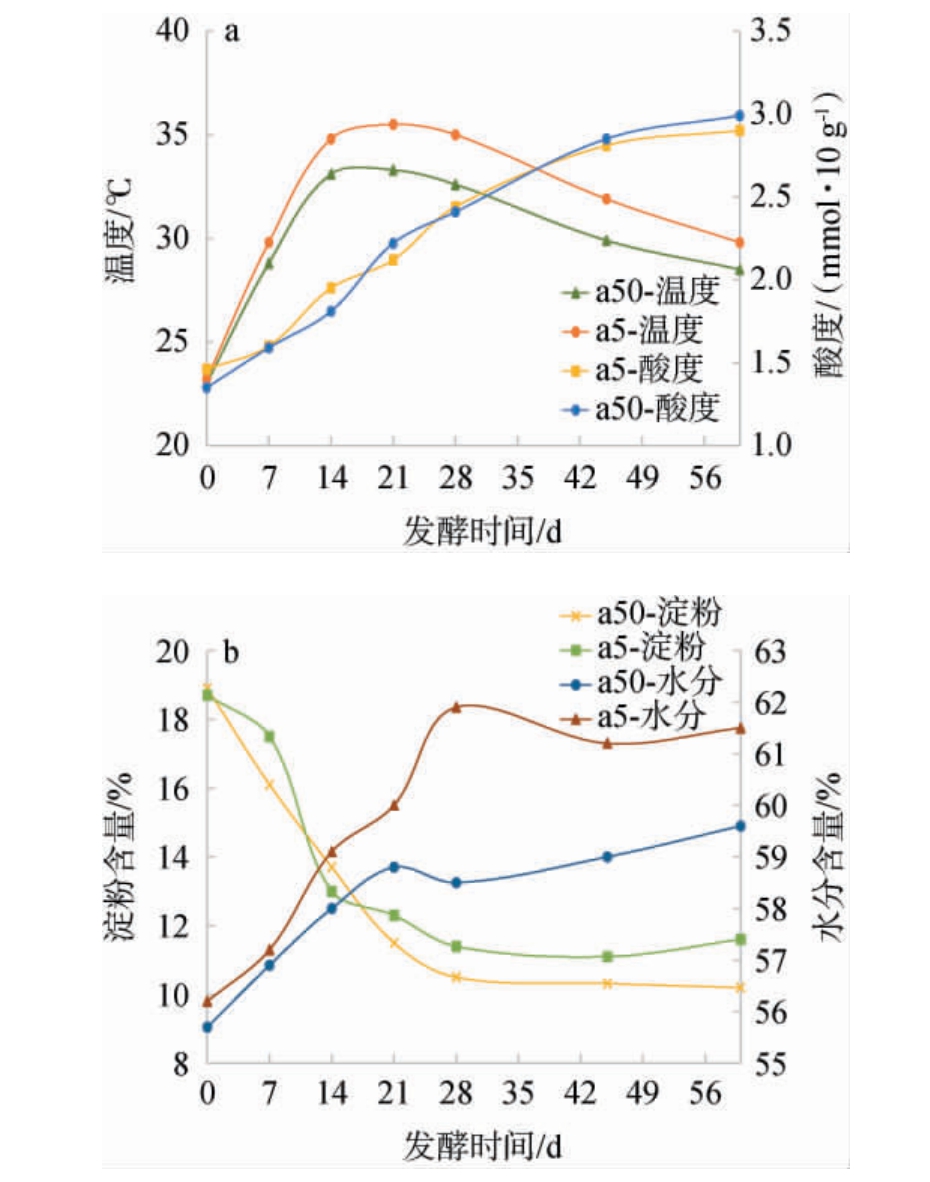
图1 不同窖龄窖池酒醅发酵过程中理化指标及温度检测结果
Fig.1 Determination results of physicochemical indicators and temperature of fermented grains in pits with different ages during fermentation process
由图1a可知,不同窖龄窖池酒醅发酵过程中温度的变化趋势相似,均呈现先上升后缓慢下降的特点,分析原因可能是发酵初期酵母菌快速生长繁殖,产生了大量的生物热,窖内温度升高,有利于发酵过程中微生物的生长繁殖;发酵20 d后,微生物产生的生物热小于散失的热能,且水分挥发损失一部分热,故发酵中后期表现为发酵温度逐渐降低[11]。发酵过程中酸度呈现逐渐升高的趋势,入窖酸度范围为1.3~1.5 mmol/10 g,该范围内的酸度适宜入窖发酵时有益微生物的生长需要;发酵0~28 d酸度升高速度快,发酵28~46 d酸度仍呈上升趋势,发酵46 d后酸度上升幅度趋于平缓,推测可能是因为微生物代谢需要大量营养物质,但发酵后期可发酵性糖不足,导致上升逐渐变缓[12]。
酒醅淀粉作为酿酒的主要碳源,变成可发酵性糖后可被微生物直接利用[13-14]。由图1b可知,不同窖龄窖池酒醅发酵过程中淀粉含量分别在0~14 d、0~21 d下降趋势明显,主要是由于此阶段微生物代谢旺盛,发酵过程中会随之产生较多的酶作用于淀粉类物质,促使酒醅淀粉含量迅速降低[15-16],发酵30 d后两组淀粉含量变化不明显;发酵结束时,a50组的淀粉含量低于a5组。不同窖龄窖池酒醅发酵过程中水分含量分别在0~28 d、0~21 d上升迅速,发酵中期均有不同程度的下降,推测可能是发酵前期微生物大量繁殖产生大量水,而随着窖内温度的升高,酒醅水分因自然挥发而逐渐降低,且酒醅温度的增加将加速水分的挥发[17],故酒醅发酵过程中水分变化曲线呈起伏状,但整体呈上升趋势。
综上所述,不同窖龄窖池酒醅发酵过程中温度及淀粉、酸度和水分理化指标变化均处于较适宜的范围内,整体发酵情况良好[4]。
2.2 不同窖龄窖池酒醅发酵过程中微生物群落结构分析
2.2.1 酒醅发酵过程中微生物群落的α多样性分析
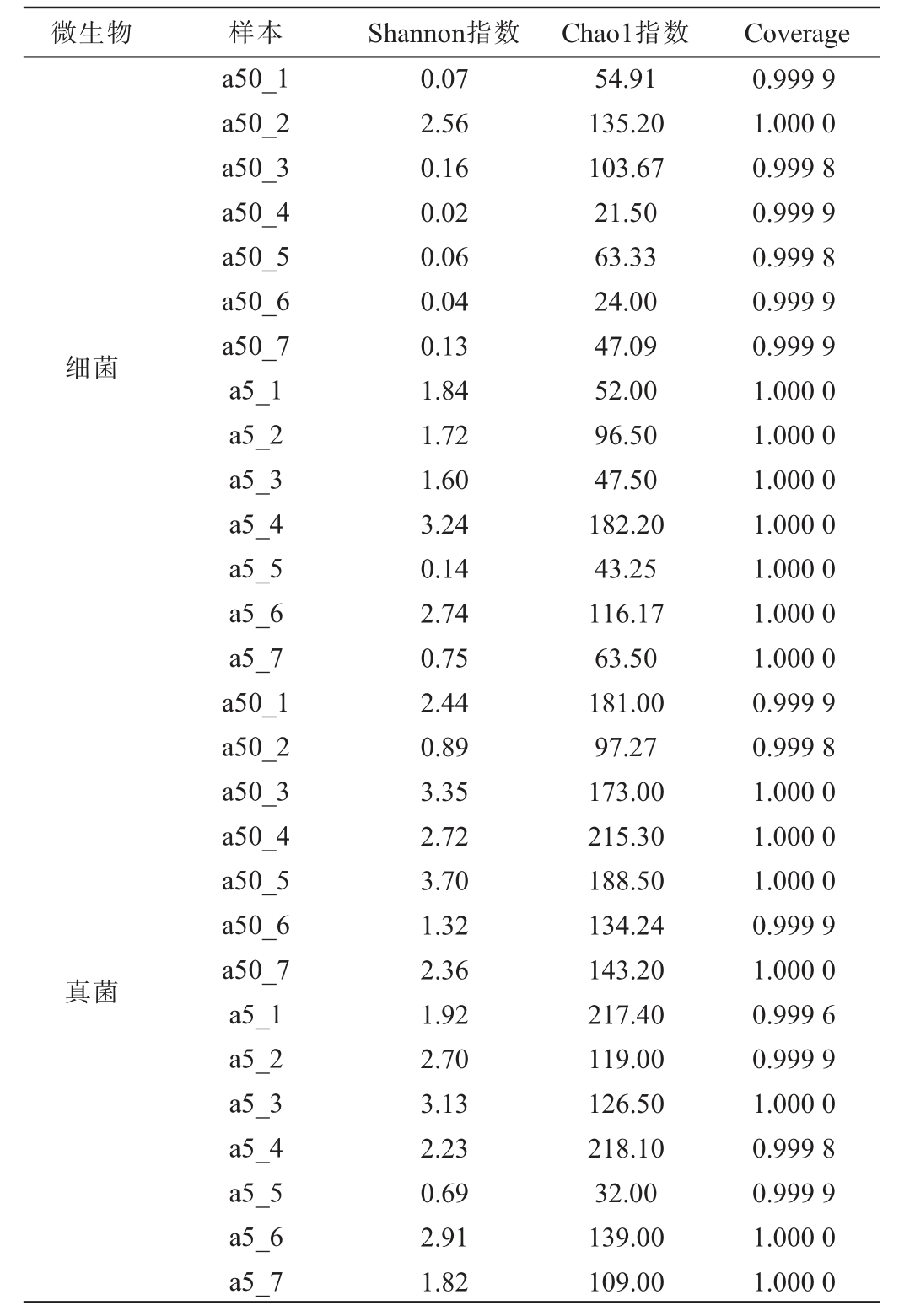
不同窖龄窖池酒醅发酵过程中微生物群落的α多样性分析结果见表1。Chao1指数反映群落丰富度,Shannon指数反映群落多样性[18],Coverage数值表示样本序列覆盖率[19],由表1可知,所有样品的Coverage数值均接近1,说明本次测序结果可以代表样品的真实情况,能够反映酒醅微生物多样性。
表1 不同窖龄窖池酒醅发酵过程中微生物群落的Alpha多样性分析结果
Table 1 Analysis results of Alpha diversity of microbial communities of fermented grains in pits with different ages during fermentation process
微生物 样本 Shannon指数 Chao1指数 Coverage细菌真菌a50_1 a50_2 a50_3 a50_4 a50_5 a50_6 a50_7 a5_1 a5_2 a5_3 a5_4 a5_5 a5_6 a5_7 a50_1 a50_2 a50_3 a50_4 a50_5 a50_6 a50_7 a5_1 a5_2 a5_3 a5_4 a5_5 a5_6 a5_7 0.07 2.56 0.16 0.02 0.06 0.04 0.13 1.84 1.72 1.60 3.24 0.14 2.74 0.75 2.44 0.89 3.35 2.72 3.70 1.32 2.36 1.92 2.70 3.13 2.23 0.69 2.91 1.82 54.91 135.20 103.67 21.50 63.33 24.00 47.09 52.00 96.50 47.50 182.20 43.25 116.17 63.50 181.00 97.27 173.00 215.30 188.50 134.24 143.20 217.40 119.00 126.50 218.10 32.00 139.00 109.00 0.999 9 1.000 0 0.999 8 0.999 9 0.999 8 0.999 9 0.999 9 1.000 0 1.000 0 1.000 0 1.000 0 1.000 0 1.000 0 1.000 0 0.999 9 0.999 8 1.000 0 1.000 0 1.000 0 0.999 9 1.000 0 0.999 6 0.999 9 1.000 0 0.999 8 0.999 9 1.000 0 1.000 0
在细菌方面,不同窖龄窖池酒醅发酵过程中微生物群落的Chao1指数及Shannon指数整体均呈现先升高后降低的趋势,a50_2样品、a5_4样品的Chao1指数及Shannon指数值均最大,说明整个发酵过程中,a50组和a5组酒醅样品细菌菌群的多样性及丰富度分别在第14天、第28天最高。发酵结束时,a50 组酒醅样品细菌菌群的Shannon指数和Chao1指数值均低于a5组,说明a50组酒醅样品细菌菌群的多样性及丰富度更低。在真菌方面,a50及a5组酒醅样品真菌菌群的Shannon指数值分别为0.89~3.70、0.69~3.13,a50_5和a5_3样品的Shannon指数值最高,说明50年窖龄窖池酒醅在发酵第28天时真菌菌群的多样性最高,而5年窖龄窖池酒醅在发酵第14天时最高。a50和a5组酒醅样品的Chao1指数值分别为97.27~215.30、32.00~218.10,a50_4和a5_4样品的Chao1指数值最高,说明50年及5年窖龄窖池酒醅均在发酵第21天时真菌菌群的丰富度最高。综合Chao1指数及Shannon指数,推测可能是发酵初期真菌快速增殖,微生物多样性急剧增加,随着酒醅快速升至顶温以及温度持续稳定,窖内发酵环节促使微生物的多样性发生改变,真菌微生物多样性降低到最低点。直到发酵结束,a50组酒醅样品真菌菌群的丰富度和多样性均高于a5组。
2.2.2 OTU分析
Venn图可以比较直观的表现不同样本中的共有OTU和特有OTU[20],因此对不同窖龄窖池酒醅中的微生物OTU进行分类统计,结果见图2。
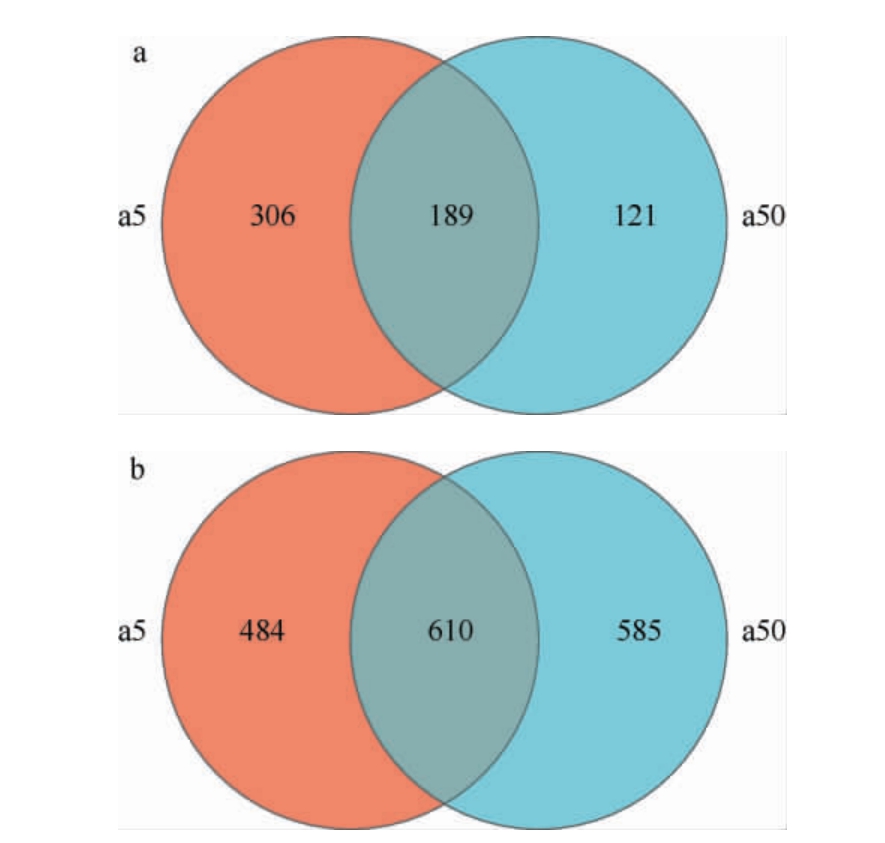
图2 不同窖龄窖池酒醅发酵过程中细菌(a)、真菌(b)操作分类单元分布Venn图
Fig.2 Venn diagram of bacterial (a) and fungul (b) operational taxonomic units in fermented grains in pits with different ages during fermentation process
由图2a可知,a5、a50组酒醅样品的细菌OTU数分别为495个、310个,特有的OTU数分别为306个、121个,共有的OTU数为189个,占样品组总OTU数的30.7%。由图2b可知,a5、a50组酒醅样品的真菌OTU数分别为1 094个、1 195个,特有的OTU数分别为484个、585个,分别占样品组总OTU数的26.9%、34.8%,共有OTU数为610个,占样品组总OTU数的36.3%,结果表明,a50组酒醅样品的真菌菌群多样性高于a5组,细菌多样性低于a5组。
2.2.3 酒醅发酵过程中细菌群落组成分析
基于门和属水平不同窖龄窖池酒醅发酵过程中细菌菌群结构见图3。从所有酒醅样品细菌菌群中共注释到27个门、58个纲、136个目、211个科、333个属。由图3a可知,a5组酒醅发酵过程中平均相对丰度排名前3的细菌门为厚壁菌 门(Firmicutes)、变 形 菌 门(Proteobacteria)、放 线 菌 门(Actinobacteriota),a50组酒醅发酵过程中厚壁菌门一直占绝对优势,其在发酵过程中相对丰度基本趋于稳定,推测主要原因是随着发酵的进行酒醅酸度和酒精度增加,窖内微生态环境恶劣,不适宜大量微生物的生长,仅有少量适应酸性厌氧环境的微生物生长,而很多厚壁菌可以产生内生孢子,可以抵抗极端环境,所以在发酵中后期厚壁菌门的相对丰度最大[21]。相比于a50组,a5组酒醅样品的细菌群落在发酵过程中一直未完全趋于稳定,可能是因为窖龄较短的窖泥,自身也处于一个动态演替过程,不如老窖泥稳定,导致其影响了糟醅微生物。
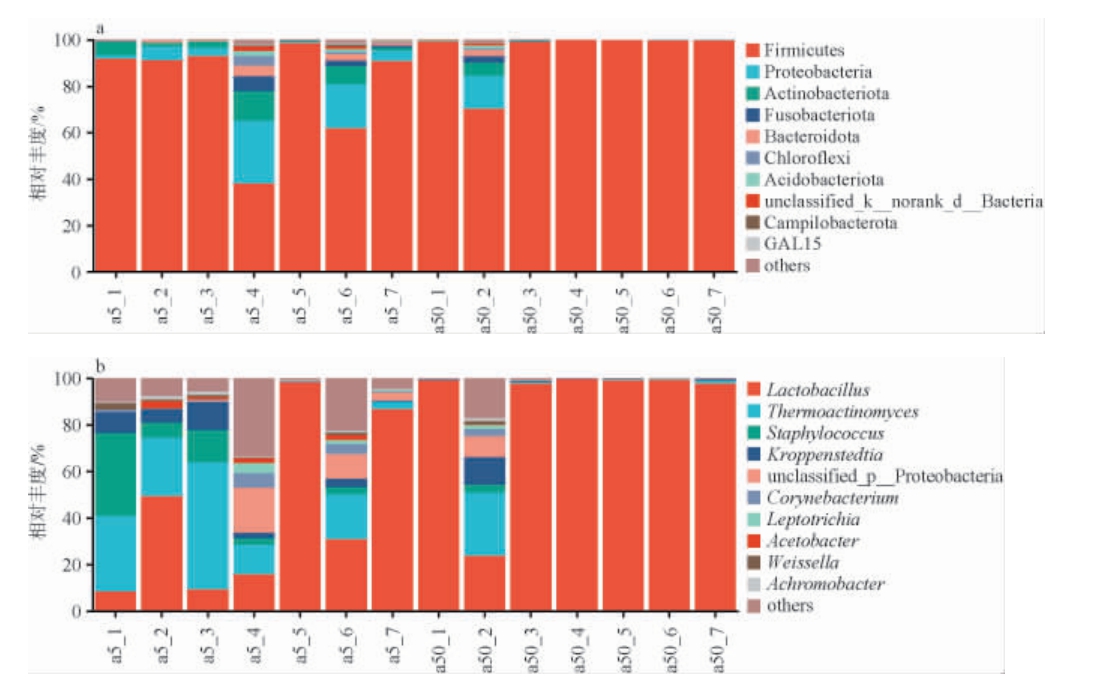
图3 基于门(a)和属(b)水平不同窖龄窖池酒醅发酵过程中细菌群落结构
Fig.3 Bacterial community structure in fermented grains in pits with different ages during fermentation process based on phylum(a) and genus (b) levels
Others:相对丰度<1%的其他菌门或菌属之和。下同。
由图3b可知,不同窖龄窖池酒醅发酵过程中主要细菌属均为乳杆菌属(Lactobacillus)、高温放线菌属(Thermoactinomyces)、葡萄球菌属(Staphylococcus)和克罗彭斯特德菌属(Kroppenstedtia),发酵结束后,这4种细菌属在a50、a5组酒醅样品中的总相对丰度分别为94.8%、77.5%,Lactobacillus作为不同窖龄窖池酒醅发酵结束时的绝对优势细菌属,代谢产物主要是乳酸,研究发现以乳酸为电子供体,在一系列酶的催化下,可实现碳链的逐步延长,最终合成中链脂肪酸己酸,其可作为合成己酸乙酯前体物质[22],从而增加酒体风味;Thermoactinomyces具有较强的耐高温特性,具有分泌蛋白酶、淀粉酶等多种功能酶的能力,并将大分子物质分解形成风味物质,对白酒产香有促进作用[23-26]。不同窖龄窖池酒醅发酵前期菌群种类均较多,这是由于窖内营养物质丰富,同时氧气含量较高,酒醅酸度较低,所以一些好氧细菌,例如Thermoactinomyces、Staphylococcus相对丰度较大,但是随着窖内溶氧量的减少以及微环境的改变,发酵中后期相对丰度逐渐减少,其他优势菌种越来越占有优势。虽然不同窖龄窖池酒醅主要细菌属类似,但其群落的演变速度存在明显差异,窖龄越老的窖池酒醅微生物群落演变更迅速,在发酵第14天,Lactobacillus便成为了绝对优势菌属,且一直维持不变。新窖龄窖池酒醅的主要细菌属较多,且不断演变。可能是因为在相同的生产方式和曲药下,酒醅微生物主要受窖泥微生物的影响。随着窖龄的增长,其微生物经过了长时间的驯化和群落更替,微生物逐渐适应窖泥而形成了优势群体[27],导致a50发酵过程中酒醅微生物群落演替更为迅速。
2.2.4 酒醅发酵过程中真菌群落组成分析
基于门和属水平不同窖龄窖池酒醅发酵过程中真菌菌群结构见图4。从所有酒醅样品真菌菌群中共注释到11个门、38个纲、96个目、230个科、488个属。
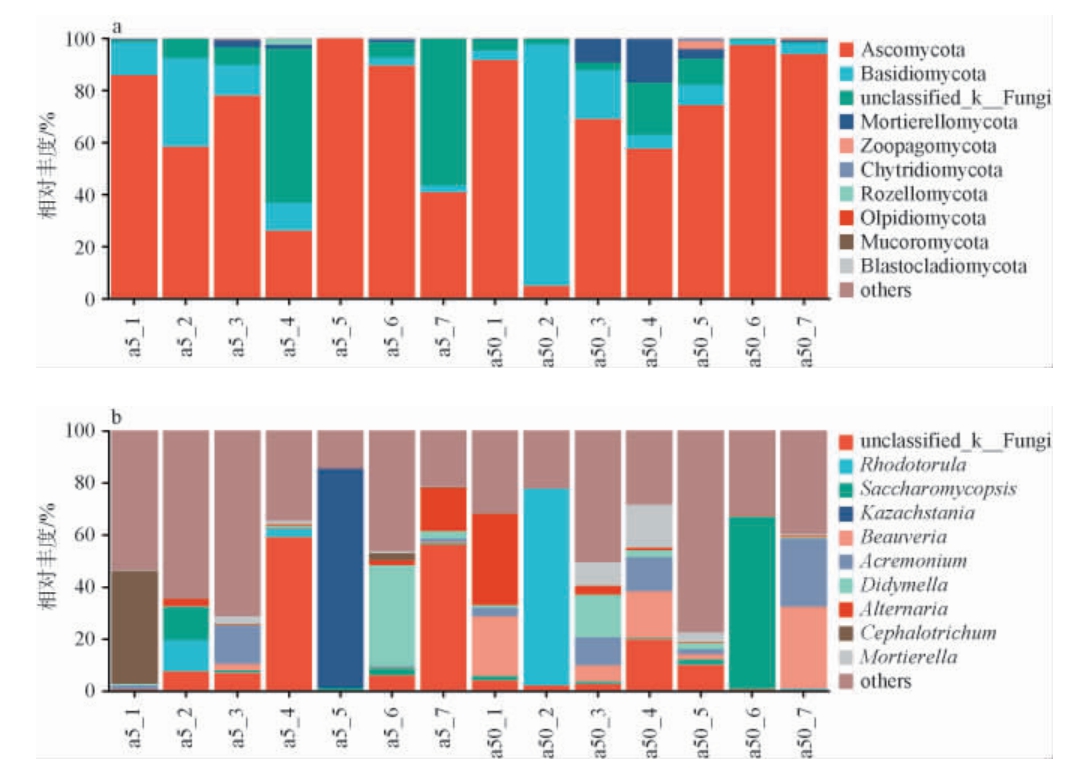
图4 基于门(a)和属(b)水平不同窖龄窖池酒醅发酵过程中真菌群落结构
Fig.4 Fungal community structure in fermented grains in pits with different ages during fermentation process based on phylum(a) and genus (b) levels
由图4a可知,酒醅发酵过程中主要真菌门为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),同时存在其他未知真菌菌门。子囊菌门在a50、a5组酒醅样品中的平均相对丰度分别为69.9%、68.4%,担子菌门在a50、a5组酒醅样品中的平均相对丰度分别为19.2%、10.7%。随着发酵的进行,担子菌门相对丰度逐渐降低,子囊菌门相对丰度呈起伏状,发酵结束后,a5组酒醅样品中unclassified_k_fungi(56.3%)是优势真菌门,a50组酒醅样品中Ascomycota(94.0%)是优势真菌门,相关研究显示,Ascomycota也是酱香型白酒中优势真菌种群、清香型白酒及食醋等多种发酵食品生产中的主要真菌菌群[28-30]。
由图4b可知,在属水平上,白僵菌属(Beauveria)、枝顶孢属(Acremonium)、复膜孢酵母属(Saccharomycopsis)和红酵母属(Rhodotorula)为a50组酒醅样品的主要真菌属,unclassifed-k-fungi、链 格 孢 属(Alternaria)、单 孢 酵 母 属(Kazachstania)、亚隔孢壳属(Didymella)为a5组的主要真菌属。研究表明Beauveria具有很好的抗逆性,且能分泌几丁质酶、脂肪酶以及有机酸[31],这也许是发酵结束时,其相对丰度较高的原因,而Acremonium的次级代谢产物有酚类、萜类、环肽,具有生物活性的有机酸等[32]。其中Saccharomycopsis是大曲香气的主要产生菌,该菌属在黄酒酿造和以大米为原料的酿造酒生产过程具有重要作用,同时也在浓香型白酒发酵酒醅中检出[30-31]。Alternaria[33]和Didymella[34]均为常见的真菌,广泛分布在空气、土壤、水等多种基质上。Kazachstania是泸州老窖旺盛发酵阶段中的4种优势酵母属之一[35],同时张霞等[36]在五粮液发酵糟醅中也陆续分离到多株K.humilis酵母菌株。对比不同窖龄下发酵过程中真菌的群落结构可以发现,a50组酒醅样品中优势真菌属都是以往研究证实其代谢可产生发酵酶类和对酒体有益的微生物,而a5组酒醅样品中该部分的微生物占比较少,可能是窖龄较短,窖泥微生物还处在不断的驯化过程,还有很多无用的酿酒微生物[37]。
2.3 理化因子与主要微生物属间关联性分析
选取总相对丰度排名前30的微生物属与理化因子进行相关性网络分析,结果见图5。
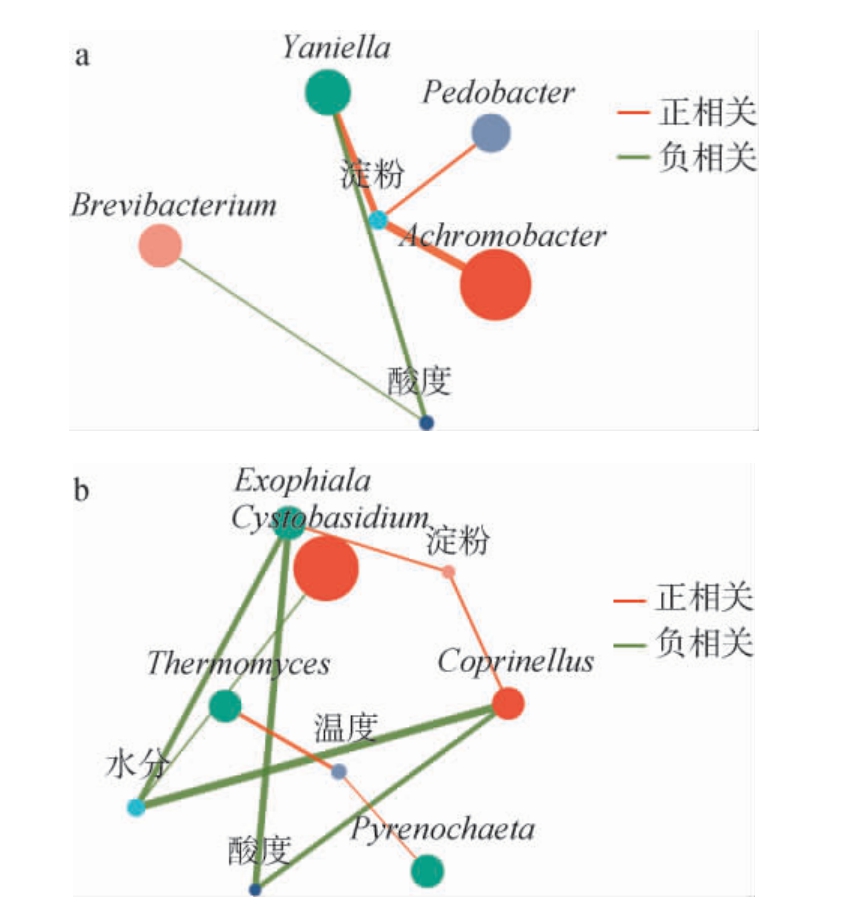
图5 基于属水平不同窖龄窖池酒醅发酵过程中主要细菌(a)及真菌(b)与理化因子间相关性网络分析结果
Fig.5 Results of correlation network analysis between main bacteria(a), fungi (b) and physicochemical factors of fermented grains in pits with different ages during fermentation process based on genus level
由图5a可知,淀粉与土地杆菌属(Pedobacter)、无色杆菌属(Achromobacter)、Yaniella呈正相关,酸度与乳酪菌属(Brevibacterium)和Yaniella呈负相关。由图5b可知,淀粉与白假鬼伞属(Coprinellus)、外瓶霉属(Exophiala)呈正相关,水分与Coprinellus、Exophiala、生泡囊担孢酵母属(Cystobasidium)呈负相关,酸度与Coprinellus、Exophiala呈负相关,温度与嗜热真菌属(Thermomyces)、棘壳孢属(Pyrenochaeta)呈正相关,综上,白酒发酵过程中在胁迫因子的推动下,微生物之间通过相互制约、相互促进影响群落结构的演替。
3 结论
不同窖龄窖池酒醅样品在发酵过程中的理化指标均处于适宜的范围内。发酵60 d时,a50样品真菌菌群的丰富度和多样性均高于a5样品,而细菌菌群则相反。发酵过程中,虽然不同窖龄窖池酒醅中的主要细菌属均为乳杆菌属(Lactobacillus)、高温放线菌属(Thermoactionmyces)、葡萄球菌属(Staphylococcus)和克罗彭施泰特氏菌属(Kroppenstedtia),但是a50样品细菌群落演替更迅速;a50样品的主要真菌属为白僵菌属(Beauveria)、枝顶孢属(Acremonium)、复膜孢酵母属(Saccharomycopsis)和红酵母属(Rhodotorula),a5样品的主要真菌属为unclassifed-k-fungi、链格孢属(Alternaria)、单 孢 酵 母 属(Kazachstania)、亚 隔 孢 壳 属(Didymella)。进一步分析酒醅发酵过程中微生物群落的结构变化与理化因子的关系发现,不同窖龄发酵过程中理化因子推动着微生物群落演替,淀粉与Pedobacter、Achromobacter、Yaniella、Coprinellus、Exophiala呈正相关,酸度与Brevibacterium、Yaniella、Coprinellus、Exophiala呈负相关,水分与Coprinellus、Exophiala、Cystobasidium 呈 负 相 关,温度与Thermomyces、Pyrenochaeta呈正相关。本研究揭示了不同窖龄发酵过程中微生物群落的差异主要是细菌群落演变的速度及真菌的种类,为以后酿酒工艺控制和优化提供微生物方面的理论依据。
[1]LIU H L,SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[2]董蔚.浓香型白酒“窖香”特征风味物质解析及其生成途径的研究[D].广州:华南理工大学,2020.
[3]李大和.浓香型白酒生产工艺与质量关系的思考[J].酿酒科技,2001(5):28-29.
[4]李大和,李国红.浓香型曲酒酿造生产工艺要素(一)[J].酿酒,2010,37(4):5-10.
[5]徐占成.中国浓香型白酒生产过程的技术质量控制与管理[J].食品与发酵技,2010,46(4):1-5.
[6]HU X L,DU H,REN C,et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Appl Environ Microbiol,2016,82(8):2506-2515.
[7]WANG X S,DU H,XU Y.Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor[J].Int J Food Microbiol,2017,244:27-35.
[8]曾波,饶家权,邹永芳,等.浓香型白酒酒醅发酵过程中微生物群落结构演替及其与理化指标相关性[J].食品科学,2024,45(7):111-118.
[9]钟娟,何静,陈晓珍,等.高通量测序技术分析浓香型白酒酒糟自然堆积发酵过程的微生物多样性[J].酿酒,2023,50(6):50-56.
[10]韩兴林,崔磊,常强,等.浓香白酒发酵过程中酒醅微生物结构分析[J].酿酒,2021,48(1):81-86.
[11]徐永松.微生物发酵传热特性研究及温度场模拟[D].重庆:重庆大学,2006.
[12]黄治国,侯海波,罗惠波,等.浓香型白酒酒醅发酵过程中淀粉和还原糖的变化规律研究[J].中国酿造,2012,31(7):107-110.
[13]吕春福,刘建华,于勇.白酒固态发酵过程中三大变化[J].酿酒,2003,30(3):61-62.
[14]张文学,岳元媛,向文良,等.浓香型白酒酒醅中化学物质的变化及其规律性[J].四川大学学报,2005,37(4):44-48.
[15]方军,张宿义.浓香型白酒发酵过程中各因子动态变化研究[J].酿酒科技,2012(1):38-43.
[16]黄治国,侯海波,罗惠波,等.浓香型白酒酒醅发酵过程中淀粉和还原糖的变化规律研究[J].中国酿造,2012,31(7):107-110.
[17]蒲领平.浓香型白酒酒醅发酵时空差异性研究[D].自贡:四川轻化工大学,2022.
[18]梁宗林,秦亚玲,王沛,等.云南省蒙自酸性矿山排水微生物群落结构和功能[J].生物工程学报,2019,35(11):2035-2049.
[19]WANG C X,TANG J D,QIU S Y.Profiling of fungal diversity and fermentative yeasts in traditional Chinese Xiaoqu[J].Front Microbiol,2020,11:2103.
[20]杨旭,马歌丽,王光路,等.高通量测序解析白酒中高温大曲细菌和真菌群落结构[J].中国酿造,2020,39(6):119-123.
[21]程庆,江超,陈苏芳,等.高通量测序分析湖南汝城县热水圩热泉微生物多样性[J].湘南学院学报,2021,42(5):22-27.
[22]王薪淯,朱晓宇,李海翔,等.乳酸碳链延长技术及其在有机废弃物资源化中的应用研究进展[J].应用与环境生物学报,2020,26(4):827-835.
[23]SU Y,YANG L,HUI L,et al.Bacterial communities during the process of high-temperature Daqu production of roasted sesame-like flavour liquor[J].J I Brewing,2015,121(3):440-448.
[24]李豆南,黄魏,王晓丹,等.酱香型大曲中高温放线菌的筛选及风味成分分析[J].食品科学,2018,39(6):171-176.
[25]郭敏,黄永光,邱树毅,等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造,2017,36(5):146-151.
[26]邓杰,卫春会,边名鸿,等.浓香型白酒不同窖龄窖池窖泥中古菌群落结构分析[J].食品科学,2017,38(8):37-42.
[27]WU Q, CHEN L Q, XU Y.Yeast community associated with the solid state fermentation of traditional Chinese Maotai-flavor liquor[J].Int J Food Microbiol,2013,166(2):323-330.
[28]LI X R,MA E,YAN L,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].Int J Food Microbiol,2011,146(1):31-37.
[29]WANG Z M,LU Z,SHI J,et al.Exploring flavour-producing core microbiota in multispecies solid-state fermentation of traditional Chinese vinegar[J].Sci Rep,2016,6(1):26818.
[30]NGA B H,CHIU L L,KOH S L,et al.Occurrence of genetic segregation in a putative haploid strain of Endomyces fibuliger met by spontaneous sectoring of protoplast fusants[J].World J Microbiol Biot,1994,10(4):465-471.
[31]乔宗伟,张文学,张丽莺,等.浓香型白酒发酵过程中酒醅的微生物区系分析[J].酿酒,2005,32(1):18-22.
[32]朱静.球孢白僵菌适应环境pH变化及胞内pH稳态维持的遗传分子基础及其对生物防治潜能的贡献[D].杭州:浙江大学,2016.
[33]孙霞.链格孢属真菌现代分类方法研究[D].泰安:山东农业大学,2006.
[34]占浩鑫,杨一帆,宋婉婷,等.亚隔孢壳属Didymella真菌研究进展[J].菌物研究,2024,22(3):207-225.
[35]杨建刚,苏畅,窦晓,等.泸型酒发酵过程中酵母菌演替规律及其对部分风味分子形成的影响[J].食品科学,2018(1):166-172.
[36]张霞,郑佳,赵东,等.多粮浓香型白酒中特征酵母菌与耐酸乳杆菌的关系[J].微生物学通报,2019,46(7):1571-1581.
[37]肖琴,何平,周瑞平,等.不同窖龄及位置浓香型白酒窖泥微生物群落多样性与理化因子的比较分析[J].食品科学,2023,44(20):165-174.