葡萄酒的香气物质主要来源于葡萄果实、酵母和乳酸菌等微生物发酵、橡木桶浸出以及瓶内陈酿过程中的化学转化[1]。其中,来源于葡萄果实的挥发性物质常被称为葡萄酒的“一类香气”或者“品种香气”,它们属于葡萄果实的次级代谢产物,主要包括萜烯类、C13-降异戊二烯类、C6/C9类、硫醇类、吡嗪类、挥发性酚类和芳香族类化合物等[2-3]。这些化合物能够反映葡萄品种的香气特点,例如里那醇、香茅醇和香叶醇等单萜类物质贡献‘小白玫瑰’(Vitisvinifera cv.Muscat Blanc à Petits Grains)和‘玫瑰香’(Vitis vinifera cv.Muscat Hamburg)等芳香葡萄品种浓郁的花香[4]。3-异丁基-2-甲氧基吡嗪、3-异丙基-2-甲氧基吡嗪和3-叔丁基-2-甲氧基吡嗪等吡嗪类物质贡献‘赤霞珠’(Vitis vinifera cv.Cabernet Sauvignon)、‘佳美娜’(Vitis vinifera cv.Carmenere)、‘品丽珠’(Vitis vinifera cv.Cabernet Franc)和‘长相思’(Vitis vinifera Sauvignon Blanc)果实典型的青椒或植物味[5-7]以及3-巯基-1-己醇、3-巯基己基乙酸酯和4-巯基-4-甲基-2-戊酮等含硫化合物贡献‘长相思’葡萄酒独特的葡萄柚、西番莲等热带水果香气[8-9]。
葡萄果实成熟过程中,品种香气物质的形成与积累受到葡萄品种、产区风土和葡萄园微气候等因素的影响[2,10-11]。由于不同葡萄酒产区的地形地貌、光照、温度、降水和土壤等方面存在差异,影响成熟期葡萄果实风味物质的组成与含量,最终导致葡萄酒品质和风格出现明显差异[12]。前人研究报道,罗纳河谷最南部的温暖气候使歌海娜(Vitis vinifera cv.Grenache)葡萄酒含有最高含量的β-大马士酮和香叶醇,而其他产区葡萄成熟度相对较差,导致葡萄酒中β-大马士酮的含量较低,但β-紫罗兰酮的含量较高[13]。欧美杂交种‘塔明内’(Traminette)成熟期葡萄果实在冷凉产区具有更高含量的C6醛类物质,而其在温暖产区则积累更多的单萜类物质[14]。
与世界主要葡萄酒产区的地中海式气候和海洋性气候不同,我国中西部葡萄酒产区均属于温带大陆性季风气候,表现出夏季高温多雨、冬季寒冷干燥的特点,葡萄果实风味物质的形成与调控机制也存在差异。XU X Q等[15]在探究我国独特气候条件下不同产区对葡萄果实香气物质积累影响的研究中发现,我国河北昌黎产区成熟期‘赤霞珠’葡萄果实中苯甲醇、苯乙醇、1-己醇和1-辛烯-3-醇的含量显著高于甘肃高台产区,而后者则表现出高含量的己醛、庚醛、3-异丁基-2-甲氧基吡嗪和(E)-β-大马士酮,上述差异与昌黎和高台两个产区的气候差异息息相关。WEN Y Q等[16]利用代谢组学和转录组学技术研究发现,与我国河北昌黎产区相比,甘肃高台产区降雨量少、光照强的气候特点可能能够提前诱发‘小白玫瑰’葡萄果实成熟相关基因的表达,加快果实成熟,最终抑制萜烯类物质的积累。因此,我国河北昌黎和甘肃高台两地的气候差异能够影响葡萄果实发育过程中的风味代谢相关结构基因的表达以及转录因子的表达,从而引起两个产区成熟期葡萄果实风味物质的差异。与‘赤霞珠’相似,‘西拉’(Vitis vinifera cv.Syrah)也在我国主要葡萄酒产区广泛种植,不同产地的‘西拉’葡萄酒表现出不同的风味特征,然而我国大陆性季风气候下不同产区对该葡萄品种香气物质积累影响的研究鲜有报道。
因此,该研究选取河北昌黎和甘肃高台的‘西拉’葡萄果实为样本,分析‘西拉’葡萄果实发育过程中游离态香气物质的变化规律,探究不同产区对‘西拉’葡萄果实香气物质积累的影响,为改进栽培措施、提高酿酒葡萄原料品质提供参考依据。
1 材料与方法
1.1 材料与试剂
供试材料为2019年分别采自河北昌黎(39.48 N,119.20 E)和甘肃高台产区葡萄园(39.14 N,99.84 E)的‘西拉’葡萄果实。第一个采收时间点为花后4周,其后每两周采收一次,直至商业采收期分别编号为4w、6w、8w、10w、12w、14w、16w、17w)。从物候期观测来看,昌黎和高台产区‘西拉’葡萄果实的转色期分别是8月7日至8月27日和8月2日至8月23日。产区气候资料来自中国地面际交换站气候资料日值数据集。数据来源于各省、市、自治区气候资料处理部分逐月上报的《地面气象记录月报表》的信息化资料。
氢氧化钠、氯化钠、酒石酸和葡萄糖(均为分析纯):北京化学试剂公司;乙醇(色谱纯):美国Honeywell公司;所有的香气标准品、聚乙烯聚吡咯烷酮(polyvinylpolypyrrolidone,PVPP)、C7~C24的正构烷烃(均为色谱纯):美国Sigma Aldrich公司。
1.2 仪器与设备
6890-5975C气相色谱-质谱联用仪:美国Agilent公司;CTC CombiPAL多功能进样器:瑞士Zwingen公司;HPINNOWAX色谱柱(60 m×0.25 mm×0.25 μm):美国J&W Scientific公司。
1.3 方法
1.3.1 采样方法
采样参照WEN Y Q等[16]的方法,除去葡萄园边际5行和两端10 m不采集样品,在每穗果实的肩部、中部和顶部随机采取外观良好、无机械损伤和病害的葡萄果实400粒。采后立即运回实验室,用液氮迅速冻结,贮藏在-80 ℃的超低温冰箱中待用。
1.3.2 理化指标的检测
可溶性固形物和可滴定酸的测定参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》,可溶性固形物采用数显手持糖度计检测;可滴定酸(以酒石酸计)采用NaOH进行滴定法。
1.3.3 挥发性香气化合物的检测
挥发性香气化合物的测定参照本实验室已建立的顶空固相微萃取-气相色谱-质谱联用(head space-solid phase micr-oextraction gas chromatography-mass spectrometry,HSSPME-GC-MS)技术[17]。
取存放于-80 ℃冰箱的葡萄果实100粒,用液氮速冻,去果梗和种子后,在液氮保护下研磨成粉末状,加入1.0 gPVPP和0.5 g D-葡萄糖酸内酯,搅拌均匀后在4 ℃冰箱静置浸渍120 min,随后在4 ℃、8 000 r/min条件下离心15 min,收集澄清葡萄汁。
HS-SPME条件:采用CTC CombiPAL多功能进样器,取5 mL澄清葡萄汁于20 mL的样品瓶中,加入1.0 g NaCl和10 μL内标(4-甲基-2-戊醇,1.001 8 g/L),迅速密封后置于顶空样品盘上。样品在40 ℃条件下振荡平衡30 min,然后将已活化的2 cm二乙烯苯/聚乙二醇/聚二甲基硅氧烷(DVB/CAR/PMDS)50/30 μm萃取头插入样品瓶的顶空部分,继续在40 ℃条件下振荡吸附30 min,加热槽转速为500 r/min。然后将萃取头插入气相色谱进样口,采用不分流模式,250 ℃下热解吸8 min。
GC-MS条件:载气为高纯氦气(He)(纯度>99.999%),流速1 mL/min。柱温箱的升温程序为50 ℃保持1 min,然后以3 ℃/min的速度升温至220 ℃,保持5 min。质谱端传输线温度为250 ℃,离子源为电子电离(electronic ionization,EI)源,离子源温度为230 ℃,四级杆温度为150 ℃,离子能量70 eV,质量扫描范围为35~350 amu。
挥发性香气化合物的定性和定量参照实验已建立的方法[17]。定性采用AMDIS解卷积技术解谱,将解出的质谱图与标准品以及美国国家标准技术研究所(national institute of standards and technology,NIST)2011标准谱库收录化合物的质谱信息进行匹配,并计算每个挥发性物质的保留指数,进行化合物的定性分析。对于已有标准品的化合物,利用其在模拟葡萄汁中的标准曲线定量;对于没有标准品的化合物,利用化学结构、官能团相似、碳原子数相近的标准品的标准曲线定量。模拟葡萄汁配置如下:将蒸馏水配制成7 g/L酒石酸和200 g/L葡萄糖的混合溶液,用氢氧化钠调节pH到3.3。
1.3.4 数据处理
运用SPSS 20.0进行单因素方差分析,采用Duncan多重比较分析各处理之间的差异显著性,显著性水平P<0.05;采用SIMCA-P 14.4进行主成分分析;采用R语言平台(http://www.rproject.org)‘pheatmap’包中的‘pheatmap’函数进行层次聚类热图可视化分析。
2 结果与分析
2.1 葡萄果实理化指标分析
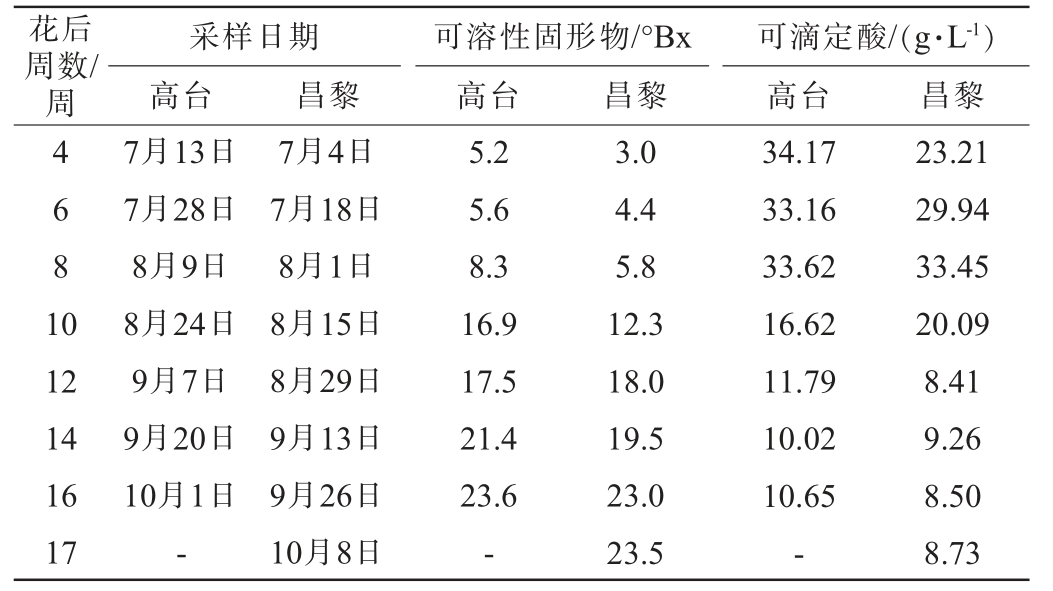
河北昌黎和甘肃高台产区发育过程‘西拉’葡萄果实的可溶性固形物和可滴定酸含量见表1。由表1可知,从物候期看,高台产区‘西拉’的始花期晚于昌黎产区。两个产区采收期葡萄果实的可溶性固形物均达到23.5°Bx以上,说明高台产区葡萄可溶性固形物的积累相对较快。高台产区葡萄果实可滴定酸含量整体高于昌黎产区。
表1 不同产区‘西拉’葡萄果实发育过程中可溶性固形物和可滴定酸含量的变化
Table 1 Changes of total soluble solid and titratable acid contents in'Syrah' grapes from different regions during fruit development
注:花后周数,至少90%的花帽凋落。
花后周数/周4 681 0采样日期高台昌黎 昌黎可溶性固形物/°Bx高台可滴定酸/(g·L-1)高台 昌黎12 14 16 17 7月13日7月28日8月9日8月24日9月7日9月20日10月1日-7月4日7月18日8月1日8月15日8月29日9月13日9月26日10月8日5.2 5.6 8.3 16.9 17.5 21.4 23.6-3.0 4.4 5.8 12.3 18.0 19.5 23.0 23.5 34.17 33.16 33.62 16.62 11.79 10.02 10.65-23.21 29.94 33.45 20.09 8.41 9.26 8.50 8.73
河北昌黎产区和甘肃高台产区的‘西拉’葡萄果实发育过程中可溶性固形物与可滴定酸的积累规律差异,与前人报道的‘赤霞珠’和‘小白玫瑰’的结果相一致[16]。XU X Q等[15]研究报道,高台产区的平均气温比昌黎产区低约5 ℃,但前者的日内温差是后者的2.1倍。因此,高台产区夜间的低温降低了糖分的消耗,导致葡萄果实可溶性固形物的积累速率快于昌黎产区,致使更快地成熟;而昌黎产区相对较高的平均气温加快了有机酸的降解,从而导致昌黎产区采收期葡萄果实的酸度更低。此外,高台产区果实糖、酸积累规律比较一致,均早于昌黎产区。
2.2 两个产区挥发性香气物质含量的变化
两个产区‘西拉’葡萄果实共检测到97种挥发性香气物质,其中萜烯类20种、C13-降异戊二烯类16种、C6类10种、醇类12种、醛类9种、酮类5种、酸类3种、酯类10种、芳香族类6种、挥发性酚类3种和其他类3种。利用层次聚类分析(hierarchical clustering analysis,HCA)绘制热图,可以将‘西拉’葡萄果实发育过程中挥发性香气物质的积累大致分为3类(见图1)。第I类物质在转色初期开始迅速积累,成熟期含量较高;第II类物质在绿果期大量积累,转色前达到高峰,成熟后期呈下降趋势;第III类物质在花后4周左右迅速积累,随后含量急剧下降,至成熟期含量显著低于绿果期甚至低于检出限。
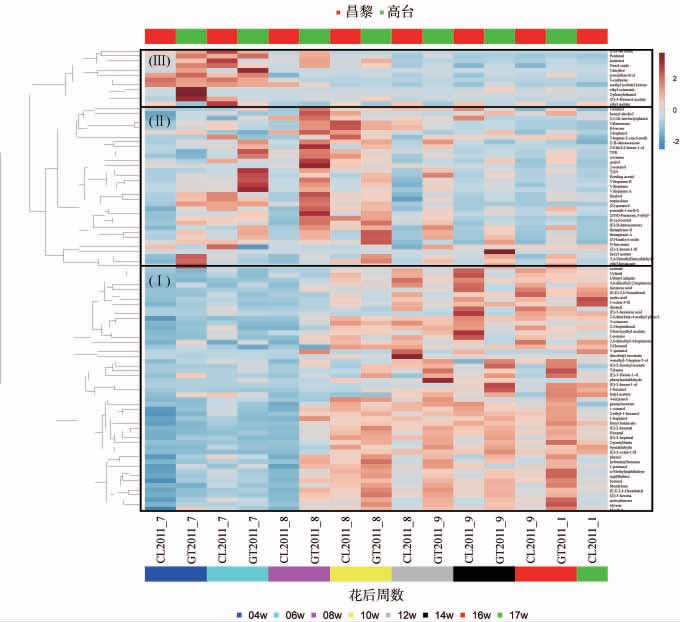
图1 不同产区‘西拉’葡萄果实发育过程中挥发性化合物层次聚类分析热图
Fig.1 Hierarchial clustering analysis heat map of volatile compounds of 'Syrah' grapes from different regions during fruit development
CL:昌黎产区;GT:高台产区。下同。
第I类物质主要包括C6类物质以及部分高级醇类、醛类、酮类和酯类物质。C6类物质常表现出青草味[18],是所有挥发性香气物质中含量最高的一类物质,在不同发育时期果实中其含量占总挥发性物质的70%~80%。C6类物质主要包括(E)-2-己烯醛、(Z)-3-己烯醛、己醛、(E,E)-2,4-己二烯醛、(E)-2-己烯醇、(E)-3-己烯醇、1-己醇等,其中(E)-2-己烯醛和己醛分别占总挥发性物质的29.3%~37.7%和28.4%~36.8%。对两个产区主要的C6类物质进行分析,结果见图2。
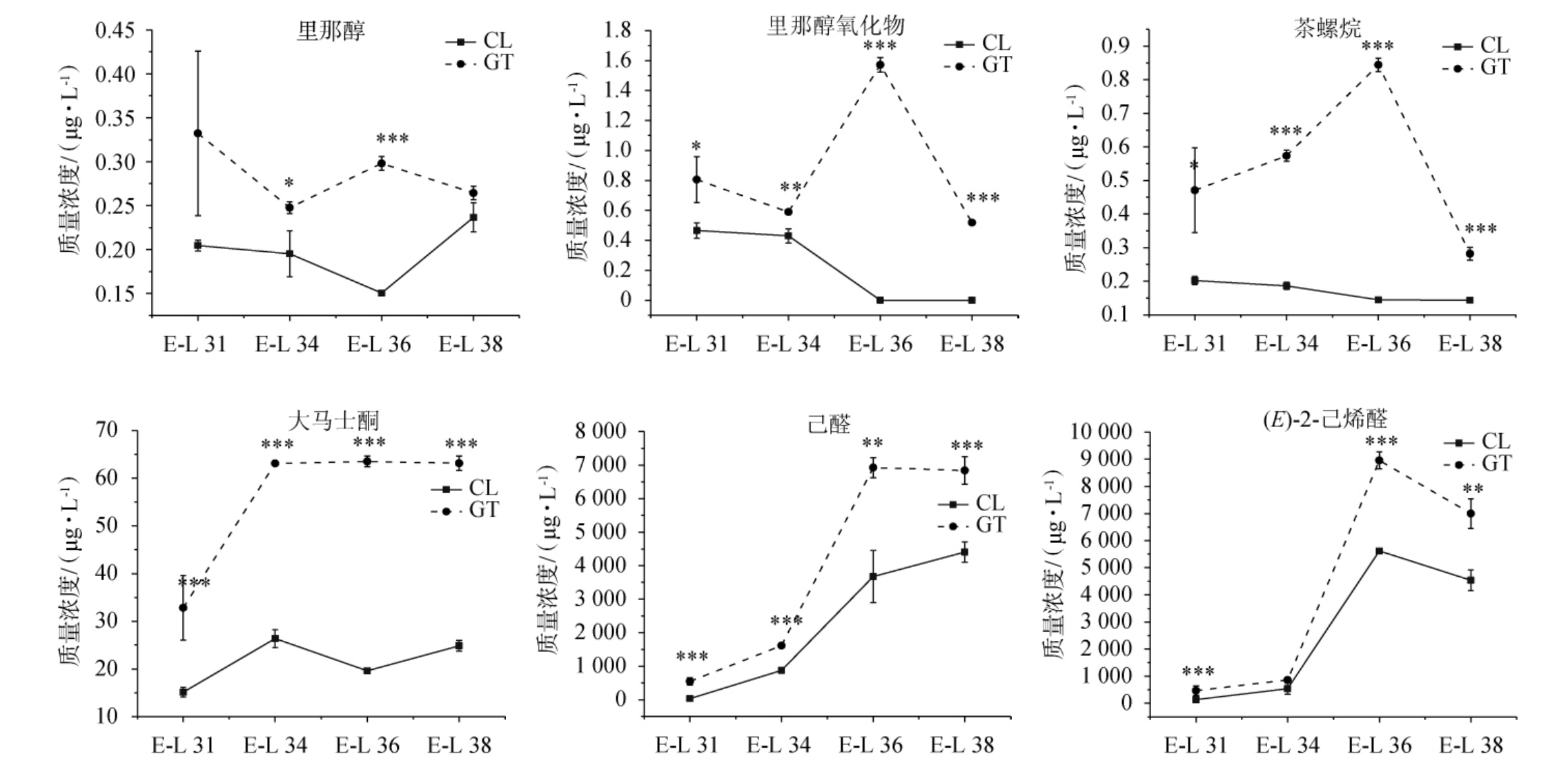
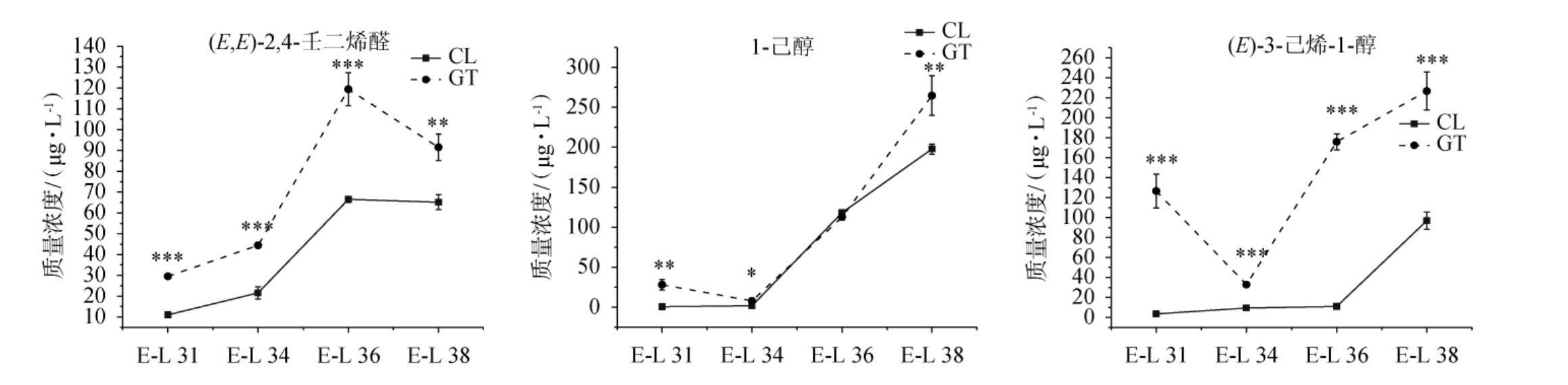
图2 不同产区‘西拉’葡萄果实发育过程中主要的C6类物质含量变化
Fig.2 Changes of main C6 compounds contents of 'Syrah' grapes from different regions during fruit development
“*”“**”“***”分别表示同一时期不同组别差异显著(P<0.05),极显著(P<0.01),高度显著(P<0.001)。E-L 31、E-L 34、E-L 36、E-L 38表示浆果发育期浆果豌豆粒大小、浆果开始变软白利糖度开始提高、成熟期浆果白利度达到中等值、浆果成熟度达到采收要求。
由图2可知,高台产区成熟期葡萄果实中己醛、(E)-2-己烯醛、1-己醇、(E)-3-己烯醇和(E)-2-己烯-1-醇的含量均显著高于昌黎产区。C6类物质主要在果实发育后期积累,在两个产区表现出相似积累规律。此外,辛醛、壬醛、癸醛、2,4-庚二烯醛、1-壬醇、1-辛烯-3-醇、乙酸、(E)-3-己烯酸和己酸也是在成熟期逐渐积累,但其在昌黎产区的果实中含量明显高于高台产区。
环境因子能够影响葡萄果实中C6类物质的合成积累。XU X Q等[15]发现高台产区采收期‘赤霞珠’葡萄果实中(E)-2-己烯醛的含量高于昌黎产区,但后者果实中1-己醇的含量则更高,与本实验的结果相一致。有研究表明,水分亏缺可以提高葡萄果实成熟过程中过氧化氢酶的水平,进而提高己醛和3-己烯醛等C6醛类物质的含量[19]。因此,在葡萄生长季,高台产区干旱少雨,而昌黎产区降雨丰沛,可能是导致高台产区‘西拉’葡萄果实C6类物质含量高于昌黎产区的原因。也有研究者提出C6类物质的含量与有效积温呈负相关[20],适当的延迟采收有利于减少果实中C6类物质的含量,从而减轻葡萄酒中不愉悦的生青味,提高葡萄酒的香气品质[21-22]。
第II类物质是C13-降异戊二烯和大部分萜烯类物质,在绿果期开始积累,转色前达到最大含量,成熟后期含量下降,主要包括(E)-β-大马士酮、茶螺烷、vitispirane、1,1,6-三甲基-1,2-二氢萘(1,2-dihydro-1,1,6-trimethylnaphthalene,TDN)、β-环柠檬醛、里那醇、香叶醇。(E)-β-大马士酮是C13-降异戊二烯类物质中含量最高的物质,在高台产区中的果实中含量达到73.74 μg/L,高于昌黎产区的53.28 μg/L。高台产区样品中里那醇、里那醇氧化物、香叶醇、α-萜品醇、(Z)-橙花醇等物质在花后8周或10周积累到最大值,且高于昌黎产区。
高台产区‘赤霞珠’葡萄果实中游离态(E)-β-大马士酮的含量高达昌黎产区的9倍。脱落酸(abscisic acid,ABA)是调控葡萄果实成熟的重要激素,葡萄果实进入成熟期后,内源ABA含量急剧升高。前人研究表明,水分亏缺能够促进葡萄果实中ABA的合成积累[23]。相较于河北昌黎产区,甘肃高台产区气候干旱、少雨,促使葡萄果实中ABA合成相关基因的表达,加速了葡萄果实的成熟进程。SUN R Z等[24]分析昌黎和高台两地‘赤霞珠’葡萄果实发育过程转录组的差异发现,高台产区‘赤霞珠’葡萄果实中与乙烯和ABA成熟信号转导相关的基因在转色前期和转色期表达均显著上调,因而高台产区果实转色期和成熟期提前一周。CHEN W K等[25]发现高台产区‘赤霞珠’葡萄果实成熟过程中类胡萝卜素代谢途径的流向偏向ABA的合成积累。这与赤霞珠在这两个地区的种植表现相似,高台产区的葡萄果实中降异戊二烯类物质的含量高于昌黎地区,与果实异戊二烯类物质合成相关的基因VvCCD4b的转录水平也显著上调。研究表明,果实中C13-降异戊二烯含量与光照有关,增加果实曝光率可以提高果实中Vitispirane、TDN、(E)-β-大马士酮等C13-降异戊二烯类物质的含量[25]。此外,水分胁迫也可以引起葡萄果实中C13-降异戊二烯类物质含量的升高[4,26]。
第III类物质是部分萜烯和酯类物质,在花后4周左右迅速积累,随后含量急剧下降,至成熟期含量显著低于绿果期甚至低于检测限。这类物质包括(Z)-氧化玫瑰、二氢松油醇、橙花醚、樟脑、δ-杜松烯、(E)-3-乙酸己烯酯。在花后4周时,高台产区中果实中的此类香气物质含量大部分高于昌黎产区,随着果实成熟,两个产区的此类香气物质含量趋于相同。
LUO J Q等[10]对五个不同葡萄品种的研究发现,‘西拉’果实中萜烯类物质在果实发育早期积累,转色后含量略有下降。对比两个产区可发现,高台产区萜烯物质在花后4周已开始大量积累,而昌黎产区相对滞后,主要在花后6周。WEN Y Q等[16]在对这两个产区‘小白玫瑰’的研究中发现,小白玫瑰葡萄果实中萜烯类物质在绿果期或转色期大量积累,随后含量下降,尽管部分萜烯在成熟期少量积累[7]。萜烯的合成受到多种环境因素的影响,隔绝光照会显著抑制葡萄果实萜类物质的合成和积累[27];摘叶处理和紫外照射可提高果实橙花醇、香叶醇含量,但对于里那醇含量影响不大[24];疏穗管理可增加果实曝光率,提高葡萄和葡萄酒中β-里那醇等萜烯物质含量[28]。因此,高台地区更多的平均日照时数和光有效辐射可能也是该地区葡萄果实中萜烯物质含量高于昌黎地区的重要原因。综上,高台和昌黎产区‘西拉’葡萄果实挥发性香气物质积累时间普遍早于昌黎产区,积累总量明显高于昌黎产区。
2.3 不同产区西拉葡萄果实发育过程中挥发性物质积累差异
为了进一步探究不同产区‘西拉’葡萄果实生育过程中挥发性物质积累的差异,以昌黎产区(CL)和高台产区(GT)的果实挥发性物质的含量为变量进行主成分分析(principal component analysis,PCA),结果见图3。
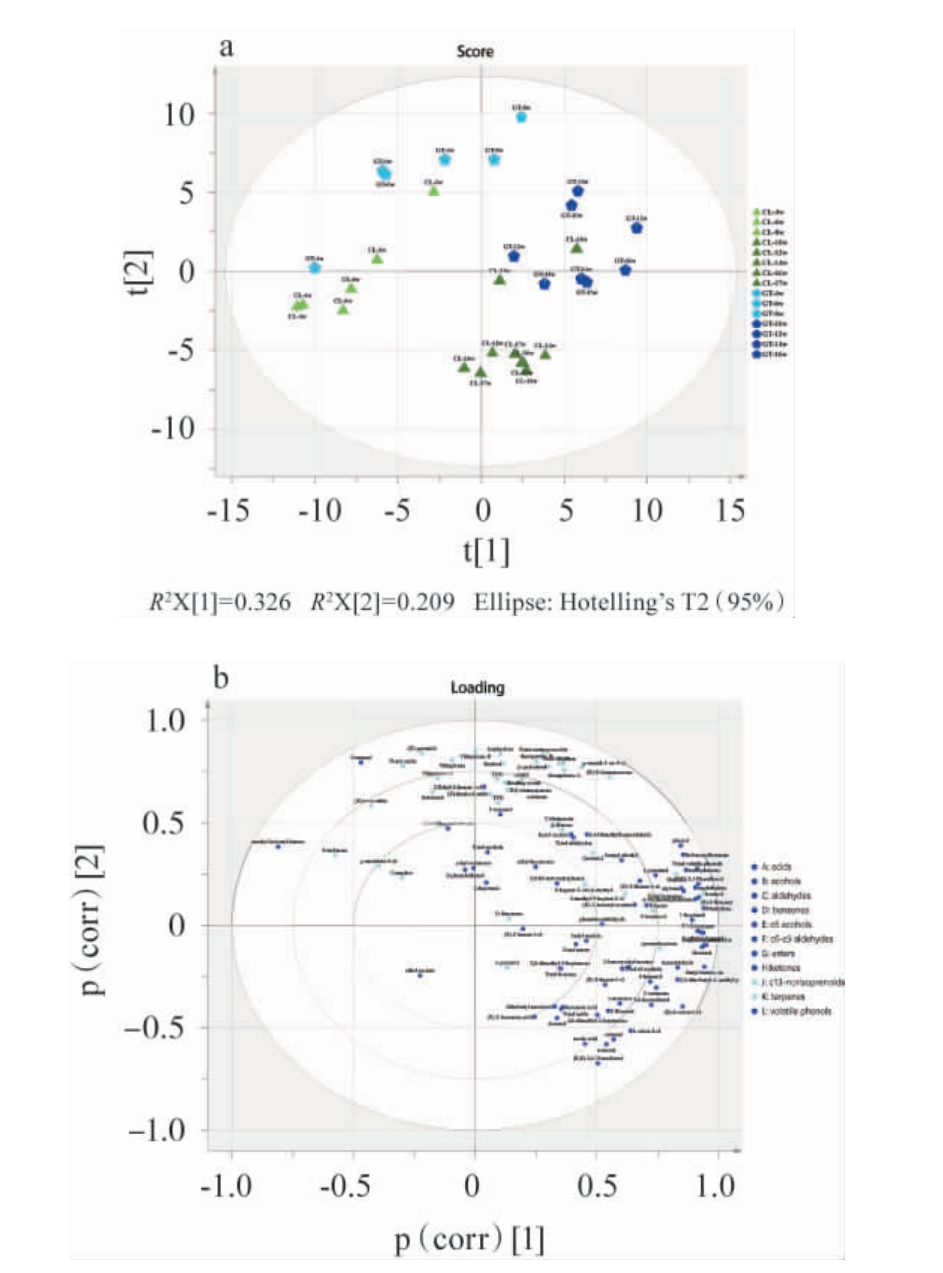
图3 不同产区‘西拉’葡萄果实发育过程中挥发性香气化合物主成分分析
Fig.3 Principal component analysis of volatile aroma compounds of'Syrah' grapes from different regions during fruit development
由图3可知,主成分1(PC1)和主成分2(PC2)能够把两个产区和不同发育期的样品大体分开。由图3a可知,PC1可以把不同发育阶段的样品进行区分,大部分花后4~8周的样品集中在PC1的负半轴,大部分花后10~17周样品集中在PC1的正半轴。结合各挥发性物质在主成分上的载荷(见图3b)进行分析,橙花醚、(Z)-氧化玫瑰、二氢松油醇、δ-杜松烯、vitispirane、TDN等以萜烯和降异戊二烯为主的物质整体与PC1呈负相关,说明浆果形成期(从绿果期到转色开始)的葡萄果实中这些香气物质的含量高于浆果成熟期(从转色开始至成熟);(E)-2-己烯醛、(Z)-3-己烯醛、己醛、(E,E)-2,4-己二烯醛、(E)-2-庚醛、1,3,5-三甲基苯、α-甲基萘、2-甲基-1-己醇、1-辛醇等以C6类物质为主的物质整体与PC1呈正相关,说明浆果成熟期上述物质的含量高于浆果形成期。通过主成分2(PC2)可以把两个产区的样品进行区分,高台产区的样品主要集中在PC2的正半轴,而昌黎产区的样品主要集中在PC2负半轴。(E)-β-大马士酮、vitispirane、TDN、茶螺烷、缩醛、(Z)-氧化玫瑰、橙花醚、香叶醇、里那醇等以C13-降异戊二烯和萜烯为主的物质与PC2呈正相关,是高台产区葡萄果实的特征物质;1-辛烯-3-醇、1-壬醇、辛醛、壬醛、癸醛、2,4-庚二烯醛、(E,E)-2,6-壬二烯醛、(E)-3-己烯-1-醇、己酸等物质与PC2呈负相关,是昌黎产区葡萄果实的特征物质。
3 结论
本研究以‘西拉’葡萄为试验材料,通过对不同产区果实生育各阶段挥发性物质的测定,发现高台和昌黎产区‘西拉’葡萄果实挥发性香气组分和代谢规律存在产区差异。高台产区与昌黎产区‘西拉’葡萄果实挥发性物质的组成和积累趋势基本相似,但在积累时间和含量上存在差异。高台产区挥发性物质积累时间普遍早于昌黎产区,积累总量明显高于昌黎产区。主成分分析结果说明‘西拉’葡萄果实生育各阶段挥发性物质代谢规律是不同的,高台和昌黎产区‘西拉’葡萄果实挥发性香气组分存在产区差异,以C13-降异戊二烯和萜烯类物质最为突出,其中(E)-β-大马士酮、里那醇等物质在高台产区果实中的含量高于昌黎产区,这可能与两产区不同的气候环境对果实挥发性物质的代谢的影响有关。
[1]LU H C,CHENG B H,LAN Y B, et al.Modifications in aroma characteristics of'Merlot'dry red wines aged in American,French and Slovakian oak barrels with different toasting degrees[J].Food Science and Human Wellness,2024,13(1):381-391.
[2]李相怡.酿酒葡萄果实中单萜糖基转移酶基因VviGT14的转录调控机制[D].北京:中国农业大学,2020.
[3]CHEN Z, WU Y P, LAN Y B, et al.Differences in aroma profile of Cabernet Sauvignon grapes and wines from four plots in Jieshi mountain region of Eastern China[J].Foods,2023,12(14):2668.
[4]RIENTH M, VIGNERON N, DARRIET P, et al.Grape berry secondary metabolites and their modulation by abiotic factors in a climate change Scenario-A review[J].Front Plant Sci,2021,12:643258.
[5]SANDERS R D,BOSS P K,CAPONE D L,et al.Methoxypyrazine concentrations in the grape bunch rachis of Vitis vinifera L.Cv Shiraz:Influence of rootstock,region and light[J].Food Chem,2023,408:135234.
[6]QIAN X,JIA F Y,CAI J,et al.Characterization and evolution of volatile compounds of cabernet sauvignon wines from two different clones during oak barrel aging[J].Foods,2021,11(1):74.
[7]LEI Y J, XIE S, GUAN X Q, et al.Methoxypyrazines biosynthesis and metabolism in grape:A review[J].Food Chem,2018,245:1141-1147.
[8]DOURNES G,VERBAERE A,LOPEZ F, et al.First characterisation of thiol precursors in Colombard and Gros Manseng: comparison of two cultivation practices[J].Aust J Grape Wine Res,2022,(28):492-499.
[9]MUHL J R,PILKINGTON L I,FEDRIZZI B,et al.Unraveling the mystery of 3-sulfanylhexan-1-ol:The evolution of methodology for the analysis of precursors to 3-sulfanylhexan-1-ol in wine[J].Foods,2022,11(14):2050.
[10]LUO J Q,BROTCHIE J,PANG M,et al.Free terpene evolution during the berry maturation of five Vitis vinifera L.cultivars[J].Food Chem,2019,299:125101.
[11]SUN L J, ZHANG Z, XIA H C, et al.Typical aroma of merlot dry red wine from eastern foothill of Helan Mountain in Ningxia, China[J].Molecules,2023,28(15):5682.
[12]SANTOS J A,FRAGA H,MALHEIRO A C,et al.A review of the potential climate change impacts and adaptation options for European viticulture[J].Appl Sci-Basel,2020,10(9):3092.
[13]SABON I, De REVEL G, KOTSERIDIS Y, et al.Determination of volatile compounds in Grenache wines in relation with different terroirs in the Rhone Valley[J].J Agr Food Chem,2002,50(22):6341-6345.
[14]JI T,DAMI I E.Characterization of free flavor compounds in traminette grape and their relationship to vineyard training system and location[J].J Food Sci,2008,73(4):C262-C267.
[15]XU X Q, LIU B, ZHU B Q, et al.Differences in volatile profiles of Cabernet Sauvignon grapes grown in two distinct regions of China and their responses to weather conditions[J].Plant Physiol Biochem,2015,89:123-133.
[16]WEN Y Q,ZHONG G Y,GAO Y,et al.Using the combined analysis of transcripts and metabolites to propose key genes for differential terpene accumulation across two regions[J].BMC Plant Biol,2015,15:240.
[17]WANG Y,LI H Q,GAO X T,et al.Influence of attenuated reflected solar radiation from the vineyard floor on volatile compounds in Cabernet Sauvignon grapes and wines of the north foot of Mt.Tianshan[J].Food Res Int,2020,137:109688.
[18]GARBAY J,CAMELEYRE M,RIQUIER L,et al.Development of a new method for the quantitative analysis of aroma compounds potentially related to the fruity aroma of red wines[J].J Agr Food Chem,2023,71(35):13066-13078.
[19]JU Y L,LIU M,TU T Y, et al.Effect of regulated deficit irrigation on fatty acids and their derived volatiles in'Cabernet Sauvignon'grapes and wines of Ningxia,China[J].Food Chem,2018,245:667-675.
[20]LU H C, CHEN W K, WANG Y, et al.Effect of the seasonal climatic variations on the accumulation of fruit volatiles in four grape varieties under the double cropping system[J].Front Plant Sci,2021,12:809558.
[21]GU X B,ZHANG X,WANG K Q,et al.GC-MS Untargeted analysis of volatile compounds in four red grape varieties (Vitis vinifera L.cv) at different maturity stages near harvest[J].Foods,2022,11(18):2804.
[22]ZHANG H H,FAN P G,LIU C X,et al.Sunlight exclusion from Muscat grape alters volatile profiles during berry development[J].Food Chem,2014,164:242-250.
[23]FERRANDINO A,PAGLIARANI C,PEREZ-ALVAREZ E P.Secondary metabolites in grapevine:crosstalk of transcriptional,metabolic and hormonal signals controlling stress defense responses in berries and vegetative organs[J].Front Plant Sci,2023,14:1124298.
[24]SUN R Z,HE F,LAN Y B,et al.Transcriptome comparison of Cabernet Sauvignon grape berries from two regions with distinct climate[J].J Plant Physiol,2015,178:43-54.
[25]CHEN W K, YU K J, LIU B, et al.Comparison of transcriptional expression patterns of carotenoid metabolism in 'Cabernet Sauvignon'grapes from two regions with distinct climate[J].J Plant Physiol,2017,213:75-86.
[26]PALAI G,CARUSO G,GUCCI R,et al.Deficit irrigation differently affects aroma composition in berries of Vitis vinifera L.(cvs Sangiovese and Merlot)grafted on two rootstocks[J].Aust J Grape Wine Res,2022,28(4):590-606.
[27]CAMPOS-ARGUEDAS F,SARRAILHE G,NICOLLE P,et al.Different temperature and UV patterns modulate berry maturation and volatile compounds accumulation in Vitis sp[J].Front Plant Sci,2022,13:862259.
[28]MIAO W,LUO J Q,LIU J D,et al.The influence of UV on the production of free terpenes in Vitis vinifera cv.Shiraz[J].Agronomy-Basel,2020,10(9):1431.