中国白酒与白兰地、伏特加、威士忌、朗姆酒、金酒并称为世界六大蒸馏酒,其酿造历史源远流长,是中华民族的宝贵财富。白酒是以粮谷为主要原料,经酒曲糖化后发酵、蒸馏、陈酿、勾调而成的蒸馏酒,按香型可分为浓香型、酱香型、清香型、米香型等多种,其中浓香型、浓酱兼香型等白酒以己酸乙酯、己酸等为主要风味物质,国家标准GB/T 10781.1—2021《白酒质量要求 第1部分:浓香型白酒》、GB/T 10781.8—2021《白酒质量要求第8部分:浓酱兼香型白酒》要求其己酸乙酯达到一定含量且来源于酿酒原料自身发酵。
传统理化检测方法可准确检测白酒中酯类、酸类物质的含量[1-2],但对其来源鉴别困难,导致白酒外源添加鉴别研究推进困难。稳定同位素技术是国际上已被证实的可用于食品溯源、掺假、外源添加等真实性鉴别领域的有效技术手段,在蜂蜜、肉制品、葡萄酒、奶制品、果汁、食用油等食品鉴别领域已被广泛使用[3-17]。国内,稳定同位素技术在白酒真实性鉴别方面也已进行一些突破性研究[18-24],但这些研究均还停留在白酒中各物质本身δ13C上,如研究白酒中乙醇δ13C、乙醇δ18O、风味物质δ13C等,对于这些物质δ13C相互之间的影响少有提及,特别是白酒中醇δ13C、酸δ13C和酯δ13C之间的相关性更是未有提及。
对于白酒来说,酸、酯是重要的呈香物质,而在有水分存在的情况下,醇、酸会发生酯化反应生成酯,酯会发生水解反应生成醇、酸,即在白酒体系中存在醇、酸、酯的动态平衡反应。而在以己酸、己酸乙酯为主要风味物质的白酒中,乙醇δ13C、己酸δ13C和己酸乙酯δ13C也通过乙醇+己酸⇌己酸乙酯+水的动态反应产生联系。若无外源添加,白酒中己酸、乙醇、己酸乙酯均来源于酿酒原料发酵产生,乙醇δ13C、己酸δ13C与己酸乙酯δ13C之间的关系本身就是动态稳定的。无论外源添加乙醇、己酸还是己酸乙酯(导致其中一者δ13C或者多者δ13C发生变化),在理论上都会引起白酒中该动态反应的平衡移位,从而引起新平衡下的己酸乙酯δ13C发生变化。本研究基于此原理,结合多元线性回归分析,对白酒中乙醇δ13C、己酸δ13C和己酸乙酯δ13C的相关性进行研究,旨在为稳定同位素技术在白酒外源添加鉴别方面的运用提供参考依据。
1 材料与方法
1.1 材料与试剂
玉米乙醇(食品级):河南鑫河阳酒精有限公司;木薯乙醇(分析纯):上海泰坦科技股份有限公司;丙酮(色谱纯):西陇化工股份有限公司;正己烷(色谱纯):南京化学试剂股份有限公司;己酸乙酯1(色谱纯)、己酸1(色谱纯):梯希爱(上海)化成工业发展有限公司;己酸5(色谱纯)、浓硫酸(分析纯):赛默飞世尔科技(中国)有限公司;己酸乙酯2、3(纯度均>90%):自发酵产生;品牌白酒1(52%vol,2022年)、品牌白酒2(50%vol,2013年)、品牌白酒3(52%vol,2016年)、品牌白酒4(52%vol,2016年)、其他不同酒厂不同品牌不同批次不同酒精度白酒:市售。乙醇δ13C、己酸δ13C和己酸乙酯δ13C具体信息见表1。
表1 乙醇δ13C、己酸δ13C及己酸乙酯δ13C
Table 1 Ethanol δ13C, hexanoic acid δ13C and ethyl hexanoate δ13C
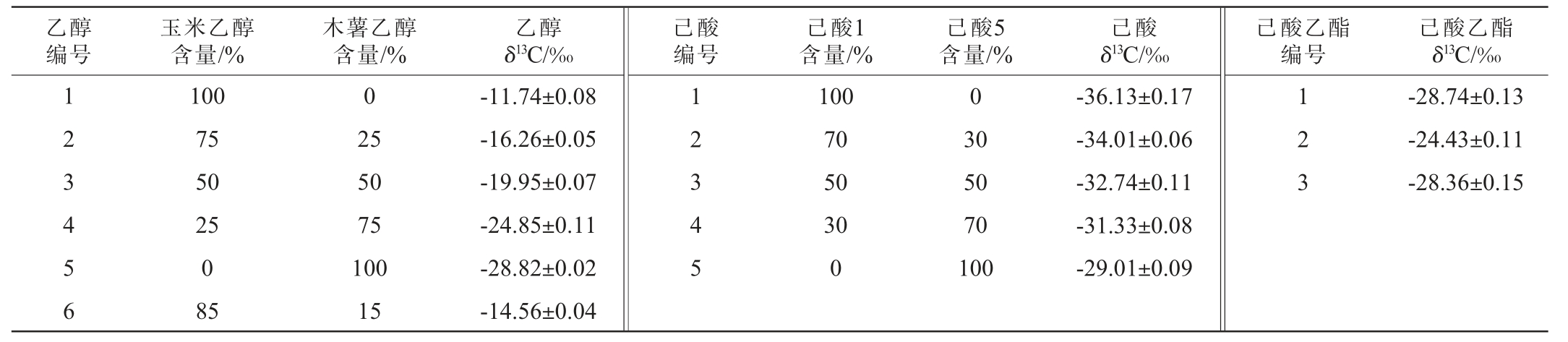
乙醇编号玉米乙醇含量/%木薯乙醇含量/%乙醇δ13C/‰己酸编号己酸1含量/%己酸5含量/%己酸δ13C/‰己酸乙酯编号己酸乙酯δ13C/‰1 2 3 4 5 6 100 75 50 25 0 85 0 0 25 50 75 100 15-11.74±0.08-16.26±0.05-19.95±0.07-24.85±0.11-28.82±0.02-14.56±0.04 1 2 3 4 5 100 70 50 30 0 30 50 70 100-36.13±0.17-34.01±0.06-32.74±0.11-31.33±0.08-29.01±0.09 1 2 3-28.74±0.13-24.43±0.11-28.36±0.15
1.2 仪器与设备
AI 1310自 动 进 样 器、Trace GC Ultra 气 相 色 谱(gas chromatography,GC)仪、GC Isolink燃烧(combustion,C)转化装置、Delta V Advantage稳定同位素比质谱(stable isotope ratio mass spectrometer,IRMS)仪:美国Thermo Fisher公司;HWS-26水浴锅:上海一恒科学仪器有限公司;LABDANCER S000旋涡振荡器:艾卡(广州)仪器设备有限公司。
1.3 方法
1.3.1 样品处理
白酒模拟物1:5 mL已知δ13C的乙醇水溶液(酒精度为52%vol)中加入5 μL已知δ13C的己酸(或己酸乙酯),摇匀待用。
白酒模拟物2:100 mL已知δ13C的乙醇水溶液(酒精度为60%vol)中加入250 μL已知δ13C己酸,摇匀待用。
外源添加乙醇品牌白酒:2.5 mL品牌白酒(酒精度为52%vol)中加入2.5 mL已知δ13C的乙醇水溶液(酒精度为52%vol),摇匀待用。
外源添加己酸乙酯品牌白酒:5 mL品牌白酒(酒精度为52%vol)中加入5 μL已知δ13C的己酸乙酯,摇匀待用。
外源添加己酸品牌白酒:5 mL品牌白酒(酒精度为52%vol)中加入5 μL已知δ13C的己酸,摇匀待用。
1.3.2 反应方法
在旋涡振荡条件下以1滴/s的速度向5 mL样品(品牌白酒、白酒模拟物或外源添加品牌白酒)中缓慢滴入0.66 mL浓硫酸[25],然后放置于40 ℃水浴中反应,直至反应达到动态平衡,冷却至室温后,加入水(使酒精度<15%vol)和2 mL正己烷,涡旋振荡萃取2 min,静置分层,取有机相,采用气相色谱-燃烧-稳定同位素比质谱(GC-C-IRMS)仪检测己酸乙酯δ13C。
乙醇+己酸⇌己酸乙酯+水的动态反应达到平衡是一个缓慢过程,需通过一定方法加快反应进行,但反应过程使用的方法、物质应不使目标检测物产生明显的同位素分馏效应,故对反应过程进行同位素分馏效应分析,包括正己烷萃取效果及反应时间的确认。
1.3.3 分析检测
采用GC-C-IRMS技术检测待测样品中乙醇δ13C、己酸乙酯δ13C和己酸δ13C。
样品前处理:采用丙酮将乙醇体积分数稀释至0.4%,用于测定乙醇δ13C。采用丙酮将己酸乙酯、己酸体积分数稀释至0.02%,用于测定己酸乙酯δ13C、己酸δ13C。
测定乙醇δ13C的GC条件:TR-WAXMS毛细管色谱柱(60 m×0.25 mm×0.25 μm);载气为高纯氦气(He),恒流模式,流速为1.0 mL/min;进样体积为1 μL,进样口温度为220 ℃;分流比为20∶1;升温程序为起始温度40 ℃,保持2 min,以1 ℃/min升温至50 ℃后保持1 min,再以20 ℃/min升温至220 ℃并保持4 min。
测定己酸乙酯δ13C、己酸δ13C的GC条件:TR-WAXMS毛细管色谱柱(60 m×0.25 mm×0.25 μm);载气为高纯氦气,恒流模式,流速为1.2 mL/min;进样体积为1 μL,进样口温度为220 ℃,不分流;升温程序为起始温度55 ℃,保持5 min,以4 ℃/min升温至80 ℃后保持4 min,再以6 ℃/min升温至100 ℃并保持7 min,接着以15 ℃/min升温至120 ℃后保持0 min,最后以10 ℃/min升温至220 ℃后保持3 min。
燃烧转化装置配备陶瓷氧化管,工作温度1 000 ℃。
IRMS条件:离子源真空为1.3×10-6mBar,电压为2.996kV。
1.3.4 数据处理
使用IRMS自带软件Isodat 3.0对测定的各物质δ13C数据进行导出和计算,再通过两点标准漂移校正模式校正得到各物质δ13C。
2 结果与分析
2.1 同位素分馏效应分析
2.1.1 正己烷萃取效果分析
在不加浓硫酸反应的条件下,按照1.3.2方法中萃取过程对不同样品处理后,测定己酸乙酯δ13C,考察正己烷对不同样品中己酸乙酯的萃取效果,结果见表2。
表2 正己烷萃取效果分析
Table 2 Extraction efficiency analysis of n-hexane
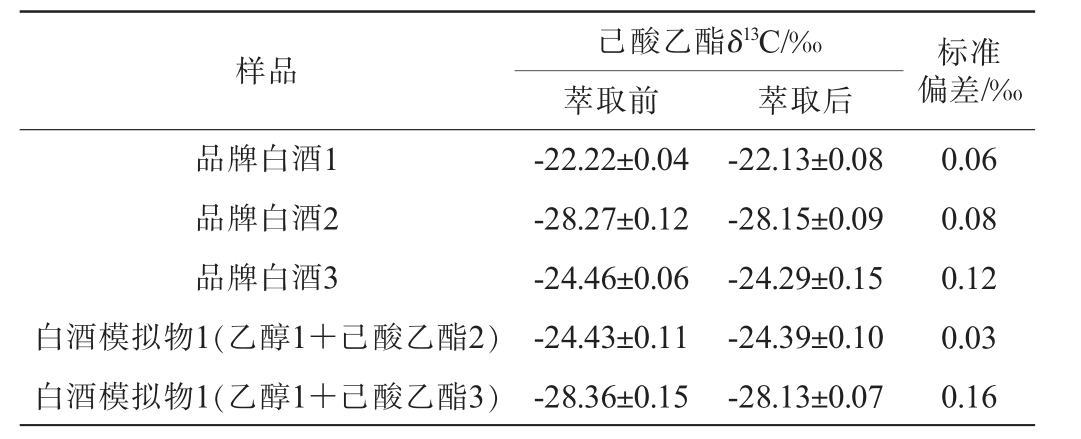
样品 标准偏差/‰己酸乙酯δ13C/‰萃取前 萃取后品牌白酒1品牌白酒2品牌白酒3白酒模拟物1(乙醇1+己酸乙酯2)白酒模拟物1(乙醇1+己酸乙酯3)-22.22±0.04-28.27±0.12-24.46±0.06-24.43±0.11-28.36±0.15-22.13±0.08-28.15±0.09-24.29±0.15-24.39±0.10-28.13±0.07 0.06 0.08 0.12 0.03 0.16
由表2可知,无论是在品牌白酒中,还是白酒模拟物中,正己烷对酒精度<15%vol反应体系中的己酸乙酯进行萃取后,己酸乙酯δ13C均无明显变化,标准偏差均<0.2‰,说明正己烷在本方法中不会使己酸乙酯产生明显的同位素分馏效应,其萃取效果是有效且适用的。
2.1.2 反应时间的选择
为研究乙醇δ13C、己酸δ13C、己酸乙酯δ13C在本反应条件下达到平衡的时间,不同样品按照1.3.2方法反应不同时间,测定己酸乙酯δ13C,考察不同反应时间对不同样品中己酸乙酯的δ13C的影响,结果见图1。
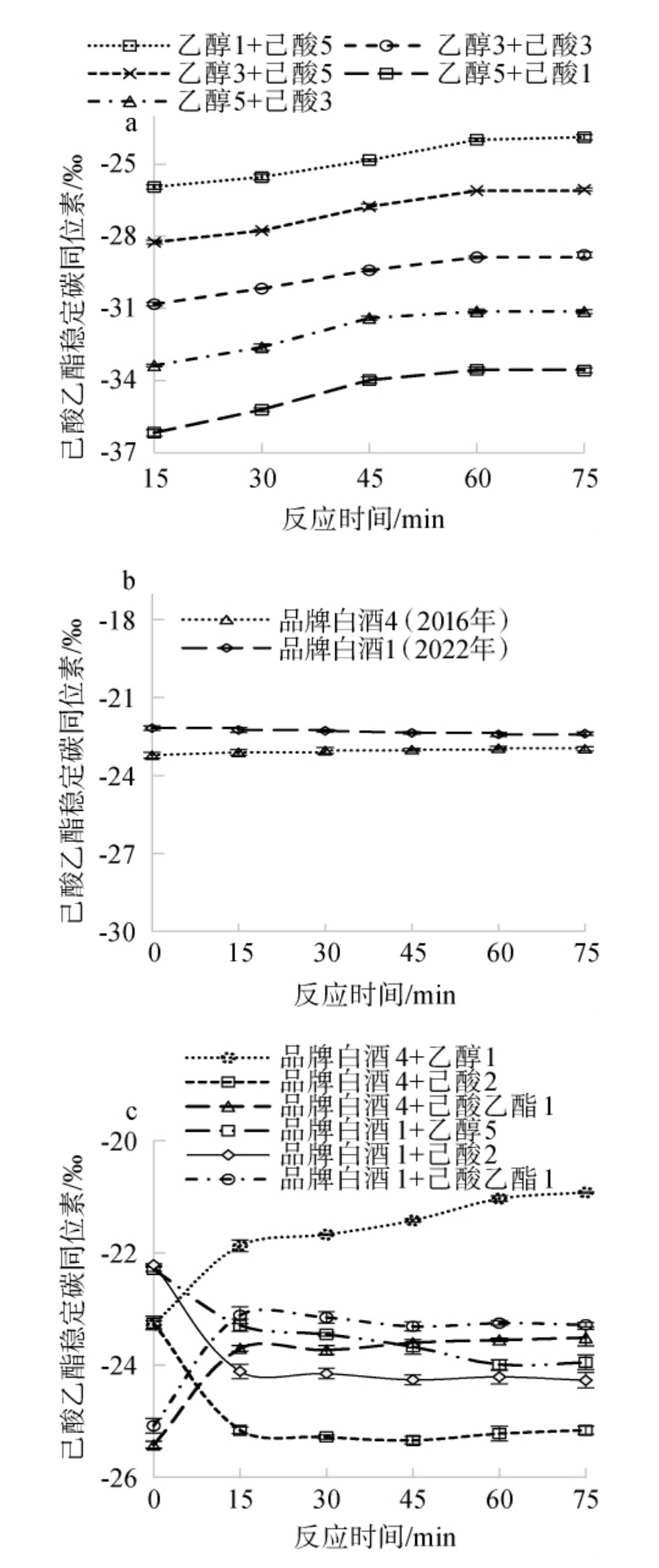
图1 不同样品在不同反应时间下己酸乙酯δ13C的变化
Fig.1 Changes of ethyl hexanoate δ13C in different samples at different reaction times
a-白酒模拟物1;b-品牌白酒;c-外源添加品牌白酒。
由图1可知,随着反应时间的延长,不同样品中的己酸乙酯δ13C有不同变化,且不同样品达到动态平衡的时间不同。白酒模拟物1在反应60 min后,己酸乙酯δ13C不再明显变化,说明白酒模拟物1在反应60 min后达到动态平衡。不同于白酒模拟物1,无外源添加的不同品牌白酒无论反应多长时间,其己酸乙酯δ13C在反应前后均无明显变化,说明无外源添加的品牌白酒中,同源的乙醇δ13C、己酸δ13C、己酸乙酯δ13C本身就是平衡的,并且整个反应过程不会使己酸乙酯产生明显的同位素分馏效应。分别添加了外源乙醇、外源己酸、外源己酸乙酯的品牌白酒中,当反应时间分别达到60 min、15 min、15 min后,样品中己酸乙酯δ13C均不再明显变化,说明不同外源添加后,达到动态平衡反应的时间不同。综上,所有样品在反应60 min后,己酸乙酯δ13C均不再明显变化,故在本研究条件下,反应时间均采用60 min。
2.2 白酒模拟物中乙醇δ13C、己酸δ13C和己酸乙酯δ13C的关系
2.2.1 基于白酒模拟物建立乙醇δ13C、己酸δ13C和己酸乙酯δ13C的关系公式
己酸乙酯来源于己酸、乙醇的酯化合成,己酸乙酯δ13C必定由乙醇δ13C、己酸δ13C共同决定,为研究这种决定性关系,按照1.3.1方法制备不同白酒模拟物1,再按照1.3.2方法进行反应,测定己酸乙酯δ13C,结果见表3。
表3 白酒模拟物中己酸乙酯δ13C测试值与计算值的差异
Table 3 Difference between the values and calculated values of ethyl hexanoate δ13C of Baijiu simulants
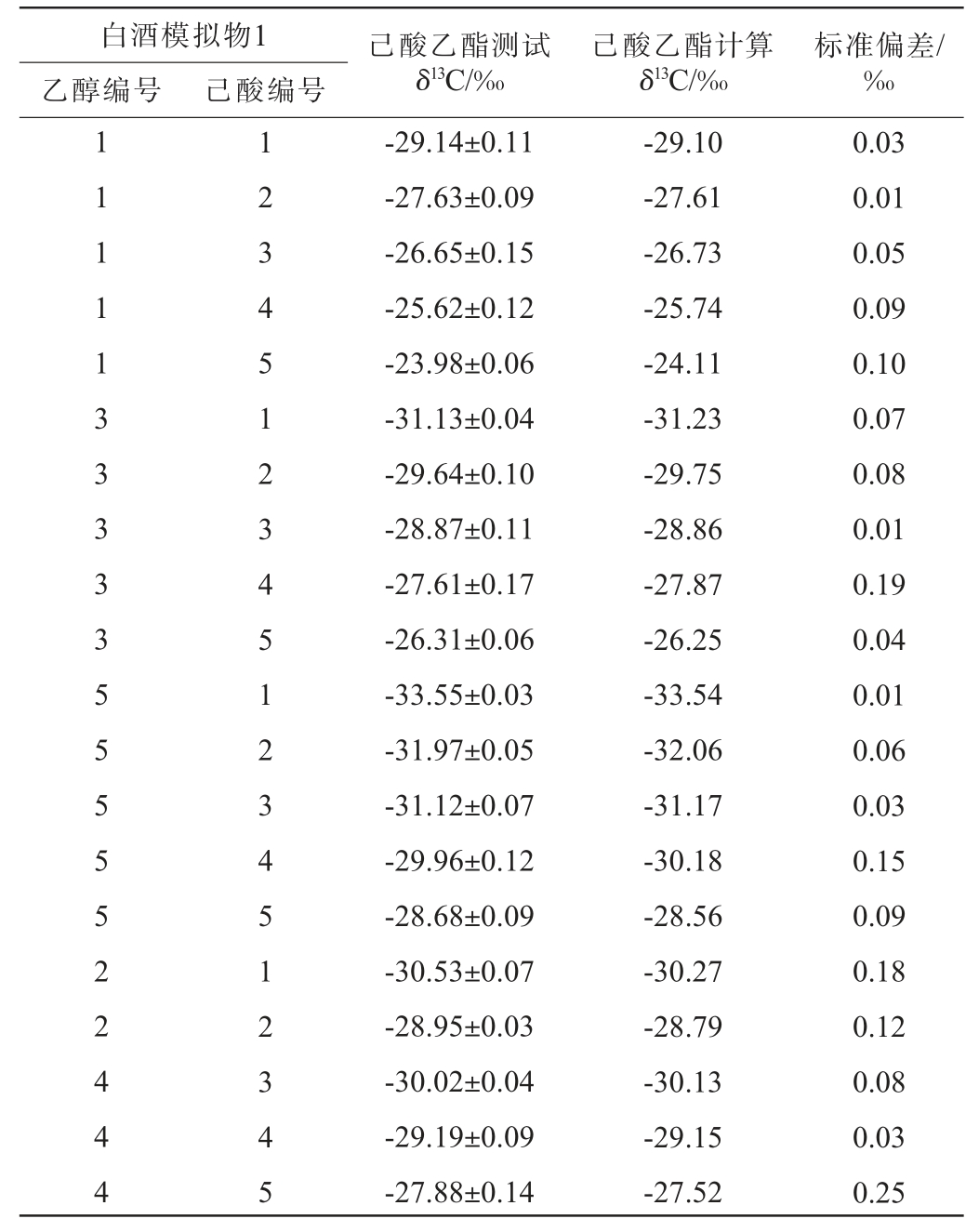
己酸乙酯测试δ13C/‰白酒模拟物1乙醇编号 己酸编号己酸乙酯计算δ13C/‰标准偏差/‰1 1 1 1 1 3 3 3 3 3 5 5 5 5 5 2 2 4 4 4 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5-29.14±0.11-27.63±0.09-26.65±0.15-25.62±0.12-23.98±0.06-31.13±0.04-29.64±0.10-28.87±0.11-27.61±0.17-26.31±0.06-33.55±0.03-31.97±0.05-31.12±0.07-29.96±0.12-28.68±0.09-30.53±0.07-28.95±0.03-30.02±0.04-29.19±0.09-27.88±0.14-29.10-27.61-26.73-25.74-24.11-31.23-29.75-28.86-27.87-26.25-33.54-32.06-31.17-30.18-28.56-30.27-28.79-30.13-29.15-27.52 0.03 0.01 0.05 0.09 0.10 0.07 0.08 0.01 0.19 0.04 0.01 0.06 0.03 0.15 0.09 0.18 0.12 0.08 0.03 0.25
结合表1,对表3白酒模拟物1中乙醇δ13C、己酸δ13C、己酸乙酯测试δ13C作散点图,结果见图2。由图2可知,在己酸δ13C不变的情况下,随着乙醇δ13C的变化,生成的己酸乙酯δ13C出现了较好的线性变化;在乙醇δ13C不变的情况下,随着己酸δ13C的变化,生成的己酸乙酯δ13C也出现了较好的线性变化。结果说明己酸乙酯δ13C受到了原料乙醇δ13C、己酸δ13C的决定性影响,并且这种影响是多元线性的。
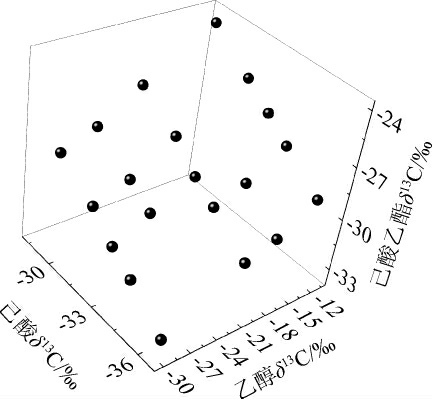
图2 白酒模拟物中乙醇δ13C、己酸δ13C、己酸乙酯测试δ13C散点图
Fig.2 Scatter plot of ethanol δ13C, hexanoic acid δ13C and detected ethyl hexanoate δ13C in Baijiu simulants
结合表1,对表3中乙醇δ13C、己酸δ13C、己酸乙酯测试δ13C数据进行多元线性回归分析,并对回归模型进行方差分析、对回归系数进行显著性检验分析,结果分别见表4和表5。
表4 白酒模拟物中乙醇δ13C、己酸δ13C及己酸乙酯测试δ13C多元线性回归模型方差分析结果
Table 4 Variance analysis results of multiple linear regression model of ethanol δ13C, hexanoic δ13C and ethyl hexanoate δ13C in Baijiu simulants
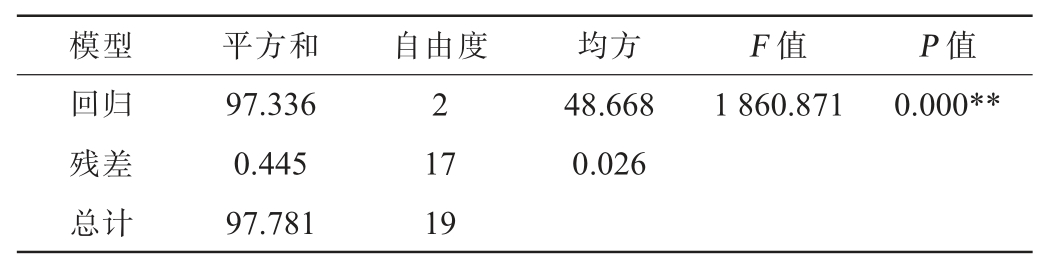
注:“**”表示极显著(P<0.01)。下同。
模型 平方和 自由度 均方 F 值 P 值回归残差总计97.336 0.445 97.781 2 1 860.871 0.000**17 19 48.668 0.026
表5 白酒模拟物中乙醇δ13C、己酸δ13C及己酸乙酯测试δ13C多元线性回归系数显著性检验结果
Table 5 Significance test results of multiple linear regression coefficient of ethanol δ13C, hexanoic acid δ13C and detected ethyl hexanoate δ13C in Baijiu simulants
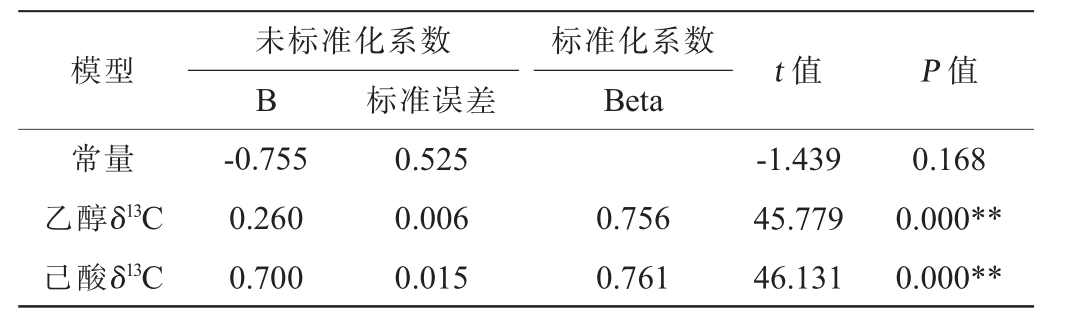
未标准化系数B 标准误差模型 t 值 P 值标准化系数Beta常量乙醇δ13C己酸δ13C-0.755 0.260 0.700 0.525 0.006 0.015 0.756 0.761-1.439 45.779 46.131 0.168 0.000**0.000**
由表4可知,模型极显著(P<0.01),说明回归模型有统计学意义;由表5可知,乙醇δ13C、己酸δ13C极显著(P<0.01),说明两变量均对己酸乙酯δ13C具有极显著影响。由此得到白酒模拟物中基于乙醇δ13C、己酸δ13C的己酸乙酯δ13C计算公式:
2.2.2 公式(1)的验证
结合表1,将表3数据带入公式(1)计算得到己酸乙酯计算δ13C。由表3可知,己酸乙酯的测试δ13C和计算δ13C差距不明显,其标准偏差均小于0.3‰,说明公式(1)准确可用。
为进一步验证公式(1)的准确性,采用其他组合的己酸、乙醇进行相同实验,测定己酸乙酯测试δ13C,并按公式(1)计算得到己酸乙酯计算δ13C,结果见表6。由表6可知,己酸乙酯的测试δ13C和计算δ13C差距不明显,其标准偏差均小于0.3‰,进一步说明公式(1)准确可用。
表6 基于不同白酒模拟物1对公式(1)的验证实验结果
Table 6 Verification experiment results of formula (1) based on different Baijiu simulants 1
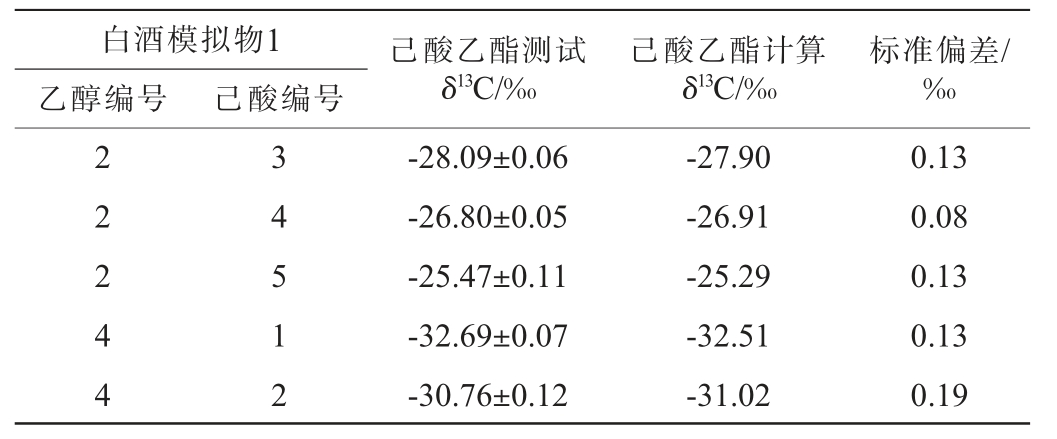
己酸乙酯测试δ13C/‰白酒模拟物1乙醇编号 己酸编号己酸乙酯计算δ13C/‰标准偏差/‰2 2 2 4 4 3 4 5 1 2-28.09±0.06-26.80±0.05-25.47±0.11-32.69±0.07-30.76±0.12-27.90-26.91-25.29-32.51-31.02 0.13 0.08 0.13 0.13 0.19
为排除反应条件、萃取过程可能引起同位素分馏效应,造成对结果准确度的影响,再进一步验证公式(1)在白酒模拟物中的准确性,按照1.3.1方法制备白酒模拟物2,加入10 μL浓硫酸后室温放置5年,直至乙醇δ13C、己酸δ13C、生成己酸乙酯δ13C在自然条件下达到平衡。测试放置前、后乙醇δ13C、己酸δ13C和己酸乙酯生成δ13C,再将该白酒模拟物2按照1.3.2方法进行反应,测试反应后己酸乙酯δ13C,再按照公式(1)计算得到己酸乙酯计算δ13C,结果见表7。
表7 基于不同白酒模拟物2对公式(1)的验证实验结果
Table 7 Verified experimental results of formula (1) based on different Baijiu simulants 2
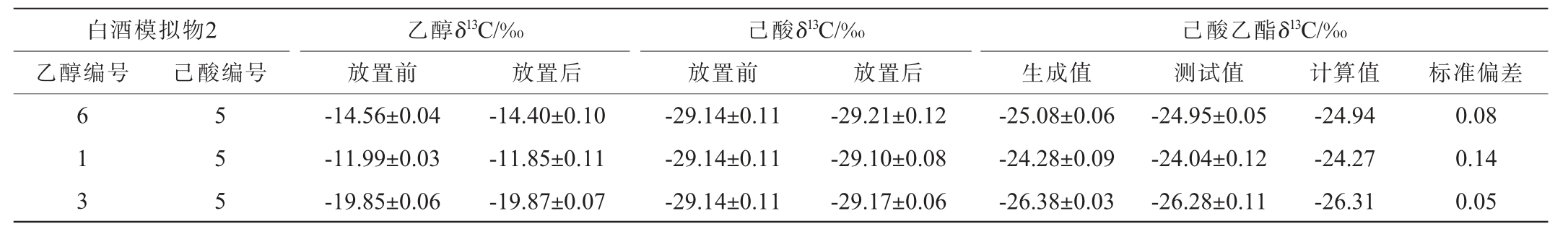
白酒模拟物2乙醇编号乙醇δ13C/‰放置前己酸δ13C/‰放置前己酸编号 放置后 放置后己酸乙酯δ13C/‰生成值 测试值 计算值 标准偏差6 1 3 5 5 5-14.56±0.04-11.99±0.03-19.85±0.06-14.40±0.10-11.85±0.11-19.87±0.07-29.14±0.11-29.14±0.11-29.14±0.11-29.21±0.12-29.10±0.08-29.17±0.06-25.08±0.06-24.28±0.09-26.38±0.03-24.95±0.05-24.04±0.12-26.28±0.11-24.94-24.27-26.31 0.08 0.14 0.05
由表7可知,在自然反应条件下,排除加热、萃取等过程,放置5年后,乙醇δ13C、己酸δ13C均无明显变化,说明乙醇、己酸的自然酯化反应达到平衡后不会引起乙醇、己酸明显的同位素分馏效应。按照1.3.2方法反应后,己酸乙酯测试δ13C和自然条件生成δ13C无明显差异,说明放置5年后,乙醇δ13C、己酸δ13C、己酸乙酯δ13C已自然达到平衡,且本研究1.3.2方法只加速了实验进程,并未改变实验结果,再次验证了本研究方法的准确可用性。虽然表3、表7中使用的乙醇溶液酒精度、己酸添加比例不同,但表7中按照公式(1)计算得到的己酸乙酯计算δ13C与生成δ13C、反应后测试δ13C均无明显差异,标准偏差均小于0.2‰,说明白酒模拟物中己酸乙酯δ13C只与原料乙醇δ13C、己酸δ13C相关,与乙醇溶液酒精度、己酸添加比例无关,再次验证公式(1)在白酒模拟物中是准确可用的。
2.2.3 公式(1)在白酒中的应用
采用GC-C-IRMS检测11个不同酒厂不同品牌不同酒精度白酒的乙醇δ13C、己酸δ13C、己酸乙酯δ13C,并按照公式(1)计算得到己酸乙酯计算δ13C1,结果见表8。由表8可知,不同酒厂不同品牌不同酒精度白酒的己酸乙酯测试δ13C和计算δ13C1差异不同,标准偏差1为0.13‰~1.87‰,并且大部分标准偏差1都较大(>0.5‰),说明公式(1)不适用于白酒中己酸乙酯δ13C的计算。分析原因可能是,一是白酒模拟物成分简单、影响因素少,而白酒成分复杂,除了乙醇、己酸、己酸乙酯外还有很多其他高级醇、酯、酸可能会对乙醇、己酸有竞争反应,影响乙醇δ13C、己酸δ13C、己酸乙酯δ13C在白酒中的平衡,造成公式(1)在白酒中使用误差较大;二是建立的公式(1)使用的己酸δ13C范围在-36.13‰~-29.01‰(市面上能购买到的己酸δ13C均偏负),超出了白酒中己酸δ13C范围(大部分>-27‰),造成公式(1)在白酒中使用误差较大。
表8 公式(1)及公式(2)在白酒中的应用
Table 8 Application of formula (1) and formula (2) in Baijiu
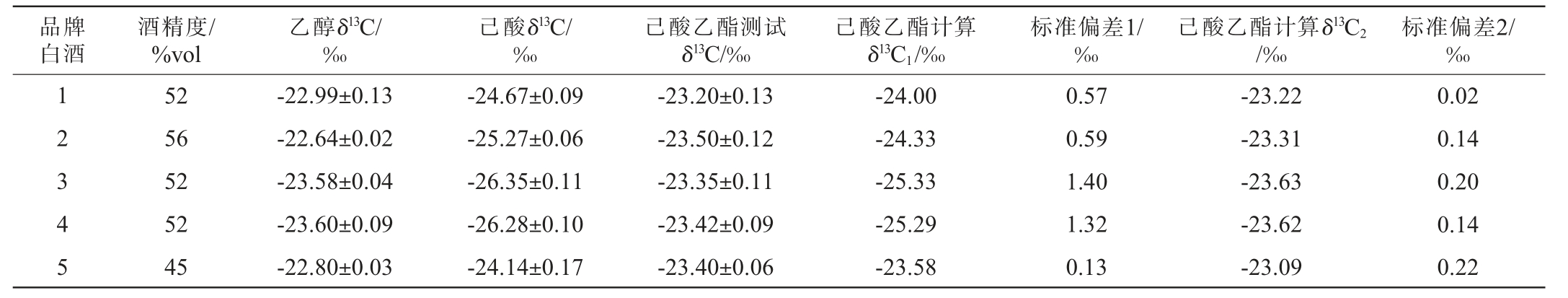
品牌白酒酒精度/%vol乙醇δ13C/‰己酸δ13C/‰己酸乙酯测试δ13C/‰己酸乙酯计算δ13C1/‰标准偏差1/‰己酸乙酯计算δ13C2/‰标准偏差2/‰1 2 3 4 5 52 56 52 52 45-22.99±0.13-22.64±0.02-23.58±0.04-23.60±0.09-22.80±0.03-24.67±0.09-25.27±0.06-26.35±0.11-26.28±0.10-24.14±0.17-23.20±0.13-23.50±0.12-23.35±0.11-23.42±0.09-23.40±0.06-24.00-24.33-25.33-25.29-23.58 0.57 0.59 1.40 1.32 0.13-23.22-23.31-23.63-23.62-23.09 0.02 0.14 0.20 0.14 0.22
续表
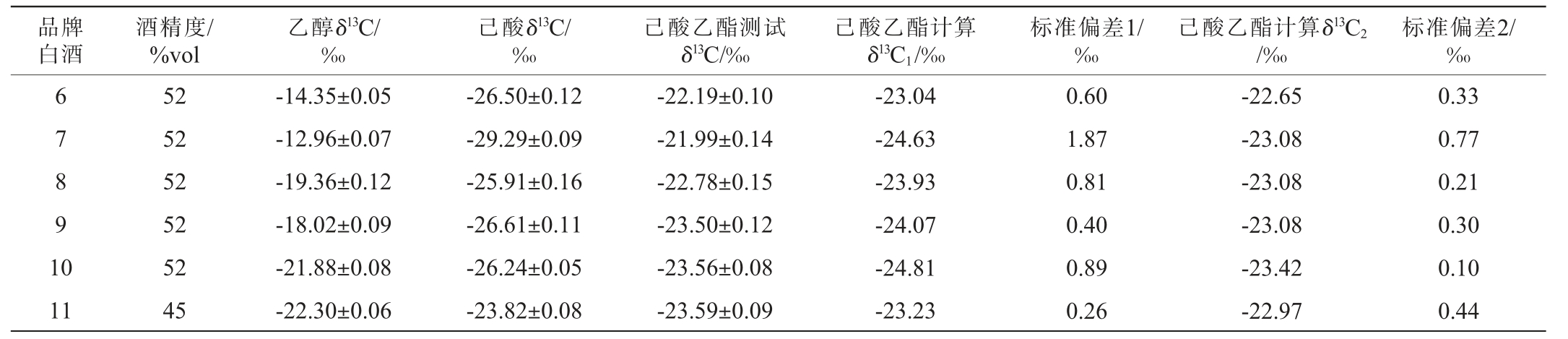
品牌白酒酒精度/%vol乙醇δ13C/‰己酸δ13C/‰己酸乙酯测试δ13C/‰己酸乙酯计算δ13C1/‰标准偏差1/‰己酸乙酯计算δ13C2/‰标准偏差2/‰6 7 8 9 1 0 11 52 52 52 52 52 45-14.35±0.05-12.96±0.07-19.36±0.12-18.02±0.09-21.88±0.08-22.30±0.06-26.50±0.12-29.29±0.09-25.91±0.16-26.61±0.11-26.24±0.05-23.82±0.08-22.19±0.10-21.99±0.14-22.78±0.15-23.50±0.12-23.56±0.08-23.59±0.09-23.04-24.63-23.93-24.07-24.81-23.23 0.60 1.87 0.81 0.40 0.89 0.26-22.65-23.08-23.08-23.08-23.42-22.97 0.33 0.77 0.21 0.30 0.10 0.44
2.3 白酒中乙醇δ13C、己酸δ13C和己酸乙酯δ13C的关系
2.3.1 基于白酒建立乙醇δ13C、己酸δ13C和己酸乙酯δ13C的关系公式
为验证白酒中乙醇δ13C、己酸δ13C、己酸乙酯δ13C的相关性,选择不同酒厂7个品牌(高端产品)共计165个白酒样品,对其乙醇δ13C、己酸δ13C、己酸乙酯δ13C进行检测,结果见表9。
表9 不同品牌白酒样品乙醇δ13C、己酸δ13C及己酸乙酯δ13C检测结果
Table 9 Test results of ethanol δ13C, hexanoic acid δ13C and ethyl hexanoate δ13C of different brands of Baijiu samples
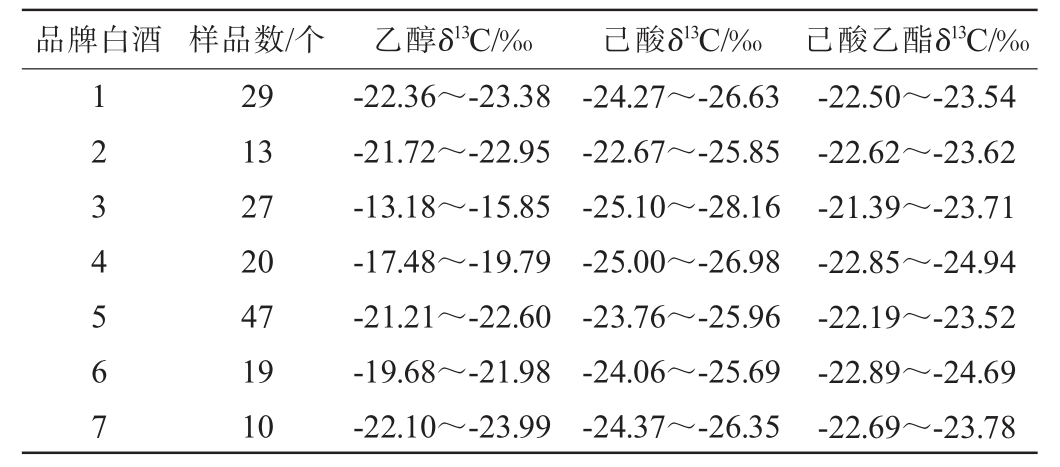
品牌白酒 样品数/个 乙醇δ13C/‰ 己酸δ13C/‰ 己酸乙酯δ13C/‰1 2 3 4 5 6 7 29 13 27 20 47 19 10-22.36~-23.38-21.72~-22.95-13.18~-15.85-17.48~-19.79-21.21~-22.60-19.68~-21.98-22.10~-23.99-24.27~-26.63-22.67~-25.85-25.10~-28.16-25.00~-26.98-23.76~-25.96-24.06~-25.69-24.37~-26.35-22.50~-23.54-22.62~-23.62-21.39~-23.71-22.85~-24.94-22.19~-23.52-22.89~-24.69-22.69~-23.78
对表9数据进行多元线性回归分析,并对回归模型进行方差分析、对回归系数进行显著性检验分析,结果分别见表10和表11。
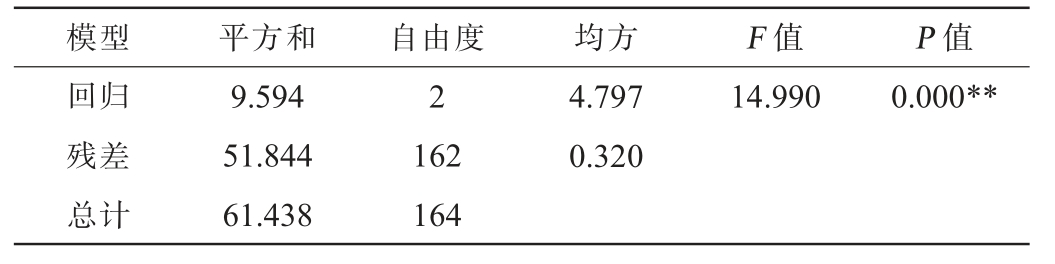
表10 白酒中乙醇δ13C、己酸δ13C及己酸乙酯δ13C多元线性回归模型方差分析结果
Table 10 Variance analysis results of multiple linear regression model of ethanol δ13C, hexanoic δ13C and ethyl hexanoate δ13C in Baijiu
模型 平方和 自由度 均方 F 值 P 值回归残差总计9.594 51.844 61.438 2 14.990 0.000**162 164 4.797 0.320
表11 白酒中乙醇δ13C、己酸δ13C及己酸乙酯δ13C多元线性回归系数显著性检验结果
Table 11 Significance test results of multiple linear regression coefficient of ethanol δ13C, hexanoic acid δ13C and ethyl hexanoate δ13C in Baijiu
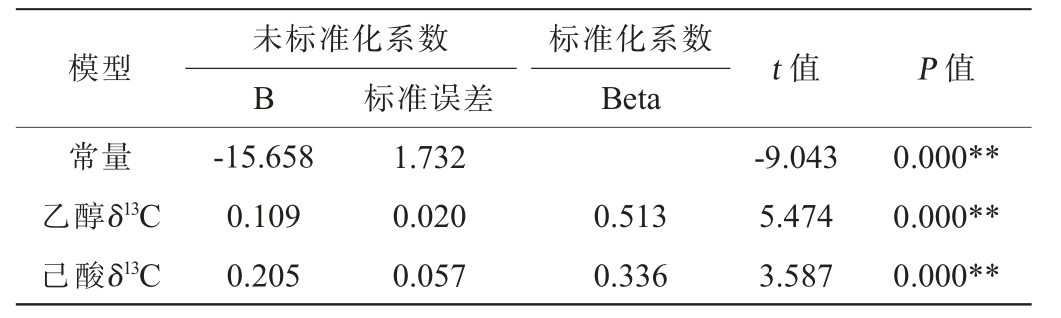
未标准化系数B 标准误差模型 t 值 P 值标准化系数Beta常量乙醇δ13C己酸δ13C-15.658 0.109 0.205 1.732 0.020 0.057 0.513 0.336-9.043 5.474 3.587 0.000**0.000**0.000**
由表10可知,回归模型极显著(P<0.01),说明回归模型有统计学意义;由表11可知,乙醇δ13C、己酸δ13C均极显著(P<0.01),说明两变量均对己酸乙酯δ13C具有显著影响。由此得到品牌白酒中基于乙醇δ13C、己酸δ13C的己酸乙酯δ13C计算公式:
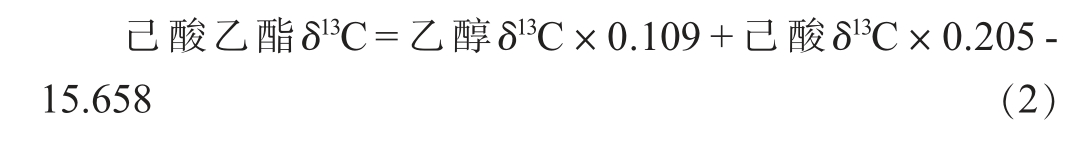
2.3.2 公式(2)的验证及应用
将表8中11个样品数据带入公式(2)计算得到己酸乙酯计算δ13C2值,结果发现,己酸乙酯测试δ13C和计算δ13C2的标准偏差2为0.02‰~0.77‰(也说明7号酒样可能有外源添加),并且大部分样品的标准偏差2都小于0.5‰,相较于公式(1)的标准偏差1,公式(2)的标准偏差2明显更小,说明公式(2)更适用于白酒的使用。
将表9中165个样品的数据带入公式(2)计算得到各白酒己酸乙酯计算δ13C,对比己酸乙酯计算δ13C和测试δ13C,计算得到标准偏差。结果发现,7个品牌共165个样品中,己酸乙酯计算δ13C和测试δ13C的标准偏差≤0.3‰的样品占比为57.58%,0.3‰<标准偏差≤0.5‰的样品占比为24.85%,标准偏差>0.5‰的样品占比为17.58%。说明公式(2)在白酒中有一定适用性,但误差偏大。分析原因可能是,一是这批成品酒虽然乙醇δ13C范围(-13‰~-24‰)、己酸δ13C范围(-22‰~-28‰)较宽,但己酸乙酯δ13C范围(-21‰~-25‰)较窄,造成公式(2)在白酒中使用误差较大;二是这批成品酒可能有部分酒中有外源添加,造成其中乙醇δ13C、己酸δ13C、己酸乙酯δ13C未达到平衡状态,使公式(2)在白酒中使用误差较大。
3 结论
本研究基于乙醇+己酸⇌己酸乙酯+水的动态平衡反应,研究了白酒模拟物和白酒中乙醇δ13C、己酸δ13C、己酸乙酯δ13C的相关性,建立了展示该关系的公式(1):己酸乙酯δ13C=乙醇δ13C×0.260+己酸δ13C×0.700-0.755,公式(2):己酸乙酯δ13C=乙醇δ13C×0.109+己酸δ13C×0.205-15.658,但因白酒体系复杂,公式(1)并不适用于分析白酒中3者的相关性,然而相较于公式(1),公式(2)标准偏差较小,能较好的展示白酒中乙醇δ13C、己酸δ13C及己酸乙酯δ13C的关系,在白酒中具有一定的适用性,为稳定同位素技术在白酒外源添加方面的运用提供了参考依据。此外,本研究反应方法在保证白酒中无外源添加时,反应前后己酸乙酯δ13C不产生明显稳定同位素分馏效应的前提下,快速使不同样品达到平衡状态,操作简单、时间短、结果准确,为研究乙醇δ13C、己酸δ13C、己酸乙酯δ13C的相关性提供了技术支持。
[1]李先贵,陈剑波,王莉,等.酱香型白酒中有机酸的分析[J].酿酒科技,2019(6):105-107,111.
[2]韩云翠,吕志远,刘玉涛,等.基于傅立叶变换中红外光谱技术的浓香型基酒快速检测[J].食品与发酵工业,2024,50(1):272-278,285.
[3]LI C L, KANG X M, NIE J, et al.Recent advances in Chinese food authentication and origin verification using isotope ratio mass spectrometry[J].Food Chem,2023,398:133896.
[4]彭凯秀,刘欢,刘鸽,等.稳定同位素技术在动植物源食品溯源中的应用研究[J].食品工业科技,2021,42(8):338-345.
[5]王静娴.基于稳定同位素和矿质元素指纹的蜂蜜产地鉴别研究[D].银川:宁夏大学,2023.
[6]MEI H Y, NIE J, PAN M Z, et al.Geographical origin identification of Pujiang Kyoho grapes in China using stable isotope and elemental profiles[J].Food Control,2024,162:110454.
[7]FAN S X,ZHONG Q D,GAO H B,et al.Elemental profile and oxygen isotope ratio(δ18O)for verifying the geographical origin of Chinese wines[J].J Food Drug Anal,2018,26(3):1033-1044.
[8]SPANGENBERG J E,VOGIATZAKI M,ZUFFEREY V.Gas chromatography and isotope ratio mass spectrometry of Pinot Noir wine volatile compounds (δ13C) and solid residues (δ13C, δ15N) for the reassessment of vineyard water-status[J].J Chromatogr A,2017,1517:142-155.
[9]LI Y L,YANG X T,ZHAO S S,et al.Effects of sampling time and location on the geographical origin traceability of protected geographical indication (PGI) Hongyuan yak milk: Based on stable isotope ratios[J].Food Chem,2024,441:138283.
[10]SUTO M, KAWASHIMA H, SUTO N.Heart-cutting two-dimensional liquid chromatography combined with isotope ratio mass spectrometry for the determination of stable carbon isotope ratios of gluconic acid in honey[J].J Chromatogr A,2019,1608:460421.
[11]王鹏飞,郭康,沈娟章,等.稳定同位素结合粗脂肪、粗蛋白含量判别核桃的产地来源[J].食品与发酵工业,2019,45(2):214-219.
[12]HUANG Y L,WANG D B,ZHONG Q D,et al.Application of gas chromatography-stable isotope mass spectrometry to determine the oxygen isotope ratio of water in concentrated fruit juice[J].J Agr Food Res,2024,15:100940.
[13]XIONG C,WANG Q,XU J S.Tracing the geographical origin of grain vinegar using the stable isotope ratio mass spectrometry and chemometrics[J].J Food Compos Anal,2023,123:105554.
[14]郄梦洁,李政,赵姗姗,等.稳定同位素技术在甘肃环县不同乡镇肉羊溯源中的应用[J].核农学报,2023,37(9):1782-1789.
[15]马玉华,唐方东,刘佳煜,等.稳定同位素比技术用于橄榄油的掺假鉴定[J].质谱学报,2021,42(2):189-196.
[16]DING B,TAO Y W,XIE J J,et al.Traceability evaluation of wild and cultivated cordyceps sinensis by elemental analysis and GasBench II coupled to stable isotope ratio mass spectrometry[J].Food Anal Method,2023,16:515-524.
[17]雷佳蕾,田丹,薛佳,等.δD,δ18O和δ13C同位素比率质谱法在鲜榨苹果汁鉴伪中的应用[J].食品与发酵工业,2020,46(9):234-242.
[18]秦丹,吴子阳,张锋国,等.稳定同位素技术在饮料酒掺杂和溯源检测的应用[J].中国酿造,2018,37(1):16-20.
[19]张倩,谢正敏,安明哲,等.酿酒粮食发酵蒸馏乙醇碳稳定同位素的变化[J].酿酒科技,2020(3):47-51.
[20]李贺贺,胡萧梅,孙宝国,等.碳稳定同位素在白酒真实性中的应用[J].中国食品学报,2019,19(1):183-189.
[21]张倩,谢正敏,安明哲,等.稳定碳同位素判别浓香型白酒的品牌[J].食品与发酵工业,2021,47(6):234-240.
[22]岳涛,王道兵,李安军,等.白酒大生产过程中乙醇稳定碳同位素变化特征研究[J].食品与发酵工业,2023,49(2):63-67.
[23]王道兵,钟其顶,李国辉,等.发酵乙醇中13C/12C分布的影响因素研究[J].酿酒科技,2014(11):6-9.
[24]张建,邵飞龙,马义虔,等.酱香型白酒中稳定碳/氮同位素的测定[J].中国酿造,2017,36(8):158-160.
[25]中华人民共和国工业和信息化部.QB/T 5403—2019 共轭亚油酸[S].北京:中国轻工业出版社,2019.