生物胺是一类含氨基的低分子质量有机化合物的总称,一般由氨基酸发生脱羧反应形成,广泛存在于各类发酵食品和蛋白质含量丰富的食品中[1]。依据生物胺的结构可将其分为脂肪族生物胺(如腐胺、尸胺、精胺等)、芳香族生物胺(如苯乙胺、酪胺等)以及杂环生物胺(如组胺、色胺等)三类[2]。少量生物胺在活性细胞中发挥着重要的生理作用,低含量的生物胺是合成荷尔蒙、生物碱和蛋白质等活性物质的前体,适量摄入生物胺对促进生长发育、增强代谢活力、增强免疫力和清除自由基都具有积极作用[3-4]。但是,当生物胺摄入过量时,就会引发头疼、恶心、呕吐、呼吸紊乱、血压变化、心悸等中毒症状,严重时会引起脑出血,甚至死亡[5-6]。生物胺除自身具有毒性外,还可与亚硝酸盐等生成具有致癌性的亚硝胺而间接致癌[7]。
食品中生物胺主要由微生物降解氨基酸产生。发酵酒是指用谷物、果汁等为原料经发酵而得的低度酒,包括葡萄酒、啤酒、黄酒和果酒等,其发酵过程有丰富的微生物参与,产生大量发酵副产物,生物胺就是其中重要的胺类物质[2,8-9]。目前已有不少国家对葡萄酒中的生物胺进行了限定,澳大利亚、瑞士、法国、荷兰和德国对葡萄酒中组胺限量规定分别为10mg/L、10mg/L、8mg/L、3.5mg/L、2mg/L[10-12],而我国并未规定酒类中的生物胺含量的限量标准。因此,开展发酵酒中残留生物胺的分离与检测技术研究,对于残留生物胺的快速分析与相关产品的质量安全标准的制订具有重要现实意义。
目前,生物胺的样品前处理方法主要有固相萃取法[13]和液相萃取法[14],但这两种方法过程较为繁琐,样品基质效应较大;检测技术主要包括高效液相色谱法(high performance liquid chromatography,HPLC)[15-17]、气相色谱法(gas chromatography,GC)[18-20]、离子色谱法(ion chromatography,IC)[21]以及高效液相色谱-串联质谱法(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)[22-23]等,其中,GB 5009.208—2016《食品安全国家标准食品中生物胺的测定》中采用液相色谱法和分光光度法测定食品中的生物胺含量,但是大部分需要对生物胺进行衍生化处理以减小极性,从而实现在色谱柱上的分离,这存在操作繁琐耗的问题,无法实现高通量的筛查等。因此,本研究通过考察前处理方法、色谱条件及基质效应拟建立一种非衍生化方法即通过式固相萃取结合超高效液相色谱-串联质谱(ultra-high performance liquid chromatographytandem mass spectrometry,UPLC-MS/MS)同时检测发酵酒中的15种生物胺,并对其进行方法学考察,以期为发酵酒中生物胺的高通量检测提供新方法。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
发酵酒(黄酒、啤酒、葡萄酒):市售,各10批次。
1.1.2 试剂
15种生物胺标准品(3,3'-二氨基二丙胺、腐胺、精胺、N-(4-氨基丁基)乙酰胺、N1-乙酰精胺、亚精胺、尸胺、三甲胺、酪胺、色胺、组胺、3-甲基组胺、苯胺、章鱼胺、β-苯乙胺)、4种生物胺内标(尸胺-d4、组胺-d4、色胺-d4、章鱼胺-d3):天津阿尔塔科技有限公司;N-丙基乙二胺(N-primary secondary amine,PSA)、球形十八烷基硅烷(octadecylisilane,ODS)C18填料(50 μm):博纳艾杰尔科技有限公司;乙腈:德国Merck公司;甲酸:美国Honeywell公司;甲酸铵:上海阿拉丁生化科技股份有限公司。本研究所用试剂均为分析纯或色谱纯。
1.2 仪器与设备
0.22 μm有机相针头式滤器:上海安谱实验科技股份有限公司;PRiME HLB固相萃取小柱:美国WATERS公司;Q-Trap 6500+液质联用仪:美国SCIEX公司;XPE 205电子天平:瑞士METTLER公司;Multifuge X1R离心机:美国Thermo Fisher公司;KH-500DV超声仪:江苏昆山禾创有限公司。
1.3 方法
1.3.1 标准溶液的配制
单一标准储备液:称取各种生物胺标准品或生物胺同位素内标适量,分别用0.1 mol/L HCl配制成质量浓度均为1 000 mg/L的标准储备液,置于-20 ℃冰箱避光储存备用。
生物胺混合标准工作液:分别吸取各生物胺单一标准储备液,用0.1 mol/L HCl配制成质量浓度为10 mg/L的标准中间液,置于-20 ℃冰箱避光储存备用。
生物胺同位素内标混合标准工作液:分别吸取各生物胺同位素内标单一标准储备液,用0.1 mol/LHCl配制成质量浓度为10 mg/L的标准中间液,置于-20 ℃冰箱避光储存备用。
生物胺标准系列溶液:准确量取适量混合标准工作液,用0.1%甲酸-水溶液稀释成质量浓度分别为1.0 μg/L、5.0 μg/L、10.0 μg/L、20.0 μg/L、40.0 μg/L、100.0 μg/L的混合标准系列溶液,其中内标质量浓度为40 μg/L。备用。
1.3.2 超高效液相色谱-串联质谱条件优化
液相色谱条件:微纯MicroPuliteHSST3(100mm×2.1mm,1.8 μm);柱温35 ℃;进样量2 μL;流动相为0.1%甲酸水(A)和0.1%甲酸乙腈(B),梯度洗脱程序为0~2.00 min、5%B,2.00~4.00 min、5%~90%B,4.00~7.00 min、90%B,7.00~7.10min、90%~5%B,7.10~10.00min,5%B;流速0.30mL/min。
质谱条件:电喷雾离子源,正离子扫描模式,多反应监测(multiple reaction monitoring,MRM)模式;电离电压4 500 V;离子源温度450 ℃;气帘气流速35 L/min;碰撞气流量55 L/min;各化合物的定性离子对、定量离子对、去簇电压、碰撞能量见表1。
表1 多反应监测模式下生物胺的质谱条件
Table 1 Mass conditions of biogenic amines under multiple reaction monitoring mode
注:“*”表示为定量离子。
化合物 母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/eV 3,3'-二氨基二丙胺腐胺精胺N-(4-氨基丁基)乙酰胺N1-乙酰精胺亚精胺尸胺三甲胺酪胺色胺组胺3-甲基组胺苯胺章鱼胺β-苯乙胺132.1 89.2 203.3 131.1 245.3 146.2 103.1 60.1 138.2 161.2 112.1 126.1 94.0 154.1 122.2 98.0*/58.2 60.8*/72.0 129.2*/112.1 114.1*/72.2 171.1*/129.0 72.0*/112.0 86.2*/69.3 44.0*/30.0 121.3*/77.3 144.2*/115.1 95.2*/68.1 108.9*/96.0 77.0*/51.1 91.0*/107.1 105.1*/77.1 60 60 60 55 60 70 65 60 60 60 60 65 65 65 70 22/21 21/17 18/27 16/23 21/22 25/20 15/22 28/45 22/35 19/20 22/30 23/25 26/41 26/35 30/35
在此基础上,以质量浓度为20.0 μg/L的混合标准溶液为检测样,分别考察色谱柱(Waters ACQUITY UPLC®BEH C18(100 mm×2.1 mm,1.7 μm)、Waters Atlantis T3(150 mm×2.1 mm,5 μm)、Waters Acquity UPLC HSS T3(100 mm×2.1 mm,1.8 μm)、Waters ACQUITY UPLC ® BEH HILIC(100 mm×2.1 mm,1.7 μm)、微纯MicroPulite HSS T3(100 mm×2.1 mm,1.8 μm))、流动相(0.1%甲酸乙腈-0.1%甲酸水、乙腈-0.1%甲酸水、乙腈-水、乙腈-5 mmol/L甲酸铵)对生物胺分离效果的影响。
1.3.3 前处理方法的比较
为实现多种生物胺的快速测定,结合现已报道的不需要进行衍生化的前处理方法[11,23],以葡萄酒作为基质,按1 mg/L质量浓度水平进行加标后,采用PRiME HLB固相萃取柱净化法(通过式固相萃取净化)和QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)净化法两种方法分别进行净化,采用优化后的UPLC-MS/MS进行检测,对比两种前处理方法的净化效果。
PRiME HLB固相萃取柱净化法:吸取2.0 mL样品,加入0.3 mL生物胺同位素内标混合标准工作液后过PRiME HLB固相萃取柱,取1.00 mL滤出液,用0.1%甲酸溶液稀释至100 mL,取稀释液过0.22 μm滤膜后上机检测。
QuEChERS净化法:吸取样品1.0 mL样品于50 mL塑料离心管中,加入0.3 mL生物胺同位素内标混合标准工作液后,加入9 mL乙腈,涡旋振荡5 min,加入200 mg PSA、200 mg ODS C18,涡旋混匀1 min,4 500 r/min离心5 min,取上清液1.0 mL用0.1%甲酸溶液稀释至10 mL,过0.22 μm滤膜后上机检测。
1.3.4 基质效应分析
采用经过两种前处理方法净化的基质溶液(黄酒、葡萄酒、啤酒)配制质量浓度为20 μg/L的生物胺混合标准工作液,以采用0.1 mol/L HCl配制的质量浓度为20 μg/L的生物胺混合标准工作液为对照,采用优化后的UPLC-MS/MS进行检测,以两者中各生物胺的峰面积比值乘以100作为基质效应评估值。
1.3.5 方法学考察
标准曲线的绘制:腐胺、N1-乙酰精胺、亚精胺以及3-甲基组胺采用外标法进行定量,以其质量浓度(X)作为横坐标,以峰面积(Y)作为纵坐标绘制标准曲线。其余11种生物胺,采用内标法进行定量,以其质量浓度(X)为横坐标,以其峰面积与相应内标峰面积比值(Y)为纵坐标绘制标准曲线。
检出限及定量限:以3倍信噪比(S/N=3)计算检出限(limit of detection,LOD),10 倍信噪比(S/N=10)计算定量限(limit of quantitation,LOQ)。
加标回收率及精密度实验:以啤酒、黄酒以及葡萄酒3种典型的发酵酒为样品基质,分别添加0.3 mg/L(低)、1.0 mg/L(中)、10.0 mg/L(高)的15种生物胺混合标准品,开展回收实验,每个实验重复平行6次,计算其加标回收率及精密度实验结果的相对标准偏差(relative standard deviations,RSDs)。
1.3.6 实际样品中生物胺的检测
采用建立的通过式固相萃取-UPLC-MS/MS检测市售30份发酵酒样品中的15种生物胺。
1.3.7 数据处理
采用Excel 2021和Origin 8.0对实验数据进行整理和统计分析。
2 结果与分析
2.1 色谱条件的优化
2.1.1 色谱柱的选择
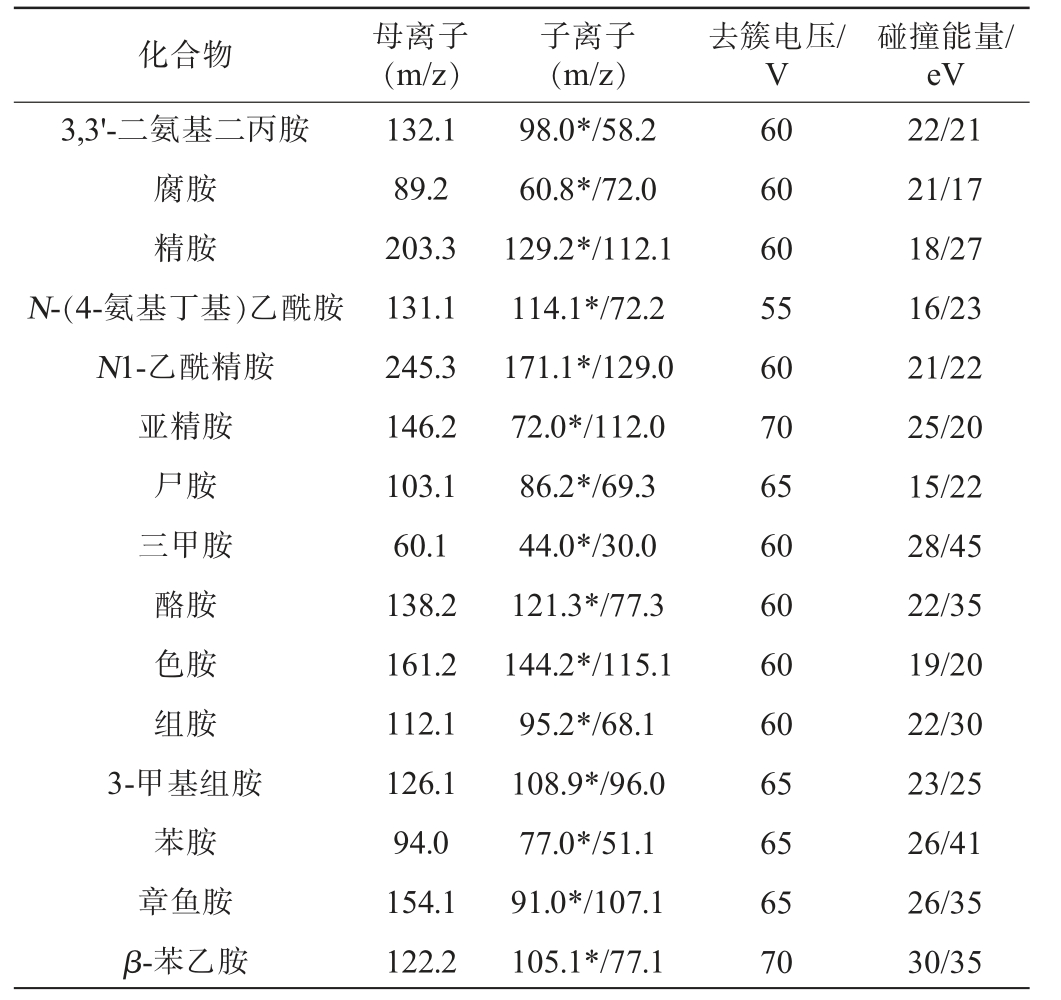
生物胺是一类碱性的含氮化合物,具有生物活性,分子质量小等特点,但15种生物胺的结构类型和化学性质存在差异,因此,需要考察不同色谱柱对15种生物胺分离效果的影响,结果见图1。由图1可知,当使用Waters ACQUITY UPLC®BEH HILIC色谱柱对生物胺进行分离时,3,3'-二氨基二丙胺、N-(4-氨基丁基)乙酰胺、N1-乙酰精胺、亚精胺、三甲胺、色胺、3-甲基组胺出现峰形较宽、严重拖尾,苯胺色谱峰分岔,而腐胺、精胺、尸胺、酪胺则未出现色谱峰,分析原因可能是由于生物胺是极性较大的水溶性化合物,需溶解在一定比例的水溶液中,而该色谱柱对水敏感所致。当使用Waters Atlantis T3色谱柱进行分离时,3,3'-二氨基二丙胺、腐胺、精胺、亚精胺、N1-乙酰精胺、尸胺、苯乙胺等9个生物胺均未出现色谱峰,除N-(4-氨基丁基)乙酰胺、苯胺和章鱼胺峰形良好外,其余均出现分岔、拖尾等现象。当使用Waters Acquity UPLC HSS T3色谱柱进行分离时,3,3'-二氨基二丙胺、精胺、N1-乙酰精胺、亚精胺以及β-苯乙胺的色谱峰出现拖尾、分岔等现象。当使用微纯HSS T3色谱柱对生物胺进行分离时,3,3'-二氨基二丙胺、腐胺、精胺的色谱峰存在峰形对称性不好的现象。然而,当采用Waters ACQUITY UPLC®BEH C18色谱柱进行分离时,15种生物胺都具有较好的峰形,且具有良好的分离效果,因此,选择Waters ACQUITY UPLC®BEH C18色谱柱为最佳色谱柱。
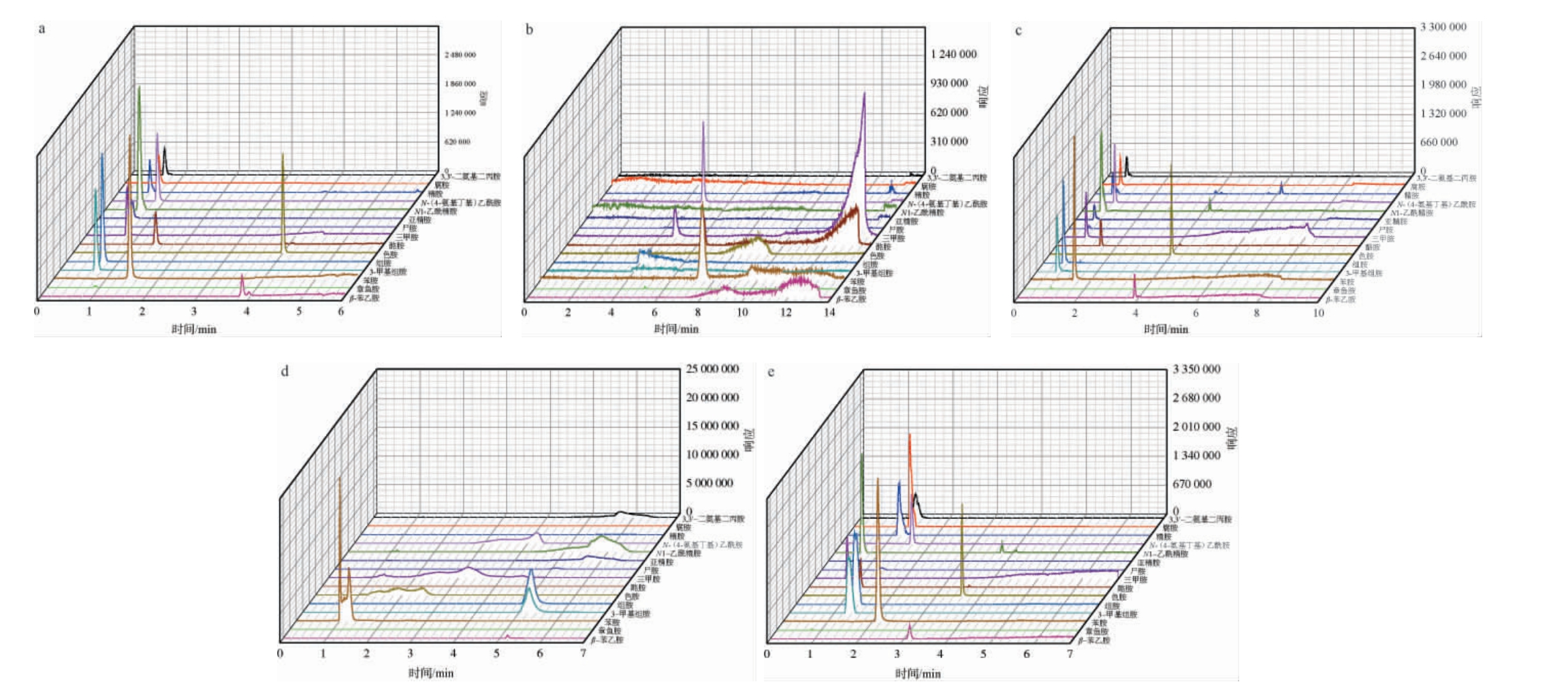
图1 不同色谱柱对15种生物胺分离效果的影响
Fig.1 Effect of different chromatographic columns on the separation effect of 15 kinds of biogenic amines
a为Waters ACQUITYUPLC®BEHC18色谱柱;b为WatersAtlantisT3色谱柱;c为WatersAcquityUPLCHSS T3色谱柱;d为Waters ACQUITY UPLC®BEHHILIC色谱柱;e为微纯MicroPuliteHSS T3色谱柱。
2.1.2 流动相的选择
考虑到质谱在正离子扫描模式下,加入甲酸、甲酸铵等可使化合物形成[M+H]+峰,有助于正离子质子化及促进离子化,提高分析灵敏度[24]。因此,考察不同流动相对15种生物胺分离效果的影响,结果见图2。由图2可知,当乙腈-水作为流动相时,β-苯乙胺、章鱼胺出现分岔且峰形变宽等现象,除色胺、组胺外其余11种化合物均存在色谱峰拖尾且响应低的现象;将流动相变成乙腈-5 mmol/L甲酸铵时,各生物胺的色谱峰与未加缓冲盐的并无太大区别;当流动相为乙腈-0.1%甲酸水时,15种生物胺分岔且峰形变宽的情况基本解决,得到的峰形对称性良好,但当流动相为0.1%甲酸乙腈-0.1%甲酸水时,酪胺、亚精胺、精胺可以获得更高的响应。因此,确定0.1%甲酸乙腈-0.1%甲酸水为最佳流动相。

图2 不同流动相对15种生物胺分离效果的影响
Fig.2 Effect of different mobile phase on the separation effect of 15 kinds of biogenic amines
a为乙腈-水溶液作为流动相;b为乙腈-5 mmol/L甲酸铵为流动相;c为乙腈-0.1%甲酸水溶液为流动相;d为0.1%甲酸乙腈-0.1%甲酸水溶液为流动相。
2.2 基质效应的考察
基质效应是在分析过程中,样品中除分析物以外的其他成分对分析结果的影响[25-26]。因此,采用发酵酒样(啤酒、黄酒、葡萄酒)配制生物胺混合标准工作液(20 μg/L),考察不同发酵酒样对生物胺基质效应的影响,结果见图3。由图3可知,3种发酵酒样的两种前处理方法对腐胺、N1-乙酰精胺、亚精胺、3-甲基组胺基质效应值在90.1%~111.2%,基本不存在基质效应,其余的11种生物胺在3种发酵酒样中均存在不同程度的基质抑制。而在实际检测过程中,发酵酒中的阴性基质较难发现,因此考虑不存在基质效应的4种化合物直接采用溶剂标曲进行校准,存在基质效应的化合物则采用内标法进行校准。

图3 不同发酵酒中15种生物胺的基质效应分析
Fig.3 Analysis of matrix effects of 15 biogenic amines in different fermented alcoholic drinks
a为啤酒中生物胺的基质效应;b为黄酒中生物胺的基质效应;c为葡萄酒中生物胺的基质效应。
2.3 前处理方法的比较
不同前处理方法对15种生物胺回收率的影响见图4。
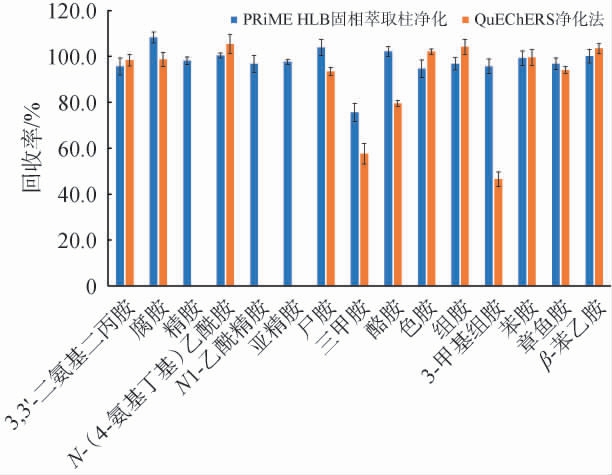
图4 2种前处理方法对15种生物胺回收率的影响
Fig.4 Effect of 2 pretreatment methods on the recovery rates of 15 biogenic amines
由图4可知,采用QuEChERS净化法处理后,样品中精胺、N1-乙酰精胺、亚精胺都未检出,3,3'-二氨基二丙胺、三甲胺以及3-甲基组胺的回收率偏低,在48.7%~58.1%之间,可能是该类生物胺被净化粉末中PSA吸附,而不加入该粉末时,ODS C18粉末无法很好的去除水果类发酵酒中的一些酸性色素,净化效果较差。采用PRiME HLB固相萃取柱净化时,15种生物胺均未出现净化过程中被吸附的现象,回收率在75.6%~108.2%之间,能满发酵酒中生物胺检测的需求。因此,选择PRiME HLB柱净化法作为最优净化方法。
2.4 方法学考察
2.4.1 标准曲线线性范围、回归方程、相关系数、检出限及定量限
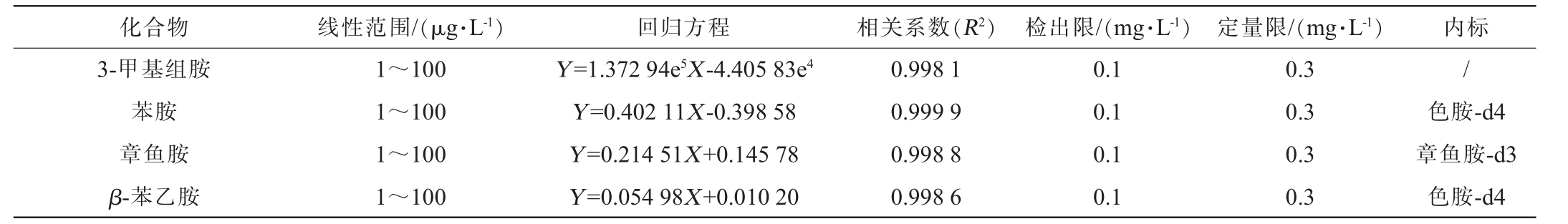
采用优化后的通过式固相萃取-UPLC-MS/MS检测生物胺标准系列溶液,各生物胺的线性范围、线性回归方程、相关系数、检出限及定量限见表2。由表2可知,15种生物胺均在质量浓度1~100 μg/L范围内线性关系良好,相关系数(R2)均>0.99,检出限和定量限均分别为0.1 mg/L和0.3 mg/L,远低于GB 5009.208—2016《食品安全国家标准食品中生物胺的测定》中LOD(2 mg/L或5 mg/L)和LOQ(5 mg/L或10 mg/L)要求,满足发酵酒中含量较低的生物胺的测定要求。
表2 15种生物胺的线性范围、回归方程、相关系数、检出限和定量限
Table 2 Linear range, regression equation, correlation coefficient, detection limit and quantification limit of 15 biogenic amines
化合物 线性范围/(μg·L-1)回归方程 相关系数(R2)检出限/(mg·L-1)定量限/(mg·L-1)内标3,3'-二氨基二丙胺腐胺精胺N-(4-氨基丁基)乙酰胺N1-乙酰精胺亚精胺尸胺三甲胺酪胺色胺组胺1~100 1~100 1~100 1~100 1~100 1~100 1~100 1~100 1~100 1~100 1~100 Y=1.415 71X-6.096 30 Y=11 064.893 00X+1.120 98e5 Y=0.828 71X-1.728 21 Y=0.165 99X+0.119 31 Y=1.830 80e5X-5.780 90e5 Y=27 954.90X-15 514.76 Y=0.199 12X+0.147 68 Y=0.130 27X+0.068 46 Y=1.178 54X-0.040 03 Y=0.169 30X-0.005 43 Y=0.123 97X+0.099 36 0.997 7 0.995 6 0.997 4 0.998 6 0.995 6 0.999 8 0.998 9 0.998 8 0.999 5 0.999 5 0.999 7 0.1 0.1 0.1 0.1 0.1 0.1 0.1 0.1 0.1 0.1 0.1 0.3 0.3 0.3 0.3 0.3 0.3 0.3 0.3 0.3 0.3 0.3尸胺-d4/尸胺-d4色胺-d4//尸胺-d4色胺-d4色胺-d4色胺-d4组胺-d4
续表
注:“/”表示采用外标法定量。
化合物 线性范围/(μg·L-1)回归方程 相关系数(R2)检出限/(mg·L-1)定量限/(mg·L-1)内标3-甲基组胺苯胺章鱼胺β-苯乙胺1~100 1~100 1~100 1~100 Y=1.372 94e5X-4.405 83e4 Y=0.402 11X-0.398 58 Y=0.214 51X+0.145 78 Y=0.054 98X+0.010 20 0.998 1 0.999 9 0.998 8 0.998 6 0.1 0.1 0.1 0.1 0.3 0.3 0.3 0.3/色胺-d4章鱼胺-d3色胺-d4
2.4.2 方法的加标回收率和精密度实验结果
方法的加标回收率和精密度实验结果RSD见表3。由表3可知,在不同的添加水平下,啤酒中15种生物胺的加标回收率为75.6%~109.5%,精密度实验结果的RSDs为0.7%~6.1%;黄酒中15种生物胺的加标回收率为77.2%~106.4%,精密度实验结果的RSDs为0.6%~5.5%;葡萄酒中15种生物胺的加标回收率为79.7%~104.3%,精密度实验结果的RSDs为0.4%~6.4%。综上,各生物胺的加标回收率均>75%,精密度实验结果的RSDs均<10%,满足发酵酒中15种生物胺的测定要求。
表3 3种基质中15种生物胺的加标回收率和精密度实验结果
Table 3 Standard recovery rates and precision test results for 15 bioamines in 3 substrates
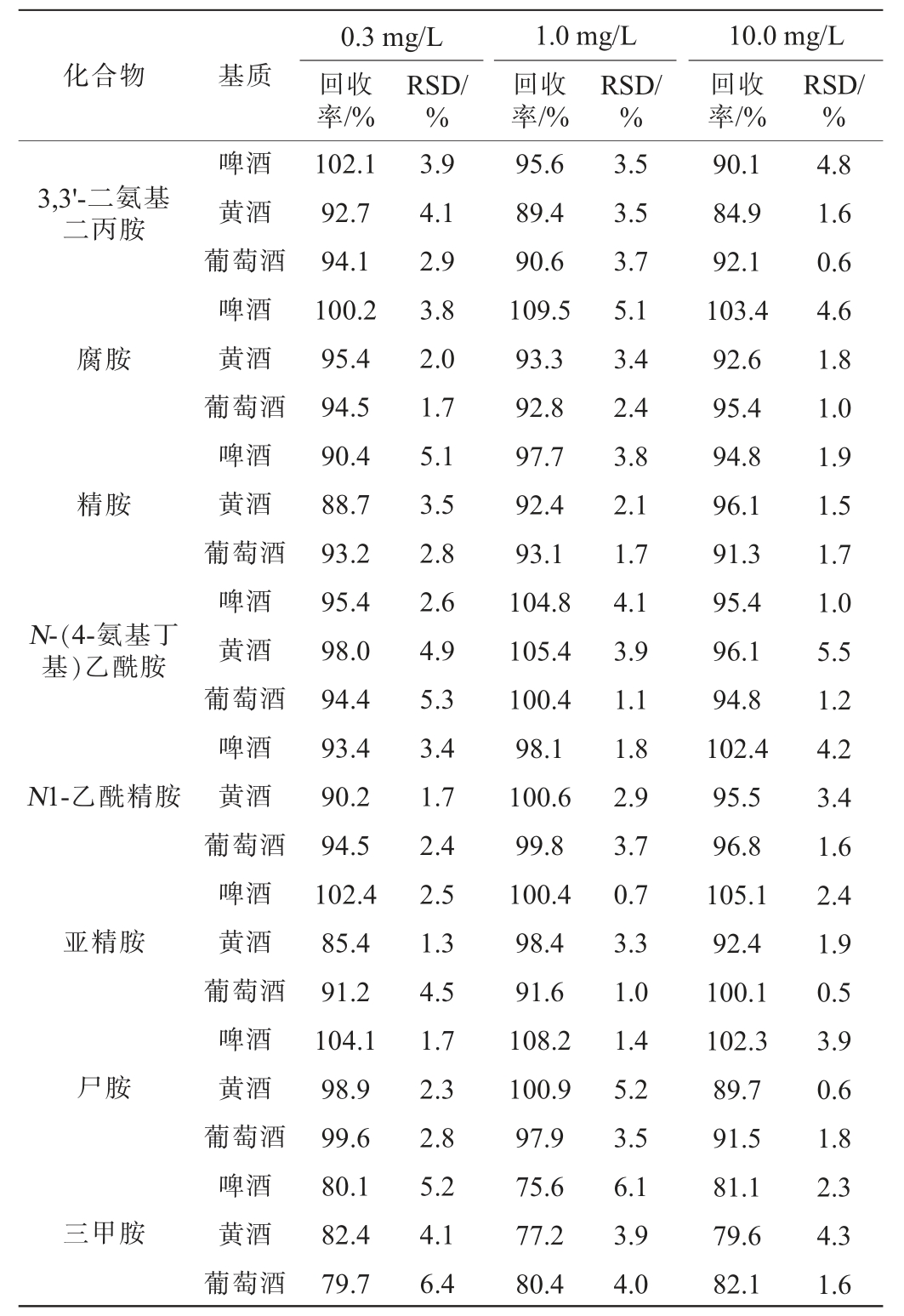
化合物 基质0.3 mg/L回收率/%RSD/%1.0 mg/L回收率/%RSD/%10.0 mg/L回收率/%RSD/%3,3'-二氨基二丙胺腐胺精胺N-(4-氨基丁基)乙酰胺N1-乙酰精胺亚精胺尸胺三甲胺啤酒黄酒葡萄酒啤酒黄酒葡萄酒啤酒黄酒葡萄酒啤酒黄酒葡萄酒啤酒黄酒葡萄酒啤酒黄酒葡萄酒啤酒黄酒葡萄酒啤酒黄酒葡萄酒102.1 92.7 94.1 100.2 95.4 94.5 90.4 88.7 93.2 95.4 98.0 94.4 93.4 90.2 94.5 102.4 85.4 91.2 104.1 98.9 99.6 80.1 82.4 79.7 3.9 4.1 2.9 3.8 2.0 1.7 5.1 3.5 2.8 2.6 4.9 5.3 3.4 1.7 2.4 2.5 1.3 4.5 1.7 2.3 2.8 5.2 4.1 6.4 95.6 89.4 90.6 109.5 93.3 92.8 97.7 92.4 93.1 104.8 105.4 100.4 98.1 100.6 99.8 100.4 98.4 91.6 108.2 100.9 97.9 75.6 77.2 80.4 3.5 3.5 3.7 5.1 3.4 2.4 3.8 2.1 1.7 4.1 3.9 1.1 1.8 2.9 3.7 0.7 3.3 1.0 1.4 5.2 3.5 6.1 3.9 4.0 90.1 84.9 92.1 103.4 92.6 95.4 94.8 96.1 91.3 95.4 96.1 94.8 102.4 95.5 96.8 105.1 92.4 100.1 102.3 89.7 91.5 81.1 79.6 82.1 4.8 1.6 0.6 4.6 1.8 1.0 1.9 1.5 1.7 1.0 5.5 1.2 4.2 3.4 1.6 2.4 1.9 0.5 3.9 0.6 1.8 2.3 4.3 1.6
续表
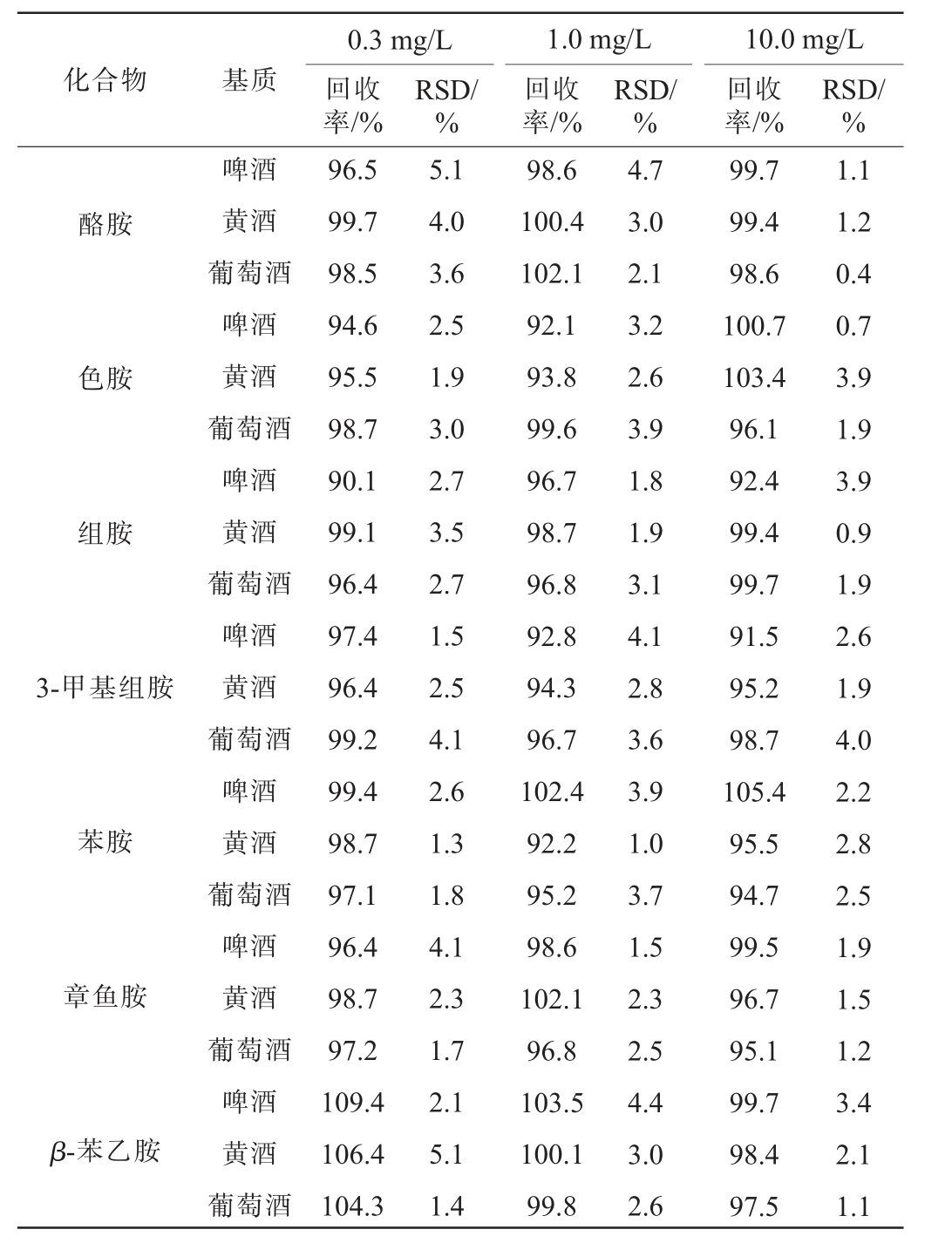
化合物 基质0.3 mg/L回收率/%RSD/%1.0 mg/L回收率/%RSD/%10.0 mg/L回收率/%RSD/%酪胺色胺组胺3-甲基组胺苯胺章鱼胺β-苯乙胺啤酒黄酒葡萄酒啤酒黄酒葡萄酒啤酒黄酒葡萄酒啤酒黄酒葡萄酒啤酒黄酒葡萄酒啤酒黄酒葡萄酒啤酒黄酒葡萄酒96.5 99.7 98.5 94.6 95.5 98.7 90.1 99.1 96.4 97.4 96.4 99.2 99.4 98.7 97.1 96.4 98.7 97.2 109.4 106.4 104.3 5.1 4.0 3.6 2.5 1.9 3.0 2.7 3.5 2.7 1.5 2.5 4.1 2.6 1.3 1.8 4.1 2.3 1.7 2.1 5.1 1.4 98.6 100.4 102.1 92.1 93.8 99.6 96.7 98.7 96.8 92.8 94.3 96.7 102.4 92.2 95.2 98.6 102.1 96.8 103.5 100.1 99.8 4.7 3.0 2.1 3.2 2.6 3.9 1.8 1.9 3.1 4.1 2.8 3.6 3.9 1.0 3.7 1.5 2.3 2.5 4.4 3.0 2.6 99.7 99.4 98.6 100.7 103.4 96.1 92.4 99.4 99.7 91.5 95.2 98.7 105.4 95.5 94.7 99.5 96.7 95.1 99.7 98.4 97.5 1.1 1.2 0.4 0.7 3.9 1.9 3.9 0.9 1.9 2.6 1.9 4.0 2.2 2.8 2.5 1.9 1.5 1.2 3.4 2.1 1.1
2.5 实际样品中15种生物胺的测定
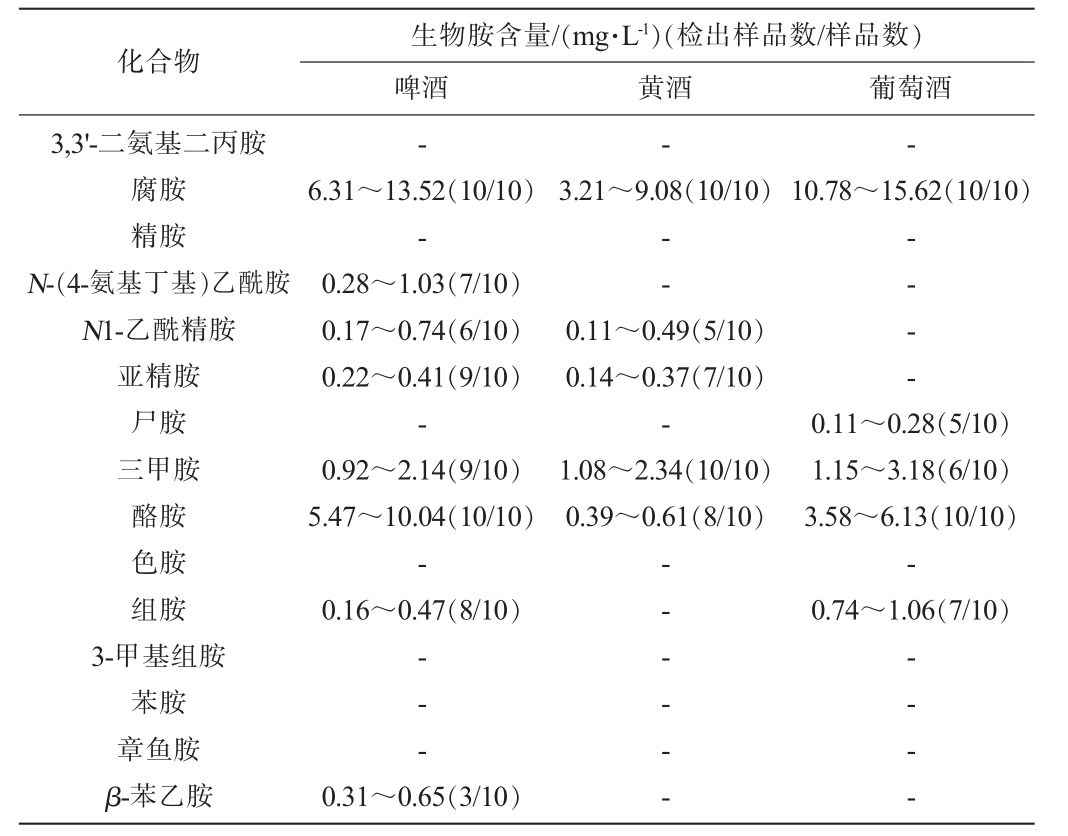
收集市售啤酒、黄酒、葡萄酒样品各10批次,使用本研究建立的通过式固相萃取-UPLC-MS/MS方法测定样品中的15种生物胺,结果见表4。由表4可知,从啤酒中共检出8种生物胺,其中腐胺、酪胺在10批次啤酒中均有检出,且含量较高,分别为6.31~13.52 mg/L和5.47~10.04 mg/L。从黄酒中检出腐胺、N1-乙酰精胺、亚精胺、三甲胺以及酪胺5种生物胺,其中腐胺、三甲胺的检出率为100%,含量分别为3.21~9.08 mg/L和1.08~2.34 mg/L。从葡萄酒中共检出5种生物胺,分别为腐胺、尸胺、三甲胺、酪胺以及组胺,其中腐胺、酪胺在10批次葡萄酒中均有存在,含量分别为10.78~15.62 mg/L和3.58~6.13 mg/L。综上,在3种发酵酒中均检出腐胺、三甲胺、酪胺,而未检出3,3'-二氨基二丙胺、精胺、色胺、3-甲基组胺、苯胺、章鱼胺6种生物胺。
表4 实际样品中15种生物胺的检测结果
Table 4 Detection results of 15 biological amines in actual samples
注:“-”表示未检出。
化合物生物胺含量/(mg·L-1)(检出样品数/样品数)啤酒 黄酒 葡萄酒3,3'-二氨基二丙胺腐胺精胺N-(4-氨基丁基)乙酰胺N1-乙酰精胺亚精胺尸胺三甲胺酪胺色胺组胺3-甲基组胺苯胺章鱼胺β-苯乙胺---6.31~13.52(10/10)-0.28~1.03(7/10)0.17~0.74(6/10)0.22~0.41(9/10)-0.92~2.14(9/10)5.47~10.04(10/10)-0.16~0.47(8/10)3.21~9.08(10/10)10.78~15.62(10/10)--0.11~0.49(5/10)0.14~0.37(7/10)-1.08~2.34(10/10)0.39~0.61(8/10)-- - -0.11~0.28(5/10)1.15~3.18(6/10)3.58~6.13(10/10)-0.74~1.06(7/10)-- -0.31~0.65(3/10)-- - - - --- - -
3 结论
本研究通过色谱条件的选择、基质效应分析、前处理方法比较,建立了无需衍生、可直接同时测定发酵酒中15种生物胺的通过式固相萃取-超高效液相色谱-串联质谱法,即样品加入同位素内标后经PRiME HLB柱净化,以0.1%甲酸乙腈-0.1%甲酸水为流动相,采用Waters ACQUITY UPLC®BEH C18色谱柱(100 mm×2.1 mm,1.7 μm)进行分离,通过多反应监测(MRM)模式采集数据。其中,腐胺、N1-乙酰精胺、亚精胺、3-甲基组胺4种生物胺无基质效应,采用外标法进行定量,其余11种生物胺采用内标法进行定量。方法学考察结果表明,15种生物胺均在1~100 μg/L的质量浓度范围内线性关系良好,相关系数R2均>0.99,检出限和定量限均分别为0.1 mg/L和0.3 mg/L;在3种发酵酒基质中添加3个不同质量浓度的生物胺(0.3 mg/L、1.0 mg/L、10.0 mg/L),平均加标回收率为75.6%~109.5%,精密度实验结果的相对标准偏差(RSDs)为0.4%~6.4%,说明该方法适用于发酵酒中15种生物胺的同时检测。采用该方法从黄酒、葡萄酒、啤酒实际样品中均检出腐胺、三甲胺、酪胺。该方法操作简单,分析时间更短、灵敏度更高,为发酵酒中生物胺的高通量检测提供新思路。
[1]杨姗姗,张凤艳,蒋万枫,等.发酵酒中生物胺的研究进展[J].中国酿造,2022,41(3):18-23.
[2]蔡琼,余文琴,李小琴,等.高效液相色谱-三重四极杆/复合线性离子阱质谱法同时测定液态发酵食品中14种生物胺及其代谢物[J].食品安全质量检测学报,2024,15(4):87-97.
[3]李丽萍,范赛,张楠,等.QuEChERS-超高效液相色谱-串联质谱法测定红酒中4种生物胺含量[J].食品安全质量检测学报,2021,12(12):4883-4888.
[4]ZHANG Y J, ZHANG Y, ZHOU Y, et al.A review of pretreatment and analytical methods of biogenic amines in food and biological samples since 2010[J].J Chromatogr A,2019,1605(8):360-361.
[5]刘景,任婧,孙克杰.食品中生物胺的安全性研究进展[J].食品科学,2013,34(5):322-326.
[6]LEE S,YOO M,SHIN D.The identification and quantification of biogenic amines in Korean turbid rice wine,Makgeolli by HPLC with mass spectrometry detection[J].LWT-Food Sci Technol,2015,62(1):350-356.
[7]FEDDERN V,MAZZUCO H,FONSECA F N,et al.A review on biogenic amines in food and feed:toxicological aspects,impact on health and control measures[J].Anim Prod Sci,2019,59(4):608-618.
[8]刘慕妆,任红,孙哲,等.黄酒生物胺的研究进展[J].中国酿造,2022 ,41(3):30-37.
[9]杨姗姗,张凤艳,蒋万枫,等.发酵酒中生物胺的研究进展[J].中国酿造,2022 ,41(3):18-23.
[10]张立飞,孙明浩,华成黎,等.发酵食品中生物胺的形成、检测及其防控策略的研究进展[J].食品与发酵工业,2023,49(3):329-339.
[11]张颖,张蕴,赵永纲.分散固相萃取-高效液相色谱-串联质谱法测定红酒中14种生物胺及其代谢产物[J].中国卫生检验杂志,2022,32(9):1025-1029.
[12]ZHU Z Y, SONG X Y, JIANG Y Z, et al.Determination of biogenic amines in wine from chinese markets using ion chromatography-tandem mass spectrometry[J].Foods,2023,12(11):2262.
[13]林瑶.超高效液相色谱-串联质谱法同时测定食品中5种生物胺的方法建立[J].预防医学论坛,2022,28(11):834-838.
[14]张永茂,唐会鑫,李朔,等.酱油和醋中8种生物胺的高效液相色谱串联质谱法测定法[J].职业与健康,2022,38(14):1898-1901.
[15]董孝元,冯小进,李斯琳,等.高效液相色谱法测定白酒中6种生物胺的含量[J].酿酒,2023,50(3):106-109.
[16]郭永辉,郭佩华,连雅林,等.超高效液相色谱紫外-柱前衍生法测定肉制品中的9种生物胺[J].食品安全质量检测学报,2021,12(20):7960-7968.
[17]田颖,张丽英,陈义强,等.高效液相色谱法同时测定动物源性饲料中9种生物胺[J].中国畜牧杂志,2023,59(9):337-342.
[18]杨静,王琨,周元.气相色谱-电子捕获检测器分析葡萄酒中8种生物胺[J].中国酿造,2023,42(2):228-234.
[19]KAMANKESH M,ABDORREZA M,KIANDOKHT G.Determination of biogenic amines in Lighvan cheese using a novel hollow-fibre electromembrane-microextraction coupled with gas chromatography-mass spectrometry[J].Int J Dairy Technol,2021,74(4):759-767.
[20]王芳,罗敏,陶文波,等.固相萃取-气相色谱法测定腌肉中5种生物胺[J].理化检验(化学分册),2018,54(5):512-515.
[21]宋卫得,许美玲,高尧华,等.离子色谱法同时测定果汁中20种有机胺、生物胺和阳离子[J].分析实验室,2020,39(5):590-595.
[22]邓浩,尹青春,谭高好,等.超高效液相色谱法(HPLC)测定猪肉种9种生物胺的含量[J].食品工业科技,2019,40(10):253-257.
[23]高何刚,林益炜,高源,等.非衍生化-PriME净化的超高效液相色谱-串联质谱法检测黄酒9种生物胺[J].预防医学,2024,36(1):86-88,90.
[24]魏泉增,汤雅,李伟民.液相色谱-串联质谱测定食醋中生物胺含量[J].中国酿造,2019,38(4):170-173.
[25]苏萌,艾连峰.液相色谱-串联质谱基质效应及其消除方法[J].食品安全质量检测学报,2014,5(2):511-515.
[26]冯媛媛,田冶,尹利辉.液质联用分析技术中的基质效应[J].中国新药杂志,2024,33(10):1009-1020.