虾青素(astaxanthin)化学名称为3,3'-二羟基-4,4'-二酮基-β,β-胡萝卜素,是一种非维生素A原的类胡萝卜素[1],具有较强的抗氧化、抗衰老、抗肿瘤、增强机体免疫力等多种生物学功能[2-3],因此被广泛应用于饲料、食品、保健品、化妆品和医药等领域[4-7]。目前虾青素的来源主要有三种途径:化学合成、甲壳动物废物提取及微生物发酵。其中化学合成法生产虾青素成本较高且产物主要为顺式结构,很难被人体吸收且存在潜在的安全隐患,因此利用该方法生产虾青素前景受到一定限制。通过甲壳动物废物提取途径获得虾青素则存在含量低、提取的虾青素中灰粉及几丁质等杂质含量高等问题[8-10]。相较于其他两种获得途径,利用微生物发酵法生产虾青素具有环境友好、生产周期短、生产的虾青素更加安全等优点,因此其应用前景更加广阔[11-13]。
自然界中产虾青素的微生物种类较多,其中红法夫酵母因为具有生长周期短、易实现高密度培养、能利用的碳源种类丰富、体内虾青素含量高等优点而被人们所关注[14-16]。根据文献报道,在适宜的条件下,红法夫酵母能在短时间内积累大量的类胡萝卜素,而其中的虾青素占到45%~90%[17]。虽然目前利用红法夫酵母生产虾青素方面的研究较多,技术方面也比较成熟,但实际上却并未能进行大规模推广应用,其中一个很重要的原因便是红法夫酵母的生长温度范围一般在4~27 ℃,超过28 ℃便难以生长,属于兼性嗜冷的低温型微生物[18-19],目前报道的绝大多数红法夫酵母的最适发酵温度均在20~22 ℃左右[20-21]。鉴于此,在利用大发酵罐进行大规模发酵生产虾青素的时候,往往需要消耗较多的能量和冷却水用于发酵醪液的冷却,尤其是在环境温度比较高的地域或季节需要的冷却成本更高。因此,选育出能够在高温条件下仍能正常生长且产虾青素的红法夫酵母菌种将对降低发酵成本具有重要意义。
为了解决此问题,目前有一些研究人员进行了耐高温红法夫酵母方面的研究。如MIAO L等[22]利用亚硝基胍和Co60复合诱变得到一株能够在25 ℃条件下高效发酵产虾青素的红法夫酵母突变菌株,虽然该突变菌株在一定程度上提高了其最适发酵温度,但与其他绝大多数普通微生物发酵相比,需要的冷却成本仍然偏高。龚玉姣等[23]利用紫外线和亚硝基胍协同诱变获得一株高产虾青素的红法夫酵母突变菌株,同时发现该菌株的最适发酵温度为28 ℃。虽然这些研究取得了一定的进展,但真正能用于工业化生产的耐高温红法夫酵母菌株鲜有报道。因此,获得更多的能够耐受更高温度的红法夫酵母菌种将是一个重要的研究方向。
诱变育种具有操作简单、效率高、周期短、成本低等优点,因此常被用于微生物菌种的改良。但单一的诱变方法容易产生饱和效应,影响诱变效果,将两种或多种诱变方法结合使用,产生的协同效应能极大地提高诱变效果[24-25]。鉴于此,本研究拟利用紫外线与甲基磺酸乙酯(ethyl methylsulfone,EMS)对实验室保存的野生型红法夫酵母进行复合诱变,并利用单因素和响应面法对突变菌株的发酵条件进行优化,以期获得能够耐受高温的红法夫酵母突变菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
红法夫酵母(Phaffia rhodozyma)AS2.1557:购买于广东省微生物菌种保藏中心,经实验室长期驯化改良,保藏于4 ℃冰箱。
1.1.2 化学试剂
葡萄糖、蛋白胨、酵母浸粉、麦芽浸粉、琼脂粉、盐酸、氢氧化钠、Na2S2O3(均为分析纯或生物试剂):北京奥博星生物技术有限公司;甲基磺酸乙酯、乙腈(均为分析纯):美国Sigma-Aldrich公司;甲醇(色谱纯):赛默飞世尔科技(中国)有限公司。
1.1.3 培养基
YM液体培养基:酵母浸粉3 g/L,麦芽浸粉3 g/L,葡萄糖10 g/L,蛋白胨5 g/L,pH自然。
摇瓶发酵培养基:酵母浸粉5 g/L,葡萄糖20 g/L,蛋白胨5 g/L,(NH4)2SO4 3 g/L,MgSO4·7H2O 0.5 g/L,KH2PO4 1.5 g/L,CaCl2·2H2O 0.1 g/L,pH 5.0。所有培养基灭菌条件均为115 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
LYZ-2102C恒温摇床:上海龙跃仪器设备有限公司;DNP-9272BS-Ⅲ恒温培养箱:哈尔滨东联电子技术开发有限公司;CL-32L高压灭菌器:日本ALP 公司;4-20R高速冷冻离心机:湖南恒诺仪器设备有限公司;CZX-9030MBE电热鼓风干燥箱:德国Eppendorf公司;MK3/MulTiskAn Sky GO酶标仪:赛默飞世尔科技(中国)有限公司;Agilent 1260 infinity II高效液相色谱仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 菌悬液的制备
将冻存的红法夫酵母菌种接种于YM固体培养基平板上,置于22 ℃条件下活化培养48 h。挑取已活化好的红法夫酵母接种至YM液体培养基中,置于22 ℃、200 r/min摇床中培养至对数生长期。取部分培养好的菌液在4 ℃、8 000 r/min条件下离心6 min,弃上清液收集菌体,然后加入无菌生理盐水充分振荡均匀后再次离心收集菌体,反复洗涤3次,最后将洗涤好的菌体细胞用无菌生理盐水充分振荡均匀制成菌悬液,并用血球计数板在显微镜下对酵母菌的细胞数进行测定,调整细胞浓度至108 CFU/mL左右。
1.3.2 紫外-EMS复合诱变
(1)紫外诱变:在诱变前,将紫外灯预热30 min,取10 mL制备的菌悬液加入直径9 cm的平皿中,在磁力搅拌下置于15 W的紫外线灯下30 cm处,分别照射0 s、30 s、60 s、90 s、120 s、150 s和180 s,以不经紫外线照射的菌悬液作为对照组。将照射后的菌悬液在黑暗条件下避光稳定10 min,然后以红光为保护光将菌悬液进行适当的梯度稀释后取60 μL分别涂布于固态YM培养基平板上。将平板置于22 ℃培养箱中避光培养4 d,记录菌落数并计算致死率。致死率计算公式如下:
(2)EMS诱变:取2 mL菌悬液置于10 mL无菌离心管中,加入2 mL EMS溶液(由0.1 mol/L磷酸缓冲液配制并经过0.22 μm滤膜过滤除菌),使EMS的体积分数分别达到0、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%,充分混合均匀,处理30 min,然后加入等体积的2%Na2S2O3终止反应。将诱变后的菌悬液进行适当的梯度稀释后涂布到YM固体培养基平板上,然后置于22 ℃培养箱中培养3 d,记录菌落数并根据(1)中方法计算致死率。
(3)紫外-EMS复合诱变:首先将制备好的菌悬液在最佳条件下进行紫外诱变,诱变完成后再在红光灯下取1 mL诱变后的菌液加到100 mL YM液体培养基中,用黑色的布包裹好避光,在22 ℃、200 r/min条件下摇床培养48 h。将培养好的菌液再次制备成菌悬液在最佳条件下进行EMS诱变,诱变完成后再在高温条件下进行突变菌株的筛选。
1.3.3 耐高温菌种的筛选
取复合诱变后的菌悬液稀释合适倍数后涂布于YM固体培养基平板上,分别置于35 ℃的条件下培养72 h,观察平板上红法夫酵母菌落的生长情况,挑选出生长快、菌落大、颜色鲜艳的菌落,在YM固体培养基平板上进行划线纯化并置于35 ℃条件下培养72 h,如此反复纯化3次后,将挑选出来的耐高温菌株在35 ℃、200 r/min条件下进行摇床发酵比较,根据生物量和虾青素产量挑选出性状最优良的耐高温突变株。
1.3.4 耐高温菌种遗传稳定性研究
将获得的耐高温突变菌株连续转接传代8次,每次转接传代后在35 ℃条件下进行摇瓶发酵,测定其生长情况及虾青素发酵情况,如无明显变化,则说明该突变菌株具有良好的遗传稳定性。
1.3.5 发酵条件优化
(1)发酵条件优化单因素试验
设置初始发酵条件为发酵温度35 ℃、接种量6%、初始pH为6.0、摇床转速200 r/min,发酵时间144 h。以此为基础,固定其他条件不变,依次改变发酵温度(29 ℃、32 ℃、35 ℃、38 ℃、41 ℃)、接种量(2%、4%、6%、8%、10%)、初始pH(5.0、5.5、6.0、6.5、7.0)、摇床转速(160 r/min、180 r/min、200 r/min、220 r/min、240 r/min)进行发酵。每次发酵完成后测定生物量和虾青素产量。
(2)发酵条件优化响应面试验
根据单因素试验结果,选取对生物量和虾青素产量影响较大的3个因素发酵温度(A)、接种量(B)、初始pH值(C)为自变量,以虾青素产量(Y)为响应值,采用Design Expert 12.0软件设计3因素3水平Box-Behnken试验,优化发酵条件并进行验证,Box-Behnken 试验设计因素与水平见表1。
表1 红法夫酵母发酵产虾青素条件优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments for fermentation conditions optimization of astaxanthin production by Phaffia rhodozyma

水平 A 发酵温度/℃ B 接种量/% C 初始pH值-1 0 1 30 32 34 4 6 8 4.5 5.5 6.5
1.3.6 分析检测
生物量的测定:取10 mL菌液在4 ℃、8 000 r/min条件下离心5 min,弃上清收集菌体,然后加入无菌水充分振荡均匀后再次离心并收集菌体,如此反复清洗3次,最后将获得的菌体于烘箱内105 ℃干燥至质量恒定,使用分析天平称质量并计算生物量。
虾青素产量测定:取5 mL发酵液在4 ℃、8 000 r/min条件下离心5 min,去上清收集菌体,用无菌水反复洗涤2次,加入5 mL 3 mol/L的盐酸溶液振荡均匀并浸泡30 min,接着沸水浴4 min并立即放入冰水迅速冷却,然后离心收集沉淀并用无菌水反复离心洗涤2次以去除盐酸。得到的沉淀中加入5 mL甲醇在避光条件下振荡提取1 min,离心取上清。若提取不完全,加入甲醇继续提取直至菌体呈无色,合并提取液。利用高效液相色谱法测定提取液中虾青素含量,色谱条件:紫外检测器;检测波长:478 nm;色谱柱:Agilent C18色谱柱(4.6 mm×250 mm,5 μm);流动相:甲醇和乙腈(体积比9∶1);流动相流速:1 mL/min;柱温:30 ℃。
1.3.7 数据处理与统计分析
采用Excel 2019对数据进行整理,用Origin 8.5对数据进行作图。每组试验重复3次,数据结果以平均值表示。
2 结果与分析
2.1 紫外诱变时间的确定
将菌悬液置于紫外灯下经过不同照射时间处理后,在红光保护下涂布于YM固体培养基平板上,然后在22 ℃条件下避光培养3 d,对生长出来的菌落进行计数并绘制致死率曲线,结果见图1。从图1可以看出,红法夫酵母的致死率与紫外诱变时间呈正相关,当诱变时间为120 s时,致死率为82.81%。一般认为,诱变育种时致死率在80%~90%时正突变率比较高[26],因此后续的诱变选择的紫外诱变时间为120 s。
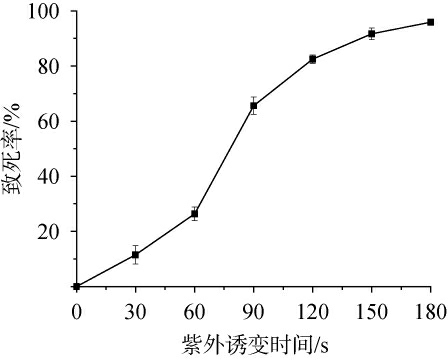
图1 紫外诱变时间对红法夫酵母菌体致死率的影响
Fig.1 Effect of ultraviolet mutagenesis time on the mortality rate of Phaffia rhodozyma
2.2 EMS体积分数的确定
分别向菌悬液中加入不同体积分数的EMS进行诱变处理,然后将处理后的菌悬液涂布于YM固体培养基平板上进行菌落计数并绘制致死率曲线,结果见图2。从图2可以看出,随着EMS体积分数的升高,红法夫酵母的致死率上升,当EMS的体积分数为2.0%时,红法夫酵母的致死率为86.16%,处于正突变率比较高的范围,因此后续的EMS体积分数选择为2.0%。
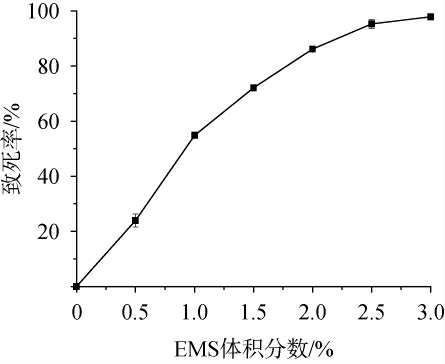
图2 甲基磺酸乙酯体积分数对红法夫酵母菌体致死率的影响
Fig.2 Effect of ethyl methylsulfonate volume fraction on the mortality rate of Phaffia rhodozyma
2.3 耐高温复合诱变突变菌株的筛选结果
在最优诱变条件下经过多轮次复合诱变后,共获得41株能够在35 ℃条件下快速生长、菌落较大且颜色艳丽的突变菌株。对这些分离出来的突变菌株划线纯化后在35 ℃温度条件下进行摇瓶发酵,测量各菌体的生物量及虾青素产量。经测定,编号为UE-09的突变株在35 ℃时发酵144 h后的菌体生物量为2.79 g/L、虾青素产量为1.65 mg/L,明显高于其他菌株,后续将对该株菌进行进一步研究。
2.4 突变菌株的遗传稳定性试验结果
对分离到的突变菌株UE-09进行连续传代8次,每传代一次后即在35 ℃条件下进行摇瓶发酵验证,测定其生物量和虾青素产量情况,结果见图3。从图3可以看出,突变菌株UE-09的在连续传代8次过程中菌体生物量和虾青素产量均没有出现明显变化,保持了较好的遗传稳定性。
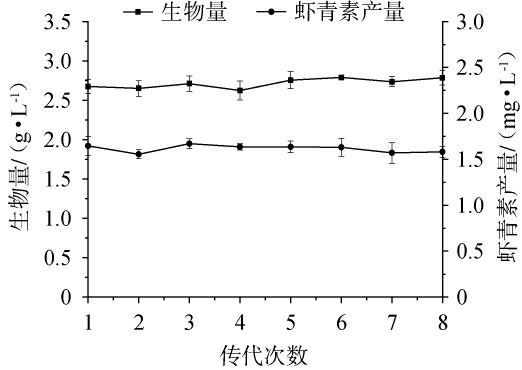
图3 红法夫酵母突变菌株UE-09的遗传稳定性试验结果
Fig.3 Genetic stability test results of the mutant strain UE-09 of Phaffia rhodozyma
2.5 突变菌株UE-9发酵条件优化
2.5.1 单因素试验结果
分别对突变菌株UE-9的发酵条件(发酵温度、接种量、初始pH及摇床转速)进行优化,结果见图4。
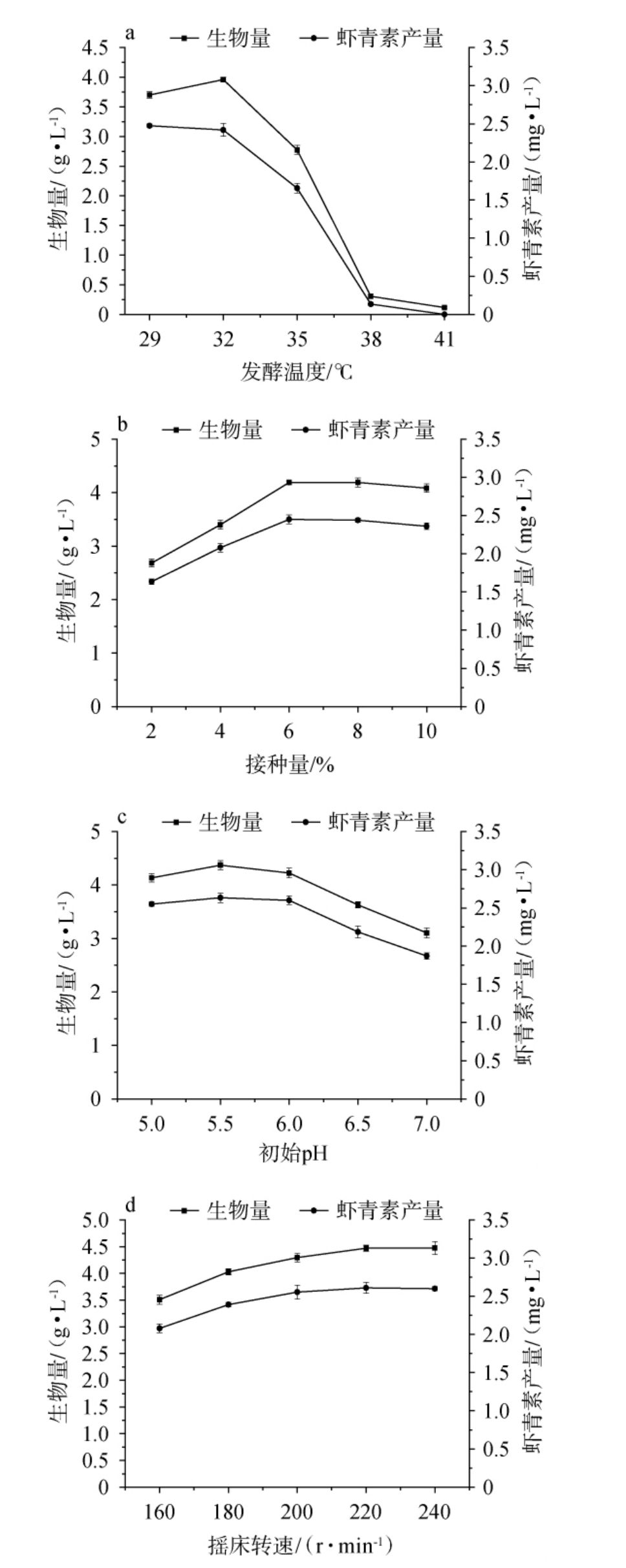
图4 不同发酵温度(a)、接种量(b)、初始pH(c)及摇床转速(d)对突变菌株UE-09产虾青素的影响
Fig.4 Effect of different fermentation temperature (a), inoculum (b),initial pH (c) and rotation speed (d) on astaxanthin production by mutant strain UE-09
由图4a可知,随发酵温度的升高,突变菌株UE-09的生物量及虾青素产量均呈先升高后降低的趋势,可能是在合适的发酵温度范围内,发酵温度越高突变菌株生长越快,但发酵温度越高,细胞内虾青素的产量反而下降。发酵温度为32 ℃时,突变菌株UE-09的生物量和虾青素产量均达到最高,分别为3.96 g/L和2.42 mg/L,发酵温度为35 ℃时突变菌株UE-09仍可生长;发酵温度为38 ℃时,该菌株基本停止生长。因此突变菌株UE-09产虾青素的最佳发酵温度为32 ℃。
由图4b可知,随着接种量的升高,突变菌株UE-09的生物量及虾青素产量均呈先升高后降低的趋势,可能是接种量太高,微生物增殖过快,消耗了大量的营养物质,因此导致虾青素产量略微下降。接种量为6%时,突变菌株UE-09的生物量和虾青素产量均达到最高,分别为4.19 g/L和2.45 mg/L。因此突变菌株UE-09产虾青素的最佳接种量为6%。
由图4c可知,随着培养基初始pH值的升高,突变菌株UE-09的生物量及虾青素产量均呈先升高后略降低的趋势,可能是初始pH值影响细胞膜的通透性,代谢物的解离及一些酶的活性等。初始pH值为5.5时,突变菌株UE-09的生物量和虾青素产量均达到最高,分别为4.37 g/L和2.64 mg/L。因此突变菌株UE-09产虾青素的最佳初始pH值为5.5。
由图4d可知,随着摇床转速的升高,突变菌株UE-09的生物量及虾青素产量均呈先升高后略降低的趋势,可能是虾青素具有较强的抗氧化性,因此增加发酵液中的溶氧可能会诱导产生更多的虾青素,但发酵液中的溶氧达到最大值后,摇床转速越大产生的机械力对细胞造成的伤害也越大。摇床转速为220 r/min时,突变菌株UE-09的生物量和虾青素产量均达到最高,分别为4.47 g/L和2.61 mg/L。因此突变菌株UE-09产虾青素的最佳摇床转速为220 r/min。
2.5.2 响应面试验结果与分析
根据单因素试验结果,选择对发酵产酶影响最显著的3个因素发酵温度(A)、接种量(B)、初始pH(C)作为自变量,以虾青素产量(Y)为响应值,运用Design Expert 12.0设计3因素3水平共17个试验点的Box-Behnken响应面分析试验。发酵条件优化Box-Behnken试验设计及结果见表2,回归模型方差分析见表3。
表2 红法夫酵母突变菌株UE-09发酵产虾青素条件优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments for fermentation conditions optimization of astaxanthin production by mutant strain UE-09 of Phaffia rhodozyma
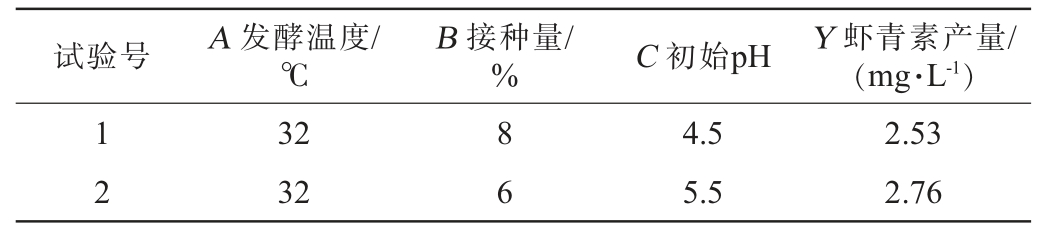
试验号 A 发酵温度/℃B 接种量/% C 初始pH Y 虾青素产量/(mg·L-1)1 2 32 32 8 6 4.5 5.5 2.53 2.76
续表
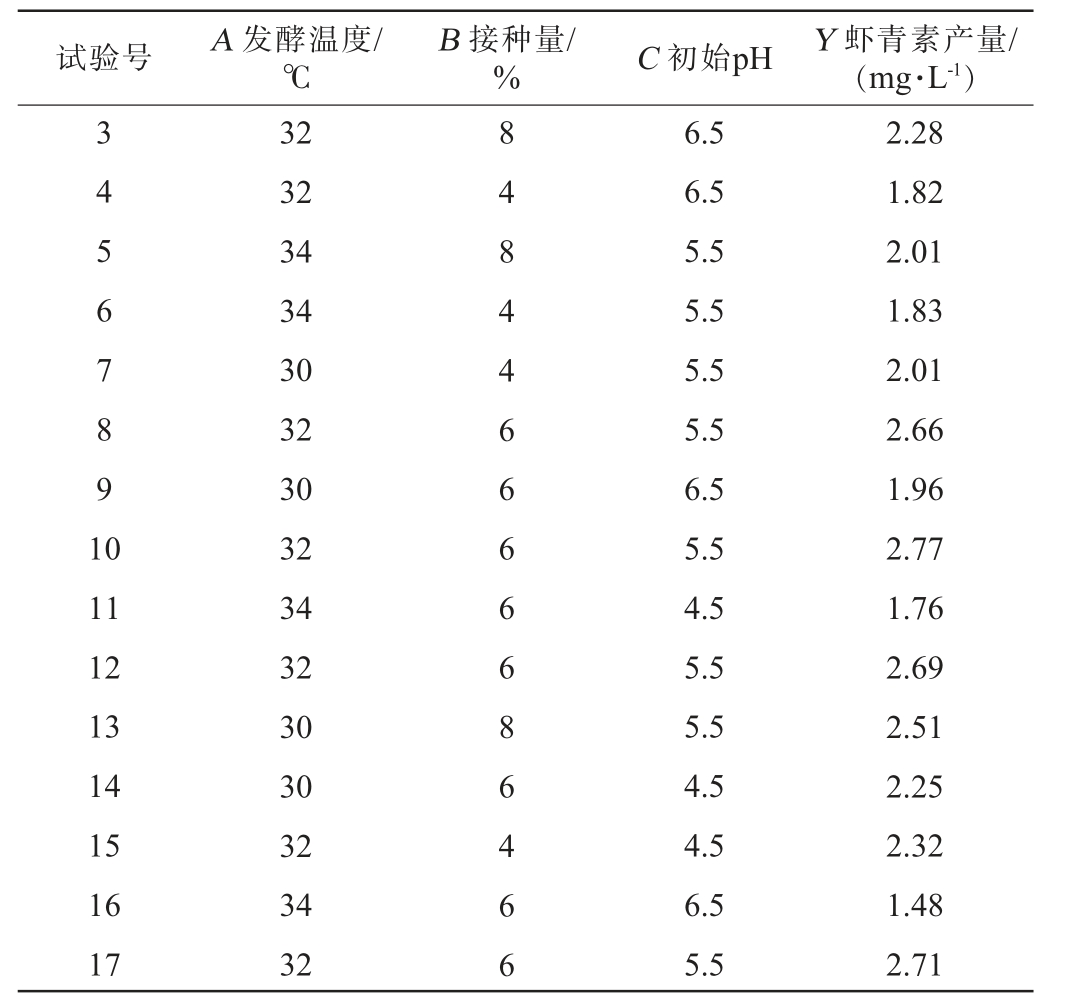
试验号 A 发酵温度/℃B 接种量/% C 初始pH Y 虾青素产量/(mg·L-1)3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 32 32 34 34 30 32 30 32 34 32 30 30 32 34 32 8 4 8 4 4 6 6 6 6 6 8 6 4 6 6 6.5 6.5 5.5 5.5 5.5 5.5 6.5 5.5 4.5 5.5 5.5 4.5 4.5 6.5 5.5 2.28 1.82 2.01 1.83 2.01 2.66 1.96 2.77 1.76 2.69 2.51 2.25 2.32 1.48 2.71
表3 回归模型方差分析
Table 3 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
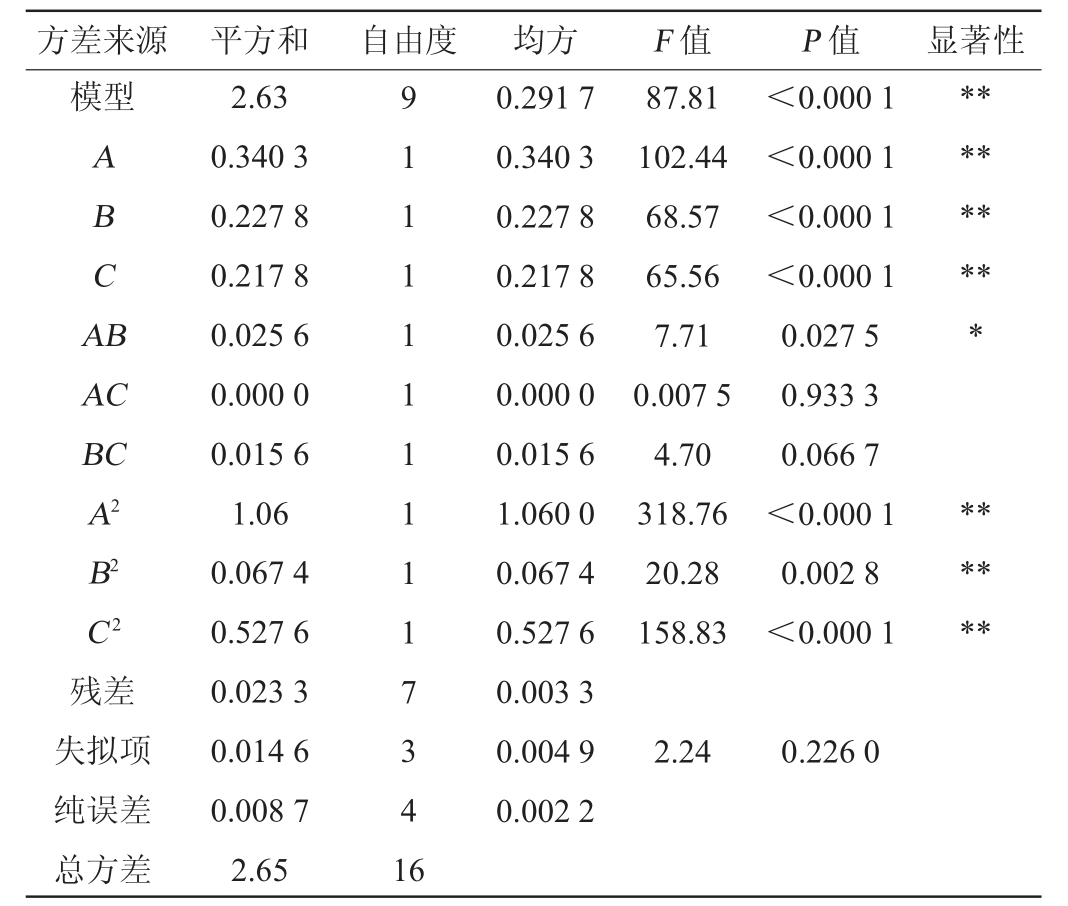
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型A B C A B*********AC BC A2 B2 C2残差失拟项纯误差总方差2.63 0.340 3 0.227 8 0.217 8 0.025 6 0.000 0 0.015 6 1.06 0.067 4 0.527 6 0.023 3 0.014 6 0.008 7 2.65 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 0.291 7 0.340 3 0.227 8 0.217 8 0.025 6 0.000 0 0.015 6 1.060 0 0.067 4 0.527 6 0.003 3 0.004 9 0.002 2 87.81 102.44 68.57 65.56 7.71 0.007 5 4.70 318.76 20.28 158.83<0.000 1<0.000 1<0.000 1<0.000 1 0.027 5 0.933 3 0.066 7<0.000 1 0.002 8<0.000 1******2.24 0.226 0
采用Design Expert 12.0软件对表3数据进行二次回归方程拟合,得到虾青素产量(Y)对发酵温度(A)、接种量(B)及初始pH(C)的多元二次回归方程:Y=2.72-0.31A+0.17B+0.17C-0.12AB+0.004AC+0.06BC-1.13A2-0.13B2-0.35C2。
由表3可知,模型的P<0.000 1,该模型极显著。失拟项P=0.226 0>0.05,不显著。由此可知,该二次回归方程拟合度良好,能较好地进行响应面预测。决定系数R2=0.991 2,说明有99.12%的响应值变化可以用模型来解释;调整决定系数R2adj=0.979 9,预测决定系数R2pre=0.906 8,差值<0.2,这表明拟合程度良好,可以采用此模型预测突变株的虾青素的产量。变异系数(coefficient of variation,CV)为2.56%,CV<10%,表明试验的可信度和精确度高,变异(偏离)程度较小。因此,该回归模型预测值与实测值有较好的拟合水平,适用于对红法夫酵母的虾青素发酵条件进行分析和预测。由F值可知,各因素对虾青素产量的影响显著性大小顺序依次为发酵温度(A)>接种量(B)>初始pH值(C)。
2.5.3 各因素交互作用响应曲面分析
发酵温度(A)、接种量(B)、初始pH(C)各因素交互作用对结果影响的响应面及等高线见图5。由图5可知,3个显著因素间交互作用的响应面曲线都呈现抛物线形态,且开口向下,表明存在有峰值。响应面坡度越陡,各种因素间的交互作用就越显著。结合方差分析可知,发酵温度(A)和接种量(B)交互作用对结果影响显著(P<0.05),发酵温度(A)和初始pH(C)、接种量(B)和初始pH(C)交互作用对结果影响不显著(P>0.05)。
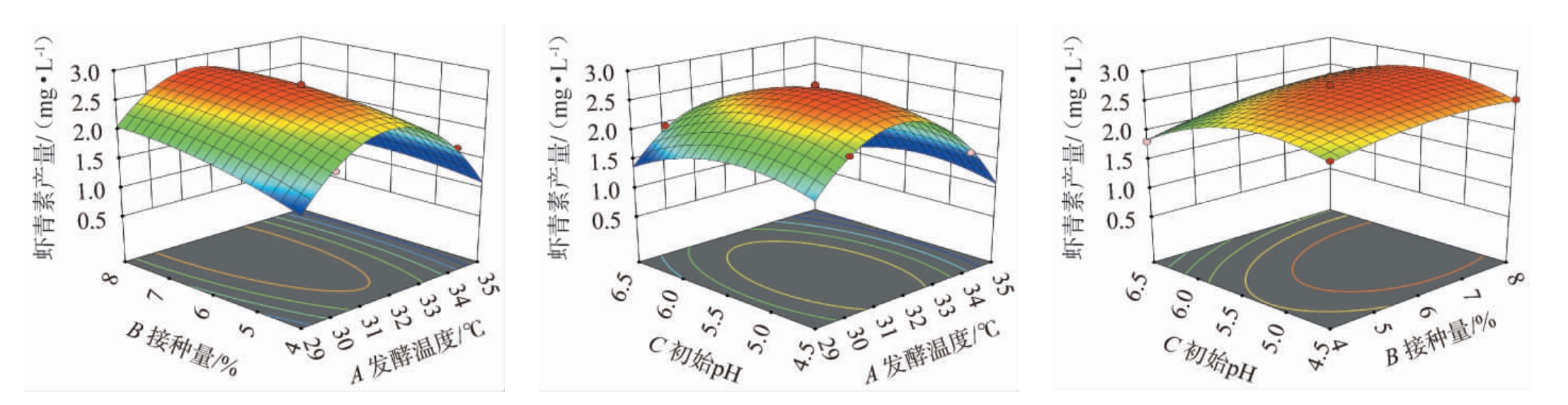
图5 各因素间交互作用对红法夫酵母突变菌株UE-09发酵产虾青素影响的响应曲面及等高线
Fig.5 Response surface plots and contour lines of effect of interaction between various factors on astaxanthin production by mutant strain UE-09 of Phaffia rhodozyma
2.5.4 验证试验
经Design-Expert 12.0软件分析,突变菌株ARUV3-26最优发酵条件为最佳初始pH5.495,发酵温度31.57 ℃,接种量为7.29%。在此最佳条件下虾青素产量的预测值为2.81 mg/L。为方便实际操作,调整最优发酵条件为初始pH 5.5、发酵温度32 ℃、接种量7.0%。在此优化条件下,进行3次平行验证试验,虾青素产量的实际值为2.74 mg/L,与预测值接近,比优化前提高了66.06%。表明该方程拟合性好,模型准确。验证结果与响应面试验预测结果基本一致,说明所构建模型能够较真实反映各因素对糖化酶活力的影响,优化条件方案可行。
3 结论
利用紫外线(UV)和甲基磺酸乙酯(EMS)对红法夫酵母(Phaffia rhodozyma)AS2.1557进行了多轮次复合诱变并结合高温胁迫进行突变株筛选,获得1株能够在35 ℃条件下正常生长且产虾青素的突变菌株UE-09。经过连续8次转接及发酵验证,证明该菌株具有良好的遗传稳定性。利用单因素及响应面法对突变菌株UE-09的发酵条件进行了优化,确定最佳发酵条件为发酵温度32 ℃,初始pH值为5.5,接种量7.0%,摇床转速220 r/min。在最佳条件下进行发酵,该突变菌株的虾青素产量最高达2.74 mg/L,与优化前相比提高了66.06%。后续研究将主要集中在如何进一步提高该突变菌株的虾青素产量及解决在扩大生产方面遇到的问题。
[1]MISAWA N, SATOMI Y, KONDO K, et al.Structure and functional analysis of a marine bacterial carotenoid biosynthesis gene cluster and astaxanthin biosynthetic pathway proposed at the gene level[J].J Bacteriol,1995,177(22):6575-6584.
[2]AHIRWAR A, MEIGNEN G, KHAN M J, et al.Light modulates transcriptomic dynamics upregulating astaxanthin accumulation in Haematococcus:A review[J].Bioresource Technol,2021,340(1):125707.
[3]NISHIDA Y,NAWAZ A,HECHT K,et al.Astaxanthin as a novel mitochondrial regulator:A new aspect of carotenoids,beyond antioxidants[J].Nutrients,2021,14(1):107.
[4]HUSSEIN G, SANKAWA U, GOTO H, et al.Astaxanthin, a carotenoid with potential in human health and nutrition[J].J Nat Prod,2006;69(3):443-449.
[5]KRINSKY N I, JOHNSON E J.Carotenoid actions and their relation to health and disease[J].Mol Asp Med,2005,26(6):459-516.
[6]PATIL A D,KASABE P J,DANDGE P B.Pharmaceutical and nutraceutical potential of natural bioactive pigment: astaxanthin[J].Nat Prod Bioprospect,2022,12(1):1-27.
[7]GRIMMIG B,DALY L,SUBBARAYAN M,et al.Astaxanthin is neuroprotective in an aged mouse model of Parkinson's disease[J].Oncotarget,2018,9(12):10388-10401.
[8]AMBATI R R,PHANG S M,RAVI S,et al.Astaxanthin:sources,extraction,stability,biological activities and its commercial applications-a review[J].Mar Drugs,2014,12(1):128-152.
[9]NUNES A N, RODA A, GOUVEIA L F, et al.Astaxanthin extraction from marine crustacean waste streams: an integrate approach between microwaves and supercritical fluids[J].ACS Sustain Chem Eng, 2021,9(8):3050-3059.
[10]MARTINS N,FERREIRA I C F R.Wastes and by-products: upcoming sources of carotenoids for biotechnological purposes and health-related applications[J].Trends Food Sci Technol,2017,62(1):33-48.
[11]ANEESH P A,AJEESHKUMAR K K,LEKSHMI R G K,et al.Bioactivities of astaxanthin from natural sources, augmenting its biomedical potential:A review[J].Trends Food Sci Technol,2022,125:81-90.
[12]DOMÍNGUEZ-BOCANEGRA A R, PONCE-NOYOLA T, TORRESMUÑOZ J A.Astaxanthin production by Phaffia rhodozyma and Haematococcus pluvialis: a comparative study[J].Appl Microbiol Biotechnol,2007,75(4):783-791.
[13]LUNA-FLORES C H, WANG A, VON HELLENS J, et al.Towards commercial levels of astaxanthin production in Phaffia rhodozyma[J].J Biotechnol,2022,350:42-54.
[14]NUTAKOR C, KANWUGU O N, KOVALEVA E G, et al.Enhancing astaxanthin yield in Phaffia rhodozyma:current trends and potential of phytohormones[J].Appl Microbiol Biotechnol,2022,106(9):3531-3538.
[15]SILVA P G P, JU′ NIOR D P, DE MEDEIROS BURKERT J F, et al.Carotenoid extraction from Phaffia rhodozyma biomass: downstream strategies and economic evaluation of energy[J].Braz J Chem Eng,2023,40(1):93-102.
[16]PALÁGYI Z,FERENCZY L,VÁGVÖLGYI C.Carbon-source assimilation pattern of the astaxanthin-producing yeast Phaffia rhodozyma[J].World J Microbiol Biotechnol,2001,17(1):95-97.
[17]CALO P, GONZÁLEZ T.The yeast Phaffia rhodozymaas an industrial source of astaxanthin[J].Microbiología,1995,11(3):386-388.
[18]裘娟萍,沈寅初.红发夫酵母的生物学特性[J].工业微生物,2001,31(3):6-8.
[19]JOHNSON E A.Phaffia rhodozyma:colorful odyssey[J].Int Microbiol,2003,6(3):169-174.
[20]STACHOWIAK B.Astaxanthin synthesis by Xanthophyllomyces dendrorhous DSM 5626 and its mutants on carrot extract medium under different illumination intensity[J].Appl Biochem Microbiol,2014,50:471-476.
[21]ZHANG J,LI Q R,LIU J H,et al.Astaxanthin overproduction and proteomic analysis of Phaffia rhodozyma under the oxidative stress induced by TiO2[J].Bioresource Technol,2020,311:123525.
[22]MIAO L L, WANG Y X, CHI S, et al.Reduction of fatty acid flux results in enhancement of astaxanthin synthesis in a mutant strain of Phaffia rhodozyma[J].J Ind Microbiol Biotechnol,2010,37(6):595-602.
[23]龚玉姣,屈平华,曹理想,等.协同诱变法选育虾青素高产优良酵母菌株[J].微生物学杂志,2010,30(1):16-20.
[24]涂媛,金显,蔡俊.复合诱变选育虾青素高产菌株及发酵条件优化[J].中国酿造,2023,42(5):91-96.
[25]周秋利,顾喆,龙凌凤,等.复合诱变野生酵母ZZ-46选育高产油脂菌株[J].食品与发酵工业,2020,46(21):16-22.
[26]诸葛健,李华钟,王正祥.微生物遗传育种学[M].北京:化学工业出版社,2016:79-89.