我国拥有广袤的水域资源与丰富的水产储备,但鱼类宰后品质劣变问题严重制约了其产业化发展。屠宰后的新鲜鱼肉肌肉在短期内会开始收缩,逐渐失去柔软性和弹性[1]。同时,鱼肉内含有丰富的酶系和菌系,导致新鲜鱼肉内的糖原、游离氨基酸和小分子肽等物质迅速溶出,为鱼肉中腐败微生物的生长繁殖营造了一个适宜的生长环境,造成新鲜鱼肉容易迅速腐败变质[2]。因此,对于延长新鲜鱼肉的食用周期和保藏时间的研究具有重要意义。
目前,鱼糜是一种常见的鱼肉加工方式,且获得了消费者的认可与喜爱。工业上一般直接采用低温冷冻的方式对鱼糜产品进行冷藏和储存,但是这样的加工方式会导致新鲜鱼糜中肌原纤维蛋白的正常功能结构受损,从而降低了鱼糜的凝胶特性和持水能力,造成鱼糜口感大幅度降低[3]。为了弥补这一缺陷,工业中通常通过向鱼糜中加入蔗糖和山梨醇等冷冻保护剂,以减缓新鲜鱼糜在储存过程中的冷冻变性的进程[4]。然而,常用的冷冻保护剂因甜度和热量双高的特性会影响鱼糜本身的风味口感,因此寻找合适的抗冻保护剂成为鱼糜制造加工行业研究热点。
黄水是浓香型白酒酿造过程中产生的副产物,内含丰富的有机组分,如多糖类、有机酸类、醇类、酯类、酚类和芳香族化合物类物质等[5-6]。如果对黄水直接排放会造成环境污染和资源浪费的问题,因此,对黄水中的生物资源以及非生物资源进行回收利用不仅迎合了当前节能减排以及环境保护的生态主题大局,又提高了工业上黄水的附加价值,为黄水资源的开发与利用提供了新思路[7-8]。浓香型白酒的黄水多糖被报道具有丰富的网状结构,优异的持水能力和益生菌的冷冻、冻干保护活性[7-8]。因此,本研究以黄水多糖为冷冻保护剂,探究其在冷冻过程中对鱼糜的表观形态以及肌原纤维蛋白(myofibrillar protein,MP)的保护作用,为黄水多糖的应用拓展以及鱼糜冷冻保护剂的开发提供理论指导基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
黄水:四川某浓香型白酒厂发酵窖池;新鲜鲈鱼:四川省成都市当地农贸市场。
1.1.2 试剂
Ca2+-腺苷三磷酸酶(adenosine triphosphatase,ATPase)活性检测试剂盒:上海生工生物工程股份有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶配制试剂盒:上海碧云天生物技术股份有限公司;Tris、HCl、NaCl及山梨醇等试剂(均为分析纯):成都市科隆化学品有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
DYY-6C型电泳仪电源:北京六一生物科技有限公司;JYS-M01型九阳磨粉机:九阳股份有限公司;CX33型光学显微镜:奥林巴斯(中国)有限公司;SLK-R3000-S型LED数显翘板摇床:上海科雅生物科技有限公司;JJ500型分析天平:常熟双杰测试仪器厂;D-500高剪切均质乳化机:维根技术(北京)有限公司;H1850R型台式高速冷冻离心机:湖南湘仪集团、RM2245型半自动轮转式切片机:德国Leica公司;CUT4062型手动石蜡切片机:德国SLEE医疗公司。
1.3 方法
1.3.1 黄水多糖的制备
参照WANG Z H等[7]的方法提取黄水多糖。
1.3.2 鱼糜样品的制备与冻存
新鲜的鲈鱼样品经去鳞、去内脏和清水洗干净后装入冰盒中,在20 min内运送至实验室。沿鲈鱼背部切开去皮,取背部肌肉的白肉部分,清洗后切成小块,沥干水分并用粉碎机绞成肉糜。取3份40 g鱼糜,分别加入20 mL 4%蔗糖和4%山梨醇混合溶液(阳性对照组)、20 mL超纯水(阴性对照组)以及20 mL 4%黄水多糖溶液(Huangshui polysaccharide,HSP实验组),置于-20 ℃冰箱中进行冷冻储藏,并分别在冻存2周、3周、4周及5周取样。
1.3.3 鱼糜样品肌原纤维蛋白的提取及分析
参照ZHENG Y等[9]的方法提取鱼糜肌原纤维蛋白。采用考马斯亮蓝法测定鱼糜肌原纤维蛋白浓度[10]。参考ZHENG Y等[11]的方法采用紫外可见光分光光度计对冻存2~5周的鱼糜肌原纤维蛋白进行紫外-可见光吸收光谱测定分析,记录MP溶液在波段230~320 nm的吸收峰强度。采用5,5'-二硫代双(2-硝基苯甲酸)(5,5'-dithiobis-(2-nitrobenzoic acid),DTNB)法对MP溶液的巯基含量进行测定[11]。采用SDS-PAGE凝胶电泳检测鱼糜冻存过程中肌原纤维蛋白质分子质量的变化。按照Ca2+-ATPase活性检测试剂盒的方法测定鱼糜样品中Ca2+-ATPase活性,酶活力单位定义:每小时每克鱼糜组织中Ca2+-ATPase分解1 μmol无机磷的量计算为一个酶活力单位,U/g。
1.3.4 鱼糜物理特性分析
(1)鱼糜持水能力的测定
通过测定冻存过程中各组鱼糜的解冻损失和离心损失来评估鱼糜的持水能力。通过测定解冻前后鱼糜的质量以计算解冻损失,通过测定离心(转速1 760×g)10 min前后鱼糜的质量以计算离心损失,其计算公式分别如下:
式中:M1为解冻前鱼糜的质量,g;M2为解冻后鱼糜的质量,g。
式中:M1为离心前鱼糜的质量,g;M2为离心后鱼糜的质量,g。
(2)鱼糜表面形态分析
将5 mg冻存4周后的鱼糜样品固定在扫描电镜载物台上,经喷金处理后,通过扫描电子显微镜对冻干后鱼糜样品的表面形态进行观察。
(3)鱼糜肌肉组织形态学分析
将冷冻后的鱼糜样品切成2 cm×1 cm×1 cm的块状,并在Carnoy溶液中固定24 h;样品经乙醇脱水后使用石蜡进行包埋切片,利用苏木精-伊红(hematoxylin-eosin,HE)染色法对切片进行染色,并用光学显微镜观察鱼糜肌肉组织的显微结构。
1.3.5 数据处理与统计学分析
每个试验重复3次,结果用“平均值±标准差”表示,采用SPSS 19.0软件的One-way ANOVA对数据进行统计学分析以及显著性检验,并采用Origin2021对试验数据进行作图。
2 结果与分析
2.1 鱼糜冻存过程中肌原纤维蛋白的变化
2.1.1 肌原纤维蛋白紫外-可见光吸收光谱分析
在鱼糜肌原纤维蛋白中,酪氨酸和色氨酸残基的苯环含有共轭双键,因而可以通过观察蛋白质溶液在波长280 nm左右的紫外吸收峰强度判定鱼糜肌原纤维蛋白的变性程度。新鲜鱼糜及冻存过程中鱼糜样品肌原纤维蛋白在波段230~320 nm的吸收峰强度见图1。由图1可知,新鲜鱼糜及冻存过程中的鱼糜样品肌原纤维蛋白均在波长300 nm左右处观察到吸收峰,表明检测到了苯丙氨酸、酪氨酸和色氨酸的苯环结构,导致吸收峰发生红移[12]。冻存过程中,鱼糜样品肌原纤维蛋白吸收峰的吸光度值逐渐降低,说明鱼糜样品的肌原纤维蛋白逐渐受到了冻害。冻存2周后,肌原纤维蛋白吸收峰的吸光度值大小按新鲜鱼糜样品、HSP实验组、阳性对照组和阴性对照组的顺序依次降低,其中,HSP实验组与新鲜鱼糜样品组间的吸光度值相近,且高于阳性对照和阴性对照组,表明黄水多糖在短期冷冻(2周)储藏条件下对鱼糜样品具有优异的冷冻保护活性。冻存3周后,HSP实验组吸收峰的吸光度值略高于阳性对照组,且明显高于阴性对照组,表明冻存3周条件下HSP实验组中鱼糜蛋白的变性程度低于阳性对照组,进一步说明黄水多糖对冻存鱼糜样品肌原纤维蛋白的保护作用仍高于4%蔗糖和4%山梨醇混合溶液。冻存4周后,HSP实验组和阳性对照组吸收峰的吸光度值相近,但二者均高于阴性对照组,且与冻存2周和3周的鱼糜样品相比吸光度值下降较少,表明HSP实验组和阳性对照组具有优异的冷冻保护活性。冻存5周后,HSP实验组吸收峰的吸光度值略低于阳性对照组,但仍高于阴性对照,说明黄水多糖对鱼糜具有优异的冷冻保护作用。综上,在冻存条件下,黄水多糖对鱼糜肌原纤维蛋白具有较好的保护效果,且在短期冻存(2~3周)条件下优于4%蔗糖和4%山梨醇混合溶液。
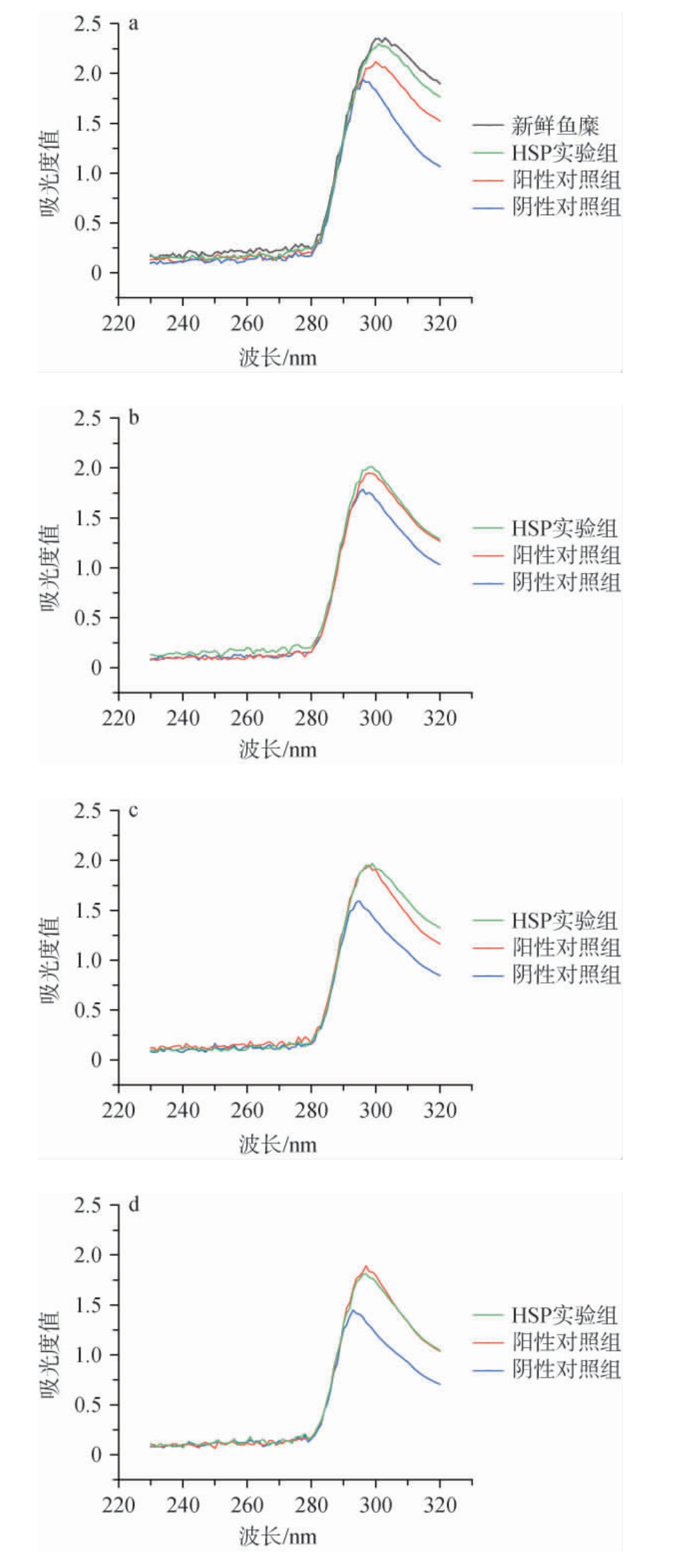
图1 鱼糜冻存过程中肌原纤维蛋白紫外吸收光谱的变化
Fig.1 Changes of ultraviolet absorption spectra of myofibrillar protein of surimi during cryopreservation period
a为新鲜鱼糜和冻存2周的鱼糜肌原纤维蛋白,b~d分别为冻存3周、4周、5周的鱼糜肌原纤维蛋白。
ZHENG Y等[11]通过紫外吸收光谱测定了新鲜鱼糜样品、经蔗糖和山梨醇处理的阳性对照组、金针菇多糖实验组和未经处理的阴性对照组鱼糜在波长280 nm处的吸光度值,结果发现,经金针菇多糖处理的鱼糜吸光度值大于阳性和阴性对照组,表明金针菇多糖对于冷冻鱼糜优异的保护活性;NIAN L Y等[13]利用紫外光谱检测红鲷(Pagrosomus major)鱼糜中不同芳香族氨基酸残基的变化,进而研究防冻蛋白对于鱼糜肌原纤维蛋白的保护作用,结果表明,防冻蛋白对鱼糜肌原纤维蛋白具有良好的保护效果。在本研究中,黄水多糖对鱼糜肌原纤维蛋白的保护效果优异,这与已报道的鱼糜冷冻保护剂具有相似的冷冻保护性能,说明了黄水多糖应用于鱼糜冷冻保护领域的可行性。
2.1.2 总巯基含量分析
在冷冻储存过程中,鱼糜肌原纤维蛋白的结构变化会使得蛋白质内部的巯基基团暴露在蛋白质表面,巯基被氧化为二硫基,并在蛋白质分子间形成二硫键,导致鱼糜蛋白中巯基含量下降[10]。因此,考察冻藏期间不同处理条件下鱼糜总巯基含量的变化趋势以评估鱼糜蛋白的变质情况,结果见图2。由图2可知,冻存鱼糜样品的总巯基含量均显著低于新鲜鱼糜样品(P<0.05),且在冻存过程中,各处理组鱼糜样品的总巯基含量均呈缓慢下降趋势,HSP实验组与阳性对照组总巯基含量无显著差异(P>0.05),且均显著高于阴性对照组(P<0.05)。在冻存5周时,阴性对照组、阳性对照组和HSP实验组的总巯基含量分别下降70.29%、32.26%和31.50%,表明阳性对照组与HSP实验组能在很大程度上通过抑制肌原纤维蛋白巯基的氧化,从而抑制鱼糜蛋白质的变性。在冻存2周时,各处理组总巯基含量均显著下降的原因可能是虽然在冻存初期鱼糜肌原纤维蛋白结构并未遭受严重破坏,但由于部分巯基位于蛋白质结构外侧,因而很快被氧化导致总巯基含量急剧下降[14-15]。ZHANG M等[16]研究发现,大豆低聚糖能够抑制鱼糜巯基含量降低的原因可能是由于多糖抑制了巯基的氧化或多糖支链中半乳糖的羟基与水结合形成氢键,抑制了冰晶的生长从而减小了对鱼糜肌原纤维蛋白的损失。
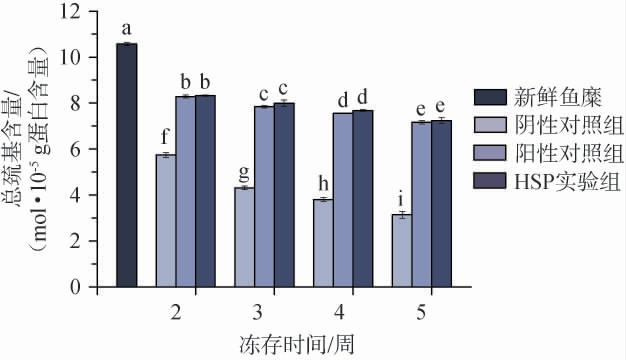
图2 鱼糜冻存过程中总巯基含量的变化
Fig.2 Changes of total sulfhydryl content of surimi during cryopreservation period
不同字母表示差异显著(P<0.05)。下同。
2.1.3 Ca2+-ATPase活性变化
Ca2+-ATPase广泛分布于鱼肉机体内的生物膜酶系统,对于维持机体正常的生理生化活动如物质运输、离子平衡及能量代谢等方面起着十分重要的作用[17]。在鱼肉冷冻储藏过程中,由低温引起的蛋白质三级结构的改变使得体系离子强度增加,从而导致Ca2+-ATPase活性降低[18]。因此,Ca2+-ATPase的活性可以作为反映外源性钙离子存在下肌动蛋白—肌球蛋白复合物完整性的重要参数,在一定程度上代表肌球蛋白的完整性,从而反映出鱼糜肌原纤维蛋白受冷冻变性程度;同时,Ca2+-ATPase活性的大小是影响鱼糜肌肉收缩张力和收缩速率的重要指标,从而可以作为判定鱼糜口感好坏的关键因素[15-17]。因此,对鱼糜冻存过程中的Ca2+-ATPase活性进行测定,结果见图3。由图3可知,冻存鱼糜样品的Ca2+-ATPase活性均显著低于新鲜鱼糜样品(P<0.05)。在冻存过程中,各处理组鱼糜样品的Ca2+-ATPase活性均呈下降趋势。在冻存2周时,阴性对照组、阳性对照组和HSP 实验组的Ca2+-ATPase 活性分别降低56.90%、50.29%和46.54%;在冻存3周和4周时,HSP实验组的Ca2+-ATPase活性均显著高于阳性对照组和阴性对照组(P<0.05);在冻存5周时,HSP实验组的Ca2+-ATPase活性略低于阳性对照组,但两者差异并不显著(P>0.05),但仍比阴性对照组高6.26%(P<0.05)。结果表明,在短期(2~4周)冻存过程中,黄水多糖对于鱼糜肌原纤维蛋白结构变性的保护能力优于4%蔗糖和4%山梨醇混合溶液,但随着冻存时间的延长,黄水多糖的保护能力逐渐降低。该结果再次印证了黄水多糖在鱼糜短期冻存中的优良保护作用。
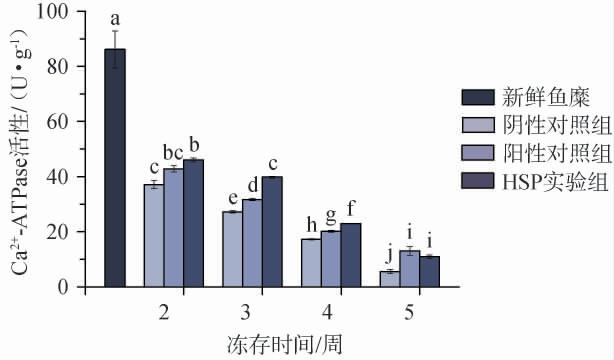
图3 鱼糜冻存过程中Ca2+-ATPase活性的变化
Fig.3 Changes of Ca2+-ATPase activity in surimi during cryopreservation period
GAO W H等[18]研究发现,鱼糜肌原纤维蛋白中Ca2+-ATPase活性降低的原因在于冰晶的形成和生长使得结合水与蛋白质的结合状态以及肌球蛋白头部构象发生变化;TAO L等[19]研究发现,γ-聚谷氨酸对于水分子的较强吸附能力增加了草鱼鱼糜的持水能力,从而降低了鱼糜组织中冷冻水的含量和体积,从而抑制了Ca2+-ATPase活性的降低。因此,推测黄水多糖对于鱼糜的冷冻保护作用的内在机理之一可能是通过提高鱼糜组织的持水能力,进而抑制了冰晶形成。
2.1.4 肌原纤维蛋白组成分析
为了进一步判定鱼糜蛋白的变性程度,利用SDS-PAGE分析鱼糜冻存过程中肌原纤维蛋白组成的变化,结果见图4。肌球蛋白重链、肌动蛋白和肌球蛋白轻链(分子质量分别约为220 kDa、45 kDa和<20 kDa)为鱼糜肌原纤维蛋白的主要组成部分[9],由图4可知,在冻存2周时,各组鱼糜肌原纤维蛋白条带与新鲜鱼糜相比无明显差异,但仍可以发现阴性对照组的肌球蛋白重链的含量略低于新鲜鱼糜样品、阳性对照和HSP实验组;HSP实验组高分子质量的蛋白含量与新鲜鱼糜样品相近,分析其原因可能是由于黄水多糖处理的鱼糜肌原纤维蛋白中小分子质量的蛋白质和多糖分子通过交联聚合形成了更高分子质量的聚合物和聚合体[9]。在冻存3周时,阴性对照组的重链肌球蛋白含量明显低于阳性对照组和HSP实验组,说明鱼糜蛋白经冷冻变性后片段化降解成了小分子质量的蛋白质。在冻存4周时,各处理组样品的肌原纤维蛋白含量较前两周均明显降低,同时发现仅阴性对照组和阳性对照组在42 kDa处有条带,而HSP实验组在55~200 kDa分子质量区间有多条蛋白条带,分析原因可能是由于肌球蛋白重链的降解形成的。冻存5周时,HSP实验组各蛋白含量均高于阴性对照和阳性对照。综上,结果表明,黄水多糖对于鱼糜肌原纤维蛋白冷冻变性具有优异的保护作用。
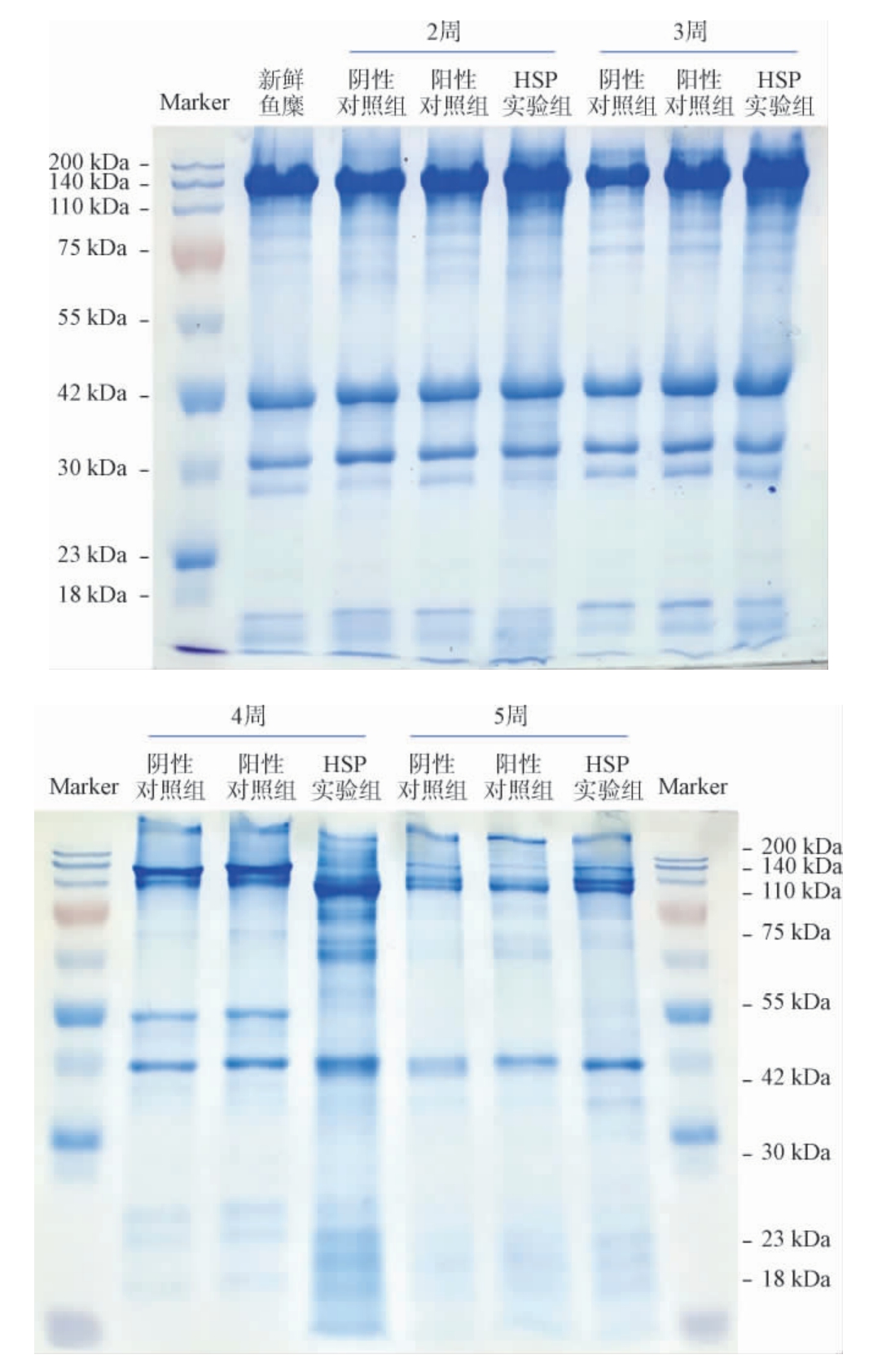
图4 鱼糜冻存过程中肌原纤维蛋白的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析结果
Fig.4 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis analysis results of myofibrillar protein of surimi during cryopreservation period
2.2 鱼糜冻存过程中物理特性变化分析
2.2.1 鱼糜持水能力分析
鱼糜的保水能力会直接影响肉的色泽、口感、嫩度和品质;鱼糜样品在冷冻储藏过程中,细胞外未冻结的水会逐渐形成冰晶,使得未冻结水中的溶质浓缩,伴随着压力的产生,肌肉纤维中的水会随之渗出,从而导致肌纤维和肌肉组织的损伤[20-21]。肌肉组织内形成的冰晶在解冻过程中会被动渗出水分,该过程即为解冻损失;鱼糜样品中松散的结合水则可以通过离心法去除,这些液体在解冻后不能重新被鱼糜制品所吸收;基于此,通过测定鱼糜的解冻损失和离心损失分析各组样品的持水能力[22]。通常样品的解冻损失和离心损失越低代表鱼糜的品质越好。冻存过程中各组鱼糜样品的持水能力见图5。
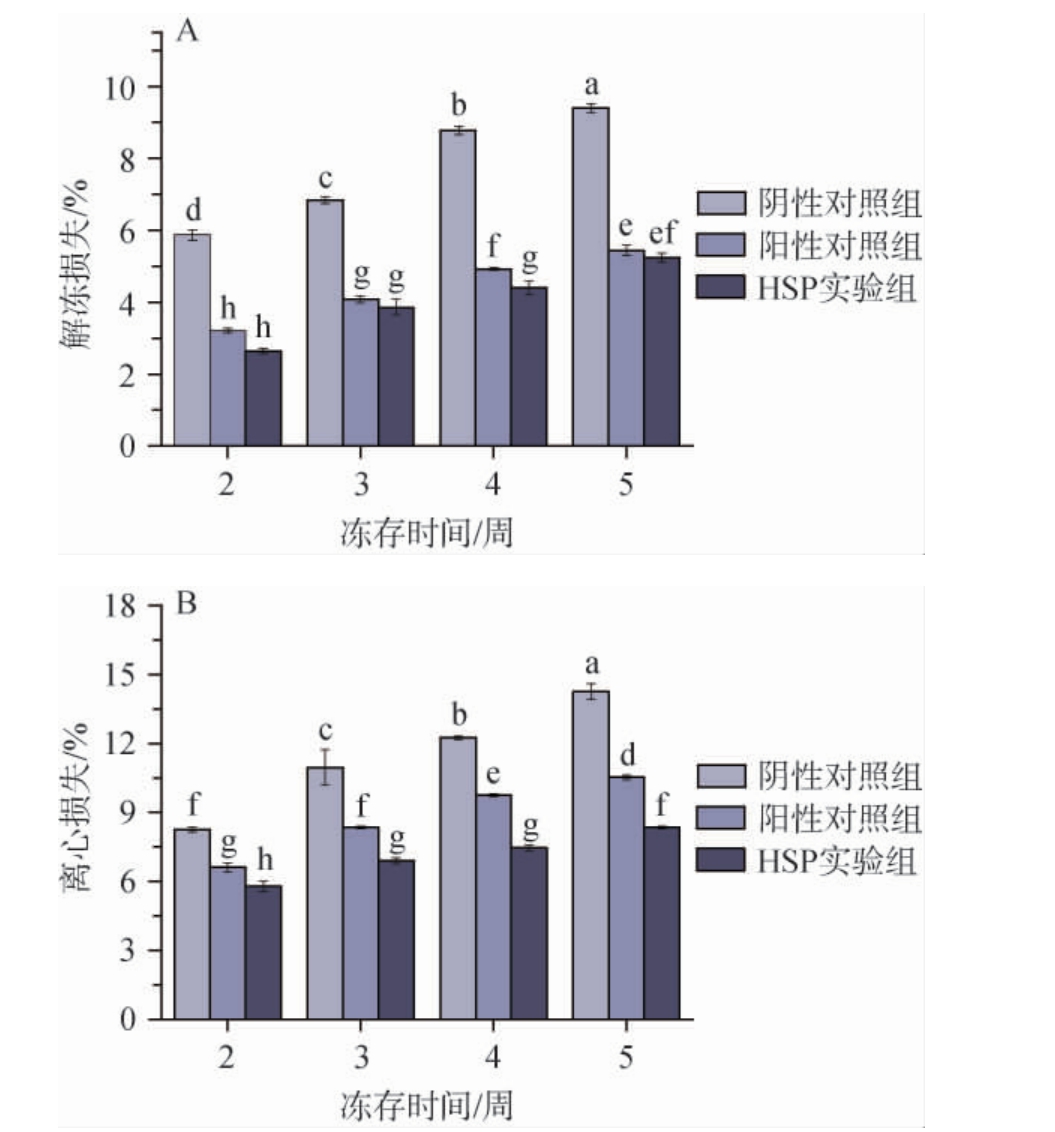
图5 冻存过程中鱼糜持水能力的变化
Fig.5 Changes in the water-holding capacity of surimi during cryopreservation period
由图5可知,随冻存时间的延长,各处理组鱼糜样品的解冻损失以及离心损失均不断提高,且阴性对照组的解冻损失和离心损失在冻存期间均显著高于阳性对照组和HSP实验组(P<0.05);而HSP组的解冻损失和离心损失均低于阳性对照组,表明黄水多糖对冷冻鱼糜持水能力的保护作用优于4%蔗糖和4%山梨醇混合液,分析其原因可能由于黄水多糖的网状结构和大量羟基形成的氢键使得黄水多糖在鱼糜中表现出优秀的持水能力[23]。同时,HSP实验组的鱼糜持水能力显著高于阴性对照组,这与鱼糜中Ca2+-ATPase活性变化趋势一致,进一步说明黄水多糖可以有效提高鱼糜的持水特性从而表现出优异的冷冻保护特性。
2.2.2 冷冻鱼糜表面形态观察
利用扫描电镜观察新鲜鱼糜及冻存4周时各组鱼糜样品的微观结构,结果见图6。由图6a可知,新鲜鱼糜的肌纤维间细致且紧密,无任何裂缝,鱼糜肌肉纤维组织结构完整。由图6b可知,阴性对照组鱼糜样品表观形态发生明显变化,肌纤维间的间隙明显增加,肌肉纤维遭到破坏,肌肉组织间存在较大裂缝和孔洞,排列不再有序紧致,导致肌肉结构劣质的原因可能是在冷冻和解冻过程中,鱼糜样品未受到保护导致大量体积较大且形状不规则的冰晶形成,从而使得鱼糜样品的细胞和纤维组织遭受破坏[24]。由图6c可知,阳性对照组鱼糜样品表观形态基本完整,与新鲜鱼糜样品相比有少量孔洞出现,表明鱼糜样品的形态基本完整,部分较小的孔洞可能是由于少量冰晶的形成。由图6d可知,HSP实验组鱼糜样品表观形态存在部分微小的裂缝,但总体形态完整,肌肉组织纤维间排列紧密且表面光滑,说明黄水多糖对于鱼糜冻藏的潜在利用价值。DU X等[24]同样通过扫描电镜研究了不同冻融循环次数及不同浓度冰结构蛋白处理条件下鲤鱼鱼糜的表观形态,结果表明,冰结构蛋白处理后的鲤鱼样品的微观结构被破坏程度明显小于对照组,肌肉纤维间几乎没有裂缝形成,分析这种现象的原因可能是由于冰结构蛋白的热滞后性所导致的,添加冰结构蛋白的样品组可以抑制冰晶的形成以及控制冰体积的膨胀,从而减少冻融对肌肉组织结构的损伤。CHENG S S等[25]通过对不同冻融条件下牛肉肌肉微观形态的观察也得到了类似的结果。本研究中冷冻后HSP实验组鱼糜样品表观形态与冰结构保护后的鱼糜样品的相似,进一步说明了黄水多糖可能通过抑制鱼糜中冰晶的形成从而减少了冷冻过程中低温对鱼糜肌肉组织的损伤,进而提高了鱼糜肌肉组织的完整性。

图6 不同处理条件下鱼糜样品表观形态观察结果
Fig.6 Observation results of the apparent morphology of surimi samples under different treatment conditions
a为新鲜鱼糜样品;b为阴性对照组(冻存4周);c为阳性对照组(冻存4周);d为HSP实验组(冻存4周)。
2.2.3 冷冻鱼糜肌肉组织形态观察
通过冷冻切片、HE染色和光学显微镜观察不同冻存时间和处理条件下各组鱼糜样品的肌肉组织形态,结果见图7,图中红色区域代表鱼糜的肌肉肌原纤维,而大片白色区域则代表在冻存过程中鱼糜肌肉组织中的冰晶通过膨胀挤压所形成的空间[26]。由图7a可知,新鲜鱼糜样品的组织学形态完整,其中肌肉肌原纤维排列紧密且均匀。由图7b可知,在冻存2周后,阴性对照组鱼糜样品中出现大片空白区域,表明在冻存过程中有大块冰晶形成,导致肌肉组织结构的完整性遭到破坏,而在阳性对照组和HSP实验组中,相较于新鲜鱼糜样品出现少量小区域白色部分,但两者的肌肉纤维组织排列总体完整且形态较为均匀。由图7c可知,在冻存3周后,阴性对照组鱼糜样品白色区域进一步增大,且形状不规则,表明未受冷冻保护的鱼糜样品肌肉纤维组织受冰晶膨胀挤压而遭到进一步破坏,阳性对照组和HSP实验组鱼糜样品HE染色切片无明显变化,说明两者对于鱼糜制品冷冻储藏良好的保护作用。由图7d可知,在冻存4周时,各组鱼糜样品均出现大块白色区域,表明此时鱼糜的形态和结构出现较为明显的改变,该结果与前文所测得的肌原纤维蛋白变性程度在第4周时出现明显变化结果一致。由图7e可知,在冻存5周时,阴性对照组鱼糜样品呈大面积白色区域,且鱼糜的肌肉纤维组织完全松散无序,红色的肌肉肌原纤维不再连接而是呈片段状出现,表明该条件下的鱼糜结构已遭到冰晶凝结膨胀挤压所导致的严重损坏,该鱼糜的组织形态已遭到严重破坏;而相比之下阳性对照组和HSP实验组鱼糜样品虽有少量大面积空白出现,但鱼糜的肌肉组织结构仍总体完整,纤维排列有序连接。综上,黄水多糖对于鱼糜冷冻储藏过程中肌肉组织形态和完整结构具有较好的保护作用。
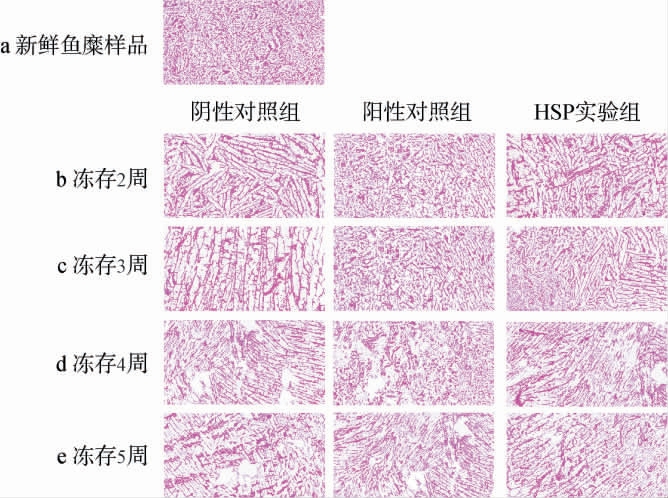
图7 冻存过程中鱼糜肌肉组织的HE染色切片观察结果
Fig.7 Observation results of HE staining sections of surimi muscle tissues during cryopreservation period
3 结论
本研究以超纯水处理为阴性对照、4%蔗糖和4%山梨醇混合溶液处理为阳性对照,采用黄水多糖作为冷冻保护剂对鲈鱼鱼糜样品进行处理(HSP实验组)后冻存5周,结果发现,在冻存期间,HSP实验组鱼糜肌原纤维蛋白在300 nm左右处的吸收峰强度明显高于阴性对照组,且在冻存3周前高于阳性对照;总巯基含量与Ca2+-ATPase活性均高于阴性对照和阳性对照,在冻存5周时分别比阴性对照高38.79%和6.26%。随着冻存时间的延长,HSP实验组中的肌球蛋白重链含量均有所降低,但始终高于阴性对照和阳性对照。此外,黄水多糖处理的鱼糜具有更高的持水能力,鱼糜表观形态及肌肉组织形态纤维组织结构完整,排列连接有序。综上,黄水多糖可以有效地减缓鱼糜肌原纤维蛋白的冷冻变性进程,同时提高鱼糜的持水能力、保持鱼糜表观形态以及肌肉组织结构完整性。
[1]杨宏旭,衣庆斌,刘承初.淡水养殖鱼类死后生化变化及其对鲜度质量的影响[J].上海水产大学学报,1995,4(1):1-9.
[2]ZHANG L T,LI Q,LYU J,et al.The impact of stunning methods on stress conditions and quality of silver carp(Hypophthalmichthys molitrix)fillets stored at 4 ℃during 72 h postmortem[J].Food Chem,2017,216:130-137.
[3]LAGO A M T, VIDAL A C C, SCHIASSI M C E V, et al.Influence of the addition of minced fish on the preparation of fish sausage:Effects on sensory properties[J].J Food Sci,2017,82(2):492-499.
[4]宋永,胡梦,刘程,等.镜鲤鱼糜抗冻剂的选择[J].黑龙江水产,2021,40(3):3-5.
[5]王子豪,黄平,郑佳,等.白酒酿造副产物黄水研究现状及综合利用研究进展[J].中国酿造,2023,42(4):20-28.
[6]郭双海.黄水的化学组分、微生物组成及综合利用研究进展[J].中国酿造,2023,42(7):25-29.
[7]WANG Z H, ZHANG M, HAO L Y, et al.Two novel polysaccharides from Huangshui: Purification, structure, and bioactivities[J].Int J Biol Macromol,2024,267:131396.
[8]KANG J M, SUN Y T, HUANG X N, et al.Unraveling the microbial compositions,metabolic functions,and antibacterial properties of Huangshui, a byproduct of Baijiu fermentation[J].Food Res Int, 2022, 157:111320.
[9]ZHENG Y,SHI Y Z,YANG X,et al.Flammulina velutipes polysaccharide improves the water-holding capacity in the dorsal muscle of freeze-thawed cultured large yellow croaker(Larimichthys crocea)[J].Food Chem,2023,403:134401.
[10]张霞.大豆低聚糖对淡水鱼糜的冷冻保护作用及其机制[D].长沙:中南林业大学,2023.
[11]ZHENG Y,ZHOU F,ZHANG L,et al.Effect of different extent of protein oxidation on the frozen storage stability of muscle protein in obscure pufferfish(Takifugu obscurus)[J].LWT-Food Sci Technol,2021,137:110416.
[12]ZHANG D,LI H J,EMARA A M,et al.Effect of in vitro oxidation on the water retention mechanism of myofibrillar proteins gel from pork muscles[J].Food Chem,2020,315:126226.
[13]NIAN L Y,CAO A L,CAI L Y,et al.Effect of vacuum impregnation of red sea bream(Pagrosomus major)with herring AFP combined with CS@Fe3O4 nanoparticles during freeze-thaw cycles[J].Food Chem,2019,291:139-148.
[14]黄海,曾名勇.鳙鱼肌肉胶原蛋白在低温贮藏中的变化[J].食品研究与开发,2009,30(12):21-25.
[15]张霞,张灵芝,张钰琦,等.刺云实胶对草鱼肌原纤维蛋白的冷冻保护作用[J].食品工业科技,2022,43(23):334-340.
[16]ZHANG M,CAI S L,MA J W.Evaluation of cardio-protective effect of soybean oligosaccharides[J].Gene,2015,555(2):329-334.
[17]HUO J Y,WU J H,HUANG M Q,et al.Structural characterization and immuno-stimulating activities of a novel polysaccharide from Huangshui,a byproduct of Chinese Baijiu[J].Food Res Int,2020,136:109493.
[18]GAO W H, HUANG Y P, ZENG X A, et al.Effect of soluble soybean polysaccharides on freeze-denaturation and structure of myofibrillar protein of bighead carp surimi with liquid nitrogen freezing[J].Int J Biol Macromol,2019,135:839-844.
[19]TAO L,TIAN L,ZHANG X S,et al.Effects of γ-polyglutamic acid on the physicochemical properties and microstructure of grass carp(Ctenopharyngodon idellus)surimi during frozen storage[J].LWT-Food Sci Technol,2020,134:109960.
[20]NAKAZAWA N, OKAZAKI E.Recent research on factors influencing the quality of frozen seafood[J].Fisheries Sci,2020,86(2):231-244.
[21]郭兵兵,胡澳,陈梦婷,等.魔芋葡甘聚糖对鱼糜抗冻机理和品质特性的研究进展[J].现代食品科技,2025,41(1):1-13.
[22]李旭海,杨丽凤,汪兰.基于可见光谱的淡水鱼肉持水性的预测研究[J].中国调味品,2023,48(10):55-59.
[23]SUN X Y, LI Q, DING N, et al.Cryoprotective effect of fistular onion stalk polysaccharide on frozen surimi derived from bighead carp: Physicochemical properties and gel quality during storage[J].Food Hydrocolloid,2024,148:109404.
[24]DU X,CHANG P,TIAN J Y,et al.Effect of ice structuring protein on the quality,thermal stability and oxidation of mirror carp(Cyprinus carpio L.)induced by freeze-thaw cycles[J].LWT-Food Sci Technol,2020,124:109140.
[25]CHENG S S, WANG X H, LI R R, et al.Influence of multiple freezethaw cycles on quality characteristics of beef semimembranous muscle:With emphasis on water status and distribution by LF-NMR and MRI[J].Meat Sci,2019,147:44-52.
[26]ÖNNEBY K,PIZZUL L,BJERKETORP J,et al.Effects of di-and polysaccharide formulations and storage conditions on survival of freeze-dried Sphingobium sp.[J].World J Microbiol Biotechnol, 2013, 29(8):1399-1408.