赛买提杏是新疆最重要的特色林果之一[1],因其位居首位的栽培面积和产量[2],近年来已先后被加工成多种多元化产品[3-6]。但赛买提杏果中富含营养物质和果胶[7],这为赛买提杏酒带来了潜在的甲醇超标风险。在传统生产工艺中,杏果酒常被报道甲醇含量偏高,接近或超过相关安全标准限值。甲醇作为一种有毒副产物,具有较强的毒害作用,其含量超标不仅影响酒体风味,更会引起中毒或死亡等不良危害,对人体健康构成严重威胁[8]。甲醇的生成主要源于原料果胶中甲酯化半乳糖醛酸残基在果胶甲酯酶(pectinesterase,PME)等酶作用下的脱甲氧基过程,生成的甲醇在发酵过程中释放并积累[9]。因此,对于果酒中甲醇的产生和控制应引起足够的重视。目前降低果酒甲醇的策略主要包括原料预处理(如热水烫漂、酶解)以降低果胶含量、筛选低产甲醇酵母菌株以及优化发酵工艺参数(如温度、pH)等[10-11]。其中,发酵温度作为关键工艺参数,因其对微生物活性和酶促反应速率具有显著调控作用,被认为是影响甲醇生成的关键因素。
研究表明,甲醇的生成主要源于原料果胶的酶解过程,果胶酶会分解原料中的果胶从而产生果胶酸和甲醇,其中果胶甲酯酶(PME)、多聚半乳糖醛酸酶(polygalacturonase,PG)和果胶裂解酶(pectate lyase,PL)是催化果胶降解为甲醇的三大关键酶[12]。在相同底物的条件下,酶活力能影响产物的生成量。这些酶的活力受发酵温度显著影响,但温度对其协同作用机制及动态调控规律仍不明确,成为制约甲醇精准控制的技术瓶颈。早期研究多聚焦于原料贮藏过程中酶的活性与温度相关性,李娇娇等[13]研究发现,低温可抑制桑葚采后贮藏过程中的PL和PG活力。传统研究多采用恒温发酵模式,忽视了温度动态变化对PME、PG、PL协同作用的影响。基于动态温度控制的绿色调控技术近年来成为关注热点。董文娟[14]通过梯度升温策略测定PME活力和葡萄酒甲醇含量,但其机制局限于PME活性变化,未涉及PG和PL的响应规律。因此,针对赛买提杏酒这一重要特色产品面临的甲醇超标安全隐患,通过系统探究PME、PG、PL的活力互作规律及其与甲醇生成的动态耦合机制,有利于为了开发基于3种果胶降解酶协同规律的低甲醇发酵控温工艺提供科学依据,突破现有杏果酒甲醇易过高的酿造问题,对开发精细化和低甲醇杏酒酿造工艺,提升赛买提杏深加工产品的品质和安全性,推动新疆特色林果产业高质量发展具有一定现实意义。
本研究聚焦温度对PME、PG、PL活力动态调控机制,隔天监测杏酒中酶活力、甲醇生成量与理化指标,解析温度对PME、PG、PL酶活力及果胶降解的影响,结合赛买提杏酒最终甲醇含量,研究产甲醇关键酶活性与甲醇生成量的相关性,保障酒体安全性,以期为酿酒工业提供低甲醇、高品质生产的绿色解决方案,为多酶系统动态优化提供新思路。
1 材料与方法
1.1 材料与试剂
赛买提杏:购于新疆乌鲁木齐市九鼎农贸市场。
Lallzyme HC果胶酶(10 000 U/mL):法国LALLEMAND公司;K1 活性干酵母:法国LALLVIN 公司;纤维素酶(700 U/mL):天津诺维信生物技术有限公司;咔唑(化学纯):国药集团化学试剂有限公司;无水乙醇、氯化钠、浓硫酸、盐酸(均为分析纯):天津市致远化学有限公司;氢氧化钠(分析纯):天津市光复科技发展有限公司;半乳糖醛酸(分析纯):北京索莱宝科技有限公司;果胶粉、溴麝香草酚蓝(均为分析纯):天津市化学试剂三厂;磷酸二氢钾(分析纯):天津福晨化学试剂厂;甲醇(色谱纯):Thermo Fisher公司。
1.2 仪器与设备
4K15C离心机:德国希格玛公司;TU-1810紫外分光光度计:北京普析通用仪器有限责任公司;DZKW-S-4水浴锅:北京市永光明医疗仪器有限公司;TP-A500电子天平:福州华志科学仪器有限公司;福斯WineScan葡萄酒全自动分析仪:福斯华(北京)科贸有限公司;5英寸双极酒膜过滤器:烟台帝伯仕自酿机有限公司。
1.3 方法
1.3.1 杏酒的制作工艺流程及操作要点
赛买提杏→预处理→酶解→接种K1酵母→发酵→过滤澄清→果酒成品
操作要点:
赛买提杏预处理:挑选转黄率>80%、硬度为(1.2±0.11)kg/cm2、可溶性固形物为(15±0.3)°Bx且无机械伤、无病虫害、重量平均的赛买提杏果实,清洗后对半切开,去核破碎压榨取清汁。
酶解:按照1∶1的比例添加0.02%纤维素酶和果胶酶,酶解24 h。
接种酵母:取发酵液体积0.2%的K1干酵母,加入少量杏汁中,按照酵母使用说明于37~40 ℃下活化30 min。
发酵:选用不锈钢发酵罐进行发酵,分别加入活化好的酵母,将发酵醪置于20 ℃恒温发酵至还原糖含量低于4 g/L为止,每个样品重复3次。
过滤:使用酒膜过滤机对果酒进行0.22 μm过滤,得到杏酒成品。
1.3.2 取样方法
在恒温发酵箱内进行杏酒发酵,控制整个发酵过程中的温度,参照黄蓓蓓[15]对杏酒发酵条件选择的方法,分为4个处理组,分别为:12 ℃、18 ℃、24 ℃、30 ℃。在发酵0 d进行第一次取样,之后在发酵1 d、3 d、5 d、7 d、9 d、11 d时分别取样,测定PME、PG、PL酶活性、甲醇含量及理化指标。
1.3.3 分析检测
(1)理化指标的测定
总酸含量、酒精度参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》[16]测定;可溶性固形物含量采用手持糖度计直接测定;苹果酸含量、乳酸含量、CO2释放量采用葡萄酒全自动分析仪测定。
(2)甲醇含量的测定
参照GB 5009.266—2016《食品安全国家标准食品中甲醇的测定》[17]进行测定。标准曲线绘制:于5支25 mL容量瓶中分别加入0.5 mL、1.0 mL、2.0 mL、4.0 mL、5.0 mL甲醇标准储备液,用40%乙醇溶液定容至刻度,此时甲醇质量浓度依次为100 mg/L、200 mg/L、400 mg/L、800 mg/L、1 000 mg/L,现配现用。
气相色谱条件:DB-WAX毛细管柱(50 m×0.32 mm,0.5 μm),程序升温:初始温度50 ℃,恒温1 min,以4.0 ℃/min升至130 ℃,在以20 ℃/min升至200 ℃,恒温5 min;以高纯氮气作为载气,载气压力为10 kPa,流速1.0 mL/min,选择分流进样,分流比为20∶1;进样体积为0.5 μL,检测器温度为250 ℃;进样口温度为250 ℃。以甲醇含量为横坐标、峰面积为纵坐标,得回归方程y=2 965.9x-40 306(R2=0.999 1),计算甲醇含量。
(3)PME酶活性的测定
参考LI M等[18]的方法测定PME酶活性,以每毫升酶液每分钟内释放l mmol CH3O-为l个PME酶活力单位,U/mL。PME酶活力计算公式如下:
式中:0.05为NaOH的摩尔浓度,mmol/mL;V1为消耗的NaOH体积,mL;V2为反应系统内加入酶液的体积,mL;t为酶促反应时间,min;1 000为换算系数。
(4)PL酶活性的测定
参考文献[19],通过比色法在波长235 nm下测定吸光度值计算酶活力,以每分钟催化生成1 μmol不饱和半乳糖醛酸产物所需的酶量定义为1个酶活力单位(U/L)。PL酶活力计算公式如下:
式中:A为样品在235 nm下吸光度值;A0为对照品在235 nm下吸光度值;V1为总体积,L;DF为稀释倍数;ε为不饱和产物摩尔消光系数,5 500 L/(mol·cm);d为比色皿光径(1 cm),cm;t 为酶促反应时间,min;V2为反应系统内加入酶液的体积,L。
(5)PG酶活性的测定
参考曹建康等[20]的3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定其酶活力[20]。以每分钟催化生成1 μmol半乳糖醛酸产物所需的酶量定义为1个酶活力单位(U/L)。计算公式如下:
式中:ΔC为样品与对照品标准曲线下浓度差值;Vt为反应终止前总体积,L;DF为稀释倍数;M为半乳糖醛酸分子质量194 g/mol;t为酶促反应时间,min;V为反应系统内加入酶液的体积,L。
1.3.4 数据处理
采用IBM SPSS Statistics 26和DPS数据处理系统进行数据分析,用OriginPro 2021绘图,文中所有数据分析均使用重复3次后获得的平均值。
2 结果与分析
2.1 不同温度处理对PME酶活力的影响
PME果胶酶能和水解果胶中甲酯化的羧基,利用甲酯化的糖醛酸残基催化生成高半乳糖醛酸,为PG果胶酶提供反应底物,生成甲醇和果胶酸[21]。因此,PME酶的活力高低直接影响甲醇的生成量。4种温度下赛买提杏果酒发酵过程中PME酶活性的变化见图1。
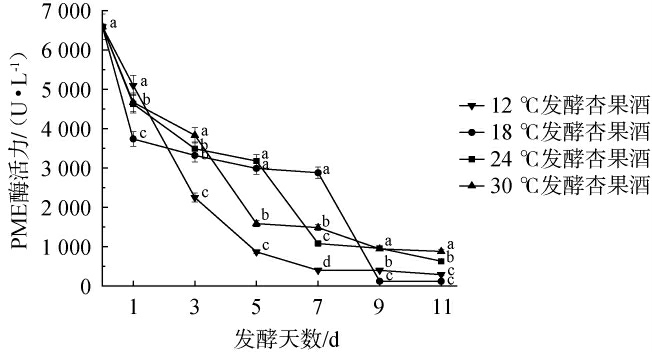
图1 不同温度处理对杏酒发酵过程中果胶甲酯酶活力的影响
Fig.1 Effect of different temperature treatments on pectinesterase activity during apricot wine fermentation
不同字母代表在同一时期不同样品酒之间差异显著(P<0.05)。下同。
由图1可知,整个发酵过程中,所有组的PME果胶酶活性均呈下降趋势。在发酵7~9 d时,18 ℃处理组的PME果胶酶活性大幅下降。发酵结束后,各组赛买提杏果酒(按发酵温度从低至高排序)PME果胶酶活性分别为290 U/L、120 U/L、630 U/L、880 U/L,降幅为95.59%、98.17%、90.44%和86.64%,其中12 ℃和18 ℃处理组PME果胶酶活性较其他处理显著性降低(P<0.05),这可能是由于低温显著抑制PME构象灵活性,导致酶与底物结合效率下降(活化能不足)[22]。经过11 d发酵,30 ℃处理组PME酶活力持续保持较高活力水平,发酵环境温度越高,酶活力越高,这与刘涛等[23-24]研究结果一致。因此,低温发酵(12~18 ℃)可以显著抑制PME果胶酶活性,通过降低酶-底物结合效率减缓果胶分解,从而达到降低甲醇含量的预期效果。
2.2 不同温度处理对PL酶活力的影响
PL果胶酶只对甲酯基旁边的α-1,4糖苷键具有专一酶解效果,使酯化的多聚半乳糖醛酸5号位上的β-C原子转移形成双键,释放酚类、黄酮类、花色苷等风味物质,使酒体色泽和香气更加饱满[25]。4种温度处理对赛买提杏酒PL酶活力的影响见图2。
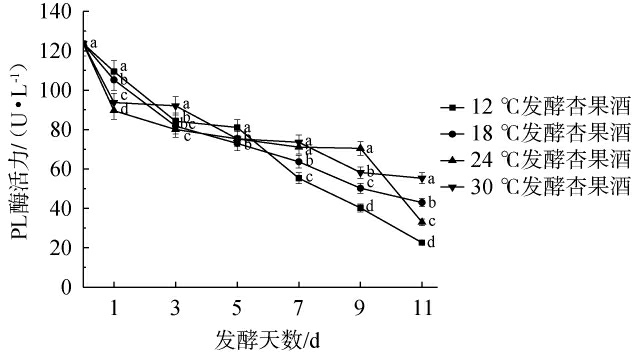
图2 不同温度处理对杏酒发酵过程中多聚半乳糖醛酸酶活力的影响
Fig.2 Effect of different temperature treatments on polygalacturonidase activity during apricot wine fermentation
由图2可知,4个不同温度处理组的赛买提杏果酒PL酶活力随发酵进程的推进均呈下降趋势,底物的减少和产物的积累导致竞争性抑制或反馈调节,导致酶活力降低。同时,发酵环境温度越高,PL酶活力越大。经11 d发酵后,12 ℃处理组中杏酒的PL酶活力最低,为22.58 U/L;30 ℃处理组中的PL酶活力最高,为55.30 U/L。造成这一现象的原因可能是30 ℃条件下发酵醪液中的PME酶活力较高,为PL酶提供了较多的反应底物,使PL酶保持在较好的活力状态;也可能是温度升高增强催化效率,提升酶分子构象柔韧性,加速果胶与活性中心的结合[26];而12 ℃下果胶降解以水解路径为主,产物以半乳糖醛酸为主,PME活性同步受低温抑制,底物提供较少,导致酶活力下降较快。实验结果与陆玲鸿等[27]的结果相似,经11 d发酵,12 ℃条件处理因底物匮乏及水解路径导致PL酶活力最低,而高温发酵(30 ℃)可显著提升PL酶活力。
2.3 不同温度处理对PG酶活力的影响
PG酶作用在酯化的多聚半乳糖醛酸残基间的α-1,4-糖苷键上,具有酶解效果,可以脱去果胶中的甲氧基引发果胶水解[28]。不同温度处理对赛买提杏酒PG酶活力的影响见图3。
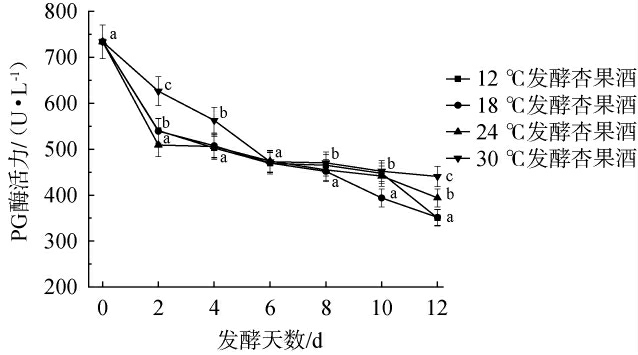
图3 不同温度处理对杏酒发酵过程中果胶裂解酶活力的影响
Fig.3 Effect of different temperature treatments on pectin lyase activity during apricot wine fermentation
由图3可知,随着发酵进程的推进,时间对酶活力产生负向影响,PG果胶酶活力逐渐降低,主要是PG持续水解果胶导致底物多聚半乳糖醛酸减少,同半乳糖醛酸单体积累可能通过反馈抑制降低PG酶活力。但发酵温度对PG酶活力具有正向调控,发酵温度越高,酶分子热运动越强,促进底物多聚半乳糖醛酸与活性中心的结合效率。从实验结果可知,发酵第11天时,12 ℃和18 ℃处理组酒样中的PG果胶酶活力较低,分别为351.84 U/L和350.59 U/L,酶活力较第0天分别下降了52.05%和52.22%;30 ℃处理组酶活力最高,为440.73 U/L,同比其他发酵条件PG果胶酶活力更活跃5.15%~12.28%。PG虽不直接催化甲醇生成,但其水解果胶产生的低酯化度果胶片段,结合图1分析可知,PG酶水解果胶产生的低酯化度果胶片段可能成为了PME的底物,间接促进后续甲醇生成。该结果与周姝颖等[29]的结论相一致。综上可知,高温发酵(30 ℃)显著维持PG酶高活力,其催化生成的低酯化度果胶片段间接驱动甲醇生成,并且时间进程与底物衰减共同导致酶活下降。
2.4 不同温度处理对赛买提杏酒甲醇含量和酒精度的影响
甲醇作为一种有毒副产物,其含量需要进行严格的控制。赛买提杏酒发酵醪液中的果胶会经过PME酶、PG酶和PL酶水解后产生甲醇。不同温度处理对赛买提杏酒甲醇含量和酒精度的影响见图4。
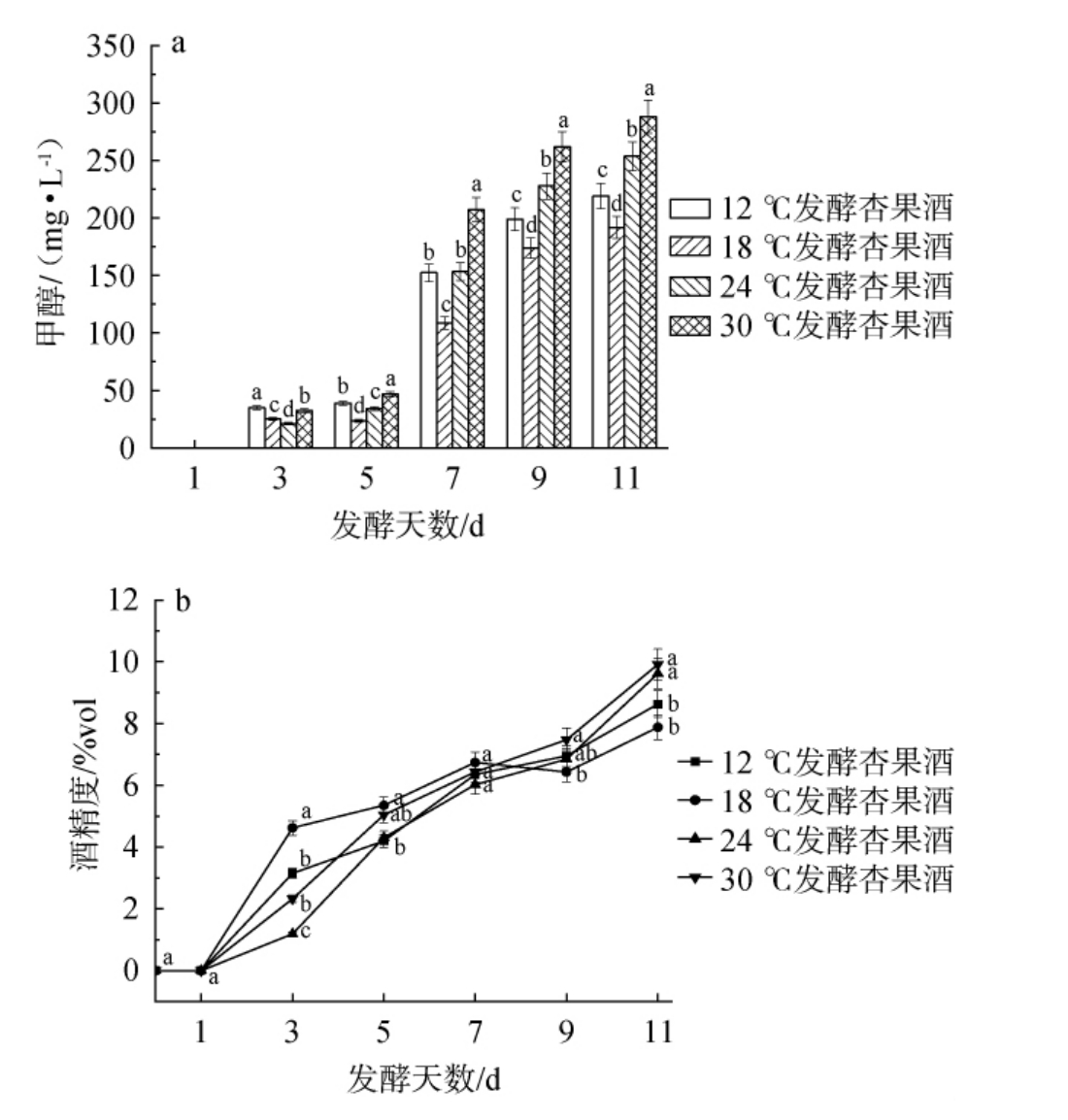
图4 不同温度处理对杏酒发酵过程中甲醇含量(a)和酒精度(b)的影响
Fig.4 Effect of different temperature treatments on methanol content(a) and alcohol content (b) of apricot wine during fermentation
由图4a可知,随着发酵时间的延长,不同发酵温度下赛买提杏酒甲醇含量均呈上升趋势。发酵结束后,4个温度条件下赛买提杏果酒甲醇含量排序为:30 ℃处理组>24 ℃处理组>12 ℃处理组>18 ℃处理组,4个处理组样品中(按发酵温度从低到高排序)甲醇量分别为218.98 mg/L、191.83 mg/L、253.61 mg/L、288.05 mg/L,这与PME酶活性有关。30 ℃发酵条件相比其他处理组温度更高,发酵醪液中PME酶活力更高,酶活力下降程度最低,果胶酶和酵母中的酶在高温下更活跃,发酵结束后生成的甲醇含量和酒精度也最高,且过高的发酵温度会使赛买提杏酒果香和口感品质降低。18 ℃条件下,PME酶活力下降最快,使其在所有处理组中甲醇含量最低。在发酵醪液中原果胶含量相同的条件下,处理温度不同导致各处理组最终甲醇含量不同,除18 ℃以外,其余温度产品均存在甲醇超标风险。高温(30 ℃)显著提升PME酶稳定性与活性,导致甲醇生成量最高;而18 ℃通过加速PME失活,使甲醇含量降至最低。可以推测环境温度不同导致酶活力不同,从而影响甲醇生成。实验结果与陈静等[30]结果相一致。
由图4b可知,发酵温度显著影响酒精度,酒精度随温度升高呈阶梯式增长。发酵结束后,各组别的酒精度为18 ℃处理组(7.88%vol)<12 ℃处理组(8.63%vol)<24 ℃处理组(9.62%vol)<30 ℃处理组(9.91%vol)。30 ℃条件下酵母活性最强,推动酒精度增长;12~18 ℃显著抑制酵母活力,导致酒精度相较于其他处理组更低。值得注意的是,酒精度与甲醇生成呈现协同增长趋势,说明温度通过影响酵母代谢活力与果胶酶活力从而加剧甲醇风险。在不同发酵温度下,各处理组最终酒精度含量各不相同。18 ℃处理组酒精度适中,同时可使PME失活,使甲醇含量得到一定控制(191.83 mg/L),为低甲醇杏酒工艺优化提供关键依据。
2.5 PME酶、PG酶、PL酶和甲醇含量之间的相关性分析
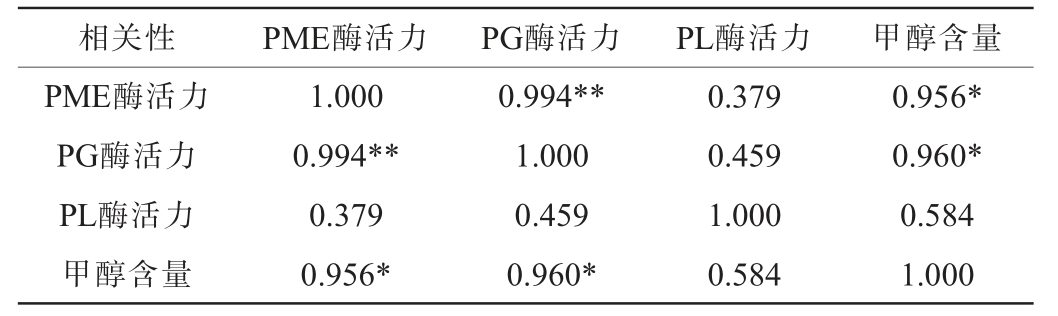
对发酵结束(11 d)时不同温度发酵赛买提杏果酒中的PME酶、PL酶、PG酶及甲醇含量进行相关性分析,结果见表1。
表1 杏酒中果胶甲酯酶、多聚半乳糖醛酸酶、果胶裂解酶和甲醇含量之间的相关性分析
Table 1 Correlation analysis between pectin methylesterase,polygalacturonase, pectin lyase and methanol content in apricot wine
注:“**”表示相关性极显著(P<0.01);“*”表示相关性显著(P<0.05)。
相关性 PME酶活力 PG酶活力 PL酶活力 甲醇含量PME酶活力PG酶活力PL酶活力甲醇含量1.000 0.994**0.379 0.956*0.994**1.000 0.459 0.960*0.379 0.459 1.000 0.584 0.956*0.960*0.584 1.000
由表1可知,不同处理组赛买提杏果酒的PME酶、PG酶与PL酶活力和甲醇含量均呈正相关性,说明酶活力越强,生成的甲醇越多。其中,PME酶活力和PG酶活力与甲醇含量呈显著正相关(P<0.05)。PME酶可以促进赛买提杏中的果胶分解为果胶酸和甲醇,PME酶活力的大小可以影响果胶分解速度和能力,影响PG酶和PL酶作用底物生成量,继而影响赛买提杏果酒中的甲醇含量[11]。
2.6 不同温度处理对赛买提杏酒基本理化指标的影响
2.6.1 对赛买提杏酒CO2释放量的影响
赛买提杏酒在不同发酵温度下经11 d发酵,每2 d检测CO2释放量,测定结果见图5。由图5可知,18 ℃和24 ℃发酵条件下,CO2释放量最大值均在第1天,而12 ℃和30 ℃组的最大CO2释放量均在第3天,表明不同发酵温度能够影响赛买提杏酒的发酵速率;发酵1 d后,30 ℃处理组CO2释放量一直大于其他处理组,可能是由于环境温度导致发酵瓶内的温度过高,使发酵速率偏高。
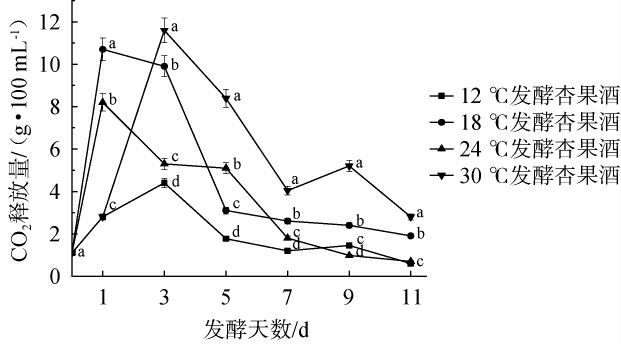
图5 不同温度对杏果酒发酵过程中CO2释放量的影响
Fig.5 Effect of different temperature on the CO2 release of apricot wine during fermentation
2.6.2 对赛买提杏酒理化指标的影响
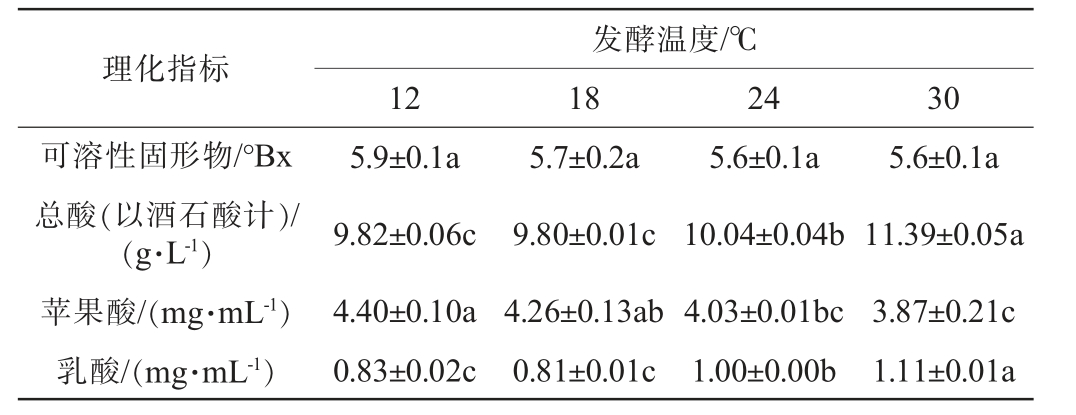
第11天发酵结束时不同温度下发酵赛买提杏果酒的理化指标结果见表2。由表2可知,发酵11 d时,各组之间可溶性固形物含量差异不显著(P>0.05)。不同发酵温度条件下赛买提杏酒总酸含量随温度升高呈增大趋势,18 ℃、24 ℃、30 ℃各组之间差异显著(P<0.05),12 ℃和其他组间差异不显著(P>0.05),其中18 ℃处理组赛买提杏酒的总酸含量最低,为9.82 g/L,酒体中酸甜平衡;30 ℃处理组的总酸和乳酸含量最高,为11.39 g/L和1.11 mg/mL,苹果酸含量最低,为3.87 mg/mL。随着温度升高,苹果酸含量呈现下降趋势,乳酸含量呈上升趋势,说明温度越高越有利于苹果酸乳酸发酵进程推进;而18 ℃赛买提杏酒苹果酸含量较高,乳酸含量最低,说明相较其他处理组,该组苹果酸乳酸发酵进程较慢。赛买提杏酒样品各组理化指标均符合葡萄酒国标要求。
表2 不同发酵温度对赛买提杏果酒理化指标的影响
Table 2 Effect of different fermentation temperature on the physicochemical indexes of Saimaiti apricot wine
理化指标发酵温度/℃12 18 24 30可溶性固形物/°Bx总酸(以酒石酸计)/(g·L-1)苹果酸/(mg·mL-1)乳酸/(mg·mL-1)5.9±0.1a 9.82±0.06c 4.40±0.10a 0.83±0.02c 5.7±0.2a 9.80±0.01c 4.26±0.13ab 0.81±0.01c 5.6±0.1a 10.04±0.04b 4.03±0.01bc 1.00±0.00b 5.6±0.1a 11.39±0.05a 3.87±0.21c 1.11±0.01a
3 结论
赛买提杏因富含果胶等营养成分,其果酒在发酵过程中易产生甲醇超标问题,成为制约产品品质与安全性的关键瓶颈。为此,本研究系统解析了不同发酵条件下三种产甲醇关键酶(PME、PG、PL)的活力动态及其与甲醇生成的关联规律。结果表明,发酵环境温度正向调控酶活力,而发酵时间则负向影响酶活力,其中PME和PG活力与甲醇含量均呈显著正相关(P<0.05)。18 ℃条件下酿制的杏酒甲醇含量(191.83 mg/L)较30 ℃组降低33.4%,有效实现了低甲醇风险与高品质的平衡。
相较于化学吸附、高温蒸馏等后处理手段,发酵温度调控具有绿色经济的双重优势:作为发酵工艺的固有环节,无需依赖外源添加剂或复杂物理处理,既可降低甲醇含量,又能最大限度保留果酒天然风味特性。这为新疆特色果酒产业的标准化生产和市场拓展提供了关键技术支撑。本研究只对比了发酵温度对杏酒的影响,在后续研究中,应进一步利用物理方式例如电场、等方法,探究其对赛买提杏酒甲醇生成的影响,并选取更加节能、高效的方式运用到工业生产当中,实现低甲醇赛买提杏酒产业化。
[1]张定元.新疆杏产业发展风险分析及规避[J].农村经济与科技,2014,25(7):3.
[2]CHEN M X,CHEN X,CHEN Z J,et al.Changes of sugar and acid constituents in apricot during fruit development[J].Sci Agr Sinica,2006,10(5):1-2.
[3]孔丽洁,冯作山,白羽嘉.不同工艺处理对杏汁理化指标及挥发性物质成分的影响[J].食品与发酵工业,2023,49(17):243-250.
[4]廉苇佳,韩琛,郭红梅,等.新疆赛买提杏干发酵杏酒工艺优化[J].保鲜与加工,2023,23(5):47-54.
[5]承春平,陈恺,王雪妃,等.浸硫处理结合热风干燥对杏干品质的影响[J].食品与发酵工业,2023,49(12):40-46,53.
[6]郑丽萍,张建超,白羽嘉,等.玫瑰花风味杏果糕弱微波辅助干热空气干燥动力学模型的建立[J].食品科技,2022,47(8):54-62.
[7]范新光.杏果实采后品质特性及近冰温冷藏技术研究[D].北京:中国农业大学,2018.
[8]张志兵,崔聪聪,赵蕾,等.原料热处理方式对苹果蒸馏酒中甲醇含量和香气的影响[J].中国酿造,2023,42(1):41-47.
[9]孙凯.果胶酶与果酒品质关系的研究[D].石家庄:河北科技大学,2018.
[10]赵岩.红枣蒸馏酒甲醇产生与控制机制和工艺对风味组成影响的研究[D].无锡:江南大学,2022.
[11]王小东.低甲醇、发酵型柿子果酒酿造工艺的研究[D].杨陵:西北农林科技大学,2017.
[12]丁燕,汤晓宏,林雪青,等.苹果中果胶及果胶酶活性和发酵方式对苹果酒中甲醇含量的影响[J].食品与发酵工业,2024,50(19):142-147.
[13]李娇娇,郜海燕,陈杭君,等.温度对桑葚采后贮藏品质及细胞壁代谢酶的影响[J].中国食品学报,2016,16(2):166-172.
[14]董文娟.酵母菌种对冰苹果酒和山楂酒品质的影响[D].泰安:山东农业大学,2015.
[15]黄蓓蓓.仰韶杏酒发酵工艺研究[D].杨陵:西北农林科技大学,2014.
[16]国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2008.
[17]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.266—2016 食品安全国家标准 食品中甲醇的测定[S].北京:中国标准出版社,2016.
[18]LI M,ZHI H H,DONG Y.Textural property and cell wall metabolism of'Golden Bosc'and'Anjou'pears as influenced by oxygen regimes after long-term controlled at mosphere storage[J].Post Biol Technol,2019,151:26-35.
[19]姜文广,李记明,赵虎,等.葡萄酒酿造用商业果胶酶中主要功能酶活性研究[J].酿酒科技,2012(12):27-30.
[20]曹建康,姜微波,赵玉梅.果蔬菜后生理生化试验指导[M].北京:中国轻工业出版社,2007:50-122.
[21]余淑琪,丘佳慧,杜芷君,等.发酵果酒中甲醇的研究进展及控制方法[J].中国酿造,2024,43(7):33-40.
[22]郭聪聪,沈永宝,史锋厚.温度对白皮松种子萌发过程中储藏物质代谢及酶活性的影响[J].南京林业大学学报(自然科学版),2023,47(6):25-34.
[23]刘涛,李丹丹,苗泽,等.精准控温对甜樱桃贮藏品质的影响[J].保鲜与加工,2024,24(11):40-47.
[24]孙奡.不同采收期和贮藏温度对蓝果忍冬果实品质的影响[D].哈尔滨:东北农业大学,2023.
[25]王宇,邹玉锋,张家旭,等.不同果胶酶对低醇桑葚果酒品质的影响研究[J].中国酿造,2023,42(12):185-191.
[26]董绍伟.酶的热稳定性研究及其在棉织物退浆、精练中的应用[D].上海:东华大学,2009.
[27]陆玲鸿,马媛媛,古咸彬,等.猕猴桃果实软化过程中细胞壁多糖物质含量与果胶降解相关酶活性变化[J].浙江农业学报,2022,34(12):2648-2658.
[28]刘小林,伍志权,卓怡,等.EDTA和金属离子对多聚半乳糖醛酸酶酶活力的影响及其动力学研究[J].江西农业大学学报,2010,32(1):153-158.
[29]周姝颖.酒曲中低活性果胶酯酶产生菌的筛选及降低白酒发酵甲醇含量的研究[D].哈尔滨:黑龙江大学,2017.
[30]陈静,郝俊光,蔡秋杏,等.巨峰葡萄酒发酵过程中甲醇杂醇油变化规律研究[J].食品研究与开发,2020,41(13):31-36.