虾青素又名虾黄素,是一种二酮类胡萝卜素,除了作为食品成分外,还具有重要的营养价值[1]。虾青素具有改善水产品和畜禽肤色、增强免疫力、抗氧化和神经保护作用等功效[2]。市场上的虾青素大多是人工合成的,合成的虾青素起始于从石油中获得的酮基异佛尔酮,比天然发现的立体异构体更多,只有小部分的商业虾青素是从雨生红球藻、红法夫酵母或其他生产虾青素的生物有机体中提取得到的[3]。由生物提取的天然虾青素具有相对稳定的反式结构,而化学合成虾青素具有低生物利用度的顺式结构,天然来源中的虾青素通常存在于多种微生物、海洋动物、植物和一些鸟类之中[4-7]。
人工合成的虾青素在虾青素的工业开发中占主导地位(95%),因为与藻类替代品相比,它需要更低的生产成本,而缺点在于,化学合成的虾青素是含有较多异构体的混合物,它还可能含有一定量对机体有害的化学试剂或残留溶剂[5]。天然虾青素由于产量低、栽培和提取成本高,无法满足市场需求[6]。因此,化学合成的虾青素以其低成本、高利润率成为主要的商业来源[7]。然而,由于化学合成虾青素过程中形成的副产物相关的安全问题,天然虾青素仍是市场的主要需求[8]。
目前国内外对红法夫酵母生产虾青素的研究大多集中在菌种改良、培养基优化、虾青素的提取等方面[9],徐彩荣[10]用超声波和氯化锂诱变对红发夫酵母进行复合诱变,获得比出发菌株色素产量高的菌株,NI H等[11]以硫酸铵、硝酸钾和牛肉抽提物为氮源设计的正交试验表明这三种物质的比例对虾青素的产量有重大的影响并确定了最佳氮源组合,KOBAYASHI M等[12]使用了纤维素酶和裂解酶处理雨生红球藻,有效地获得了虾青素,但对多菌种复合发酵生产虾青素的研究鲜见报道。本课题组对植物乳杆菌CG1的产酸能力,酿酒酵母FP-8发酵能力和红法夫酵母XYV3生产虾青素的能力都进行过一些研究,发现植物乳杆菌CG1具有产酸能力强、产酸量高、生长速度快的优质特性,非常适合作为青贮饲料调制加工所使用的微生物发酵剂。酿酒酵母FP-8具有起酵时间短、发酵速度快的优势,在复合发酵菠萝残渣生产虾青素时,它可能凭借高效发酵能力,快速利用菠萝残渣中的糖类等营养物质进行代谢活动。其旺盛的代谢作用不仅为其他菌种提供适宜的发酵环境,还可能通过产生特定的代谢产物[13-14]。
本研究在前期的研究基础上,探究利用酿酒酵母FP-8、植物乳植杆菌CG1和红法夫酵母XYV3复合发酵菠萝残渣生产虾青素的条件,通过单因素试验结合响应面试验,找出对发酵过程影响较为显著的因素,并确定发酵菠萝皮渣生产虾青素的最优发酵条件,为菠萝皮渣的高值化利用及红法夫酵母产虾青素条件摸索以及生产应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
新鲜菠萝皮渣:海口水果市场。
红法夫酵母(Phaffia rhodozyma)XYV3、酿酒酵母(Sac charomyces cerevisiae)FP-8、植物乳植杆菌(Lactiplantibacillus plantarum)CG1:海南大学食品科学与工程学院。
1.1.2 试剂
琼脂粉、酵母膏(均为生化试剂):广东环凯微生物科技有限公司;丙酮、二甲基亚砜、3,5-二硝基水杨酸、葡萄糖(均为分析纯):广州化学试剂厂;虾青素标准品(纯度>98%):美国Sigma公司。
1.1.3 培养基
麦芽汁培养基、MRS肉汤培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:广东环凯微生物科技有限公司。
发酵培养基:新鲜菠萝皮渣与水按比例2∶1打浆过滤、用葡萄糖调糖含量至6%,在121 ℃的条件下灭菌15 min。
红法夫酵母种子液培养基:葡萄糖20 g/L,(NH4)2SO4 2 g/L,KH2PO4 2 g/L,MgSO4 7H2O 0.5 g/L,酵母膏2 g/L,pH值5.0,在121 ℃的条件下灭菌15 min。
1.2 仪器与设备
UV-1100紫外分光光度计:上海美谱达仪器有限公司;PHS-3EpH计:上海雷磁仪器厂;MPL-HWS恒温水浴锅:大地自动化仪器厂;TGL-16C台式离心机:上海医疗器械六厂;YM50FGN全自动高压灭菌锅:上海沪誉贸易有限公司;SHZ-85DF恒温摇床:常州市顶新试验仪器有限公司;PB303-N电子天平:瑞士Mettler Toledo仪器公司;超低温冰箱:日本三洋电机株式会社。
1.3 方法
1.3.1 菌种活化
取-80 ℃保存的植物乳杆菌CG1、酿酒酵母FP-8和红法夫酵母菌XYV3。将植物乳杆菌CG1接种于MRS液体培养基中,在37 ℃条件下培养1 d;将酿酒酵母FP-8接种于PDA液体培养基中,在28 ℃条件下培养1 d;将红法夫酵母菌XYV3接种于麦芽汁琼脂斜面培养基划线,在22.5 ℃培养3 d。
1.3.2 发酵菌株菌悬液及种子液制备
菌悬液的制备:将活化后的植物乳杆菌和酿酒酵母菌摇匀,各取5 mL于无菌离心管中,在4 500 r/min离心5 min,并将沉淀物用无菌生理盐水洗涤两次。再用生理盐水调整菌悬液浓度为1×108 CFU/mL[15]。
红法夫酵母种子液制备:将在麦芽汁培养基中已活化的红法夫酵母接种到种子液培养基中,在22.5 ℃、180 r/min培养48 h作为种子液[14]。
1.3.3 菠萝皮渣发酵
菠萝皮渣采取分段发酵:将菠萝皮渣洗干净,按照菠萝皮渣和水的比例为2∶1打浆,121℃的条件下灭菌15 min,将已打浆灭菌的菠萝皮渣加入酿酒酵母和植物乳杆菌(酿酒酵母∶植物乳杆菌菌种比例1∶1、接种量5%、发酵时间48 h)在30 ℃培养箱中进行厌氧发酵,作为前发酵阶段。
将前发酵阶段结束的菠萝皮渣采用压榨法挤出汁水,在121 ℃的条件下灭菌15 min后加入8%红法夫酵母种子液进行后发酵,在22.5 ℃、180 r/min的摇床中进行好氧发酵作为后发酵阶段[14-16]。
1.3.4 虾青素标准曲线的制作
用二甲基亚砜与丙酮混合液(体积比5∶4)配制50 mg/L的虾青素标准品母液。配制质量浓度为0.5 mg/L、1 mg/L、2 mg/L、3 mg/L、4 mg/L、5 mg/L、6 mg/L的虾青素标准液。以二甲基亚砜与丙酮混合液(体积比5∶4)为空白对照,用分光光度计测定虾青素标准液在波长480 nm处的吸光度值,以OD480 nm值(y)为纵坐标,虾青素标准液的质量浓度(x)为横坐标,绘制虾青素的标准曲线。得到虾青素标准曲线回归方程为:y=0.178 3x+0.002,相关系数为R2=0.999 1。
1.3.5 虾青素的提取及测定
虾青素含量的测定采用二甲基亚砜法[18]。红法夫酵母发酵液在4 000 r/min离心5 min后洗涤两次,加入55 ℃预热的二甲基亚砜溶液,55 ℃水浴5 min,加入丙酮提取,离心后收集上清液,以萃取液为空白对照组,于480 nm波长下测定上清液的吸光度值。虾青素产量计算公式如下:
式中:Va为萃取液体积,mL;A480为480 nm波长下的吸光度值;E为比消光系数1 783;Vb为发酵液取样体积,mL;10 000为单位换算后余数,mg/L。
1.3.6 生物量的测定
采用干质量法测量菌体生物量。取10 mL的发酵液于干燥的离心管中,在4 000 r/min条件下离心5 min后用无菌水洗涤两次沉淀得到菌体,在80 ℃烘箱中烘干至恒质量,按照下式计算生物量[19]。
式中:N-离心管恒质量,g;M-加发酵液后烘干后恒质量,g;V-发酵液体积,mL。
1.3.7 红法夫酵母发酵动态曲线
为确定红法夫酵母最佳细胞积累时间和生产虾青素时间,将打浆过滤的菠萝皮渣汁水,用葡萄糖将糖含量调节到6%,接入8%的法夫酵母种子液,在22.5 ℃、180 r/min的摇床中好氧发酵108 h,每隔12 h取样,测量其pH值,还原糖含量和生物量的变化,并在波长480 nm处测量吸光度值,计算虾青素产量,并绘制对应的发酵曲线。
1.3.8 复合菌种发酵菠萝皮渣生产虾青素前发酵工艺优化
(1)单因素试验设计
设置基础前发酵条件为接种量5%、发酵时间48 h、酿酒酵母∶植物乳杆菌菌种比例1∶1、30 ℃厌氧培养,采用单因素变量法依次调控酿酒酵母与植物乳杆菌比例(1∶1、1∶2、2∶1、3∶1、1∶3)、接种量(3%、5%、7%、9%、11%)和前发酵时间(24 h、36 h、48 h、60 h、72 h),将发酵结束的果渣挤出汁在121 ℃的条件下灭菌15 min后加入8%红法夫酵母种子液进行后发酵,在22.5 ℃、180 r/min的摇床中进行后发酵96 h,研究前发酵阶段对红法夫酵母生物量及虾青素产量的影响,试验重复3次取平均值[14-16]。
(2)响应面分析试验
在单因素试验基础上,选择植物乳杆菌和酿酒酵母菌种比例(A)、接种量(B),前发酵时间(C)为自变量,以虾青素产量为响应值设计3因素3水平响应面试验。试验重复3次取平均值。响应面试验因素和水平见表1。
表1 发酵工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for fermentation process optimization

水平 A 菌种比例 B 接种量/% C 前发酵时间/h-1 01 1∶2 1∶1 2∶1 791 1 36 48 60
1.3.9 数据统计与分析
使用Origin 2021软件进行图像绘制,Design Expert 8.0.6软件对结果进行回归分析。
2 结果与分析
2.1 红法夫酵母发酵动态曲线
红法夫酵母生长曲线及发酵菠萝皮渣产虾青素结果见图1。由图1可知,红法夫酵母细胞生物量与虾青素产量随发酵时间呈先升后降趋势。发酵前期延滞阶段,细胞需适应发酵体系,酶系调整与代谢激活过程缓慢,故生长迟缓;进入对数生长期后,体系内营养(碳氮源等)充足,环境条件适配,细胞增殖代谢旺盛,生物量显著提升,驱动虾青素积累。发酵至96 h时,生物量达8.8 g/L,虾青素产量达到1.86 mg/L。稳定期后,营养物质耗竭与代谢副产物(如抑制性物质)积累,抑制细胞活性,导致两者产量下降。pH值与还原糖含量随发酵时间呈现规律性动态变化:进入对数生长期后,酵母细胞对碳源的消耗显著加剧,伴随产酸代谢活动增强,发酵液pH值与还原糖含量大幅下降;至发酵72 h时,pH值降至4.17左右并趋于稳定,还原糖含量亦同步降至4.4%后维持稳定状态。微生物对数生长期对碳源的高效利用及酸性代谢产物的累积,是引发体系还原糖含量下降与pH值降低的关键因素;当发酵体系内碳源消耗速率与代谢产物生成速率达成动态平衡时,pH值与还原糖含量将呈现稳定特征。综上,发酵96 h时红法夫酵母生物量与虾青素产量达最优平衡,此阶段营养利用效率与代谢活性协同性最佳,实现产量最大化。故后续采用红法夫酵母发酵时间(即后发酵时间)为96 h。
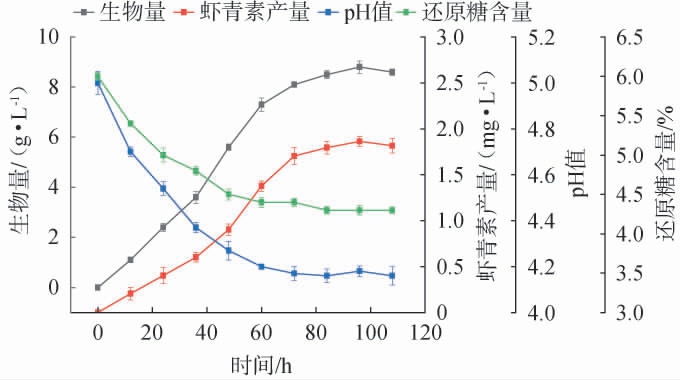
图1 红法夫酵母生长曲线及pH值和还原糖含量的变化曲线
Fig.1 Growth curve of Phaffia rhodozyma and the variation curves of pH value and reducing sugar content
2.2 复合菌种发酵菠萝皮渣生产虾青素工艺优化单因素试验
2.2.1 酿酒酵母与植物乳杆菌菌种比例的确定
由图2可知,不同酿酒酵母与植物乳杆菌菌种比例条件下,红法夫酵母生物量与虾青素产量呈先上升后下降趋势:当菌种比例为1∶1时,红法夫酵母生物量达峰值11.2 g/L,虾青素产量亦处于最高水平。从作用机制来看,酿酒酵母与植物乳杆菌之间的协同作用可优化发酵体系的营养供给与代谢环境,促进目标菌株生长及代谢产物合成;反之,菌种比例失衡易引发营养竞争或代谢抑制,进而抑制红法夫酵母生长与虾青素积累[20-23]。综上,前发酵最佳菌种比例为酿酒酵母∶植物乳杆菌1∶1。
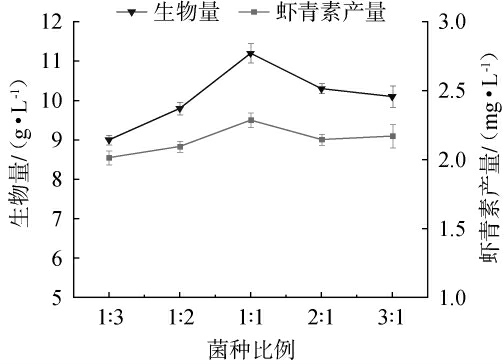
图2 酿酒酵母与植物乳杆菌比例对红法夫酵母生物量及虾青素产量的影响
Fig.2 Effect of Saccharomyces cerevisiae and Lactiplantibacillus plantarum ratio on the biomass of Phaffia rhodozyma and astaxanthin production
2.2.2 酿酒酵母与植物乳杆菌发酵时间的确定
由图3可知,红法夫酵母生物量与虾青素产量随前发酵时间呈现先上升后下降的趋势,发酵时间低于48 h时,二者随时间延长逐步提升,发酵至48 h时,红法夫酵母生物量达峰值13 g/L,虾青素产量亦处于最高水平;超过48 h后,红法夫酵母生物量与虾青素产量均呈下降态势。从作用机制看,适宜发酵时间可维系体系营养供给与细胞代谢活性的平衡,促进红发夫酵母生长及次级代谢产物合成;发酵时间不足,细胞增殖与代谢激活不充分,时间过长则因营养耗竭、代谢副产物积累抑制细胞活性[24-25]。综上,前发酵48 h时红法夫酵母生物量与虾青素产量达较优水平,该阶段发酵体系的营养利用与细胞代谢协同性最佳,为实现产量最大化提供了有利条件。
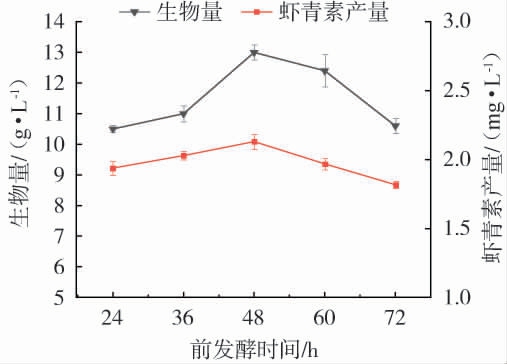
图3 前发酵时间对红法夫酵母生物量及虾青素产量的影响
Fig.3 Effect of pre-fermentation time on the biomass of Phaffia rhodozyma and astaxanthin production
2.2.3 酿酒酵母与植物乳杆菌接种量的确定
由图4可知,红法夫酵母生物量与虾青素产量随酿酒酵母和植物乳杆菌接种量增加呈现先上升后下降的趋势,接种量为7%时生物量达峰值11 g/L,虾青素产量在接种量为9%时达到最高。从作用机制分析,低接种量条件下,酿酒酵母与植物乳杆菌初始菌量不足,菌种繁殖启动迟缓,对碳源、氮源等营养物质的协同利用效率低下,难以构建红法夫酵母适宜的代谢微环境,导致生物量提升受限;当接种量增至9%时,两种辅助菌数量适配,通过代谢协同效应(如分泌促生长因子、优化营养转化路径)为红法夫酵母提供了更有利的生长条件,显著促进其增殖及虾青素合成;而过高接种量(11%)引发菌种间营养竞争加剧,体系营养消耗速率超出红法夫酵母利用能力,导致体系失衡[26]。综上,9%接种量为红法夫酵母发酵的最优接种量,此条件下辅助菌的代谢协同效应与体系营养供给达成最佳匹配,为细胞生长及虾青素合成提供了理想的微生态环境。
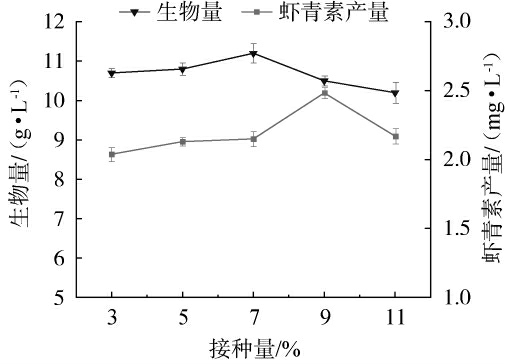
图4 酿酒酵母与植物乳杆菌接种量对红法夫酵母生物量及虾青素产量的影响
Fig.4 Effect of Saccharomyces cerevisiae and Lactiplantibacillus plantarum inoculum on the biomass of Phaffia rhodozyma and astaxanthin production
2.3 响应面优化试验结果及分析
2.3.1 响应面试验结果
在单因素试验基础上,以菌种比例(A),接种量(B),发酵时间(C)为自变量,以虾青素产量为评价指标,采用响应面法优化发酵条件,Box-Behnken试验设计及结果见表2。
表2 发酵工艺优化Box-Behnken试验设计及结果
Table 2 Design and results of response surface experiments for fermentation process optimization
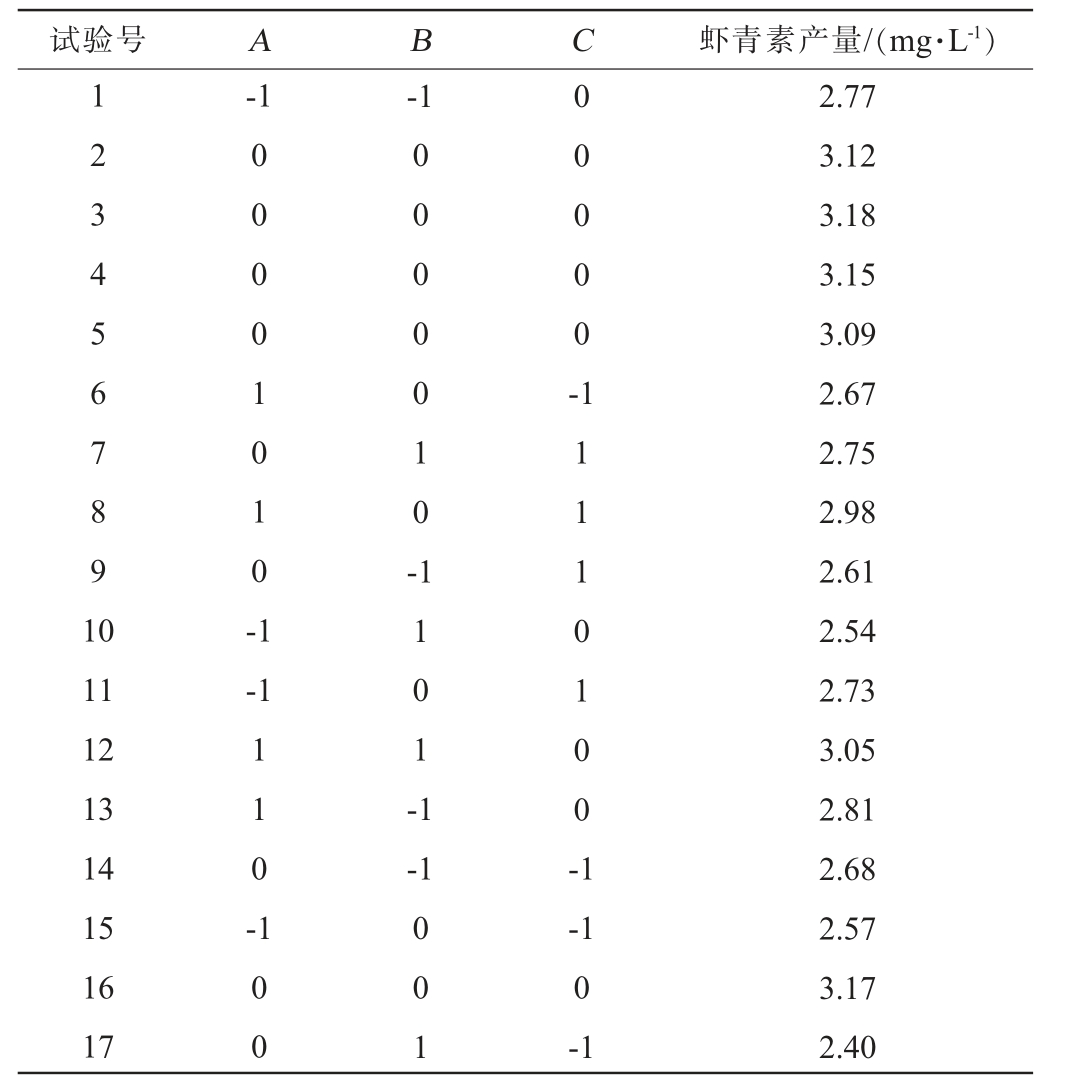
试验号 A B C 虾青素产量/(mg·L-1)1 2 3 4 5 6 7 8 9 1 0-1-1 0 0 0 0 1 0 1 0 -1 0 0 0 0 0 1 0 -0 0 0 0 0 -11 12 13 14 15 16 17-1 1 1 0 -1 1 0 1 -1-1 1 1 1 1 0 1 0 0 -1 1 0 0 0 0 1-1 0-1 2.77 3.12 3.18 3.15 3.09 2.67 2.75 2.98 2.61 2.54 2.73 3.05 2.81 2.68 2.57 3.17 2.40
通过Design Expert 8.0.6 软件进行回归分析,方差分析结果见表3,进行多元回归方程拟合后,得到多元回归方程模型如下:
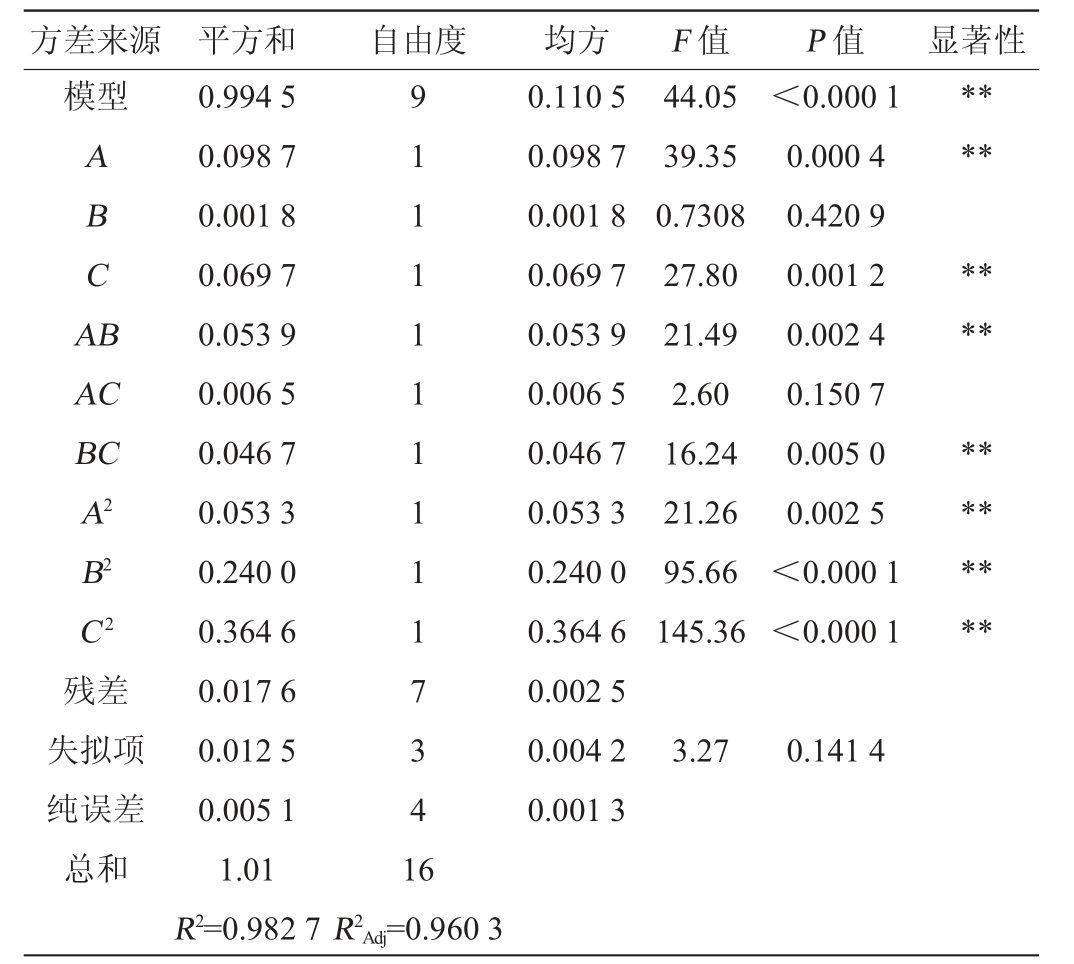
表3 回归模型方差分析
Table 3 Variance analysis of regression model
注:“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B********AC BC A2 B2 C2残差失拟项纯误差总和0.994 5 0.098 7 0.001 8 0.069 7 0.053 9 0.006 5 0.046 7 0.053 3 0.240 0 0.364 6 0.017 6 0.012 5 0.005 1 1.01 R2=0.982 7 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 0.110 5 0.098 7 0.001 8 0.069 7 0.053 9 0.006 5 0.046 7 0.053 3 0.240 0 0.364 6 0.002 5 0.004 2 0.001 3 44.05 39.35 0.7308 27.80 21.49 2.60 16.24 21.26 95.66 145.36<0.000 1 0.000 4 0.420 9 0.001 2 0.002 4 0.150 7 0.005 0 0.002 5<0.000 1<0.000 1********3.27 0.141 4 R2Adj=0.960 3
Y=3.14+0.111 1A-0.015 1B+0.093 4C+0.116 1AB+0.040 4AC+0.100 9BC-0.112 5A2-0.238 7B2-0.294 3C2
由表3方差分析可知,模型F值为44.05,P<0.000 1,表明该模型极显著。失拟项P=0.141 4>0.05,表现为不显著,说明数据模型稳定具有统计学意义。由表3F值可知,三个因素对益生菌发酵菠萝皮渣生产虾青素的影响大小顺序为:菌种比例>发酵时间>接种量,其中一次项A、C对虾青素产量影响极显著(P<0.01),AB、BC的交互作用对虾青素产量影响极显著(P<0.01),二次项A2、B2、C2对虾青素产量影响极显著(P<0.01),决定系数R2=0.982 7,调整决定系数R2Adj=0.960 3,表明该模型拟合程度较好,预测值与真实值高度关联。综合以上数据,该模型能较好的反映三个因素之间的关系,所得的回归方程能较好的预测益生菌发酵菠萝皮渣生产虾青素在不同因素下的变化规律。
2.3.2 响应面图形分析
通过Design Expert 8.0.6软件获得益生菌发酵菠萝皮渣生产虾青素的响应面图和等高线图,以便直观地反映出菌种比例,发酵时间和接种量之间的交互作用对虾青素产量的影响程度,结果见图5。
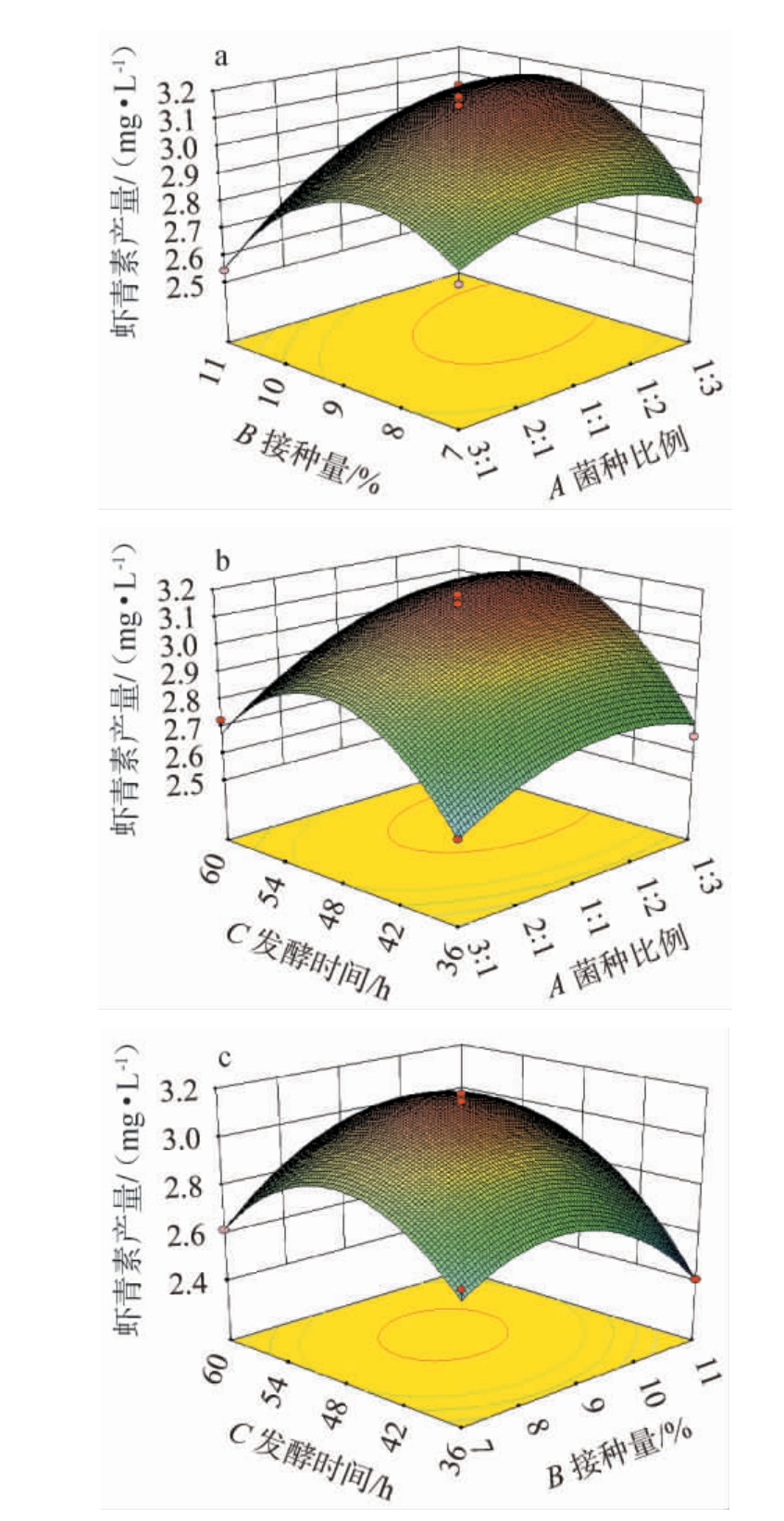
图5 各因素间交互作用对虾青素产量影响的响应面和等高线
Fig.5 Response surface plots and contour line of effects of interaction between various factors on astaxanthin production
由图5a可知,响应曲面较陡峭,菌种比例的曲面倾斜度大于接种量的倾斜度,说明菌种比例对虾青素产量的影响大于接种量,等高线呈密集的椭圆形,表明菌种比例和接种量之间存在较强的交互作用,且两因素对虾青素产量的影响显著。由图5b可知,等高线接近圆形,表明菌种比例和发酵时间之间的交互作用较弱,且两因素对虾青素产量影响不显著。由图5c可知,随着接种量的增加和发酵时间的延长,虾青素含量先升高后,响应曲面较陡峭,且发酵时间的曲面倾斜度大于接种量的倾斜度,说明发酵时间对虾青素产量的影响大于接种量,等高线呈现密集的椭圆形,表明接种量和发酵时间之间的交互作用较强,对虾青素产量的影响显著。
2.3.3 响应面试验的最佳优化结果及验证
由响应面分析可得,益生菌发酵菠萝皮渣生产虾青素的最佳前发酵工艺条件为:酿酒酵母FP-8与植物乳杆菌CG1比例2∶1,接种量9.54%,前发酵时间51.30 h,预测的虾青素产量为3.17 mg/L。考虑到实际可操作性,将最佳工艺条件调整为菌种比例2∶1,接种量10%,前发酵时间51 h。在此条件下进行3组平行验证试验。得到的虾青素产量实际值为3.12 mg/L,接近预测值3.17 mg/L,说明响应面分析法对益生菌发酵菠萝皮渣生产虾青素的工艺条件是可行的。
3 结论
本研究通过优化多菌种分阶段发酵工艺,确定菠萝皮渣生产虾青素的最佳条件为前发酵阶段酿酒酵母FP-8与植物乳杆菌CG1接种比例2∶1、接种量10%、前发酵时间51 h,后发酵阶段接入8%红法夫酵母XYV3于22.5 ℃、180 r/min好氧发酵96 h。在此条件下,虾青素产量达3.12 mg/L,较单菌发酵提升67.47%。本研究揭示了复合菌群代谢协同机制对虾青素合成的促进作用,为果蔬加工废弃物资源化利用提供了创新路径;未来可结合转录组学技术解析菌群间代谢互作网络,明确关键调控通路;同时开展中试规模发酵试验,进一步提升工艺稳定性与普适性,为天然虾青素绿色生产及果蔬加工废弃物资源化提供技术支撑。
[1]BASIONY M,OUYANG L,WANG D N,et al.Optimization of microbial cell factories for astaxanthin production: Biosynthesis and regulations,engineering strategies and fermentation optimization strategies[J].Synth Syst Biotechnol,2022,7:689-704.
[2]XIA W, TANG N, VARKANEH H K, et al.The effects of astaxanthin supplementation on obesity, blood pressure, CRP, glycemic biomarkers,and lipid profile:A meta-analysis of randomized controlled trials[J].Pharmacol Res,2020,161:105113.
[3]ZHOU P,LI M,SHEN B,et al.Directed coevolution of β-carotene ketolase and hydroxylase and its application in temperature-regulated biosynthesis of astaxanthin[J].J Agr Food Chem,2019,67(4):1072-1080.
[4]AMBATI R R, SIEW MOI P, RAVI S, et al.Astaxanthin: Sources, extraction,stability,biological activities and its commercial applications-A Review[J].Marine Drug,2014,12:128-52.
[5]PEREZ-LOPEZ P,GONZALEZ-GARCIA S,JEFFRYES C S,et al.Life cycle assessment of the production of the red antioxidant carotenoid astaxanthin by microalgae:from lab to pilot scale[J].J Clean Prod,2014,64:332-344.
[6]LIM K C,YUSOFF F M,SHARIFF M,et al.Astaxanthin as feed supplement in aquatic animals[J].Rev Aquacult,2018,10:738-773.
[7]孙克诚,胡丹丹,袁文华,等.高产虾青素的红法夫酵母菌株选育研究进展[J].中国畜牧杂志,2024,60(5):12-17.
[8]ZHOU D W,YANG X Y,WANG H X,et al.Biosynthesis of astaxanthin by using industrial yeast[J].Biofuels,2023,17(3):602-615.
[9]BARREDO J L,GARCÍA-ESTRADA C,KOSALKOVA K,et al.Biosynthesis of astaxanthin as a main carotenoid in the heterobasidiomycetous yeast Xanthophyllomyces dendrorhous[J].J Fungi,2017,3(3):44.
[10]徐彩荣.高产虾青素措施的研究[D].泰安:山东农业大学,2013.
[11]NI H, CHEN Q, RUAN H, et al.Studies on optimization of nitrogen sources for astaxanthin production by Phaffia rhodozyma[J].Journal of Zhejiang University Science B,2007,8(5):365-370.
[12]KOBAYASHI M,KURIMURA Y,SSKAMOTO Y,et al.Selective extraction of astaxanthin and chlorophyll from the green alga Haematococcus pluvialis[J].Biotechnol Techn,1997,11(9):657-660.
[13]崔坤鹏,谭海生,杨劲松,等.香蕉残次果及香蕉花上乳酸菌的筛选鉴定[J].中国酿造,2017,36(7):53-57.
[14]杨劲松.果蔬汁发酵生产虾青素的研究[J].中国食品学报,2006,6(2):29-35.
[15]KANTACHOTE D,RATANABUREE A,HAYISAMA-AE W,et al.The use of potential probiotic Lactiplantibacillus plantarum DW12 for producing a novel functional beverage from mature coconut water[J].J Funct Food,2017,32:401-408.
[16]孙克诚,胡丹丹,袁文华,等.高产虾青素的红法夫酵母菌株选育研究进展[J].中国畜牧杂志,2024,60(5):12-17.
[17]ZHOU D, YANG X, WANG H, et al.Biosynthesis of astaxanthin by using industrial yeast[J].Biofuels Bioprod Bioref,2022,15:2449.
[18]杜似鹃,梅艳珍,胡耀辉,等.红法夫酵母生产虾青素的培养条件研究[J].食品科学,2008,29(8):441-444.
[19]沈宁燕.法夫酵母产虾青素发酵工艺的研究及代谢调控发酵[D].厦门:集美大学,2015.
[20]谭仁芩,张曼君,周春丽,等.益生菌对发酵果蔬汁品质影响的研究进展[J].保鲜与加工,2025,25(2):121-133.
[21]毛方华,陈倩倩,史怀,等.酵母菌和乳酸菌发酵对棕榈粕-豆粕发酵饲料品质的影响[J].中国饲料,2025(1):179-183.
[22]犹然,贾晓珂,郑萌萌,等.乳酸菌酵母菌混合发酵果蔬汁对产品风味的影响[J/OL].食品与发酵工业,1-10[2025-03-26].https://doi.org/10.13995/j.cnki.11-1802/ts.041738.
[23]ADESULU-DAHUNSI A T,DAHUNSI S O,OLAYANJU A.Synergistic microbial interactions between lactic acid bacteria and yeasts during production of Nigerian indigenous fermented foods and beverages[J].Food Control,2020,110:106963.
[24]LI C,REN Y C,JIANG S H,et al.Effects of dietary supplementation of four strains of lactic acid bacteria on growth, immune-related response and genes expression of the juvenile sea cucumber Apostichopus japonicus Selenka[J].Fish Shellfish Immun,2018,74(3):69-75.
[25]陈秋慧,魏建敏,穆先,等.刺梨果渣酵素复合发酵工艺优化[J].中国调味品,2023,48(9):122-130.
[26]CUI L, CHANG S K C, NANNAPANENI R.Comparative studies on the effect of probiotic additions on the physicochemical and microbiological properties of yoghurt made from soymilk and cow's milk during refrigeration storage(R2)[J].Food Control,2021,119:107474.