酱油是一种以大豆(或豆粕)和小麦为主要原料,制曲后经霉菌、酵母、细菌等多种微生物的共同作用发酵得到的液体调味品[1-2],具有独特的风味和丰富的营养价值[3]。在酱油发酵过程中,米曲霉(Aspergillus oryzae)作为发酵的核心功能菌株,在制曲阶段能分泌丰富的酶系,在发酵阶段将原料中蛋白、淀粉等物质降解后,经微生物进一步转化利用,形成酱油复杂的风味品质[4-6],因此,米曲霉菌株的发酵性能对酱油最终品质的形成具有决定性作用。目前,我国80%以上的酱油企业均采用米曲霉制曲[7]。李雪玲等[8]通过开展酱油酿造优良菌株的初筛和复筛,选育出了高产中性蛋白酶活的优良菌株;张霖靖等[9]挖掘出了具有优良酶活性能的常压室温等离子体诱变米曲霉菌株D3,该菌株在酱油酿造中表现出优异的性能。
酿造食品的品质特征及其微生物群落密切相关[10-11]。赤水河流域的酱油以其酱香浓郁、味道鲜美等品质特征,深受消费者喜爱[12-13],赤水河流域具有丰富的曲霉、酵母、细菌等微生物资源[14],这些微生物在酱油发酵过程中相互作用,共同促进原料的转化和风味的形成[2]。近年来,已有学者对赤水河流域酱油发酵中的酵母菌[15]、细菌[16]进行了选育研究,以提高酱油风味品质。然而,针对赤水河流域曲霉发酵菌种的开发研究仍较为匮乏,这限制了该地区酱油品质的进一步提升。
基于此,本研究对赤水河流域酱油酿造环境及酱醪样品中霉菌进行分离筛选,通过形态学观察、分子生物学技术对筛选菌株进行鉴定,以常用商业菌株米曲霉(Aspergillus oryzae)沪酿3.042作为对照,通过测定筛选出的菌种制备的酱油曲酶活、产黄曲霉毒素B1(aflatoxin B1,AFB1)能力、发酵酱醅样品理化指标、游离氨基酸含量、挥发性风味成分,比较了不同米曲霉菌株的发酵特性,以期确定赤水河流域酱油发酵的优质功能菌株,为酱油生产选育高效发酵菌株提供数据参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
发酵环境、酱醪样品来源:用灭菌后的湿棉花分别涂抹酱池表面、晒场缸体、晒场盖子,用无菌钥匙取晒场地上酱醅、晒场土壤、发酵酱醪样品,置于无菌离心管中,4 ℃密封保存;所有样品取样工作均在四川省合江县先市酿造食品有限公司进行。
黄豆、土豆、麸皮、食盐、炒麦粉、黄豆粉:市售;米曲霉(Aspergillus oryzae)沪酿3.042(M3.042):石家庄鼎鑫酿造食品科学研究所。
1.1.2 试剂
水合茚三酮、甲醛、正己烷、三乙胺、异硫氰酸苯酯、氯化镉、福林酚、对硝基苯胺(均为分析纯):成都市科隆化学品有限公司;N-苄氧羰酰基-L-苯丙氨酰-L-亮氨酸、L-亮氨酸-4-硝基苯胺(纯度均≥98%):上海源叶生物科技有限公司;乙腈、甲醇、游离氨基酸混合标准品(均为色谱纯):美国Sigma-Aldrich公司;酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)快速检测试剂盒:四川纳敏生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):上海泰坦科技股份有限公司;TSINGKE脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京擎科生物科技股份有限公司。
1.1.3 培养基
孟加拉红培养基:青岛日水生物技术有限公司;YM培养基:青岛高科技工业园海博生物技术有限公司。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:称取200 g土豆切碎后,加去离子水煮沸30 min,过滤后补足1 L水,加入琼脂、葡萄糖各20 g,115 ℃高压蒸汽灭菌20 min。
淀粉酶筛选培养基:可溶性淀粉10 g,蛋白胨2 g,酵母膏5 g,NaCl 5 g,K2HPO4 3 g,琼脂粉20 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
酸性脱脂奶粉培养基:A液为25 g/L脱脂奶粉水溶液,B液为20 g/L琼脂水溶液。A液与B液分别于115 ℃灭菌30 min,使用时在无菌环境下按2∶3体积比混合。
黄豆汁培养基:1 kg黄豆,加水4~5 L,浸泡4 h~12 h,煮沸3~4 h,纱布过滤,调整滤液至5 °Bé。取黄豆汁1 L、可溶性淀粉20 g、磷酸二氢钾1 g、硫酸镁0.5 g、硫酸铵0.5 g、琼脂20 g,混匀后于121 ℃灭菌20 min。
麸皮培养基:按照麸皮∶黄豆粉∶水=4∶1∶4(g∶g)混合,拌匀后浸润30 min,分装60 g于1 L的锥形瓶中,并用8层纱布封口,121 ℃灭菌20 min。
1.2 仪器与设备
GCMS-TQ8040三重四级杆气相色谱-串联质联仪(triple quadrupole tandem mass spectrometry,GC-MS/MS):日本岛津公司;VF-WAXms色谱柱(60 m×2.5 mm×0.25 μm)、Agilent 1260 Infinity II高效液相色谱仪(high performance liquid chromatography,HPLC):美国安捷伦科技有限公司;Multiskan FC型酶标仪:赛默飞世尔(上海)仪器有限公司;Seven Direct SD20 pH计:梅特勒-托利多仪器(上海)有限公司;S3-LA166(S)碎肉机:九阳股份有限公司。
1.3 方法
1.3.1 菌株分离纯化
向前期所取样品中加入10 mL无菌生理盐水,充分涡旋后,记为10-1梯度,此后对其进行逐级梯度稀释,分别获得10-2、10-3、10-4、10-5、10-6梯度样品。此后,将不同梯度样品涂布于孟加拉红培养基平板,于30 ℃培养48 h。此后,选取曲霉形态(颜色、尺寸、菌丝状态、孢子状态、孢子质地等)不同的单菌落在PDA平板上进行多次划线纯化,再将纯化后得到的不同曲霉菌株于PDA斜面中保存,并依据保藏先后顺序依次命名。
1.3.2 米曲霉的筛选
(1)米曲霉初筛
高产淀粉酶菌种初筛:将纯化后菌株点植于淀粉酶筛选培养基平板,30 ℃培养60 h,于菌落表面喷洒稀碘液,测定菌落直径(d)和透明圈直径(D),筛选D/d值较大菌株。
高产蛋白酶菌种初筛:将纯化后的菌株点植于酸性脱脂奶粉培养基平板,30 ℃培养72 h,测定D、d值,筛选D/d值较大菌株。
(2)米曲霉复筛
麸皮曲制备:将初筛淀粉酶和蛋白酶活力综合较强的菌株接种于麸皮培养基,30 ℃培养16 h后将其摇散继续培养,24 h时进行二次摇瓶,目的是将过长的菌丝打断,长出较多菌丝分支,以便获得更多的孢子,后继续平铺培养。培养48 h后(麸皮表面被黄绿色孢子均匀覆盖),获得麸皮曲。测定麸皮曲中淀粉酶、中性蛋白酶、酸性蛋白酶、氨肽酶、羧肽酶活力。
1.3.3 米曲霉菌株鉴定
(1)形态学观察
将筛选菌株及对照商业米曲霉菌株M3.042点植于黄豆汁培养基平板,于30 ℃培养160 h后,观察各菌株菌落形态;挑取霉菌单菌落的孢子及菌丝进行染色制片,于显微镜下观察菌株形态。
(2)分子生物学鉴定
菌株接种至YM液体培养基,于30 ℃条件下摇床振荡(120 r/min)培养24 h,对离心(3 000 r/min、5 min)后获得菌体进行DNA提取。
DNA提取:取菌体20 mg,加入液氮充分研磨后,使用TSINGKE DNA提取试剂盒进行霉菌DNA提取。
聚合酶链式反应(polymerase chain reaction,PCR)扩增:以ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')为引物进行扩增,PCR扩增体系(50 μL):mix 45 μL,ITS1 2 μL,ITS4 2 μL,DNA模板1 μL;PCR扩增程序:98 ℃预变性2 min;98 ℃变性10 s,56 ℃退火10 s,72 ℃延伸10 s,共35个循环数,72 ℃再延伸5 min。测序后于美国国家生物技术信息中心(national center for biotechnology information,NCBI)中的基本局部比对搜索工具(basic local alignment search tool,BLAST)程序拼接完成后,与NCBI 16S rDNA数据库中的数据进行比对,得到与待测物种序列相似性最大的同源序列,采用MEGA5.0生物学软件的邻接(neighbor-joining,NJ)法构建系统发育树,确定菌株种属关系。
1.3.4 米曲霉菌株在酱油酿造中的应用
酱油曲制备:将黄豆用温水(60~70 ℃)浸泡3~4 h后,蒸煮至均匀熟透,颗粒酥软不烂。待黄豆冷却至室温后,以黄豆与炒麦粉按照质量比6∶4混匀,再接入0.5%麸皮曲。将拌匀后的曲均匀铺开,保持相对湿度(>90%),在30 ℃条件下培养至曲料表面长满黄绿色菌丝即可。测定酱油曲中淀粉酶、中性蛋白酶、酸性蛋白酶、氨肽酶、羧肽酶活力和AFB1含量。
酱醅制备[17]:将酱油曲与盐水按照质量比1.0∶1.8混匀后,调整发酵体系含盐量在17%左右,于35 ℃条件下发酵90 d,即得酱醅。测定酱醅中理化指标(水分、总酸、氨基酸态氮、还原糖)、游离氨基酸、挥发性风味成分。
1.3.5 分析检测
菌株产AFB1能力测定:利用ELISA试剂盒;总酸测定:参考GB 12456—2021《食品中总酸的测定》中自动电位滴定法;氨基酸态氮测定:参考GB 5009.235—2016《食品中氨基酸态氮的测定》中酸度计法;还原糖测定:采用3,5-二硝基水杨酸法;pH值测定:采用pH计;游离氨基酸测定:采用HPLC法[18];淀粉酶活、中性蛋白酶活、酸性蛋白酶活、氨肽酶活、羧肽酶活测定方法:参考文献[19]的方法。
1.3.6 酱醅样品中挥发性风味成分分析
样品预处理:准确称取2 g粉碎均质后的酱醅样品于固相萃取瓶中,加入2 mL饱和氯化钠、10 μL 0.4 μg/mL的4-甲基-2-戊醇(内标),混合均匀;在60 ℃平衡20 min后,吸附30 min,解吸5 min。
GC条件:VF-WAXms色谱柱(60 m×2.5 mm×0.25 μm),载气为高纯氦气(He),柱流量为1 mL/min,进样口温度为250 ℃;升温程序为初始温度50 ℃保持3 min;以5 ℃/min的速度升温至85 ℃,保持1.5 min;以10 ℃/min的速度升温至100 ℃,保持0.5 min;以2.5 ℃/min的速度升温至145 ℃,保持0.5 min;以10 ℃/min的速度升温至250 ℃。
MS条件:采集方式为Q3 Scan,电子电离(electronic ionization,EI)源,离子源温度为230 ℃,溶剂延迟时间2 min,扫描范围为35~350 m/z。
定性定量分析:未知化合物在美国国家标准技术研究所(national institute of standards and technology,NIST)17s谱库进行检索匹配,仅采用相似度≥80%的匹配结果实现化合物定性;采用内标法定量。
相对气味活度值(relative odor activity value,ROAV):ROAV是衡量挥发性化合物气味活性的重要指标,当某物质ROAV>1时,被视作关键挥发性风味物质[16]。ROAV由化合物相对含量(Ci)及其在水中嗅觉阈值(olfactory threshold,OT)共同决定。各物质的气味阈值来自文献[17]。ROAV计算公式如下:
1.3.7 数据处理
利用Excel2019进行数据处理;通过MEGA11、TBtools、Origin 2022、Adobe illustrator CC软件绘图。
2 结果与分析
2.1 霉菌分离及筛选
2.1.1 霉菌分离及初筛
采用传统培养法从赤水河流域的发酵环境、酱油酱醅中分离纯化得到44株具有典型曲霉菌落形态的菌株。在此基础上,对44株曲霉进行产淀粉酶和蛋白酶能力初筛,结果见表1。由表1可知,44株米曲霉在淀粉酶筛选平板上均能产生透明圈(D/d值为1.127~1.742),除菌株XS-4外,其余43株曲霉在酸性脱脂奶粉培养基上均产生透明圈(D/d值为1.035~1.371)。菌株XS-42在淀粉酶筛选平板和蛋白酶筛选培养基上D/d值最大,分别为1.742、1.371。菌株XS-10、XS-15、XS-17、XS-33、XS-34等14株产淀粉酶能力较强,D/d值均>1.400。44株曲霉在酸性脱脂奶粉培养基上D/d值变化相对较小,D/d值范围为1.00~1.371。其中菌株XS-2、XS-17、XS-18、XS-24、XS-32、XS-33、XS-34、XS-42、XS-43等产蛋白酶能力相对较强(D/d值为1.086~1.371)。综合淀粉酶及蛋白酶的D/d值考虑,最终选择具有较强的蛋白酶及淀粉酶产生能力的13株菌株XS-2、XS-10、XS-13、XS-15、XS-17、XS-18、XS-24、XS-32、XS-33、XS-34、XS-38、XS-42、XS-43进入复筛。
表1 初筛菌株的D/d 值测定结果
Table 1 Determination results of the D/d value of preliminarily screened strains
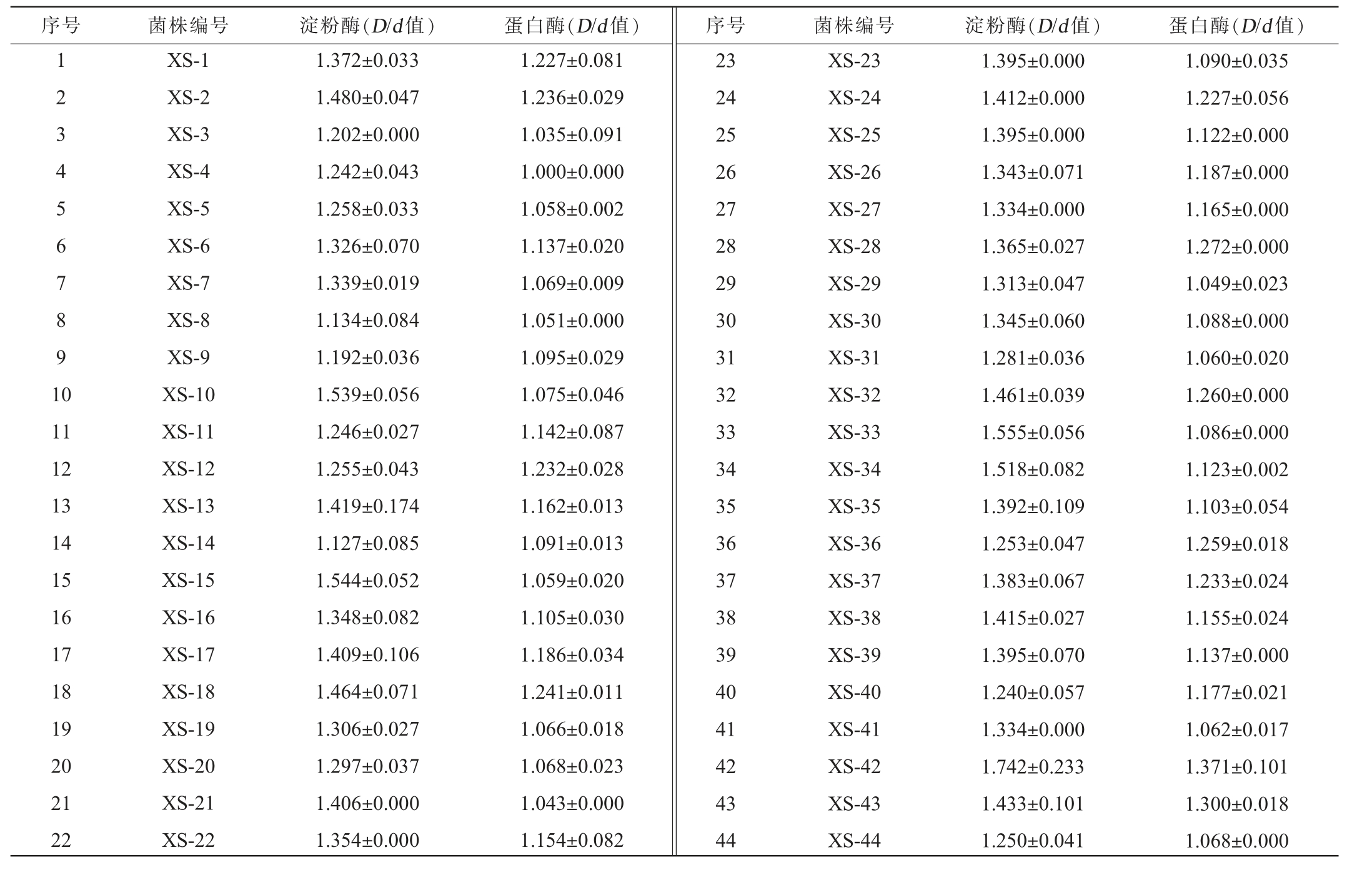
序号 菌株编号 淀粉酶(D/d 值)蛋白酶(D/d 值)序号 菌株编号 淀粉酶(D/d 值)蛋白酶(D/d 值)1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 20 21 22 XS-1 XS-2 XS-3 XS-4 XS-5 XS-6 XS-7 XS-8 XS-9 XS-10 XS-11 XS-12 XS-13 XS-14 XS-15 XS-16 XS-17 XS-18 XS-19 XS-20 XS-21 XS-22 1.372±0.033 1.480±0.047 1.202±0.000 1.242±0.043 1.258±0.033 1.326±0.070 1.339±0.019 1.134±0.084 1.192±0.036 1.539±0.056 1.246±0.027 1.255±0.043 1.419±0.174 1.127±0.085 1.544±0.052 1.348±0.082 1.409±0.106 1.464±0.071 1.306±0.027 1.297±0.037 1.406±0.000 1.354±0.000 1.227±0.081 1.236±0.029 1.035±0.091 1.000±0.000 1.058±0.002 1.137±0.020 1.069±0.009 1.051±0.000 1.095±0.029 1.075±0.046 1.142±0.087 1.232±0.028 1.162±0.013 1.091±0.013 1.059±0.020 1.105±0.030 1.186±0.034 1.241±0.011 1.066±0.018 1.068±0.023 1.043±0.000 1.154±0.082 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 XS-23 XS-24 XS-25 XS-26 XS-27 XS-28 XS-29 XS-30 XS-31 XS-32 XS-33 XS-34 XS-35 XS-36 XS-37 XS-38 XS-39 XS-40 XS-41 XS-42 XS-43 XS-44 1.395±0.000 1.412±0.000 1.395±0.000 1.343±0.071 1.334±0.000 1.365±0.027 1.313±0.047 1.345±0.060 1.281±0.036 1.461±0.039 1.555±0.056 1.518±0.082 1.392±0.109 1.253±0.047 1.383±0.067 1.415±0.027 1.395±0.070 1.240±0.057 1.334±0.000 1.742±0.233 1.433±0.101 1.250±0.041 1.090±0.035 1.227±0.056 1.122±0.000 1.187±0.000 1.165±0.000 1.272±0.000 1.049±0.023 1.088±0.000 1.060±0.020 1.260±0.000 1.086±0.000 1.123±0.002 1.103±0.054 1.259±0.018 1.233±0.024 1.155±0.024 1.137±0.000 1.177±0.021 1.062±0.017 1.371±0.101 1.300±0.018 1.068±0.000
2.1.2 霉菌复筛
不同菌株制麸皮曲的酶活力测定结果见图1。由图1A可知,除了菌株XS-2淀粉酶活较低外(762.90 U/g),其余菌株淀粉酶活力范围为1 288.74~1 794.88 U/g,显著高于范梦雪等[20]诱变选育的米曲霉菌株。由图1B可知,不同菌株间中性蛋白酶活在699.84~899.52 U/g之间,其中,菌株XS-13、XS-15、XS-17、XS-24、XS-33、XS-34中性蛋白酶活力相对较高(833.31~899.52 U/g)。由图1C可知,各菌株酸性蛋白酶活力范围在73.69~125.86 U/g之间,其中,菌株XS-10、XS-15、XS-17、XS-33、XS-34的产酸性蛋白酶能力较强(102.98~125.86 U/g)。由图1D可知,菌株XS-13、XS-15、XS-17、XS-24、XS-32、XS-33、XS-34产氨肽酶能力较强,酶活在2 968.33~3 194.39 U/g之间;菌株XS-10、XS-38、XS-42、M3.042产氨肽酶能力较弱,尤其是菌株M3.042氨肽酶活力仅有1 342.17 U/g。由图1E可知,不同菌株间羧肽酶差异较大,羧肽酶活范围在210.77~1 567.48 U/g之间,其中,菌株XS-33、XS-34和XS-42产羧肽酶能力最强,酶活在1 422.15~1 567.48 U/g之间,其余羧肽酶活在565.45~1 098.98 U/g之间(除菌株XS-38外)。相较于酱油企业常用商业菌株M3.042而言,菌株XS-15、XS-17、XS-33、XS-34各项酶活较均衡,适合酱油酿造且这4株菌株的氨肽酶活、羧肽酶活显著高于张霖靖等[9]选育的米曲霉菌株。因此,选取这4株菌进行后续研究。
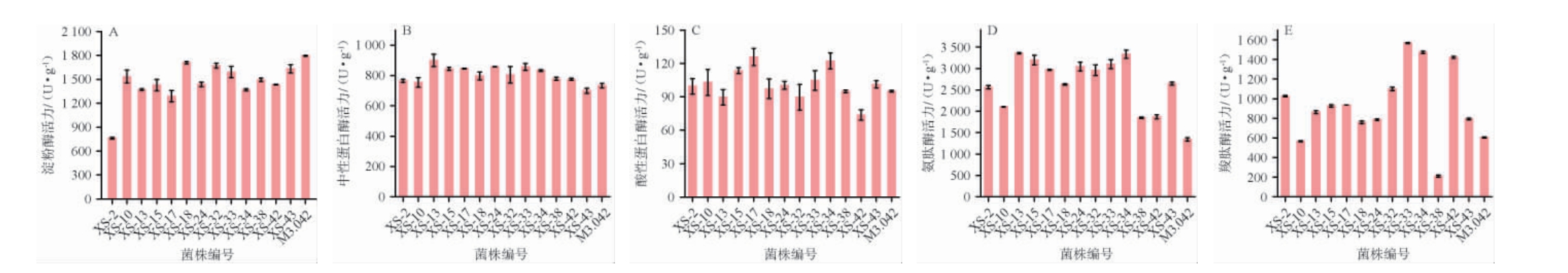
图1 不同菌株制备酱油曲的酶活力测定结果
Fig.1 Determination results of enzyme activities of soy sauce koji prepared by different strains
2.1.3 霉菌菌株的鉴定
(1)形态学观察
复筛菌株的菌落形态及产孢结构见图2。
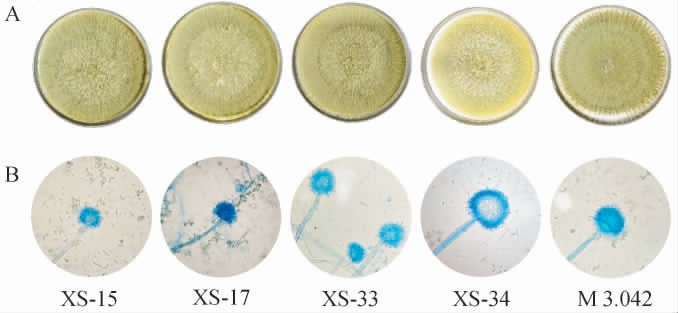
图2 筛选菌株的菌落形态(A)及产孢结构(B)
Fig.2 Colony morphology (A) and spore structure (B) of the screened strains
由图2A可知,5株菌株的菌落形态相似,宏观菌落均呈黄绿色,丝绒质地,菌丝短且疏松且呈现出放射状褶皱,这与赵谋明等[4]的研究一致。然而,也存在一定差异。菌株XS-15、XS-17、XS-33菌落表面几乎看不见白色菌丝,而菌株XS-34、M3.042菌落周围还存在一道白色菌丝圆环;由图2B可知,菌株XS-34孢子颜色相对其余4株菌更偏黄绿色;此外,与菌株M3.042相比,筛选的4株菌中心存在较为明显的绒毛状菌丝。5株菌株均具有分生孢子梗,孢梗茎壁薄且长,顶端具有球形顶囊,其表面有辐射状小梗,分生孢子串生。结合孙笑寒等[21]对米曲霉的鉴定研究结论及上述形态学特征,初步判定XS-15、XS-17、XS-33、XS-34均为米曲霉。
(2)分子生物学鉴定
基于16S rDNA基因序列筛选菌株的系统发育树见图3。由图3可知,菌株XS-15、XS-17、XS-33、XS-34的ITS序列高度相似,聚为一类,且4株菌均与米曲霉(Aspergillus oryzae)菌株聚为一支,序列相似度>99.12%。结合形态学特征结果,4株菌株均被鉴定为米曲霉(Aspergillus oryzae)。
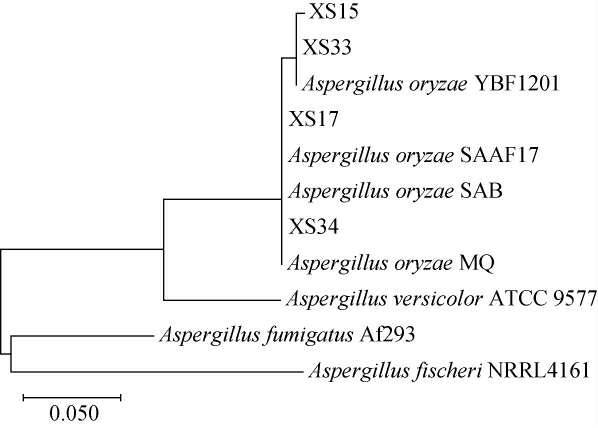
图3 基于16S rDNA基因序列筛选菌株的系统发育树
Fig.3 Phylogenetic tree of screened strains based on 16S rDNA gene sequences
2.2 米曲霉菌株在酱油曲及酱醅中的应用
2.2.1 米曲霉菌株在酱油曲中的应用
(1)酱油曲酶活性分析
成曲的酶活通常作为检验成曲的质量的重要指标之一[9],不同菌种制备的酱油曲酶活见图4。
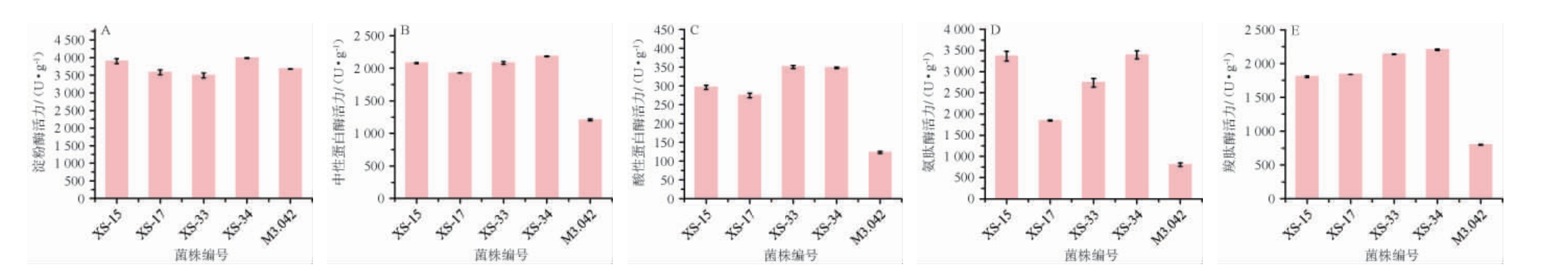
图4 筛选菌株制备酱油曲的酶活力测定结果
Fig.4 Determination results of enzyme activities of soy sauce koji prepared by screened strains
由图4A可知,5株菌株制备酱油曲中淀粉酶在3490.88~3 984.39 U/g之间,酶活差异较小。其中,菌株XS-34制备成曲淀粉酶活力最强,为3 984.39 U/g,淀粉酶酶解产物不仅可为酱类食品后期发酵微生物提供碳源,还是醇类、有机酸类风味物质形成的前体物质[21],在酱类食品中发挥重要作用。
发酵菌株蛋白酶活力的高低将直接影响原料利用率及产品产率,进而影响酱油品质[22]。由图4B可知,5株菌株制备酱油曲中性蛋白酶活在1 207.72~2 185.19 U/g之间,产中性蛋白酶活能力由高到低菌株排序为XS-34>XS-33>XS-15>XS-17>M3.042。
由图4C可知,5株菌株制备酱油曲酸性蛋白酶活在123.03~350.26 U/g之间。菌株XS-33酸性蛋白酶活最高,为350.26U/g,菌株XS-34酸性蛋白酶活与其相近,为347.76U/g,其次为菌株XS15、XS17、M3.042。
氨肽酶作为酱油酿造的重要生物酶之一,可有效增加发酵食品甜味、鲜味,降低苦味[19]。由图4D可知,各菌株制备的酱油曲氨肽酶活差异较大,5株米曲霉制备成曲氨肽酶活在807.07~3 395.35 U/g之间。对照菌株M3.042制备成曲的氨肽酶活最低,菌株XS-34、XS-33、XS-15、XS-17制备的成曲氨肽酶活相对M3.042分别提高320.70%、239.10%、128.74%、317.05%。
羧肽酶具有与氨肽酶相似的能力[3]。由图4E可知,菌株XS-34制备成曲羧肽酶活力最强,达2 203.79 U/g,菌株XS-33酱油曲羧肽酶活次之,为2138.75U/g。菌株XS-17和XS-15制备酱油曲羧肽酶活较为相近,分别为1 839.30 U/g、1 806.78 U/g。菌株M3.042制备酱油曲羧肽酶活最低,仅800.00 U/g。
综上,与对照菌株M3.042相比,4株筛选菌株制备的酱油曲的中性蛋白酶、酸性蛋白酶、氨肽酶和羧肽酶均有一定提升。其中,菌株XS-34对中性蛋白酶活、氨肽酶酶活和羧肽酶酶活的提升最大,这将有利于降解原料中的蛋白质,以供后期酱醅发酵过程微生物的生产代谢[22]。综合而言,4株选育的米曲霉菌种制曲效果均优于M3.042,尤其菌株XS-34的淀粉酶活、中性蛋白酶活、酸性蛋白酶活、氨肽酶活、羧肽酶活均较强。
(2)酱油曲中黄曲霉毒素B1(AFB1)分析
为分析上述4株优选米曲霉菌株在实际应用中的安全性,将筛选菌株与对照菌株M3.042在酱油曲中产AFB1情况进行对比验证,结果见图5。由图5可知,所有样品中均检出了AFB1,且菌株M3.042制备的酱油曲中AFB1含量最低,为0.718 μg/kg,选育的4株米曲霉菌株中AFB1含量为1.390~1.630 μg/kg。上述菌株的AFB1含量远低于发酵食品安全国家标准中的5.0 μg/kg[23]。此外,已有关于M3.042发酵酱油的研究报道指出,该菌株不产AFB1[22],这也说明了本次酱油曲中AFB1可能源自原料的污染[24]。
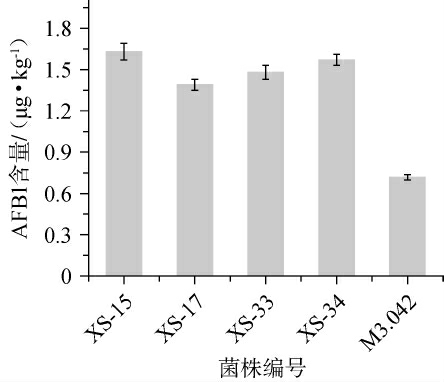
图5 不同菌株制备酱油曲中黄曲霉毒素B1含量
Fig.5 Contents of aflatoxin B1 in soy sauce koji prepared by different strains
2.2.2 米曲霉菌株在酱醅中的应用
(1)酱醅理化指标分析
不同菌株制曲发酵酱醅理化指标检测结果见图6。
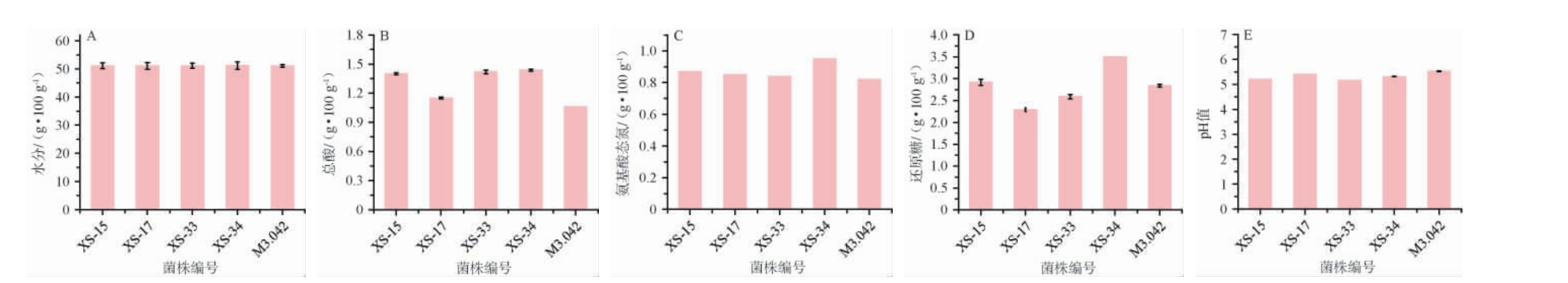
图6 不同菌株发酵酱醅理化指标检测结果
Fig.6 Determination results of physicochemical indexes of sauce mash fermented with different strains
由图6A可知,不同菌株发酵酱醅样品的水分含量相近(51.08%~51.19%),这可能与工艺制备的高度一致性有关。由图6B可知,不同菌株发酵酱醅样品的总酸含量在1.06~1.44 g/100 g之间。其中,菌株XS-34发酵酱醅总酸含量最高,菌株M3.042发酵酱醅样品中的总酸含量最低。这可能与菌株XS-34酶活性能最强,菌株M3.042酶活性能较差有关。成曲酶活较高,微生物所需底物的生产能力较强,为乳酸菌生长繁殖提供了有利条件,从而导致总酸含量升高[25]。氨基酸态氮是米曲霉分解蛋白质的产物,能为酱油提供鲜味,其含量越高,酱油滋味越好,品质越高[26]。由图6C可知,不同菌株发酵酱醅的氨基酸态氮含量在0.82~0.95 g/100 g之间。4株筛选菌株发酵酱醅样品氨基酸态氮含量均高于对照菌株M3.042,其中,菌株XS-34发酵酱醅氨基酸态氮含量最高,这与其在制曲过程具有较高的蛋白酶活力密不可分[22]。还原糖是糖化酶和淀粉酶分解淀粉质原料的产物,是酱油甜味的重要来源[27]。由图6D可知,不同菌株制备酱醅样品的还原糖含量在2.29~3.50 g/100 g之间,这与郭婷等[27-28]的研究结果相近。菌株XS-34发酵酱醅样品还原糖含量显著高于其余菌株,这与其良好的淀粉酶活密切相关。由图6E可知,不同菌株发酵酱醅样品的pH值为5.17~5.53,这与肖张弛等[29]研究结果相近。总体而言,4株筛选菌株发酵酱醅的理化指标优于菌株M3.042。其中,菌株XS-34发酵酱醅各理化品质指标较为突出。
(2)酱醅游离氨基酸分析
酱醅中游离氨基酸是提供氨基酸态氮的主要物质,是挥发性物质的潜在来源,也是酱醅滋味的重要提供者[28]。不同菌株发酵酱醅的游离氨基酸含量测定结果见图7。由图7可知,与对照组M3.042(24.08 g/kg)相比,4株筛选米曲霉发酵酱醅中游离氨基酸含量均有所提升,含量范围在25.14~27.74 g/kg之间,这可能与筛选的米曲霉菌株蛋白酶活力较高有关,较高的蛋白酶活力可更有效促进原料中蛋白质分解,进而生成更多游离氨基酸[9]。其中,菌株XS-34发酵酱醅中游离氨基酸含量最高,这与氨基酸态氮含量结果一致。此外,谷氨酸、天门冬氨酸、亮氨酸、精氨酸是酱醅中的主要游离氨基酸,4种氨基酸占总游离氨基酸含量占比为40.52%~41.14%,且各种游离氨基酸的含量在不同菌株发酵酱醅中存在差异。
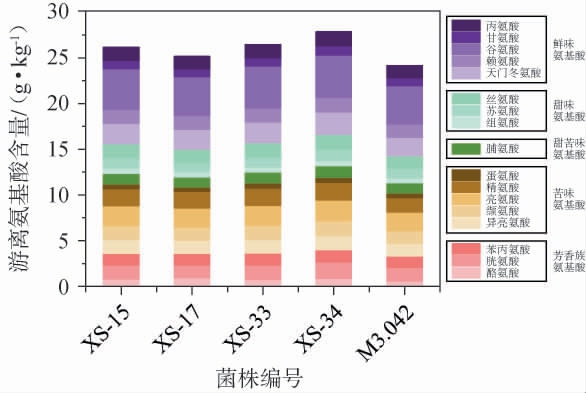
图7 不同菌株发酵酱醅的游离氨基酸含量测定结果
Fig.7 Determination results of free amino acid contents in sauce mash fermented with different strains
氨基酸可根据其呈味特性,分为鲜味氨基酸、甜味氨基酸、芳香族氨基酸、甜苦味氨基酸、苦味氨基酸五类[30]。所有样品中呈味氨基酸组成模式相似,均以鲜味氨基酸含量最高,含量范围为9.86~11.18 g/kg;其次是苦味氨基酸(6.86~7.89 g/kg)和芳香族氨基酸(3.26~3.94 g/kg),这与钟碧疆等[30]的研究相近。与菌株M3.042相比,4株筛选菌株发酵酱醅中鲜味氨基酸、甜味氨基酸、芳香族氨基酸的含量分别提高2.70%~13.38%、2.88%~15.39%、9.25%~20.65%,尤其是菌株XS-34效果最明显,这可能与其较高的羧肽酶活有关,羧肽酶可在中性蛋白酶作用的基础上进一步作用于多肽末端产生小分子肽和游离氨基酸,为发酵食品增加鲜味和甜味,显著降低水解物的苦味[19],有助于酱油良好滋味的形成。不同菌株发酵酱醅中各呈味氨基酸含量占比相近,具体而言,芳香族氨基酸、甜苦味氨基酸、苦味氨基酸、甜味氨基酸、鲜味氨基酸占比分别在13.55%~14.41%、4.36%~4.65%、28.46%~28.99%、12.15%~12.40%、40.29%~40.97%,这可能是受到了原料中各种氨基酸的影响。
(3)酱醅的挥发性风味成分分析
酱油风味与酱醅中挥发性风味成分的含量及种类密切相关[31]。不同菌株制备的酱醅样品中各类别挥发性风味成分种类及相对含量结果见图8。
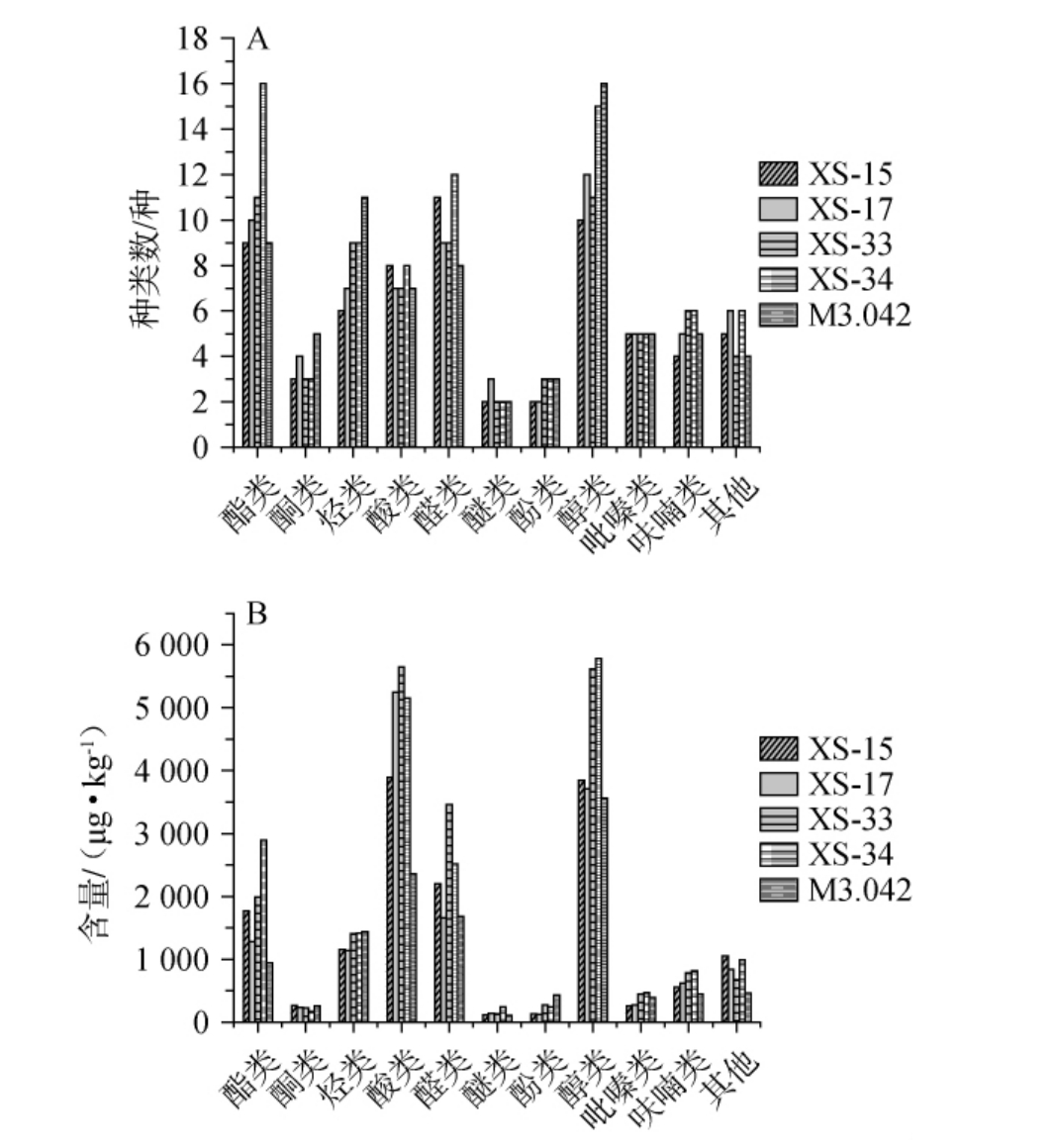
图8 不同菌株发酵酱醅的挥发性风味成分种类(A)和含量(B)
Fig.8 Types (A) and contents (B) of volatile flavor components in sauce mash fermented with different strains
由图8A可知,5株菌株发酵酱醅样品中共检测出挥发性成分103种,其中酯类16种、醇类20种、烃类13种、醛类15种、酸类9种、吡嗪类5种、呋喃类6种、醚类5种、酮类5种、酚类3种、其他物质6种。菌株XS-34发酵酱醅样品挥发性成分种类数最多,达85种,菌株XS-15、XS-17、XS-33、M3.042发酵酱醅挥发性化合物种类数分别为65种、70种、70种、75种。由图8B可知,不同菌株制曲发酵酱醅样品醇类、酸类的挥发性成分相对含量最高,含量范围为2 358.90~5 779.92 μg/kg;其次为醛类(1 658.96~3 461.27 μg/kg)、酯类(944.90~2 891.40 μg/kg)、和烃类(1 136.95~1 438.05 μg/kg),这与张颖超[32]的研究结果相近。与对照菌株M3.042发酵酱醅挥发性成分相对含量(12 099.51 μg/kg)相比,4株筛选菌株发酵酱醅挥发性成分相对含量提高26.19%~71.06%,这可能与其优良的酶活性能有关。其中,菌株XS-34发酵酱醅样品挥发性成分含量相对最高,达20 698.01 μg/kg,而酱醅发酵过程中更高含量的挥发性成分可能意味着较好的风味[33]。总体而言,4株筛选菌株发酵酱醅的挥发性风味成分含量均高于菌株M3.042,其中菌株XS-34的挥发性风味成分含量和种类最为突出。
不同菌株发酵酱醅中关键挥发性风味物质聚类分析热图见图9。由图9可知,5种菌株发酵酱醅中共确定出37种关键挥发性风味物质(ROAV>1),菌株XS-33、XS-34发酵酱醅样品中关键挥发性风味成分最多,达33种;菌株M3.042发酵酱醅样品中关键挥发性风味成分最少,仅28种。共有关键挥发性风味物质25种,共有关键挥发性风味物质中乙酸乙酯和苯乙醇ROAV较高,分别为17 312.68~49 042、5 055.66~19 156.98之间,其余物质ROAV均<1 000,这说明5种菌株发酵酱醅均具有突出的果香、玫瑰香。菌株XS-34发酵酱醅还存在特有物质2-壬烯醛,具有蔬果香、脂香;菌株XS-17、XS-33发酵酱醅样品均含有十碳醛,具有较强的甜香和花果香,而菌株M3.042发酵酱醅样品独有的3-辛酮则具有霉味和奶酪味。5种菌株发酵酱醅的关键挥发性风味成分之间既存在一定联系,也存在较大差异。
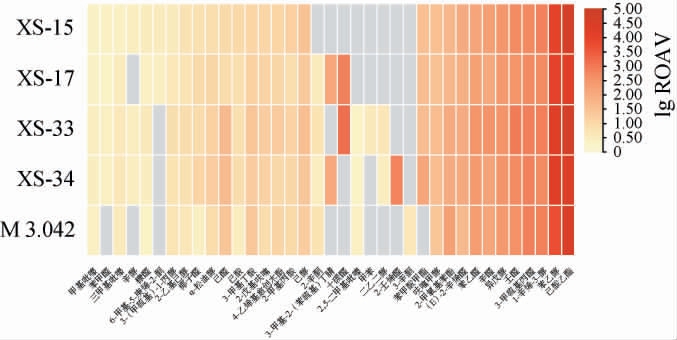
图9 不同菌株发酵酱醅中关键挥发性风味物质聚类分析热图
Fig.9 Heat map of cluster analysis of key volatile flavor compounds in sauce mash fermented with different strains
3 结论
本研究从赤水河流域酱油发酵环境及酱醪中筛选出4株酶活性能较优的菌株(编号为XS-15、XS-17、XS-33、XS-34),经鉴定为米曲霉(Aspergillus oryzae)。以米曲霉沪酿3.042(M3.042)为对照,考察筛选菌株应用于酱油曲及酱醅中的发酵性能。与M3.042菌株相比,4株米曲霉制备酱油曲的中性蛋白酶、酸性蛋白酶、氨肽酶和羧肽酶分别提升59.74%~80.93%、123.27%~184.69%、128.74%~320.70%和125.85%~175.47%;氨基酸态氮含量、总酸、游离氨基酸、挥发性成分含量分别提升2.30%~15.87%、8.51%~34.47%、4.41%~15.20%、26.19%~71.06%;上述结果表明筛选菌株能显著提高酱油曲和酱醅的发酵性能。其中,菌株XS-34对酱油制曲和酱醅发酵品质的提升效果最强,其酱油曲酶活性能综合性能较优、酱醅总酸(1.44 g/100 g)、氨基酸态氮(0.95 g/100 g)、还原糖(3.50 g/100 g)、游离氨基酸含量(27.74 g/kg)、挥发性成分含量(20 698.01 μg/kg)均最高,其关键挥发性风味成分种类最丰富(33种)。本研究为赤水河流域酱油高品质发酵功能菌株的筛选提供了数据基础,为传统酿造酱油企业风味传承提供了科学依据。
[1]ZHOU X,GUO T,HADIATULLAH H,et al.Metabolic behavior of Aspergillus oryzae in salt-reduced soy sauce and its regulation for the brewing process[J].Food Biosci,2024,59:104206.
[2]LI F,WANG Y,LIAO H,et al.Exploring correlations between soy sauce components and the formation of thermal contaminants during low-salt solid-state fermentation[J].Food Res Int,2024,182:114113.
[3]LIU Y, SUN G, LI J, et al.Starter molds and multi-enzyme catalysis in koji fermentation of soy sauce brewing:A review[J].Food Res Int,2024,184:114273.
[4]赵谋明,林涵玉,梁卓雄,等.传统酿造酱油酱醪中的霉菌筛选及其部分酶系特征分析[J].现代食品科技,2020,36(6):114-120.
[5]CHEN C,HOU S,WU C,et al.Improving protein utilization and fermentation quality of soy sauce by adding protease[J].J Food Compos Anal,2023,121:105399.
[6]梁锦云,温林凤,李俊,等.酱油中米曲霉酶系组成及其应用的研究进展[J].中国食品添加剂,2024,35(3):289-295.
[7]纪凤娣,鲁绯,程永强.中国传统酱油生产用米曲霉菌种研究进展[J].北京工商大学学报(自然科学版),2012,30(4):41-43,49.
[8]李雪玲,颜喆,胡文锋.酱油酿造优良米曲霉菌株的高效选育[J].中国调味品,2021,46(8):20-23,28.
[9]张霖靖,刘功良,彭勃,等.不同米曲霉在高盐稀态酱油中的发酵性能比较[J].食品与发酵工业,2025,51(3):137-146.
[10]KNIGHTS D,KUCZYNSKI J,CHARLSON E S,et al.Bayesian community-wide culture-independent microbial source tracking[J].Nat Methods,2011,8(9):761-763.
[11]黄昊.赤水河流域生态变迁与酱香型白酒产业绿色发展研究[J].生态环境与保护,2021,4(1):67-70.
[12]刘婕.四川守护赤水河“一江春水、两岸青山”[N].四川经济日报,2023-10-31.
[13]李雄波,符怡,王相甫,等.四川晒露酱油感官风味轮构建及应用[J].食品与发酵科技,2024,60(6):92-99.
[14]姜政飞.赤水河产区酱香型白酒酿造微生物来源及环境微生物分布[D].无锡:江南大学,2023.
[15]杨阳,邓岳,刘彦希,等.一株酱醅中耐盐酵母Meyerozyma guilliermondii的分离鉴定及其挥发性香气成分分析[J].中国测试,2016,42(11):55-59.
[16]曹月,邓岳,徐小芳,等.自然发酵酱油酱醅中产香芽孢杆菌的筛选及其产酶性能研究[J].中国测试,2021,47(8):58-64.
[17]梁小玲,张巧苑,李洁珠.酱油酿造工艺分析[J].现代食品,2022,28(8):65-67.
[18]李雄波,范智义,王泽亮,等.不同品种蚕豆原料对郫县豆瓣品质的影响研究[J].食品工业科技,2024,45(9):72-82.
[19] 王泽亮,邓维琴,刘书亮,等.半干态豆豉高效发酵菌株筛选及其发酵性能评价[J].食品科学,2024,45(5):31-39.
[20]范梦雪,贾玉晗,王玉芳,等.基于水解酶系均衡的米曲霉菌种复壮选育和诱变育种研究[J].鲁东大学学报(自然科学版),2024,40(4):354-359.
[21]孙笑寒,蒋雪薇,肖智予,等.米曲霉优良菌株的筛选及在制曲发酵西瓜黄豆酱中的应用[J].食品科学,2022,43(6):204-211.
[22]范林旭.高产蛋白酶米曲霉的筛选及其在豆瓣酱中的应用[D].无锡:江南大学,2022.
[23]LUO D,GUAN J,DONG H,et al.Simultaneous determination of twelve mycotoxins in edible oil,soy sauce and bean sauce by PRiME HLB solid phase extraction combined with HPLC-Orbitrap HRMS[J].Front Nutr,2022,9:1001671.
[24]霍茜.三种快速检测发酵食品中黄曲霉毒素B1免疫层析试纸条的研制[D].南昌:南昌大学,2023.
[25]于茜雅,鲁骞,吴昌正,等.温度对广式高盐稀态酱油原油品质的影响[J].食品科学,2023,44(22):55-63.
[26]谭春雷,盛军,赵存朝.核桃粕酱油的研制及品质分析[J].中国调味品,2024,49(4):154-160.
[27]黄留瑶.酱油罐式发酵与池式发酵关键组分与过程特性的对比研究[D].广州:华南理工大学,2023.
[28]郭婷,王凤军,周新运,等.米曲霉盐胁迫对酱油发酵理化指标及微生物群落的影响[J].中国酿造,2023,42(6):97-102.
[29]肖张弛,顾紫檬,黄勋,等.耐盐产乙醇奥默柯达酵母的筛选及其对高盐稀态酱油风味的影响[J].食品与发酵工业,2025,51(6):134-143.
[30]钟碧疆,余阳,沈建东.陈酿时间对日晒夜露法酿造酱油品质的影响[J].食品科技,2024,49(3):286-292.
[31]王涛.功能乳酸菌的筛选及其在低盐固态酱油发酵中的应用[D].无锡:江南大学,2023.
[32]张颖超.酱油酿造功能微生物分离及强化发酵对酱油品质的影响[D].济南:齐鲁工业大学,2023.
[33]FENG Y,CUI C,ZHAO H,et al.Effect of koji fermentation on generation of volatile compounds in soy sauce production[J].Int J Food Sci Technol,2013,48(3):609-619.