真菌毒素是由不同类型的真菌(主要是青霉属、曲霉属和镰刀菌属)产生的有毒次级代谢产物,广泛存在于水果、坚果、乳制品、饲料、香料及谷物(小麦、大麦、玉米、水稻)中,因其具有致突变性、致癌性等多种毒性,直接威胁着人类和动物的健康[1]。据统计,全球每年约25%的粮食作物受到不同程度的污染,对食品工业和畜牧业等造成了巨大的经济损失[2]。目前,对粮食、饲料污染影响较大的真菌毒素主要有黄曲霉毒素(aflatoxins,AFs)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、赭曲霉毒素(ochratoxin,OT)、伏马毒素(fumonisins,FB)和玉米赤霉烯酮(zearalenone,ZEN),其中ZEN和DON污染范围最为广泛,气候潮湿的地区污染率极高[3]。ZEN又称为F-2霉菌毒素,长期食用对人类和动物的健康具有多重危害,尤其表现在血液毒性、生殖发育毒性、致癌性、免疫毒性、肝肾毒性等方面,被国际癌症研究机构(International Agency for Research on Cancer,IARC)归类为Ⅲ类致癌物[4]。DON即使在低浓度下也会产生有害的影响,主要表现为肾毒性、肝毒性、遗传毒性、免疫毒性、神经毒性等,DON还会抑制蛋白质、核糖核酸(ribonucleic acid,RNA)和脱氧核糖核酸(deoxyribonucleic acid,DNA)的合成,并通过与核糖体结合诱导细胞凋亡[5-6];其中,动物对DON的敏感程度从高到低分别为猪>大鼠>小鼠>家禽和反刍动物,猪对DON最为敏感[7]。
目前,已报道的用于脱除食物和饲料中真菌毒素的策略包括物理法、化学法和生物法。其中化学法主要依赖氧化、还原或中和反应来降解毒素,如使用碱性物质(氢氧化钠、氢氧化钙等)进行处理,该方法可显著降低ZEN和DON的含量,但可能产生化学残留及毒性未知的新产物,对环境和食品品质造成潜在危害[8-9]。生物法则利用微生物及其产生的降解酶脱除毒素,存在菌株安全性和降解酶产量低、抗逆性和稳定性较差等问题。物理法通过吸附、辐射等手段实现毒素脱除,其操作相对简单,不会引入化学残留,但部分物理方法(如辐照)设备成本高,难以大规模应用[10-11]。而微生物吸附因其成分稳定、处理简单、吸附能力强、环境友好等优点,展现出巨大的应用潜力[12]。
酵母作为发酵工业中常见的菌种,其水解物因其独特的细胞壁结构,显示出对多种真菌毒素的吸附潜力[13]。酵母细胞壁的主要成分包括β-1,3-D葡聚糖和β-1,6-D葡聚糖,这些成分能够通过氢键和范德华力与真菌毒素结合吸附[14]。酵母水解物作为一种生物脱毒剂,可以用于饲料添加剂和食品工业,具有较大的应用前景[15]。尽管酵母水解物显示出对ZEN和DON的吸附潜力,但关于其吸附机理的研究还相对较少,且食品工业中对真菌毒素吸附应用的研究主要集中在酿酒酵母和乳酸菌的应用上[16]。
本研究以毕赤酵母为研究对象,通过控制自溶时间、酶解时间以及辅以机械破壁的方式获得不同水解程度的酵母水解物(yeast hydrolysate,YHs)。基于液相色谱-质谱联用(liquid chromatography-mass spectrometry,LC-MS)、扫描电子显微镜(scanning electron microscope,SEM)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)等分析手段,比较和分析了不同水解程度、不同添加量和不同pH条件水解物对ZEN和DON吸附效果的影响,分析了吸附前后红外光谱图变化。最后体外静态模拟水解物对ZEN和DON的吸附作用。
1 材料与方法
1.1 材料与试剂
巴斯德毕赤酵母(Pichia pastoris):本实验室保存;ZEN、DON标准品:普瑞邦(北京)科技有限公司;甲醇、甲酸、甲酸铵(均为色谱纯):美国Thermo Fisher公司;酵母浸粉、蛋白胨、琼脂粉(均为生化试剂),葡萄糖(分析纯):北京索莱宝科技有限公司;无水乙醇、盐酸、氢氧化钠(均为分析纯):北京奥博星生物技术有限责任公司;复合蛋白酶(120U/mg):上海源叶生物科技有限公司。
酵母浸出粉蛋白胨葡萄糖(yeastextractpeptonedextrose,YPD)液体培养基[17]:酵母浸粉10.0 g/L,蛋白胨20.0 g/L,葡萄糖20.0 g/L,115 ℃高压蒸汽灭菌20 min,自然pH。如配制固体培养基另加入20.0 g琼脂粉。
1.2 仪器与设备
YJ-VS-1 型单人垂直超净工作台:无锡一净净化设备有限公司;LDZX-50L型高压蒸汽灭菌锅:上海申安医疗器械厂;DHP-9602电热恒温培养箱:上海一恒科学仪器有限公司;BS-2E 型恒温振荡培养箱:常州恒隆仪器有限公司;ME204型电子分析天平、FE22型pH 计:梅特勒-托利多国际贸易(上海)有限公司;Agilent 6545 ESI QTOF 超高效液相色谱-四级杆飞行时间质谱仪:安捷伦科技有限公司;JSMIT700HR型扫描电镜:日本电子株式会社(JEOL);Nicoleti N10-i Z10傅里叶变换显微红外光谱仪:赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 毕赤酵母菌的培养
将巴斯德毕赤酵母菌株从-80 ℃保藏管或甘油菌中取出,划线接种于YPD固体培养基平板上,置于30 ℃培养箱中培养24 h,以完成菌株的活化。活化完成后,从平板上挑选单菌落,接种于含有5 mL YPD液体培养基的试管中,置于30 ℃、200 r/min的摇床中培养12 h,制备种子液。随后,按5%的接种量(V/V)将种子液接种到YPD液体培养基中,继续在30 ℃、200 r/min的条件下培养48 h。培养结束后,将培养液置于4 ℃冰箱中静置10 min,然后在4 ℃条件下,以10 000 r/min的速度离心10 min,收集酵母菌体,用于后续实验。
1.3.2 酵母水解物的制备方法
用灭菌水将上述菌体重悬,使菌体的质量浓度为10%,加入质量分数1‰~5‰的柠檬酸,在55℃、200 r/min条件下反应24 h,使其自溶,每12 h取样一次;加入质量分数5‰的复合酶,在55 ℃、200 r/min的条件下使其酶解24 h,每12 h取样一次;最后在60 MPa高压细胞破碎仪3次,将不同水解阶段的YHs真空冷冻干燥备用[13,18-19]。未经水解的干酵母粉作为参照记为YH0,自溶12 h和24 h的干粉分别记为YH1和YH2,酶解12 h和24 h的干粉分别记为YH3和YH4,高压破碎后干燥所得记为YH5,共6个吸附剂。
1.3.3 氨基酸态氮的含量检测
酵母水解物经去离子水复溶后离心取上清液为待测液,参考GB/T 20886.2—2021《酵母产品质量要求第2部分:酵母加工制品》测定氨基酸态氮含量。
1.3.4 核酸的含量检测
YHs经去离子水复溶后离心取上清液为待测液,使用核酸检测试剂盒(定磷比色法)测定核算含量。
1.3.5 SEM扫描电子显微镜分析YHs表面形貌结构
通过SEN对不同水解阶段的YHs的表面形态进行观察:蘸取少量真空冷冻干燥后的样品,将其用导电胶粘在样品台上,样品喷金镀膜3次,然后置于样品室中抽真空,观察并对所需样品图像拍照。
1.3.6 ZEN和DON毒素含量检测
样品前处理:取待测样品(12 000 r/min离心10 min取上清液)100 μL加900 μL 5%乙醇-水溶液混匀。
ZEN和DON毒素含量采用LC-MS检测方法。LC条件:采用Agilent Poroshell 120 EC-C18的色谱柱(2.1 mm×100 mm,2.7 μm),进样量2 μL,流速0.3 mL/min,温度30 ℃。流动相A为0.1%甲酸-5 mmol/L甲酸铵水溶液,流动相B为0.1%甲酸-甲醇溶液。梯度洗脱程序:0~1 min,流动相B:10%;1~1.5 min,流动相B均匀增加至45%;1.5~8.5 min,流动相B均匀增加至100%,并保持至9.5 min;9.5~10 min,流动相B均匀降至10%。
质谱条件:电喷雾离子源采用负离子扫描模式,喷雾器压力40 psi,毛细管压力4.0 kV,破裂器电压175 V,锥孔电压65 V,雾化温度300 ℃,辅助气(N2)流速5 L/min。鞘内气体温度325 ℃,流速11 L/min。质谱在全扫描模式下运行,收集质荷比(m/z)为100~1 200之间的数据,扫描频率2 Hz/s。
定性定量方法:结合保留时间和精确质量数进行定性。通过Q-TOF-MS采集其高分辨质谱数据,提取[M-H]-离子的精确质量数进行定性,其中ZEN的特征离子为m/z 317.139 4,DON的特征离子为m/z 297.133 3。采用外标法进行定量。
1.3.7 不同水解阶段的YHs对ZEN和DON的吸附
1 μg ZEN毒素管的制备:精确称量5 mg ZEN标准品定容于100 mL色谱级甲醇中,得到质量浓度为50 μg/mL储备液;在无菌的2 mL离心管中加入20 μL ZEN储备液,置于真空离心浓缩仪中蒸干。
10 μg DON毒素管的制备:精确称量DON标准品10 mg溶于色谱乙腈中并定容于100 mL容量瓶中,制得质量浓度为100 μg/mL储备液;在无菌的2 mL离心管中加入100 μL储备液,置于真空离心浓缩仪中蒸干。
精确量取不同水解阶段、质量浓度为20 mg/mL的YHs 500 μL,于毒素结合管中先以50 μL无水乙醇复溶,再补加450 μL去离子水,使吸附剂终质量浓度达10 mg/mL。随后,在37 ℃、200 r/min振荡条件下,于自然pH条件下孵育3 h。
1.3.8 不同添加量的YHs对ZEN和DON的吸附
根据上述结果,选择脱除效果差异较大的2个吸附剂样品(下同)作为研究对象,分别考察添加量为5.0 mg/mL、7.5mg/mL、10.0mg/mL、12.5mg/mL、15.0mg/mL、17.5mg/mL、20 mg/mL时,在37 ℃、200 r/min孵育3 h后,YHs对ZEN和DON吸附的影响。
1.3.9 不同pH条件的YHs对ZEN和DON的吸附
基于1.3.8确定最佳的吸附剂添加量,使用氢氧化钠和盐酸溶液调节孵育体系pH值为2、4.5、7、9.5,分别研究上述的2个吸附剂在相同孵育条件下对ZEN和DON吸附的影响。
1.3.10 FTIR傅里叶红外光谱测定
分别取上述2个吸附剂YHs与溴化钾颗粒400 mg(1∶99,W/W)置于研钵中充分研磨成粉末。取混合物粉末于仪器中压片,将制备的样品放入仪器样品槽中进行检测。
傅里叶变换红外光谱仪试验参数设置:光谱数据的记录范围为4 000~400 cm-1红外区,采用2 cm-1分辨率进行测量,每次测量平均扫描16次。每个样品重复3次。测量之前会先对仪器进行空气背景扫描,以校准仪器并自动扣除背景噪声。
1.3.11 体外模拟消化实验
采用模拟体外静态(international network for gastrointestinal science and technology,INFOGEST)消化模型[20-21],主要包括3种模拟消化液体:模拟唾液(simulated salivary fluid,SSF)、模拟胃液(simulated gastric fluid,SGF)、模拟肠液(simulated intestinal fluid,SIF),3种模拟消化液的具体配方见表1。
表1 体外模拟消化液配方
Table 1 Formula of simulated digestive solution in vitro
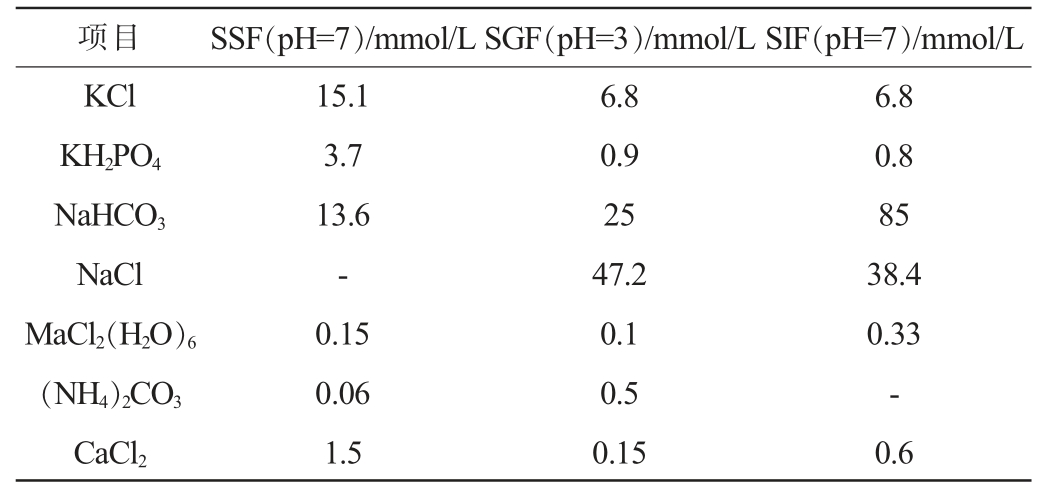
项目 SSF(pH=7)/mmol/L SGF(pH=3)/mmol/L SIF(pH=7)/mmol/L KCl KH2PO4 NaHCO3 NaCl MaCl2(H2O)6(NH4)2CO3 CaCl2 15.1 3.7 13.6-0.15 0.06 1.5 6.8 0.9 25 47.2 0.1 0.5 0.15 6.8 0.8 85 38.4 0.33-0.6
模拟口腔消化:分别加入YHs样品200 mg,ZEN/DON毒素100 μg,4 mL SSF,CaCl2(H2O)2溶液25 μL(使得最终浓度为1.5 mmol/L),调节最终唾液淀粉酶活力为75 U/mL,1 mol/L盐酸调节pH为7.0,补充蒸馏水使最终反应液体积为10 mL,在37 ℃、20 r/min的条件下反应2 min以模拟机械消化运动。反应结束取1 mL用于检测毒素含量。
模拟胃消化:在模拟口腔消化液中添加7.2 mL SGF,加入CaCl2(H2O)2溶液45 μL(使得最终浓度为0.15 mmol/L),调节最终胃蛋白酶活力为2 000 U/mL,1 mol/L盐酸调节pH为3.0,补充蒸馏水使最终反应液体积为18 mL,在37 ℃、20 r/min的条件下反应120 min以模拟机械消化运动。反应结束取1 mL用于检测毒素含量。
模拟肠道消化:在模拟胃消化液中添加8.6 mLSIF,加入CaCl2(H2O)2溶液34 μL(使得最终浓度为0.6 mmol/L),调节最终胰蛋白酶活力为100 U/mL,猪胆盐浓度为10 mmol/L,1 mol/L NaOH调节pH为7.0,补充蒸馏水使最终反应液体积为34 mL,在37 ℃、20 r/min的条件下反应120 min以模拟机械消化运动。待反应结束取1 mL用于毒素含量检测。
1.3.12 测定方法
YHs对ZEN和DON的吸附效率、脱除率按以下公式进行计算:
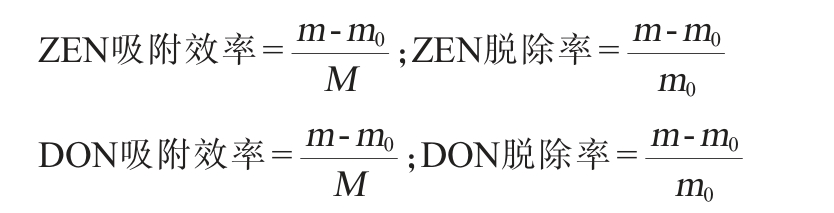
式中:m为吸附后毒素质量,μg;m0为吸附前毒素质量,μg;M为吸附剂(YHs)的质量,g。
1.3.13 数据统计与分析
实验数据用“平均值±标准差”(standard deviation,SD)表示。数据经Excel初步整理后,采用SPSS软件(版本26.0)进行统计分析,单因素方差分析(analysis of variance,ANOVA)进行统计学检验,GraphPad Prism 9.0 作图。
2 结果与分析
2.1 不同水解阶段YHs的水解效果分析
按照1.3.2方法制备YHs,YHs表征结果见图1。由图1A可知,从YH0~YH5细胞壁被破坏程度明显增强,反映了水解物的水解程度逐渐增加。由图1B可知,与YH0相比,随着水解时间的延长和水解方式对细胞破坏的增强,YH1~YH5上清液的核酸含量和氨基酸态氮含量均呈上升趋势,水解程度增加,与电子显微镜观察结果一致。因此,YHs可作为不同水解程度的吸附机开展以下研究。

图1 不同水解阶段酵母水解物水解效果分析
Fig.1 Analysis of the hydrolysis effect of yeast hydrolysates with different hydrolysis degree
A:SEM扫描图;B:水解物上清液核酸含量;C:水解物上清液氨基酸态氮含量。
2.2 不同水解阶段YHs对ZEN和DON吸附效果的影响
细胞壁的物理结构、化学成分及与毒素分子的相互作用复杂[22]。因此,探究不同水解阶段YHs对毒素的吸附性能具有重要意义[23]。不同水解阶段YHs对ZEN和DON的吸附效果见图2。
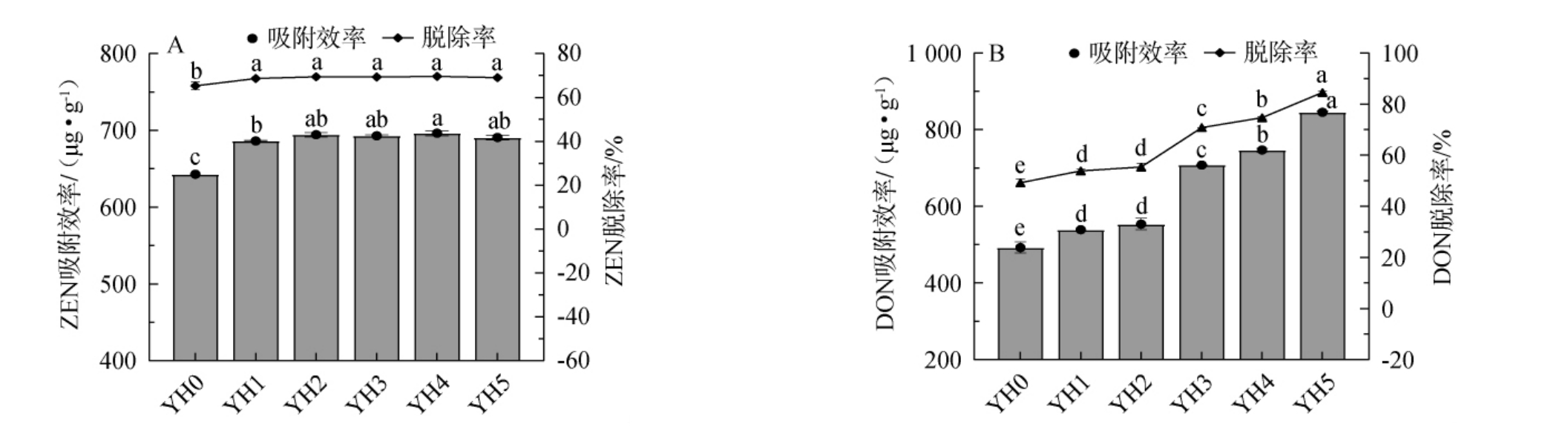
图2 不同水解阶段酵母水解物对玉米赤霉烯酮(A)和呕吐毒素(B)的吸附效果
Fig.2 Adsorption effect of yeast hydrolysates with different hydrolysis degree on ZEN (A) and DON (B)
由图2可知,与YH0相比,YH1~YH5对ZEN、DON吸附效果、脱除率均显著上升(P<0.05),YH5对ZEN吸附效果、脱除率与YH1~YH4差异不显著(P>0.05),对DON吸附效果、脱除率显著优于YH1~YH4(P<0.05)。对于ZEN,随着水解程度增加,水解物对其吸附和脱除效果增加不明显,推测ZEN在YHs的吸附位点大部分是在细胞壁外侧,即甘露聚糖层。对于DON,随着水解程度增加,水解物对其吸附和脱除效果呈现逐渐上升趋势,推测DON在YHs中的吸附位点除了在细胞壁外侧,还涉及酵母细胞内部的结构或成分,即DON可能进入酵母细胞内部,与细胞内的蛋白质、核酸等生物大分子的特定结合位点发生作用;当水解程度增加时,水解物可能暴露出更多的结合位点或改变细胞壁的通透性,使得DON更容易进入细胞内部并与之结合,从而提高了对DON的吸附和脱除效果。因此,选择YH0和YH5作为后续实验的研究对象。
2.3 不同添加量YH0和YH5对ZEN和DON吸附效果的影响
YHs作为一种新型吸附剂,其吸附性能受到添加量的影响,因此探究了不同添加量的YHs对毒素的吸附效果。不同添加量YH0、YH5对ZEN和DON的吸附效果的影响见图3。
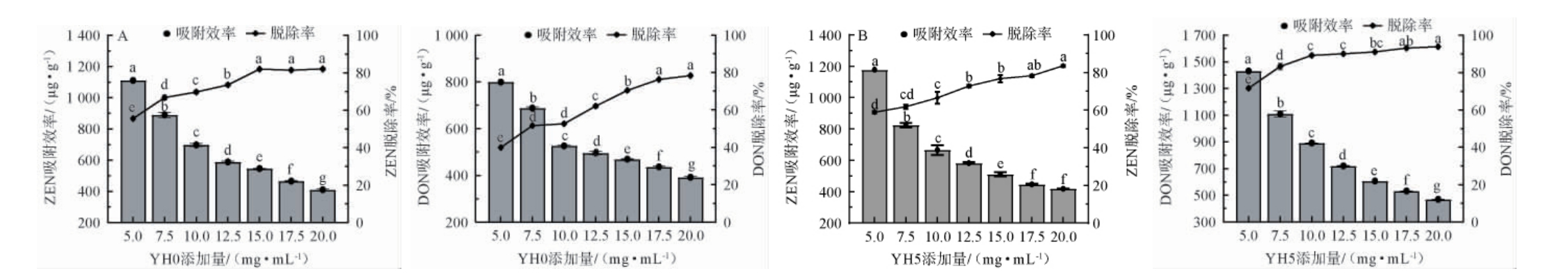
图3 不同添加量YH0(A)和YH5(B)对玉米赤霉烯酮和呕吐毒素的吸附效果的影响
Fig.3 Effect of different addition of YH0 (A) and YH5 (B) on the adsorption effect of ZEN and DON
由图3可知,随着YHs添加量的增加,毒素吸附效率呈下降趋势,脱除率先上升后趋于稳定。当YH0添加量为20.0 mg/mL时,ZEN吸附效率和脱除率分别达410.28 μg/g、82.06%,DON 吸 附 效 率 和 脱 除 率 分 别 达391.95 μg/g、78.39%;当YH5添加量为20.0 mg/mL,ZEN吸附效率和脱除率分别达417.77 μg/g、83.55%,DON吸附效率和脱除率分别达469.23 μg/g、91.85%。基于此,后续将YH0和YH5质量浓度确定为20 mg/mL。
2.4 不同pH条件YH0和YH5对ZEN和DON吸附效果的影响
真菌毒素随着食物和饲料经口腔进入体内,首先进入胃道,后进入肠道。由于胃道和肠道环境pH存在明显的差异,考虑会对吸附过程产生影响。因此,研究pH值对吸附过程的影响可以判断吸附剂从胃道到肠道至排出体外的过程是否会造成解吸的发生。不同pH对ZEN和DON的吸附效果的影响见图4。
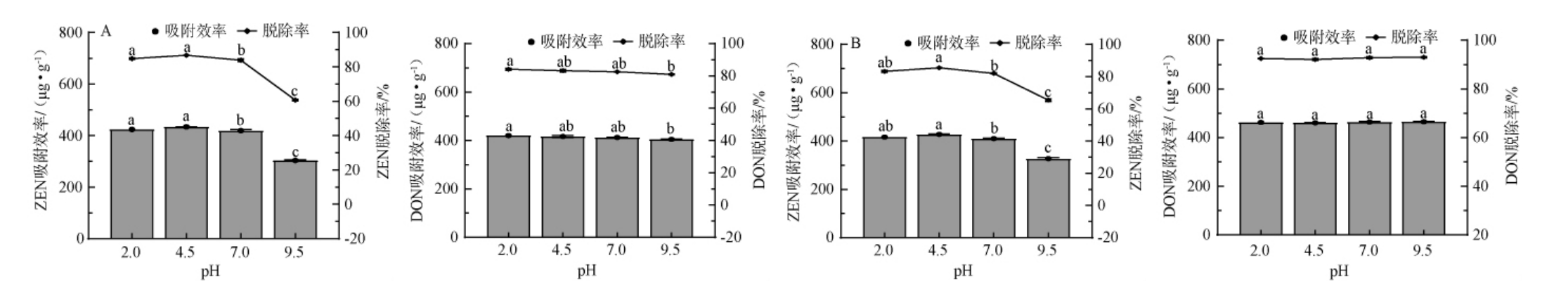
图4 不同pH条件下YH0(A)和YH5(B)对玉米赤霉烯酮和呕吐毒素的吸附效果的影响
Fig.4 Effect of YH0 (A) and YH5 (B) under different pH conditions on the adsorption effects of ZEN and DON
由图4可知,与中性相比,酸性(pH 2.0~4.5,下同)条件下,YH0和YH5对ZEN脱除率略有增加,碱性条件(pH 9.5,下同)条件下,YH0和YH5对ZEN显著降低(P<0.05)。可能是在低pH条件下,ZEN分子中的酚羟基保持质子化(中性或弱正电),使其疏水性增强,溶解度降低,容易以疏水力与酵母细胞壁结合。碱性条件下,ZEN分子中的酚羟基去质子化,带负电荷(ZEN-),亲水性增加,溶解度增强,且酵母细胞壁的主要成分(如β-葡聚糖、甘露聚糖)含有羟基,在碱性环境中可能轻微去质子化,使细胞壁表面带负电,此时,带负电的ZEN-与细胞壁之间因静电排斥而难以吸附。因此,在低pH下,ZEN的中性形态和细胞壁的疏水作用主导吸附;在高pH下,ZEN的离子化及静电排斥导致吸附能力下降[24]。这一现象为ZEN的生物吸附剂开发提供了重要理论依据。
与中性相比,酸性、碱性条件下,YH0、YH5对DON的脱除率变化均不明显。原因在于DON几乎无疏水区域。DON的吸附主要依赖其羟基与酵母细胞壁多糖(如β-葡聚糖、甘露聚糖)的羟基之间的氢键作用,以及分子间作用力(如范德华力),这些作用力受pH影响较小。综上,与DON相比,ZEN的脱除效果受pH影响较大,但在胃道(强酸性)均能够较好吸附ZEN和DON。当pH分别为4.5、9.5时对ZEN、DON的脱除率最大,分别为85.48%、92.95%。
2.5 YH0和YH5吸附前后的FTIR分析
ZEN和DON标准品的FTIR光谱见图5A。由图5A可知,峰值在波数3 311.9~3 333.4 cm-1范围内出现的吸收峰是由于O-H伸缩振动;峰值在波数2 885.1~2 953.3 cm-1范围内出现的吸收峰是由于C-H伸缩振动;波数1 694.2 cm-1处为ZEN环酮中羰基C=O的吸收峰,波数1 648.8 cm-1、1 617.1 cm-1为酯键内C=O振动峰,C=O的吸收峰由于共轭所以向低波位移动;波数1 682.5 cm-1处为DON羰基环酮中C=O的吸收峰[25]。分别对YH0、YH5吸附ZEN和DON前后样品进行红外光谱分析,结果见图5B~图5F。由图5B~图5F可知,峰值在波数3 682.3~3 302.1 cm-1范围内出现的吸收峰是由于O-H的伸缩振动;峰值在波数2 925.5~2 928.1 cm-1范围内出现的吸收峰是由于C-H的伸缩振动;峰值在波数1 648.2~1 656.2 cm-1范围内出现的吸收峰是由于-CONH2中C=O的伸缩振动;峰值在波数1 537.6~1 542.9 cm-1范围内出现的吸收峰是由于C=C伸缩振动;峰值在波数1 398.1~1 405.9 cm-1范围内出现的吸收峰是由于C-H弯曲振动;峰值在波数1 045.2~1 047.8 cm-1范围内出现的吸收峰是由于C-O-C伸缩振动,是多糖的特征吸收峰[11,26]。
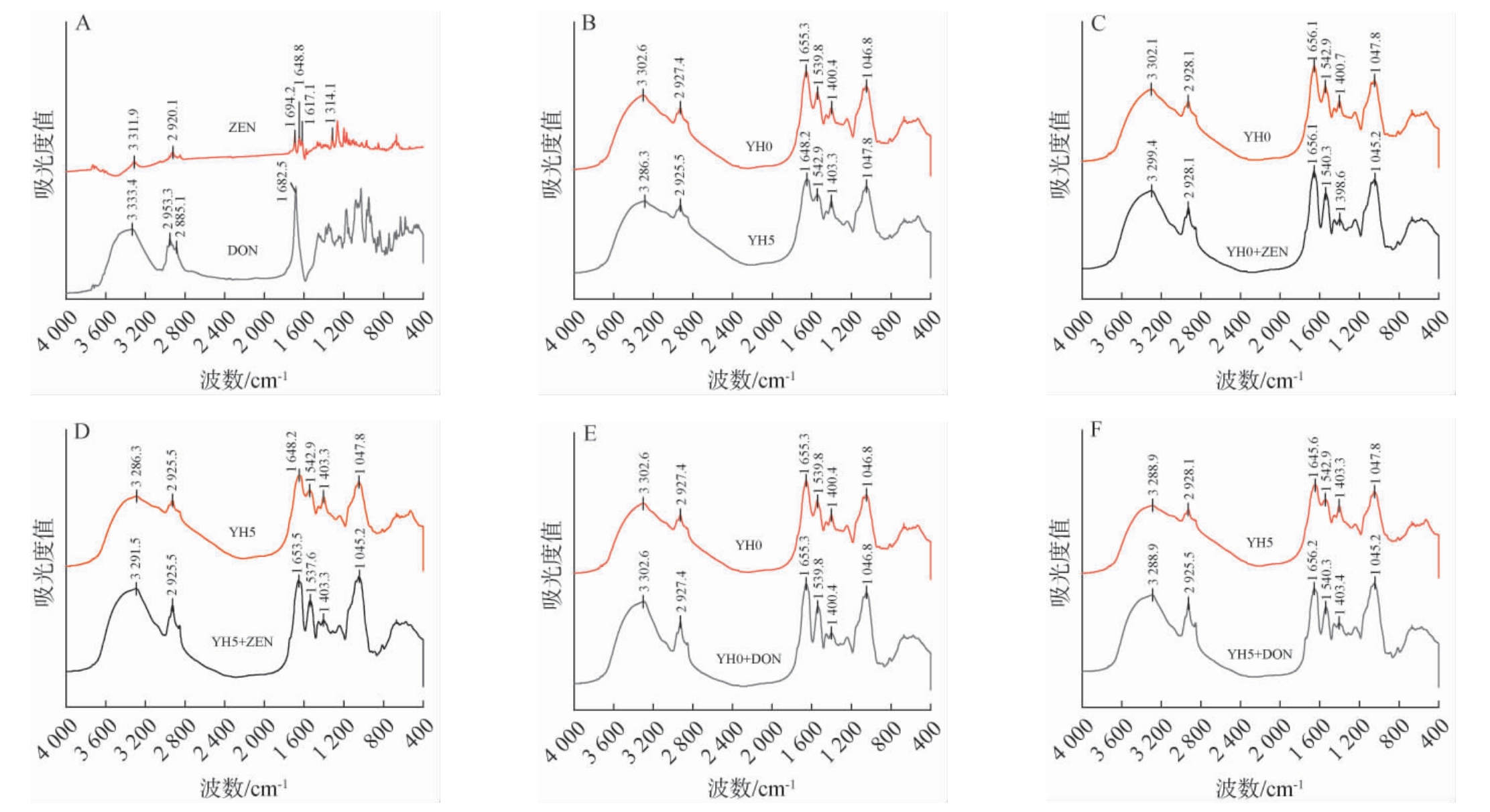
图5 YH0和YH5对玉米赤霉烯酮和呕吐毒素吸附前后的FTIR图谱
Fig.5 FTIR spectra of YH0 and YH5 before and after adsorption of ZEN and DON
由图5B可知,YH0和YH5含有羟基、吡喃环及酰胺基等基团。其中,YH0酰胺基含量较高,推测可能大量糖蛋白分布在酵母细胞壁最外层,这种结构赋予了甘露糖蛋白多种生物学活性,如免疫调节、抗氧化、吸附霉菌毒素等[27]。由图5C~图5F可知,除了波数1 398.1~1 405.9 cm-1的吸收峰之外,YHs吸附真菌毒素后的谱图标峰所在的峰面积均显著增加,这是由于ZEN和DON含有-OH、C=C、C=O、C-O-C。此外,对于DON吸附前后-CONH2中C=O所在峰形和峰位发生明显的变化,结合图4中不同pH条件下YHs对DON吸附效果的影响,表明在吸附的过程中有氢键形成。
2.6 体外静态模拟消化实验YH0和YH5对ZEN和DON的吸附效果
由于机体消化系统是复杂的,除了胃液具有低pH之外,口腔和肠道还分布有大量的酶,这关系到真菌毒素被摄入体内后与吸附剂结合形成吸附剂-毒素复合体能否稳定。通过在体外静态条件下,模拟了YHs在猪体内对ZEN和DON的吸附效果,结果见图6。
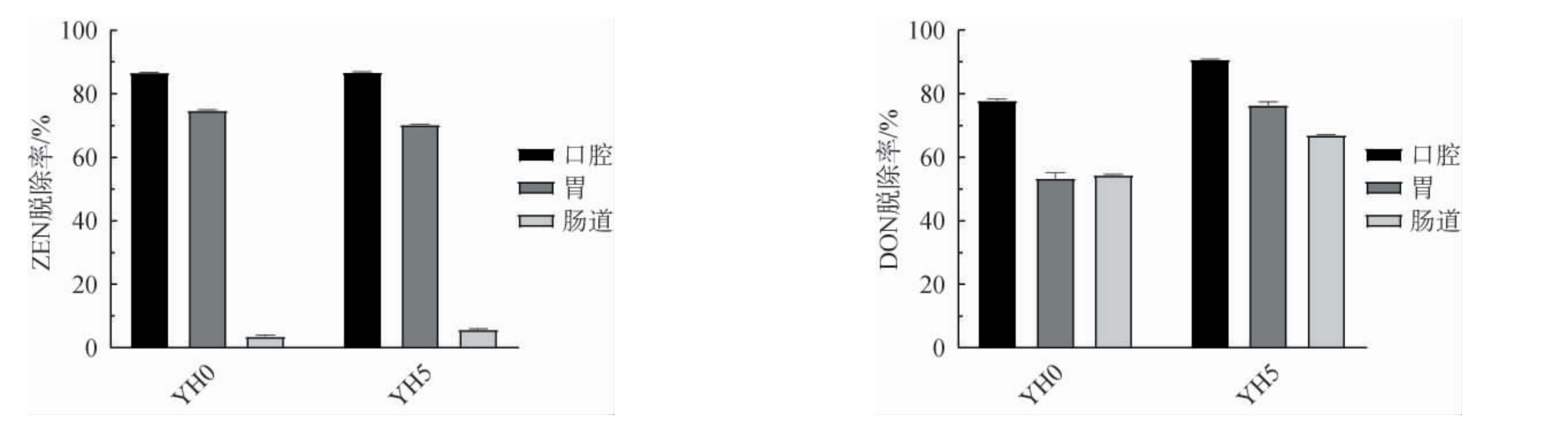
图6 YYH0和YH5对真菌毒素的体外静态模拟消化实验结果
Fig.6 In vitro static simulation digestion experiment results of YH0 and YH5 on fungal toxins
由图6可知,YH0-ZEN和YH5-ZEN复合体在口腔环境和胃的酸性环境中稳定存在,随着食物进入肠道,由于解吸附作用几乎全部被释放。与YH0类似,YH5对ZEN的脱除率在胃液为72.45%,到达肠道仅为4.28%,未能实现有效脱除,这是因为猪胆盐具有良好的表面活性和乳化性能,破坏了疏水作用力,将脂溶性ZEN分散到液体环境,从YHs的细胞壁上释放出来;而YH0-DON和YH5-DON复合体在口腔环境和胃的酸性环境中稳定存在,随着食物进入肠道,由于基质复杂极少部分被解吸附,可以实现有效脱除。
3 结论
酵母水解物作为一种天然的微生物吸附剂,是通过控制自溶时间、酶解时间以及辅以机械破壁的方式将酵母细胞的水解而制备,因其无生命活性而具有良好的生物相容性和安全性。YHs在食品和饲料中的应用不仅可以有效脱除真菌毒素,还能额外提供营养成分(如氨基酸、B族维生素等)。本文开展了不同水解程度、不同添加量的YHs及在不同pH条件下对ZEN和DON的吸附效果。结果表明,与ZEN相比,DON的脱除效果受YHs的水解程度影响较大;随着YHs添加量的增加,毒素的脱除率增加;与DON相比,ZEN的脱除效果受pH影响较大;其中YH5添加量为20 mg/mL,pH分别为4.5、9.5时对ZEN、DON的脱除率最大,分别为85.48%、92.95%。结合红外光谱进一步分析可得,ZEN主要通过疏水作用与YHs细胞壁外侧的甘露聚糖结合,DON则主要通过氢键与YHs结合。体外静态模拟消化实验结果表明,YHs能够在体内有效吸附DON,但对ZEN的吸附效果有限,无法实现体内有效脱除。
[1]KANG F,GE Y,HU X,et al.Understanding the sorption mechanisms of aflatoxin B1 to kaolinite, illite, and smectite clays via a comparative computational study[J].J Hazard Mater,2016,320:80-87.
[2]LUO Y, LIU X, LI J.Updating techniques on controlling mycotoxins-A review[J].Food Control,2018,89:123-132.
[3]王丹,胡小风,王督,等.小麦中玉米赤霉烯酮高灵敏智能POCT技术研究[J].河南工业大学学报(自然科学版),2023,44(3):34-41.
[4]LV Q,XU W, YANG F, et al.Reproductive toxicity of zearalenone and its molecular mechanisms:A review[J].Molecules,2025,30(3):505.
[5]XU J,SU S,SONG X,et al.A simple nanocomposite photocatalyst HTrGO/TiO2 for deoxynivalenol degradation in liquid food[J].Food Chem,2023,408:135228.
[6]邓诣群,林如琴,吴思婷,等.呕吐毒素的毒理机制及防治策略研究进展[J].华南农业大学学报,2022(6):87-96.
[7]邹诗祺,宋佳,曹清明,等.呕吐毒素的危害及脱毒研究进展[J].饲料工业,2024(3):127-135.
[8]MA C G, WANG Y D, HUANG W F, et al.Molecular reaction mechanism for elimination of zearalenone during simulated alkali neutralization process of corn oil[J].Food Chem,2020,307:125546.
[9]李圆圆.Zn基光催化材料降解DON研究[D].牡丹江:牡丹江师范学院,2024.
[10]FANG J, LU J, ZHAO X, et al.Zearalenone removal using inactivated yeast embedded in porous modified yam starch aerogels and its application in corn silk tea[J].Food Chem,2024,460:140593.
[11]ZHAO Z,LI Y,ZHAI W,et al.Highly efficient adsorption and degradation of zearalenone by Fe single-atom N-doped porous carbon:Degradation mechanisms and pathways[J].Mater Today Commun, 2025, 43:111601.
[12]ZHANG Y, OUYANG B, ZHANG W, et al.An overview of chemical,physical and biological methods for zearalenone elimination: Recent advances and future prospective[J].Food Control,2023,154:110011.
[13]尹鹏,杨芸芸,赵一凡,等.基于BP人工神经网络的酿酒酵母发酵培养基优化及其水解物对真菌毒素吸附研究[J].中国粮油学报,2023,38(8):206-212.
[14]赵萌,高婧,褚华硕,等.黄曲霉毒素B1的分子致毒机理及其微生物脱毒研究进展[J].食品科学,2019,40(11):235-245.
[15]张雪娇.酵母水解物在畜禽饲料和水产饵料中的应用效果[J].新农业,2023(17):53-54.
[16]孟晓,李景明,杨丽丽,等.农产品中真菌毒素的微生物脱除研究进展[J].中国食品学报,2023(4):435-450.
[17]白玉峰,张文霞,田亚楠,等.宁夏贺兰山东麓降L-苹果酸葡萄酒酵母的筛选[J].中国酿造,2021,40(1):49-54.
[18]徐栋,王春维.高压均质与酶法破碎酵母细胞壁的工艺条件研究[J].饲料工业,2009,30(12):44-47.
[19]徐智鹏,陈毛清,曹诗国,等.高蛋白酵母水解物生产菌株的筛选研究[J].中国饲料,2020(3):115-118.
[20]BRODKORB A,EGGER L,ALMINGER M,et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nat Protoc,2019,14(4):991-1014.
[21]NOBRE C,GONZÁLEZ A,LOSOYA C,et al.Detoxification of ochratoxin A and zearalenone by Pleurotus ostreatus during in vitro gastrointestinal digestion[J].Food Chem,2022,384:132525.
[22]LUO Y,LIU X,YUAN L,et al.Complicated interactions between bioadsorbents and mycotoxins during mycotoxin adsorption: Current research and future prospects[J].Trends Food Sci Tech,2020,96:127-134.
[23]康玉茹,牟斌,朱永峰,等.离子液体表面活性剂改性凹凸棒石去除玉米赤霉烯酮[J].硅酸盐学报,2024(10):3170-3179.
[24]施晶晶,何贝贝,刘宽博,等.真菌毒素吸附剂开发及吸附效果评价方法研究进展[J].粮油食品科技,2022,30(3):177-185.
[25]钟凤.重组ZEN降解酶A4-Prx的纯化、酶学特性和降解产物初步研究[D].广州:华南理工大学,2015.
[26]成建国,张善飞,张利,等.酵母细胞壁多糖分子量分布和结构的初步分析[J].食品工业科技,2012(12):143-146.
[27]盛周煌,陈智仙,张彦.酵母甘露糖蛋白的研究进展[J].合成生物学,2025,6(2):408-421.