酵母类菌株在益生菌领域中扮演着重要角色,其中布拉迪酵母(Saccharomyces boulardii)是一种备受关注的益生菌。研究表明,它能够通过多种机制维持肠道健康,包括抑制病原菌的生长、增强肠道屏障功能以及调节免疫反应[1]。益生菌由于对生存环境的要求较苛刻而导致其在食品等领域应用上的局限。后生元(postbiotics)是一个在食品科学和健康领域逐渐受到关注的概念。目前许多研究表明,灭活的益生菌及其代谢产物也具有为宿主健康提供益处的能力[2]。酵母源后生元作为一种新兴的健康促进剂,受到了广泛的关注,尤其是布拉迪酵母源后生元。它们不仅能够改善肠道健康,还对免疫系统和代谢健康产生积极影响。随着研究的深入,布拉迪酵母源后生元在食品及营养补充剂中的应用潜力将会进一步被发掘,为人类健康带来新的机遇。
本文基于国内外后生元研究动态和应用现状,对布拉迪酵母源后生元的主要活性成分及益生功能进行了阐述,总结了国内外后生元的研究进展,旨在为后生元的理论研究和商业化应用提供参考。
1 布拉迪酵母
布拉迪酵母(Saccharomyces boulardii)是广泛应用在临床治疗中且具有益生作用的真菌种类[3],属于酿酒酵母属中的一个特殊亚种,其在遗传学上与常见的酿酒酵母(Saccharomyces cerevisiae)(模式酵母)拥有相似的核型,但布拉迪酵母展现出的一些独特的性状使其在生理和代谢方面与酿酒酵母存在显著差异[4]。并且这些独特的生理性状使其能更好地适应宿主环境,并被用于维护胃肠道健康。
1.1 布拉迪酵母的生物学特性
布拉迪酵母的菌落呈白色或奶白色,圆形,凸出,且表面平滑,其初生菌体形状为椭圆形[5]。布拉迪酵母属于酿酒酵母,利用脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)等手段进行的分子分型研究表明,不同来源的布拉迪酵母株都属于酿酒酵母种内的一个明确划分的簇,属于同一物种的不同菌株[6]。同样,一项脱氧核糖核酸(deoxyribonucleic acid,DNA)/核糖核酸(ribonucleic acid,RNA)杂交斑点微阵列研究也证实,布拉迪酵母是失去了所有完整Ty1/2元件的酿酒酵母菌株[7]。与酿酒酵母相比,布拉迪酵母不能产生孢子[8],不能转为单倍体,也不能使用半乳糖作为碳源[9],对温度和酸性胁迫的抵抗力较强,但对胆盐的抵抗力较弱[10]。如表1所示,布拉迪酵母和酿酒酵母相似但不同。EDWARDS-INGRAM L等[11]研究发现,布拉迪酵母和酿酒酵母基因组差异主要集中在三条染色体上:染色体Ⅰ(基因PRM9、MST28、YAR047C、YAR050W、CUP1、YAR047C、CUP1、YAR050W、Yar060W和Yar061W)、染色体Ⅱ(基因YGL052W和MST27)和染色体Ⅲ(基因ASP3和YLR156W)。这些基因的不同为两者之间性状的差异提供了合理的解释。
表1 布拉迪酵母和酿酒酵母的生物学特性
Table 1 Biological characteristics of Saccharomyces boulardii and Saccharomyces cerevisiae
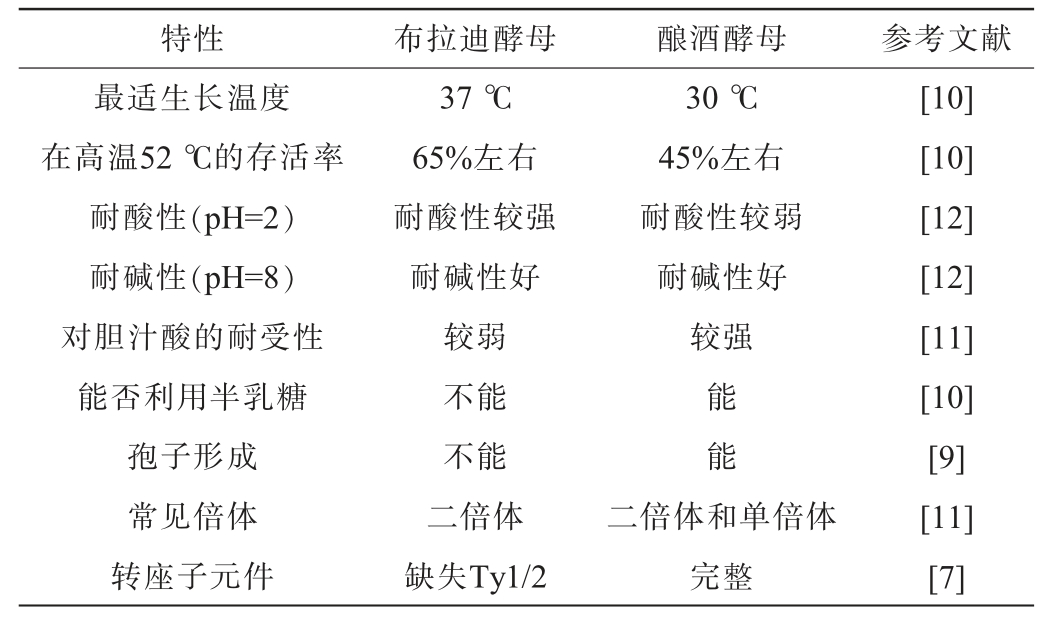
特性 布拉迪酵母 酿酒酵母 参考文献最适生长温度在高温52 ℃的存活率耐酸性(pH=2)耐碱性(pH=8)对胆汁酸的耐受性能否利用半乳糖孢子形成常见倍体转座子元件37 ℃65%左右耐酸性较强耐碱性好较弱不能不能二倍体缺失Ty1/2 30 ℃45%左右耐酸性较弱耐碱性好较强能能二倍体和单倍体完整[10][10][12][12][11][10][9][11][7]
1.2 布拉迪酵母在机体内的作用机制
1.2.1 维护肠道菌群平衡
布拉迪酵母能够调节肠道菌群的结构和功能,增加益生菌的数量和多样性,调节肠道微生物产生的代谢物。如:布拉迪酵母已被证明能改变短链脂肪酸(short-chain fatty acids,SCFAs)的产生[13],最直接的影响是与SCFAs生产相关的细菌增加,主要是毛螺菌科(Lachnospiraceae)和瘤胃球菌科(Ruminococcaceae),其次也增加了拟杆菌科(Bacteroidaceae)和普雷沃菌科(Prevotellaceae)的丰度[14],从而改善肠道环境,有效调节肠道菌群的组成和功能。布拉迪酵母和低聚果糖联合使用可显著增加结肠炎小鼠的有益菌丰度,如乳酸杆菌属(Lactobacillus)和双歧杆菌属(Bifidobacterium)[15]。此外,口服布拉迪酵母CNCM I-745不会对健康宿主的肠道菌群产生影响[16-17],但对于进行抗生素处理过的小鼠或其他疾病模型小鼠(溃疡性结肠炎[18]、免疫力低下[19]、糖尿病[20]、肝损伤[21]等),布拉迪酵母可促进失调的肠道菌群恢复,并增加肠道菌群的多样性。研究发现,布拉迪酵母通过降低变形杆菌属(Proteus)和埃希氏-志贺氏菌属(Escheria-Shigella)的丰度,显著增加糖尿病小鼠的C肽分泌,并降低了血糖[20]。在D-半乳糖诱导的小鼠肝损伤模型中,经口灌胃布拉迪酵母后,小鼠肠道中拟杆菌门(Bacteroidota)相对丰度显着增加,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)相对丰度降低,布拉迪酵母通过调节肠道菌群减轻小鼠肝损伤[21]。并且KELLY C P等[22]研究证实,布拉迪酵母CNCM I-745在健康志愿者抗艰难梭酸菌(Clostridioides difficile)感染治疗期间能调节粪便胆汁酸代谢。ROSTOLL C L等[23]研究发现,布拉迪酵母可加速肠道微生物群成熟,其机制与新生奶牛肠道分泌型刺激免疫球蛋白(immunoglobulin A,IgA)水平增加相关。
1.2.2 调节肠道屏障功能
布拉迪酵母能够增强肠道屏障的功能,维持肠道黏膜的完整性,增加黏液的产生,调节黏膜免疫系统的功能。在葡聚糖硫酸钠诱导的结肠炎小鼠模型的研究中发现,布拉迪酵母能通过降低炎症因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-8(interleukin-8,IL-8)水平,提高紧密连接蛋白-1(zonula occludens-1,ZO-1)和紧密连接组分闭合蛋白(occludin)水平,从而发挥抗炎和修复肠屏障的功能[24]。在体外实验中培养并收集布拉迪酵母上清可抑制艰难梭菌毒素A[25],布拉迪酵母的代谢物还能诱导结肠癌caco-2细胞凋亡,并抑制结肠癌细胞中生存素、IL-8和核转录因子(nuclear transcription factor-κB,NFκB)基因的表达[26]。此外,布拉迪酵母培养物的上清液能抑制白细胞介素-1β(interleukin-1β,IL-1β)和毒素A诱导的NCM 460细胞中细胞外调节蛋白激酶(extracellular regulated protein kinases 1/2,Erk 1/2)和c-Jun氨基末端激酶应激活化蛋白激酶(c-Jun N-terminal kinase/stress-activated protein kinase,JNK/SAPK)的活化。布拉迪酵母除了能抑制促炎细胞因子IL-8的合成外,还具有促进NFκB的核转位的能力。CHEN X等[27]报道,布拉迪酵母通过抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)ERK 1/2和JNK/SAPK的活化,减少IL-8的产生。有研究表明,布拉迪酵母菌BR14能通过显著降低TNF-α和白细胞介素-6(interleukin-6,IL-6)的表达水平、升高白细胞介素-10(interleukin-10,IL-10)的表达水平改善肠道屏障,缓解葡聚糖硫酸钠诱导的小鼠结肠炎[28]。口服布拉迪酵母菌、热灭活的布拉迪酵母菌和布拉迪酵母菌的β-葡聚糖还可以增加紧密连接蛋白(闭合蛋白和ZO-1)的水平,降低TNF-α、IL-1β和IL-6的水平,并抑制结肠中TNF-α、IL-1β和IL-6信使核糖核酸(messenger ribonucleic acid,mRNA)的表达[29]。
1.2.3 抗病原活性
布拉迪酵母与肠道致病微生物的相互作用和对肠粘膜的影响是其抗病原活性主要作用靶点和可能的作用机制。布拉迪酵母能够抑制多种病原菌的生长,主要通过与病原菌竞争营养物质和附着位点,吸附病原菌,以及产生抗菌物质等方式实现。分泌型免疫球蛋白A(secretoryimmunoglobulin,sIgA)释放是肠道中抵抗病原体的第一道防线。体内研究表明,布拉迪酵母能够降低幽门螺杆菌负荷,减少胃内炎性因子和趋化因子的表达,并增加小肠内抗幽门螺杆菌的IgA和sIgA产生[17]。有研究发现,服用布拉迪酵母可预防与抗生素有关的腹泻和复发性艰难梭菌结肠炎[30],并且在显微镜下观察到,受布拉迪酵母保护的动物肠道病变减轻[29,31]。此外,布拉迪酵母的保护作用与艰难梭菌的肠道浓度和其分泌的毒素A或毒素B的水平相关(图1)。BUTS J P等[32]研究结果显示,布拉迪酵母菌在体内能分泌一种分子质量为63 kDa的蛋白酶,该酶可以破坏致病大肠杆菌的内毒素。其他研究发现,布拉迪酵母通过阻断MAPk ERk1/2的激活来抑制毒素A相关的肠炎。同时布拉迪酵母可以通过调节肠道上皮细胞的连接蛋白,降低肠道的通透性,减少病原微生物和有害物质的渗透,保护肠道黏膜免受侵害。
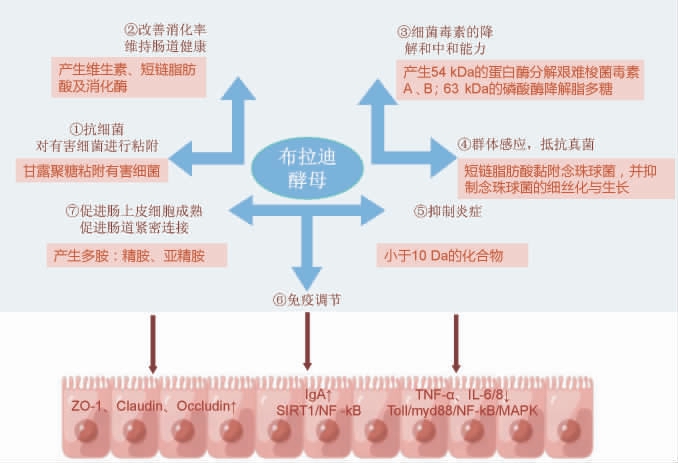
图1 布拉迪酵母在机体内的作用机制
Fig.1 Action mechanism of Saccharomyces boulardii in the body
布拉迪酵母也可产生具有抗菌活性的物质,如抗生素样分子和酸性物质,从而直接对病原体产生抑制作用。这些抗菌物质可以破坏病原体的细胞壁或干扰其代谢途径,导致病原体死亡或生长受抑。TOMICˇIC′ R等[33]研究发现,在与白色念珠菌(Candida albicans)共培养且数量相当的情况下,布拉迪酵母表现出显著的抑菌效果;当布拉迪酵母与白色念珠菌数量相当时,白色念珠菌的黏附能力降低了50%;当布拉迪酵母的浓度是白色念珠菌的10倍时,甚至无法检测到白色念珠菌的黏附。其对白色念珠菌的抑制作用主要体现在两个方面:一方面是通过降低白色念珠菌的丝状化来减少生物膜的形成;另一方面是酵母菌分泌的代谢物具有抗黏附性,从而阻止白色念珠菌黏附在细胞表面,这是其发挥抑制作用的关键因素(图1)。在生物膜形成的早期阶段,布拉迪酵母菌的抑制作用尤为显著,而且其活菌及培养液提取物也可降低生物膜的厚度。
1.2.4 免疫调节活性
布拉迪酵母能调节宿主的免疫反应,增强宿主对病原菌的抵抗能力,抑制炎症反应,并促进肠道黏膜屏障的修复(图1)。研究表明,布拉迪酵母能通过靶向特定的Toll样受体和相关因子,调节鸡骨髓来源树突状细胞,从而诱导宿主的免疫反应[34]。布拉迪酵母通过增加小肠中γ干扰素(interferon-γ,IFN-γ)基因的表达,降低IL-10基因的表达;提高盲肠中IFN-γ和IL-10的mRNA水平,从而介导鼠伤寒沙门氏菌沿消化道向脾脏和肝脏的易位减少和宿主的免疫反应[35]。酵母来源的β-葡聚糖可通过影响中性粒细胞和巨噬细胞的炎症反应和抗菌活性来帮助宿主抵抗感染。有研究发现,酵母细胞壁成分可通过树突状细胞中的Dectin1-Cox2信号轴,促进初始T细胞转化为调节性T细胞,与此同时还可通过抑制IFN-γ的表达,抑制效应T细胞的辅助性T淋巴细胞分化来调节免疫功能[36]。
1.2.5 营养作用
除了上述活性外,布拉迪酵母还可通过其类物质及自身微量元素,如代谢蛋白酶和多胺等在人体内的释放提高相应酶的活性,从而促进蛋白的消化吸收,发挥营养作用(图1)。研究发现,布拉迪酵母可分泌多种不同的消化酶,在宿主肠道感染或炎症等条件下,这些酶的活性在肠道内被认为可能是有利的[37]。布拉迪酵母对人类和大鼠小肠细胞具有一定的营养效应,口服布拉迪酵母冻干制剂能够刺激人类和大鼠肠细胞刷状缘膜(brush border membrane,BBM)酶,BBM因其含有消化酶和蛋白转运酶是碳水化合物最终消化以及营养和水分吸收的场所[37]。此外,布拉迪酵母CNCM I-745能分泌一种灭活梭状芽孢杆菌毒素A和B的蛋白酶,该酶对多种回肠刷状缘蛋白和高铁血红蛋白也有作用[32]。此外,布拉迪酵母菌CNCM I-745能分泌一种碱性磷酸酶,该酶可通过去磷酸化作用使大肠杆菌脂多糖失活[38]。上述研究表明,布拉迪酵母可能通过增加消化酶的活性发挥其对小肠黏膜的营养作用。布拉迪酵母的另一个营养效应是多胺[39]。在补充冻干的布拉迪酵母的大鼠空肠黏膜中测得的亚精胺和精胺浓度分别比对照组增加了21.4%和21.9%[40]。在一项临床实验中发现,布拉迪酵母作为能产多胺的酵母,可以通过抑制肠道细菌的生长和增强胃肠功能促进早产儿肠道成熟[41]。
2 后生元
“后生元”(postbiotics)的概念是在益生菌(probiotics)和益生元(prebiotics)之后提出的,是一种新兴的健康产品。2021年,国际益生菌和益生元科学协会(International Scientific Association for Probiotics and Prebiotics,ISAPP)将“后生元”定义为对宿主健康有益的无生命微生物和/或其成分的制剂[42]。主要包括:灭活微生物、微生物裂解物、微生物细胞成分、微生物代谢物等多种形式。
后生元在肠道健康、免疫调节、病原菌抑制和炎症反应降低等方面具有潜在的健康效益。主要具有以下几点优势:①后生元的最主要优势是稳定性高。与需要在特定温度和湿度条件下存储的活性益生菌相比,后生元不需要活菌就能产生健康效益,更稳定,储存和运输更方便[43]。同时后生元不含活菌,能避免二次污染,也可在不适合添加活性益生菌的产品中添加,这使其在食品和饮料工业中有更广泛的应用前景。②后生元的安全性也是其重要优势。它们不包含可能引起感染或过敏反应的活菌,使其对免疫功能低下或对某些菌群过敏的人群更为适用[44],避免使用益生菌时可能在体内产生抗生素抗性基因和毒力因子的问题[45]。③后生元的生物活性也是其优势之一。后生元包含的代谢物和细胞壁成分对宿主具有健康益处,有助于改善肠道健康、调节免疫系统、抑制病原菌生长、降低炎症反应等。尽管后生元具有上述优势,但其在科学研究和临床应用中仍面临一些挑战。关于后生元的研究还处于初级阶段,需要更多的科学研究来证实这些潜在的健康效益,并明确适用的剂量和使用方式。此外,对于后生元的定义和分类也尚未完全统一,这可能影响其在食品和药品监管中的定位和应用。
3 布拉迪酵母源后生元的应用
布拉迪酵母源后生元在维护肠道健康方面有重要作用。如灭活的酵母、酵母抽提物、酵母细胞壁成分和酵母代谢物(短链脂肪酸、多胺、消化酶、活性肽等),可作为肠道有益菌的营养源,调节肠道菌群,对维护肠道微生物的稳定性和多样性具有重要意义。另外,其在肠道免疫调节上的作用也不可忽视。研究发现,布拉迪酵母在大鼠小肠中可产生一种新型蛋白磷酸酶,该酶作为一种后生元有利于机体的营养消化[39]。布拉迪酵母CNCM I-745通过改变细胞外基质组成抑制艰难梭菌体外生物膜形成,该研究为艰难梭酸菌感染的患者提供新的治疗思路[46]。而且布拉迪酵母的细胞壁以及灭活的细胞成分能调节宿主的免疫反应,抑制艰难梭菌分泌毒素A[30]。布拉迪酵母还可减少抗生素相关腹泻、旅行者腹泻、急性腹泻、儿童腹泻的发生,其机制可能与其产生的后生元有关[47-49]。
3.1 在食品中的应用
3.1.1 饮料和功能性食品
由于后生元表现出的多种健康特性,常被用于功能性食品配料中。到目前为止,大多数后生元研究都是基于不同的乳杆菌菌株进行的[50]。在面包、啤酒、酒、酸奶、奶酪等产品的生产过程中,灭活的布拉迪酵母也是一种重要的食品工业配料。高压处理的啤酒中失活的布拉迪酵母,可减少乙醇的积累[51]。研究表明,使用布拉迪酵母发酵啤酒,其产生的代谢物能使啤酒具有浊度更低、更易于过滤、pH值低、防止腐败的优点[52]。此外,布拉迪酵母在啤酒中分泌的乙酸和癸酸能抑制大肠杆菌和白色念珠菌[53]。对比布拉迪酵母和植物乳杆菌发酵后的大豆酸奶的营养价值发现,两种酸奶中产生的B族维生素均有增加,但布拉迪酵母发酵后的酸奶显示出更好的安全特性以及对热、酸和碱胁迫的高耐受性,且布拉迪酵母发酵后的酸奶中总饱和脂肪酸减少,不饱和脂肪酸增加,抗氧化活性、酚酸和粗蛋白含量均较高,这与布拉迪酵母相关代谢物密不可分。因此,布拉迪酵母源后生元可被视为功能性乳制品的潜在候选材料[54]。
3.1.2 食品添加剂
布拉迪酵母源后生元——布拉迪酵母代谢物作为食品添加剂具有极大的应用前景。研究表明,布拉迪酵母发酵后的产物可以在较长时间内稳定食物基质的pH和酸度,从而对微生物的生长产生积极影响,促进益生菌的生存和繁殖[55]。在发酵乳制品中,布拉迪酵母产生的某种生物活性成分能抑制有害微生物的生长,从而减少食品腐败的风险,有效延长产品的保质期[56]。此外,布拉迪酵母发酵过程中产生的代谢物还可以提高乳制品的风味和口感,增加消费者的接受度。布拉迪酵母的风味成分主要来自其代谢过程中产生的多种化合物,如:δ-癸内酯、苯乙醇等,这些化合物在其代谢过程中通过不同途径合成,具有独特的香气和风味特性[57]。总而言之,布拉迪酵母发酵产生的风味物质在发酵食品中的应用潜力巨大,可以改善食品的风味、营养价值和安全性,并具有多种保健功能[58]。随着研究的深入,布拉迪酵母源后生元在食品工业中的应用将会越来越广泛。
3.1.3 食品包装
由于合成包装对环境的有害影响,食品制造业开发了有机包装材料,如可食用涂层材料,具有良好的气体保护能力,可延长食品保质期,并有可能含有抗氧化剂和抗菌化合物[59]。MOHAMMADI R等[60]利用后生元改善细菌纳米纤维素的抗菌性能,基于细菌纳米纤维素的抗菌包装材料开发抗菌膜,后生元以浓度依赖性方式在所有研究菌株中显示抗菌活性。研究表明,利用布拉迪酵母ATCC MYA-796和多糖的发酵产物开发的可食用涂层对羊肉具有保鲜效果,可有效地减少微生物的生长,延长肉类的保质期,保持羊肉良好的感官特性[61]。ABBASI A等[62]研究发现,掺入包含酵母发酵产生的细菌纤维素以及羧甲基纤维素和甘油而制成的酵母复合膜,表现出高水溶性(42.86%),且显示出对3种微生物菌株(包括大肠杆菌(Escherichia coli)、铜绿假单胞菌(Pseudomonas aeruginosa)和金黄色葡萄球菌(Staphylococcus aureus))的抗菌活性,能延长包装食品材料的保质期。
3.2 在药物上的应用
布拉迪酵母自20世纪50年代以来,一直被用作预防和治疗抗生素相关性腹泻的益生菌,并在炎症性肠病(in flammatory bowel disease,IBD)患者的试验研究中证实了其疗效[63]。布拉迪酵母源后生元在治疗肠道疾病、维持肠道健康领域也有极大的开发空间。研究发现,在治疗由葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎中,布拉迪酵母和布拉迪酵母源后生元(布拉迪酵母冻干粉和喷雾干燥粉)均能减轻结肠组织损伤,显著降低结肠炎模型动物血清中TNF-α、IL-6、IL-1β和结肠IL-1β的表达水平,修复肠屏障蛋白,调节肠道微生态的稳定性,从而减轻DSS诱导的结肠炎,且布拉迪酵母源后生元的治疗效果更好[64]。含有布拉迪酵母代谢产物粗混合物的食物具有抗癌、抗炎、抗氧化、抗白色念珠菌活性和增强肠道屏障的功能[65-66]。有研究表明,来自酿酒酵母和布拉迪酵母的培养上清液可逆转由应激刺激引起的肠蠕动紊乱的状态[67]。布拉迪酵母培养上清还表现出抗炎和抗氧化活性[68],还可加速伤口愈合和肠道屏障的再生[69]。布拉迪酵母细胞壁提取物可降低腹泻发生率,并增强肠粘膜的免疫应答[70]。上述研究表明,布拉迪酵母源后生元可能具有和益生菌相同甚至更强的生物活性,可作为极具治疗如结肠炎等疾病潜力的生物制剂。
4 布拉迪酵母源后生元应用的注意事项
大量研究表明,后生元具有免疫调节、治疗代谢性疾病、抗氧化、抗癌和改善肥胖等作用。随着食品工业的发展,后生元作为一种新兴的健康促进因素,可在食品和医药行业中安全地替代益生菌。它们不仅能提供多种健康益处,帮助预防各类疾病,更有可能实现治疗目的,提升生活品质。与其他生物制剂相比,后生元除易于运输、储存和操作方便外,还可延长货架期,这使得它们在制备、储存和运输过程中更具优势[71]。
除了关注后生元的生物活性等优势以外,其应用的安全性也是必须考虑的。在使用灭活嗜酸乳杆菌(Lactobacillus acidophilus)的婴儿随机对照试验中评估了后生元的负面影响,其与婴儿胃肠胀气、严重脱水和呕吐等反应间接相关性[72]。尽管布拉迪酵母后生元表现出良好的生物活性,但这些生物活性大多局限于体外或动物研究,并没有考虑宿主的药代动力学和药效学,所以布拉迪酵母源后生元对健康的益处必须得到临床证实[42]。
在制备后生元的方法中,可以直接通过外源添加微生物的代谢物或裂解物,也可通过热解、超声、高压处理或酶处理等方法使微生物失活,对整个灭活的微生物进行研究。所以灭活方式的选择必须结合现有生产工艺和成本等。此外,还需要进一步考虑感官和营养因素。微生物的大量自溶可能会释放出具有风味活性的代谢物,如肽、核苷酸和氨基酸,这些物质可以提高产品的口感和风味。然而,灭活的处理方式也可能导致抗氧化剂、多酚和维生素的损失[73],这就需要在处理过程中进行精细的调控,以保证产品的营养价值。
最后,在开发布拉迪酵母源后生元制剂的过程中,还要确定可被布拉迪酵母选择性利用的基质,确定布拉迪酵母源后生元是否可作为后生元配方,明确布拉迪酵母源后生元组分与整个粗提取物之间的功能差异,以及食品/药物基质和加工对布拉迪酵母源后生元产量和组成的影响。
5 结语
布拉迪酵母源后生元,在维护肠道健康、调节免疫系统等方面具有潜在的健康效益。尽管布拉迪酵母源后生元在食品和药物开发中具有应用潜力,但是其效果和安全性仍需要更多的科学研究来支持,还需要更多的科学证据和监管指导。此外,不同的人可能对布拉迪酵母源后生元具有不同的反应效果,因此在使用含有布拉迪酵母源后生元的食品或补充剂时,应考虑个体差异,并在必要时寻求医疗专业人士的建议。
总的来说,布拉迪酵母源后生元制剂作为一种新兴的健康产品,具有稳定性好、安全性高、生物活性强等优势,具有广泛的应用前景,未来或将被开发为具有特殊和有益生理效果的新型药理、治疗或食品产品。
[1]SEN S,MANSELL T J.Yeasts as probiotics:Mechanisms,outcomes,and future potential[J].Fungal Genet Biol,2020,137:103333.
[2]中国食品科学技术学会益生菌分会.后生元的研究现状及产业应用[J].中国食品学报,2022,22(8):416-426.
[3]BERNI C R,CUCCHIARA S,CUOMO R,et al.Saccharomyces boulardii:A summary of the evidence for gastroenterology clinical practice in adults and children[J].Eur Rev Med Pharmacol Sci,2011,15(7):809-822.
[4]VAN D A K A,JESPERSEN L.The taxonomic position of Saccharomyces boulardii as evaluated by sequence analysis of the D1/D2 domain of 26S rDNA,the ITS1-5.8S rDNA-ITS2 region and the mitochondrial cytochrome-c oxidase II gene[J].Syst Appl Microbiol,2003,26(4):564-571.
[5]HENNEQUIN C,THIERRY A,RICHARD G F,et al.Microsatellite typing as a new tool for identification of Saccharomyces cerevisiae strains[J].J Clin Microbiol,2001,39(2):551-559.
[6]MITTERDORFER G, MAYER H K, KNEIFEL W, et al.Clustering of Saccharomyces boulardii strains within the species S.cerevisiae using molecular typing techniques[J].J Appl Microbiol,2002,93(4):521-530.
[7]EDWARDS-INGRAM L C,GENT M E,HOYLE D C,et al.Comparative genomic hybridization provides new insights into the molecular taxonomy of the Saccharomyces sensu stricto complex[J].Genome Res,2004,14(6):1043-1051.
[8]KHATRI I,TOMAR R,GANESAN K,et al.Complete genome sequence and comparative genomics of the probiotic yeast Saccharomyces boulardii[J].Sci Rep,2017,7(1):371-382.
[9]MCFARLAND L V.Saccharomyces boulardii is not Saccharomyces cerevisiae[J].Clin Infect Dis,1996,22(1):200-201.
[10]UKASZEWICZ M. Saccharomyces cerevisiae var. boulardii-Probiotic Yeast[M].Brazil:São Paulo State University,2012:1-656.
[11]EDWARDS-INGRAM L, GITSHAM P, BURTON N, et al.Genotypic and physiological characterization of Saccharomyces boulardii,the probiotic strain of Saccharomyces cerevisiae[J].Appl Environ Microbiol,2007,73(8):2458-2467.
[12]FIETTO J L,ARAU′JO R S,VALADÃO F N,et al.Molecular and physiological comparisons between Saccharomyces cerevisiae and Saccharomyces boulardii[J].Can J Microbiol,2004,50(8):615-621.
[13]SCHNEIDER S M,GIRARD-PIPAU F,FILIPPI J,et al.Effects of Saccharomyces boulardii on fecal short-chain fatty acids and microflora in patients on long-term total enteral nutrition[J].World J Gastroenterol,2005,11(39):6165-6169.
[14]KAZ′MIERCZAK-SIEDLECKA K, RUSZKOWSKI J, FIC M, et al.Saccharomyces boulardii CNCM I-745:A non-bacterial microorganism used as probiotic agent in supporting treatment of selected diseases[J].Curr Microbiol,2020,77(9):1987-1996.
[15]WU Y,FU H,XU X,et al.Intervention with fructooligosaccharides,Saccharomyces boulardii, and their combination in a colitis mouse model[J].Front Microbiol,2024,15:1356365.
[16]LI Y, ALI I, LEI Z, et al.Effect of a multistrain probiotic on feline gut health through the fecal microbiota and its metabolite SCFAs[J].Metabolites,2023,13(2):228.
[17]CZERUCKA D,RAMPAL P.Diversity of Saccharomyces boulardii CNCM I-745 mechanisms of action against intestinal infections[J].World J Gastroenterol,2019,25(18):2188-2203.
[18]GAO H, LI Y, XU J, et al. Saccharomyces boulardii protects against murine experimental colitis by reshaping the gut microbiome and its metabolic profile[J].Front Microbiol,2023,14:1204122.
[19]LU Q,NIU J,WU Y,et al.Effects of Saccharomyces cerevisiae var.boulardii on growth, incidence of diarrhea, serum immunoglobulins, and rectal microbiota of suckling dairy calves[J].Livest Sci,2022,258:104875.
[20]ABREU I,ALBUQUERQUE R,BRANDÃO A B P,et al.Saccharomyces boulardii exerts renoprotection by modulating oxidative stress,renin angiotensin system and uropathogenic microbiota in a murine model of diabetes[J].Life Sci,2022,301:120616.
[21]YU L, ZHAO X K, CHENG M L, et al. Saccharomyces boulardii administration changes gut microbiota and attenuates D-galactosamine-induced liver injury[J].Sci Rep,2017,7(1):1359.
[22]KELLY C P,CHONG N C,PALMIERI L J,et al.Saccharomyces boulardii CNCM I-745 modulates the fecal bile acids metabolism during antimicrobial therapy in healthy volunteers[J].Front Microbiol,2019,10:336.
[23]ROSTOLL C L,VILLOT C,AMORIN-HEGEDUS R,et al.Saccharomyces cerevisiae boulardii accelerates intestinal microbiota maturation and is correlated with increased secretory IgA production in neonatal dairy calves[J].Front Microbiol,2023,14:1129250.
[24]DONG J,TENG G,WU T,et al.P865 The protective effect of Saccharomyces boulardii on intestinal mucosal barrier of inflammatory bowel disease[J].J Crohns Colitis,2018,12(supplement_1):S553-S555.
[25]POTHOULAKIS C.Review article: Anti-inflammatory mechanisms of action of Saccharomyces boulardii[J].Aliment Pharmacol Ther,2010,30(8):826-833.
[26]PAKBIN B,ALLAHYARI S,DIBAZAR S P, et al.Anticancer properties of Saccharomyces boulardii metabolite against colon cancer cells[J].Probiotics Antimicrob Proteins,2024,16(1):224-232.
[27]CHEN X,KOKKOTOU E G,MUSTAFA N,et al.Saccharomyces boulardii inhibits ERK1/2 mitogen-activated protein kinase activation both in vitro and in vivo and protects against Clostridium difficile toxin A-induced enteritis[J].J Biol Chem,2006,281(34):24449-24454.
[28]MU Z,YANG Y,XIA Y,et al.Probiotic yeast BR14 ameliorates DSSinduced colitis by restoring the gut barrier and adjusting the intestinal microbiota[J].Food Funct,2021,12(18):8386-8398.
[29]JIN Y,WU J,HUANG K,et al.Heat-killed Saccharomyces boulardii alleviates dextran sulfate sodium-induced ulcerative colitis by restoring the intestinal barrier, reducing inflammation, and modulating the gut microbiota[J].Nutrients,2024,16(5):702.
[30]QAMAR A,ABOUDOLA S,WARNY M,et al.Saccharomyces boulardii stimulates intestinal immunoglobulin A immune response to Clostridium difficile toxin A in mice[J].Infect Immun,2001,69(4):2762-2765.
[31]ZANELLO G,MEURENS F,BERRI M,et al.Saccharomyces boulardii effects on gastrointestinal diseases[J].Curr Issues Mol Biol,2009,11(1):47-58.
[32]BUTS J P, DE K N.Effects of Saccharomyces boulardii on intestinal mucosa[J].Dig Dis Sci,2006,51(8):1485-1492.
[33]TOMICˇIC′ R,TOMICˇIC′ Z,RASPOR P.Influence of culture conditions on co-aggregation of probiotic yeast Saccharomyces boulardii with Candida spp.and their auto-aggregation[J].Folia Microbiol, 2022, 67(3):507-515.
[34]RAJPUT I R,HUSSAIN A,LI Y L,et al.Saccharomyces boulardii and Bacillus subtilis B10 modulate TLRs mediated signaling to induce immunity by chicken BMDCs[J].J Cell Biochem,2014,115(1):189-198.
[35]PONTIER-BRES R, MUNRO P , LAURENT B, et al. Saccharomyces boulardii modifies Salmonella typhimurium traffic and host immune responses along the intestinal tract[J].Plos One,2014,9(8):e103069.
[36]LEE C,VERMA R,BYUN S,et al.Structural specificities of cell surface β-glucan polysaccharides determine commensal yeast mediated immunomodulatory activities[J].Nat Commun,2021,12(1):3611.
[37]MORÉ M I,VANDENPLAS Y.Saccharomyces boulardii CNCM I-745 improves intestinal enzyme function: A trophic effects review[J].Clin Med Insights Gastroenterol,2018,11:1179552217752679.
[38]BUTS J P,DEKEYSER N,STILMANT C,et al.Saccharomyces boulardii produces in rat small intestine a novel protein phosphatase that inhibits Escherichia coli endotoxin by dephosphorylation[J].Pediatr Res,2006,60(1):24-29.
[39]MORÉ M I.Saccharomyces boulardii CNCM I-745-the medicinal yeast improves intestinal enzyme function[J].MMW-Fortschr Med, 2019,161:20-24.
[40]BUTS J, KEYSER N D E, RAEDEMAEKER L D E. Saccharomyces boulardii enhances rat intestinal enzyme expression by endoluminal release of polyamines[J].Pediatr Res,1994,36(4):522.
[41]COSTALOS C,SKOUTERI V,GOUNARIS A,et al.Enteral feeding of premature infants with Saccharomyces boulardii[J].Early Hum Dev,2003,74(2):89-96.
[42]SALMINEN S,COLLADO M C,ENDO A,et al.The international scientific association of probiotics and prebiotics(ISAPP)consensus statement on the definition and scope of postbiotics[J].Nat Rev Gastroenterol Hepatol,2021,18(9):649-667.
[43]ZHONG Y J,WANG T,LUO R,et al.Recent advances and potentiality of postbiotics in the food industry: Composition, inactivation methods,current applications in metabolic syndrome,and future trends[J].Crit Rev Food Sci Nutr,2024,64(17):5768-5792.
[44]AGUILAR-TOALÁ J E, GARCIA-VARELA R, GARCIA H S, et al.Postbiotics:An evolving term within the functional foods field[J].Trends Food Sci Tech,2018,75:105-114.
[45]BRIAL F, LE L A, DUMAS M E, et al.Implication of gut microbiota metabolites in cardiovascular and metabolic diseases[J].Cell Mol Life Sci,2018,75(21):3977-3990.
[46]LACOTTE P A,SIMONS A,BOUTTIER S,et al.Inhibition of in vitro Clostridioides difficile biofilm formation by the probiotic yeast Saccharomyces boulardii CNCM I-745 through modification of the extracellular matrix composition[J].Microorganisms,2022,10(6):1082.
[47]ERDEVE O, TIRAS U, DALLAR Y, et al. Saccharomyces boulardii and antibiotic-associated diarrhoea in children[J].Aliment Pharmacol Ther,2005,21(12):1508-1509.
[48]LE N B, BRAZEILLES R, GUYONNET D, et al.Mo1322 Effect of a fermented milk product containing Bifidobacterium lactis CNCM I-2494 in patients with irritable bowel syndrome(IBS):A randomized,doubleblinded,placebo-controlled trial[J].Gastroenterol,2016,150(4):S697.
[49]MOUREY F,SUREJA V,KHENI D,et al.A Multicenter,randomized,double-blind,placebo-controlled trial of Saccharomyces boulardii in infants and children with acute diarrhea[J].Pediatr Infect Dis J,2020,39(11):e347-e351.
[50]YENENEH H,MARIT N,NAM V,et al.Postbiotic modulation of retinoic acid imprinted mucosal-like dendritic cells by probiotic Lactobacillus reuteri 17938 in vitro[J].Front Immunol,2016,7(1):96.
[51]SENKARCINOVA B,DIAS I A G,NESPOR J,et al.Probiotic alcoholfree beer made with Saccharomyces cerevisiae var.boulardii[J].LWTFood Sci Technol,2019,100:362-367.
[52]RAFAEL Z V,JOSEACUTE L M E S,JOSEACUTE V G L,et al.Development and characterization of a symbiotic cheese added with Saccharomyces boulardii and inulin[J].Afr J Microbiol Res, 2013, 7(23):2828-2834.
[53]ANNA M,ANNA K,PIOTR S,et al.Capric acid secreted by S.boulardii inhibits C.albicans filamentous growth,adhesion and biofilm formation[J].Plos One,2010,5(8):e12050.
[54]MEHAYA F M, EL-SHAZLY A I, EL-DEIN A N, et al.Evaluation of nutritional and physicochemical characteristics of soy yogurt by Lactobacillus plantarum KU985432 and Saccharomyces boulardii CNCMI-745[J].Sci Rep,2023,13(1):13026.
[55]TOMICˇIC′ Z,ŠARIC′ L,TOMICˇIC′ R.Novel insights in the application of probiotic yeast Saccharomyces boulardii in dairy products and health promotion[J].Foods,2024,13(18):2866.
[56]SADEGHI A,EBRAHIMI M,SHAHRYARI S,et al.Food applications of probiotic yeasts; focusing on their techno-functional, postbiotic and protective capabilities[J].Trends Food Sci Tech,2022,128:278-295.
[57]VILJOEN B C,HEARD G M. Saccharomyces|Saccharomyces cerevisiae[M].Oxford:Elsevier,1999:1918-1925.
[58]LAZO VÉLEZ M A,SERNA SALDÍVAR S O,ROSALES MEDINA M F,et al.Application of Saccharomyces cerevisiae var.boulardii in food processing:A review[J].J Appl Microbiol,2018,125(4):943-951.
[59]SAADAT Y R,KHOSROUSHAHI A Y,MOVASSAGHPOUR A A,et al.Modulatory role of exopolysaccharides of Kluyveromyces marxianus and Pichia kudriavzevii as probiotic yeasts from dairy products in human colon cancer cells[J].J Funct Food,2019,64:103675.
[60]MOHAMMADI R, MORADI M, TAJIK H, et al.Potential application of postbiotics metabolites from bioprotective culture to fabricate bacterial nanocellulose based antimicrobial packaging material[J].Int J Biol Macromol,2022,220:528-536.
[61]ATTA O M,MANAN S,AHMED A A Q,et al.Development and characterization of yeast-incorporated antimicrobial cellulose biofilms for edible food packaging application[J].Polymers,2021,13(14):2310.
[62]ABBASI A, SABAHI S, BAZZAZ S, et al.An edible coating utilizing Malva sylvestris seed polysaccharide mucilage and postbiotic from Saccharomyces cerevisiae var.boulardii for the preservation of lamb meat[J].Int J Biol Macromol,2023,246:125660.
[63]SIVANANTHAN K, PETERSEN A M.Review of Saccharomyces boulardii as a treatment option in IBD[J].Immunopharm Immunot,2018,40(6):465-475.
[64]XU X,WU J,JIN Y,et al.Both Saccharomyces boulardii and its postbiotics alleviate dextran sulfate sodium-induced colitis in mice, association with modulating inflammation and intestinal microbiota[J].Nutrients,2023,15(6):1484.
[65]DE M S, SICHETTI M, MURADYAN D, et al.Probiotic cell-free supernatants exhibited anti-inflammatory and antioxidant activity on human gut epithelial cells and macrophages stimulated with LPS[J].Evid Based Complement Alternat Med,2018,2018:1756308.
[66]PAKBIN B,PISHKHAN D S,ALLAHYARI S,et al.Probiotic Saccharomyces cerevisiae var.boulardii supernatant inhibits survivin gene expression and induces apoptosis in human gastric cancer cells[J].Food Sci Nutr,2021,9(2):692-700.
[67]BIAGI E, FRANCESCHI C, RAMPELLI S, et al.Gut microbiota and extreme longevity[J].Curr Biol,2016,26(11):1480-1485.
[68]ARUMUGAM M,RAES J,PELLETIER E,et al.Enterotypes of the human gut microbiome[J].Nature,2011,473(7346):174-180.
[69]OOKS M G,GARRETT W S.Gut microbiota,metabolites and host immunity[J].Nat Rev Immunol,2016,16(6):341-352.
[70]LIU M, LIU W, ZHANG W, et al.Ultrasound-assisted extraction of boulardii yeast cell wall polysaccharides:Characterization and its biological functions on early-weaned lambs[J].Food Sci Nutr,2021,9(7):3617-3630.
[71]ASIF A, AFZALL M, SHAHID H, et al.Probing the functional and therapeutic properties of postbiotics in relation to their industrial application[J].Food Sci Nutr,2023,11(8):4472-4484.
[72]MALAGÓN-ROJAS J N,MANTZIARI A,SALMINEN S,et al.Postbiotics for preventing and treating common infectious diseases in children:A systematic review[J].Nutrients,2020,12(2):389.
[73]MARSON G V,DE C R J S,BELLEVILLE M P, et al.Spent brewer's yeast as a source of high added value molecules: A systematic review on its characteristics,processing and potential applications[J].World J Microb Biot,2020,36(7):95.