睡眠是影响身心健康的关键因素,睡眠不足主要临床症状表现为入睡困难、入睡潜伏期长、易醒、早醒、睡眠质量下降和总睡眠时间减少[1]。长期睡眠不足会导致机体免疫力低下、精神或情绪障碍等,可能会诱发多种疾病[2],如代谢紊乱、免疫功能下降、认知功能降低、内分泌激素混乱等[3]。天麻(Gastrodia elata)为兰科植物天麻的干燥块根,在传统中医学领域,长期被用于辅助改善和治疗失眠 [4],如《金匮要略》中,有“天麻仁丸”方,用于治疗“失眠多梦,心悸不安”等症状[5]。灵芝(Ganoderma lucidum)为多孔菌科灵芝属真菌,具有安神宁心功效,常用于失眠的改善和治疗[6],《神农本草经》记载灵芝可“补肝气,安精魂”,《中华人民共和国药典》2020 版记载,灵芝具有“补气安神”功效,主治“心神不宁,失眠心悸”[7]。国家卫生健康委员会和国家市场监督管理总局联合发文正式将天麻、灵芝纳入按照传统既是食品又是中药材的物质目录(2023年第9号文件),为其在食品领域的合规使用提供了有效的依据,促进了天麻灵芝在食品领域的应用。
目前市场上流通的天麻灵芝多为干制品,消费者买到以后不知如何食用,一般只能用作烹饪炖汤使用,限制了天麻灵芝的销量,酵素作为一种现代加工食品,利用微生物将食品原料中的营养物质代谢转化[8],改变营养物质的结构以及含量,或者通过肠道菌群其对宿主生理代谢过程发挥作用[9],进而影响其吸收利用途径及效果[10]。近年来,国内研究发现天麻酵素具有抗氧化、抗抑郁、镇静、神经保护作用,林灵等[11]研究揭示了天麻酵素通过增加小鼠脑内的5-羟色胺(5-hydroxytryptamine,5-HT)、γ-氨基丁酸(γ-aminobutyric acid,GABA)和白细胞介素-1β(interleukinbeta,IL-1β)的含量及提高超氧化物歧化酶(superoxide dismutase,SOD)的活性,发挥镇静催眠的作用,GAO M等[12]研究发现,天麻发酵液通过调节单胺水平和BDNF/NMDAR通路来达到抗抑郁作用,WANG Y等[13]研究发现,发酵天麻可以通过调节小鼠的神经递质来缓解认知缺陷,从而达到神经保护作用。国外对于天麻灵芝的研究多集于活性成分的分离和鉴定以及其生物活性[14-15]。课题组前期通过酵素化发酵技术处理天麻,不仅能有效改善天麻不愉悦风味且更方便食用;而且能将天麻中较难利用的活性物质进行降解,还会生成丰富的小分子功能成分,更利于人体吸收与利用[16]。为拓展天麻灵芝的食用途径,进一步促进天麻灵芝在食品领域的应用,通过混菌发酵技术开发天麻灵芝酵素(fermented Gastrodia elata Blume and Ganoderma lucidum,FGEGL),并对其改善睡眠的健康属性进行评价研究,旨在为有睡眠问题的人群改善睡眠提供食疗方案,推动天麻灵芝在大健康食品领域的发展和应用。
1 材料与方法
1.1 材料与试剂
天麻、灵芝:贵州黔芝灵药业公司;对氯苯丙氨酸(pchlorophenylalanine,PCPA):美国Sigma公司;戊巴比妥钠;枣仁安神液:北京同仁堂股份有限公司;碳酸氢钠:昆明裕泰兴商贸有限责任公司;4%多聚甲醛固定液:武汉塞维尔生物科技公司;5-羟色胺(5-hydroxytryptamine,5-HT)试剂盒、γ-氨基丁酸(γ-aminobutyric acid,GABA)试剂盒、IL-1β试剂盒、NO试剂盒:上海瑞番生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒:南京建成生物工程研究所;脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:美国Omega Bio-Tek有限公司;NanoDrop 2000超微量分光光度计:美国Thermo Fisher Scientific公司。
食用植物发酵剂(葡萄酒酵母菌∶植物乳酸菌∶醋酸杆菌比例为1∶1∶1):贵州省天然产物研究中心自制;葡萄酒酵母BV818:安琪酵母股份有限公司;植物乳杆菌(Lactobacillus plantarum)PG-LPZ131:山东嘉城生物科技有限公司;巴氏醋杆菌(Acetobacter pasteurianus)(沪酿1.01):沂水锦润生物科技有限公司。
无特定病原体(specific pathogen free,SPF)ICR小鼠,雄性,体质量18~20 g:斯克贝斯生物科技股份有限(河南)公司,许可证号:SCXK(豫)2020-0005。
1.2 仪器与设备
KG-PB-936电子天平:北京赛多利斯仪器有限公司;VICTOR Nivo酶标仪:珀金埃尔默企业管理有限公司;Eppendorff 5430r高速离心机:艾本德(上海)国际贸易有限公司;Drop2000QL-901旋涡混合器:海门其林贝尔仪器制造有限公司;TG-18W高速离心机:济南爱来宝医疗科技有限公司。
1.3 方法
1.3.1 天麻灵芝酵素的发酵制备工艺

参照文献[17]的方法,挑选无破损的鲜天麻用清水清洗干净后自然晾干、称质量,将灵芝按照料液比1∶50(g∶mL)水煮后得到灵芝水提液。按照灵芝水提液与鲜天麻按照质量1∶1混合后进行打浆破碎,得到天麻灵芝混合液,按照混合液的质量添加8%白砂糖,0.3%纤维素酶搅拌均匀后,将食用植物酵素发酵剂(酵母菌∶乳酸菌∶醋酸杆菌的比例为1∶1∶1)采用温水活化后,按照0.5%的接种量进行接种发酵,控制发酵温度为35 ℃,恒温有氧发酵60 d,取上清液过滤后用于实验。
1.3.2 试验小鼠分组与造模
将60只ICR雄性小鼠随机分成6个组,每组10只,分别为:空白组(Control)、模型组(Model)、枣仁安神液组((阳性对照组)ZAS)、天麻灵芝酵素低剂量组(FGEGL-L)、天麻灵芝酵素中剂量组(FGEGL-M)和天麻灵芝酵素高剂量组(FGEGL-H),各组小鼠饲养于屏障级动物房,温度20~25 ℃,相对湿度50%~60%,且每12 h光照/黑暗循环交替的条件下适应性喂养一周,期间自由摄食和饮水。一周后除空白组外,其他组小鼠均腹腔注射对氯苯丙氨酸(PCPA)混悬液(450 mg/kg,阿拉伯胶水溶解,pH=7~8),1次/d,连续注射5 d,造模期间观察小鼠行为,与空白组相比,其他组小鼠出现昼夜节律失调,白天活动频繁,毛发杂乱,攻击性增大,体质量显著下降,大便灰白等显著的行为学改变,提示失眠模型造模成功。造模成功后,取天麻灵芝酵素用碳酸氢钠调节pH为6.78,根据酵素中天麻含量换算得到天麻灵芝酵素干物质含量,按照小鼠体质量设置高剂量组(1.13 g/kg),中剂量组(0.565 g/kg),低剂量组(0.285 g/kg)。各组别均按小鼠体质量0.1 mL/10 g给药,每日一次,连续灌胃14 d后进行镇静催眠功效测试。灌胃期间,每天对各组小鼠的精神状态、皮毛颜色、对外界的反应、摄食量、饮水量、有无死亡等进行观察并记录,每隔2 d称量并记录各组小鼠的体质量,分析各组小鼠体质量的变化情况。
1.3.3 戊巴比妥钠阀下剂量催眠试验
连续灌胃天麻灵芝酵素12d,各组小鼠腹腔注射30mg/kg戊巴比妥钠(该剂量为预实验确定小鼠戊巴比妥钠阈下剂量催眠剂量),30 min内,记录各组入睡小鼠数量,睡眠以翻正反射消失为指标,当小鼠置于背卧位时,会立即翻正身位,如超过1 min不能翻正者,即认为翻正反射消失,进入睡眠,并以入睡只数计算出小鼠入睡率(入睡率=入睡只数/小鼠总数×100%)。
1.3.4 延长戊巴比妥钠睡眠时间、睡眠潜伏期试验
连续灌胃天麻灵芝酵素13 d,灌胃30 min后,各组动物均腹腔注射剂量为50 mg/kg的戊巴比妥钠(该剂量由预试验引起100.00%小鼠睡眠的最小阈剂量测得),以翻正反射消失为依据,观察并记录各组小鼠的睡眠潜伏期及睡眠持续时间。从注射开始到翻正反射消失所用时间为睡眠潜伏期,记录各组小鼠睡眠潜伏期。腹腔注射戊巴比妥钠,以翻正反射消失和翻正反射恢复为指标,两者之间的时间为睡眠时间。
1.3.5 神经递质、炎症及氧化应激指标检测
灌胃第14天,将各组小鼠禁食12 h以上,眦静脉取全血,3 500 r/min分离血清用于NO、SOD、1L-1β含量检测。取血后脱臼处死小鼠,解剖取出各组小鼠脑组织、结肠及盲肠内容物,脑及海马组织用盐生理水冲洗中缝核后称质量并记录(部分海马组织用10%中性甲醛固定),部分海马组织加入质量分数10%的生理盐水,匀浆,在4 ℃、8 000 r/min条件下离心10 min,取上清液,用于测定5-羟色胺(5-hydroxytryptamine,5-HT)、γ-氨基丁酸(γ-aminobutyric acid,GABA)含量,5-HT、GABA的测定参照Elisa剂盒的操作步骤进行。
1.3.6 小鼠脑组织、结肠组织病理切片分析
取出备用的小鼠整体脑组织和结肠置于10 mL EP管中,并加入足量10%中性甲醛固定。各组小鼠脑组织和结肠均按病理检验SOP程序进行。脱水、修剪、包埋、切片、染色、封片等,镜检,采集图片。
1.3.7 肠道菌群分析检测
取出备用的盲肠内容物送美吉生物科技有限公司进行肠道菌群分析,采用E.Z.N.A.® Soil DNA Kit的DNA抽屉试剂盒对总DNA进行抽提,检测DNA浓度及纯度,并进行1%琼脂凝胶电泳,电压5 V/cm,时间为20 min DNA的完整性检测采用Illumina Miseq PE300平台(美国Illumina有限公司)对16S rRNA基因V3-V4高变区进行扩增和测序[17]。使用的引物是338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')。
1.3.8 数据处理与统计分析
使用GraphPad Prism5、Origin2022软件进行作图分析,SPSS 20.0软件分析数据,数据均以“平均值±标准差”表示,使用t检验进行两组间的对比,若P<0.05则显示组间差异有着统计学意义。
2 结果与分析
2.1 天麻灵芝酵素对小鼠体质量的影响
各组小鼠的体质量变化结果见图1。由图1可知,0~5 d为造模时间,5~20 d为灌胃时间。与空白组相比,造模5 d后各组小鼠体质量均下降且小鼠昼夜节律絮乱,皮毛蓬乱无泽,攻击性增强,白天不停走动,失眠而引起体质量下降。给药14 d后,各组小鼠体质量均上升,小鼠状态逐渐好转,白天活动减少,睡眠时间延长。
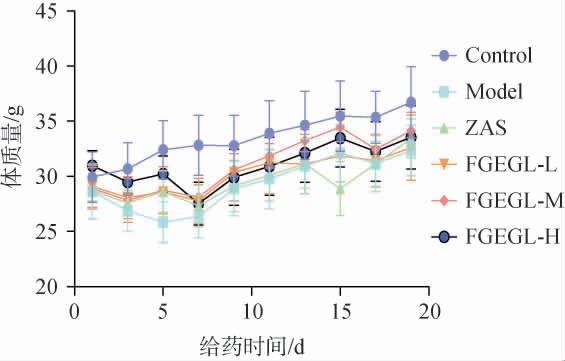
图1 各组小鼠体质量变化
Fig.1 Changes in body mass of mice in each group
2.2 天麻灵芝酵素对小鼠睡眠的影响
2.2.1 戊巴比妥钠阀下剂量对小鼠睡眠的影响
天麻灵芝酵素对戊巴比妥钠阈下剂量催眠试验30 min内睡眠动物数的影响见表1。由表1可知,天麻灵芝酵素各剂量组入睡小鼠只数与空白组和模型组比较显著增加(P<0.05),说明天麻灵芝酵素各剂量组能增加小鼠戊巴比妥钠阀下剂量入睡率。
表1 天麻灵芝酵素对小鼠戊巴比妥钠阈下剂量睡眠发生率的影响
Table 1 Effect of Gastrodia elata and Ganoderma lucidum Jiaosu on the incidence of sleep at subthreshold doses of pentobarbital sodium in mice
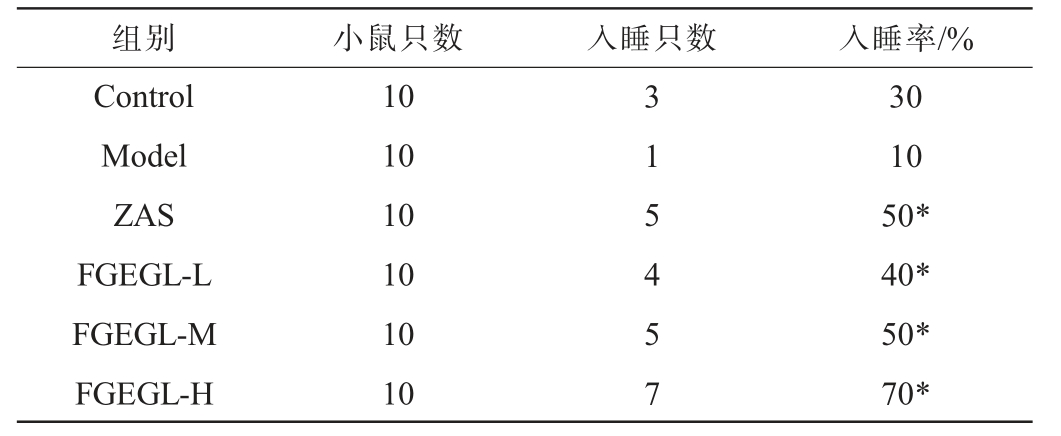
注:“*”表示与模型组比较,差异显著(P<0.05),下同。
组别 小鼠只数 入睡只数 入睡率/%Control Model ZAS FGEGL-L FGEGL-M FGEGL-H 10 10 10 10 10 10 3 1 5 4 5 7 30 10 50*40*50*70*
2.2.2 戊巴比妥钠诱导小鼠睡眠时间的影响
天麻灵芝酵素对小鼠睡眠潜伏期和睡眠时间的影响见表2。
表2 天麻灵芝酵素对小鼠巴比妥钠睡眠潜伏期和睡眠时间的影响
Table 2 Effect of Gastrodia elata and Ganoderma lucidum Jiaosu on barbiturate sodium sleep latency and sleep duration in mice
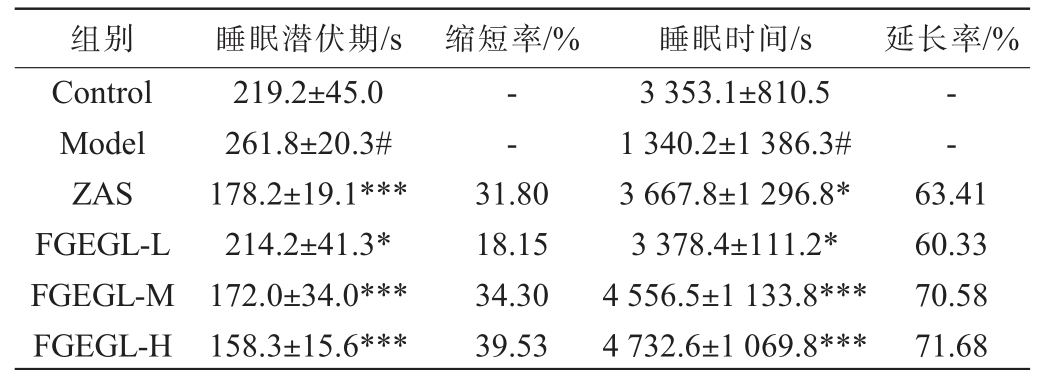
注:与空白组比较,“#”表示差异显著(P<0.05),“##”表示差异极显著(P<0.01),“###”表示差异高度显著(P<0.001);与模型组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01),“***”表示差异高度显著(P<0.001)。下同。
组别 睡眠潜伏期/s 缩短率/% 睡眠时间/s 延长率/%Control Model ZAS FGEGL-L FGEGL-M FGEGL-H 219.2±45.0 261.8±20.3#178.2±19.1***214.2±41.3*172.0±34.0***158.3±15.6***——31.80 18.15 34.30 39.53 3 353.1±810.5 1 340.2±1 386.3#3 667.8±1 296.8*3 378.4±111.2*4 556.5±1 133.8***4 732.6±1 069.8***63.41 60.33 70.58 71.68
由表2可知,与空白组比较,模型组的睡眠潜伏期显著延长(P<0.05),进一步表明PCPA失眠模型造模成功。与模型组相比,天麻灵芝酵素低、中、高剂量组睡眠潜伏期显著缩短(P<0.05),睡眠潜伏期缩短率分别为18.15%、34.30%、39.53%;在睡眠时间方面,天麻灵芝酵素低、中、高剂量组的睡眠时间均显著延长(P<0.05),睡眠时间延长率分别为60.33%、70.58%、71.68%。说明天麻灵芝酵素能够显著缩短PCPA失眠模型小鼠的睡眠潜伏期以及延长睡眠时间,且天麻灵芝酵素随剂量的增加,镇静催眠作用效果越好,其中天麻灵芝酵素高剂量镇静催眠的作用效果最佳。
2.3 天麻灵芝酵素对失眠小鼠生化指标的影响
天麻灵芝酵素对失眠小鼠生化指标的影响结果见图2。由图2A可知,与空白组相比,模型组小鼠血清SOD活性极显著下降(P<0.01);与模型组相比,阳性对照组SOD活性极显著升高(P<0.01),天麻灵芝酵素低剂量组、中剂量组SOD活性显著升高(P<0.05),天麻灵芝酵素高剂量组SOD活性高度显著升高(P<0.001)。由图2B可知,与空白组相比,模型组NO含量高度显著升高(P<0.001);与模型组相比,阳性对照组和天麻灵芝酵素高剂量组NO含量高度显著下降(P<0.001),天麻灵芝酵素中剂量组NO含量显著降低(P<0.05),天麻灵芝酵素低剂量组NO含量无显著差异(P>0.05)。

图2 天麻灵芝酵素对小鼠血清中超氧化物歧化酶(A)、NO(B)、白细胞介素-1β(C)和脑组织中5-羟色胺(D)、γ-氨基丁酸(E)含量的影响
Fig.2 Effect of Gastrodia elata and Ganoderma lucidum Jiaosu on the contents of superoxide dismutase (A), NO (B), interleukin-1β (C) in the serum of mice and 5-hydroxytryptamine (D) and γ-aminobutyric acid (E) in brain tissue
由图2C可知,与空白组相比,模型组血清中IL-1β含量高度显著升高(P<0.001);与模型组相比,阳性对照组IL-1β含量显著下降(P<0.05),天麻灵芝酵素高剂量组IL-1β含量高度显著下降(P<0.001),天麻灵芝酵素中剂量组IL-1β含量显著下降(P<0.05),天麻灵芝酵素低剂量组IL-1β含量无显著差异(P>0.05)。由图2D可知,与空白组比较,模型组小鼠脑组织中5-HT含量显著降低(P<0.05);与模型组相比,阳性对照组和天麻灵芝酵素高剂量组小鼠脑组织中5-HT含量极显著升高(P<0.01),天麻灵芝酵素低剂量组和中剂量组小鼠脑组织中5-HT含量显著升高(P<0.05)。由图2E可知,与空白组比较,模型组小鼠脑组织中GABA含量高度显著降低(P<0.001);与模型组相比,阳性对照组小鼠脑组织中GABA含量极显著升高(P<0.01),天麻灵芝酵素高剂量组小鼠脑组织中GABA含量显著升高(P<0.05),天麻灵芝酵素低剂量组和中剂量组小鼠脑组织中GABA含量无显著差异(P>0.05)。结果表明,天麻灵芝酵素可以通过调节氧化应激、炎症因子及小鼠海马中的神经递质含量来达到镇静催眠的作用。
2.4 天麻灵芝酵素对失眠小鼠脑组织病理切片的影响
天麻灵芝酵素对失眠小鼠脑组织病理切片的影响结果见图3。图中虚线框出的两个区域分别为海马CA1区域和DG区域,这两个区域是海马组织的关键区域,神经元较为丰富且神经元密度高。
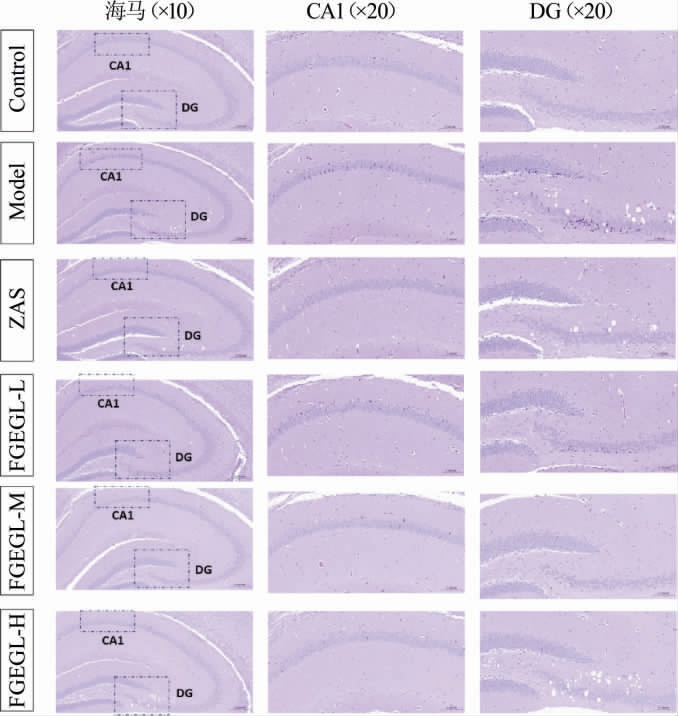
图3 天麻灵芝酵素对小鼠脑组织病理切片的影响
Fig.3 Effect of Gastrodia elata and Ganoderma lucidum Jiaosu on pathological sections in mice brain tissue
由图3可知,与空白组相比,模型组CA1和DG区域海马神经元数量减少,排列疏松且不规则,细胞形态不一,部分神经元皱缩,染色质明显深染,分布不均匀。此结果与PCPA的使用导致海马神经元状态改变和前额叶皮层中血清素水平的降低研究一致[18]。与模型组相比,经天麻灵芝酵素干预后,小鼠海马CA1和DG区域神经元数量较多,结构较完整,排列整齐且紧密,胞浆丰富而淡染,胞核清晰而居中,且中、高剂量的天麻灵芝酵素海马神经元结构损伤部分改善,细胞结构较完整,排列较为整齐,部分神经元胞浆丰富,核仁清晰。结果表明,天麻灵芝酵素可以明显改善失眠小鼠海马神经元数量减少,排列疏松且不规则,细胞形态不一,部分神经元皱缩,染色质明显深染,分布不均匀等问题。
2.5 天麻灵芝酵素对失眠小鼠肠道菌群的影响
2.5.1 天麻灵芝酵素对失眠小鼠肠道菌群多样性的影响
通过对6个试验组30个样本进行16S rRNA分析,考察天麻灵芝酵素对失眠小鼠肠道菌群多样性的影响,结果见图4。
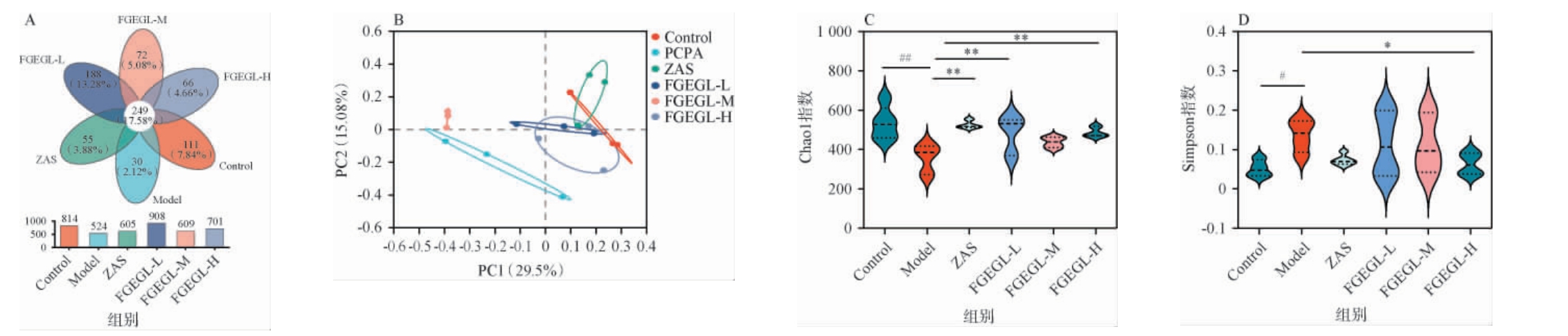
图4 天麻灵芝酵素对失眠小鼠肠道菌群多样性的影响
Fig.4 Effect of Gastrodia elata and Ganoderma lucidum Jiaosu on intestinal flora diversity in insomnia mice
由图4A可知,韦恩图显示了每一组中操作分类单元(operational taxonomic units,OTUs)的数量和重叠的数量,Control、Model、ZAS、FGEGL-L、FGEGL-M和FGEGL-H分 别 有814、524、605、908、609和701个OTUs,其中共有的OTUs数目为249个,表明6个组至少有249个共生菌。进一步比较各组间的OTUs,Control组有111个独特的OTUs,而Model组只有30个独特的OTUs,ZAS、FGEGL-L、FGEGL-M和FGEGL-H分别有55、188、72和66个OTUs。由图4B可知,主坐标分析结果显示,PCPA造模和天麻灵芝酵素灌胃干预后,肠道菌群的组成发生了显著变化,Control和Model组间易于分开,天麻灵芝酵素各剂量组与模型组明显分离。进一步分析α多样性,由图4C、图4D可知,与空白组相比,模型组中Chao1指数显著下降(P<0.05),而Simpson指数显著上升(P<0.05),而经FGEGL干预后,Chao1指数极显著上升(P<0.01),Simpson指数显著下降(P<0.05)。以上结果表明,PCPA可使小鼠肠道菌群发生变化,FGEGL可在一定程度上改善肠道菌群的组成。
2.5.2 天麻灵芝酵素对失眠小鼠肠道菌群门水平的影响
天麻灵芝酵素对失眠小鼠肠道菌群门水平上物种组成的影响见图5。由图5可知,空白组、模型组以及各给药组的肠道菌群在门水平上主要分属于12个菌门,其中占主要的是厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、脱铁杆菌门(Deferribacteres)、蓝藻门(Cyanobacteria)。厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)是各组中的绝对的优势菌群,其中Firmicutes相对丰度占比第一,分别为Control(27.19%)、Model(64.67%)、ZAS(18.98%)、FGEGL-L(48.29%)、FGEGL-M(68.36%)和FGEGL-H(48.54%),Bacteroidetes相对丰度分别为Control(66.75%)、Model(15.46%)、ZAS(75.22%)、FGEGL-L(34.48%)、FGEGL-M(29.10%)和FGEGL-H(25.33%)。与空白组相比,模型组中的Firmicutes增加,Bacteroidetes降低,Firmicutes与Bacteroidetes的比值(F/B)在模型组中达到最高。研究表明,F与B的比值在睡眠剥夺后显著下降[19],有研究表明,失眠小鼠的厚壁菌门增加,拟杆菌门显著减少,F/B比值显著增加,与本研究结果相一致[20]。经ZAS和各剂量的FGEGL干预后,Firmicutes和Bacteroidetes的相对丰度分别降低和增多,F/B极显著增加(P<0.01)。有研究表明,睡眠不足会导致放线菌门和变形菌门丰度显著下降[21],与本研究结果一致。综上,FGEGL可通过降低厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)的丰度,增高拟杆菌门(Bacteroidetes)的相对丰度,并显著回调F/B比值,在一定程度上改善了PCPA所致失眠引起的菌群紊乱。
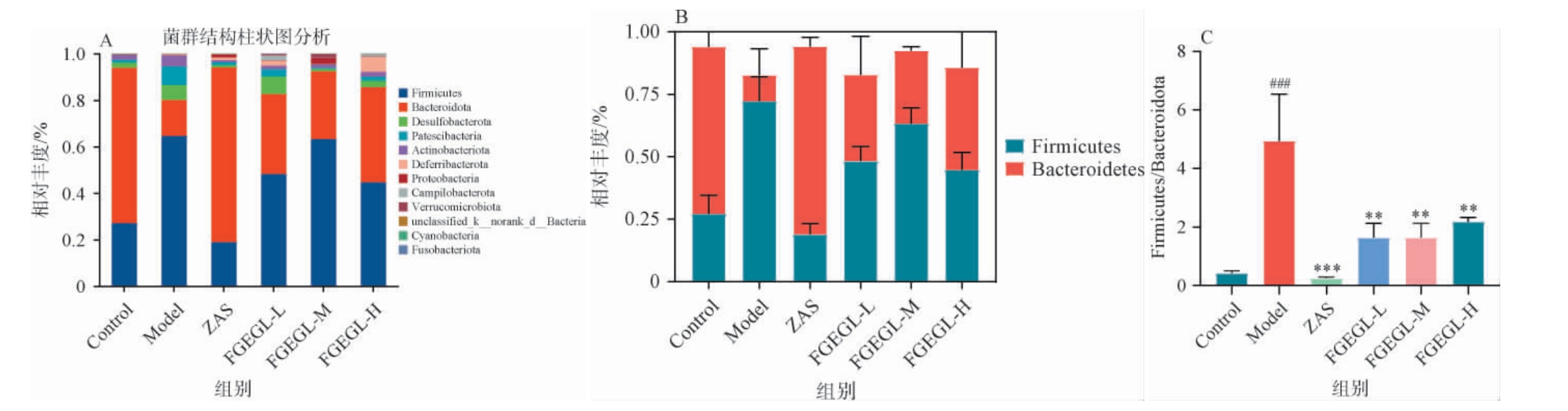
图5 天麻灵芝酵素对失眠小鼠肠道菌群门水平上物种组成的影响
Fig.5 Effect of Gastrodia elata and Ganoderma lucidum Jiaosu on species composition of intestinal flora in insomnia mice at phylum level
2.5.3 天麻灵芝酵素对失眠小鼠肠道菌群属水平的影响
天麻灵芝酵素对失眠小鼠肠道菌群属水平上物种组成的影响见图6。由图6A可知,小鼠肠道中属水平上的主要菌群为Lactobacillus、norank_f__Muribaculaceae、Bacteroides、Alloprevotella、norank_f__norank_o__Clostridia_UCG-014 和Alistipes,由图6B、图6C可知,与空白组相比,模型组中小鼠肠道菌群如Lactobacillus和norank_f__Muribaculaceae相对丰度显著下降(P<0.05),给予FGEGL-H后,显著回调了以上两种菌的相对丰度。研究表明Lactobacillus具有改善睡眠的作用,其原因是它可以产生神经递质如GABA和乙酰胆碱,并且会减少炎症因子的水平以及与慢性睡眠小鼠相关的TLRs的炎症[22]。由图6D可知,与空白组相比,模型组中另枝菌属(Alistipes)相对丰度增多,由图6E~图6G可知,拟杆菌(Bacteroides)、异杆菌(Alloprevotella)、norank_f__norank_o__Clostridia_UCG-014相对丰度极显著或高度显著上升(P<0.01或P<0.001)。
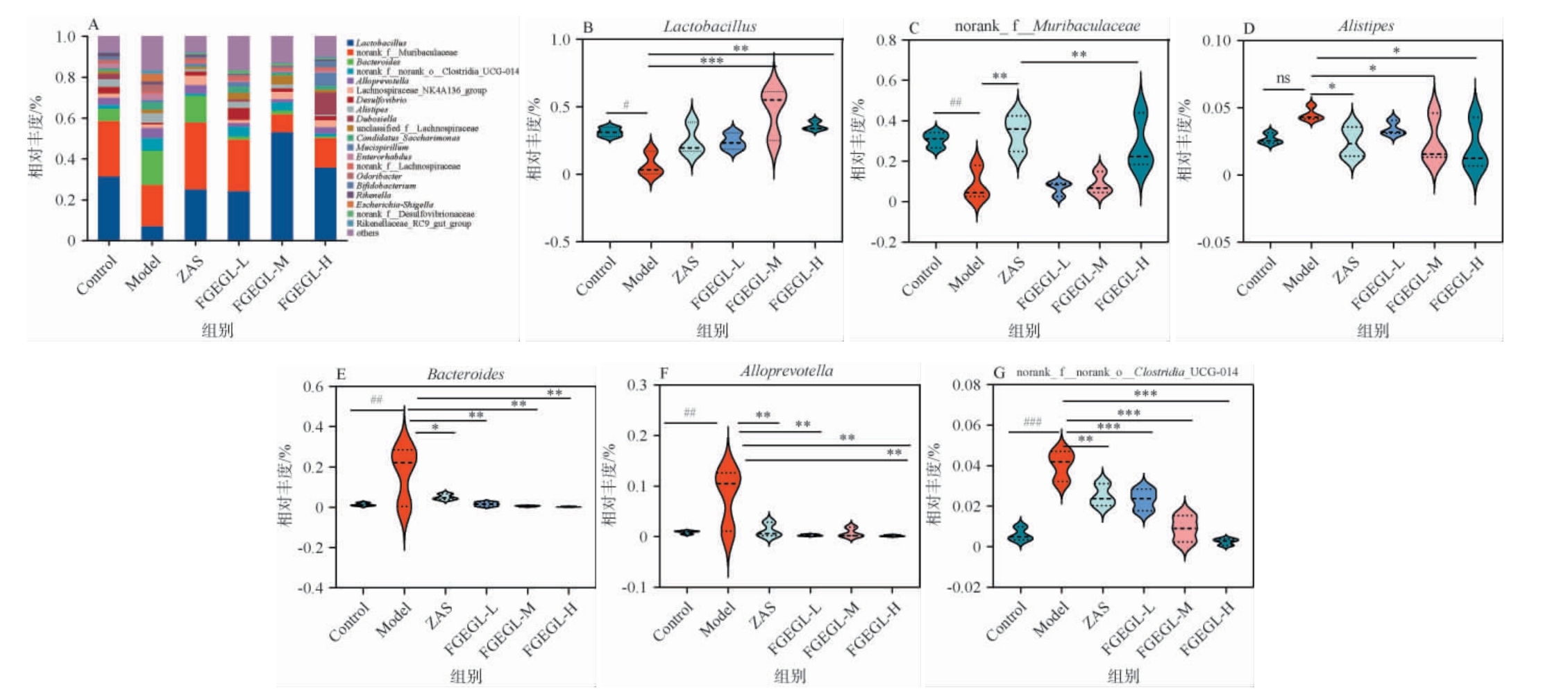
图6 天麻灵芝酵素对失眠小鼠肠道菌群属水平上物种组成的影响
Fig.6 Effect of Gastrodia elata and Ganoderma lucidum Jiaosu on species composition of intestinal flora in insomnia mice at genus level
通过给予天麻灵芝酵素各剂量组对以上菌群丰度的紊乱都具有显著回调作用。拟杆菌(Bacteroides)为条件致病菌,既具有益生作用,又有一定的条件致病性,拟杆菌的代谢物如肠毒素、内毒素、脂多糖等均具有致病性,当机体免疫力下降时,这些条件致病菌可激活P-65信号并传导信号,促进炎症的发生。在此研究中发现,与空白组比较,在失眠小鼠中相对丰度显著上升,菌群丰度失调[23],另有研究结果表明,PCPA诱导的失眠小鼠中Bacteroides丰度也显著上升,与本研究相一致[24]。异杆菌(Alloprevotella)是一种产短链脂肪酸(short-chain fatty acid,SCFAS)的特定系统型细菌[25],此种细菌在运动后富集[26]。这可能与失眠小鼠睡眠减少、活动增加、兴奋性高,以及具有攻击性有关。睡眠障碍患者中拟杆菌科(Bacteroidaceae)和疣微菌科(Ruminococcaceae)显著减少[27]。norank_f__norank_o__Clostridia_UCG-014属于未分类的梭状芽孢杆菌(Clostridium),梭状芽孢杆菌属是严格的厌氧芽孢杆菌,属内包含肉毒梭菌、破伤风梭菌和产气荚膜梭菌,YAN Y S等[28]研究发现,应用破伤风梭菌神经毒素能够增加细胞表面AMPAR表达,动物实验表明,间歇性睡眠剥夺小鼠肠道内产气荚膜梭菌的相对丰度显著增加[29],睡眠剥夺的大鼠肠道内产气荚膜梭菌也出现此种变化[30]。本试验中模型组norank_f__norank_o__Clostridia_UCG-014相对丰度高度显著上升(P<0.01),提示可能属于梭状芽孢杆菌属中的产气荚膜梭菌,与失眠的发生发展有紧密联系。且随机森林模型通过交叉验证模型确定了Bacteroides,o_Clostridia可在肠道生态网络中作为用于识别失眠患者的生物标志物[31]。Alistipes对焦虑、抑郁、炎症性结肠疾病和慢性疲劳综合征具有致病作用,对肝脏和心血管疾病具有保护作用[32]。综上,经PCPA诱导的失眠小鼠肠道菌群紊乱,属水平上与失眠有关菌群丰度的失调如Lactobacillus、norank_f__Muribaculaceae、g-Bacteroides、Alloprevotella、norank_f__norank_o__Clostridia_UCG-014和Alistipes。而经FGEGL的干预,显著回调了以上菌群紊乱,提示FGBFL可通过降低F/B、上调Lactobacillus、norank_f__Muribaculaceae相对丰度并下调Bacteroides、Alloprevotella、norank_f__norank_o__Clostridia_UCG-014和Alistipes相对丰度,从而对失眠起到改善作用。
2.6 小鼠肠道菌群与神经递质、氧化应激指标的相关性分析
进一步探究肠道菌群与SOD、IL-1β、NO、5-HT和GABA指标的相关性,基于Spearman相关性|r|>0.6,P<0.05,挑选物种进行相关性网络图分析,结果见图7。
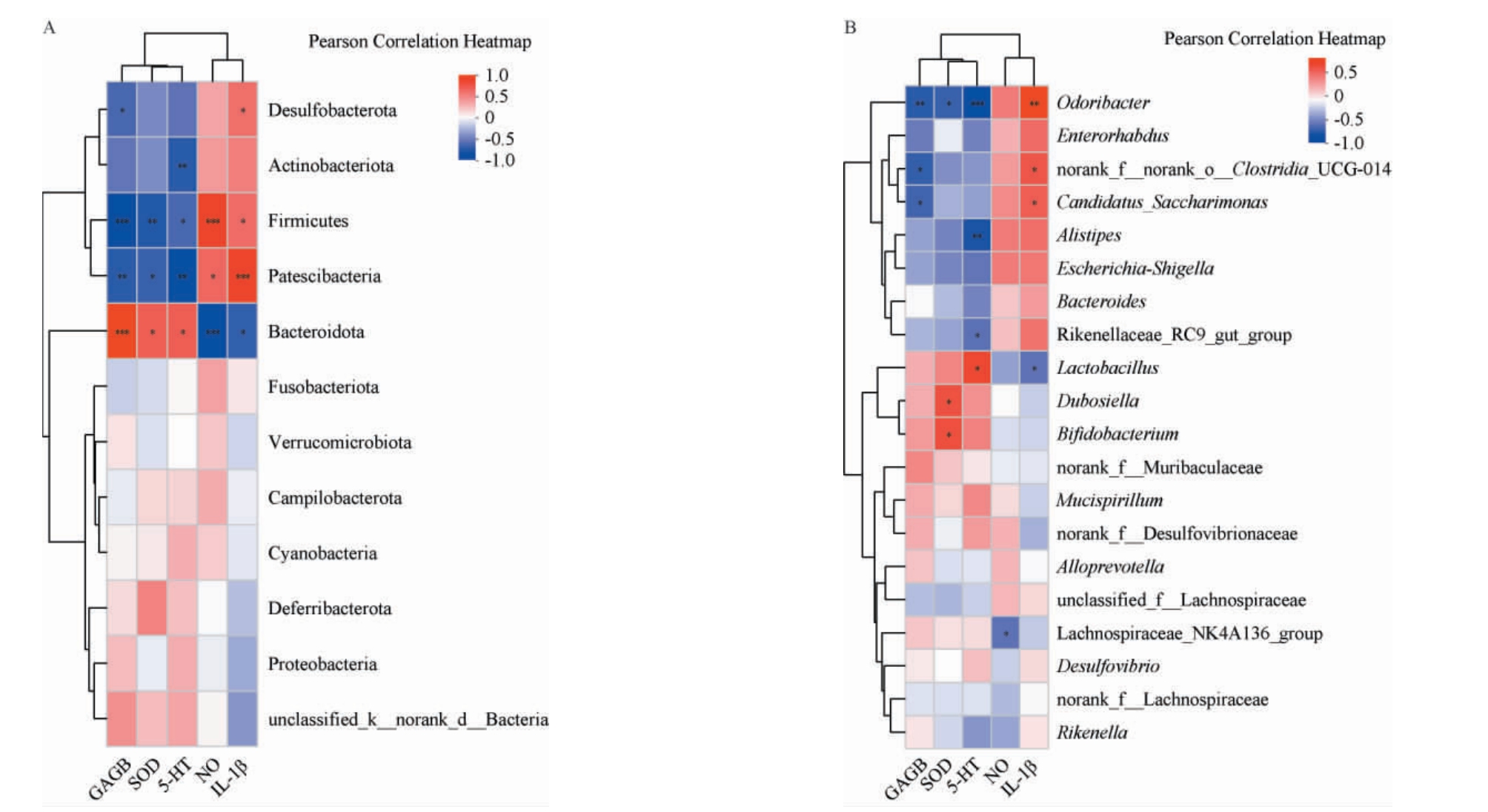
图7 小鼠神经递质、炎症和氧化应激指标与门水平(A)及属水平(B)细菌热图分析
Fig.7 Heat map analysis of neurotransmitters, inflammation and oxidative stress indicators of mice with bacteria at the phylum level (A) and genus level (B)
由图7A可知,在门水平上,厚壁菌门(Firmicutes)与GABA、SOD和5-HT呈高度显著、极显著和显著负相关(P<0.001,P<0.01,P<0.05),另有研究发现睡眠障碍中,Firmicutes与GABA呈显著负相关[33]、与5-HT呈显著负相关[34],与本研究结果一致。Bacteroidota与GABA、SOD和5-HT呈高度显著、极显著和显著正相关(P<0.001,P<0.05,P<0.05),与NO和IL-1β呈高度显著和显著负相关(P<0.001,P<0.05),PCPA诱导的失眠小鼠中在门水平上Bacteroidota与GABA呈高度显著正相关(P<0.001)[35]。由图7B可知,在属水平上,norank_f__norank_o__Clostridia_UCG-014 与GABA 呈显著负相关(P<0.05),与IL-1β呈显著正相关(P<0.05)。Alistipes与5-HT呈极显著负相关(P<0.01),Lactobacillus与IL-1β呈显著负相关(P<0.05)。综上,肠道微生物与失眠小鼠神经递质、炎症及氧化应激水平具有相关性,其主要相关菌属有:门水平上Firmicutes、Bacteroidota,属水平上norank_f__norank_o__Clostridia_UCG-014、Alistipes。
2.7 天麻灵芝酵素对失眠小鼠结肠病理切片的影响
当给予PCPA造模后,小鼠昼夜节律失常,致使小鼠失眠,从而使小鼠机体产生一定的氧化应激反应,损伤机体的正常细胞,结肠作为机体主要吸收部位,氧化应激也会造成肠细胞的损伤及肠道菌群的失常,天麻灵芝酵素对小鼠结肠病理切片的影响结果见图8。由图8可知,空白组结肠黏膜上皮较为完整,肠壁未见水肿和增厚,腺体排列整齐,隐窝结构规则,杯状细胞圆润饱满,无炎性细胞浸润和溃疡,杯状细胞圆润饱满。与空白组比较,模型组小鼠肠壁完整性被破坏,腺体减少,隐窝消失,大范围的炎性细胞浸润,杯状细胞明显减少或萎缩,结肠组织病理损伤严重。经FGEGL中、高剂量给药后,小鼠肠黏膜病理组织形态有所明显,可见连接较为紧密的上皮细胞,完整隐窝数目较多,杯状细胞分泌增多,炎性细胞浸润减少。结果表明天麻灵芝酵素可以一定程度上改善失眠引起的结肠细胞的损伤,进而改善肠道菌群的失常。
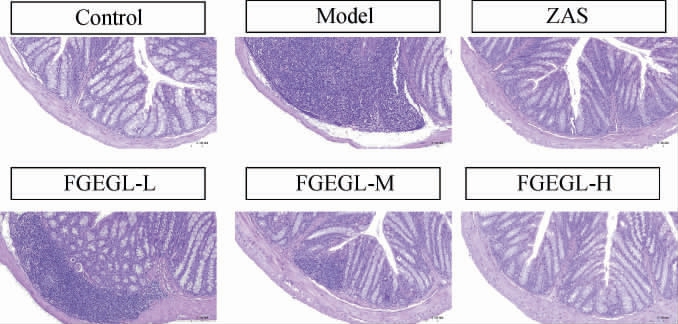
图8 天麻灵芝酵素对小鼠结肠病理切片的影响
Fig.8 Effect of Gastrodia elata and Ganoderma lucidum Jiaosu on pathological sections of mice colon
3 结论
本研究以PCPA构建小鼠失眠模型,采用天麻灵芝酵素进行干预,通过小鼠行为学,神经递质、炎症及氧化应激指标检测,结肠病理切片,脑组织病理切片以及肠道菌群分析,结果显示,天麻灵芝酵素能延长睡眠时间,缩短睡眠潜伏期,增加入睡率以及下调NO、IL-1β含量,上调SOD、5-HT和GABA含量,改善了失眠引起的氧化应激对结肠细胞的损伤,通过增加有益菌的丰度、降低失眠标志菌拟杆菌门、提高厚壁菌门/拟杆菌门的比率,调节失眠小鼠菌群失调,从而改善PCPA引发的小鼠失眠情况。其中,天麻灵芝酵素高剂量组对小鼠失眠情况改善效果最佳。这次研究仅对天麻灵芝酵素对失眠小鼠的改善作用效果进行了分析讨论,下一步将进一步从代谢通路以及基因表达的水平进一步阐明其作用机制。
[1]SCHRECK A K, RICHDALE L A.Sleep problems, behavior, and psychopathology in autism: Inter-relationships across the lifespan[J].Curr Opin Psychol,2020,34:105-111.
[2]CALCATERRA V, ROSSI V, TAGI M V, et al.Food intake and sleep disorders in children and adolescents with obesity[J].Nutrients,2023,15(22):161-172.
[3]ROWE R K, GRIESBACH G S.Immune-endocrine interactions in the pathophysiology of sleep-wake disturbances following traumatic brain injury:A narrative review[J].Brain Res Bull,2022,185:117-128.
[4]WU X, CHEN Z, DU S, et al.Gastrodin as adjuvant therapy improves neuroprotective effect in acute stroke patients: A systematic review with meta-analysis of randomised controlled trials[J].J Herbal Med,2024,46:100895.
[5]胡芙蓉,王昱涵,向琴,等.天麻改善失眠作用机制及产品开发研究进展[J].食品工业科技,2024,10(1):1-16.
[6]QIU Y, MAO Z J, RUAN Y P, et al.Exploration of the anti-insomnia mechanism of Ganoderma by central-peripheral multi-level interaction network analysis[J].BMC Microbiol,2021,21(1):296.
[7]叶辉宇,李强明,张玉英,等.灵芝子实体不同提取物对小鼠睡眠改善作用的比较[J].食品工业科技,2021,42(17):350-356.
[8]周亚楠,郑舒怡,柳嘉雯,等.植物酵素代谢产物形成机制研究进展[J].食品工业科技,2024,45(15):380-391.
[9]FANG Q,HU J,NIE Q,et al.Effects of polysaccharides on glycometabolism based on gut microbiota alteration[J].Trends Food Sci Tech,2019,92:65-70.
[10]LEE B,LEE S M,SONG J W,et al.Gut microbiota metabolite messengers in brain function and pathology at a view of cell type-based receptor and enzyme reaction[J].Biomolecules Therapeutics,2024,32(4):403-423.
[11]林灵,王瑜,杨娟,等.天麻酵素对失眠小鼠的镇静催眠功效评价[J].现代食品科技,2021,37(10):55-61,152.
[12]GAO M,WU Y,YANG L,et al.Anti-depressant-like effect of fermented Gastrodia elata Bl.by regulating monoamine levels and BDNF/NMDAR pathways in mice[J].J Ethnopharmacol,2023,301:115832.
[13]WANG Y,ZHAO M,XIE C,et al.Fermented Gastrodia elata Bl.alleviates cognitive deficits by regulating neurotransmitters and gut microbiota in D-Gal/AlCl3-induced Alzheimer's disease-like mice[J].Foods,2024,13(13):16.
[14]李增梅.灵芝发酵培养与生物活性研究[D].济南:齐鲁工业大学,2023.
[15]SOCCOL C R,BISSOQUI L Y,RODRIGUES C,et al.Pharmacological properties of biocompounds from Spores of the Lingzhi or Reishi medicinal mushroom Ganoderma lucidum(Agaricomycetes):A review[J].Int J Med Mushrooms,2016,18(9).
[16]赵敏,王瑜,杨娟,等.天麻酵素的发酵工艺优化与品质评价[J].中国酿造,2022,41(10):177-182.
[17]LIU C,ZHAO D,MA W,et al.Denitrifying sulfide removal process on high-salinity wastewaters in the presence of Halomonas sp.[J].Appl Microbiol Biot,2016,100(3):1421-1426.
[18]GHAHERI S,NIAPOUR A, SAKHAIE N, et al.Postnatal depletion of serotonin affects the morphology of neurons and the function of the hippocampus in male rats[J].Int J Dev Neurosci,2022,82(3):222-230.
[19]BENEDICT C, VOGEL H, JONAS W, et al.Gut microbiota and glucometabolic alterations in response to recurrent partial sleep deprivation in normal-weight young individuals[J].Molecular Metabolism, 2016,5(12):1175-1186.
[20]QIAO T, WANG Y, LIANG K, et al.Effects of the radix ginseng and semen Ziziphi Spinosae drug pair on the GLU/GABA-GLN metabolic cycle and the intestinal microflora of insomniac rats based on the braingut axis[J].Front Pharmacol,2022,13:1094507.
[21]SONG Z, LIU L, XU Y, et al.Caffeine-induced sleep restriction alters the gut microbiome and fecal metabolic profiles in mice[J].Int J Mol Sci,2022,23(23):14837.
[22]DINAN T G,CRYAN J F,et al.Gut instincts:microbiota as a key regulator of brain development,ageing and neurodegeneration[J].J Physiol,2017,595(2):489-503.
[23]李桂军,楼永良.脆弱拟杆菌肠毒素致病机制研究进展[J].中国人兽共患病学报,2009,25(1):70-2,7.
[24]SI Y,WEI W,CHEN X,et al.A comprehensive study on the relieving effect of Lilium brownii on the intestinal flora and metabolic disorder in p-chlorphenylalanine induced insomnia rats[J].Pharm Biol,2022,60(1):131-143.
[25]PETRIZ B A,CASTRO A P,ALMEIDA J A, et al.Exercise induction of gut microbiota modifications in obese, non-obese and hypertensive rats[J].BMC Genomics,2014,15(1):511.
[26]CAMPBELL S C,WISNIEWSKI P J,NOJI M,et al.The effect of diet and exercise on intestinal integrity and microbial diversity in mice[J].Plos one,2016,11(3):e0150502.
[27]SMITH R P,EASSON C,LYLE S M,et al.Gut microbiome diversity is associated with sleep physiology in humans[J].Plos one,2019,14(10):e0222394.
[28]YAN Y S, CHUAN W D, LIDONG L, et al.Role of AMPA receptor trafficking in NMDA receptor-dependent synaptic plasticity in the rat lateral amygdala[J].J Neurochem,2008,106(2):889-995.
[29]李云,周明眉,苟小军,等.姜黄素对间歇性睡眠剥夺大鼠特定肠道菌的影响[J].中草药,2016,47(5):794-798.
[30]王慧,张艳鹤,杨记康,等.小檗碱调节睡眠剥夺大鼠的肠道菌群结构以及Th17/Treg细胞平衡[J].基础医学与临床,2017,37(6):860-864.
[31]LIU B,LIN W,CHEN S,et al.Gut microbiota as an objective measurement for auxiliary diagnosis of insomnia disorder[J].Front Microbiol,2019,10:1770.
[32]PARKER B J,WEARSCH P A,VELOO A C M,et al.The genus alistipes:Gut bacteria with emerging implications to inflammation,cancer,and mental health[J].Front Immunol,2020,11:906.
[33]ZHU Z,ZHANG J,YUAN G,et al.Association between mobile phone addiction,sleep disorder and the gut microbiota:A short-term prospective observational study[J].Front Microbiol,2023,14:1323116.
[34]ÇUBUKÇU H C,YURTDAS, M,DURAK Z E, et al.Oxidative and nitrosative stress in serum of patients with Parkinson's disease[J].Neurol Sci,2016,37(11):1793-1798.
[35]TANG Q,XIONG J,WANG J,et al.Queen bee larva consumption improves sleep disorder and regulates gut microbiota in mice with PCPAinduced insomnia[J].Food Biosci,2021,43:101256.