酱油作为传统发酵食品的代表,其独特风味与营养价值深受消费者青睐。酱油酿造过程包括制曲与酱醪发酵两大核心阶段:制曲阶段通过米曲霉(Aspergillus oryzae)等微生物的代谢活动,产酶分解原料中的大分子物质[1];酱醪阶段则通过复杂的微生物群落演替与代谢作用,形成酱油的特征风味[2]。尽管已有研究关注酱醪阶段的菌群动态,但制曲阶段微生物如何演替至酱醪阶段,及其在风味形成中的具体作用仍不明确,成为制约酱油品质提升与工艺优化的关键瓶颈。
微生物群落的演替是酱油风味多样化的核心驱动力。制曲阶段形成的魏斯氏菌属(Weissella)、芽孢杆菌属(Bacillus)等功能菌群可能通过生态位竞争与代谢协同延续至酱醪阶段,成为产酸、产酯等功能模块的核心成员,直接影响有机酸、醇类、酯类等风味前体物质的合成[3]。然而,现有研究多聚焦酱醪阶段的菌群变化,对制曲菌群如何塑造酱醪微生态及其代谢功能缺乏系统性追踪。此外,酱醪阶段的敞口发酵易受肠杆菌属(Enterobacter)等有害微生物污染[4]。若制曲菌群能优先占据优势生态位,则可能抑制杂菌生长并稳定发酵进程[5]。因此,解析制曲菌群向酱醪的演替规律及其功能转化机制,对定向调控酱油风味、提升产品稳定性具有重要意义。
目前,多数研究仅关注酱醪阶段菌群,而制曲菌群如何通过代谢网络影响风味前体合成尚不明确。本研究结合高通量测序技术追踪菌群从制曲到酱醪的演替规律,利用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)和感官分析技术关联微生物动态与风味组分变化,并通过共发生网络模型挖掘核心功能菌群。研究旨在阐明制曲菌群对酱醪微生态及风味形成的贡献机制,为酱油酿造工艺的精准调控与风味优化提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和原料
米曲霉(Aspergillus oryzae)3.042:天津科技大学菌种保藏中心;大豆、面粉:市售。
1.1.2 试剂
葵醛、2-甲基丁酸乙酯、苯乙醇、3-甲基丁醛、异丁酸丁酯、4-乙基-2-甲氧基苯酚、乙偶姻、乙醇(均为色谱纯):上海Sigma Aldrich公司;E.Z.N.A.® soil脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒:美国Omega Bio-Tek公司;338F-806R、ITS1F-ITS2R引物:苏州金唯智生物科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)试剂盒:上海迭戈生物科技有限公司;PCR产物回收纯化试剂盒:北京百奥莱博科技有限公司;TruSeq® DNA PCR-Free Sample Preparation Kit:北京诺禾致源科技股份有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Illumina NovaSeq 6000高通量测序仪:上海鲸舟基因科技有限公司;ZA220R4分析天平:上海赞维衡器有限公司;PEN 3.5电子鼻:德国Airsense Analytics公司;QP2010 Ultral气相色谱-质谱联用仪:日本岛津公司;TG Wax毛细管色谱柱(30 m×0.25 mm×0.25 μm)、TR-5 MS毛细管色谱柱(30 m×0.25 mm×0.25 μm):美国Thermo Fisher Scientific;ABI Gene Amp® 9700 PCR仪:上海迭戈生物科技有限公司。
1.3 方法
1.3.1 酱油酿造及取样
采用广式高盐稀态酿造工艺酿造酱油。具体工艺:大豆浸泡12 h后置于旋转式蒸煮罐中,0.08 MPa压力下蒸煮20 min,风冷机冷却至38 ℃后按大豆质量混入30%的面粉,并按大豆质量接种0.3%的米曲霉孢子,置于曲池中按2 cm厚度混匀铺平(此时收集曲池样品),30 ℃培养。约培养16 h后,待曲料表面出现一层白色时进行第一轮翻曲、曲料平铺(并收集制曲样品),此时是米曲霉菌丝生长初期,菌丝呈现白色。再培养6~8 h,待曲料变雪白色且曲料中心温度持续升高,不超过40 ℃,进行第二轮翻曲(此时收集松曲样品)。再培养约6~8 h后,曲料由白变黄,最后变绿色,出曲(此时收集出曲样品)。随后将大曲与18%的盐水按质量比1∶2.5混合,置于酱油发酵罐中自然发酵90 d,每天搅拌一次。酱醪样品分别于酿造前期(1 d、3 d、7 d、14 d)以及酿造后期(28 d、42 d、90 d)搅拌均匀后取样。
1.3.2 微生物多样性分析
脱氧核糖核酸(DNA)提取、PCR扩增及高通量测序:采用E.Z.N.A.® soil DNA试剂盒提取样品微生物的总脱氧核糖核酸(DNA),以质控和稀释后的总DNA为模板(1 ng/μL),采用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')PCR扩增细菌菌群16S rRNA的V3-V4区域基因序列;采用引物ITS1-F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2-R(5'-GCTGCGTTCTTCATCGATGC-3')PCR扩增真菌菌群ITS区域基因序列。PCR扩增体系(50 μL):10×buffer 5 μL,三磷酸脱氧核糖核苷酸(deoxy-ribonucleoside triphosphate,dNTP)1 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,TaqDNA聚合酶(50 U/μL)0.5 μL,DNA模板100 ng,双蒸水(ddH2O)40 μL。PCR扩增条件为:95 ℃预变性5 min;95 ℃变性30 s,60℃退火30s,72℃延伸90s,共28个循环;72℃再延伸10min。将PCR产物以2%的琼脂糖凝胶电泳进行检测和纯化。回收的产物以TruSeq® DNA PCR-Free Sample Preparation Kit构建文库,并使用NovaSeq 6000进行上机测序。
生物信息学分析:原始序列使用FLASH软件(Version 1.2.7)(http://ccb.jhu.edu/software/FLASH)进行质控拼接[6]。基于UPARSE软件(Version 7.1)(http://drive5.com/uparse/),根据97%的相似度,对序列进行操作分类单元(operational taxonomic unit,OTU)聚类[7]。采用Greengenes数据库(Re lease 13.8)(http://greengenes.secondgenome.com/)进行细菌分类注释,采用NITE数据库(Release 5.0)(https://unite.ut.ee/)进行真菌分类注释[8]。采用QIIME(Version 1.7.0)进行菌群多样性分析,采用R软件(Version 4.2.2)中的WGCNA、stats和ggplot2软件进行主坐标分析(principal co-ordinates analysis,PCoA)[9]。采用R软件(Version 4.2.2)的stats和psych软件包计算菌属(相对丰度>0.1%)之间的Spearman相关性系数(ρ)和显著性P值,设置阈值(|ρ|>0.6)和显著性P值(P<0.01)以滤除弱相关连接。使用Gephi-0.9.2进行菌群共发生网络可视化和拓扑描述,包括平均节点、连通性、聚类系数和模块度[10]。
1.3.3 风味特征分析
基于菌群组成对样品初步聚类后,选取出每个阶段最后取样的样品(出曲样品、酿造前期14 d、酿造后期90 d样品)进行电子鼻、感官和风味组分分析。
电子鼻检测[11]:将5 g样品置于20 mL密封玻璃瓶,在(80±2)℃条件下水浴30 min,采用PEN 3.5电子鼻检测样品的气味。
感官定量描述分析(quantitative descriptive analysis,QDA)[12]:招募30名成员(15名男性,15名女性,年龄20~30岁)组成感官评价小组,培训60 h后,在感官实验室中对酱油的8个传统感官术语(脂肪、果味、花香、谷物味、甜味、烟熏味、和酒味)进行QDA。以葵醛、2-甲基丁酸乙酯、苯乙醇、3-甲基丁醛、丁基异丁酸酯、4-乙基-2-甲氧基苯酚、乙醇的10倍阈值浓度作为香气属性标准,评分标准为0(无强度)、1~3(弱)、4~6(中等)、7~9(强)、10(非常强)。
挥发性风味物质测定[12]:采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)-GC-MS测定样品中的挥发性风味物质,以挥发性风味组分的质量浓度除以阈值计算气味活性值(odor activity value,OAV),筛选对感官有贡献的关键挥发性风味物质(OAV≥1)进行统计分析。
1.3.4 统计分析
所有样品取3次平行,使用SPSS 20.0处理数据并进行单因素方差分析(one-way ANOVA)以及威尔科克森秩和检验(Wilcoxon rank-sum test),P<0.05时表示差异显著。采用XLstat 2018进行偏最小二乘回归(partial least squares regression,PLSR)分析,考察挥发性风味组分与感官得分的相关性分析[13]。使用SIMCA-14.1构建双向正交偏最小二乘法(two-way orthogonal partial least squares,O2PLS)模型,考察微生物菌群对挥发性风味组分的影响。
2 结果与分析
2.1 酱油酿造过程中微生物菌群多样性分析
酱油酿造过程中微生物菌群的多样性见图1。酱油酿造过程中,环境微生物会在各个阶段选择性定殖于酿造体系中,其中曲池环境对于微生物的定殖至关重要。
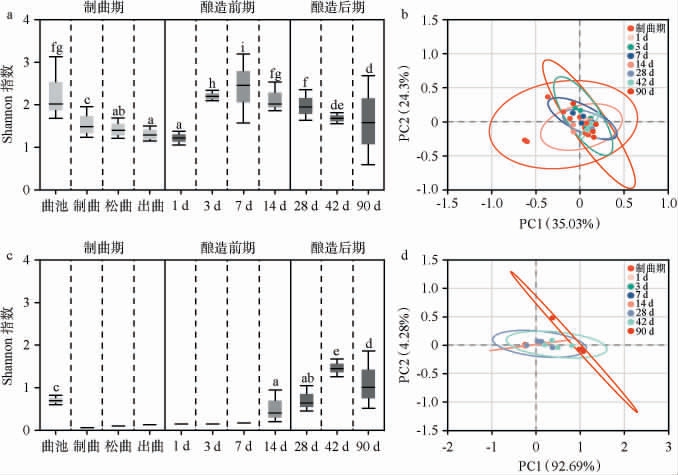
图1 酱油酿造过程中微生物菌群多样性的变化
Fig.1 Changes of microbial community diversity in the soy sauce brewing process
a和c分别为细菌、真菌菌群的Shannon指数;b和d分别为细菌、真菌菌群的PCoA结果;不同字母表示显著差异(P<0.05)。
由图1a和图1c可知,曲池样品的细菌和真菌菌群的香农(Shannon)指数均较高,分别为2.07和0.73;而进入到制曲期,细菌菌群的Shannon指数仍有1.48(制曲样品),真菌菌群的Shannon指数降为0.09(制曲样品),分析原因可能是曲池环境中的微生物参与到制曲阶段所致。曲池中的细菌群落对大曲的品质有直接影响,如魏斯氏菌属(Weissella)、四联球菌属(Tetragenococcus)和肠球菌属(Enterococcus)等优势细菌有助于大曲富集茶多酚酶,加速脂质和蛋白质的降解;相反,芽孢杆菌属(Bacillus)、库特氏菌属(Kurthia)、葡萄球菌属(Staphylococcus)等腐生菌的滋生,可能导致大曲酸化以及生物胺的富集[4]。从曲池到大曲再到酿造过程,细菌菌群的Shannon指数均高于真菌,说明细菌在整个阶段较为活跃。酱油酿造14 d后,细菌菌群的Shannon指数有所下降,而真菌菌群的Shannon指数明显升高,说明酱油酿造前14 d,微生物竞争激烈,部分细菌承受不了高盐的酿造环境而消亡,酿造14 d后,耐盐的真菌多样性增多,与细菌协同降解原料,促进酱油风味的形成[14]。由此可见,曲池微生物向酿造阶段的演替,将直接影响酿造进程和酱油的品质。
由图1b可知,大曲和不同酿造阶段样品的细菌菌群聚集度较高,大曲和酿造阶段样品的细菌群落组成差异不显著(P>0.05),说明大曲中的细菌群落演替进入酱油的整个酿造阶段。由此可知,大曲的细菌群落是构成酱油核心酿造细菌的基础。由图1c和图1d可知,真菌菌群多样性在酿造14 d后升高,且酿造后期的真菌群落出现偏离,尤其是酿造结束(90 d)时真菌群落的差异化程度达到最大(P<0.05)。有研究发现,酵母是酿造后期的主要真菌菌群,喜好偏酸性环境,繁殖速度较慢。酱油酿造后期酵母的多样性预示着酱油风味组成的多样化程度[15]。
2.2 酱油酿造过程中微生物菌群的演替规律
酱油酿造过程中微生物菌群的演替规律见图2。由图2a可知,酱油曲池中的细菌,如魏斯氏菌属、四联球菌属、芽孢杆菌属和肠球菌属随着大曲制备和酿造的进行而不断演替,成为酱油酿造阶段的主要微生物,参与酱油的酿造。其中,魏斯氏菌属的相对丰度最高,且在曲池中相对丰度最高达68.7%,制曲期下降至40%以上,酿造前期维持在10%~20%之间,直至酿造后期其相对丰度最低达到7.0%。而四联球菌的相对丰度则随着酿造时间的延长不断增加,到酿造后期相对丰度最高达到41.3%。魏斯氏菌属和四联球菌属组成贯穿整个酱油制曲和酿造阶段的优势细菌群落。魏斯氏菌属和四联球菌属可以为酱油提供有机酸类、醇类等风味物质[16]。芽孢杆菌属常以芽孢形态残存于曲池中,在松曲后(即二次翻曲后),大曲富氧的情况下,开始大量繁殖,并在出曲时处于绝对优势(相对丰度为67.4%),演替至酿造阶段后相对丰度稳定在10%~20%参与酱油酿造。芽孢杆菌属产生的淀粉酶、蛋白酶和L-谷氨酰胺酶,具备较强底物转化能力,可协助米曲霉进行原料底物的水解,是酱油酿造阶段原料降解的重要微生物,也可以促进4-乙基愈创木酚(烟熏香、丁香)和麦芽酚(焦奶油香)以及其他间接产物的形成[17]。类似的,肠球菌属在松曲后大量繁殖(相对丰度为21.6%),并在酿造过程中相对丰度保持在10%~20%。肠球菌属是酿造豆制品的常见菌群,可提高制曲的酸性蛋白酶、β-葡萄糖苷酶和果胶酶活性,并在酿造过程中富集总酚、总黄酮、有机酸、氨基酸组分的同时,提高酱油的抗氧化能力[18]。可见,酱油酿造过程中细菌菌群的多样性是酱油风味丰富多样的基础,曲池是细菌多样性来源的重要场所。另外,盐厌氧菌属(Halanaerobium)、红球菌属(Rhodococcus)、片球菌属(Pediococcus)、色盐杆菌属(Chromohalobacter)和葡萄球菌属等微生物在制曲和酿造过程中相对丰度较低,具有高盐耐受性,其分泌的耐盐水解酶在酿造过程中发挥着一定的作用,促进了酱油风味的形成[19-21]。
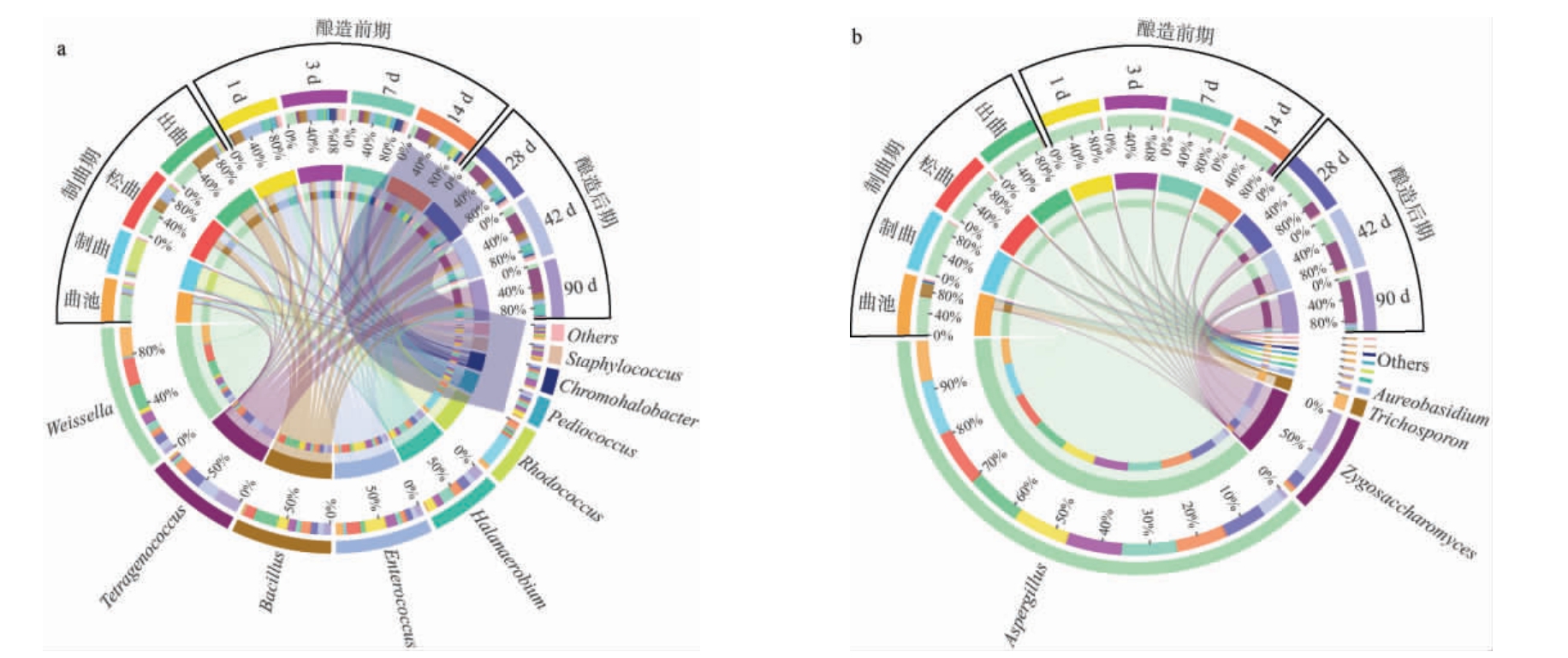
图2 酱油酿造过程中细菌(a)及真菌菌群(b)的演替规律
Fig.2 Succession rules of bacteria (a) and fungi communities (b) in the soy sauce brewing process
由图2b可知,曲霉属在酱油大曲制备和酿造阶段发挥了关键作用,平均相对丰度为74.9%。但是,到达酿造后期曲霉属相对丰度下降,接合酵母菌属(Zygosaccharomyces)的相对丰度升高,在酿造90 d时达到最高相对丰度(77.4%),与细菌共同参与酿造,促进酱油风味的不断进化,优化酱油的整个风味体系。丝孢酵母(Trichosporon)是发现于曲池的一种油脂富集型酵母菌。虽然丝孢酵母在原始曲池富集相对丰度达到19.1%,但由于大曲制备阶段的米曲霉生态位竞争导致其并未大幅度演替[22]。短梗霉属(Aureobasidium)相对丰度较低,但是其可以合成多种天然产物,如普鲁兰多糖、聚苹果酸、木霉素、黑色素等,分泌的胞外酶包括淀粉酶、脂肪酶、酯酶、纤维素酶、木聚糖酶、蛋白酶、漆酶、甘露聚糖酶等[23]。
2.3 酱油酿造过程中菌群共发生生态网络演替规律
酱油酿造过程中菌群共发生生态网络演替规律见图3。由图3可知,酱油制曲到酿造阶段主要演替的菌群由魏斯氏菌属、四联球菌属、芽孢杆菌属、肠球菌属、曲霉属、接合酵母菌属组成,这些微生物兼具丰度优势和连通度优势,保证了微生态演替过程中的稳定性。由图3左下角灰色框中的功能模块I、Ⅱ、Ⅲ的变化情况(从制曲向酿造阶段演替的微生态“小世界”拓扑结构)可知,大曲中的微生物通过生态位协作逐渐进化,到发酵后期时,功能模块Ⅲ形成稳定的以厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为主的微生态聚集,从而发挥其发酵功能,如:风味形成、代谢物积累、色素转化等[24]。
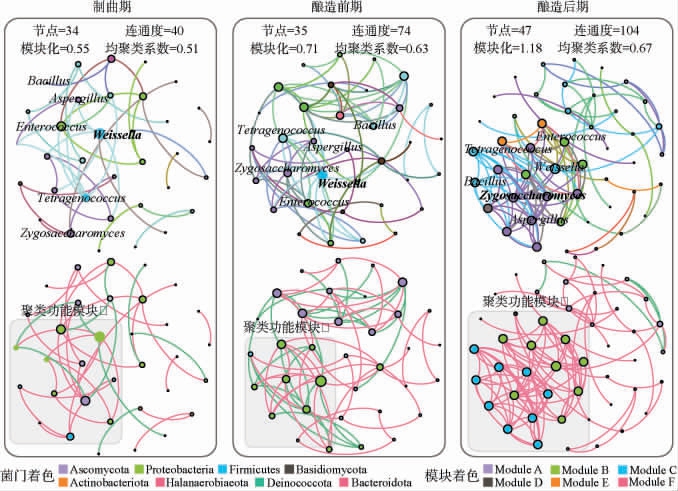
图3 从制曲向酿造阶段演替的微生物菌群相对丰度比较
Fig.3 Comparison of relative abundance of microbial community in succession process from koji-making to brewing period
节点代表菌属,菌属之间的连线代表连通度,上层同一个颜色按照菌门着色,下层同一个颜色按照模块着色。
菌群共发生网络拓扑结构揭示了微生态的演替过程。制曲阶段,参与共发生的菌属数量仅有34个(节点=34),连通度为40,仅表现为菌属的一对一互作现象,模块化和聚类化均较差。酿造阶段,随着还原糖、氨基酸等营养物质的积累,菌群共发生网络得到了持续强化[25]。尤其是酿造后期,共发生网络扩张到47个节点、104个连通度(是制曲期的2.6倍),菌属表现为一对多互作。其中,接合酵母菌属取代制曲期和酿造前期的魏斯氏菌属,成为新的基石类群,联通整个共发生网络。接合酵母菌属的优势有利于酸类、酯类、醇类等酱油综合香气的形成[26],而接合酵母成为优势基石类群的前提,可能是由魏斯氏菌属主导的乳酸菌代谢因子和酸性环境[27]。
2.4 酱油风味特征分析
通过感官评价构建了酱油大曲、酿造前期和酿造后期的风味轮廓,并采用电子鼻分析进一步验证了酱油酿造变化的整体感官特点,结果见图4。
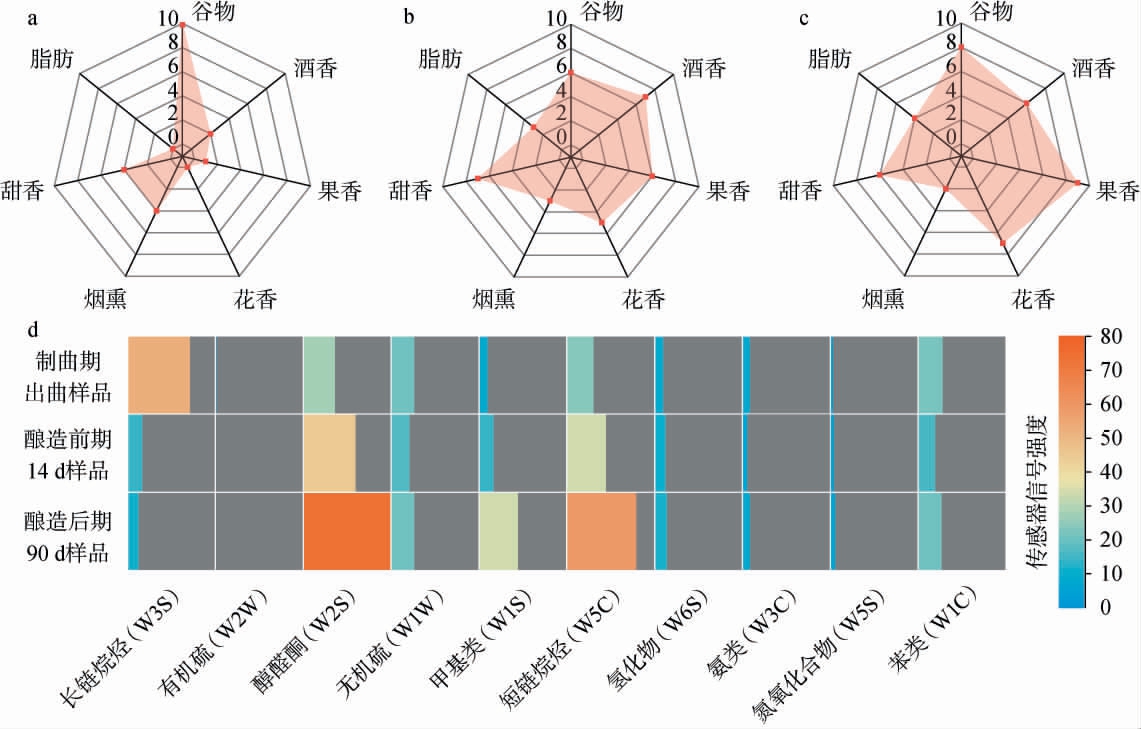
图4 酱油酿造过程中风味特征感官评价及电子鼻分析结果
Fig.4 Sensory evaluation and electronic nose analysis results of flavor characteristics in the soy sauce brewing process
a为制曲期出曲样品的感官评价;b为酿造前期14 d样品的感官评价;c为酿造后期90 d样品的感官评价;d为电子鼻评价结果。
由图4a~c可知,大曲以物料原始风味为主,呈谷物香气并略带甜香和烟熏香;酿造阶段酒香、果香和花香逐渐增强,说明醇类、醛类、酮类及酯类物质在酿造过程中逐渐富集[28]。酿造后期脂肪味增强,可能是由于以大豆为底物的脂质富集和氧化产生的脂肪味组分所致。
由图4d可知,从制曲到酿造演替过程中,长链烷烃逐渐减少,而醇醛酮、甲基类、短链烷烃逐步富集。醇醛酮类物质是酱油复杂酒香、花香和甜香的源头,而甲基类组分可能会带来醇香、坚果香、果香等的香气特征[28]。此外,富集的短链烷烃,则是醇醛酮及酯类组分的重要底物储备。
通过GC-MS从酱油酿造过程中共检出71种挥发性风味物质,其中OAV≥1的关键挥发性风味物质共17种,结果见表1。由表1可知,在醇类物质中,2-甲基-1-丁醇和异戊醇具有浓郁的酒香[29],随着发酵的进行逐渐升高,在酿造后期达到最高;而蘑菇醇则是在制曲期含量较高,酿造期逐渐降低。在醛类物质中,异丁醛、异戊醛、2-甲基丁醛和3-甲硫基丙醛,为谷物香的主要来源,在制曲期含量高,酿造期有所下降;苯乙醛和壬醛对发酵后期的感官贡献比制曲期和发酵前期高,他们呈现出花果香和肉香味道[29]。在酯类物质中,乙酸乙酯、2-甲基丁酸乙酯、乙酸异戊酯和癸酸乙酯可以提供水果香[29],在酿造后期达到最高。4-乙烯基愈创木酚和2-乙酰基-1-吡咯啉主要在制曲期提供烟熏风味[30]。
表1 酱油酿造过程中关键挥发性风味物质含量分析结果
Table 1 Analysis results of key volatile flavor compounds contents in the soy sauce brewing process

注:“/”表示未检出。
化合物 阈值[31]/(mg·kg-1)制曲期(出曲样品)含量/(μg·kg-1)酿造前期(14 d)含量/(μg·kg-1)OAV OAV酿造后期(90 d)含量/(μg·kg-1)OAV 2-甲基-1-丁醇异戊醇蘑菇醇异丁醛异戊醛2-甲基丁醛3-甲硫基丙醛苯乙醛0.015 9 0.004 0.001 5 0.001 5 0.001 1 0.001 0.000 45 0.006 3/31.19±0.82 34.21±2.31 9.75±0.61 65.60±1.19 29.91±0.76 12.06±0.52 71.99±1.68/7.80±0.21 22.81±1.54 6.50±0.41 59.64±1.08 29.91±0.76 26.80±1.16 11.43±0.27 20.83±0.62 22.92±0.59 18.31±0.46 6.41±0.21 38.84±1.48 24.28±1.13 7.72±0.25 53.25±2.74 1.31±0.04 5.73±0.15 12.21±0.31 4.27±0.14 35.31±1.35 24.28±1.13 17.16±0.56 8.45±0.43 101.05±6.83 155.24±8.76 13.86±0.26 6.83±0.19 42.03±2.87 21.34±1.65 11.62±1.16 107.14±7.92 6.36±0.43 38.81±2.19 9.24±0.17 4.55±0.13 38.21±2.61 21.34±1.65 25.82±2.58 17.01±1.26壬醛乙酸乙酯2-甲基丁酸甲酯2-甲基丁酸乙酯乙酸异戊酯癸酸乙酯愈创木酚4-乙烯基愈创木酚2-乙酰基-1-吡咯啉0.001 1 0.005 0.000 25 0.000 013 0.000 15 0.005 0.000 84 0.012 02 0.000 053 4.78±0.32 1.95±0.15 4.35±0.29 0.39±0.03// / / /// / / /1.60±0.07 5.86±0.23 0.67±0.04 1.45±0.06 1.17±0.05 2.68±0.16// /// /7.18±0.16 22.76±1.87/1.59±0.36 1.16±0.08 6.32±0.43 6.53±0.15 4.55±0.37/122.31±27.69 7.73±0.53 1.26±0.09 161.15±6.92 7.85±0.58 13.41±0.58 148.11±10.94 1.90±0.07 11.33±0.38/2.26±0.08 0.94±0.03/// /// /
2.5 酱油酿造过程中的菌群对风味的影响
将挥发性风味物质与感官评分进行PLSR分析,结果见图5a。由图5a可知,酒香主要来源于2-甲基-1-丁醇和异戊醇;果香、花香和甜香主要由乙酸乙酯和癸酸乙酯等直链酯贡献,其次为2-甲基丁酸乙酯和乙酸异戊酯等支链酯的贡献;醛类物质在制曲期和发酵前期出现,主要为谷物香;蘑菇醇、4-乙烯基愈创木酚和2-乙酰基-1-吡咯啉在制曲期表现特殊,提供烟熏风味。将核心微生物与挥发性风味物质进行O2PLS分析,结果见图5b。由图5b可知,四联球菌属和接合酵母菌属与2-甲基-1-丁醇、异戊醇以及多种酯类物质相关性最高,可能是酒香和果香的主要来源[32]。以魏斯氏菌为主体的产酸菌共发生模块,包括芽孢杆菌属、肠球菌属、片球菌属等,与醛类物质相关性高,有潜力成为醛类物质转化为酸类物质的源头,这与其从制曲向酿造阶段演替的早期定殖优势,以及高效表达的醛脱氢酶系密切相关[33]。
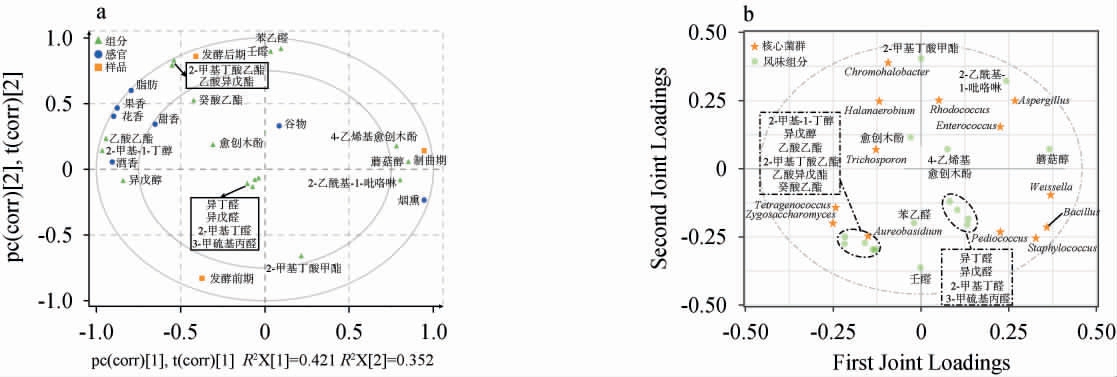
图5 挥发性风味物质与感官评分、核心微生物菌群的相关性分析结果
Fig.5 Analysis results of correlation between volatile flavor compounds and sensory evaluation, core microbial communities
3 结论
酱油大曲中的魏斯氏菌属(Weissella)、四联球菌属(Tetragenococcus)、芽孢杆菌属(Bacillus)、肠球菌属(Enterococcus)等细菌能一直持续存在于酱油的整个酿造期,其中魏斯氏菌属在曲池中相对丰度最高(68.7%),制曲期下降至40%以上,酿造前期维持在10%~20%,酿造后期降至最低(7.0%);四联球菌属的相对丰度则随着酿造时间延长不断增加,酿造后期最高达到41.3%;芽孢杆菌属(Bacillus)和肠球菌属(Enterococcus)相对丰度保持平稳(10%~20%)。曲霉属(Aspergillus)在酱油大曲制备和酿造阶段发挥了关键作用,平均相对丰度为74.9%。在酿造后期曲霉属的相对丰度下降,接合酵母菌属(Zygosaccharomyces)相对丰度升高,在酿造90 d时达到最高(77.4%)。菌群共发生网络的连通度在酿造后期是制曲期的2.6倍,说明大曲微生态演替到酿造阶段,并表现出一对多的菌群互作。细菌是醛类物质转化为酸类物质的源头,四联球菌属和接合酵母菌属是醇类和酯类香气的来源。综上,酱油大曲的制备是酱油酿造的关键,曲池环境是大曲中细菌多样性的主要来源。制曲期细菌能够演替或塑造酿造期的菌群微生态,并通过联通菌群互作形成功能模块,创造适宜酵母菌生长的生态位,进而改善酱油风味。本研究为酱油风味的定向调控提供了理论依据。
[1]SASSI S,WAN-MOHTAR W A A Q I,JAMALUDIN N S,et al.Recent progress and advances in soy sauce production technologies:A review[J].J Food Process Pres,2021,45(10):e15799.
[2]ZHAO C,LIN J Y,ZHANG Y X,et al.Comprehensive analysis of flavor formation mechanisms in the mechanized preparation Cantonese soy sauce koji using absolute quantitative metabolomics and microbiomics approaches[J].Food Res Int,2024,180:114079.
[3]ZHANG L L,XIONG S J,DU T H,et al.Effects of microbial succession on the dynamics of flavor metabolites and physicochemical properties during soy sauce koji making[J].Food Biosci,2023,53:102636.
[4]HU G Y,CHEN J,DU G C,et al.Moromi mash dysbiosis trigged by salt reduction is relevant to quality and aroma changes of soy sauce[J].Food Chem,2023,406:135064.
[5]WU W Y,CHEN T,ZHAO M M,et al.Effect of co-inoculation of different halophilic bacteria and yeast on the flavor of fermented soy sauce[J].Food Biosci,2023,51:102292.
[6]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nat Methods,2010,7(5):335-336.
[7]EDGAR R C.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nat Methods,2013,10(10):996-998.
[8]ABARENKOV K, NILSSON R H, LARSSON K H, et al.The UNITE database for molecular identification and taxonomic communication of fungi and other eukaryotes: sequences, taxa and classifications reconsidered[J].Nucleic Acids Res,2024,52(D1):D791-D797.
[9]YAO Y P,ZHOU X Y,HADIATULLAH H,et al.Determination of microbial diversities and aroma characteristics of Beitang shrimp paste[J].Food Chem,2021,344:128695.
[10]BASTIAN M, HEYMANN S, JACOMY M.Gephi: An open source software for exploring and manipulating networks[J].ICWSM,2009,8:361-362.
[11]ZHAO G Z, DING L L, HADIATULLAH H, et al.Characterization of the typical fragrant compounds in traditional Chinese-type soy sauce[J].Food Chem,2020,312:126054.
[12]GAO X L,FENG T,SHENG M J,et al.Characterization of the aromaactive compounds in black soybean sauce,a distinctive soy sauce[J].Food Chem,2021,364:130334.
[13]史伊格,蒲丹丹,勇倩倩,等.10种特级酱油香气差异分析[J].食品工业科技,2024,45(4):250-260.
[14]ZHAO C, ZHANG Y X, LI S S, et al.Impacts of Aspergillus oryzae 3.042 on the flavor formation pathway in Cantonese soy sauce koji[J].Food Chem,2024,441:138396.
[15]DEVANTHI P V P, GKATZIONIS K.Soy sauce fermentation: Microorganisms,aroma formation,and process modification[J].Food Res Int,2019,120:364-374.
[16]LIU P,YANG Z Q,JIN C Z,et al.Antifungal activity of metabolites of Weissella cibaria KM14 isolated from traditional Korean food kimchi against three spoilage fungi[J].LWT-Food Sci Techonl, 2024, 205:116545.
[17]YE M,LIU X,ZHAO L Y.Production of a novel salt-tolerant L-glutaminase from Bacillus amyloliquefaciens using agro-industrial residues and its application in Chinese soy sauce fermentation[J].Biotechnology,2013,12:25-35.
[18]ZHANG X L,LIU Z P,KANG B,et al.Effect of Lactobacillus plantarum or Enterococcus faecalis as co-inoculants with Aspergillus oryzae in koji making on the physicochemical properties of soy sauce[J].J Food Sci,2022,87(2):714-727.
[19]LI W J,LI C S,WANG Y Q,et al.Improvement effect of Halanaerobium fermentans YL9-2 on quality and flavor of fish sauce during fermentation[J].S China Fisheries Sci,2022,18(2):115-123.
[20]LIAN Y Y,SONG J J,MUMBY W,et al.The correlation between flavor formation and microbial community dynamics during the fermentation of Zha cai[J].J Sci Food Agr,2024,104(10):6233-6241.
[21]LI C S,ZHAO Y,WANG Y Q,et al.Contribution of microbial community to flavor formation in tilapia sausage during fermentation with Pediococcus pentosaceus[J].LWT-Food Sci Techonl,2022,154:112628.
[22]孙鲁欢.高盐胁迫下皮状丝孢酵母的微生物油脂发酵研究[D].上海:华东理工大学,2021.
[23]KANG X X,JIA S L,WEI X,et al.Liamocins biosynthesis,its regulation in Aureobasidium spp.,and their bioactivities[J].Crit Rev Biotechnol,2021,3:1-13.
[24]BARBERÁN A,BATES S T,CASAMAYOR E O,et al.Using network analysis to explore co-occurrence patterns in soil microbial communities[J].ISME J,2012,6(2):343-351.
[25]ZHOU X Y,GUO T,LU Y L,et al.Effects of amino acid composition of yeast extract on the microbiota and aroma quality of fermented soy sauce[J].Food Chem,2022,393:133289.
[26]徐新玉,李心智,吴昌正,等.接种产酯酵母结合梯度升温工艺对低盐稀态发酵酱油的风味提升研究[J].食品与发酵工业,2025,51(12):149-157.
[27]ZHOU X Y,GUO T, HADIATULLAH H, et al.Metabolic behavior of Aspergillus oryzae in salt-reduced soy sauce and its regulation for the brewing process[J].Food Biosci,2024,59:104206.
[28]DIEZ-SIMON C, EICHELSHEIM C, MUMM R, et al.Chemical and sensory characteristics of soy sauce: A review[J].J Agr Food Chem,2020,68(42):11612-11630.
[29]ARN H,ACREE T E.Flavornet:A database of aroma compounds based on odor potency in natural products[J].Dev Food Sci,1998,40:27.
[30]TIAN W H,ZHAO S Y,WANG Q F,et al.Influence of spatial and temporal diversity and succession of microbial communities on physicochemical properties and flavor substances of soy sauce[J].Food Chem,2025,463:141041.
[31]GEMERT L J V.Odour thresholds:compilations of odour threshold values in air,water and other media[M].Utrecht:Oliemans Punter&Partners BV,2011:207-359.
[32]DEVANTHI P V P,LINFORTH R,ONYEAKA H,et al.Effects of coinoculation and sequential inoculation of Tetragenococcus halophilus and Zygosaccharomyces rouxii on soy sauce fermentation[J].Food Chem,2018,240:1-8.
[33]KÖNST P,MERKENS H,KARA S,et al.Enantioselective oxidation of aldehydes catalyzed by alcohol dehydrogenase[J].Angew Chem Int Ed,2012,51(39):9914-9917.