大豆分离蛋白(soybean protein isolate,SPI)是豆粕在低温条件下经碱提、酸沉、洗涤、干燥等一系列处理后得到的提取物,蛋白含量高达90%以上[1-2],且必需氨基酸组成完整,是唯一的一种全价植物蛋白[3-4]。在国内油脂工业发展带动下,豆粕产量巨大(年产约7 682万t)[5],为SPI提供了稳定的生产供应来源,但由于一直缺乏有效的利用途径,至今豆粕仍主要被用作饲料,造成了优质蛋白资源的浪费。如何高效挖掘豆粕蛋白资源的营养与经济价值一直是国内外科研学者关注的焦点。
SPI序列中富含活性氨基酸[谷氨酰胺(glutamine,Q)和精氨酸(arginine,R)]和鲜味氨基酸[谷氨酸(glutamic acid,E)和天冬氨酸(aspartic acid,D)][6-7],利用生物酶解或发酵制备抗氧化肽[8]、免疫活性肽[9]、鲜味肽膏[6,10]等产品,是其重要利用途径之一[11]。然而,由于SPI序列组成特性研究缺乏,前期相关大豆活性肽或呈味肽的制备常缺乏明确的目标,以致产物功能活性或呈味特性不突出,特征肽不明确,限制了其工业应用。大量研究表明SPI序列主要由7S(α,α'和β亚基)和11S(酸性和碱性亚基)组成,但各亚基对应的具体蛋白序列尚未明晰,同时,序列中潜在的高丰度活性或鲜味肽鲜见有相关报道,不利于大豆多肽的靶向制备,严重阻碍了大豆活性与鲜味肽的品质提升与产业发展。
为此,本研究采用蛋白质组学与十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)解析大豆分离蛋白(SPI)的序列组成,基于多肽组学分析SPI中的高丰度多肽序列,并结合多肽数据库和预测模型挖掘SPI中的生物活性肽和鲜味肽,以期为SPI中高丰度活性肽或鲜味肽的靶向酶解或发酵释放提供理论指导与科学依据,并助力推动大豆蛋白资源的充分利用与价值挖掘。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(蛋白含量>90%):湖南千荣食品配料有限公司;胰蛋白酶(2 500 U/g)、乙腈、甲酸(均为色谱纯):上海麦克林生化科技股份有限公司;4%~20%梯度预制胶:北京索莱宝科技有限公司;BeyoColorTM彩色预染蛋白标准品(分子质量为10~170 kDa)、5×SDS-PAGE蛋白上样缓冲液:上海碧云天生物技术有限公司。
1.2 仪器与设备
Microfuge 20R高速冷冻离心机:美国Beckman Coulter公司;X500高分辨高效液相色谱-电喷雾电离-四级杆飞行时间质谱(high performance liquid chromatography-electrospray ionization-quadrupole-time of flight-mass spectrometry,HPLC-ESI-Q-TOF-MS)联用仪:美国AB-SCIEX公司;1×100 mm HSS T3色谱柱(2.1 mm×50 mm×1.8 μm):美国Waters公司;Mini-PROTEAN® Tetra 电泳槽(配置PowerPacTM电源):美国Bio-Rad公司;Tanon 5200系列全自动化学发光图像分析系统:上海天能科技有限公司。
1.3 方法
1.3.1 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
参考HSIA S Y等[12]的方法略作修改。将大豆分离蛋白溶液质量浓度稀释至2 mg/mL,取20 μL样品溶液与5 μL蛋白上样缓冲液混合,100 ℃沸水浴5~10 min,冷却至室温后上样。电泳条件:12%分离胶与4%浓缩胶浓度,每孔上样15 μL,80 V浓缩胶电压30 min,120 V分离胶电压1~2 h。电泳结束后,取出凝胶,使用考马斯亮蓝R-250染色24 h,去离子水脱色至条带清晰,最后使用凝胶成像仪采集电泳图像并分析。
1.3.2 蛋白质组学分析
1%大豆分离蛋白水溶液,调节pH至7.5,加入1%胰蛋白酶(以蛋白质含量计),37 ℃酶解24 h,酶解结束后,95 ℃灭酶15min,冷却至室温后,4℃、8 000r/min条件下离心20 min,取上清液稀释至质量浓度2 mg/mL,过0.22 μm水系滤膜,上机分析[13-14]。
使用高分辨液质联用(HPLC-ESI-Q-TOF-MS)仪对样品进行分离和检测,流动相由0.1%(V/V)的甲酸水溶液A相和乙腈B相组成,液相洗脱梯度及质谱采集参数依据范丽琪等[15]前期研究进行设置。质谱数据采用软件Proteo Wizard 3.0进行格式转换。从蛋白质数据库Uniprot(https://www.uniprot.org/)中采用关键词“soybean”进行搜索,筛选种子蛋白并下载相应的Fsata序列。采用软件Proteome Discoverer 2.4进行搜库鉴定,酶切方式为Trypsin,全降解模式,多肽鉴定引擎为Sequest,肽段长度范围设置4~100个氨基酸残基,一级离子质量误差20 ppm,二级离子质量误差0.02 Da,容错率(false discovery rate,FDR)设置为1%。
1.3.3 蛋白序列统计分析
根据蛋白质组学与电泳分析结果,采用PepOS 3.0.4软件[16]对SPI序列进行统计分析,统计长度范围2~10个氨基酸残基,质量含量输出阈值1%,长度覆盖率输出阈值1%。
1.3.4 肽段活性匹配分析
利用在线工具生物活性肽数据库(Bioactive peptides-University of Wisconsin-Milwaukee,BIOPEP-UWN)(https://biochemia.uwm.edu.pl/biopep/start_biopep.php)对源序列中所有可能的多肽进行活性匹配分析[17],包括活性肽的全匹配与部分匹配。
1.3.5 鲜味肽预测分析
利 用 在 线 工 具Umami·YYDS(http://www.tastepeptides-meta.com/Umami_YYDS)对源序列中的潜在高丰度多肽进行鲜味预测分析,该方法在输入多肽序列后,自动提取序列特征,再基于模型权重和决策树结构计算其鲜味评分,最终输出预测值,以量化该肽段的鲜味强度[18]。
1.3.6 数据处理
采用Excel 2016对实验数据进行整理,利用Image J 1.54f软件对电泳图像进行分析并计算,采用Origin 2018,GraphPad prism 9.5进行绘图。
2 结果与分析
2.1 基于蛋白组学的SPI序列组成分析
对SPI进行蛋白质组学分析,结合非标定量法计算各蛋白条带相对组成,结果见表1。由表1可知,SPI主要共由8条不同的蛋白序列组成,这些序列主要可分为两大类:β-伴大豆球蛋白(β-conglycinin)和大豆球蛋白(glycinin)。其中,序列P0DO16、P11827和P25974分别对应β-伴大豆球蛋白(β-conglycinin)中的α、α'以及β亚基,累计占比42.49%,依据相关文献报道推测前者主要为7S 组分,而序列P04776、P04005、P11828、P04347 和P02858 则 来 源 于 大 豆 球 蛋 白(glycinin)中的5个亚基(G1~G5),累计占比57.51%,考虑其组分占比与文献报道中的11S组分占比相近,推测其可能主要与11S有关[19],但其序列分子质量与文献报道中的11S分子质量并不一致,有待在后文中进一步分析讨论。
表1 基于蛋白质组学的大豆分离蛋白序列组成分析
Table 1 Composition analysis of soy isolate protein sequences based on proteomics
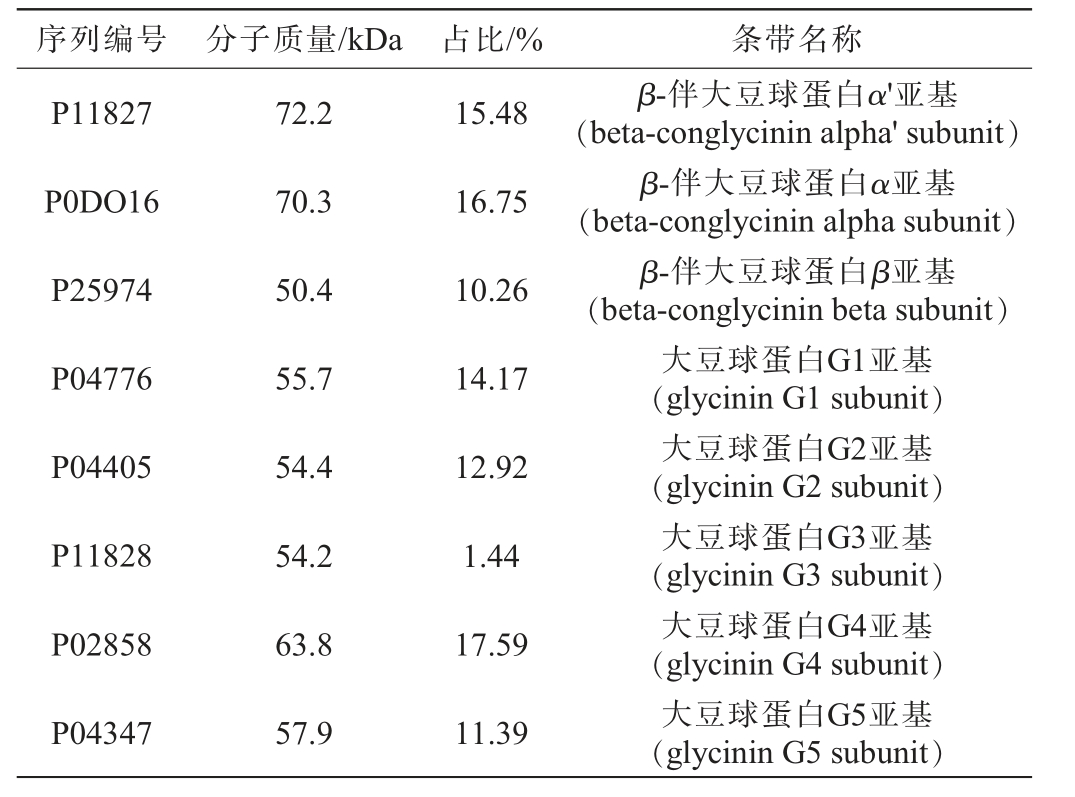
序列编号 分子质量/kDa 占比/% 条带名称P11827 P0DO16 P25974 P04776 P04405 P11828 P02858 P04347 72.2 70.3 50.4 55.7 54.4 54.2 63.8 57.9 15.48 16.75 10.26 14.17 12.92 1.44 17.59 11.39 β-伴大豆球蛋白α'亚基(beta-conglycinin alpha'subunit)β-伴大豆球蛋白α亚基(beta-conglycinin alpha subunit)β-伴大豆球蛋白β亚基(beta-conglycinin beta subunit)大豆球蛋白G1亚基(glycinin G1 subunit)大豆球蛋白G2亚基(glycinin G2 subunit)大豆球蛋白G3亚基(glycinin G3 subunit)大豆球蛋白G4亚基(glycinin G4 subunit)大豆球蛋白G5亚基(glycinin G5 subunit)
2.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析与蛋白序列注释
为进一步明晰SPI序列的组成情况,对SPI进行SDSPAGE凝胶电泳分析,并采用软件ImageJ对电泳图像进行分析并计算,结果见图1。由图1a可知,SPI主要由6个不同分子质量的条带组成,分别包括来自7S组分的α'、α和β亚基和11S组分的酸性亚基和碱性亚基。由图1b可知,7S组分占比约42%,11S组分占比约为58%,二者比值为1.38,与文献[20-21]报道和蛋白质组学分析结果接近一致,说明前述分析具备较高的可靠性与准确性。结合表1可知,大豆球蛋白(glycinin)中的5个亚基(G1~G5)确实应与11S组分的酸性亚基和碱性亚基相对应,但由于电泳分析无法显示具体序列组成,二者之间的具体对应关系尚无法可知。11S的两个组分分子质量均小于大豆球蛋白(glycinin)5个亚基(G1~G5)分子质量,由此推测这可能与SPI中大豆球蛋白(glycinin)序列在电泳样品制备过程中发生了断裂和二次聚集有关[22-24]。
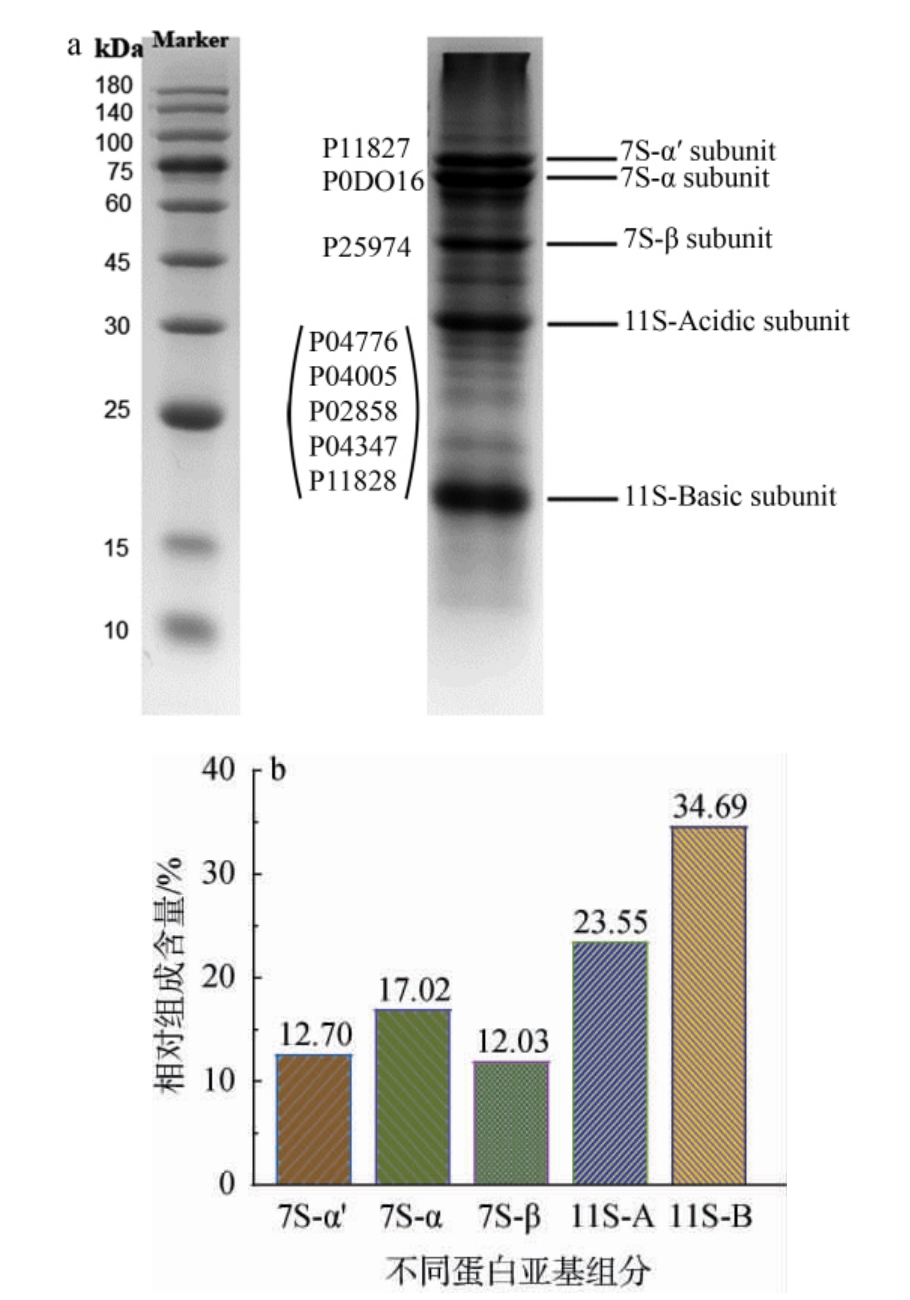
图1 大豆分离蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析与序列注释结果
Fig.1 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis analysis and sequence annotation results of soybean protein isolates
综上,对图1a中各泳带进行注释,表1中序列P0DO16、P11827和P25974分别对应泳带7S β-大豆球蛋白(glycinin)中的α、α'以及β亚基,而序列P04776、P04005、P02858、P04347和P11828则整体主要对应泳带11S的酸性和碱性亚基部分,虽其具体对应关系尚不明晰,仅能知晓碱性与酸性亚基的组成占比,但这一现象对于后续基于蛋白质组学和肽组学的序列统计分析基本无影响。
2.3 SPI序列中的潜在高丰度多肽分析
基于表1中所述蛋白序列组成,分析SPI的理论氨基酸组成,进一步对蛋白质组学分析结果进行辅助验证,发现高丰度氨基酸,如亮氨酸(leucine,L)(9.54%)、谷氨酰胺(Q)(11.40%)、精氨酸(R)(10.01%)、谷氨酸(E)(12.85%)等与相关文献报道基本一致[25],说明蛋白质组学分析结果基本可靠。进一步使用PepOSX 3.0.软件[26]对序列中所有可能的多肽进行频次统计和相对组成含量分析,筛选理论上最大组成含量排名Top15的潜在高丰度多肽,并统计其等电点与疏水性值,结果见图2。由图2a可知,SPI序列中理论高丰度多肽大多为包含L、Q、R和E的二肽,尤其含E、Q、L等氨基酸的二肽序列相对丰度较高,这一现象主要与前述氨基酸残基含量高有关,在潜在目标肽筛选过程中,应优先考虑含有这几种氨基酸残基的短肽。此外,谷氨酸-谷氨酸(EE)、谷氨酰胺-谷氨酰(QQ)和天冬氨酸-谷氨酸(DE)等二肽的相对含量较高,分别为3.74%、3.07%、2.84%。其中EE和DE均含有鲜味谷氨酸残基,据报道二者具有较强的鲜味特性[27-28],同时在免疫调节和抗氧化中还可发挥重要作用,能够有效清除自由基,减少氧化应激[29],而QQ含有谷氨酰胺残基,据报道可有助于促进细胞增殖[30],具备较强的生理活性。这三种二肽较高的理论含量、生物活性和鲜味特性亦较好地展示了大豆肽在功能食品和调味品领域的广阔发展前景。

图2 大豆分离蛋白序列中的潜在高丰度多肽
Fig.2 Potential high-abundance polypeptides in soy protein isolate sequences
a.理论最高组成含量和序列覆盖率;b.等电点;c.疏水性。S为丝氨酸(serine)、P为脯氨酸(proline)、G为甘氨酸(glycine)。
由图2b可知,Top15的理论多肽的等电点主要聚集分布于3.5~4.0、5.8~6.0以及10.0~11.0三个区间,分别为靶向酶解SPI制备多肽在酸性、中性和碱性食品中的应用指明了可行目标。值得注意的是,等电点位于3.5~4.0区间的Top理论多肽数量最多,且理论最大含量较高,反映以二肽(EE、QQ、DE等)作为SPI靶向酶解释放目标预期可获得较高的理论可行性,并在近中性或偏碱性食品(功能型水、运动饮料、弱碱性水)中获得较好的稳定性。不同多肽的疏水性值以Gravy值评价[31-32],负值表现为亲水,正值表现为疏水。由图2c可知,除亮氨酸-亮氨酸(LL)以外,其余Top 15理论多肽的Gravy值均为负值,表明其具有较好的亲水性,可在水溶液体系中获得较好的稳定性并发挥其功能或呈味特性,这也反映靶向酶解SPI制备疏水性多肽的难度较大,同时,大豆肽在白酒中的应用可能导致较多沉淀产生。
2.4 SPI序列中的多肽重复特征分析
基于SPI蛋白序列和理论Top15多肽分别统计X_Z_Y、X_Z_和_Z_Y(X和Y表示某种具体氨基酸残基,Z表示间隔氨基酸残基的数量)类型多肽的理论最大组成含量,分析序列重现特征,结果见图3。
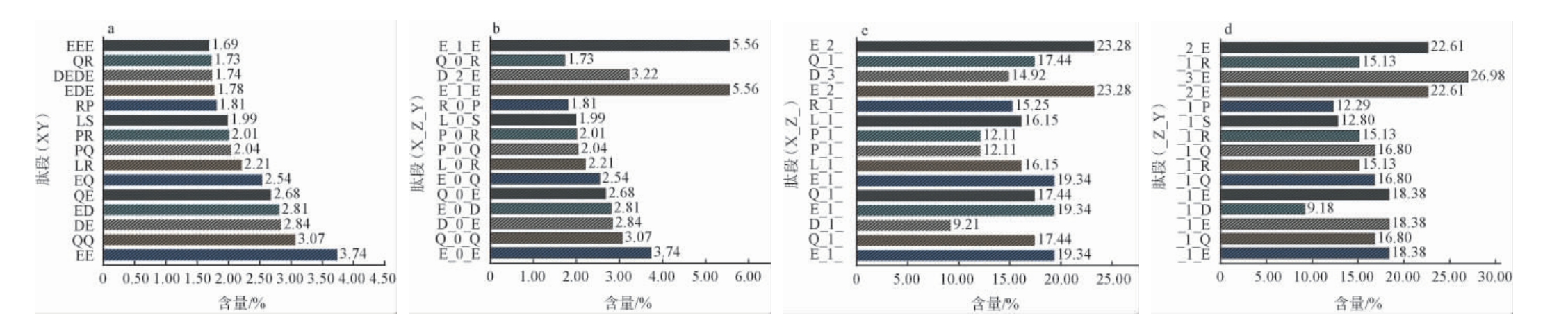
图3 大豆分离蛋白序列中Top15多肽的重复特征分析
Fig.3 Repetitive characteristics analysis of Top 15 polypeptides in soy protein isolate sequences
由图3a可知,二肽谷氨酸-谷氨酸(EE)、谷氨酰胺-谷氨酰胺(QQ)的相对含量最高,分别达到3.74%和3.07%。由图3b可知,N端和C端均为谷氨酸残基的三肽谷氨酸-任意1个氨基酸-谷氨酸(E_1_E)含量比二肽谷氨酸-谷氨酸(E_0_E)含量更高,达到了5.56%。由图3c和3d可知,SPI蛋白序列主要以E或Q起始和结尾的二肽和三肽重复居多,其理论最大含量均>16%,尤其含E的二肽及三肽理论最大含量均>18%,充分展示了大豆寡肽在鲜味剂领域的广阔发展和提升空间。与此同时,序列中含有L的二肽重复率或占有率亦较高,可达15.88%,以其为酶解释放目标预期可为大豆抗氧化二肽的制备提供较强可行性[33]。这些多肽片段重复特征分析可为SPI的靶向酶解释放提供一定理论参考,尤其在酶制剂的选择方面将具有重要指导意义。
2.5 SPI序列中多肽的活性匹配与呈味预测
对SPI蛋白序列中重现率或理论相对组成含量不低于1%的多肽进行活性匹配,统计含有已知活性片段的多肽数量,结果见图4。由图4可知,SPI蛋白序列中的多肽片段富含各种生物活性,包括降血糖[34]、降血压[35]、激活[36]、抗氧化[37]、抗炎[38]及神经活性[39]等,其中,包含已知降血压和降血糖活性片段的多肽数量较多,反映SPI在这两种生物活性肽产业领域具有良好的发展前景。值得注意的是,由于当前活性肽数据库收录容量较小,可能导致在其他生物活性方面匹配分析结果存在偏差。目前,高血压、高血糖作为“三高”疾病的典型代表[40],国内外相关研究较为广泛,故对应活性肽的发掘较为完善,数据库收录信息较多,有利于对应活性肽的匹配分析。未来,随着数据库的不断完善,活性多肽的挖掘将迎来显著加速和发展。
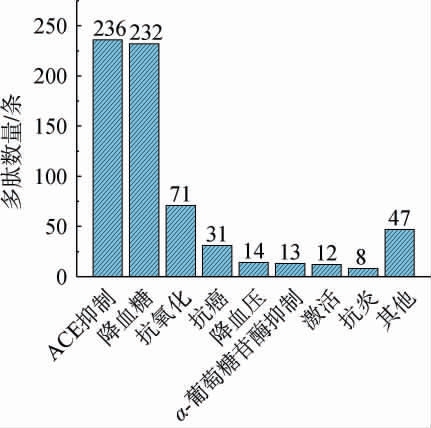
图4 包含已知活性片段的理论多肽数量
Fig.4 Theoretical quantity of polypeptides containing known bioactive fragments
对理论最大组成Top 15的潜在高丰度多肽进行活性全匹配分析,并使用Umami·YYDS模型对多肽进行鲜味预测,结果见表2。
表2 潜在高丰度Top 15多肽活性匹配与鲜味预测结果
Table 2 Activity matching and umami prediction results of potential high abundance Top 15 polypeptides
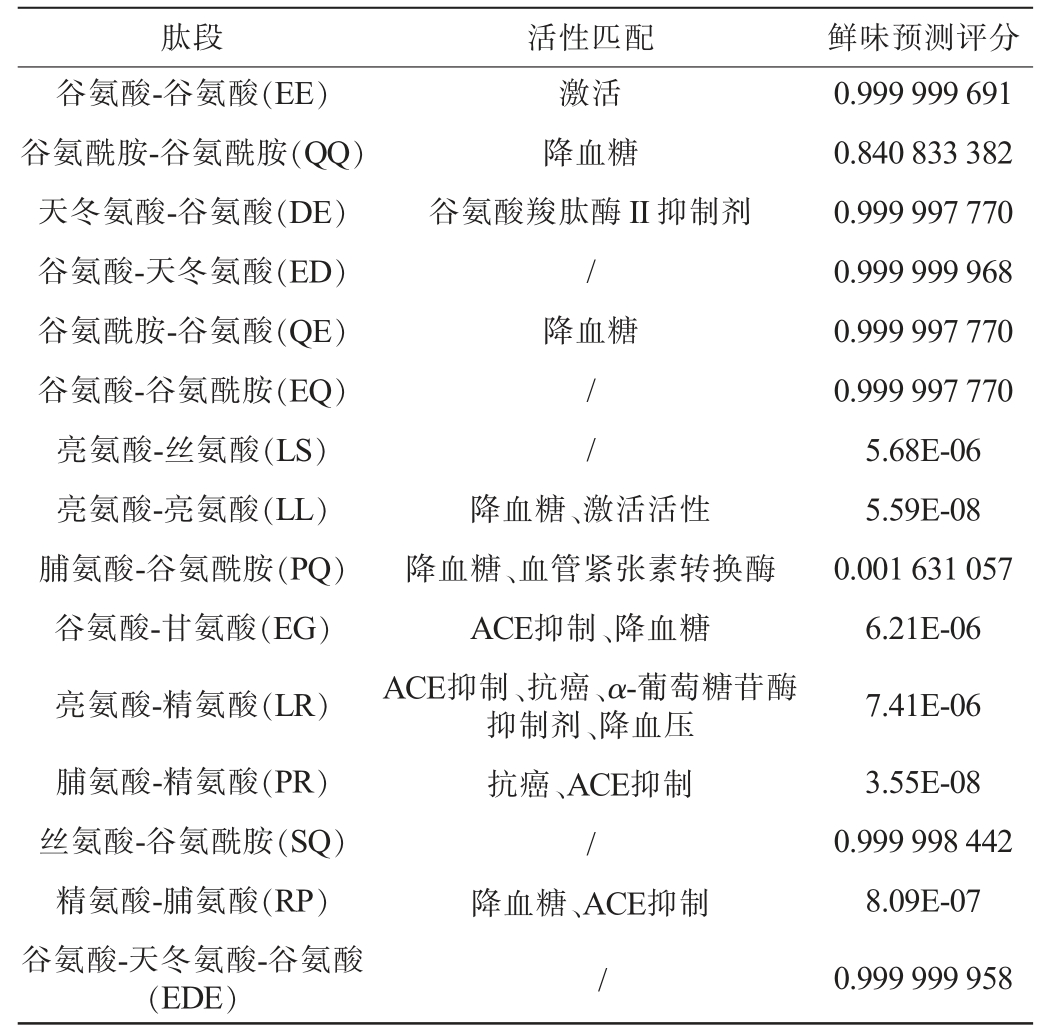
注:鲜味预测评分:评分越接近“1”或“0”即模型认为其鲜味或苦味物质的概率越大。
肽段 活性匹配 鲜味预测评分谷氨酸-谷氨酸(EE)谷氨酰胺-谷氨酰胺(QQ)天冬氨酸-谷氨酸(DE)谷氨酸-天冬氨酸(ED)谷氨酰胺-谷氨酸(QE)谷氨酸-谷氨酰胺(EQ)亮氨酸-丝氨酸(LS)亮氨酸-亮氨酸(LL)脯氨酸-谷氨酰胺(PQ)谷氨酸-甘氨酸(EG)亮氨酸-精氨酸(LR)脯氨酸-精氨酸(PR)丝氨酸-谷氨酰胺(SQ)精氨酸-脯氨酸(RP)谷氨酸-天冬氨酸-谷氨酸(EDE)激活降血糖谷氨酸羧肽酶II 抑制剂/降血糖//降血糖、激活活性降血糖、血管紧张素转换酶ACE抑制、降血糖ACE抑制、抗癌、α-葡萄糖苷酶抑制剂、降血压抗癌、ACE抑制/降血糖、ACE抑制/0.999 999 691 0.840 833 382 0.999 997 770 0.999 999 968 0.999 997 770 0.999 997 770 5.68E-06 5.59E-08 0.001 631 057 6.21E-06 7.41E-06 3.55E-08 0.999 998 442 8.09E-07 0.999 999 958
由表2可知,潜在高丰度Top 15多肽中,有10条二肽具备已知报道的生物活性,主要为激活活性、降血糖活性和血管紧张素转化酶(angiotension converting enzyme,ACE)抑制活性等,其中LR所报道的生物活性最多,拥有4种生物活性。在鲜味预测方面,Top 15条多肽中,有7条评分值均>0.99,依据模型输出原则,评分值越接近1则鲜味越强,评分值越接近0则苦味越强,说明这些多肽可能具有较强的鲜味特性,且占比达到50%,结合TAMURA M等[41]相关研究报道,其中DE、EE已被明确报道具有较强的鲜味特性,这充分展示了SPI在靶向功能型调味剂中的广阔发展和应用前景。值得注意的是,亮氨酸-精氨酸(LR)、亮氨酸-亮氨酸(LL)、脯氨酸-精氨酸(PR)等二肽鲜味预测评分均<0.05甚至为0,依据模型预测显示其可能为苦味物质,结合其构效组成分析,这可能与多肽氨基酸残基侧链的疏水性基团有关。苦味虽常令人难以接受,但研究表明,苦味与鲜味等多种滋味的交织组合,往往给人以丰富多彩的味觉感受,这也是呈味肽膏在调味品中广泛应用与备受欢迎的重要原因。
3 结论
本研究通过蛋白质组学和SDS-PAGE分析揭示了大豆分离蛋白(SPI)的主要蛋白序列组成,并结合多肽组学分析工具对SPI中的高丰度多肽进行了统计分析、活性匹配和呈味预测。结果表明,SPI主要由P11827、P0DO16、P25974、P04776、P04405、P11828、P02858和P04347 合计8条蛋白序列组成,其中P11827、P0DO16和P25974分别对应7S组分中的α、α'以及β亚基,合计占比约42.49%,而后5条序列(分别占比14.17%、12.92%、1.44%、17.59%和11.39%)可能是由于在电泳样品制备过程中发生了意外断裂,在泳带上对应显示为11S的酸性和碱性亚基组分,累计占比约57.51%。经统计发现,SPI序列中以二肽的潜在理论含量较高,尤其EE、QQ、DE等二肽理论最大含量>2.5%,对应序列中以E或Q开头和结尾的二肽重复特征突出,理论最大含量均>16%,且具备较高的潜在鲜味特性或降血糖活性,充分展示了SPI在靶向功能型鲜味剂中的广泛应用前景。未来研究将对前述二肽进行合成,评价其鲜味特性和生物活性,并就其靶向酶解或发酵释放和制备展开探讨和研究。
[1]孟昂,栾滨羽,郭波莉,等.碱提酸沉参数影响大豆分离蛋白变性、聚集和流变特性的研究进展[J].食品科学,2024,45(10):342-354.
[2]刘紫薇,朱明明,王凤新,等.高温湿热处理对大豆分离蛋白的结构及其功能特性的影响[J].食品与发酵工业,2021,47(15):157-164.
[3]王天宇.葡萄糖对提取过程中大豆分离蛋白性质的影响[J].食品研究与开发,2017,38(9):41-45.
[4]尹秀莲,赵瑜辉,管明,等.大豆分离蛋白提取及其凝胶制备影响因素研究[J].食品与发酵科技,2017,53(6):62-66.
[5]王辽卫.我国豆粕供需形势及减量替代实施现状[J].广东饲料,2024,33(9):18-20.
[6]刘立煜.大豆呈味基料酶法制备过程聚集物研究[D].广州:华南理工大学,2021.
[7]WANG Y M,ZHANG Z,SHENG Y,et al.A systematic review on marine umami peptides:Biological sources,preparation methods,structure-umami relationship,mechanism of action and biological activities[J].Food Biosci,2024,57:103637.
[8]CHATTERJEE C,GLEDDIE S,XIAO C W.Soybean bioactive peptides and their functional properties[J].Nutrients,2018,10(9):1211.
[9]CABANOS C, MATSUOKA Y, MARUYAMA N.Soybean proteins/peptides:a review on their importance,biosynthesis,vacuolar sorting,and accumulation in seeds[J].Peptides,2021,143:170598.
[10]曾沐芝.大豆—鸡肉呈味基料的制备及其在鸡肉肠中应用研究[D].广州:华南理工大学,2022.
[11]王金玲,王雨淅,王梓同,等.大豆多肽的制备及功能性研究进展[J].中国酿造,2022,41(1):25-31.
[12]HSIA S Y, HSIAO S Y H, LI W T, et al.Aggregation of soy proteinisoflavone complexes and gel formation induced by glucono-δ-lactone in soymilk[J].Sci Rep,2016,6(1):35718.
[13]杨昭,黄佳佳,姚玉静,等.水解度对牡蛎酶解产物功能特性和抗氧化活性的影响[J].食品工业,2021,42(5):134-138.
[14]侯艳霞,刘丽萍,潘浩,等.高效液相色谱-电感耦合等离子体质谱分析大米中砷形态化合物[J].分析试验室,2013,32(10):103-107.
[15]范丽琪,刘洋,杨宝,等.酸溶性大豆蛋白酶解产物的制备及特性研究[J].食品工业科技,2025,46(3):53-59.
[16]刘万顺,郑淋,李文治,等.PepOSX在食品多肽组学鉴定分析中的应用与评价[J].现代食品科技,2024,40(12):91-97.
[17]MINKIEWICZ P, IWANIAK A, DAREWICZ M.BIOPEP-UWM database of bioactive peptides:Current opportunities[J].Int J Mol Sci,2019,20(23):5978.
[18]CUI Z Y,ZHANG Z W,ZHOU T X,et al.A TastePeptides-Meta system including an umami/bitter classification model Umami_YYDS,a Taste-PeptidesDB database and an open-source package Auto_Taste_ML[J].Food Chem,2023,405:134812.
[19]LIU S S,LUO T T,SONG Y R,et al.Hypocholesterolemic effects of soy protein isolates from soybeans differing in 7S and 11S globulin subunits vary in rats fed a high cholesterol diet[J].J Funct Foods,2022,99:105347.
[20]吴海波,邱硕,朱秀清,等.不同11S/7S比值原料豆乳的乳液特性研究[J].食品工业科技,2019,40(22):49-55.
[21]JOHN H,CHANDRA P,GIRI S K,et al.Effect of processing methods on 11S/7S protein and nitrogen solubility index of soy protein isolate[J].J Inst Eng India Ser A,2021,102(4):1-6.
[22]YIN H C,HUANG J,ZHANG H R.Study on isolation and raman spectroscopy of glycinin in soybean protein[J].Grain Oil Sci Technol,2018,1(2):72-76.
[23]HUANG Y Y, LIU J Y, LI Y P, et al.Focusing on the mechanism of glycinin-soybean lipophilic protein hybrid gels:Effect of ultrasonic,subunit interactions,and formation process analysis[J].Ultrason Sonochem,2025,113:107239.
[24]YANG Z, LI D Z, CHEN L, et al.Structural characteristics, technofunctionalities,innovation applications and future prospects of soybean β-conglycinin/glycinin:a comprehensive review[J].Crit Rev Food Sci Nutr,2024:11-18.
[25]陈智仙,张海波,张双庆,等.3种不同来源蛋白质的氨基酸组成及体外动态消化研究[J].河南工业大学学报(自然科学版),2019,40(2):62-68.
[26]LIU W S,ZHAO M M,GAN L S,et al.PeposX-Exhaust:A lightweight and efficient tool for identification of short peptides[J].Food Chem X,2024,22:101249.
[27]王春鑫,吴燕燕,方秀,等.基于微生物代谢的传统发酵海鲈鲜味肽筛选及其对苦味的抑制作用[J].食品科学,2024,45(21):147-156.
[28]ZHANG L Y,ZHANG L,PÉREZ-MORENO J,et al.Novel umami peptides from two Termitomyces mushrooms and molecular docking to the taste receptor T1R1/T1R3[J].Food Science and Human Wellness,2024,13(2):1055-1064.
[29]JIANG J,SHI D,ZHOU X Q,et al.Effects of glutamate on growth,antioxidant capacity, and antioxidant-related signaling molecule expression in primary cultures of fish enterocytes[J].Fish Physiol Biochem,2015,41(5):1143-1153.
[30]LI X,PENG X Q,LI Y,et al.Glutamine addiction in tumor cell:oncogene regulation and clinical treatment[J].Cell Commun Signal,2024,22(1):12.
[31]KYTE J,DOOLITTLE R F.A simple method for displaying the hydropathic character of a protein[J].J Mol Biol,1982,157(1):105-132.
[32]彭伟,程蓉,刘豪,等.可溶性疏水性标签辅助的高效连续流液相多肽合成[J].有机化学:2024,44(9):2876-2888.
[33]张东杰,马中苏.凝胶过滤色谱分离大豆抗氧化肽活性的研究[J].中国酿造,2010,29(6):41-44.
[34]XU Y,YANG Y,MA C M,et al.Characterization of the structure,antioxidant activity and hypoglycemic activity of soy(Glycine max L.)protein hydrolysates[J].Food Res Int,2023,173:113473.
[35]宋田源.大豆蛋白肽的降血压及改善血管功能损伤的作用研究[D].广州:华南理工大学,2022.
[36]ZHOU M Z,SONG T Y,LI W,et al.Identification and screening of potential ACE2 activating peptides from soybean protein isolate hydrolysate against Ang II-induced endothelial dysfunction[J].J Agr Food Chem,2023,71(31):11957-11969.
[37]AMAKYE W K,HOU C L,XIE L P,et al.Bioactive anti-aging agents and the identification of new anti-oxidant soybean peptides[J].Food Biosci,2021,42:101194.
[38]EL-ASHMAWY N E,KHEDR E G,SHAMLOULA M M,et al.Evaluation of the antirheumatic effects of isoflavone-free soy protein isolate and etanercept in rats with adjuvant-induced arthritis[J].Exp Biol Med,2019,244(7):545-553.
[39]KIM I,YANG W,KIM C.Beneficial effects of soybean-derived bioactive peptides[J].Int J Mol Sci,2021,22(16):8570.
[40]CHELLIAH R,WEI S,DALIRI E B,et al.The role of bioactive peptides in diabetes and obesity[J].Foods,2021,10(9):2220.
[41]TAMURA M, NAKATSUKA T, TADA M, et al.The relationship between taste and primary structure of"Delicious Peptide"(Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala) from beef soup[J].Biosci Biotechnol Biochem,2014,53(2):319-325.