2-苯乙醇(2-phenylethanol,2-PE),又称β-苯乙醇,是一种具有玫瑰风味的芳香醇,天然存在于玫瑰、茉莉等多种植物精油中[1],广泛应用于制药和食品工业(如软饮料、糖果、冰淇淋、布丁、口香糖、饼干)[2]。目前,2-苯乙醇的生产工艺基于化学合成,但该方法会产生不需要的副产品和有毒化合物,对环境不友好。随着食品生物技术的发展和人们对食品安全性越来越重视,通过微生物发酵法生产天然苯乙醇香料得到国内外研究者的广泛关注与重视[3-4]。已有研究表明,自然界中存在多种可以合成2-苯乙醇的微生物,如酿酒酵母(Saccharomyces cerevisiae)、黑曲霉(Aspergillus niger)、白地霉(Geotrichum candidum)等。但最有前途的生产2-苯乙醇的菌种还是以酵母菌为主,如产朊假丝酵母(Candidautilis)、酿酒酵母、发酵毕赤酵母(Pichiafermentans)、克鲁维酵母(Kluyveromyces)、异常汉逊酵母(Hansenula anomala)、季也蒙毕赤酵母(Meyerozyma guilliermondii)等[5-6]。它可以通过L-苯丙氨酸的艾氏途径(Ehrlich pathway)或糖的从头合成来生产2-苯乙醇[7-8]。
在米香型白酒中,2-苯乙醇为其主体香,其特有的蜜香,被认为是由2-苯乙醇与乳酸乙酯组成。除此之外,2-苯乙醇还是浓香型白酒、酱香型白酒、豉香型白酒和黄酒等重要的特征性风味物质[9],而且对这些发酵食品其他风味物质起到调和及增效的作用,因此在多种酒类中可以通过气相色谱-质谱联用法(gas chromatography-mass spectrometry,GC-MS)检测到[10]。但在以2-苯乙醇为特征风味物质的多种发酵食品酿造过程中,还是更加重视通过调控自身微生物菌群而达到提高2-苯乙醇含量的目的[11]。郭孝敬等[12]从自制奶酪中筛选获得一株转化合成2-苯乙醇能力强、耐受性好的库德里阿兹威毕赤酵母,在最优培养条件下能转化合成2-苯乙醇达3.53 g/L。TIAN S F等[13]从米香型白酒发酵醪中筛选了一株高产2-苯乙醇的异常威克汉逊酵母(Wickerhamomyces anomalus),通过调节培养基中初始葡萄糖和L-苯丙氨酸浓度,该菌株发酵液中可以获得2.63 g/L的2-苯乙醇,在最理想的发酵培养条件下,该菌株在5 L的发酵罐中培养,可产生4.72 g/L的2-苯乙醇。由此可见,无论是作为香味调节剂还是对于提升发酵食品品质,2-苯乙醇都具有重要的研究价值。然而,已有研究筛选出的多株高产2-苯乙醇的酵母主要分离自浓香型白酒酒曲、奶酪或单一发酵醪液,对米香型白酒特有酿造微生态的研究较少,因此有必要对其进行研究。
该研究对高产2-苯乙醇的菌株进行筛选,结合分子生物学技术对菌株进行鉴定,分析其耐受性,并采用单因素试验优化菌株产2-苯乙醇的最佳条件,旨在获得优良的产2-苯乙醇菌株,为米香型白酒酒质提升提供菌株资源以及为酒质改善提供数据参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醪:天龙泉酒业公司;保藏菌株:劲牌有限公司菌种库;种曲粉、麸皮:劲牌有限公司;黄豆芽:市售。
1.1.2 化学试剂
葡萄糖(分析纯)、蛋白胨、酵母浸粉、琼脂(均为生化试剂)、硫酸铵、硫酸镁、磷酸二氢钾(均为分析纯):国药集团化学试剂有限公司;L-苯丙氨酸(分析纯):上海麦克林生化科技有限公司;2-苯乙醇标准品(纯度>98%):阿拉丁试剂(上海)有限公司;微生物基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,水1 L,121 ℃高压灭菌20 min。
YPD琼脂培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,琼脂20 g/L,水1 L,121 ℃高压灭菌20 min。发酵培养基:种曲粉400g,水2L,121℃高压灭菌20min。酵母麸皮种培养基:麸皮100 g,硫酸铵0.5 g,葡萄糖4 g,水60 g,于121 ℃灭菌20 min。
产香培养基[11]:称新鲜黄豆芽100 g,置于烧杯中,加入1 L水,小火煮沸30 min,用纱布过滤,补足失水,制成10%豆芽汁,加入葡萄糖50 g,115 ℃灭菌20 min。
转化培养基:葡萄糖80 g/L,硫酸镁0.5 g/L,磷酸二氢钾5 g/L,L-苯丙氨酸10 g/L,酵母浸粉5 g/L,121 ℃灭菌20 min。
1.2 仪器与设备
JJ6000电子天平:常熟市双杰测试仪器;MJ-250BSH-Ⅱ霉菌培养箱:上海新苗医疗器械制造有限公司;SW-CJ-1B净化工作台:苏州智净净化设备有限公司;YXQ-LS-75SII高压灭菌锅:上海博迅实业有限公司医疗设备厂;5424 R离心机:美国Eppendorf公司;岛津LC-2030高效液相色谱仪:日本Shimadzu公司;Biometra Tone聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Analytikjena公司;DMA 35 V4便携式密度计:Anton Paar(上海)商贸有限公司;7890A气相色谱仪:美国Agilent公司。
1.3 方法
1.3.1 保藏菌株的处理
从菌种库中根据入库登记的“产酯产香”信息挑选已知种属的产香产酯的22株酵母,按2%的比例吸取甘油管菌液接种于50 mL YPD液体培养基中,于30 ℃、150 r/min摇床培养24 h,保存于4 ℃冰箱备用。
1.3.2 酒醪中菌株的分离纯化
在无菌条件下取米香型白酒醪液1 mL于9 mL无菌水试管中,按10倍进行梯度稀释,取10-4、10-5、10-6 3个梯度样品,准确吸取200 μL均匀涂布于YPD琼脂培养基上,30 ℃培养48 h。挑取平板上形态差异明显的酵母单菌落,编号后分别接种于YPD液体培养基和YPD琼脂培养基中,30 ℃、150 r/min振荡培养24 h,保存于4 ℃冰箱备用。
1.3.3 产2-苯乙醇酵母菌株初筛
将纯化后浓度为1×107 CFU/mL的酵母种子液以2%添加量接种于含有杜氏小管的产香培养基中,以未接种的空白产香培养基作为对照,30 ℃恒温培养箱中静置培养48 h,组织3名经受过专业培训的公司级品评员对发酵液进行嗅闻,筛选出发酵液产生酯香气味的酵母菌株[14],并观察杜氏小管产气量判断菌株是否产气。
1.3.4 产2-苯乙醇酵母菌株复筛
以2-苯乙醇含量作为评价指标进行菌株复筛。将初筛得到的酵母菌株以2%接种量接种于发酵培养基中,30 ℃静置培养7 d,过滤发酵液,参考文献[15]中的气相色谱法检测发酵液中2-苯乙醇含量。
1.3.5 菌株分子生物学鉴定
收集菌体,放入100 μL裂解液混匀,于85 ℃水浴中进行热裂解40 min,之后放入-20 ℃或者4 ℃冰箱中静置10 min,离心取上清液用于DNA片段扩增。以提取菌株DNA为模板,采用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')进行ITS rDNA片段扩增。PCR扩增体系为30μL,其中PremixTaqTM(TaKaRa Taq TM Version 2.0 plus dye)15 μL,双蒸水(ddH2O)12 μL,引物ITS1和ITS4各0.5 μL,DNA模板2 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火50 s,72 ℃延伸1 min,循环次数35次;72 ℃最终延伸10 min。将扩增的ITS rDNA片段送往华大基因进行测序,获得相应的ITS扩增序列结果。并提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,获得其种属信息,下载相似度及同源性高的序列,利用MEGA11.0软件中的邻接法(neighbor-joining,NJ)构建系统进化树。
1.3.6 产2-苯乙醇菌株耐受性分析
将活化后的菌株按照2%(V/V)接种量接种于YPD培养基中,30 ℃培养2 d,分别考察乙酸体积分数(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)、乙醇体积分数(3%、6%、9%、12%、15%、18%)、pH(3.0、3.5、4.5、5.5、6.5、7.0)、温度(15 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)和NaCl质量浓度(5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)对菌株生长的影响,用紫外分光光度计在波长600 nm处测定发酵液OD600nm值。
1.3.7 酵母菌株在米香型白酒生产中的应用
(1)酵母麸曲制备
将菌体浓度为1.0×108 CFU/mL的菌株种子液按40%接种于酵母麸皮种培养基中,于30 ℃静置培养48 h后放于30 ℃烘箱烘干,得到酵母麸曲成曲。
(2)半固态发酵白酒工艺流程及操作要点
水+大米→蒸煮→冷却→下曲糖化→加水→发酵→蒸馏→弃头酒→成品酒
操作要点:取200 g大米,以粮水比为1∶1(g∶mL)加水,121 ℃蒸10 min,冷却至30 ℃左右下曲,对照组为天龙泉复配曲,实验组参考文献[15]的方法将筛选得到的产2-苯乙醇酵母菌株麸曲与复配曲按照质量比为1∶19配比成混合曲,按大米质量的1%分别取对照组和实验组酒曲(干质量计)与米饭充分搅拌,加入发酵瓶30 ℃糖化24 h(开口糖化,于发酵瓶口覆盖一湿润的两层纱布);糖化结束后加130%水(干质量计),发酵13 d;将醪液倒入锥形瓶,用电炉加热蒸酒,弃去头酒25 mL,再收集100 mL主体酒。
1.3.8 2-苯乙醇含量的测定
参考文献[16]的方法,绘制2-苯乙醇标准曲线,以2-苯乙醇质量浓度(X)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,得到标准曲线回归方程为Y=882 465X+36 815。样品经8 000 r/min离心10 min,取上清液1 mL,加纯水稀释1倍,用0.22 μm有机系滤膜过滤,样品于高效液相色谱分析。色谱条件:C18反相色谱柱(4.6 mm×250 mm,5 μm),流动相为甲醇-水(1∶1,V/V),流速为1.0 mL/min,检测波长为260 nm,柱温30 ℃,进样量10 μL。根据标准曲线回归方程计算2-苯乙醇含量。
1.3.9 挥发性风味物质测定
精确移取1 mL酒样于气相进样瓶中,加入10 μL混合内标溶液(2-乙基己醇:16 688.4 mg/L、叔戊醇:15 939.5 mg/L和乙酸戊酯:17 219.3 mg/L),充分混合后,将制备好的样品放入配备火焰离子化检测器和DB-FFAP色谱柱的气相色谱仪进行分析。
色谱条件:进样口采用分流模式,分流比为30∶1,温度为25 ℃。柱箱温度程序为初始温度35 ℃(保持1 min),随后以3.5 ℃/min的速率升温至120 ℃,再以20 ℃/min的速率升温至190 ℃,载气为高纯氮气(N2)(99.999%),流速恒定为1 mL/min。
1.3.10 转化培养基配方优化
接种2%菌株种子液至转化培养基,30 ℃、150 r/min摇床培养2 d[17]。为提高酵母菌株产2-苯乙醇的含量,对其培养基配方进行优化,考察培养基葡萄糖添加量(20 g/L、40 g/L、60 g/L、80 g/L、100 g/L、120 g/L)、酵母浸粉添加量(5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)、L-苯丙氨酸添加量(5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)对转化合成2-苯乙醇含量的影响。发酵液经8 000 r/min离心10 min,上清液采用方法1.3.8的高效液相色谱法测定2-苯乙醇含量。
1.3.11 数据处理与统计分析
使用Origin 2016和Microsoft Excel 2019对试验数据进行统计分析。
2 结果与分析
2.1 菌株的分离
通过稀释涂布平板法,从天龙泉米香型白酒醪液中分离得到29株酵母,编号为1~29;将实验室已鉴定的22株菌株编号为30~51,对这51株菌进行产2-苯乙醇筛选。
2.2 产2-苯乙醇菌株的筛选
2.2.1 产2-苯乙醇菌株初筛
采用产香培养基结合嗅闻法对51株酵母菌株进行了初筛,以嗅闻发酵液是否产香以及使用杜氏小管法判断是否产气,结果见表1和表2。由表1可知,通过观察杜氏小管产气情况发现,除菌株1、37、39、48不产气外,其他菌株均产气。由表2可知,可将香气类型分为五大类:酒香、清香、果香、特殊香味和不愉快气味。初筛酵母菌株中,菌株1、33、34和39产生不愉快气味。因此,基于产气和产香双重筛选标准,菌株1、33、34、37、39和48不符合筛选条件,对其余45株具有发酵产香能力的酵母菌株进行复筛。
表1 51株酵母菌株杜氏小管产气结果
Table 1 Gas production results of 51 yeast strains in Durham tubes

注:“-”表示完全不产气;“++”表示产气量约为杜氏小管体积的2/3;“+++”表示气体充满整个杜氏小管。
菌株编号 48 h产气情况+++3、4、6、7、8、10、11、12、13、14、15、16、18、19、20、21、22、23、25、26、27、28、38、32、43、45、46、47、50、51 2、5、9、17、24、29、30、31、33、34、35、36、40、41、42、44、49 1、37、39、48++-
表2 产2-苯乙醇酵母菌株初筛结果
Table 2 Preliminary screening results of 2-phenylethanol-producing yeast strains
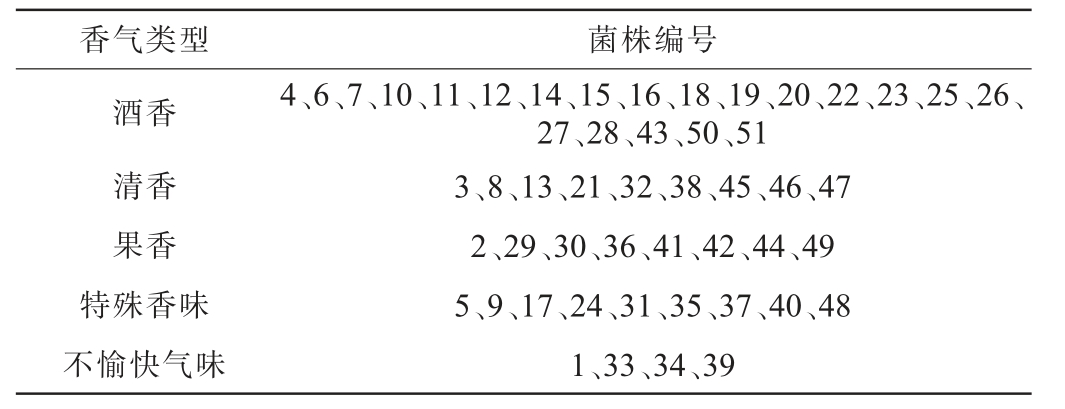
香气类型 菌株编号酒香清香果香特殊香味不愉快气味4、6、7、10、11、12、14、15、16、18、19、20、22、23、25、26、27、28、43、50、51 3、8、13、21、32、38、45、46、47 2、29、30、36、41、42、44、49 5、9、17、24、31、35、37、40、48 1、33、34、39
2.2.2 产2-苯乙醇菌株复筛
不同酵母菌株产2-苯乙醇含量结果见表3。由表3可知,36号菌株产2-苯乙醇含量最高,为78.9 mg/L,其次是15号、29号和26号,分别为54.3 mg/L、53.6 mg/L和47.7 mg/L,虽然这3株酵母产2-苯乙醇不及36号,但相比于其他酵母仍具有明显优势,其余菌株产2-苯乙醇含量相对较低。因此,选择36号、15号、29号和26号酵母进行下一步研究。
表3 不同酵母菌株发酵液中2-苯乙醇含量测定结果
Table 3 Determination results of 2-phenylethanol contents in fermentation broth by different yeast strains
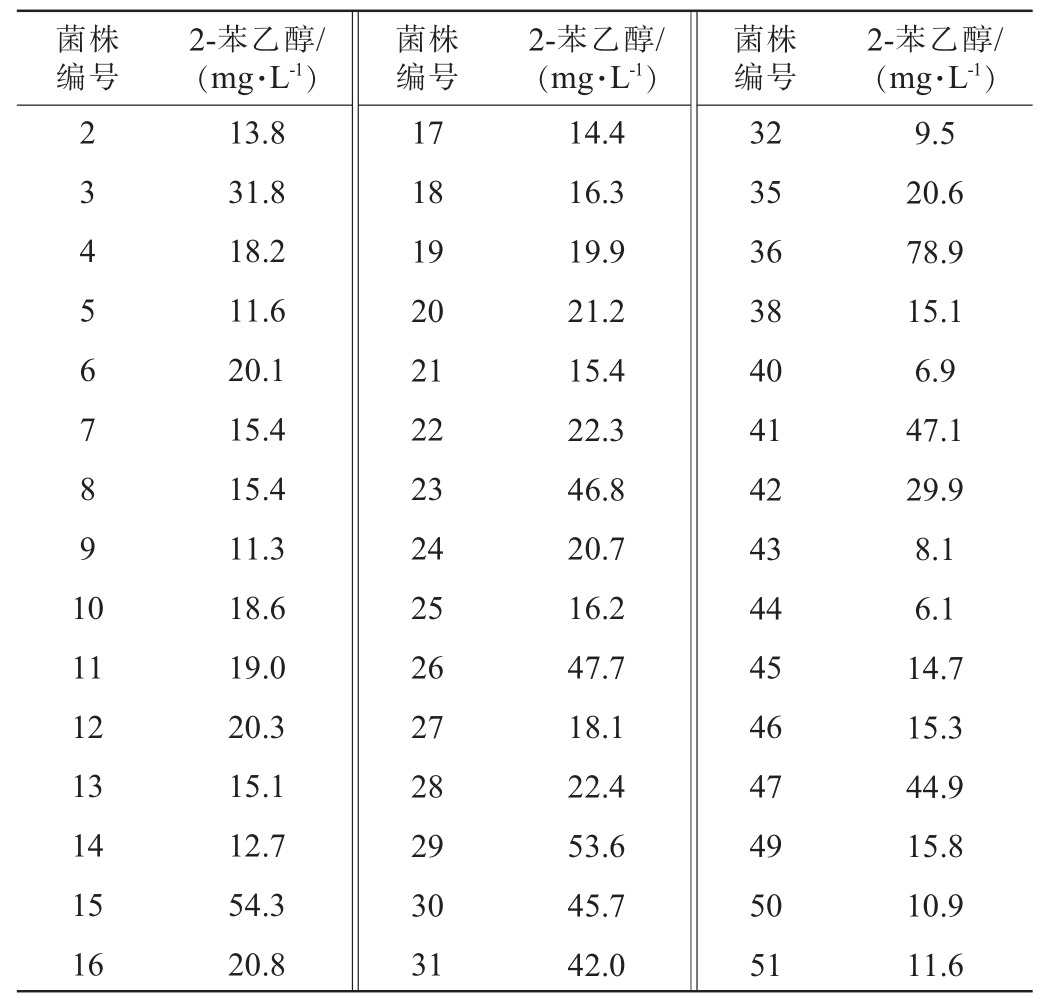
菌株编号2-苯乙醇/(mg·L-1)菌株编号2-苯乙醇/(mg·L-1)菌株编号2-苯乙醇/(mg·L-1)2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 13.8 31.8 18.2 11.6 20.1 15.4 15.4 11.3 18.6 19.0 20.3 15.1 12.7 54.3 20.8 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 14.4 16.3 19.9 21.2 15.4 22.3 46.8 20.7 16.2 47.7 18.1 22.4 53.6 45.7 42.0 32 35 36 38 40 41 42 43 44 45 46 47 49 50 51 9.5 20.6 78.9 15.1 6.9 47.1 29.9 8.1 6.1 14.7 15.3 44.9 15.8 10.9 11.6
2.3 产2-苯乙醇菌株分子生物学鉴定
由于36号菌株为实验室已经鉴定出的库德里阿兹威毕赤酵母(Pichia kudriavzevii),故对筛选出的15、26和29号菌株进行了分子生物学鉴定。将测序获得菌株15、26和29号的基因序列在NCBI基因数据库中进行BLAST同源性比对,基于ITS rDNA基因序列构建15、26和29号菌株的系统发育树[18],结果见图1。由图1可知,15号、26号和29号菌株均与Saccharomyces cerevisiae亲缘关系最近,可确定15号、26号和29号菌株为酿酒酵母(Saccharomyces cerevisiae)。
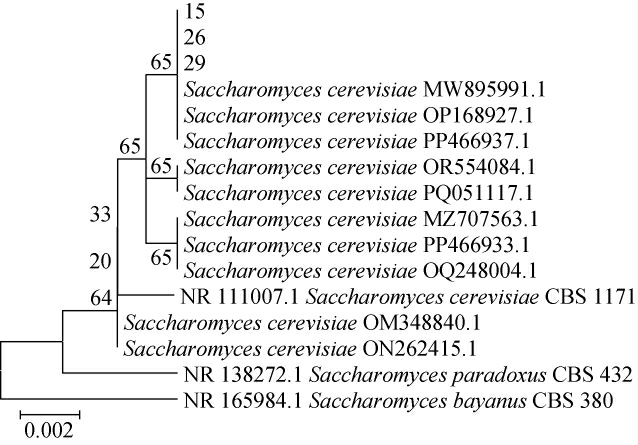
图1 基于ITS rDNA序列菌株15号、26号和29号的系统发育树
Fig.1 Phylogenetic tree of strain 15, 26 and 29 based on ITS rDNA gene sequence
2.4 产2-苯乙醇酵母耐受性分析
白酒发酵过程十分复杂,酵母菌株自身对酿造环境的适应性会影响发酵过程及酒质酒率,这些因素主要包括酒精度、酸碱性、温度和高渗透性等[19]。菌株15号、26号和29号及36号的pH、温度、乙醇体积分数、乙酸体积分数及NaCl耐受结果见图2。
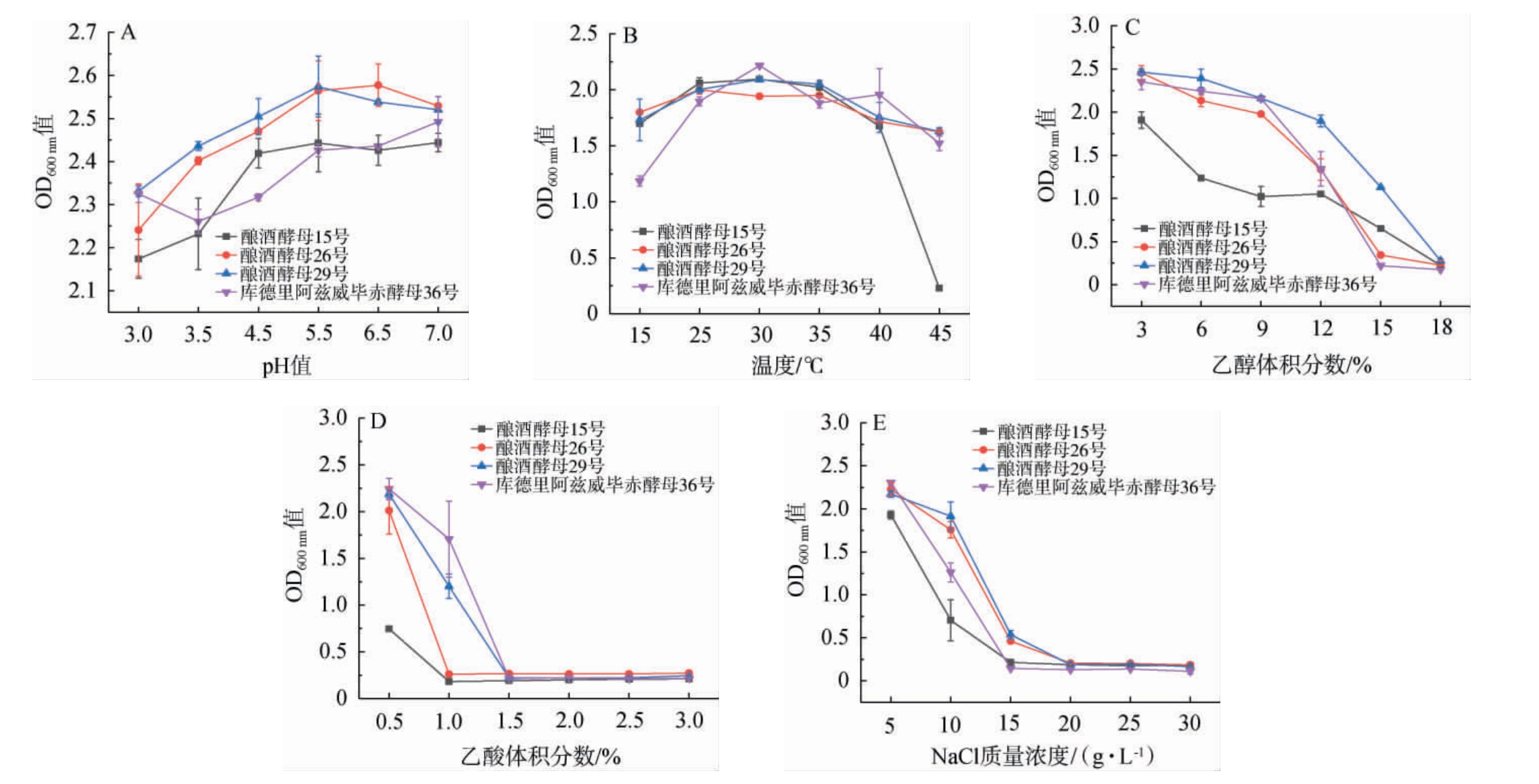
图2 不同条件下产2-苯乙醇酵母菌株生长情况
Fig.2 Growth of 2-phenylethanol-producing yeast strains under different conditions
由图2A所示,不同酵母菌株细胞生物量随着pH降低呈大致降低或先升高后降低的趋势,在pH=3.0的低酸环境下,各菌株受到的抑制程度最大,细胞生物量均为组内最低,这与魏学鼎等[20]研究结果一致;在相同pH条件下,不同酵母菌株耐受性存在差异,菌株26号和29号明显高于其他菌株。由图2B可知,所有菌株随着温度升高其生物量呈现先增加后下降趋势,其中菌株26号、29号和36号可耐受45 ℃高温,在此温度条件下仍具有较高的生物量,而15号菌株最高可耐受40 ℃高温条件,超过该温度,菌株生长受到抑制,这是因为高温环境使得蛋白质的空间构象发生不可逆改变且使膜系统稳定性丧失,最终引发细胞存活率显著下降及生理代谢活动的全面抑制[21]。由图2C可知,所有菌株随乙醇体积分数增加生长变缓,但所有菌株均可耐受体积分数12%的乙醇,当乙醇体积分数>12%时,菌株生长受到抑制,当乙醇体积分数>15%时,菌株停止生长,这是由于乙醇对酵母的细胞质膜三磷酸腺苷酶(adenosine triphosphatase,ATPase)产生了抑制[22-23]。一般情况下,酵母在pH 5.0~6.0的酸性环境中可以很好地生长,但在发酵过程中pH会发生改变,低pH改变细胞内电解质,进而严重影响酵母的生长和代谢。因此,选择在酸性胁迫下生长良好的酵母是极其重要的[24]。由2D可知,乙酸对15号和26号菌株生长影响较大,15号和26号菌株可耐受0.5%乙酸,29号和36号菌株可耐受1.0%乙酸。由图2E可知,15号和36号酵母可耐受10g/LNaCl,26号和29号酵母可耐受15g/L的NaCl。由此可见,四株高产2-苯乙醇酵母菌株均具有较好的耐受性。
2.5 产2-苯乙醇酵母在米香型白酒中的应用
为实现菌株筛选的工业化应用目标,本研究以复配曲为对照组,将复配曲分别与15号、26号、29号和36号菌株麸曲按质量比19∶1制成混合曲为实验组,开展了4轮米香型白酒半固态小试实验,测定四轮次白酒酒精度及部分挥发性风味物质含量,结果见表4。
表4 四轮次米香型白酒主要挥发性风味成分测定结果
Table 4 Determination results of main volatile flavor components in 4th rounds of rice flavor Baijiu
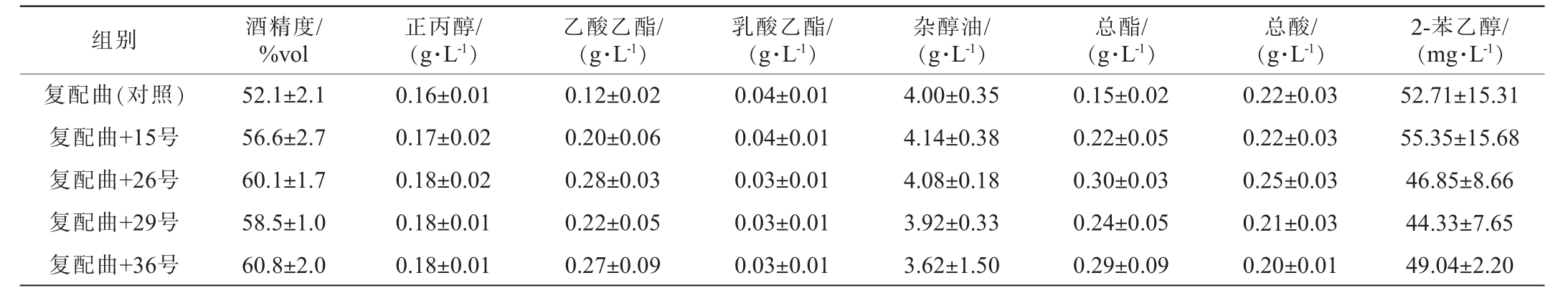
组别 酒精度/%vol正丙醇/(g·L-1)乙酸乙酯/(g·L-1)乳酸乙酯/(g·L-1)杂醇油/(g·L-1)总酯/(g·L-1)总酸/(g·L-1)2-苯乙醇/(mg·L-1)复配曲(对照)复配曲+15号复配曲+26号复配曲+29号复配曲+36号52.1±2.1 56.6±2.7 60.1±1.7 58.5±1.0 60.8±2.0 0.16±0.01 0.17±0.02 0.18±0.02 0.18±0.01 0.18±0.01 0.12±0.02 0.20±0.06 0.28±0.03 0.22±0.05 0.27±0.09 0.04±0.01 0.04±0.01 0.03±0.01 0.03±0.01 0.03±0.01 4.00±0.35 4.14±0.38 4.08±0.18 3.92±0.33 3.62±1.50 0.15±0.02 0.22±0.05 0.30±0.03 0.24±0.05 0.29±0.09 0.22±0.03 0.22±0.03 0.25±0.03 0.21±0.03 0.20±0.01 52.71±15.31 55.35±15.68 46.85±8.66 44.33±7.65 49.04±2.20
由表4可知,通过对实验组与对照组的系统对比分析,各菌株代谢特性呈现以下规律性差异:所有实验组酒精度升高(升高7.8%~16.7%),表明菌株添加有效强化了乙醇脱氢酶活性[25];各实验组正丙醇含量上升6.25%~12.5%;各菌株乙酸乙酯含量提升66.7%~133.3%;相较于对照组,15号菌株乳酸乙酯含量与之持平,其余菌株均降低,降幅25%左右;杂醇油方面,36号菌株较对照组降低9.5%,29号菌株略降,其他菌株微增,增幅均在5%内;相较于对照组总酸,26号菌株提高13.6%,其余菌株均降低,降幅均在5%内;主体呈香物质2-苯乙醇方面,只有15号菌株高于对照组,比其高2.64 mg/L,增幅5%,表明15号菌株在通过微生物细胞合成2-苯乙醇方面具有一定优势。
2.6 高产2-苯乙醇酵母转化培养条件优化单因素试验
在酵母细胞中2-苯乙醇合成方式因培养基中氮源的种类不同分为莽草酸途径和艾氏途径(Ehrlich pathway)[26-27]。当以L-苯丙氨酸作为唯一氮源时,酵母直接通过艾氏途径对底物L-苯丙氨酸进行生物转化合成2-苯乙醇,且2-苯乙醇合成产量很可观[28]。为了探究酵母菌株最佳转化培养基条件,以高产2-苯乙醇菌株15号酿酒酵母为研究目标,以2-苯乙醇产量为考察指标,分别考察了培养基中的葡萄糖、酵母浸粉和L-苯丙氨酸添加量对菌株合成2-苯乙醇的影响,结果见图3。
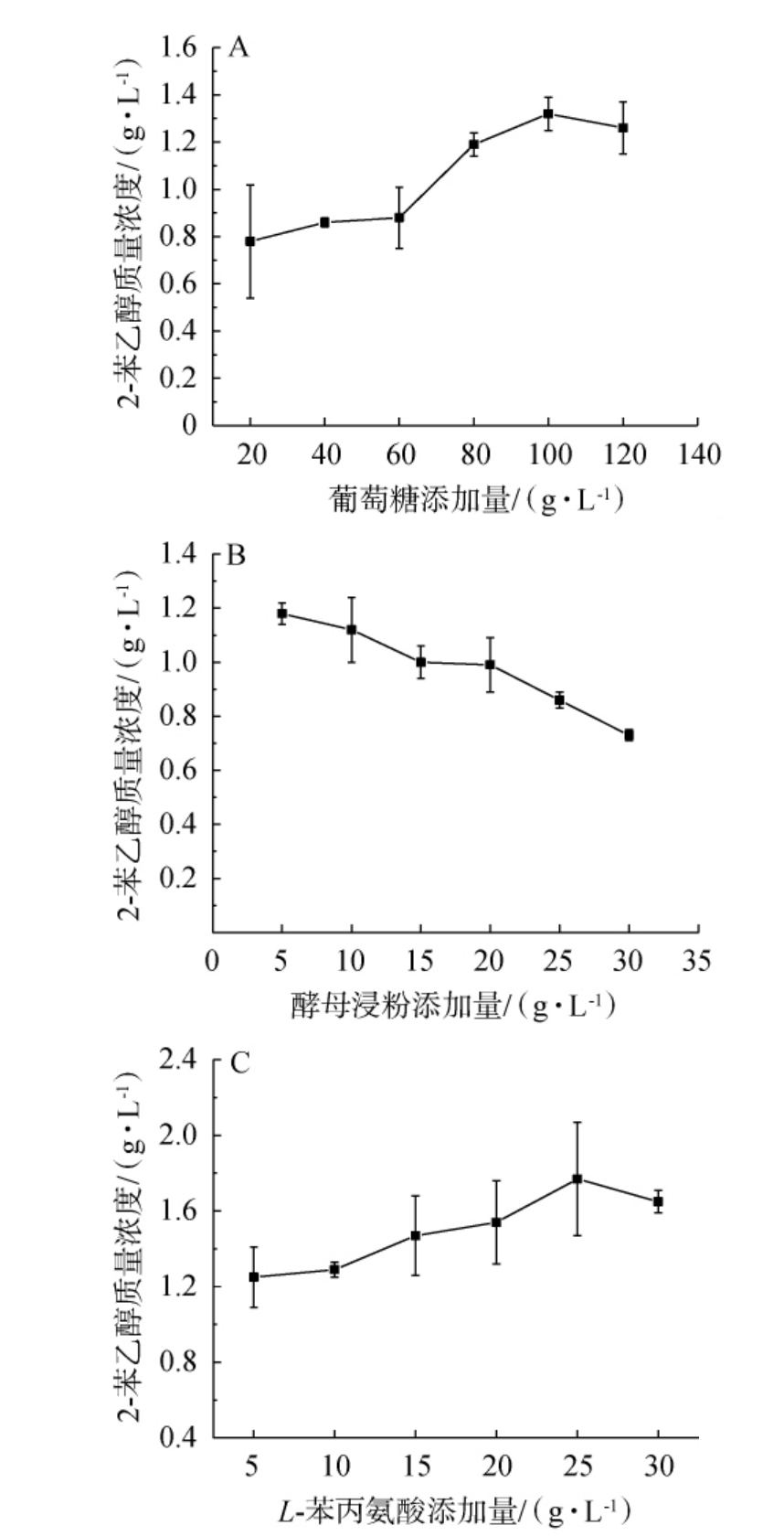
图3 不同培养基成分添加量对菌株15号转化产2-苯乙醇的影响
Fig.3 Effect of different medium components addition on the transformation of yeast strain No.15 to produce 2-phenylethanol
由图3A可知,随着葡萄糖添加量增加,2-苯乙醇产量先升高后降低,当葡萄糖添加量达到100 g/L时,2-苯乙醇产量达到最大,为1.32 g/L,故最佳葡萄糖添加量为100 g/L;由图3B可知,在酵母浸粉添加量5~30 g/L范围内,2-苯乙醇产量呈现负相关趋势,其中5 g/L时达到峰值1.18 g/L。该现象与唐育岐等[6]的研究结论高度吻合:在其考察的0.5~20 g/L酵母浸粉梯度中,5.0 g/L添加量对应的2-苯乙醇产量最高,证实酵母浸粉作为微量生长因子(而非主要氮源)的剂量敏感性特征。基于上述研究结果,结合生产成本控制需求,确定酵母浸粉最佳添加量为5 g/L;由图3C可知,随着L-苯丙氨酸添加量增加,酵母菌株2-苯乙醇产量随之先增加后降低,当L-苯丙氨酸添加量为25 g/L时,2-苯乙醇产量最高,达到1.77 g/L,故最佳L-苯丙氨酸添加量为25 g/L。因此,15号酿酒酵母菌株产2-苯乙醇最佳转化培养基成分为葡萄糖100 g/L,酵母浸粉5 g/L,L-苯丙氨酸25 g/L,硫酸镁0.5 g/L,磷酸二氢钾5 g/L,此时2-苯乙醇产量为1.77 g/L。
3 结论
本研究从米香型白酒醪液中成功分离获得一株高产2-苯乙醇酵母菌株15号,经鉴定为酿酒酵母(Saccharomyces cerevisiae),该菌株具有良好的耐受性,能够在pH为3,温度为40 ℃,乙醇体积分数12%,乙酸体积分数0.5%、NaCl质量浓度10 g/L的环境中生长。将该菌株与复配曲协同应用于米香型白酒酿造体系,酒体2-苯乙醇含量显著提升5%且关键酯类物质乙酸乙酯同步增加66.7%,有效强化了米香型白酒特征性“蜜香-酯香”复合风味轮廓。通过单因素试验对该菌株合成2-苯乙醇条件进行优化,确定其最适生物合成条件为:葡萄糖添加量100 g/L,酵母浸粉添加量5 g/L,L-苯丙氨酸添加量25 g/L,硫酸镁0.5 g/L,磷酸二氢钾5 g/L,在此优化条件下2-苯乙醇产量为1.77 g/L。本研究通过功能酵母的定向引入,初步揭示了其对米香型白酒特征风味组分形成过程的潜在调控作用,该菌株的工业化应用可能为解决传统工艺中芳香物质生成效率受限的问题提供新的技术路径,同时为探索“风味定向调控”型白酒酿造新策略积累理论基础,并为行业升级储备关键微生物资源。
[1]刘子雄,王文欣,上官玲玲,等.酵母2-苯乙醇耐受性的研究进展[J].微生物学报,2024,64(4):981-998.
[2]FAN G S,CHENG L J, FU Z L, et al.Screening of yeasts isolated from Baijiu environments for 2 phenylethanol production and optimization of production conditions[J].3 Biotech,2020,10(275):1-17.
[3]王晴,毛银,赵运英,等.生香酵母生物转化法合成2-苯乙醇的研究[J].食品与发酵工业,2025,51(5):22-28.
[4]MARTÍEZ-AVILA O, SÁNCHEZ A, FONT X, et al.2-phenylethanol(rose aroma)production potential of an isolated Pichia kudriavzevii through solid-state fermentation[J].Process Biochem,2020,93:94-103.
[5]陈先锐,王肇悦,何秀萍.酵母菌合成2-苯乙醇的研究进展[J].生物工程学报,2016,32(9):1151-1163.
[6]唐育岐,刘天明,赵修报,等.高产2-苯乙醇酵母菌株的筛选及培养基优化[J].中国食品添加剂,2012(3):137-142.
[7]SUN L J,GAO Y,SUN R J,et al.Metabolic and tolerance engineering of Komagataella phaffii for 2-phenylethanol production through genomewide scanning[J].Biotechnol Biofuels Bioprod,2024,17(107):1-14.
[8]陈双,罗涛,徐岩,等.我国黄酒酵母和酿酒原料对黄酒中β-苯乙醇含量的影响[J].中国酿造,2009,27(4):23-26.
[9]张学林,季 斌,许 玲,等.清香型大曲中产β-苯乙醇酵母的分离、鉴定及在白酒酿造中的应用[J].中国酿造,2022,41(1):123-127.
[10]范三红,李颖星,白宝清.涡旋辅助分散液液微萃取-气相色谱法测定清香型白酒中5种高级醇[J].中国酿造,2020,39(4):194-200.
[11]富志磊,范光森,马超,等.老白干酒曲中一株高产β-苯乙醇酵母菌的分离、鉴定及其产香特性研究[J].中国食品学报,2019,19(1):207-214.
[12]郭孝敬,郑晓吉,史学伟,等.高产2-苯乙醇酵母的筛选及其发酵条件优化[J].中国调味品,2019,44(11):55-61.
[13]TIAN S F,LIANG X L,CHEN J,et al.Enhancement of 2-phenylethanol production by a wild-type Wickerhamomyces anomalus strain isolated from rice wine[J].Bioresource Technol,2020,318:1-8.
[14]黄慧芬.米香型白酒酿造产香酵母的筛选鉴定及其产酯规律研究[D].长沙:中南林业科技大学,2018.
[15]李群,林斌,柯锋,等.高产乙酸乙酯毕赤酵母筛选及其耐受性能研究[J].酿酒科技,2022(12):39-45.
[16]黄筱萍,刘兰,熊大维,黄国昌.一株高产2-苯乙醇酵母菌的筛选及鉴定[J].食品与生物技术学报,2016,35(5):531-536.
[17]牛明福,李亚恒,陈金帅,等.马克斯克鲁维酵母生物转化2-苯乙醇工艺优化及耐高温特性分析[J].食品与发酵工业,2018,44(2):15-20.
[18]莫新良,李梦瑶,滕明德.一株高产2-苯乙醇酵母的筛选及其特性分析[J].食品科技,2024,49(7):10-17.
[19]龚雯,罗小叶,何旭丽,等.酱香大曲中产香酵母的筛选鉴定及特性分析[J].中国酿造,2024,43(8):24-30.
[20]魏学鼎,孙文超.酿酒酵母的筛选及其发酵性能应用研究[J].粮食与油脂,2024,37(3):117-121,153.
[21]MÜHLHOFER M,BERCHTOLD E,STRATIL C G,et al.The heat shock response in yeast maintains protein homeostasis by chaperoning and replenishing proteins[J].Cell Rep,2019,29(13):4593-4607.
[22]LAI Y T,HSIEH C W,LO Y C,et al.Isolation and identification of aroma-producing non-Saccharomyces yeast strains and the enological characteristic comparison in wine making[J].LWT-Food Sci Technol,2022,154:1-13.
[23]VARIZE C,BÜCKER A,D.LOPES L,et al.Increasing ethanol tolerance and ethanol production in an industrial fuel ethanol Saccharomyces cerevisiae strain[J].Fermentation,2022,8(10):1-14.
[24]QU C Y,PENG L Y,FEI Y T,et al.Screening ester-producing yeasts to fortify the brewing of rice-flavor Baijiu for enhanced aromas[J].Bioengineered,2023,14(1):1-17.
[25]刘嫒春,曾礼兰,方帅,等.浓香型白酒风味成分对乙醇代谢及关键酶活性影响的体内实验研究[J].中国酿造,2022,41(6):122-128.
[26]MITRI S,KOUBAA M,MAROUN R G,et al.Bioproduction of 2-Phenylethanol through yeast fermentation on synthetic media and on agro-industrial waste and by-products:A review[J].Foods,2022,11(1):1-16.
[27]ZHOU R, SONG Q Y, XIA H L, et al.Isolation and identification of non-Saccharomyces yeast producing 2-phenylethanol and study of the ehrlich pathway and shikimate pathway[J].J Fungi (Basel),2023,9(9):1-16.
[28]朱灵桓,徐沙,李由然,等.微生物法从头合成2-苯乙醇的研究进展[J].食品与发酵工业,2021,47(16):271-277.