发酵香肠作为一种通过微生物发酵制备的肉类产品,具有风味独特、营养价值高、贮存时间长等特点[1]。 然而,自然发酵受外界影响较大,具有特殊性能的微生物难以快速形成优势菌群,导致产品质量参差不齐且存在安全隐患。因此,提高发酵香肠营养价值、丰富风味,生产安全健康的商品关键因素之一是筛选具有特定性质的微生物菌种。发酵肉制品中常用的微生物菌种有乳酸菌(lactic acid bacteria,LAB)、凝固酶阴性葡萄球菌(coagulase negative staphylococci,CNS)等,他们对改善发酵香肠品质意义重大,例如在香肠发酵过程中,LAB可以产生抑制有害微生物生长的乳酸,同时还可以降解香肠中的蛋白质,使香肠的口感、质地得到有效改善[1];CNS可以产生改善发酵肉制品色泽和整体风味的蛋白酶、脂肪酶等物质[2-3]。
目前,常用于接种发酵香肠的乳酸菌有植物乳植杆菌(Lactiplantibacillus plantarum)[4]、戊糖片球菌(Pediococcus pentosaceus)[5]、清酒广布乳杆菌(Latilactobacillus sakei)[6]。其中,清酒广布乳杆菌属于肉类的原生菌群,能较好的利用肉类中营养物质、能在低温(4 ℃)、高盐度的环境中生长[7],能产生细菌素,有良好的益生性和对食源性致病菌有很好的抑制作用[8]等优点。自然发酵香肠中CNS也对产品品质形成贡献较大[9];一些CNS能促进清酒广布乳杆菌菌株的生长和蛋白水解活性[10],有助于提高香肠单不饱和脂肪酸含量、改善色泽、缩短发酵周期、提升风味感官品质[11]。 因此,筛选适合的清酒广布乳杆菌和CNS菌种组合对提升发酵香肠风味具有积极意义。
国内对CNS研究多集中于木糖葡萄球菌(Staphylococcus xylosus)、肉葡萄球菌(Staphylococcus carnosus)[12],而对于被列入《可食用菌种名单》的小牛动物球菌(Mammaliicoccus vitulinus)研究较少,其作为香肠发酵剂,能显著促进发酵香肠颜色的形成,且具有很好的安全性,已在西方发酵香肠中广泛应用,并且大多数研究集中在葡萄球菌接种对干腌肉制品加工过程中微生物群落演替、挥发性物质演变的影响方面[13],但目前国内尚鲜见香肠中将清酒广布乳杆菌与小牛动物球菌进行复配发酵的研究。
本项目组前期通过发酵性能实验,从发酵肉制品中筛选得到低温生长性能好的小牛动物球菌AP2,并且发现小牛动物球菌AP2与清酒广布乳杆菌L之间没有拮抗作用。因此,为进一步探讨小牛动物球菌AP2和清酒广布乳杆菌L联合应用的可能性,本实验以自然发酵香肠为空白对照(CK),采用清酒广布乳杆菌L单独接种(L组)及其与小牛动物球菌AP2混合接种(1∶1,V/V)(L+AP2组)发酵香肠,通过测定微生物指标(乳酸菌和凝固酶阴性葡萄球菌活菌数)及常规理化指标(pH、水分含量、蒸煮损失率、亚硝酸盐含量)、质构、颜色参数、游离氨基酸含量,并对3组发酵香肠进行感官评价,探究复合菌剂发酵对香肠品质的影响,旨在为生产安全、营养的发酵香肠提供理论依据,为发酵香肠专用菌剂的研发提供数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
生猪肉:采自云南昆明本地市场三元猪后腿肉;食盐:云南省盐业有限公司;黑胡椒:佛山市海天调味食品股份有限公司;胶原蛋白肠衣:梧州神冠蛋白肠衣有限公司;单山蘸水:昆明市单山食品有限公司。
清酒广布乳杆菌(Latilactobacillus sakei)L、小牛动物球菌(Mammaliicoccus vitulinus)AP2:均分离自来源于云南本地火腿样品,并保藏于云南省农业科学院农产品加工研究所实验室。
1.1.2 试剂
盐酸、盐酸萘乙二胺、乙酸锌、亚硝酸钠、酚酞、氢氧化钠(均为分析纯):天津市致远化学试剂有限公司;氯化钠(分析纯):生工生物工程(上海)股份有限公司;对氨基苯磺酸(分析纯):天津市大茂化学试剂厂;亚铁氰化钾(分析纯):天净沙风船化学试剂科技有限公司;亚硝酸钠(分析纯):天津市盛鑫源化工有限公司;葡萄糖(分析纯):云南白药集团股份有限公司。
1.1.3 培养基
MRS培养基、肉汤(lysogeny broth,LB)培养基、甘露醇高盐琼脂(mannitol salt agar,MSA)培养基、营养肉汤(nutritional broth,NB)培养基:青岛海博生物技术有限公司。以上培养基均于118 ℃灭菌20 min。
1.2 仪器与设备
TMS-Touch质构仪:美国FTC公司;Multiskan GO酶标仪:美国Thermo公司;CM-5台式色差仪:日本美能达公司;HR/T20MM冷冻离心机:湖南赫西仪器装备有限公司;DL-CJ-2NDI超净工作台:北京东联哈尔仪器制造有限公司;GF54DA型高压蒸汽灭菌锅:致微(厦门)仪器有限公司;ME204/02电子天平、S210梅特勒pH计:梅特勒托利多科技(中国)有限公司;ZQTY-70S恒温恒湿培养箱:上海知楚仪器有限公司;2695高效液相色谱仪、AccQ-Tag专用色谱柱(3.9 mm×150 mm,4.0 μm):美国Waters公司。
1.3 方法
1.3.1 香肠的制作工艺流程及操作要点
发酵香肠的制作参考陈骏飞等[14]的工艺并稍作修改。
原料生猪肉的预处理及漂洗→绞碎接种发酵剂、添加辅料和肉混合均匀成肉糜→灌肠→发酵→成熟→香肠
操作要点:
预处理:将购买的后腿猪肉(肥瘦比为2∶8)绞碎后,每1.00 kg肉中添加辅料(食盐20.00 g、单山蘸水10.00 g、葡萄糖10.00 g、黑胡椒粉10.00 g、亚硝酸钠0.10 g、复合磷酸盐0.03 g)。
发酵菌株活化:将清酒广布乳杆菌L接种至MRS液体培养基、小牛动物球菌接种至NB液体培养基中,均在37 ℃下培养并定期监测OD600 nm值,当OD600 nm值达到1.0时传代。菌液经2次传代后,6 000 r/min条件下离心10 min,弃上清液,用生理盐水洗涤沉淀菌泥2次,备用。
接种:以不接种菌株的自然发酵为空白对照(CK);L组:只接种清酒广布乳杆菌L(菌液接种浓度为109 CFU/mL),接种量为2%(以鲜肉质量计);L+AP2组:清酒广布乳杆菌L、小牛动物球菌AP2混菌接种(两种菌液浓度均为109CFU/mL,且按体积比1∶1混合),接种量为2%(以鲜肉质量计);并确保接菌组(L组、L+AP2组)发酵香肠中初始菌落数为3×107~5×107 CFU/g。
灌肠:将人工肠衣放入40 ℃的温水中浸泡15 min,然后将浸泡好的肠衣套至灌肠工具管口,装入肉糜,匀速挤压至肠衣填装饱满并用棉绳扎紧,使每节香肠长20~25 cm,直径1.5 cm,用牙签扎孔后进行发酵。
发酵:发酵初期(0~1 d)控制温度为20 ℃,相对湿度为75%;发酵中期(2~3 d)控制温度为13 ℃,相对湿度为60%;发酵后期(4~5 d)控制温度为11 ℃,相对湿度为60%。
成熟:常温条件下后熟5 d,即得香肠成品。
1.3.2 乳酸菌和凝固酶阴性葡萄球菌活菌数测定
在香肠发酵过程中,每天对各组香肠取样并分别对乳酸菌和凝固酶阴性葡萄球菌进行菌落计数。 取1 g样品与5 mL生理盐水混合后匀浆10 min,随后用生理盐水梯度稀释,并取100 μL稀释液分别涂布于MRS培养基和MSA培养基上进行培养并菌落计数,其中,MRS培养条件为37 ℃,2 d;MSA培养条件为30 ℃,2 d。
1.3.3 理化指标分析
水分含量测定:参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》中的直接干燥法;水分活度(Aw)测定:参照GB 5009.238—2016《食品安全国家标准 食品水分活度的测定》中的水分活度仪扩散法;蒸煮损失率测定:根据余依敏等[15]的方法;pH值测定:参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》;亚硝酸盐测定:参照国标GB 5009.33—2016《食品安全国家标准食品中亚硝酸盐和硝酸盐的测定》中的分光光度法进行测定;游离氨基酸测定:采用高效液相色谱法[3]。
1.3.4 颜色参数测定
参考范鑫洋等[16]的方法并稍作修改。 将发酵香肠切成1 cm左右的正方体,用色差仪测定发酵香肠的明亮度(L*值)、红绿度(a*值)(正值为红色,负值为绿色)和黄蓝度(b*值) (正值为黄色,负值为蓝色),并按公式(1)计算颜色的饱和度(C值)。
1.3.5 质构测定
参考王宁宁等[17]的方法并稍作修改,即将发酵香肠剥去肠衣后,切成边长1 cm的正方体,采用质构仪对其硬度、弹性、内聚性、咀嚼性进行检测。 质构仪检测参数:探头为TPA 500 N,形变量75%,起始力0.75 N,检测速度120 mm/min。
1.3.6 滋味活度值计算
香肠样品中呈味物质含量与其阈值的比值为滋味活度值(taste activity value,TAV),通过TAV来判断游离氨基酸对香肠风味的贡献程度,当TAV>1时,认为该物质对样品滋味有贡献,且数值越大,贡献越显著;TAV<1时,认为该物质对呈味贡献较小[3]。 按公式(2)计算TAV。
式中:C1为游离氨基酸在香肠中的含量,mg/g;C2为该游离氨基酸呈味阈值,mg/g。
1.3.7 感官评价
选择12名经验丰富的发酵肉类产品研发人员,对发酵香肠外观、色泽、风味、口感和组织状态等5个方面进行感官评分,满分100分,评价标准见表1[18],并在去除最高分与最低分后计算平均分。
表1 香肠的感官评分标准
Table 1 Sensory evaluation standards of sausage
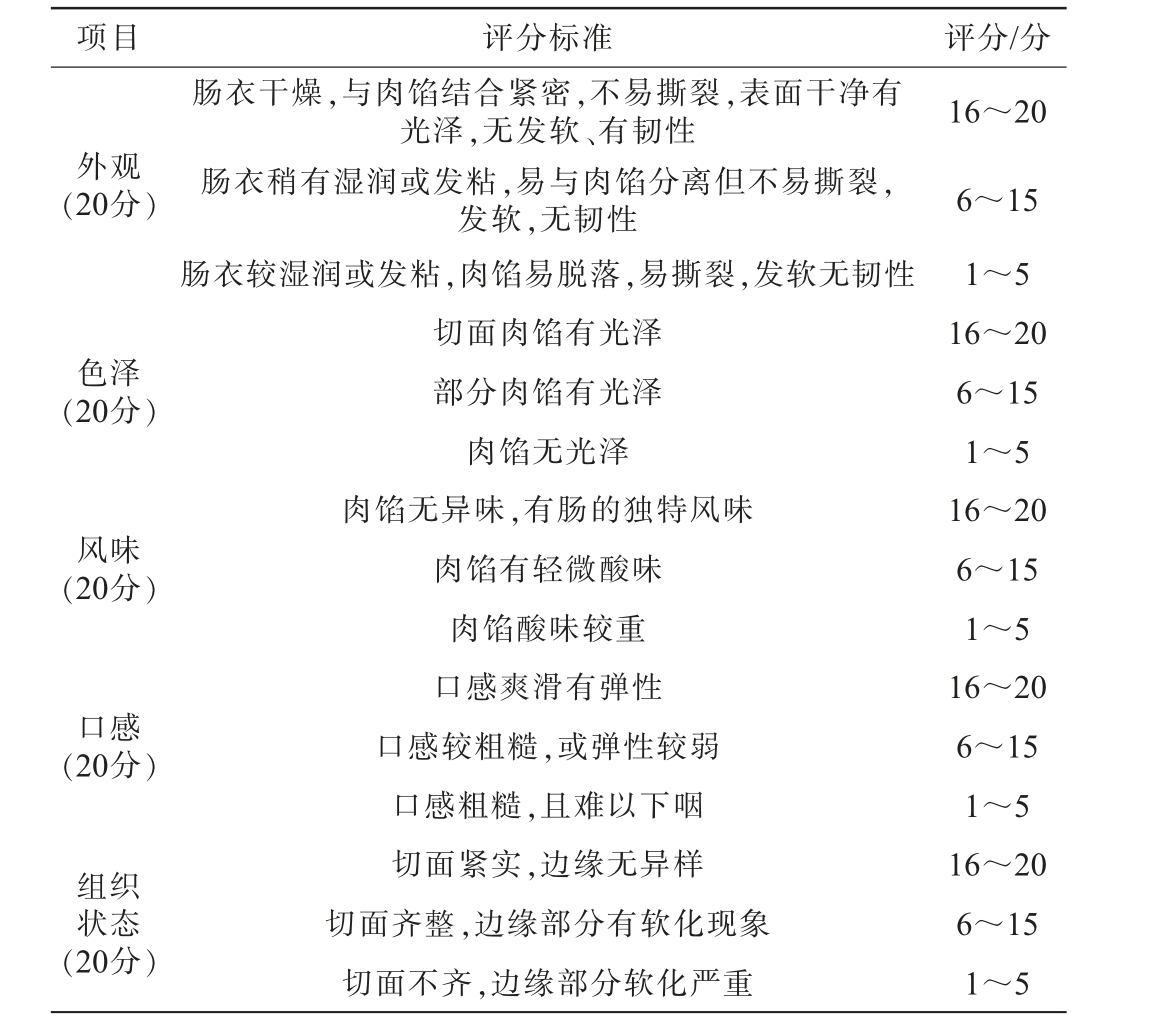
项目 评分标准 评分/分外观(20分)色泽(20分)风味(20分)口感(20分)组织状态(20分)肠衣干燥,与肉馅结合紧密,不易撕裂,表面干净有光泽,无发软、有韧性肠衣稍有湿润或发粘,易与肉馅分离但不易撕裂,发软,无韧性肠衣较湿润或发粘,肉馅易脱落,易撕裂,发软无韧性切面肉馅有光泽部分肉馅有光泽肉馅无光泽肉馅无异味,有肠的独特风味肉馅有轻微酸味肉馅酸味较重口感爽滑有弹性口感较粗糙,或弹性较弱口感粗糙,且难以下咽切面紧实,边缘无异样切面齐整,边缘部分有软化现象切面不齐,边缘部分软化严重16~20 6~15 1~5 16~20 6~15 1~5 16~20 6~15 1~5 16~20 6~15 1~5 16~20 6~15 1~5
1.3.8 数据处理
实验数据用Excel 2019进行处理,结果以“平均值±标准差”表示;IBM SPSS Statistics 26.0进行显著性分析;Graphpad Prism 8.4.3进行绘图。
2 结果与分析
2.1 香肠发酵过程中乳酸菌及凝固酶阴性葡萄球菌变化
香肠发酵过程中LAB和CNS活菌数的变化结果见图1。由图1a可知,发酵过程中接种发酵菌株的乳酸菌(LAB)活菌数显著高于CK组(P<0.05),发酵结束时,CK组、L组、L+AP2组乳酸菌活菌数分别为(3.02±0.01) lg(CFU/g)、(7.24±0.17) lg(CFU/g)和(7.42±0.09) lg(CFU/g),说明接种清酒广布乳杆后可使乳酸菌在香肠发酵过程中成为优势菌,与吴双慧等[19]的研究结果一致,且L+AP2组LAB活菌数更高。说明复配菌株可对发酵香肠内的不良微生物产生抑制作用,促进乳酸菌的生长。
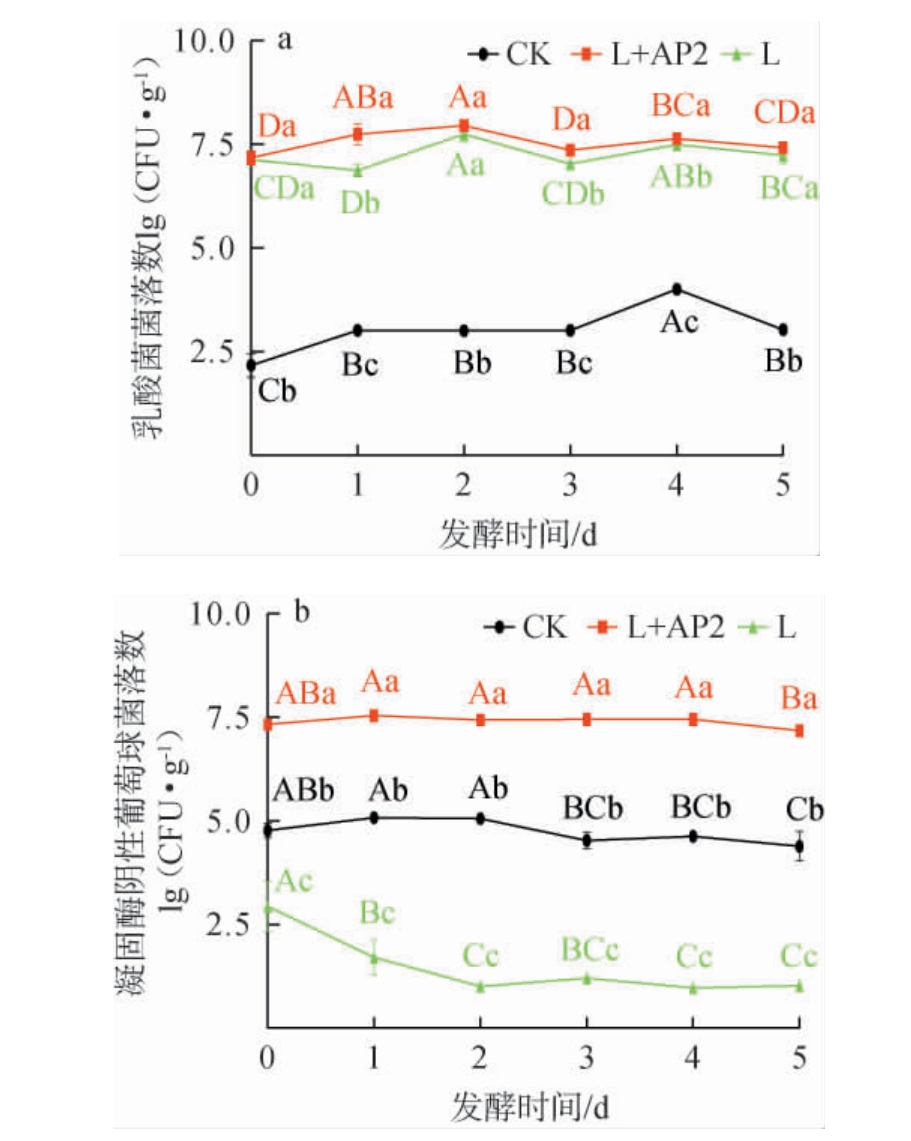
图1 香肠发酵过程中乳酸菌(a)和凝固酶阴性葡萄球菌(b)活菌数变化
Fig.1 Changes of viable count of lactic acid bacteria (a) and coagulase negative Staphylococcus (b) during sausage fermentation
不同小写字母表示同一发酵时间不同组别差异显著(P<0.05),不同大写字母表示同组别不同发酵时间差异显著(P<0.05)。下同。
由图1b可知,发酵结束时,CK组、L组、L+AP2组CNS活菌数分别为(4.39±0.29)lg(CFU/g)、(1.02±0.02)lg(CFU/g)和(7.18±0.05)lg(CFU/g),其中,L组CNS活菌数显著低于其他组(P<0.05),这可能是发酵过程中部分CNS的生长会被清酒广布乳杆菌L所抑制[6]。L+AP2组的CNS活菌数最高,这表明接种的AP2菌在复配发酵香肠中能很好的存活,在发酵第5天时才略有降低,可能是由于葡萄球菌的活性受到营养物质缺乏、代谢产物积累、水分流失等不利因素影响[6]。
2.2 香肠发酵过程中理化指标的变化
香肠发酵过程中理化指标的变化结果见图2。

图2 香肠发酵过程中理化指标变化
Fig.2 Changes of physicochemical indexes of sausage during the fermentation
由图2a可知,随着发酵过程的进行,3组香肠的pH值均呈现先下降后平稳的趋势,发酵结束时CK组、L组、L+AP2组的pH值分别为6.16、5.37、5.91。 整个发酵过程中pH值下降幅度最大的是L组(由6.43降至5.37),其次是L+AP2组(由6.43降至5.91),CK组(由6.43下降至6.16)。 整个发酵过程中,CK组的pH值在0~1 d时略有下降,这可能是原料中存在的微生物生长繁殖,作用于碳水化合物,分解产生有机酸,酸类物质的大量积累,使香肠pH值降低[20],发酵1~5 d的pH值平稳。 L+AP2组在发酵初期(0~1 d),pH值迅速降至最低(由6.43降至5.78),发酵1~2 d时pH值逐渐上升,发酵2 d后pH值平稳,这与吴双慧等[19]在复配植物乳植杆菌与葡萄球菌混合发酵香肠的结果一致。这可能是由于接菌发酵产生有机酸,使香肠的pH值降低,随着发酵的进行,微生物分解蛋白质产生碱性物质(如胺、氨等)又导致pH值上升[21]。L组在发酵初期和中期(0~3 d),pH值下降明显(由6.43降至5.33),发酵3 d后时pH值平稳,这可能是由于清酒广布乳杆菌产生了大量乳酸等酸性物质导致pH值下降明显[6],发酵后期也产生碱性物质导致pH值趋于稳定。
低含水量是确保香肠保质期和安全性的关键,接菌发酵能够降低香肠的含水量,抑制有害菌的生长,为延长香肠保质期和增加食品安全性提供可能[14]。由图2b可知,随着发酵的进行,3组香肠的水分含量均逐渐降低,发酵结束时CK组、L组、L+AP2组的水分含量分别为(6.92%、4.30%、3.70%)。 L+AP2组最低,这可能是因为发酵过程中水分蒸发和因乳酸菌增殖导致酸的产生和pH值的降低,导致肌肉蛋白变性、肌束收缩和蛋白质网络的水分流失[22]。
蒸煮损失率是评价肉制品熟制过程中质量减少程度的重要指标,由图2c可知,随着发酵过程的进行,3组香肠的蒸煮损失率均逐渐降低,发酵结束时,CK组、L组、L+AP2组的蒸煮损失率分别为0.67%、0.37%、0.30%。 接菌组(L组、L+AP2组)的蒸煮损失率显著低于CK组(P<0.05),说明发酵菌种及其代谢物能与猪肉中的蛋白相互作用,控制不易流动水,从而减少香肠的蒸煮损失[23]。
由图2d可知,随着发酵的进行,3组香肠中亚硝酸盐的含量均呈下降趋势,发酵结束时,CK组、L组、L+AP2组的亚硝酸盐含量分别为10.00 mg/kg、0.75 mg/kg、5.58 mg/kg。接菌组的亚硝酸盐含量显著低于CK组(P<0.05),说明接种清酒广布乳杆菌L及其与小牛动物球菌AP2复配均有利于亚硝酸盐的降解。此外,发酵结束时,接菌组亚硝酸盐含量均远低于国家标准规定(<30 mg/kg),这说明添加发酵剂可降低发酵香肠中的亚硝酸盐残留量,这与WANG X等[24]研究结果一致。L组的亚硝酸盐含量低于其他接菌组,这说明清酒广布乳杆菌的产酸能力有利于降低香肠中的亚硝酸盐含量。
从香肠发酵过程中理化指标变化来看,在香肠发酵过程中,复配菌株发酵能降低pH值、水分含量和蒸煮损害率,抑制亚硝酸盐生成。
2.3 香肠发酵过程中颜色的变化
发酵香肠的颜色与其品质密切相关,3组香肠发酵过程中颜色参数的变化结果见图3。
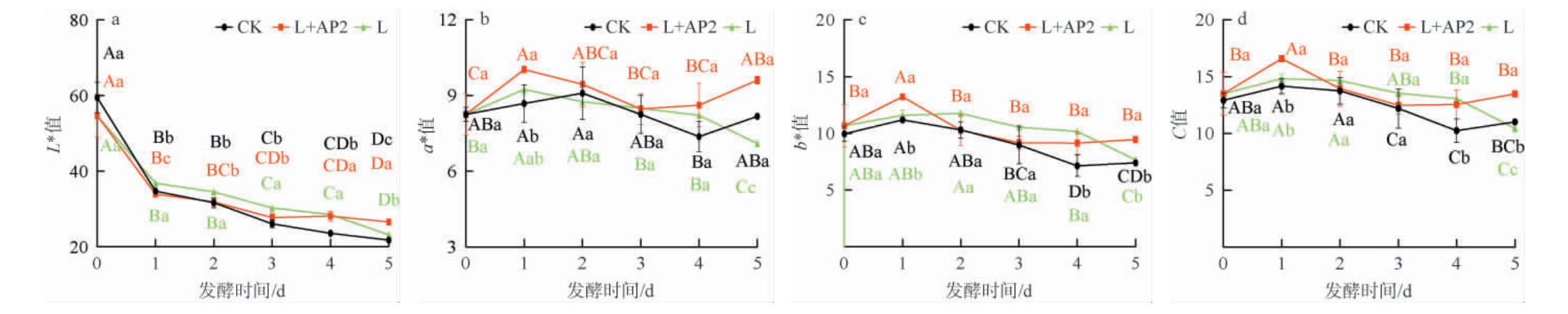
图3 香肠发酵过程中颜色参数变化
Fig.3 Changes of color parameters of sausage during the fermentation
由图3可知,从香肠发酵过程中颜色参数变化来看,发酵过程中3组香肠的明亮亮度(L*值)均呈降低趋势,这可能是由于水分的流失会导致的[23];3组的a*值、b*值、C值均呈现先升高后降低趋势,这与乳酸菌与其他CNS复配发酵香肠的变化一致[14,25]。 发酵结束时,L+AP2组的L*值(26.57±0.12)、a*值(9.61±0.12)、b*值(9.46±0.13)和C 值(13.48±0.11)均显著高于其他组合(P<0.05),说明复配菌株发酵有利于香肠发色,可能是由于接种菌株有促进亚硝酸盐分解的作用,利于亚硝基肌红蛋白生成,使香肠具有更好的色泽[25]。
2.4 香肠发酵过程中质构的变化
香肠发酵过程中质构变化见图4。

图4 香肠发酵过程中质构变化
Fig.4 Changes of texture of sausage during the fermentation
由图4可知,在发酵过程中,3组发酵香肠的硬度、咀嚼性、弹性均有所上升,内聚性则呈下降趋势。 发酵结束时,在硬度和咀嚼性方面,接菌组显著高于CK组,其中,L+AP2组的硬度、咀嚼性、弹性、内聚性分别为307.05 N、316.17 mJ、4.44 mm、0.30。说明接菌发酵能显著提高香肠的硬度和咀嚼性,可能的原因为随着香肠水分含量的减少,香肠的结构会越来越致密[4];香肠pH值的降低,可导致蛋白质的展开和疏水性基团的暴露,削弱了蛋白质与水的相互作用,且促进了疏水相互作用[26]。随着酸化的增加,疏水相互作用可能在菌接种肠蛋白凝胶网络的结构中起主导作用。蛋白质分子通过疏水相互作用顺序连接形成弹性凝胶,增强了香肠的弹性和凝聚力[27]。
综上,添加复配菌株发酵能提升香肠亮度和色泽,显著提高香肠的硬度和咀嚼性,同时保持了传统香肠的弹性和内聚性改善质构。
2.5 香肠发酵过程中游离氨基酸的变化
游离氨基酸在香肠特定风味的形成中起着重要作用,为进一步研究复合菌株发酵对香肠风味的影响及小牛动物球菌在复合菌株中的作用,对鲜肉与CK组、L组和L+AP2组香肠进行游离氨基酸检测,结果见图5。
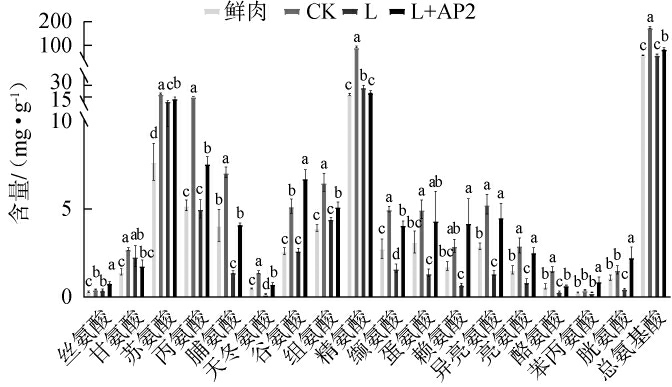
图5 鲜肉和香肠中游离氨基酸含量测定结果
Fig.5 Determination results of free amino acids contents in fresh meat and sausage
由图5可知,鲜肉和发酵香肠中共检出游离氨基酸有17种,包含必需氨基酸有6种(苏氨酸、缬氨酸、亮氨酸、苯丙氨酸、赖氨酸和异亮氨酸),鲜肉和发酵香肠中游离氨基酸和必需氨基酸的种类相同。香肠经过发酵后,丝氨酸、甘氨酸、苏氨酸、丙氨酸、谷氨酸、组氨酸、精氨酸、苯丙氨酸、总氨基酸含量较鲜肉均有不同程度的增加。L+AP2组香肠游离氨基酸总量为85.72 mg/g,其中谷氨酸、赖氨酸、胱氨酸、苯丙氨酸、丝氨酸的含量高于CK组;除精氨酸、甘氨酸外,其他15种氨基酸含量均高于L组。 CK组的游离氨基酸总量最高(176.37 mg/g),可能是自然发酵组由于盐度、亚硝酸盐添加量较低,导致致病菌如肠杆菌属、肠球菌[28]或产生物胺的细菌如乳酸片球菌、戊糖片球菌[29]生长,水解蛋白质产生大量氨基酸。
游离氨基酸按其呈味特性可分为鲜味氨基酸、甜味氨基酸、苦味氨基酸及无味氨基酸[3]。 3组发酵香肠游离氨基酸的滋味特征及TAV见表2。
表2 发酵香肠游离氨基酸滋味特征及滋味活度值
Table 2 Taste characteristics and taste activity value of free amino acids in fermented sausage
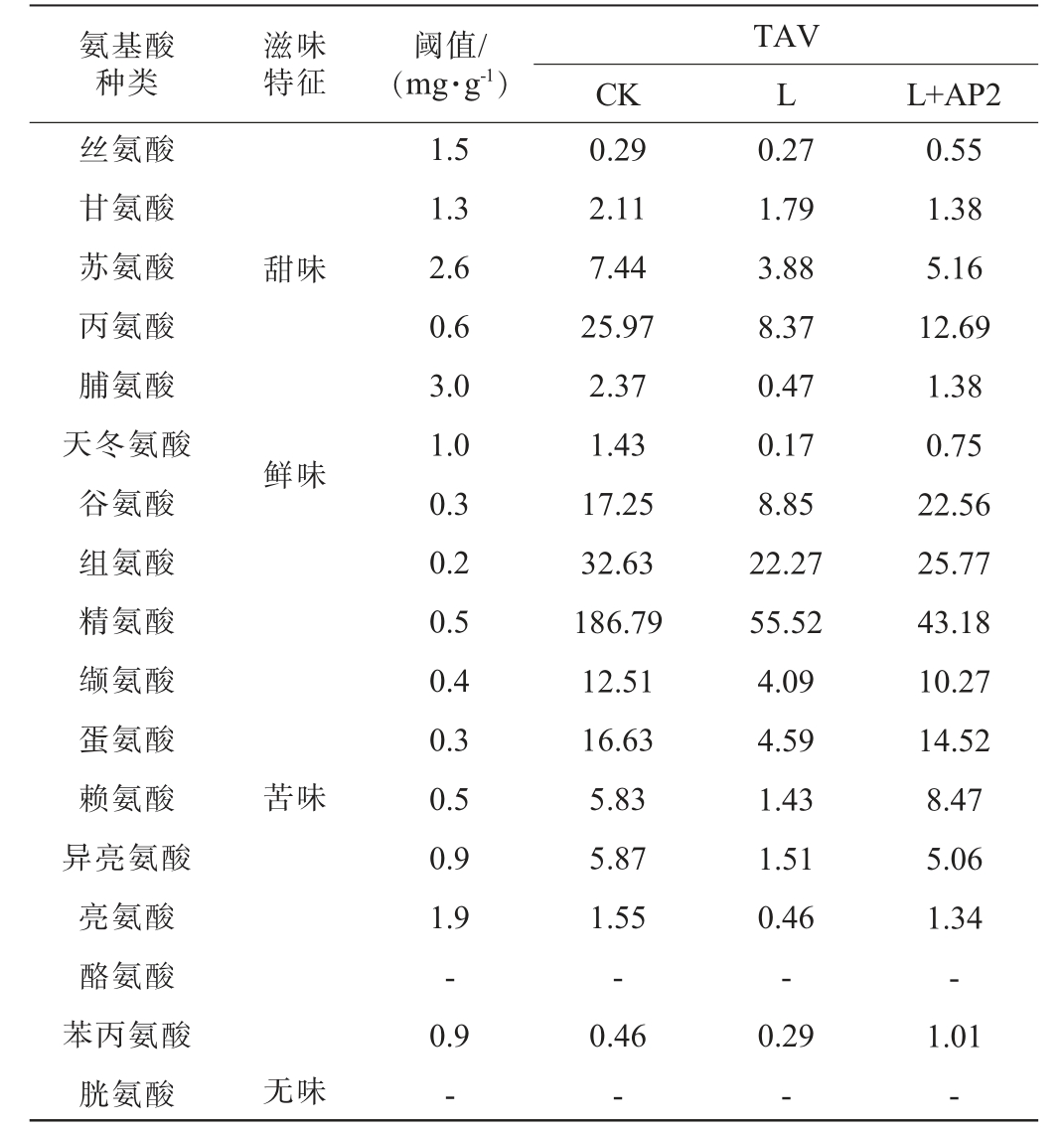
注:“-”表示未检出。
氨基酸种类滋味特征阈值/(mg·g-1)TAV CK L L+AP2丝氨酸甘氨酸苏氨酸丙氨酸脯氨酸天冬氨酸谷氨酸组氨酸精氨酸缬氨酸蛋氨酸赖氨酸异亮氨酸亮氨酸酪氨酸苯丙氨酸胱氨酸甜味鲜味苦味无味1.5 1.3 2.6 0.6 3.0 1.0 0.3 0.2 0.5 0.4 0.3 0.5 0.9 1.9-0.9-0.29 2.11 7.44 25.97 2.37 1.43 17.25 32.63 186.79 12.51 16.63 5.83 5.87 1.55-0.46-0.27 1.79 3.88 8.37 0.47 0.17 8.85 22.27 55.52 4.09 4.59 1.43 1.51 0.46-0.29-0.55 1.38 5.16 12.69 1.38 0.75 22.56 25.77 43.18 10.27 14.52 8.47 5.06 1.34-1.01-
由表2可知,除酪氨酸、胱氨酸、丝氨酸、苯丙氨酸外,共筛选出对发酵香肠滋味形成有贡献的游离氨基酸13种(TAV>1),其中,产生苦味的精氨酸、组氨酸对香肠风味的贡献值最大,但接菌发酵可以使精氨酸、缬氨酸的贡献值降低。结合图5可知,L+AP2组在香肠发酵后期可以大量积累谷氨酸、丝氨酸,提升香肠的鲜味和甜味,降低香肠的苦味。说明复配接种发酵对香肠内呈味氨基酸的积累有促进作用,并提高了整体氨基酸的含量,同时也有利于香肠中滋味物质生成。
从发酵香肠的游离氨基酸含量及滋味特征结果来看,添加复配菌株发酵增加了鲜味和甜味氨基酸含量,对香肠风味有积极作用。
2.6 香肠感官品质评价
对3组香肠进行感官评分,结果见图6。由图6可知,CK组、L组、L+AP2组发酵香肠的感官评分分别为77.00分、73.50分、87.50分。L+AP2组在组织状态、外观、色泽、风味、口感评分均为最高,可能是因为复配菌株组合通过蛋白质和脂质分解代谢,产生游离氨基酸、醛酮酯类等风味化合物,有利于改善香肠的风味[30],且复配后不会导致过酸影响口感;小牛动物球菌在蛋白质水解过程中产生了独特的肽和氨基酸模式,有助于发酵香肠的独特风味[31]。因此,通过接种清酒广布乳杆菌和小牛动物球菌对发酵香肠的外观、色泽、风味、口感和组织状态均有提升。
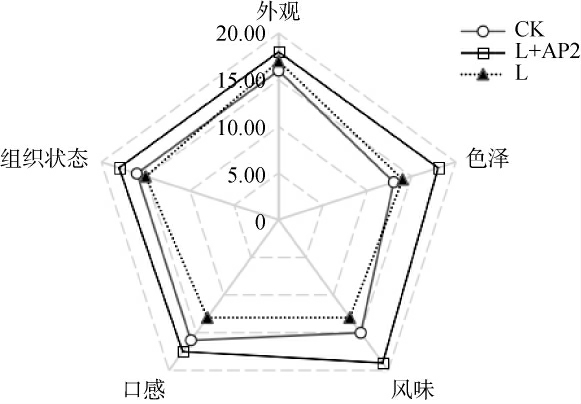
图6 香肠感官评分雷达图
Fig.6 Sensory score radar chart of sausage
3 结论
本实验研究了清酒广布乳杆菌L单一接种及其和小牛动物球菌AP2复配接种对发酵香肠微生物、理化、质构、颜色、游离氨基酸及感官的影响,在香肠发酵过程中,添加复配菌株能增加香肠的活菌数,发酵结束时,LAB和CNS活菌数分别达到7.42 lg(CFU/g)、7.18 lg(CFU/g);降低pH值、水分含量和蒸煮损失率,发酵结束时,pH值、水分含量和蒸煮损失率分别为5.91、3.70%、0.37%;抑制亚硝酸盐生成,发酵结束亚硝酸盐含量为5.58 mg/kg;提升亮度和色泽,改善质构,提升香肠风味有积极作用的游离氨基酸,使之拥有更好的风味和口感。综上,清酒广布乳杆菌L与小牛动物球菌AP2(1∶1)复配接种对发酵肠的品质和风味有积极的影响,为生产安全、营养的发酵香肠提供理论依据,为发酵香肠专用菌剂的研发提供数据支撑,为发酵香肠的实际生产提供指导。
[1]FLORES M,PIORNOS J A.Fermented meat sausages and the challenge of their plant-based alternatives: A comparative review on aroma-related aspects[J].Meat Sci,2021,182:108636.
[2]SHI Q,WANG X R,JU Z J,et al.Technological and safety characterization of Kocuria rhizophila isolates from traditional ethnic dry-cured ham of Nuodeng,Southwest China[J].Front Microbiol,2021,12:761019.
[3]刘毕琴,李宏,陈骏飞,等.嗜根考克氏菌K45对发酵猪肉品质的影响[J].中国酿造,2023,42(3):101-108.
[4]冯美琴,龚瑶,孙健.植物乳杆菌和模仿葡萄球菌复配对发酵羊肉香肠理化性质、风味及多肽抗氧化能力的影响[J].食品科学,2024,45(12):116-124.
[5]孙尔科,孙学颖,孙立娜,等.戊糖片球菌37X-9和茶多酚对发酵羊肉香肠生物胺及品质的影响[J].食品研究与开发,2024,4(23):1-11.
[6]郑云,郑爽,周天硕,等.清酒乳杆菌对发酵风干肠品质的影响[J].现代食品科技,2023,39(12):122-129.
[7]MARCEAU A,ZAGOREC M,CHAMPOMIER-VERGÈS M C.Positive effects of growth at suboptimal temperature and high salt concentration on long-term survival of Lactobacillus sakei[J].Res Microbiol,2003,154(1):37-42.
[8]LEE Y D, HONG, Y F, JEON B, et al.Differential cytokine regulatory effect of three Lactobacillus strains isolated from fermented foods[J].J Microbiol Biotechnol,2016,26:1517-1526.
[9]SAMELIS J,METAXOPOULOS J,VLASSI M,et al.Stability and safety of traditional Greek salami-a microbiological ecology study[J].Int J Food Microbiol,1998,44:69-82.
[10]TREMONTE P, REALE A D, RENZO T, et al.Interactions between Lactobacillus sakei and CNC(Staphylococcus xylosus and Kocuria varians)and their influence on proteolytic activity[J].Lett Appl Microbiol,2010,51:586-594.
[11]王德宝,胡冠华,苏日娜,等.发酵剂对羊肉香肠中蛋白、脂质代谢与风味物质的影响[J].农业机械学报,2019,50(3):336-344.
[12]叶圣雨,吴佳佳,屈炯,等.凝固酶阴性葡萄球菌在发酵食品中的应用[J].中国食品学报,2024,24(1):430-442.
[13]ZHOU C,WU X,PAN D,et al.TMT-labeled quantitative proteomic reveals the mechanism of proteolysis and taste improvement of dry-cured bacon with Staphylococcus co-inoculation[J].Food Chem,2024,436:137711.
[14]陈骏飞,申挥,张珂铭,等.嗜根考克氏菌与植物乳植杆菌复合发酵对香肠品质及细菌群落的影响[J].肉类研究,2025,39(2):1-10.
[15]余依敏,夏强,杨林林,等.魔芋葡甘聚糖-可得然胶共混凝胶替代动物脂肪对乳化肠品质特性的影响[J].食品科学,2021,42(16):46-53.
[16]范鑫洋,张香美,康晶,等.不同比例克鲁维酵母对低盐发酵香肠品质特性的影响[J].食品与发酵工业,2024,51(2):227-233.
[17]王宁宁,冯美琴,孙健.低钠复合盐对发酵香肠理化特性及风味的影响[J].食品科学,2021,42(16):1-7.
[18]黄春阳,王哲,王灵娟,等.添加非肉蛋白对南京香肠品质特性的影响[J].食品工业科技,2023,44(21):91-96.
[19]吴双慧,杨梓垚,牛茵,等.复配发酵剂对发酵香肠的品质及挥发性风味的影响[J].食品工业科技,2024,45(5):126-133.
[20]刘玥.木糖葡萄球菌干粉保护剂的研究及其在发酵香肠中的应用[D].扬州:扬州大学,2020.
[21]冯美琴,张杰,孙健.模仿葡萄球菌接种对发酵香肠品质及氧化稳定性的影响[J].食品科学,2022,43(4):105-112.
[22]王松,郭柯宇,唐林,等.发酵肉制品中凝固酶阴性葡萄球菌的应用研究进展[J].食品与发酵工业,2020,46(23):293-300.
[23]陈洪生,孔保华,王宇.蛋清蛋白对猪肉肌原纤维蛋白功能性的影响[J].中国食品学报,2014,14(5):80-84.
[24]WANG X,REN H,WANG W,et al.Effects of a starter culture on histamine reduction, nitrite depletion and oxidative stability of fermented sausages[J].J Food Safety,2016,36(2):195-202.
[25]冯美琴,李天翊,孙健.复合发酵剂对发酵鱼肉香肠品质、风味及其多肽抗氧化活性的影响[J].食品科学,2023,44(24):138-145.
[26]DU X,ZHAO M,PAN N,et al.Tracking aggregation behaviour and gel properties induced by structural alterations in myofibrillar protein in mirror carp(Cyprinus carpio)under the synergistic effects of pH and heating[J].Food Chem,2021,362:130222.
[27]LIU M, LUO H, XIAO Q, et al.Effect of Latilactobacillus sakei and Staphylococcus xylosus on the textural characteristics of dry fermented sausages[J].Food Biosci,2024,59:103972.
[28]张月,裴慧洁,何维,等.发酵食品中酪胺的形成机制及其控制研究进展[J].食品科学,2024,44(24):1-14.
[29]LI Y,YAN T,YIN L,et al.Isolation and identification of tyramine-producing bacteria and their biogenic amines formation during fermentation of sufu[J].Cell Mol Biol,2022,68(1):75-88.
[30]张香美,卢涵,叶翠,等.不同发酵剂对发酵香肠菌相、挥发性风味成分及品质的影响[J].东北农业大学学报,2021,52(3):45-53.
[31]LÓPEZ C M, SENTANDREU M A, VIGNOLO G M, et al.Proteomic and peptidomic insights on myofibrillar protein hydrolysis in a sausage model during fermentation with autochthonous starter cultures[J].Food Res Int,2015,78:41-49.