能源是人类社会赖以生存和发展的重要物质基础。在化石能源日趋枯竭和生态环境逐渐恶化的双重背景下,大力开发和利用清洁高效的可再生能源已迫在眉睫[1]。 氢能作为一种清洁、高效、低碳的可再生资源,能够实现资源和环境的可持续发展,已经被广泛用于冶金、化工、航空航天、食品和有机合成的诸多领域[2]。 纤维素类生物质是地球上最丰富和廉价的可再生资源[3],采用纤维素类生物质作为生物制氢的原料可以获得较高的产氢速率并降低生产成本,因此成为生物制氢领域的研究热点[4-5]。近年来,采用天然混合菌群暗发酵生物制氢技术被广泛研究[6]。与纯菌株发酵制氢相比,混合菌群由于其多样性的微生物结构,且不需要在无菌条件下操作,因此具有更广泛的底物范围和更高的转化效率。
与传统筛选纯菌株的思路不同,混合培养技术运用生态学的观点,通过选择压力(如限制性底物、生长因子、环境因素等)对微生物菌群进行调控[7]。因此,在纤维素降解产氢菌群的筛选驯化过程中,可以通过选择压力引导菌群形成有利于纤维素降解和氢气产生的群落结构。目前,关于限制性底物对纤维素降解产氢菌群结构的影响,以及菌群结构变化与纤维素降解和氢气累积之间的关系尚不明确,而这些信息对于调控菌群、实现纤维素转化和产氢效率的最大化至关重要。
针对上述问题,本研究以微晶纤维素作为限制性底物,牛粪堆肥作为天然菌源,在中温条件下对菌群进行富集驯化,以期获得高效稳定的纤维素降解产氢菌群,并采用高通量测序技术研究驯化前后纤维素降解产氢菌群中细菌群落组成,阐明菌群结构变化对纤维素降解和氢气累积的影响。 在单因素试验的基础上,利用响应面法对驯化后菌群发酵纤维素产氢的发酵工艺进行优化,考察菌群降解纤维素产氢气特性,以期为纤维素类生物质规模化制氢研究提供有一定参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料牛粪堆肥:取自郑州市某奶牛场,使用前对菌源进行微波辐射处理5 min用于抑制耗氢菌的活性[8-9]。
1.1.2 化学试剂
脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国OMEGA Biotech公司;碳酸氢铵、微晶纤维素(均为分析纯):国药集团化学试剂有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
富集驯化培养基:微晶纤维素0.5 g/L,NH4HCO3 1 g/L,KH2PO4 1 g/L,自然pH。
纤维素发酵培养基:微晶纤维素10 g/L,NH4HCO31 g/L,KH2PO4 1 g/L,营养液10 mL/L。
营养液[10]:FeCl20.002 78 g/L,NaCl 0.01 g/L,MgSO4·7H2O 0.1 g/L,CaCl2·2H2O 0.01 g/L,Na2MoO4·2H2O 0.01 g/L,MnSO4·7H2O 0.015 g/L。
以上培养基均现用现配,于121 ℃高压蒸汽灭菌20 min后备用。
1.2 仪器与设备
Agilent-4890气相色谱(gas chromatography,GC)仪:美国Agilent公司;FDX-116A全自动高压灭菌锅:上海申安医疗器械厂;HT211B气浴恒温振荡器:江苏春兰实验仪器厂;9099电热恒温干燥箱:重庆实验设备厂;HHS4恒温水浴锅:江苏华特实验仪器厂;SW-CJ-1FD单人单面净化工作台:苏州净化设备有限公司;T100TM Thermal Cyeler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司。
1.3 方法
1.3.1 纤维素降解产氢菌群的驯化
以微晶纤维素为限制性底物,预处理牛粪堆肥为菌源,进行厌氧富集驯化培养。 具体操作:将预处理牛粪堆肥按30%(V/V)的接种量接种至富集驯化培养基中,(35±1)℃、120 r/min条件下培养。驯化采用底物(微晶纤维素)质量浓度逐级递增的方式进行,驯化过程中当氢气产量没有明显增加时,将微晶纤维素质量浓度提高1 g/L,微晶纤维素梯度质量浓度范围为0.5~10 g/L。当生物气中的氢气含量出现下降时,停止培养,并以30%(V/V)的接种量将培养液转接至新鲜富集驯化培养基中,每传代转接一次为一轮驯化,驯化至第15轮,接种量降为10%(V/V),整个富集驯化过程持续30轮。 测定驯化菌群的产氢能力、纤维素降解率及纤维素酶活力,将具有最大稳定产氢能力的混合菌液用于后续发酵产氢试验。
1.3.2 纤维素降解产氢菌群结构分析
分别取驯化前后的混合菌液,采DNA提取试剂盒提取微生物基因组总DNA,以其为模板,采用引物F968-GC(5'-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGAACGCGAAGAACCTTAC-3')和R1401(5'-CGGTGTGTACAAGACCC-3')对细菌菌群的16S rDNA V3-V4区基因序列进行PCR扩增[11]。PCR扩增产物委托生工生物工程(上海)股份有限公司进行Illumina MiSeq高通量测序。在Illumina平台获得的双端PE reads进行样本拆分后,首先对其测序质量进行评估与筛选,去除低质量序列。之后根据双端序列之间的重叠区域对reads进行拼接,从而生成经过质量控制与拼接处理的优化数据集。通过应用如DADA2或Deblur等序列去噪算法,对优化后的数据进行处理,以识别并提取扩增子序列变体(ampliconsequencevariants,ASVs),并获取其代表序列及相应的丰度信息。 基于ASV的代表序列及其丰度数据,采用Silva数据库进行物种比对注释。
1.3.3 驯化菌群发酵纤维素产氢试验
将驯化得到的混合菌群培养液以10%(V/V)的接种量接种至纤维素发酵培养基中,装液量为90 mL,调节初始pH值为6.9~7.0,通入高纯氮气以营造厌氧环境,将发酵瓶至于恒温培养箱中,(35±1)℃、120 r/min条件下进行发酵产氢。
1.3.4 驯化菌群发酵纤维素产氢工艺优化单因素试验
在方法1.3.3基础上,采用单因素轮换法分别考察微晶纤维素质量浓度(2 g/L、4 g/L、5 g/L、6 g/L、7 g/L、8 g/L、10 g/L)、碳酸氢铵质量浓度(0、1 g/L、2 g/L、3 g/L、4 g/L、5 g/L、6 g/L、8 g/L、10 g/L)、磷酸二氢钾质量浓度(0、0.5 g/L、1 g/L、2 g/L、4g/L、6g/L、8g/L)、营养液添加量(0、4mL/L、6mL/L、8mL/L、10 mL/L、12 mL/L、15 mL/L、20 mL/L)对氢气产量的影响。
1.3.5 驯化菌群发酵纤维素产氢工艺优化响应面试验
基于单因素试验结果,选取碳酸氢铵质量浓度(X1)、磷酸二氢钾质量浓度(X2)和营养液添加量(X3)3个因素为自变量,以氢气产量(Y)作为响应值,采用Design-Expert 12.0设计3因素3水平的响应面试验,试验因素与水平见表1。
表1 驯化菌群发酵微晶纤维素产氢工艺优化响应面试验因素与水平Table 1 Factors and levels of response surface tests for process optimization of hydrogen production from microcrystalline cellulose by domesticated flora fermentation
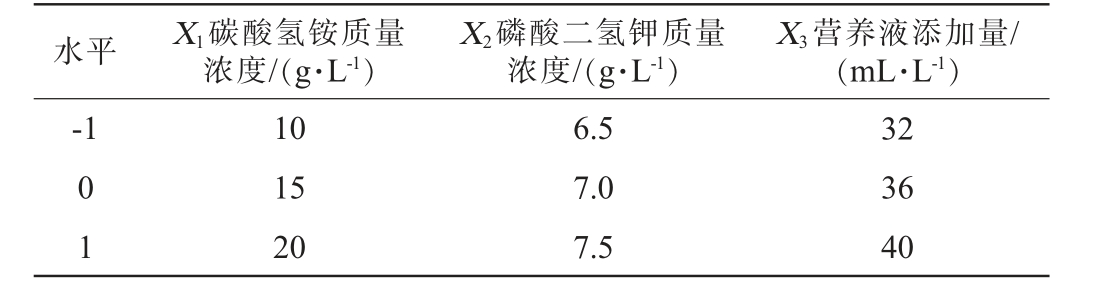
水平 X1碳酸氢铵质量浓度/(g·L-1)X3营养液添加量/(mL·L-1)-1 X2磷酸二氢钾质量浓度/(g·L-1)0 1 10 15 20 6.5 7.0 7.5 32 36 40
1.3.6 分析检测
采用气相色谱法测定氢气和二氧化碳含量[12];采用气相色谱法测定乙酸、丁酸和乙醇含量[13];将每小时产氢量的最大值计为最大产氢速率;采用失重法测定纤维素含量,并计算纤维素降解率,其计算公式如下:
通过测定滤纸酶活力反映总纤维素酶活力[14]。
1.3.7 数据处理与统计分析
采用Microsoft Office Excel 2020软件及IBM SPSS 25.0软件对数据进行统计分析处理;使用Origin 2021软件绘图;运用Design-Expert 12.0软件设计响应面试验。
2 结果与分析
2.1 纤维素降解产氢菌群的驯化
以微晶纤维素作为限制性底物,预处理牛粪堆肥作为菌源,进行厌氧驯化富集培养,驯化富集过程中菌群的氢气产量、纤维素降解率及纤维素酶活力见图1。由图1可知,在前3轮驯化阶段,纤维素酶活力较低,但随着传代次数增加,纤维素酶活力持续增强,尤其在7~25轮间增幅最大,纤维素降解率也迅速提高,表明具有纤维素降解功能的菌群在此阶段得到有效富集,纤维素降解正是菌体分泌的纤维素酶得以表达的结果。氢气产量与纤维素酶活力的变化趋势一致,随着纤维素酶活力的不断增强,氢气产量不断增加,在7~25轮间得到明显提高,表明具有产氢能力或者具有降解纤维素产氢能力的菌种得到富集。在25~30轮期间,纤维素降解率、氢气产量和纤维素酶活的增幅均明显减小,表明从25轮开始已经形成功能稳定的混合菌群。驯化结束时纤维素降解率从2.70%提高到78.10%,氢气产量从(27.5±2.55)mL/g提升至(203.5±8.10)mL/g,纤维素酶活力从0.11 U/mL增至0.63 U/mL,表明通过限制性底物的驯化方法形成了结构和功能稳定的纤维素降解产氢菌群。因此,选择驯化30轮的菌群用于后续试验。
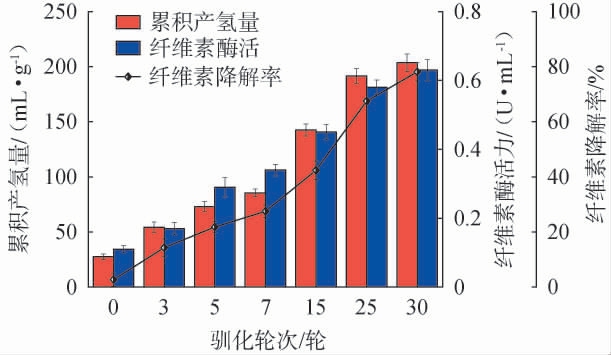
图1 纤维素降解产氢菌群驯化过程中氢气产量、纤维素酶活力和纤维素降解率测定结果
Fig.1 Determination results of hydrogen production, cellulase activities and cellulose degradation rates during the domestication of cellulose-degrading and hydrogen-producing flora
2.2 纤维素降解产氢菌群细菌菌群结构分析
驯化前后纤维素降解产氢菌群的细菌群落结构见图2。
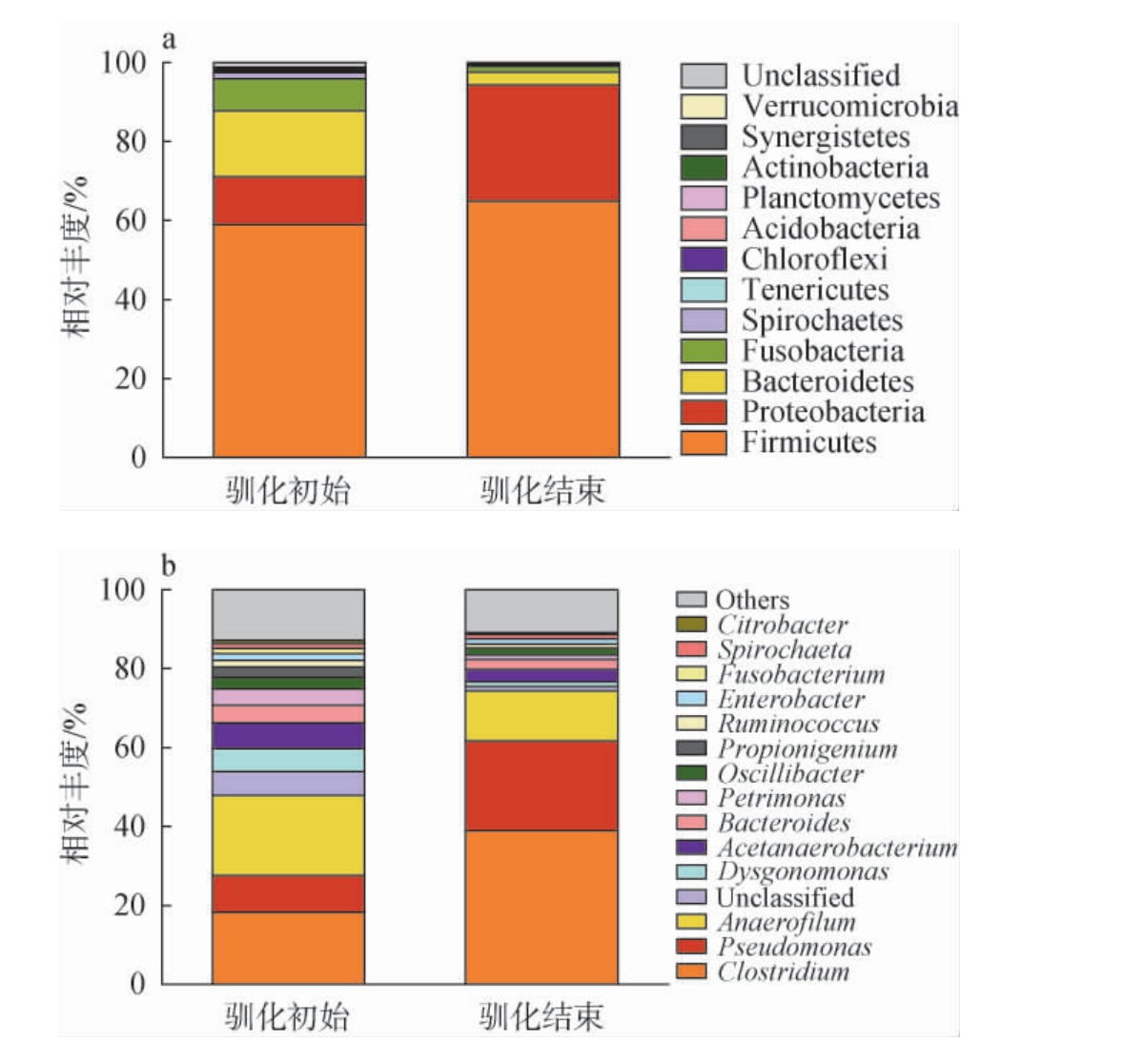
图2 基于门(a)和属(b)水平驯化前后纤维素降解产氢菌群的细菌群落结构
Fig.2 Bacterial flora structure of cellulose-degrading and hydrogenproducing flora before and after domestication based on phylum (a) and genus (b) levels
由图2a可知,从纤维素降解产氢菌群中共注释到12个细菌门,主要为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes),这与SARUNYOU W等[15]的研究结论相似,说明微生物在降解纤维素产氢过程中可能存在种群间的协同作用。 与驯化初始相比,Firmicutes在驯化结束时相对丰度变化不大,而Proteobacteria的相对丰度大幅增加,Bacteroidetes的相对丰度明显降低。 结果表明,由于微生物对单一底物环境的适应能力不同,驯化前后微生物群落结构和菌群数量不同,能够适应生存环境的菌群活性明显增强,不能适应生存环境的种群数量明显减少甚至消失,优势菌群的结构和数量处于动态变化之中。
由图2b可知,从纤维素降解产氢菌群中共注释到15个细菌属。 在驯化初始阶段,细菌属种类较多,但在选择性底物的作用下,细菌属种类明显降低,驯化结束时,主要细菌属的相对丰度出现了明显变化。驯化过程中,梭菌属(Clostridium)的相对丰度由18.20%增加至35.10%,而厌氧细杆菌属(Anaerofilum)的相对丰度由20.30%下降至11.40%。值得注意的是,假单胞菌属(Pseudomonas)的相对丰度迅速增加,由9.20%增加至20.50%。研究表明,Clostridium是纤维素降解菌和产氢菌的代表菌属[16-17],目前已经报道的丁酸梭菌(Clostridium butyricum)[18]和贝氏梭菌(Clostridium beijerinckii)[19]等为典型的产氢菌;杨氏梭状芽孢杆菌(Clostridium populeti)[20]和白蚁梭菌(Clostridium termitidis)等[21]为具有纤维素降解功能的产氢菌。Anaerofilum是典型的发酵产酸细菌[22],其中吞五碳糖嗜厌氧菌(Anaerofilum pentosovorans)和敏捷厌氧丝状菌(Anaerofilum agile)均能够发酵葡萄糖代谢产酸。 Pseudomonas是重要的纤维素降解菌属[23-24],其中荧光假单胞菌(Pseudomonas fluorescens)和莫氏假单胞菌(Pseudomonas mosselii)[25]能够产生高效水解木质纤维素的复合酶。结果表明,纤维素降解菌、发酵产氢菌以及纤维素降解产氢菌成为体系中主要的功能菌群,它们之间形成的互养关系,有效提高了纤维素降解和产氢的效率[26]。
2.3 驯化菌群发酵纤维素产氢工艺优化单因素试验
2.3.1 微晶纤维素质量浓度对氢气产量的影响
微晶纤维素质量浓度对驯化菌群产氢特性的影响见表2。由表2可知,当微晶纤维素质量浓度在2~7 g/L时,氢气产量和最大产氢速率随着微晶纤维素质量浓度的增加而上升;当微晶纤维素质量浓度在7~10 g/L时,氢气产量和产氢速率呈现下降趋势。当微晶纤维素质量浓度<7 g/L之前,纤维素降解率较高,随着微晶纤维素质量浓度的增加,纤维素降解率明显下降,表明菌群只能有效利用质量浓度为7 g/L以下的纤维素产氢,分析原因可能是由于菌群生长代谢过程中积累的酸性物质使发酵液pH下降,导致菌株纤维素降解能力的下降[27]。在不同微晶纤维素质量浓度下发酵末端的主要代谢产物为乙酸、丁酸和乙醇,其产量随微晶纤维素质量浓度的增加而提高,此现象与CHITTIBABU G等[28]的研究结论一致,高底物浓度更有利于产生有机酸和醇类等还原性副产物。虽然微晶纤维素质量浓度为7 g/L时的产氢量略高于6 g/L,但考虑到底物的转化效率,选择纤维素的最佳质量浓度为6 g/L。
表2 微晶纤维素质量浓度对驯化菌群产氢能力的影响
Table 2 Effect of microcrystalline cellulose mass concentration on hydrogen production capacity of domesticated flora
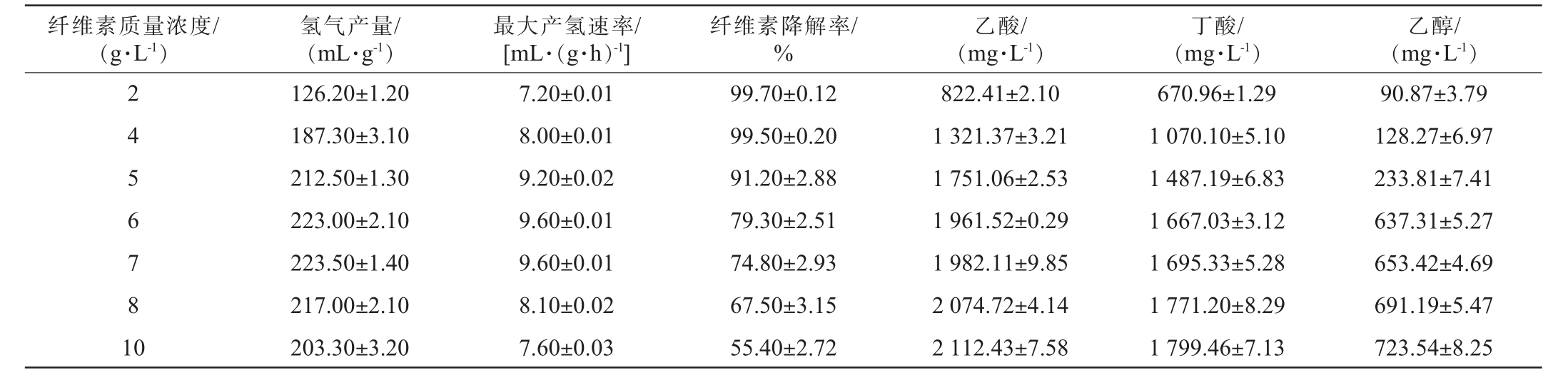
纤维素质量浓度/(g·L-1)氢气产量/(mL·g-1)最大产氢速率/[mL·(g·h)-1]纤维素降解率/%乙酸/(mg·L-1)丁酸/(mg·L-1)乙醇/(mg·L-1)2 4 5 6 7 8 1 0 126.20±1.20 187.30±3.10 212.50±1.30 223.00±2.10 223.50±1.40 217.00±2.10 203.30±3.20 7.20±0.01 8.00±0.01 9.20±0.02 9.60±0.01 9.60±0.01 8.10±0.02 7.60±0.03 99.70±0.12 99.50±0.20 91.20±2.88 79.30±2.51 74.80±2.93 67.50±3.15 55.40±2.72 822.41±2.10 1 321.37±3.21 1 751.06±2.53 1 961.52±0.29 1 982.11±9.85 2 074.72±4.14 2 112.43±7.58 670.96±1.29 1 070.10±5.10 1 487.19±6.83 1 667.03±3.12 1 695.33±5.28 1 771.20±8.29 1 799.46±7.13 90.87±3.79 128.27±6.97 233.81±7.41 637.31±5.27 653.42±4.69 691.19±5.47 723.54±8.25
2.3.2 碳酸氢铵质量浓度对氢气产量的影响
氮源是影响微生物生长代谢和产物合成的重要物质。碳酸氢铵作为发酵生产中常用的氮源,具有价格低廉、来源广泛等特点[29],因此,在纤维素发酵产氢菌群的富集和驯化过程中,采用碳酸氢铵作为氮源。碳酸氢铵质量浓度对菌群产氢特性的影响见图3。由图3可知,当培养基中未添加碳酸氢铵时,菌群生长受限,产氢能力较弱。随着碳酸氢铵质量浓度的升高,氢气产量明显增加,当碳酸氢铵质量浓度为3 g/L时,氢气产量达到最高,为(237.30±2.78)mL/g,继续增大碳酸氢铵质量浓度,氢气产量呈现明显下降趋势。与氢气产量变化趋势不同,二氧化碳产量随碳酸氢铵质量浓度的增加而不断升高,当碳酸氢铵质量浓度由0增加至10 g/L时,二氧化碳产量由(25.20±3.15)mL/g增至(201.50±4.35)mL/g。 值得注意的是,当碳酸氢铵质量浓度为4 g/L时,氢气和二氧化碳的产量比例为1.2∶1.0,属于典型的丁酸型发酵[30]。 当碳酸氢铵质量浓度为10 g/L时,氢气和二氧化碳的产量分别为(60.60±3.50)mL/g和(201.50±4.35)mL/g,显然两种气体的排放比例与微生物的产氢代谢途径不相符合,这可能是由于过量碳酸氢铵分解导致二氧化碳增加和氨氮比例过高,从而抑制了菌群生长和产氢[31]。因此,选取碳酸氢铵的最佳质量浓度为3 g/L。
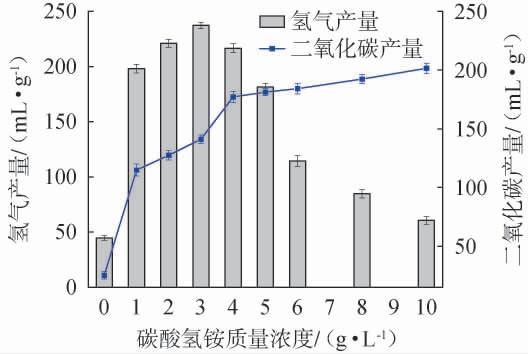
图3 碳酸氢铵质量浓度对驯化菌群产氢气能力的影响
Fig.3 Effect of ammonium bicarbonate mass concentration on hydrogen production capacity of domesticated flora
2.3.3 磷酸二氢钾质量浓度对氢气产量的影响
由于碳酸氢铵水溶液呈弱碱性,而根据本试验室的产氢经验,发酵液初始pH值在7.0左右有利于菌体生长和产氢,因此,在培养基中加入磷酸二氢钾,不仅可以为微生物提供磷源,还可以使发酵液pH值维持在适宜菌种生长的范围内。碳酸氢铵质量浓度对驯化菌群产氢特性的影响见图4。由图4可知,当磷酸氢二钾质量浓度在0~2 g/L范围内升高时,氢气产量逐渐增加,表明此时微生物生长繁殖能力和代谢活动较强;当磷酸氢二钾质量浓度为2 g/L时,氢气产量达到最高,为(250.10±3.51)mL/g;随后进一步增加磷酸二氢钾质量浓度,氢气产量明显下降。此外,随着磷酸二氢钾质量浓度的升高,发酵液的pH值呈不断下降趋势,这是由于高质量浓度的磷酸二氢钾会导致体系酸化,从而抑制微生物生长和产氢活性。 因此,确定磷酸二氢钾的最佳质量浓度为2 g/L。
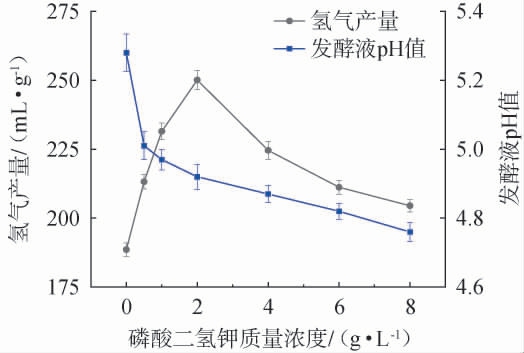
图4 磷酸二氢钾质量浓度对驯化菌群产氢气能力的影响
Fig.4 Effect of potassium dihydrogen phosphate mass concentration on hydrogen production capacity of domesticated flora
2.3.4 营养液添加量对氢气产量的影响
在厌氧发酵制氢系统中,微量元素参与微生物的细胞合成以及酶、辅酶的组成,其对于厌氧生物化学反应的进行具有重要意义[32],因此,考察营养液添加量对驯化菌群产氢特性的影响见图5。 由图5可知,随着营养液添加量的不断增加,氢气产量呈现先增大后减小的趋势。当培养基中未添加营养液时,氢气产量仅为(217.30±2.08)mL/g;当营养液添加量从4 mL/L增至8 mL/L时,氢气产量从(233.50±3.57)mL/g增加至(257.00±4.05)mL/g,说明进一步提高营养液含量不能有效增加氢气产量。 当营养液添加量增至20 mL/L时,氢气产量下降至(208.20±2.70)mL/g,表明过量添加微量元素对微生物有毒副作用,不利于其生长和产氢气。因此,确定营养液的最佳添加量为8 mL/L。
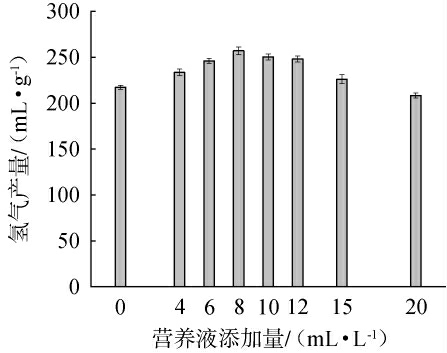
图5 营养液添加量对驯化菌群产氢气的影响
Fig.5 Effect of nutrient solution addition on hydrogen production capacity of domesticated flora
2.4 驯化菌群发酵纤维素产氢气工艺优化响应面试验
2.4.1 响应面试验结果及方差分析
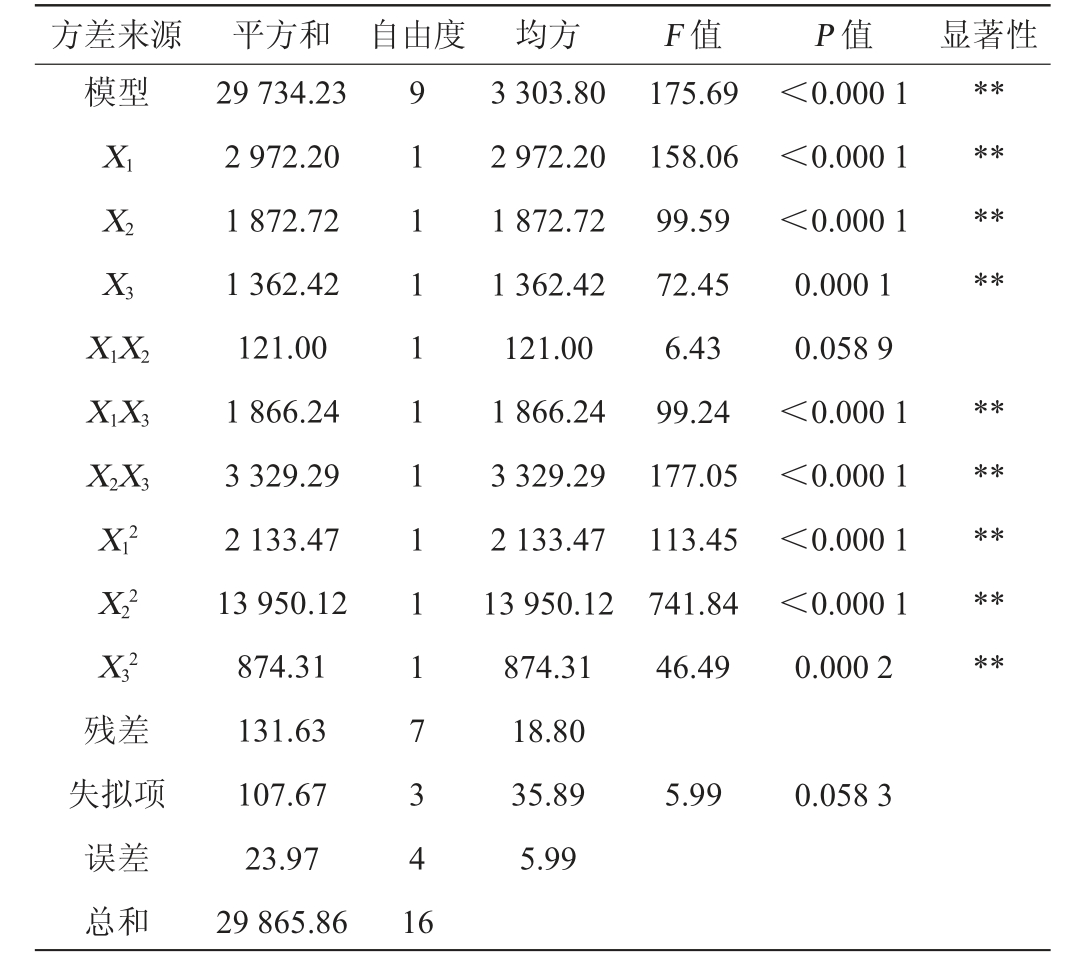
在单因素试验的基础上,选取对氢气产量影响较大的3个因素碳酸氢铵质量浓度(X1)、磷酸二氢钾质量浓度(X2)和营养液添加量(X3)为考察因素,以氢气产量(Y)为响应值,采用Design-Expert 12.0软件设计3因素3水平的响应面优化试验,试验设计及结果见表3,方差分析见表4。
表3 驯化菌群发酵微晶纤维素产氢工艺优化响应面试验设计及结果
Table 3 Design and results of response surface tests for process optimization of hydrogen production from microcrystalline cellulose by domesticated flora fermentation
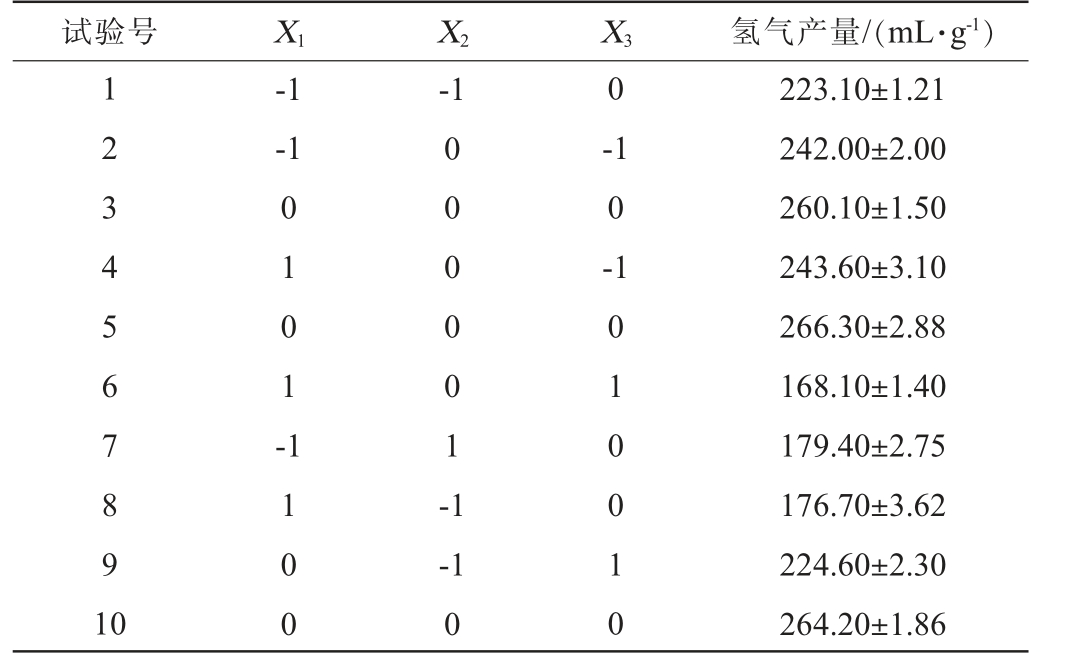
试验号 X1 X2 1 2 3 4 5 6 7 8 9 1 0-1-1-1 X3 氢气产量/(mL·g-1)0 0 1 0 1 --1 0 -1 1 0 0 0 0 0 0 0 1 -1-1 0 1 0 1 0 0 1 0 223.10±1.21 242.00±2.00 260.10±1.50 243.60±3.10 266.30±2.88 168.10±1.40 179.40±2.75 176.70±3.62 224.60±2.30 264.20±1.86
续表
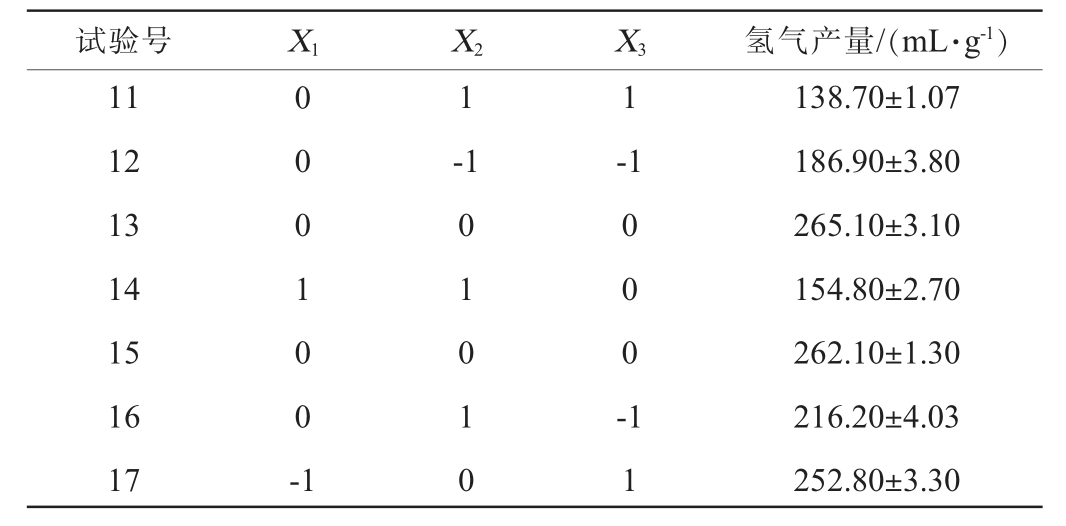
试验号 X1 X2 11 12 13 14 15 16 17 0 0 0 1 0 0 -1 1-1 X3 氢气产量/(mL·g-1)1-1 0 1 0 1 0 0 0 0 -1 1 138.70±1.07 186.90±3.80 265.10±3.10 154.80±2.70 262.10±1.30 216.20±4.03 252.80±3.30
表4 回归模型方差分析
Table 4 Variance analysis of regression model
注:“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型X1 X2 X3 X1X2 X1X3 X2X3 X12 X22 X32残差失拟项误差总和29 734.23 2 972.20 1 872.72 1 362.42 121.00 1 866.24 3 329.29 2 133.47 13 950.12 874.31 131.63 107.67 23.97 29 865.86 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 3 303.80 2 972.20 1 872.72 1 362.42 121.00 1 866.24 3 329.29 2 133.47 13 950.12 874.31 18.80 35.89 5.99 175.69 158.06 99.59 72.45 6.43 99.24 177.05 113.45 741.84 46.49<0.000 1<0.000 1<0.000 1 0.000 1 0.058 9<0.000 1<0.000 1<0.000 1<0.000 1 0.000 2******************5.99 0.058 3
采用Design-Expert 12.0软件对表3数据进行多元二次回归拟合分析,得到回归方程:Y=263.62-19.27X1-15.30X2-13.05X3+5.50X1X2-21.60X1X3-28.85X2X3-22.51X12-57.56X22-14.41X32。 由表4可知,模型P<0.000 1,极显著,失拟项P=0.058 3>0.05,不显著,说明模型可靠。决定系数R2=0.995 6,调整决定系数R2Adj=0.995 0,表明用于预测氢气产量的回归模型能够较好的反应响应值和各变量之间的关系。由P值可知,除交互项X1X2对氢气产量无显著影响外(P>0.05),其他项对氢气产量均有极显著影响(P<0.01)。 由F值可知,各因素对氢气产量影响的主次顺序为X1>X2>X3。
2.4.2 交互作用分析
响应面和等高线反映了各因素对响应值的影响程度以及交互作用的强弱,各因素间交互作用对氢气产量影响的响应面及等高线图见图6。 由图6可知,碳酸氢铵质量浓度与营养液添加量、磷酸二氢钾质量浓度与营养液添加量的响应面呈凸面,等高线呈椭圆形,说明交互作用较大,这与方差分析结果一致。

图6 各因素间交互作用对氢气产量影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between various factors on hydrogen production
2.4.3 工艺条件优化与验证
采用Design-Expert 12.0软件对多元二次回归方程进行最优求解,得到驯化菌群发酵纤维素产氢的最佳工艺条件为碳酸氢铵质量浓度2.50 g/L、磷酸二氢钾质量浓度1.82 g/L、营养液添加量8.21 mL/L。为便于实际操作,将最佳工艺条件修正为:碳酸氢铵质量浓度2.50 g/L、磷酸二氢钾质量浓度1.80 g/L、营养液添加量8.20 mL/L。在此条件下,预测得到的最大氢气产量为269.17 mL/g。在最佳工艺条件下进行3次重复验证试验,得到氢气产量实际值为(267.50±0.50)mL/g,与预测值接近,说明回归方程能够准确预测响应值的变化。
3 结论
本试验以微晶纤维素为限制性底物,牛粪堆肥为天然菌源,通过30轮富集驯化培养,获得了可以高效降解纤维素产氢的嗜温产氢菌群。 通过高通量测序发现,驯化前后菌群结构和数量发生明显变化,主要细菌门为厚壁菌门(Firmicutes),变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes),主要细菌属为梭菌属(Clostridium)、厌氧细杆菌属(Anaerofilum)和假单胞菌属(Pseudomonas),发酵体系内形成了纤维素降解菌、发酵产氢菌和纤维素降解产氢菌之间的生长协同作用,有效提高了纤维素降解和氢气的产生。在单因素试验的基础上,通过响应面试验优化得到驯化菌群发酵微晶纤维素产氢的最佳发酵工艺条件为碳酸氢铵质量浓度为2.5 g/L、磷酸二氢钾质量浓度为1.8 g/L、营养液添加量为8.2 mL/L,在此条件下最大氢气产量可达(267.50±0.50)mL/g。
[1]GARCÍA A R F,GUEZ J S,FONTANILLE P,et al.Enhanced dark fermentative hydrogen production by initial reduction of oxidation-reduction potential[J].Int J Hydrogen Energ,2024,87:1338-1346.
[2]王海涛,余良浪,江吉周,等.硫取代氮增强G-C3N4光催化产氢性能[J].物理化学学报,2024,40(5):44-47.
[3]HASSAN N S,JALIL A A,VO D V N,et al.An overview on the efficiency of biohydrogen production from cellulose[J].Biomass Conv Bioref,2023,13(10):8485-8507.
[4]LONG J Q, WANG X L, QIU S Y, et al.Construction of cellulose-degrading microbial consortium and evaluation of their ability to degrade spent mushroom substrate[J].Front Microbiol,2024,15:1356903.
[5]SARIPAN K, MAMIMIN C, IMAI T, et al.Q-PCR methodology for monitoring the thermophilic hydrogen producers enriched from elephant dung[J].Fermentation,2022,8(10):506.
[6]ZHAO Z T, DING J, WANG B Y, et al.Advances in the biomass valorization in dark fermentation systems:A sustainable approach for biohydrogen production[J].Chem Eng J,2024,481:148444.
[7]彭菲.细菌混合培养生物膜发酵产氢特性的研究[D].北京:北京化工大学,2019.
[8]ZHANG J N,LI Y H,ZHENG H Q,et al.Direct degradation of cellulosic biomass tobio-hydrogen from a newly isolated strain Clostridium sartagoforme FZ11[J].Bioresour Technol,2015,192,60-67.
[9]SONG Z X,LI X H,LI W W,et al.Direct bioconversion of raw corn stalk to hydrogen by a new strain Clostridium sp.FS3[J].Bioresource Technol,2014,157:91-97.
[10]ZHANG J,JIANG B,ZHANG H,et al.Fermentative hydrogen production from lignocellulose by mesophilic Clostridium populeti FZ10 newly isolated from microcrystalline cellulose-acclimated compost[J].Appl Sci,2022,12(19):9562.
[11]陈亚蓝,陈顺心,邢淑婕,等.信阳商城筒鲜鱼中乳酸菌的分离及鉴定[J].中国酿造,2025,44(4):159-164.
[12]CAI J,WANG Y,LIU J,et al.Pretreatment enhanced structural disruption,enzymatic hydrolysis,fermentative hydrogen production from rice straw[J].Int J Hydrogen Energ,2022,47(23):11778-11786.
[13]FAN Y T,ZHANG Y H.Efficient conversion of wheat straw wastes into biohydrogen gas by cow dung compost[J].Bioresource Technol,2006,97:500-505.
[14]王逸凡.里氏木霉纤维素酶高产突变株CU7-4的产酶机制解析及酶系优化菌株构建[D].济南:山东大学,2023.
[15]SARUNYOU W, THANAPORN L, WUTTICHAI M, et al.Comparative metagenomic analysis of microcosm structures and lignocellulolytic enzyme systems of symbiotic biomass-degrading consortia[J].Appl Microbiol Biotechnol,2013,97(20):8941-8954.
[16]EBRAHIMIAN F,DENAYER J F M,KARIMI K.Efficient coproduction of butanol,ethanol,and biohydrogen from municipal solid waste through a cocultivated biorefinery[J].Energy Convers Manag,2022,255:115303.
[17]卜杰.嗜热厌氧纤维素降解产氢菌的选育以及生物炭强化厌氧发酵性能的机理研究[D].广州:华南理工大学,2022.
[18]尹梦,孙茹茹,秦智.丁酸梭菌YM-83产氢影响因素的研究[J].环境科学与技术,2020,43(S1):17-22.
[19]迟雪.水稻秸秆丁酸—丁醇分步发酵系统的构建与效能[D].哈尔滨:哈尔滨工业大学,2018.
[20]YU X F,BORJIGIN Q,GAO J L,et al.Exploration of the key microbes and composition stability of microbial consortium GF-20 with efficiently decomposes corn stover at low temperatures[J].J Integr Agr,2019,18(8):1893-1904.
[21]AMACHANDRAN U R, RANA N W, CICEK N, et al.Hydrogen production and end-product synthesis patterns by Clostridium termitidis strain CT1112 in batch fermentation cultures with cellobiose or a-cellulose[J].Int J Hydrogen Energ,2008,33:7006-7012.
[22]班巧英,张思雨,王洋,等.接种污泥和pH值对CMC-Na厌氧降解的影响及菌群解析[J].中国环境科学,2023,43(9):4658-4665.
[23]ROSARIO D M A,PETER S,MATTHIAS K,et al.Monitoring growth and removal of Pseudomonas biofilms on cellulose-based fabrics[J].Microorganisms,2023,11(4):892.
[24]ALI S S, JIAO H X, EL-SAPAGH S, et al.Biodegradation of willow sawdust by novel cellulase-producing bacterial consortium from woodfeeding termites for enhancing methane production[J].Bioresource Technol, 2023,383:129232.
[25]CHENG C L, CHANG J S.Hydrolysis of lignocellulosic feedstock by novel cellulases originating from Pseudomonas sp.CL3 for fermentative hydrogen production[J].Bioresource Technol,2011,102:8628-8634.
[26]GOME-FLORES M,NAKHLA G,HAFEZ H.Hydrogen production and microbial kinetics of Clostridium termitidis in mono-culture and co-culture with Clostridium beijerinckii on cellulose[J].AMB Express,2017,7(1):84.
[27]FARH M E A, ABDELLAOUI N, SEO J A.pH changes have a profound effect on gene expression,hydrolytic enzyme production,and dimorphism in Saccharomycopsis fibuligera[J].Front Microbiol, 2021,12:672661.
[28]CHITTIBABU G,NATH K,DAS D.Feasibility studies on the fermentative hydrogen production by recombinant Escherichia coli BL21[J].Process Biochem,2006,41(3):682-688.
[29]叶林超,叶均安,徐国忠,等.碳酸氢铵等不同氮源对小球藻生长的影响[J].水产科学,2007(6):319-322.
[30]GWEN F,AN V,FEIJE B D,et al.In vitro kinetics of prebiotic inulin-type fructan fermentation by butyrate-producing colon bacteria:implementation of online gas chromatography for quantitative analysis of carbon dioxide and hydrogen gas production[J].Appl Environ Microbiol,2009,75(18):5884-5892.
[31]KANG J H, KIM D, LEE T J.Hydrogen production and microbial diversity in sewage sludge fermentation preceded by heat and alkaline treatment[J].Bioresource Technol,2012,109:239-243.
[32]PAN C M,FAN Y T,XING Y,et al.Statistical optimization of process parameters on biohydrogen production from glucose by Clostridium sp.Fanp2[J].Bioresource Technol,2008,99:3146-3154.