葡萄酒生产中,酿酒酵母(Saccharomyces cerevisiae)由于酒精代谢能力强,短时间内能完成发酵,成为葡萄酒生产的主要菌种。但由于发酵菌种单一,使得葡萄酒品质趋同。 近年来研究表明,非酿酒酵母(non-Saccharomycescerevisiae)能够分泌蛋白酶、果胶酶、葡萄糖苷酶、脂肪水解酶、纤维素酶等胞外酶,作用于葡萄汁中的相关底物,生成醇类、酯类、酸类、萜烯类等物质[1],会对葡萄酒的色泽、酒精度、酸度以及香气等方面产生积极影响。刘晓燕等[2]研究表明,耐热克鲁维酵母(Kluyveromyces thermotolerans)与酿酒酵母混合发酵使酒样的总花色苷含量增加了22.90%。宿萌等[3]研究发现,戴尔有孢圆酵母(Torulaspora debrueckii)单独及混合发酵均可降低葡萄酒中滴定酸的含量。 祝霞等[4]利用戴尔凯氏有孢圆酵母与酿酒酵母混菌发酵贵人香低醇甜葡萄酒,结果表明酒中酯类、高级醇以及萜烯类香气物质含量有所提高,赋予了酒样强烈的花香、果香。申静云等[5]研究表明,不同有孢汉逊酵母与酿酒酵母混合发酵威代尔冰葡萄酒,可使酯类和萜烯类物质总量分别增加88.61%和21.40%。ERASMUS B等[6]研究发现,克鲁维酵母发酵葡萄酒相比于酿酒酵母能产生更多的如苯乙醇、乙酸异戊酯和乙酸乙酯等芳香化合物。还有研究证实,非酿酒酵母所产糖苷酶在酿酒环境中表现出较强的适应性,有利于葡萄酒的增香酿造。如LÓPEZ S等[7]将汉逊酵母应用于Muscat葡萄酒的增香酿造,并验证了所产糖苷酶活力及其水解特性。 因此,将非酿酒酵母应用于葡萄酒酿造成为酿酒行业新的发展趋势。
葡萄汁有孢汉逊酵母在果酒酿造中的研究表明其具有果酒增香作用。陶永胜等[8]研究表明,葡萄汁有孢汉逊酵母糖苷酶能更多的水解葡萄中去甲类异戊二烯和一些萜烯类的糖苷,使葡萄酒表现出温带水果、小浆果和花香特征。 剧柠等[9]利用葡萄汁有孢汉逊酵母与商用酿酒酵母发酵的枸杞果酒有更多种类的香气成分。冯文倩等[10]研究表明,葡萄汁有孢汉逊酵母对酿酒酵母不具有嗜杀活性。 这些研究表明葡萄汁有孢汉逊酵母具有在葡萄酒酿造中应用的潜力。 本研究对葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)代谢相关酶活性进行评价,并利用其与商业酿酒酵母混合进行‘赤霞珠’干红葡萄酒发酵,分析不同接种方案对酒样的理化指标、香气成分及感官品质的影响,评价H.uvarum的发酵特性,确定混菌发酵接种方案,以期为生产风格突出的葡萄酒提供理论依据。
1 材料与方法
1.1 材料与试剂
‘赤霞珠’葡萄原料:2022年9月29日取自内蒙古土默特右旗,还原糖含量232 g/L,总酸含量(以酒石酸计)4.5 g/L。
酿酒酵母(S.cerevisiae)ES488:意大利爱赛科有限公司;葡萄汁有孢汉逊酵母(H.uvarum):由内蒙古特色果酒系列产品产学研科技创新平台实验室分离筛选,进行26S rRNA D1/D2区域序列鉴定。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、WL培养基:青岛海博生物技术有限公司;4-硝基苯基-β-D-吡喃葡萄糖苷(4-nitrophenyl-β-D-glucopyranoside,pNPG)、对硝基苯基-α-L-阿拉伯呋喃糖苷、对硝基苯基-α-L-吡喃鼠李糖苷、对硝基苯基-β-D-吡喃木糖苷:北京索莱宝生物科技有限公司;果胶、半乳糖醛酸、3-5-二硝基水杨酸(均为分析纯):福晨(天津)化学试剂有限公司;甲醇、2-辛醇、乙酸乙酯、异丁醇、苯甲醇等香气物质标准品(均为色谱纯):美国Sigma公司。
1.2 仪器与设备
SynergyHTMF-Take3全功能酶标仪:美国伯藤仪器有限公司;HC-2518R冷冻离心机:上海玉博生物科技有限公司;YU1901紫外分光光度计:北京普析仪器厂;STARTER3100精密pH计:奥豪斯仪器有限公司;DVB/CAR/PDMS固相微萃取(solid-phase microextraction,SPME)手动进样手柄,二乙烯基苯/聚二甲基硅氧烷萃取头(PDMS/DVB,65 μm):美国Sigma-Aldric Supelco公司;GCMS-QP2020 NX气相色谱质谱联用(gaschromatography-massspectrometry,GC-MS)仪:日本岛津公司。
1.3 方法
1.3.1 酵母培养与计数
将保藏在-80 ℃冰箱的H.uvarum,划线至YPD固体培养基上28 ℃培养48 h。 挑取菌落特征明显的菌株至YPD液体培养基中,28 ℃、180 r/min摇床培养18 h进行活化。S.cerevisiae(ES488)按照产品说明进行活化。 取活化后的酵母液用无菌生理盐水配制成菌体浓度为106 CFU/mL菌悬液作为发酵种子液备用。 发酵过程中每24 h取酒样,用WL鉴别培养基根据S.cerevisiae和H.uvarum菌落形态进行分类计数。
1.3.2 糖苷酶活力的测定
糖苷酶活力测定参考李艳等[11]方法。糖苷酶活力值根据标准曲线(y=0.006 6x+0.108 2,R2=0.992 8)计算得出。
1.3.3 果胶酶活力的测定
参考谷艺明[12]的方法。 酶活力值根据标准曲线(y=0.414 1x+0.090 3,R2=0.997 1)计算得出。
1.3.4 酯化酶活力的测定
酯化酶活力测定参考李婷等[13]方法。酶活力值根据标准曲线(y=0.015 2x+0.06,R2=0.993 1)计数得出。
1.3.5 葡萄酒发酵试验
将‘赤霞珠’葡萄果梗去除,挤压破碎,分装于10 L玻璃发酵罐,加入偏重亚硫酸钾和维果灵放置24 h抑制杂菌。之后按照前期实验筛选出的接种发酵方案(见表1),将种子液以6%的接种量接入发酵罐中,发酵温度维持在25 ℃左右进行酒精发酵。待残糖量下降至4 g/L以下或连续72 h不变化,发酵结束。 发酵结束后进行皮渣分离,转入后发酵罐中,葡萄酒分离后进入后熟阶段,满罐于15 ℃左右静置2~3个月后进行灌装。葡萄酒发酵过程中,每24 h取样测定发酵过程中酵母活菌数,测定最终酒样的理化指标、香气成分,评价感官特性。每个处理设置3组平行。
表1 干红葡萄酒发酵试验设计方案
Table 1 Design scheme for fermentation experiment of dry red wine

编号接种顺序 方案单菌发酵CK同时接种DJ-G TS-1-1 SX-N-G顺序接种酿酒酵母单菌发酵葡萄汁有孢汉逊酵母单菌发酵酿酒酵母∶葡萄汁有孢汉逊酵母=1∶1先接入酿酒酵母,3 d后接入葡萄汁有孢汉逊酵母,比例为1∶1先接入葡萄汁有孢汉逊酵母,3 d后接入酿酒酵母,比例为1∶1 SX-G-N
表2 ‘赤霞珠’干红葡萄酒的感官评分标准
Table 2 Sensory evaluation standards of 'Cabernet Sauvignon'dry red wine
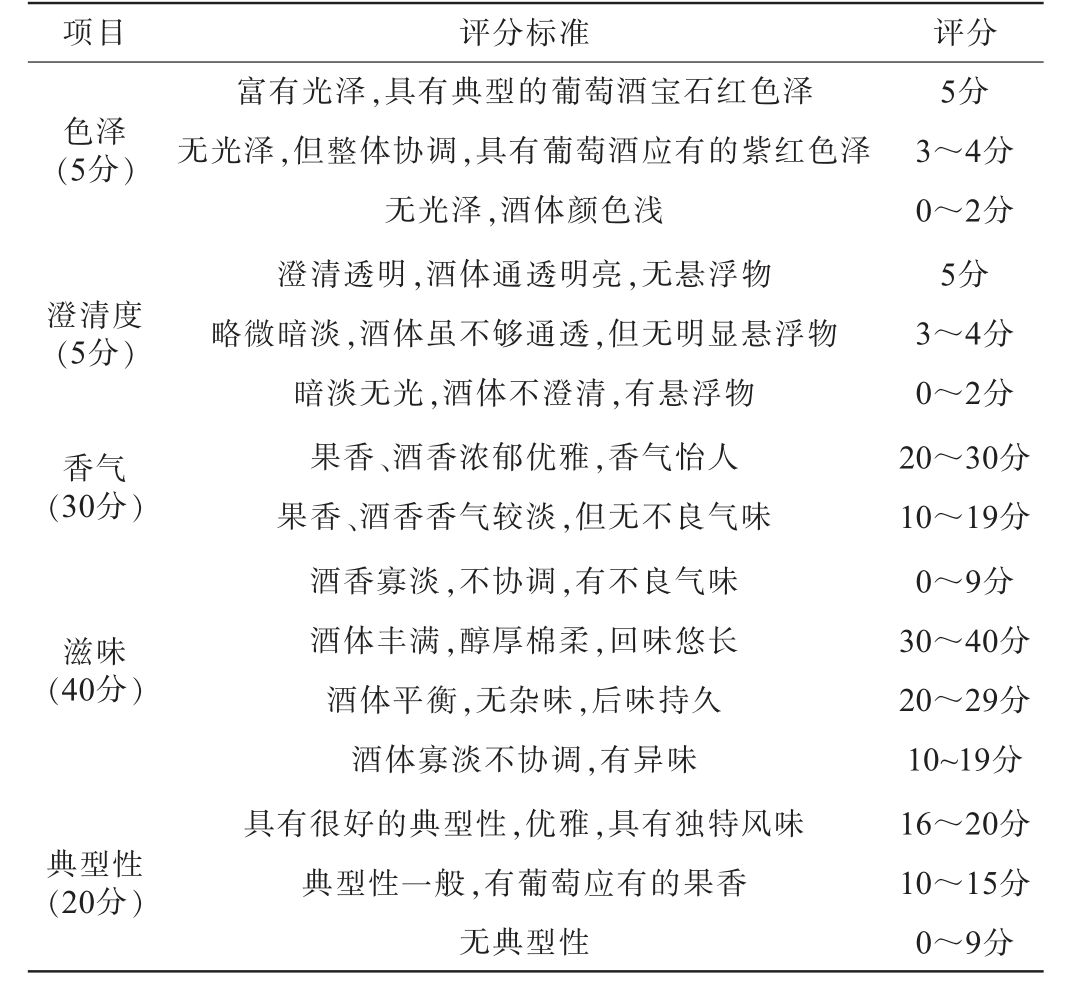
项目 评分标准 评分5分色泽(5分)澄清度(5分)香气(30分)滋味(40分)典型性(20分)富有光泽,具有典型的葡萄酒宝石红色泽无光泽,但整体协调,具有葡萄酒应有的紫红色泽无光泽,酒体颜色浅澄清透明,酒体通透明亮,无悬浮物略微暗淡,酒体虽不够通透,但无明显悬浮物暗淡无光,酒体不澄清,有悬浮物果香、酒香浓郁优雅,香气怡人果香、酒香香气较淡,但无不良气味酒香寡淡,不协调,有不良气味酒体丰满,醇厚棉柔,回味悠长酒体平衡,无杂味,后味持久酒体寡淡不协调,有异味具有很好的典型性,优雅,具有独特风味典型性一般,有葡萄应有的果香无典型性3~4分0~2分5分3~4分0~2分20~30分10~19分0~9分30~40分20~29分10~19分16~20分10~15分0~9分
1.3.6 葡萄酒理化指标测定
参考GB/T15038—2006《葡萄酒、果酒通用分析方法》[14],测定还原糖、总酸、挥发酸、酒精度等理化指标。花色苷含量参考陈亮等[15]的方法采用pH示差法测定。
1.3.7 挥发性风味成分测定
HS-SPME条件:取3 mL酒样,加入0.6 g的NaCl,5 μL 4-辛醇(50.0 mg/L,内标)于装有磁力搅拌转子的15 mL顶空瓶中。于45℃恒温条件下平衡15min,将已活化好的65μm PDMS/DVB固相微萃取纤维头插入顶空瓶内,于45 ℃恒温条件下萃取45min,取出萃取头插入GC-MS进样口解吸5min取出。
GC条件:选用SH-Rxi-5Sil MS色谱柱(30 m×0.25 mm×0.25 μm);载气为高纯氦气(He)(99.999%);检测器及进样口温度分别为230 ℃和250 ℃;升温程序:40 ℃保持3 min,以2 ℃/min升至140 ℃,然后以7.5 ℃/min升至270 ℃,保持6 min;色谱柱流量为1.78 mL/min,不分流进样。
MS条件:电子电离(electronic ionization,EI)源;电离能量70 eV;离子源温度230 ℃;传输线温度270 ℃;全扫描模式,质量扫描范围为30~450 m/z。
定量分析:提取挥发性成分质谱图,并根据标准品的保留时间,通过查询美国国家标准与技术研究院(national institute of standards and technology,NIST)17谱库,用保留指数法计算各挥发性成分的保留指数从而进行定性分析;采用内标法进行定量。
1.3.8 葡萄酒感官评价
邀请7名品酒专员,参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》制定评分标准,根据评分标准在制定分数内逐项打分,满分100分,取7人平均分。
2 结果与分析
2.1 葡萄汁有孢汉逊酵母产酶活性分析
2.1.1 糖苷酶酶活力
葡萄果实中无香味的糖苷类物质是寡糖与萜烯醇(包括香茅醇、芳樟醇、橙花醇、松油醇及香叶草醇等)以糖苷键的形式相结合形成的化合物,在经过糖苷酶解后释放出游离态的香气成分[16]。S.cerevisiae和H.uvarum的5种糖苷酶的活性测定结果见图1。由图1可知,两株酵母菌的5种糖苷酶之间的酶活力均存在显著差异(P<0.05),其中H.uvarum的β-D-葡萄糖苷酶的活性最高,为27.26 mU/mL,较S.cerevisiae高出36.3%;其次是β-D-木糖苷酶,为25.41 mU/mL,较S.cerevisiae高11.25%。 LOPEZ M C等[17]研究表明,较高的β-D-葡萄糖苷酶和β-D-木糖苷酶活力,在发酵过程中能提高葡萄酒中萜烯类物质的种类与含量。S.cerevisiae的α-L-鼠李糖苷酶、α-L-阿拉伯糖苷酶、β-D-半乳糖糖苷的活性较高,其中α-L-鼠李糖苷酶活性最高,为28.50 mU/mL,较H.uvarum高10.63%。
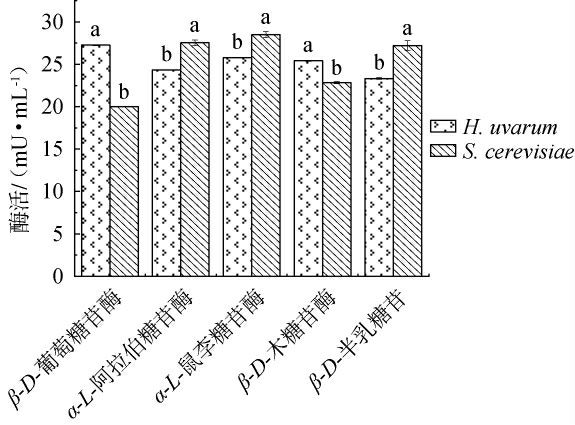
图1 两株酵母菌的5种糖苷酶酶活比较
Fig.1 Comparison of 5 glycosidases activities of 2 yeast strains
不同小写字母表示差异显著(P<0.05)。
2.1.2 果胶酶和酯化酶酶活力
在葡萄酒酿造过程中通常会加入外源的果胶酶来提高出汁率、增加酒体澄清度以及提高果皮中香气和色素物质溶出率。 此外,张宝香等[18]研究表明,经果胶酶处理可提高酒样中构成香气的主要酯类和醇类物质。在葡萄酒酿造过程中,酯酶可以催化酸类和醇类物质生产酯类物质,也能通过水解酯类物质,改变酯类物质含量,调节酯类平衡。H.uvarum和S.cerevisiae的果胶酶和酯化酶活性测定结果见表3。
表3 两株酵母菌的果胶酶及酯化酶酶活比较
Table 3 Comparison of pectinase and esterase activities of 2 yeast strains

注:同列字母不同表示处理间差异显著(P<0.05)。
酵母菌 果胶酶酶活/(U·mL-1) 酯化酶酶活/(U·mL-1)H.uvarum S.cerevisiae 2 396.09±87.47a 1 677.93±42.77b 14.07±0.25a 12.87±0.11b
由表3可知,两株酵母菌的果胶酶和酯酶活性均有显著差异(P<0.05)。H.uvarum的果胶酶酶活为2 396.09 U/mL,较S.cerevisiae高42.8%;酯化酶酶活为14.07 U/mL,较S.cere visiae高9.32%。
2.2 葡萄酒发酵过程中酵母菌生长动态变化
葡萄酒发酵过程中各处理组酵母活菌数的变化见图2。
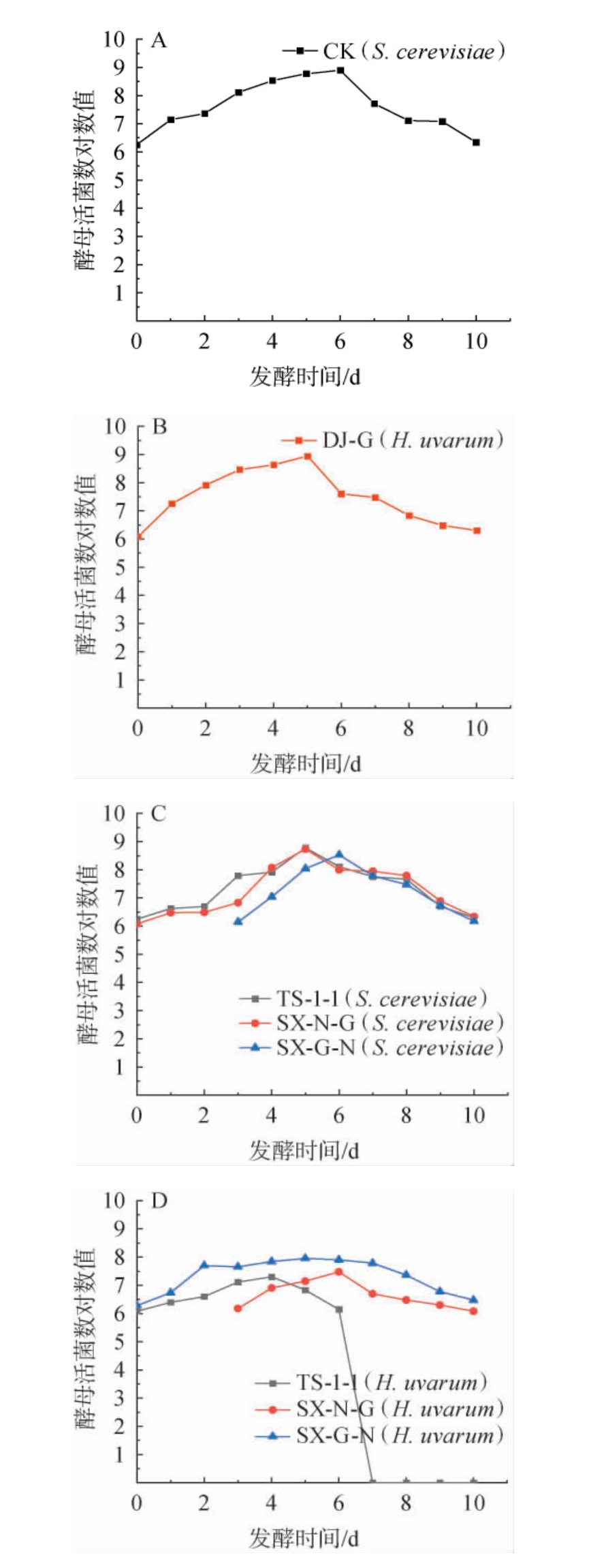
图2 葡萄酒发酵过程中酵母活菌数的动态变化
Fig.2 Dynamic changes of viable yeast counts during wine fermentation process
由图2A可知,S.cerevisiae在第6天活菌数达到最大,为7.8×108 CFU/mL,且整个发酵过程中生物量始终维持在107~108CFU/mL。由图2B可知,H.uvarum在第5天活菌数达到最大,为8.9×108 CFU/mL,发酵结束时为2.1×106 CFU/mL。由图2C可知,TS-1-1处理组S.cerevisiae在第5天活菌数达到最大,为5.5×108 CFU/mL;SX-N-G处理组S.cerevisiae在第6天活菌数达到最大,为5.4×108 CFU/mL;SX-G-N处理组S.cerevisiae在接种后第4天活菌数达到最大,为3.4×108 CFU/mL;所有处理组中S.cerevisiae的活菌数均保持在106 CFU/mL以上。由图2D可知,TS-1-1处理组H.uvarum在发酵1~4d时活菌数呈增加趋势,发酵4~6 d时呈下降趋势并在6 d后快速下降至0;SX-N-G处理组H.uvarum在接种后第4天活菌数达到最大,为3.0×107 CFU/mL;SX-G-N处理组H.uvarum活菌数在第5天达到最大,为3.4×108 CFU/mL,发酵结束时为2.0×106 CFU/mL;混合发酵中基质中的营养竞争、代谢产物以及细胞接触等都是两种酵母生长相互影响的因素[19-20]。
2.3 葡萄酒基本理化指标
由表4可知,不同处理葡萄酒样的还原糖含量为2.49~3.95 g/L,均符合GB 15037—2006《葡萄酒》中干红葡萄酒还原糖<4 g/L的要求。 不同处理葡萄酒样的酒精度为12.93%vol~13.73%vol,其中CK组葡萄酒酒精度最高,为13.73%vol;TS-1-1处理组葡萄酒样在混菌发酵组中的酒精度最高(13.57%vol),与对照组CK组葡萄酒酒样差异不显著(P>0.05),其他处理组葡萄酒样显著低于CK(P<0.05);混菌处理组葡萄酒样中酒精含量与酿造过程中的酿酒酵母活菌数成正相关,此结论与酵母菌生长情况结果一致。非酿酒酵母氧化代谢消耗葡萄糖,其中一部分会转换为甘油等其他化合物,而使乙醇代谢减少,H.uvarum约消耗糖19 g/L产生1%vol的乙醇[21]。5个处理组酒样中CK组葡萄酒样总酸含量最低,为4.36 g/L,与DJ-G和SX-G-N存在显著差异(P<0.05)。结合生物量变化分析说明,H.uvarum参与发酵能使葡萄酒中总酸含量增加。各处理组葡萄酒样花色苷含量存在显著差异(P<0.05),其中SX-G-N组葡萄酒样中花色苷含量最高(207.01 mg/L),其次是TS-1-1组葡萄酒酒样(166.98 mg/L),CK组葡萄酒酒样最低。结合果胶酶活力分析,可能是由于H.uvarum较高的果胶酶活力提高了酒样中花色苷的含量。
表4 不同处理葡萄酒样基本理化指标测定结果
Table 4 Determination results of basic physicochemical indicators of
wine with different treatments
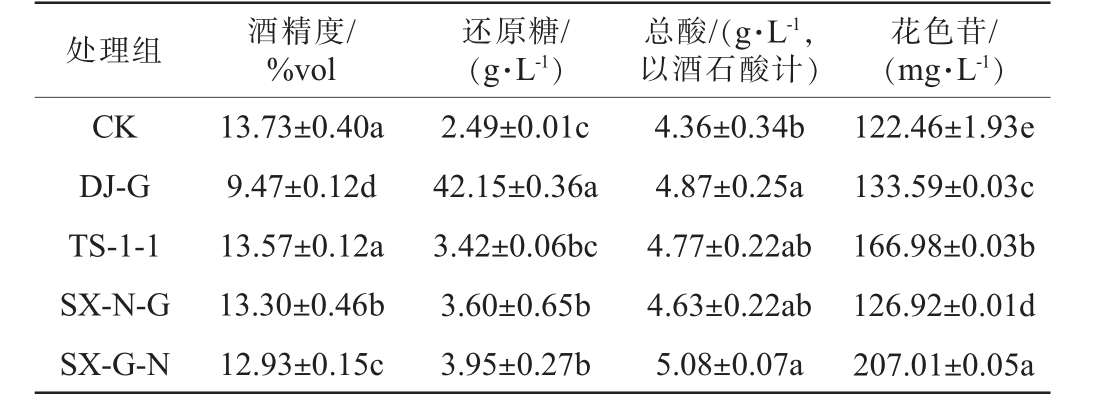
注:同列不同字母表示处理间差异显著(P<0.05)。
处理组 酒精度/%vol还原糖/(g·L-1)总酸/(g·L-1,以酒石酸计)花色苷/(mg·L-1)CK DJ-G TS-1-1 SX-N-G SX-G-N 13.73±0.40a 9.47±0.12d 13.57±0.12a 13.30±0.46b 12.93±0.15c 2.49±0.01c 42.15±0.36a 3.42±0.06bc 3.60±0.65b 3.95±0.27b 4.36±0.34b 4.87±0.25a 4.77±0.22ab 4.63±0.22ab 5.08±0.07a 122.46±1.93e 133.59±0.03c 166.98±0.03b 126.92±0.01d 207.01±0.05a
2.4 葡萄酒挥发性风味成分分析
由表5可知,不同处理葡萄酒样中共检测到挥发性香气化合物94种,其中醇类17种、酯类59种、脂肪酸类2种、萜烯类10种、其他类6种;混菌发酵处理组中的香气物质种类均高于对照组CK(61种),其中SX-G-N酒样香气种类最丰富(94种)。 SX-G-N酒样香气物质总含量最高(3 105.41 μg/L),相较于CK酒样增加了15.56%,两组存在显著差异(P<0.05)。
表5 不同处理葡萄酒样挥发性香气化合物含量检测结果及香气描述
Table 5 Detection results and aroma descriptions of volatile aroma compounds in wine samples with different treatments

含量/(μg·L-1)CK DJ-G TS-1-1 SX-G-N SX-N-G种类 化合物 阈值/(μg·L-1) 香气描述8 000 200 200 000 14 000 40 600 120 000醇类\\ \ \花香、水果香、青草香柠檬、橘子烘烤香、甜味蜂蜜、玫瑰、丁香花茉莉、柠檬味生青味、玫瑰、橙子橡胶、奶油、水果香\甜香、花香正己醇庚醇苯甲醇苯乙醇1-辛醇1-壬醇2,3-丁二醇1,5-戊二醇2-乙基己醇5-甲基-2-己醇5-甲基壬醇3-甲基-1-丁醇(异戊醇)(2R,3R)-(-)-2,3-丁二醇2-乙基-1-丁醇3-乙基-4-甲基-1-戊醇反式-2-癸烯醇3-壬烯-1-醇,(Z)共计乙酸异戊酯乙酸己酯乙酸苯乙酯丁酸乙酯3-羟基丁酸乙酯2-甲基丁基己酸酯己酸乙酯dl-2-羟基己酸乙酯3-羟基己酸乙酯庚酸乙酯辛酸乙酯辛酸丙酯壬酸乙酯癸酸乙酯丁二酸二乙酯反式-4-癸烯酸乙酯己-5-烯酸乙酯DL-白氨酸乙酯131.28±19.52ab 29.78±1.06a 0±0c 131.11±25.5b 24.08±1.61c 4.73±0.03b 1.78±0.03c 0±0c 4.24±0.55b 0±0d 1.66±0.12a 23.36±3.16a 20.56±0.06a 0±0d 2.55±0.06ab 0±0b 0±0b 375.13±51.7b 77.96±6.52b 3.60±0.05a 4.99±0.6b 19.42±6.4b 0±0b 0.98±0.05a 527.29±60.85bc 0±0c 1.17±0.37b 11.28±0.02b 1 112.03±70.99b 0.68±0.08a 2.91±0.14a 263.14±3.86ab 33.49±3.33a 0±0c 2.05±0.17ab 0.70±0.19c 84.74±15.32c 31.08±0.02a 0±0c 204.79±39.47a 21.44±1.13c 5.28±0.2ab 0.57±0.5c 2.18±0.02b 8.33±0.15a 1.21±0.09b 1.34±0.02a 1.28±0.2b 0±0c 4.84±0.06b 2.48±0.62a 2.07±0.36a 0±0b 371.63±58.16b 139.36±32.72a 5.70±0.7a 17.58±4.85a 30.45±4.08ab 0.81±0.01b 0±0b 611.99±2.89ab 0±0c 2.37±0.08a 10.78±0.03b 851.02±60.27c 1.40±0.17b 1.89±0.48ab 227.63±24.58bc 0±0c 1.14±0.05b 1.62±0.02b 2.11±1b 137.81±21.24a 42.38±6.19a 1.69±0.01a 167.45±35.34ab 23.42±0.2c 5.88±0.68a 17.18±0.02a 0±0c 4.40±0.64b 1.60±0.01a 1.51±0.27a 1.98±0.06b 0±0c 2.20±0c 1.95±0.37b 0±0b 0±0b 409.45±65.03a 110.41±11.72ab 7.17±1.01a 11.38±2.48ab 37.52±10.98a 0.71±0.08b 1.09±0.09a 581.60±56.3abc 0±0c 0.70±0b 14.49±3.1a 1 055.79±0.51b 1.54±0.42a 2.25±0.04ab 267.68±19.8a 33.78±2.65a 0±0c 2.61±0.7a 1.99±0.7b 101.47±12.1bc 26.27±21.41a 1.02±0.22b 156.91±38.16ab 27.92±0.47b 3.01±0.35c 13.94±4.84a 18.19±0.01a 7.66±0.36a 1.19±0.03b 1.53±0.26a 1.99±0.92b 4.11±1.15b 15.49±0.02a 2.64±0.92a 1.81±0.02a 0.63±0.17a 385.78±81.41a 93.59±24.97ab 5.15±2.25a 8.93±1.79ab 34.53±2.47a 0.88±0.67b 1.00±0.01a 658.98±64.34a 2.23±0.43a 2.03±0.79a 12.53±0.84ab 1 296.14±33.58a 1.54±0.27a 1.89±0.96ab 218.87±20.75c 31.28±9.55a 1.53±0.13a 2.29±0.49ab 4.27±0.13a 115.42±9.55abc 1.61±0.01b 1.20±0.4b 163.55±28.21ab 37.88±2.51a 3.05±0.86c 9.10±0.01b 0±0c 7.98±0.19a 0.91±0.01c 1.28±0.14a 3.07±1.15b 0±0c 15.48±0.02a 2.59±0.77a 0±0b 0.78±0.29a 363.90±44.12b 121.21±28.08ab 7.21±3.11a 5.77±1.92b 32.49±2.08a 0.60±0.02ab 0.99±0.08a 494.89±14.23c 1.79±0.01b 2.52±0.02a 11.46±0.84ab 858.88±38.11c 1.83±0.24a 1.79±0.01b 221.56±14.62c 21.50±1.57b 1.42±0.02a 1.80±0.01b 4.37±0.03a\\30 000酒精味、苦味、指甲油\\ \ \ \ 3 0\\ \ \ \1 500 250 20果香、鲜香蕉水果香、梨、樱桃花香、水果香、木香草莓、苹果、香蕉\\ 1\\青苹果、果香、草莓酯类4\ \\\220 5\1 200 200 1 200菠萝、果香菠萝、梨、花香\水果、玫瑰、蜡味水果香、脂肪、蜡味葡萄香气、瓜果香\\ \\\ \
续表
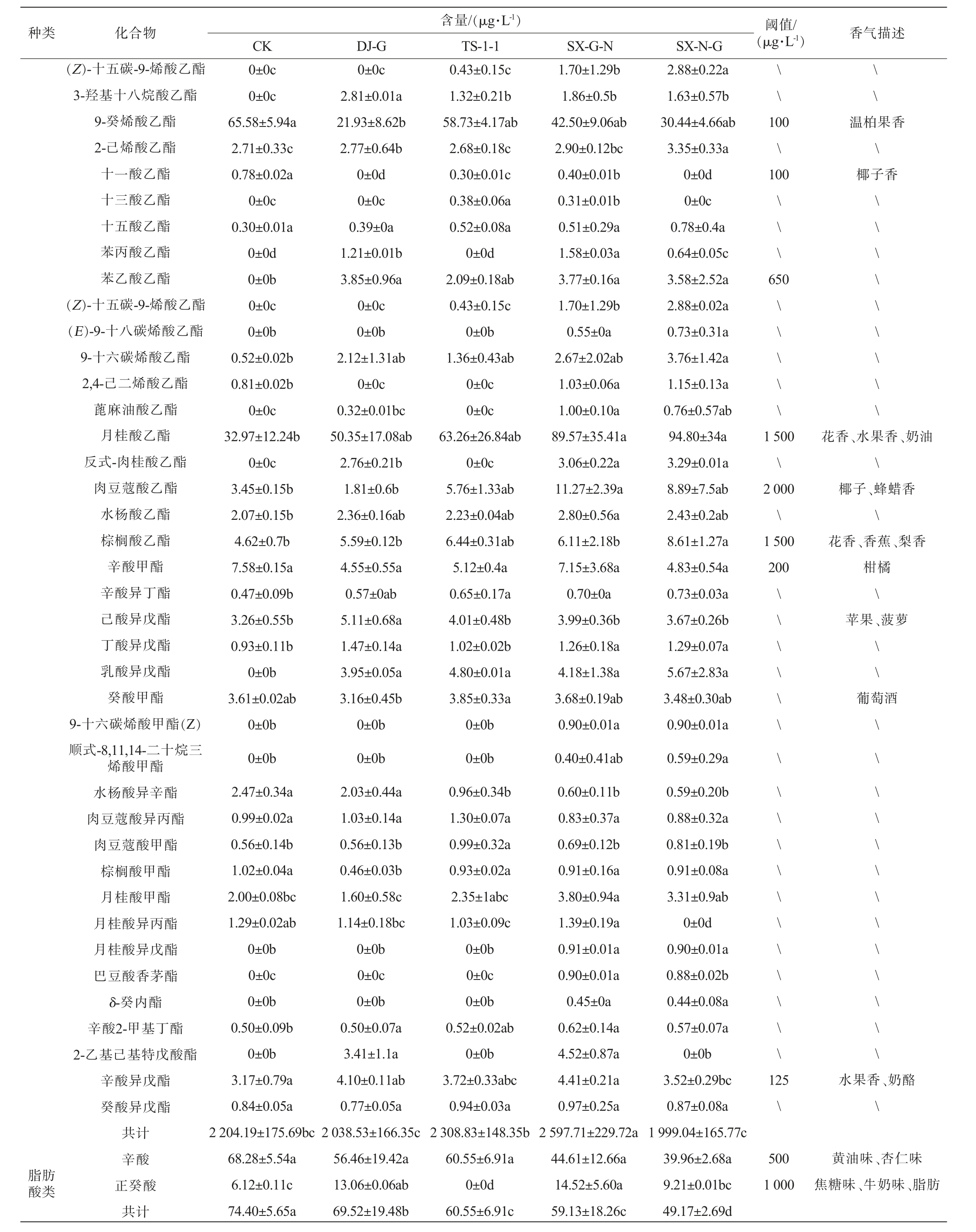
种类 化合物 阈值/(μg·L-1) 香气描述含量/(μg·L-1)CK DJ-G TS-1-1 SX-G-N SX-N-G(Z)-十五碳-9-烯酸乙酯3-羟基十八烷酸乙酯9-癸烯酸乙酯2-己烯酸乙酯十一酸乙酯十三酸乙酯十五酸乙酯苯丙酸乙酯苯乙酸乙酯(Z)-十五碳-9-烯酸乙酯(E)-9-十八碳烯酸乙酯9-十六碳烯酸乙酯2,4-己二烯酸乙酯蓖麻油酸乙酯月桂酸乙酯反式-肉桂酸乙酯肉豆蔻酸乙酯水杨酸乙酯棕榈酸乙酯辛酸甲酯辛酸异丁酯己酸异戊酯丁酸异戊酯乳酸异戊酯癸酸甲酯9-十六碳烯酸甲酯(Z)顺式-8,11,14-二十烷三烯酸甲酯水杨酸异辛酯肉豆蔻酸异丙酯肉豆蔻酸甲酯棕榈酸甲酯月桂酸甲酯月桂酸异丙酯月桂酸异戊酯巴豆酸香茅酯δ-癸内酯辛酸2-甲基丁酯2-乙基己基特戊酸酯\\\\0±0c 0±0c 65.58±5.94a 2.71±0.33c 0.78±0.02a 0±0c 0.30±0.01a 0±0d 0±0b 0±0c 0±0b 0.52±0.02b 0.81±0.02b 0±0c 32.97±12.24b 0±0c 3.45±0.15b 2.07±0.15b 4.62±0.7b 7.58±0.15a 0.47±0.09b 3.26±0.55b 0.93±0.11b 0±0b 3.61±0.02ab 0±0b 0±0b 2.47±0.34a 0.99±0.02a 0.56±0.14b 1.02±0.04a 2.00±0.08bc 1.29±0.02ab 0±0b 0±0c 0±0b 0.50±0.09b 0±0b 3.17±0.79a 0.84±0.05a 2 204.19±175.69bc 68.28±5.54a 6.12±0.11c 74.40±5.65a 0±0c 2.81±0.01a 21.93±8.62b 2.77±0.64b 0±0d 0±0c 0.39±0a 1.21±0.01b 3.85±0.96a 0±0c 0±0b 2.12±1.31ab 0±0c 0.32±0.01bc 50.35±17.08ab 2.76±0.21b 1.81±0.6b 2.36±0.16ab 5.59±0.12b 4.55±0.55a 0.57±0ab 5.11±0.68a 1.47±0.14a 3.95±0.05a 3.16±0.45b 0±0b 0±0b 2.03±0.44a 1.03±0.14a 0.56±0.13b 0.46±0.03b 1.60±0.58c 1.14±0.18bc 0±0b 0±0c 0±0b 0.50±0.07a 3.41±1.1a 4.10±0.11ab 0.77±0.05a 2 038.53±166.35c 56.46±19.42a 13.06±0.06ab 69.52±19.48b 0.43±0.15c 1.32±0.21b 58.73±4.17ab 2.68±0.18c 0.30±0.01c 0.38±0.06a 0.52±0.08a 0±0d 2.09±0.18ab 0.43±0.15c 0±0b 1.36±0.43ab 0±0c 0±0c 63.26±26.84ab 0±0c 5.76±1.33ab 2.23±0.04ab 6.44±0.31ab 5.12±0.4a 0.65±0.17a 4.01±0.48b 1.02±0.02b 4.80±0.01a 3.85±0.33a 0±0b 0±0b 0.96±0.34b 1.30±0.07a 0.99±0.32a 0.93±0.02a 2.35±1abc 1.03±0.09c 0±0b 0±0c 0±0b 0.52±0.02ab 0±0b 3.72±0.33abc 0.94±0.03a 2 308.83±148.35b 60.55±6.91a 0±0d 60.55±6.91c 1.70±1.29b 1.86±0.5b 42.50±9.06ab 2.90±0.12bc 0.40±0.01b 0.31±0.01b 0.51±0.29a 1.58±0.03a 3.77±0.16a 1.70±1.29b 0.55±0a 2.67±2.02ab 1.03±0.06a 1.00±0.10a 89.57±35.41a 3.06±0.22a 11.27±2.39a 2.80±0.56a 6.11±2.18b 7.15±3.68a 0.70±0a 3.99±0.36b 1.26±0.18a 4.18±1.38a 3.68±0.19ab 0.90±0.01a 0.40±0.41ab 0.60±0.11b 0.83±0.37a 0.69±0.12b 0.91±0.16a 3.80±0.94a 1.39±0.19a 0.91±0.01a 0.90±0.01a 0.45±0a 0.62±0.14a 4.52±0.87a 4.41±0.21a 0.97±0.25a 2 597.71±229.72a 44.61±12.66a 14.52±5.60a 59.13±18.26c 2.88±0.22a 1.63±0.57b 30.44±4.66ab 3.35±0.33a 0±0d 0±0c 0.78±0.4a 0.64±0.05c 3.58±2.52a 2.88±0.02a 0.73±0.31a 3.76±1.42a 1.15±0.13a 0.76±0.57ab 94.80±34a 3.29±0.01a 8.89±7.5ab 2.43±0.2ab 8.61±1.27a 4.83±0.54a 0.73±0.03a 3.67±0.26b 1.29±0.07a 5.67±2.83a 3.48±0.30ab 0.90±0.01a 0.59±0.29a 0.59±0.20b 0.88±0.32a 0.81±0.19b 0.91±0.08a 3.31±0.9ab 0±0d 0.90±0.01a 0.88±0.02b 0.44±0.08a 0.57±0.07a 0±0b 3.52±0.29bc 0.87±0.08a 1 999.04±165.77c 39.96±2.68a 9.21±0.01bc 49.17±2.69d 100\100温柏果香\椰子香\\ \650\\ \ \ \\\ \ \ \ \ \ \ \1 500\2 000\1 500 200\\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \花香、水果香、奶油\椰子、蜂蜡香\花香、香蕉、梨香柑橘\苹果、菠萝\\葡萄酒\\ \ \ \ \ \ \ \ \ \ \ \125\水果香、奶酪\脂肪酸类辛酸异戊酯癸酸异戊酯共计辛酸正癸酸共计500 1 000黄油味、杏仁味焦糖味、牛奶味、脂肪
续表

注:同行不同字母表示处理间差异显著(P<0.05)。
种类 化合物 阈值/(μg·L-1) 香气描述含量/(μg·L-1)CK DJ-G TS-1-1 SX-G-N SX-N-G 100\300玫瑰、青柠檬\花香、甜木香萜烯类\\ \\\ \香茅醇蘑菇醇橙花醇反式-橙花叔醇植酮突厥烯酮大马士酮香叶基丙酮金合欢烯α-佛柑油烯共计丁香酚佳乐麝香月桂醛十一醛金合欢醛金合欢基乙醛共计合计10.52±0.29c 2.23±0.03c 0±0c 0±0d 0.69±0.13b 13.86±1.53ab 0.44±0.08c 2.70±0.57b 0±0c 0±0b 30.44±2.63d 0±0c 0.30±0.01c 1.26±0.14a 1.40±0a 0±0c 0±0c 2.96±0.15c 2 687.06±137.43bc 13.21±1.61c 2.56±0.28abc 0.80±0b 8.70±0.01a 0.73±0.15b 15.17±0.15a 0.42±0.11c 4.41±0.05a 5.51±1.97a 1.92±0.63a 53.43±4.96b 0.65±0.01c 0.46±0.17c 0.86±0.15b 1.34±0.08ab 0.89±0.01a 0±0c 4.20±0.42b 2 538.05±73.71c 12.30±0.01c 2.85±0.34a 0±0c 3.21±0.01b 1.55±0.19a 15.40±4.97a 0.30±0.02c 2.87±0.76b 3.08±0.03b 0±0b 41.56±6.33c 0±0b 1.05±0.16b 1.29±0.02a 1.24±0.03bc 0±0c 0.82±0.20a 4.40±0.41b 2 824.88±74.84b 21.87±0.77b 2.83±0.53bc 1.10±0.01a 1.50±0.62c 0.92±0.22b 10.24±0.22b 9.11±0.79b 3.16±0.8b 5.17±0.15a 1.70±0a 57.60±4.11b 1.14±0.01a 1.18±0.03ab 0.80±0b 1.21±0.1c 0.50±0b 0.36±0.02b 5.19±0.16a 3 105.27±86.97a 31.14±3.76a 2.63±0.31ab 1.10±0.01a 2.97±0.78b 0.96±0.26b 10.18±0.16b 9.91±0.01a 3.13±0.16b 5.30±0.01a 1.72±0.03a 69.04±5.49a 1.15±0.26a 1.47±0.31a 0.81±0.01b 1.09±0.01d 0.50±0b 0±0c 5.02±0.59a 2 486.81±157.35c 0.05 60甜苹果、李子、桃子清甜、玫瑰香\\ 6 \ \ \ \ \ \\\丁香、甘草香其他类\\ \ \ \ \
2.4.1 酯类化合物分析
酒样中共检测到酯类化合物59种,含量为1 999.04~2 597.71 μg/L,占风味物质总含量的80%以上,是葡萄酒中的主要风味物质。SX-G-N处理组葡萄酒样中的酯类物质含量最高(2 597.71 μg/L),显著高于CK对照组葡萄酒样(2 204.19 μg/L);其次是TS-1-1组葡萄酒样(2 308.83 μg/L),与对照组没有显著差异(P>0.05)。酯类物质中乙酯类占主导地位,赋予了酒体花果香气,其中辛酸乙酯是检出的含量最高的物质(851.02~1 296.14 μg/L),主要赋予酒体菠萝、梨、花香味,顺序接种的酒样(SX-G-N、SX-N-G)的辛酸乙酯显著高于对照组CK(1 112.03 μg/L);己酸乙酯是检出含量第二高的物质(494.89~658.98 μg/L),主要赋予酒体青苹果味、草莓味,其中SX-G-N组葡萄酒样的己酸乙酯含量显著高于对照组CK(P<0.05);混菌发酵处理组葡萄酒样的丁酸乙酯含量显著高于对照组CK(P<0.05),提高了40.23%~48.24%。所有处理组葡萄酒样中均检测出癸酸乙酯,且含量均大于阈值,为葡萄酒增添了热带水果的香气。除了乙酯类外,乙酸异戊酯的含量也相较于对照组CK提高了16.70%~35.68%。
2.4.2 醇类化合物分析
醇类物质是葡萄酒中一类重要的香气物质,本试验酒样中检测到的醇类物质主要有C6化合物、高级醇类等。 高级醇是醇类物质中种类最多含量也最高的一大类物质,研究表明,高级醇的含量低于300 mg/L时可以增加酒体香气,但高于400 mg/L时会带来刺鼻感和不良气味[22],本试验中的所有酒样高级醇含量均低于300 mg/L。TS-1-1组、SX-N-G组、SX-N-G组葡萄酒样中高级醇含量均高于对照组CK(243.85 μg/L)。 在各处理酒样中,苯乙醇是各酒样中含量最高的醇类物质,占醇类总含量的50%左右,在TS-1-1组、SX-N-G组、SX-N-G组葡萄酒样中苯乙醇含量增加了19.68%~56.20%,进而给‘赤霞珠’葡萄酒带来了玫瑰、丁香和蜂蜜的香气。 此外苯甲醇仅在混菌发酵的酒样中有检出,且含量均显著高于对照组CK(P<0.05),为酒体增加了烘烤香和甜香的气味;SX-G-N和SX-N-G组中1-辛醇(茉莉和柠檬味香气)、2,3-丁二醇(奶油香和水果香)、2-乙基己醇(甜香和花香)含量均显著高于对照组CK(P<0.05)。
2.4.3 脂肪酸类、萜烯类及其他化合物分析
酒样中检出的脂肪酸含量较低,不能直接影响葡萄酒香气。混菌发酵组中萜烯类物质含量均显著高于对照组CK(P<0.05);其中反式-橙花叔醇、金合欢烯是在H.uvarum参与发酵的酒样中有检出,为葡萄酒提供了玫瑰香、青柠檬香、桃李香等花果气味[23-24];另外,SX-G-N和SX-N-G发酵组中香茅醇、橙花醇、大马士酮和丁香酚的含量均显著高于对照组CK(P<0.05)。萜烯类物质种类和含量的增加与H.uvarum有较高的葡萄糖苷酶和木糖苷酶活性有关。此外,还检测出3种醛类物质,也增加了香气的复杂性。
2.4.4 特征香化合物分析
气味活性值(odor activity value,OAV)是香气化合物浓度与香气化合物阈值的比,当OAV>1时可被确定为特征香气化合物;0.5<OAV<1时也能产生香气,是潜在特征香气化合物,能通过单个化合物的组合、协同、抑制或基质效应影响葡萄酒香气[25]。 不同处理葡萄酒样OAV>0.5的香气化合物见表6。 由表6可知,不同处理葡萄酒样OAV>0.5的香气化合物有12种,对其进行主成分分析(principal componentanalysis,PCA),结果见图3。由图3可知,PC1、PC2方差贡献率分别为48.80%、23.50%,二者累计方差贡献率为72.30%。5种酒样在置信区间被很好地区分开,对照组(CK)与混菌发酵组葡萄酒样均不在同一象限内,说明混菌发酵对葡萄酒风味有显著影响。混菌发酵中由于接种方式不同,TS-1-1组位于PC1的负半轴,而SX-G-N组和SX-N-G组位于PC1的正半轴;SX-N-G组位于PC2的正半轴,SX-G-N组则位于PC2的负半轴。CK组葡萄酒样的特征香气与辛酸乙酯、9-癸酸乙酯相关联;TS-1-1组葡萄酒样与1-辛醇、癸酸乙酯、己酸乙酯相关联,使酒样具有水果和奶油的香气;SX-G-N组葡萄酒样与辛酸乙酯、1-辛醇、大马士酮、月桂酸乙酯、香茅醇相关联;SX-N-G组葡萄酒样与丁酸乙酯、乙酸己酯、月桂酸乙酯、香茅醇、1-辛醇、大马士酮相关联;SX-G-N和SX-N-G组葡萄酒样共同的特征香气为月桂酸乙酯、香茅醇、1-辛醇、大马士酮,这些化合物都赋予葡萄酒花香和水果香。
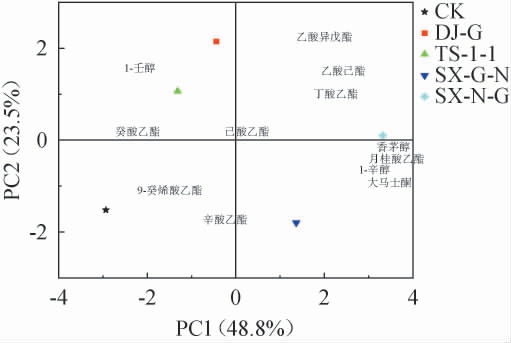
图3 不同处理葡萄酒样挥发性香气化合物主成分分析结果
Fig.3 Principal component analysis results of volatile aroma components in wine samples with different treatments
表6 不同处理葡萄酒样中特征(OAV>1)及潜在特征(OAV>0.5)挥发性香气化合物香气描述及气味活度值
Table 6 Aroma descriptions and odor activity values of the characteristic (OAV>1) and potential characteristic (OAV>0.5) volatile aroma compounds in wine samples with different treatments
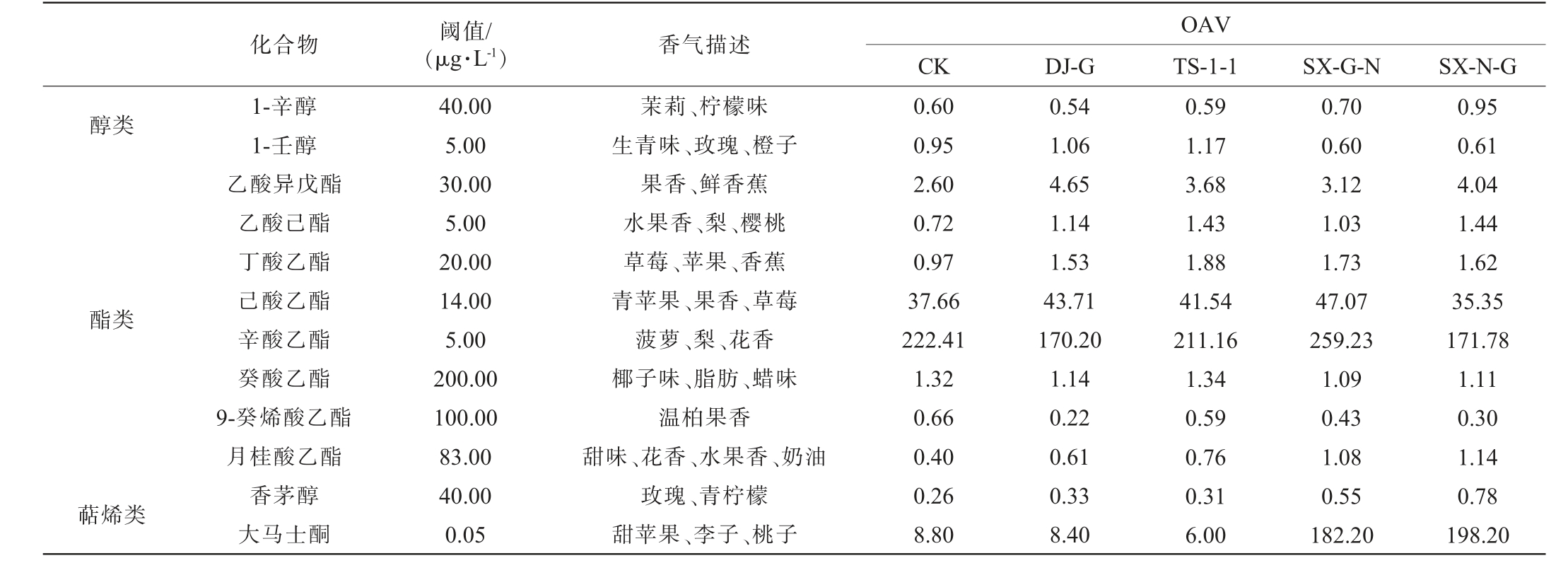
OAV CK DJ-G TS-1-1 SX-G-N SX-N-G醇类化合物 阈值/(μg·L-1) 香气描述酯类萜烯类1-辛醇1-壬醇乙酸异戊酯乙酸己酯丁酸乙酯己酸乙酯辛酸乙酯癸酸乙酯9-癸烯酸乙酯月桂酸乙酯香茅醇大马士酮40.00 5.00 30.00 5.00 20.00 14.00 5.00 200.00 100.00 83.00 40.00 0.05茉莉、柠檬味生青味、玫瑰、橙子果香、鲜香蕉水果香、梨、樱桃草莓、苹果、香蕉青苹果、果香、草莓菠萝、梨、花香椰子味、脂肪、蜡味温柏果香甜味、花香、水果香、奶油玫瑰、青柠檬甜苹果、李子、桃子0.60 0.95 2.60 0.72 0.97 37.66 222.41 1.32 0.66 0.40 0.26 8.80 0.54 1.06 4.65 1.14 1.53 43.71 170.20 1.14 0.22 0.61 0.33 8.40 0.59 1.17 3.68 1.43 1.88 41.54 211.16 1.34 0.59 0.76 0.31 6.00 0.70 0.60 3.12 1.03 1.73 47.07 259.23 1.09 0.43 1.08 0.55 182.20 0.95 0.61 4.04 1.44 1.62 35.35 171.78 1.11 0.30 1.14 0.78 198.20
2.5 感官品评试验结果
对不同处理葡萄酒样进行感官评分,结果见表7。由表7可知,混菌发酵葡萄酒样的感官评分总分均有所提高,说明混菌发酵对葡萄酒的感官有积极影响。 不同处理葡萄酒样均呈现葡萄酒应有的带有光泽的紫红色,澄清透明,酒体滋味平衡,无杂味,后味持久的感官品质;混菌发酵的葡萄酒样的香气评分均高于单菌发酵,这与香气物质分析结果相一致,其中SX-G-N组的香气评分最高为24.44分。H.uvarum参与发酵的酒样典型性评分显著高于CK组,其中SX-G-N组的典型性评分最高。SX-G-N组感官评分总分最高,为86.89分;TS-1-1其次,为83.33分。 结果表明,混菌发酵对提高‘赤霞珠’干红葡萄酒的感官品质有积极作用。
表7 不同处理葡萄酒样的感官评价结果
Table 7 Sensory evaluation results of wine samples with different treatments

酒样 色泽 澄清度 香气 滋味 典型性 总分CK DJ-G 4.31±0.16a 4.62±0.48a 4.40±0.16b 4.22±0.67b 21.44±1.58c 22.00±1.58bc 36.11±1.40a 31.00±1.41b 15.30±0.96b 16.33±1.73ab 81.57±2.12bc 78.18±3.06c
续表

注:同列不同字母表示处理间差异显著(P<0.05)。
酒样 色泽 澄清度 香气 滋味 典型性 总分TS-1-1 SX-G-N SX-N-G 4.56±1.01a 4.56±0.88a 4.44±0.70a 4.22±0.67b 4.33±0.87b 4.33±0.50b 23.33±1.50ab 24.44±1.23a 23.00±1.67abc 35.11±1.76a 36.44±1.59a 35.00±1.50a 16.11±1.05ab 17.11±0.78a 16.00±1.00ab 83.33±4.39ab 86.89±4.11a 82.78±3.35b
3 结论
本研究考察了H.uvarum与S.cerevisiae混合发酵及接种工艺对‘赤霞珠’干红葡萄酒品质的影响。总体来看,H.uvarum与S.cerevisiae相比有较高的β-D-葡萄糖苷酶、β-D-木糖苷酶和果胶酶活性。在发酵过程中,同时接种的发酵液中H.uvarum的生长明显受到抑制;先接种H.uvarum的SX-G-N组中H.uvarum生长情况最佳,活菌数保持在2.0×106CFU/mL,能够使其很好的在酿造过程中发挥作用。H.uvarum参与的发酵降低了葡萄酒的酒精度,提高了葡萄酒总酸和花色苷含量。混菌发酵的酒样中香气物质的品种更丰富,并在特征香气物质上与CK组有较大差别;H.uvarum提高了葡萄酒中丁酸乙酯和乙酸异戊酯的含量,也提高了酒样中醇类物质的含量,尤其是苯乙醇含量;使葡萄酒中萜烯类物质种类和含量有所增加;先接种H.uvarum再接种S.cerevisiae处理组香气物质的总量最高,且显著高于CK组(P<0.05),以辛酸乙酯、大马士酮和月桂酸乙酯等为特征香气物质。混菌发酵的葡萄酒样感官评分均高于单菌种发酵,H.uvarum参与发酵的酒样典型性评分显著高于CK组(P<0.05)。
H.uvarum与S.cerevisiae混合发酵可以改善‘赤霞珠’干红葡萄酒的品质,SX-G-N(先接入H.uvarum,3 d后接入S.cerevisiae)组葡萄酒样还原糖含量与酒精度能达到干红葡萄酒的要求,花色苷含量高,有最高的感官评分,花香和果香突出,典型性好,香气物质总量相较于单一S.cerevisiae发酵增加了15.56%,此混菌发酵方案在葡萄酒增香酿造中具有一定的应用潜力。 后续将从分子学角度深入研究H.uvarum与S.cerevisiae相互作用机理,进一步为葡萄汁有孢汉逊酵母在葡萄酒酿造中的应用提供理论依据。
[1]李世琦.猕猴桃酒增香型非酿酒酵母筛选及混菌发酵特性研究[D].杨凌:西北农林科技大学,2022.
[2]刘晓燕,赵晓敏,张小月,等.混菌顺序发酵对‘赤霞珠’干红葡萄酒品质的影响[J].中国酿造,2022,41(4):65-72.
[3]宿萌,李蕊蕊,王欢,等.戴尔有孢圆酵母对品丽珠和马瑟兰葡萄酒香气物质的影响[J].食品与发酵工业,2020,46(21):62-69.
[4]祝霞,王媛,刘琦,等.混菌发酵对贵人香低醇甜白葡萄酒香气影响分析[J].食品与发酵工业,2019,45(4):95-102.
[5]申静云,刘沛通,段长青,等.不同有孢汉逊酵母与酿酒酵母混合发酵对威代尔冰葡萄酒香气的影响[J].食品与发酵工业,2017,43(10):16-23.
[6]ERASMUS B,DIVOL B.Exploring the phenotypic diversity of oenological traits in Kluyveromyces marxianus strains[J].FEMS Yeast Res,2022,22(1):foac009.
[7]LÓPEZ S, MATEO J J, MAICAS S.Characterisation of Hanseniaspora isolates with potential aroma-enhancing properties in muscat wines[J].S Afr J Enol Vitic,2014,35(2):292-302.
[8]陶永胜,朱晓琳,马得草,等.葡萄汁有孢汉逊酵母糖苷酶增香酿造葡萄酒的潜力分析[J].农业机械学报,2016,47(10):280-286.
[9]剧柠,赵梅梅,柯媛,等.枸杞果酒用非酿酒酵母的分离筛选及香气成分分析[J].食品与发酵工业,2017,43(11):125-131.
[10]冯文倩,王倩,刘延琳,等.低产乙醇本土有孢汉逊酵母的筛选及酿造特性[J].食品与发酵工业,2021,47(21):9-17.
[11]李艳.自选酿酒酵母产β-D-葡萄糖苷酶的反应条件研究[J].中国食品添加剂,2018(7):84-91.
[12]谷艺明.果胶酶高产菌株的筛选、发酵优化及酶学性质的研究[D].常州:常州大学,2021.
[13]李婷,陈景桦,马得草,等.优选非酿酒酵母与酿酒酵母在模拟葡萄汁发酵中生长动力学及酯酶活性分析[J].食品科学,2017,38(22):60-66.
[14]国家质量监督检验检疫总局.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[15]陈亮,杨志勇,辛秀兰,等.蓝莓果酒发酵期间抗氧化成分及活性研究[J].中国酿造,2013,32(12):17-20.
[16]VARELA C,SENGLER F,SOLOMON M,et al.Volatile flavour profile of reduced alcohol wines fermented with the non-conventional yeast species Metschnikowia pulcherrima and Saccharomyces uvarum[J].Food Chem,2016,209:57-64.
[17]LOPEZ M C,MATEO J J,MAICAS S,et al.Screening of β-glucosidase and β-xylosidase activities in four non-Saccharomyces yeast isolates[J].J Food Sci,2015,80(8):1696-1704.
[18]张宝香,李昌禹,曹炜玉,等.不同酵母菌对酿造‘北冰红’干红葡萄酒品质影响研究[J].特产研究,2024,46(2):77-84.
[19]TAILLANDIER P, LAI Q P, JULIEN-ORTIZ A, et al.Interactions between Torulaspora delbrueckii and Saccharomyces cerevisiae in wine fermentation:Influence of inoculation and nitrogen content[J].World J Microb Biotechnol,2014,30:1959-1967.
[20]WANG C X,MAS A,ESTEVE-ZARZOSO B,et al.Interaction between Hanseniaspora uvarum and Saccharomyces cerevisiae during alcoholic fermentation[J].Int J Food Microbiol,2015,206:67-74.
[21]FURLANI M V M,MATURANO Y P,COMBINA M,et al.Selection of non-Saccharomyces yeasts to be used in grape musts with high alcoholic potential: a strategy to obtain wines with reduced ethanol content[J].FEMS Yeast Res,2017,17(2):fox010.
[22]王媛,祝霞,杨学山,等.混菌发酵对美乐低醇桃红葡萄酒香气的影响[J].核农学报,2018,32(11):2195-2207.
[23]ESCRIBANO R,GONZÁLEZ-ARENZANA L,GARIJO P,et al.Screening of enzymatic activities within different enological non-Saccharomyces yeasts[J].J Food Technol,2017,54:1555-1564.
[24]BOKULICH N A,HWANG C F,LIU S W.Profiling the yeast communities of wine fermentations using terminal restriction fragment length polymorphism analysis[J].Am J Enol Vitic,2012,63:185-194.
[25]CONTRERAS A,HIDALGO C,SCHMIDT S,et al.The application of non-Saccharomyces yeast in fermentations with limited aeration as a strategy for the production of wine with reduced alcohol content[J].Int J Food Microbiol,2015,205:7-15.