茶叶发酵通常是指茶叶叶片中内源酶的自然氧化过程,但部分红茶,如普洱茶和砖茶,会经过微生物发酵[1-3]。康普茶是一种常见的微生物发酵茶,其由加糖的茶浸液和特殊酵母及醋酸菌发酵而成[4-5]。这类微生物发酵茶(饮料)因其独特的风味和生物活性(包括抗氧化、抗衰老、减肥和降压等)在全球范围内广受欢迎[5-8]。
微生物发酵茶中的关键功能成分包括多酚、生物碱、三萜类、降异戊二烯类和B环裂解儿茶素衍生物等代谢产物[9]。微生物发酵在茶叶代谢物合成与转化方面发挥着关键作用,如由植物乳植杆菌(Lactiplantibacillus plantarum)和益生菌发酵的绿茶浸液中黄酮苷类成分组成不同[5,10];利用混合微生物(乳酸菌、醋酸菌和酵母菌)发酵红茶浸液可以通过增加其多酚和咖啡因含量来提升抗氧化活性[11];德尔布有孢圆酵母(Torulaspora delbrueckii)可通过异构化反应将橙花醇转化为香叶醇,从而提升花果香气[12];能够显著影响发酵产物中酚类物的组成,保留抗氧化活性的同时改善感官特性[13];乳酸克鲁维酵母(Kluyveromyces lactis)在发酵过程中可合成高水平的果香酯与萜烯类物质[12]。此外,通过筛选特定酵母菌种或组合发酵,可定向调控茶叶功能成分的组成与比例。因此,微生物发酵是丰富茶叶功能成分及增强其生物活性的重要技术手段。
本研究采用涂布分离法从新鲜黄金桂茶叶中分离筛选能显著提高绿茶抗氧化能力的内生真菌,通过形态学观察及分子生物学技术对其进行菌种鉴定,并将其应用于绿茶的纯种液态发酵,对比发酵前后活性成分、抗氧化能力的变化,并评价发酵绿茶对中波红斑效应紫外线B(ultraviolet B,UVB)辐射诱导人永生化角质形成(HaCaT)细胞损伤的保护作用,以期为微生物发酵茶的菌株筛选和绿茶的发酵利用提供实验依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与细胞
新鲜黄金桂茶叶、黄金桂晒青茶叶(绿茶):福建金溪茶业有限公司:HaCaT细胞:上海富衡生物科技有限公司。
1.1.2 试剂
茶氨酸(theanine,Thea)、咖啡碱(caffeine,CA)、儿茶素(catechin,C)、没食子酸(gallic acid,GA)、没食子儿茶素(gallocatechin,GC)、儿茶素没食子酸酯(catechingallat,CG)、没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)、表儿茶素(epicatechin,EC)、表没食子儿茶素(epigallocatechin,EGC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)等标准品(纯度均≥98%)、1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率试剂盒、羟自由基清除率试剂盒、真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:上海源叶生物科技有限公司;乙腈(色谱纯):德国Merck公司;乙酸铵(分析纯)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(噻唑蓝)(3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di-phenytetrazoliumromide,MTT):美国Sigma公司;胎牛血清(fetal bovine serum,FBS):浙江天杭生物科技股份有限公司;维生素E(vitamin E,VE):中国食品药品检定研究院;其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:马铃薯300 g,葡萄糖20 g,加蒸馏水定容至1 000 mL,pH自然;121 ℃高压蒸汽灭菌20 min。马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:在PDB培养基中添加琼脂粉15 g。
种子培养基:葡萄糖20 g,加蒸馏水定容至1 000 mL,pH自然,115 ℃高压蒸汽灭菌15 min[14]。
发酵培养基:晒青茶叶30 g,葡萄糖20 g,加蒸馏水定容至1 000 mL,pH自然,115 ℃高压蒸汽灭菌15 min[14]。
达尔伯克改良伊格尔培养基(Dulbecco's Modified Eagle Medium,DMEM):美国Gibico公司,10%胎牛血清、0.45%葡萄糖。
HaCaT细胞培养基:在DMEM培养基中添加1%双抗溶液(青霉素10 000 U/mL、链霉素10 mg/mL)。
1.2 仪器与设备
QEHF-X质谱(massspectrometry,MS)仪、150ICO2培养箱:美国Thermo公司;Ultimate 3000超高效液相色谱(ultrahigh performance liquid chromatography,UPLC)仪:美国Dionex公司;5430R低温高速离心机:德国Eppendorf公司;UV-6100型双光束分光光度计:上海玛帕达仪器有限公司;SW-CJ-1F超净工作台:苏州安泰空气技术有限公司;DM2500荧光显微镜:德国Leica公司;CFX-96荧光定量聚合酶链式反应(polymerase chain reactio,PCR)仪:美国BioRad公司;UVB辐照仪:荷兰飞利浦公司;CKX53倒置显微镜、BX53正置显微镜:日本Olympus公司。
1.3 方法
1.3.1 具有提高绿茶抗氧化活性内生真菌的分离与筛选
采用自来水将新鲜黄金桂茶叶冲洗干净,晾干;用体积分数75%乙醇漂洗60 s,再用无菌水反复冲洗6次;用2%的次氯酸钠漂洗6 min,再用无菌水反复冲洗6~8次[15]。在无菌条件下,将茶叶剪成(2~5)mm×(2~5)mm大小的片状,置于含50 μg/mL链霉素的PDA培养基上,28 ℃避光培养3~5 d。 挑选分离培养基平板上生长较好的单菌落进行多次分离纯化后接种于发酵培养基中,于28 ℃、200 r/min条件下培养2~3 d,发酵液经8 000 r/min离心10 min后取上清,按照试剂盒说明书检测DPPH自由基清除率,挑选DPPH自由基清除率较高的菌株保存于4 ℃冰箱中,备用。
1.3.2 内生菌真菌的鉴定
形态学观察:将筛选菌株划线接种于PDA培养基,28 ℃培养5 d,观察菌落外观、大小、颜色、边缘形状、表面干湿状态等菌落形态特征。 采用美蓝染液染色后采用显微镜观察其细胞形态。
分子生物学鉴定:采用真菌基因组DNA提取试剂盒提取筛选菌株的基因组DNA,以其为模板,采用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')对菌株的26S rDNA基因序列进行PCR扩增。PCR扩增体系:基因组DNA(100 μg/mL)1 μL、引物NL1(2 μmol/L)和NL4(2 μmol/L)各1 μL、2×Taq PCR Msster Mix(5 U/μL)12 μL、二甲基亚砜(dimethylsulfoxide,DMSO)(99%)1 μL,双蒸水(ddH2O)8 μL。PCR扩增程序:95 ℃预变性5 min;94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸1.5 min,共30个循环;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后,委托福州尚亚生物技术有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对。 选取同源性较高的模式菌株的26S rDNA基因序列,采用MEGA5.2中的邻接法(neighbor-joining,NJ)构建系统发育树,以确定菌株种属。
1.3.3 纯菌发酵绿茶工艺及样品制备
将甘油保存的筛选菌株划线接种到PDA培养基上,于28 ℃培养3~4 d。 挑取单菌落分别接种至种子培养基中,于28 ℃、200 r/min条件下培养14 h,得种子液。 将种子液以1%(V/V)的接种量接种于发酵培养基作为实验组,以未接种种子液的发酵培养基为对照组,每组3个平行,均于28 ℃、200 r/min条件下发酵培养72 h。 发酵液经8 000 r/min离心10 min,去除发酵液中的沉淀物,收集上清液。将上清液冷冻干燥去除水分制备成样品备用。
1.3.4 功能活性成分及pH的测定
茶多酚、总黄酮、生物碱、游离氨基酸、儿茶素、没食子酸、茶氨酸等功能活性成分的测定:参考文献[16-19];pH的测定:采用pH计测定。
1.3.5 抗氧化能力的测定按照试剂盒说明书测定发酵绿茶样品对DPPH自由基和羟自由基的清除能力。
1.3.6 HaCaT细胞培养
将HaCaT细胞转接至含5 mL DMEM培养基的细胞培养瓶中,在37 ℃、5%CO2的细胞培养箱中培养。2~3 d更换培养基,待细胞长至细胞培养瓶的70%~90%时进行传代,实验选取处于对数生长期且生长状态良好的HaCaT细胞。
1.3.7 发酵绿茶对UVB致HaCaT细胞损伤的保护作用
(1)发酵绿茶样品对HaCaT细胞产生毒性的最低浓度的确定
细胞复苏后,将HaCaT细胞接种至含100 μL HaCaT细胞培养基的96孔板,置于CO2培养箱(37 ℃、5%CO2)中孵育过夜。待96孔板中HaCaT细胞铺板率达到50%~60%时进行分组给药,每组设3个复孔。空白对照组(BC):每孔加入100 μL无胎牛血清HaCaT细胞培养基;阳性对照组(PC):每孔加入100 μL 10%DMSO;对照组:每孔加入100 μL未接菌发酵绿茶样品(终质量浓度分别为0.1 mg/mL、0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL和1.0 mg/mL);实验组:每孔加入100 μL接菌发酵绿茶样品(终质量浓度0.1 mg/mL、0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL和1.0 mg/mL)。给药完成后将96孔板置于CO2培养箱(37 ℃、5%CO2)中培养24h。各组培养结束后弃上清,加入MTT工作液(0.5mg/mL),置于CO2培养箱(37 ℃、5%CO2)中培养4 h,弃上清,每孔加入150 μL DMSO,在波长490 nm处测定吸光度值(OD490 nm值),并计算细胞相对活力,其计算公式如下:
(2)发酵绿茶样品对UVB致HaCaT细胞损伤的保护能力分析
细胞复苏后,将HaCaT细胞接种至含100 μL HaCaT细胞培养基的96孔板,置于CO2培养箱(37 ℃、5%CO2)中孵育过夜。 待96孔板中HaCaT细胞铺板率达到50%~60%时进行分组给药,每组设3个复孔。 空白对照组(BC)和模型组(UVB):每孔加入100 μL无胎牛血清HaCaT细胞培养基;对照组:每孔加入100 μL未接菌发酵绿茶样品(终质量浓度分别为0.05 mg/mL、0.10 mg/mL、0.20 mg/mL、0.30 mg/mL、0.40 mg/mL、0.50 mg/mL);实验组:每孔加入100 μL接菌发酵绿茶样品(终质量浓度分别为0.05 mg/mL、0.10 mg/mL、0.20 mg/mL、0.30 mg/mL、0.40 mg/mL、0.50 mg/mL)。 给药完成后将96孔板置于CO2培养箱(37 ℃、5%CO2)中培养24 h后,除空白对照组外,其他各组均进行UVB辐射,辐射剂量为40 mJ/cm2,继续于相同条件下培养24 h后,弃上清,加入MTT工作液(0.5 mg/mL),置于CO2培养箱(37 ℃、5%CO2)中培养4 h,弃上清,每组加入150 μL DMSO,在波长490 nm处测定吸光度值。
1.3.8 发酵绿茶对HaCaT细胞活性氧生成的影响
细胞复苏后,接种HaCaT细胞至含100 μL HaCaT细胞培养基的24孔板,置于CO2培养箱(37 ℃、5%CO2)中孵育过夜。待24孔板中HaCaT细胞铺板率达到50%~60%时,进行分组给药,每组设3个复孔。 空白对照组(BC)和模型组(UVB):每孔加入1mLHaCaT细胞培养基;阳性对照组(PC):每孔加入1 mL含0.05%VE的HaCaT细胞培养基;实验组:每孔加入1 mL含有发酵绿茶样品(终质量浓度为0.3 mg/mL)的HaCaT细胞培养基;对照组:每孔加入1 mL含有未接菌发酵绿茶样品(终质量浓度为0.3 mg/mL)的HaCaT细胞培养基。给药完成后将24孔板置于CO2培养箱(37 ℃、5%CO2)中培养24 h后,除空白对照组外,其他组别均进行UVB辐照,辐照剂量为300 mJ/cm2。辐照结束后,用4%的多聚甲醛进行固定处理,固定30 min后,磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗8 min。 清洗结束后,用吸水纸将周围的液体擦拭干净,滴加20 μL荧光抗猝灭封片剂,盖玻片封片。 显微镜下拍照观察线粒体活性氧簇(reactive oxygen species,ROS)荧光结果,采集图片(20×)并使用Image-Pro Plus图像处理软件统计得到积分光密度(integrated optical density,IOD),同时统计相同视野内的细胞数量,将空白对照组的ROS生成水平计为1,计算ROS生成水平及下调率,其计算公式如下:
Plus图像处理软件统计得到积分光密度(integrated optical density,IOD),同时统计相同视野内的细胞数量,将空白对照组的ROS生成水平计为1,计算ROS生成水平及下调率,其计算公式如下:

1.3.9 数据处理与统计学分析
每个试验重复3次,通过SPSS 20.0软件处理数据,结果用“平均值±标准差”,表示并进行单因素方差分析。采用GraphPad Prism 5.0软件绘图。
2 结果与分析
2.1 具有提高绿茶抗氧化活性内生真菌的分离、筛选及鉴定
采用涂布分离法从新鲜黄金桂茶叶中分离得到一株具有提高绿茶抗氧化能力的内生真菌,编号为T12,其发酵上清液对DPPH自由基的清除率达到32.52%。菌株T12的菌落及细胞形态见图1。
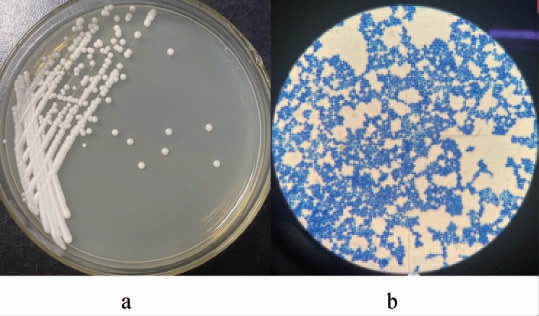
图1 菌株T12的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of the strain T12
由图1可知,菌株T12在PDA培养基上的菌落呈奶油状,乳白色,表面平滑、湿润、有光泽;细胞呈椭圆形。为确定菌株T12的种属关系,进一步基于26S rDNA基因序列构建系统发育树,结果见图2。

图2 基于26S rDNA基因序列菌株T12的系统发育树
Fig.2 Phylogenetic tree of the strain T12 based on the 26S rDNA gene sequence
由图2可知,菌株T12与汉逊德巴利酵母菌(Debaryomyces hansenii)AD-52聚于同一分支,亲缘关系最近。 结合菌株T12的形态学特征,最终将菌株T12鉴定为汉逊德巴利酵母菌(Debaryomyces hansenii)。 汉逊德巴利酵母属于半子囊菌纲的非传统酵母物种,耐低温、干燥和耐盐,大多从盐水、食物、水果,甚至人类肠道中分离得到[20-21]。汉逊德巴利酵母会产生支链醛和醇,形成不同于使用解脂耶氏酵母(Yarrowia lipolytica)和酿酒酵母(Saccharomyces cerevisiae)所获得的香气特征,可用于食品生产发酵[22]。汉逊德巴利酵母还具有抗菌防腐作用[23]。 此外,汉逊德巴利酵母也因其益生菌特性和免疫应激特性而备受关注[24-30],具有较好的研究前景。
2.2 汉逊德巴利酵母菌T12发酵对绿茶功能活性成分及pH值的影响
汉逊德巴利酵母菌T12发酵对绿茶主要功能活性成分(茶多酚、总黄酮、生物碱、游离氨基酸)的含量及pH值的影响见图3。 由图3可知,与对照组相比,实验组中的主要功能活性成分(除生物碱外)含量及pH值具有极显著差异(P<0.01)。其中,茶多酚含量(281.20 mg/g)、总黄酮含量(59.00 mg/g)分别提高34.01%、25.13%,而游离氨基酸含量(4.52 mg/g)下降了35.5%,pH由5.74下降至4.37。
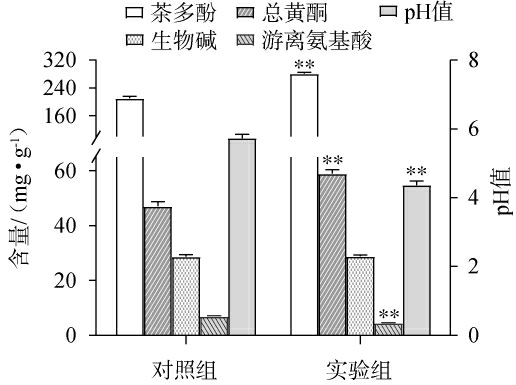
图3 汉逊德巴利酵母菌T12发酵对绿茶主要功能活性成分及pH的影响
Fig.3 Effect of Debaryomyces hansenii T12 fermentation on the main functional active components and pH of green tea
“**”表示与对照组比较,差异极显著(P<0.01)。 下同。
儿茶素、咖啡碱和茶氨酸是茶叶中重要特征组分[31],其在发酵绿茶中的含量见图4。 由图4可知,与对照组相比,实验组中GA、GC、EGC、EC、C及CA含量极显著升高(P<0.01),分别为13.77mg/g、22.51mg/g、18.84mg/g、6.77mg/g、4.37mg/g、14.42 mg/g,而Thea、EGCG、GCG含量极显著降低(P<0.01),其中,Thea含量为13.24 mg/g,EGCG和GCG未检出。 结果表明,菌株T12能使绿茶中多酚类物质发生明显转化,同时也可以促进绿茶中黄酮类化合物的积累。 经过菌株T12发酵,绿茶中的游离氨基酸含量下降,可能是因为一部分氨基酸组分会与糖类物质或儿茶素等结合反应,生成醛类、醌类、醇类或酸类物质,进而导致氨基酸组分含量降低[32]。经过菌株T12发酵,绿茶中的非酯型儿茶素和没食子酸含量增加,酯型儿茶素如茶氨酸含量下降,可能是因为该菌发酵过程中能分泌相应的酶(如单宁酶),进而将酯型儿茶素,分解成部分简单儿茶素类分子[33]。

图4 汉逊德巴利酵母菌T12发酵对绿茶主要特征成分含量的影响
Fig.4 Effect of Debaryomyces hansenii T12 fermentation on the content of main characteristic components in green tea
ND表示未检出。
2.3 汉逊德巴利酵母菌T12发酵对绿茶抗氧化活性的影响
汉逊德巴利酵母菌T12发酵对绿茶抗氧化活性的影响见图5。
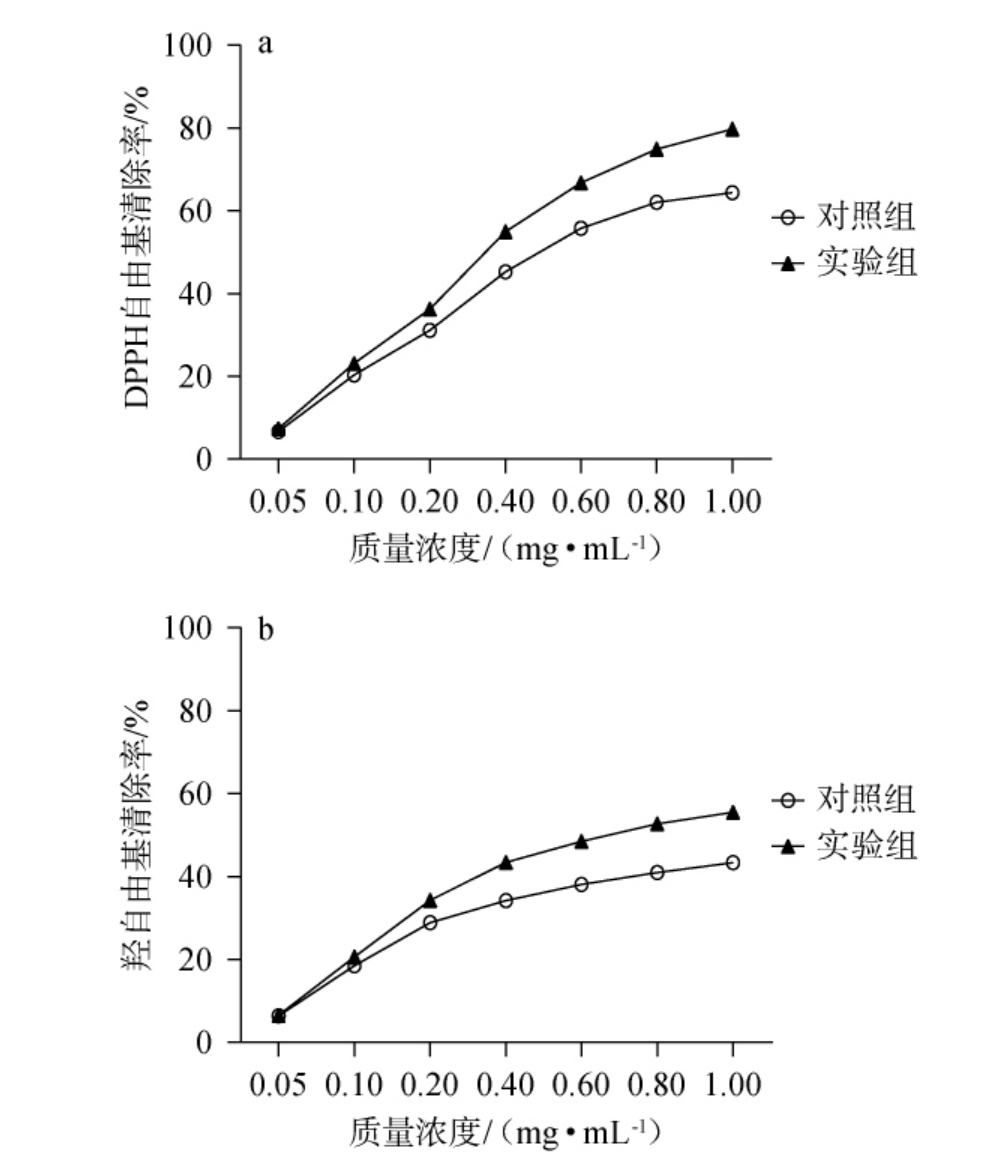
图5 汉逊德巴利酵母菌T12发酵对绿茶DPPH自由基(a)及羟自由基(b)清除能力的影响
Fig.5 Effect of Debaryomyces hansenii T12 fermentation on the scavenging ability of DPPH free radicals (a) and hydroxyl free radicals (b) in green tea
由图5可知,随着发酵绿茶样品质量浓度的升高,DPPH自由基和羟基自由基清除率均呈升高的趋势,且当发酵绿茶样品质量浓度>0.05 mg/mL之后,实验组对DPPH和羟基自由基的清除能力明显高于对照组。当发酵绿茶样品质量浓度为1.0 mg/mL时,对DPPH自由基和羟基自由基清除能力最强,其清除率分别为(79.75±0.75)%和(64.38±0.58)%。综上,菌株T12发酵绿茶能增强其抗氧化能力。
2.4 发酵绿茶对UVB致HaCaT细胞损伤的保护作用研究
发酵绿茶对HaCaT细胞生长活性的影响及其对UVB辐射致HaCaT细胞损伤的保护作用见图6。
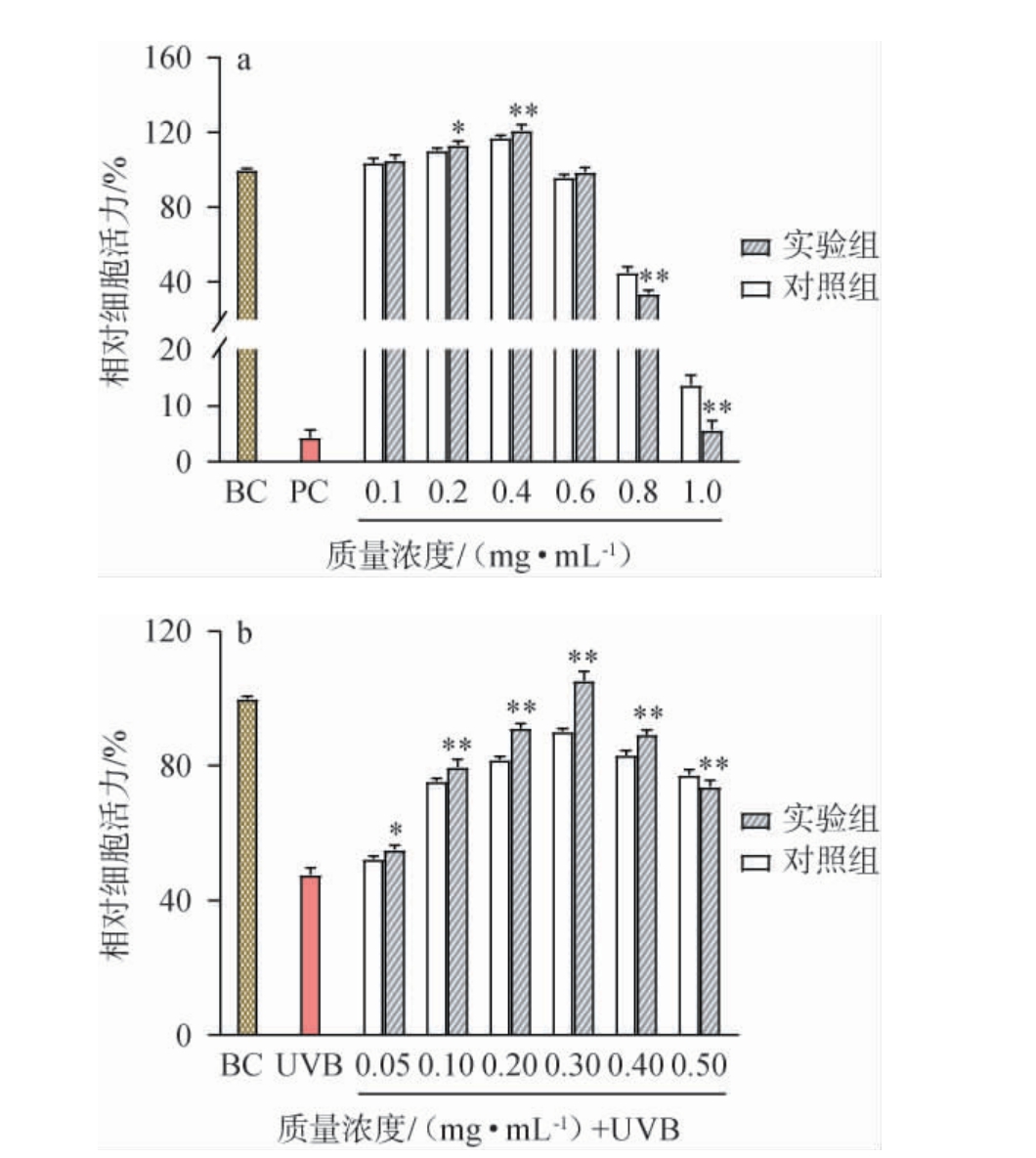
图6 发酵绿茶样品对人永生化角质形成细胞生长的影响(a)及其对紫外线B辐射致人永生化角质形成细胞损伤的保护作用(b)
Fig.6 Effect of fermented green tea samples on the growth of human immortalized keratinocytes (a) and its protective effect on the damage of human immortalized keratinocytes caused by ultraviolet B radiation (b)
与对照组相比,“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01)。下同。
由图6a可知,与空白对照组相比,对照组和实验组发酵绿茶样品质量浓度在0.4 mg/mL以内能适度促进正常HaCaT细胞增殖,未表现出明显的细胞毒性,且在质量浓度为0.2~0.4 mg/mL之间,实验组中HaCaT细胞存活率显著高于对照组(P<0.01或P<0.05)。基于此,进一步探讨不同安全剂量组对UVB致HaCaT细胞损伤的保护效果。由图6b可知,与空白对照组相比,模型组HaCaT细胞的相对细胞活力明显降低,说明UVB损伤了HaCaT细胞,模型构建成功。与模型组相比,对照组和实验组发酵绿茶样品在质量浓度为0.05~0.5 mg/mL之间时可有效保护HaCaT细胞的紫外损伤,且在质量浓度为0.05~0.4 mg/mL之间,实验组中HaCaT细胞存活率显著高于对照组(P<0.01或P<0.05),说明绿茶经菌株T12发酵后能提高绿茶对UVB辐射致HaCaT细胞损伤的保护作用。
2.5 发酵绿茶对HaCaT细胞线粒体活性氧簇生成的影响
皮肤细胞在UVB照射下会诱导活性氧物质(如羟基自由基、超氧阴离子及过氧化物自由基)的过量生成,进而引发氧化应激反应,并通过ROS介导的信号级联途径促进细胞凋亡或死亡[34-35]。在正常有氧代谢中,线粒体内膜电子传递链的电子泄漏会导致ROS积累,而UVB辐射可进一步加剧线粒体ROS水平[35]。 因此,采用UVB辐射HaCaT细胞,考察发酵绿茶对HaCaT细胞线粒体ROS生成的影响,结果见图7和表1。
表1 发酵绿茶样品对人永生化角质形成细胞活性氧簇生成水平的影响
Table 1 Effect of fermented green tea samples on the level of reactive oxygen species production in human immortalized keratinocytes
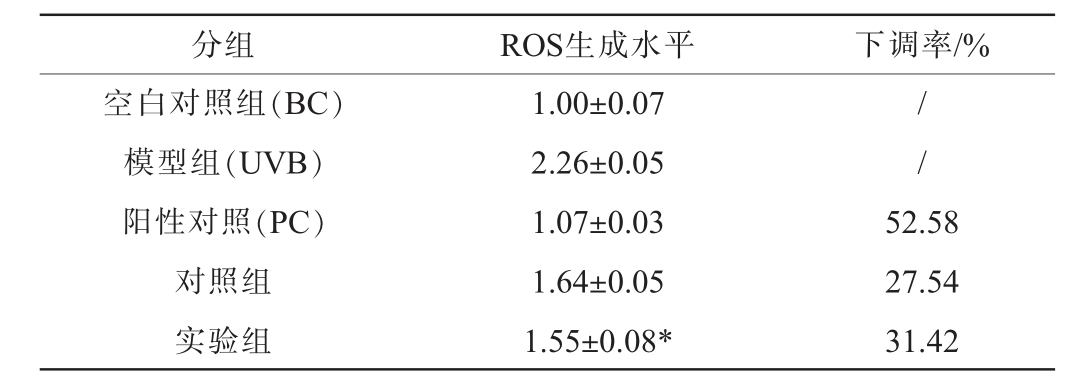
分组 ROS生成水平 下调率/%空白对照组(BC)模型组(UVB)阳性对照(PC)对照组实验组1.00±0.07 2.26±0.05 1.07±0.03 1.64±0.05 1.55±0.08*//52.58 27.54 31.42
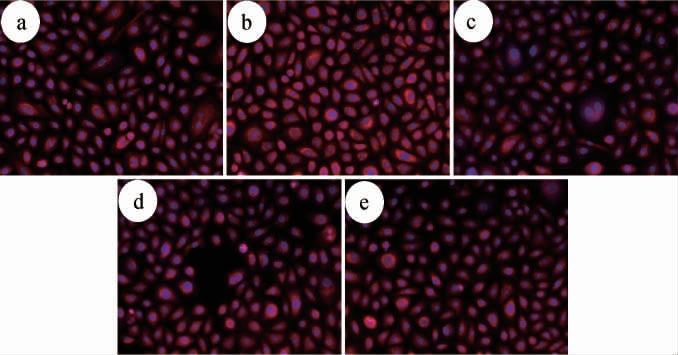
图7 不同样品对人永生化角质形成细胞活性氧簇生成的荧光图像比较
Fig.7 Comparison of fluorescence images of reactive oxygen species generation in human immortalized keratinocytes from different samples
a为空白对照组;b为模型组;c为阳性对照组;d为对照组;e为实验组。
由图7可知,模型组的荧光信号强度明显高于空白对照组,且阳性对照组、对照组及实验组的荧光信号强度介于两者之间。由表1可知,与空白对照组(1.00±0.07)相比,模型组ROS生成量(2.26±0.05)明显升高,表明UVB诱导的HaCaT细胞内ROS水平明显升高,模型构建成功。与模型组比较,阳性对照组(1.07±0.03)、对照组(1.64±0.05)及实验组(1.55±0.08)的ROS生成量明显下降,且阳性对照组下调率最高达52.58%,其次为实验组(31.42%)。此外,实验组ROS生成量显著低于对照组(P<0.05)。 分析原因可能是,汉逊德巴利酵母菌T12在发酵过程中可分泌糖苷酶,催化大分子多酚(如EGCG)降解为小分子酚酸(如没食子酸),同时促进茶黄素等次级抗氧化产物的合成,从而协同增强自由基清除能力,提高抗氧化活性。结果表明,绿茶经汉逊德巴利酵母菌T12发酵后可有效提高期抑制UVB诱导的ROS生成的提高,但提高效果弱于VE,本研究为开发天然抗氧化剂用于皮肤光损伤防护提供了理论依据。
3 结论
本研究从新鲜黄金桂茶叶中分离筛选得到一株具有提高抗氧化活性的内生真菌,编号为T12,经形态学分析和26S rDNA序列比对,鉴定其为汉逊德巴利酵母(Debaryomyces hansenii)。利用菌株T12与绿茶共发酵,结果发现,绿茶经菌株T12发酵后,pH降低至4.37,多酚、总黄酮和总儿茶素含量分别提高34.01%、25.13%和63.60%,游离氨基酸含量降低35.52%,酯型儿茶素的含量极显著降低(P<0.01),而非酯型儿茶素和没食子酸的含量极显著升高(P<0.01);DPPH自由基和羟基自由基清除能力均升高,抗氧化能力增强;显著促进HaCaT细胞增殖活性,提高了UVB辐射诱导的HaCaT细胞损伤的保护作用,降低了细胞内ROS的生成。 本研究结果可为微生物发酵茶的菌种筛选及绿茶的深度加工利用提供理论和技术依据。
[1]邹礼根,丁玉庭,陈艳.微生物在发酵茶饮料中的应用[J].食品工业科技,2004(1):23-24.
[2]YANG Y,PENG J,LI Q,et al.Optimization of pile-fermentation process,quality and microbial diversity analysis of dark hawk tea(Machilus rehderi)[J].LWT-Food Sci Technol,2024,192:115707.
[3]翟淑红,黄锦悦,周婷钰,等.8种发酵茶茶多酚含量及抗氧化活性分析[J].中国酿造,2022,41(8):179-183.
[4]AUNG T,KIM M J.A comprehensive review on kombucha biofilms: A promising candidate for sustainable food product development[J].Trends Food Sci Technol,2024,144:104325.
[5]冯雪娜,李啸,李建华,等.乳酸菌发酵红茶饮料主要营养成分变化[J].中国酿造,2022,41(2):183-186.
[6]DE OLIVEIRA P V,DA SILVA JU′NIOR A H,DE OLIVEIRA C R S,et al.Kombucha benefits,risks and regulatory frameworks:A review[J].Food Chem Adv,2023,2:100288.
[7]PAN H,LE M, HE C, et al.Dark tea: A popular beverage with possible medicinal application[J].Chinese Herbal Medicines,2023,15(1):33-36.
[8]YOO A,SEO H D,HAHM J H,et al.Dark tea extract attenuates age-related muscle loss by suppressing oxidative stress and inflammation in skeletal muscle of mice[J].J Funct Food,2024,112:105980.
[9]BHUYAN L P,BORAH,P,SABHAPONDIT S,et al.Spatial variability of theaflavins and thearubigins fractions and their impact on black tea quality[J].J Food Sci Technol,2015,52(12):7984-7993.
[10]ZHOU D D,SAIMAITI A,LUO M,et al.Fermentation with tea residues enhances antioxidant activities and polyphenol contents in kombucha beverages[J].Antioxidants,2022,11(1):155.
[11]WANG X,WANG D,WANG H,et al.Chemical profile and antioxidant capacity of Kombucha tea by the pure cultured Kombucha[J].LWT-Food Sci Technol,2022,168:113931.
[12]KING A,DICKINSON J.Biotransformation of monoterpene alcohols by Saccharomyces cerevisiae,Torulaspora delbrueckii and Kluyveromyces lactis[J].Yeast,2000,16(6):499-506.
[13]NGQUMBA Z,NTUSHELO N,JOLLY N, et al.Effect of Torulaspora delbrueckii yeast treatment on flavanols and phenolic acids of Chenin blanc wines[J].South Afr J Enol Viticult,2017,38(2):192-201.
[14]杨煌建,陈洲琴,郑木创,等.基于非靶代谢组学分析茶源微生物发酵对晒青绿茶特征化合物的影响[J].农业生物技术学报,2024,32(12):2859-2870.
[15]戴婧婧,车木勇,胡佳佳.梵净山藤茶内生菌的分离及其抑菌活性的初步研究[J].河南农业,2020(32):28-30.
[16]郑美慧,田玉凤,桂荣娟,等.茶叶中生物碱检测方法的研究进展[J].食品安全质量检测学报,2019,10(21):7194-7199.
[17]中华人民共和国工业和信息化部.QB/T 5206—2019 植物饮料 凉茶[S].北京:中国轻工业出版社,2019.
[18]国家市场监督管理总局,中国国家标准化管理委员会.GB/T 8313—2018 茶叶中茶多酚和儿茶素类含量的测定[S].北京:中国标准出版社,2018.
[19]朱小兰,陈波,罗旭彪,等.高效液相色谱法测定茶叶中的茶氨酸[J].色谱,2003,21(4):400-402.
[20]BREUER U,HARM H.Debaryomyces hansenii-an extremophilic yeast with biotechnological potential[J].Yeast,2006,23:415-437.
[21]HALLEN-ADAMS H E, SUHR M J.Fungi in the healthy human gastrointestinal tract[J].Virulence,2017,8:352-358.
[22]SØRENSEN L M,GORI K,PETERSEN M A,et al.Flavour compound production by Yarrowia lipolytica, Saccharomyces cerevisiae and Debaryomyces hansenii in a cheese-surface model[J].Int Dairy J,2011,21:970-978.
[23]井敏敏.芒果露水斑病病原菌分离鉴定及其拮抗菌筛选[D].海口:海南大学,2017.
[24]OCHANGCO H S,GAMERO A,SMITH I M,et al.In vitro investigation of Debaryomyces hansenii strains for potential probiotic properties[J].World J Microb Biot,2016,32:1-13.
[25]WRENT P,RIVAS EM,GIL DE PRADO E,et al.Development of speciesspecific primers for rapid identification of Debaryomyces hansenii[J].Int J Food Microbiol,2015,193:109-113.
[26]ANGULO M,RAMOS A,REYES-BECERRIL M,et al.Probiotic Debaryomyces hansenii CBS 8339 yeast enhanced immune responses in mice[J].3 Biotech,2023,13(1):28.
[27]REYES-BECERRIL M,SALINAS I,CUESTA A,et al.Oral delivery of live yeast Debaryomyces hansenii modulates the main innate immune parameters and the expression of immune-relevant genes in the gilthead seabream (Sparus aurata L.)[J].Fish Shellfish Immunol, 2008, 25(6):731-739.
[28]MORALES-LANGE B,DJORDJEVIC B,GAUDHAMAN A,et al.Dietary inclusion of hydrolyzed Debaryomyces hansenii yeasts modulates physiological responses in plasma and immune organs of Atlantic salmon(Salmo salar) parr exposed to acute hypoxia stress[J].Front Physiol,2022,13:836810.
[29]CESEÑA C E,JACINTO E C,GONZÁLEZ A L,et al.Dietary supplementation of Debaryomyces hansenii enhanced survival,antioxidant and immune response in juvenile shrimp Penaeus vannamei challenged with Vibrio parahaemolyticus[J].Trop Subtrop Agroecosyst,2021,24(2):71.
[30]XIAO Y,ZHONG K,BAI J R,et al.The biochemical characteristics of a novel fermented loose tea by Eurotium cristatum(MF800948)and its hypolipidemic activity in a zebrafish model[J].LWT-Food Sci Technol,2020,117:108629.
[31]宛晓春,李大祥,张正竹,等.茶叶生物化学研究进展[J].茶叶科学,2015,35(1):1-10.
[32]XIAO Y,LI M Y,LIU Y,et al.The effect of Eurotium cristatum(MF800948)fermentation on the quality of autumn green tea[J].Food Chem,2021,358:129848.
[33]夏涛,高丽萍,刘亚军,等.茶树酯型儿茶素生物合成及水解途径研究进展[J].中国农业科学,2013,46(11):2307-2320.
[34]HIBBERT S A,WATSON R E B, GRIFFITHS C E M, et al.Selective proteolysis by matrix metalloproteinases of photo-oxidised dermal extracellular matrix proteins[J].Cell Signal,2019,54:191-199.
[35]WEI M,HE X,LIU N,et al.Role of reactive oxygen species in ultraviolet-induced photodamage of the skin[J].Cell Div,2024,19(1):1.