黄酒可根据使用酒曲分为麦曲黄酒、红曲黄酒和小曲黄酒[1],其中,红曲黄酒采用糯米为原料,辅以红曲和酒曲作为酿造酒曲经过20~30 d速酿或90~120 d长酿而成,成品酒体呈棕红色,香气浓郁而独特,口感甜爽且醇厚,并具有调节血脂水平[2]、抗氧化和抗疲劳[3]等保健作用。 红曲黄酒的主要产区在福建和浙江地区,不同地区使用的红曲及白药种类均不同,造成红曲酒风味亦有所差异[4]。
天台红曲酒为浙江台州的特色红曲酒,其历史可追溯至元代[5]。酿造用水取自谓有“天下十七泉”的优质天台山山泉,其水质甘甜、清澈,富含多种微量元素,独特的环境气候和优质的酿酒用水造就天台山红曲酒的风味独特[6],福建地区大多使用古田红曲或乌衣红曲制酒,其优势微生物为黑曲霉(Aspergillus niger)、紫红曲霉(Monascus purpureus)和芽孢杆菌属(Bacillus)等[7],乌衣红曲比古田红曲具有更高的真菌物种丰富度[8],乌衣红曲酒有较强的果香、奶酪香和曲香,而古田红曲酒有较强的曲香和药草香[9];研究表明,葡糖酸醋酸杆菌属(Gluconacetobacter)、嗜酸乳杆菌(Lactobacillus acidophilus)、酿酒酵母属(Saccharomyces)、异常威克汉姆酵母属(Wickerhamomyces)与酿造过程中的挥发性风味物质呈正相关[10]。山东地区亦有红曲制作,其主要优势微生物为毕赤酵母属(Pichia)、红曲霉属(Monascus)以及魏斯氏菌属(Weissella)[11]。但目前,关于浙江台州天台红曲酒微生物菌群及其风味品质的研究报道较少。
本研究以天台红曲酒的酿造用曲和发酵醪液为研究对象,利用高通量测序技术,分析酒曲和红曲的微生物结构组成以及红曲酒在酿造过程中的菌群结构变化规律,固相微萃取(solid-phase microextraction,SPME)结合气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术分析酒样中的挥发性风味成分,探究天台红曲酒酿造过程中菌群结构与挥发性风味成分之间的关联性,以期明确天台红曲酒发酵过程中微生物组成与风味特征变化,为天台红曲酒优势微生物筛选及其风味品质提升提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
红曲、酒曲、糯米:取自浙江台州天台县某酒厂。
1.1.2 试剂
R6550-01 脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国OMEGA公司;P7589Quant-iTTMPicoGreenTM dsDNA荧光定量试剂盒:美国赛默飞世尔科技公司;N411-01 VAHTSTM DNA Clean Beads磁珠:南京诺唯赞公司;NP-101-1001 TruSeq Nano DNA LT Library Prep Kit:美国Illumina公司;Biowest Agarose琼脂糖:上海贝晶生物技术有限公司;甲醛、无水乙醇(均为分析纯):天津市大茂化学试剂厂;氢氧化钠、无水葡萄糖(分析纯):西陇科学股份有限公司;硫酸铜、磷酸氢二钠、酒石酸钾钠(分析纯):天津市致远化学试剂有限公司;丁二酸二乙酯、甲酸乙酯、乙缩醛、甲醇、异戊醛、丙酸乙酯、2,3-丁二酮、仲丁醇、正丙醇、戊酸乙酯、正丁醇、β-苯乙醇、丁二酸二乙酯、乙酸异戊酯、乳酸乙酯、乙酸、苯甲醛、糠醛、丁酸乙酯、辛酸乙酯、乙醛等(均为色谱纯):上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
NanoDropOne超微量紫外分光光度计:美国赛默飞世尔科技公司;C1000 Touch聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;Illumina Miseq PE300测序仪:美国Illumina公司;BG-Power 600电泳仪:上海贝晶生物技术有限公司;Clarus 600型GC-MS仪:美国Perkin Elmer公司;E-WAX ETR色谱柱(30 m×0.25 μm×0.50 μm):美国安捷伦公司;85 μmPA萃取头:美国Supelco公司。
1.3 方法
1.3.1 红曲酒酿造工艺流程及操作要点

操作要点:
浸米、冲洗、蒸饭、摊凉:使用当地生产用水浸泡糯米直至糯米可用手碾碎后,用水冲洗至无明显白浆流出后沥干,将糯米蒸至无白心,蒸好后的糯米饭吹风摊凉至35 ℃左右。
红曲液及酒母的制备:称一定质量红曲,以红曲与清水的质量比为1∶5加入清水,浸泡12 h制成红曲液,于糯米饭中加入1%酒曲(以糯米饭质量计)搭窝发酵2~3 d制成酒母。
落缸发酵:于糯米饭中加入50%红曲液及5%酒母(以糯米饭质量计),搅拌均匀,于27 ℃条件下发酵,总糖含量<2 g/L时结束发酵。
压榨、澄清、过滤、杀菌:发酵完成后的料液使用压滤机进行压榨,滤液进入澄清罐收集,静置澄清后,上清液经过滤机过滤后于85 ℃杀菌45 min。
装坛、贮存、勾调:将上述滤液灌装于经蒸汽杀菌过的陶坛中于10~20 ℃贮存陈化3~5年,陈化后经调酒师进行勾调,控制每批次红曲酒品质一致,制得红曲酒成品。
1.3.2 理化指标测定
总酸、总糖、氨基酸态氮的测定:参照GB/T 13662—2018《黄酒》中的方法;酒精度的测定:参照GB 5009.225—2023《食品安全国家标准 酒和食用酒精中乙醇浓度的测定》中密度瓶法。
1.3.3 DNA提取、PCR扩增、高通量测序
DNA提取:使用OMEGA公司R6550-01试剂盒对红曲、酒曲及红曲酒发酵液样品进行总DNA提取,通过NanoDrop One超微量紫外分光光度计对DNA进行定量,通过1.2%琼脂糖凝胶电泳检测DNA提取质量(选择条带无弥散或拖尾样品进行PCR扩展)。
PCR扩增: 采用通用引物338F(5'-ACTCCTACGGGAG GCAGCA-3')与806R(5'-GGACTACHVGGGTWTCTAAT-3')和ITS1(5'-TCCGTAGGTGAACCTGCGG-3')与ITS2(5'-GCTGCGTTCTTCATCGATGC-3')分别对细菌V3~V4区间和真菌ITS1区间进行PCR扩增。 PCR扩增体系(25 μL):10(buffer 2.5 μL,脱氧核糖核苷酸三磷酸(deoxy-ribonucleoside triphosphate,dNTP)2 μL,Taq DNA聚合酶(5 U/μL)0.3 μL,正向、反向引物各1 μL,DNA 1 μL,超纯水17.2 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性45 s;50 ℃(细菌)/53 ℃(真菌)退火30 s,72 ℃延伸35 s(细菌)/45 s(真菌),共计35个循环;最后72 ℃延伸5 min(细菌)/8 min(真菌)。
扩增产物采用磁珠纯化回收,对PCR扩增回收产物用荧光试剂进行荧光定量。通过Illumina公司的TruSeq Nano DNA LT LibraryPrep Kit制备测序文库,采用Illumina MiSeq平台对酒曲DNA片段进行双端Paired-end测序。 高通量测序原始数据通过QIIME2软件进行分析处理,通过调用软件内设DADA2方法进行质控、降噪,得到扩增子序列变异体(amplicon sequence variants,ASV)序列,利用reengenes数据库和UNITE数据库对样品中细菌、真菌进行物种分类学注释。
1.3.4 挥发性风味物质测定
采用固相微萃取(SPME)结合气质联用(GC-MS)仪对红曲酒中的挥发性风味物质进行测定[12]。
SPME条件:取红曲酒发酵液样品5 mL放入顶空瓶中,加入3.0 g NaCl后加入30 μL 2-辛醇(内标液,质量浓度164 mg/L),在50 ℃条件下振荡15 min后萃取吸附45 min,250 ℃解吸5 min。
GC条件:进样口温度220 ℃,载气为高纯氦气(纯度≥99.999%),流速1 mL/min,不分流进样;初始温度35 ℃,保持2 min,随后以4 ℃/min升温至80 ℃后,以2 ℃/min升温至140 ℃,后以5 ℃/min升温至230 ℃。
MS条件:电子电离(electronic ionization,EI)源,离子源温度和传输线温度均250 ℃,电子能量70 eV,扫描范围30~550 amu。
定性定量分析:挥发性风味物质根据标准品色谱保留时间和美国国家标准技术研究所(national institute of standards and technology,NIST)数据库比对分析定性,采用内标半定量法对红曲酒中挥发性风味物质进行计算,其计算公式如下:
气味活度值计算:气味活度值(odoractivityvalue,OAV)是风味物质含量与阈值之间的比值,通常用来评价风味物质对整体香气的影响,OAV≥1的挥发性风味物质对香气形成有贡献,为关键挥发性风味物质,OAV≥10的挥发性风味物质对香气形成有显著影响[13]。
1.3.5 数据处理与统计分析
所有实验均重复进行3次,数据以“平均值±标准差”表示,采用Excel 2021对数据进行处理,使用ChiPlot网站进行相关性分析及热图绘制,使用Origin 2018进行绘图。
2 结果与分析
2.1 红曲、酒曲及红曲酒发酵过程中微生物菌群Alpha多样性分析
采用Alpha多样性指数来评估样品中的物种丰富度及其多样性,Chao1指数用于表征物种的丰富度,Shannon指数和Simpson指数用于表征物种的多样性,其中Chao1指数和Shannon指数越大,物种的丰富度和多样性越高[14]。
红曲、酒曲及红曲酒发酵过程中微生物菌群Alpha多样性分析见表1。 由表1可知,红曲酒酿造用曲及其酿造过程中细菌和真菌菌群覆盖度均≥99.7%,表明测序结果能够全面反映微生物结构的信息。红曲样品真菌的Chao1指数高于细菌,细菌的Shannon和Simpson指数明显高于真菌,说明红曲中真菌的物种丰富度优于细菌,但红曲中细菌多样性优于真菌。 相对而言,酒曲中细菌的Chao1指数、Shannon指数和Simpson指数均高于其真菌,因此,酒曲中细菌在物种多样性和丰富度较高。 与酒曲相比,红曲中真菌的物种多样性和丰富度较优,且红曲细菌的物种多样性多于酒曲,而物种丰富度低于酒曲。因此,总体上看,红曲微生物多样性优于酒曲微生物多样性。
表1 红曲、酒曲及红曲酒发酵过程中微生物菌群Alpha多样性分析Table 1 Alpha diversity analysis of microbial flora of Hongqu, Jiuqu and Hongqu rice wine during fermentation process
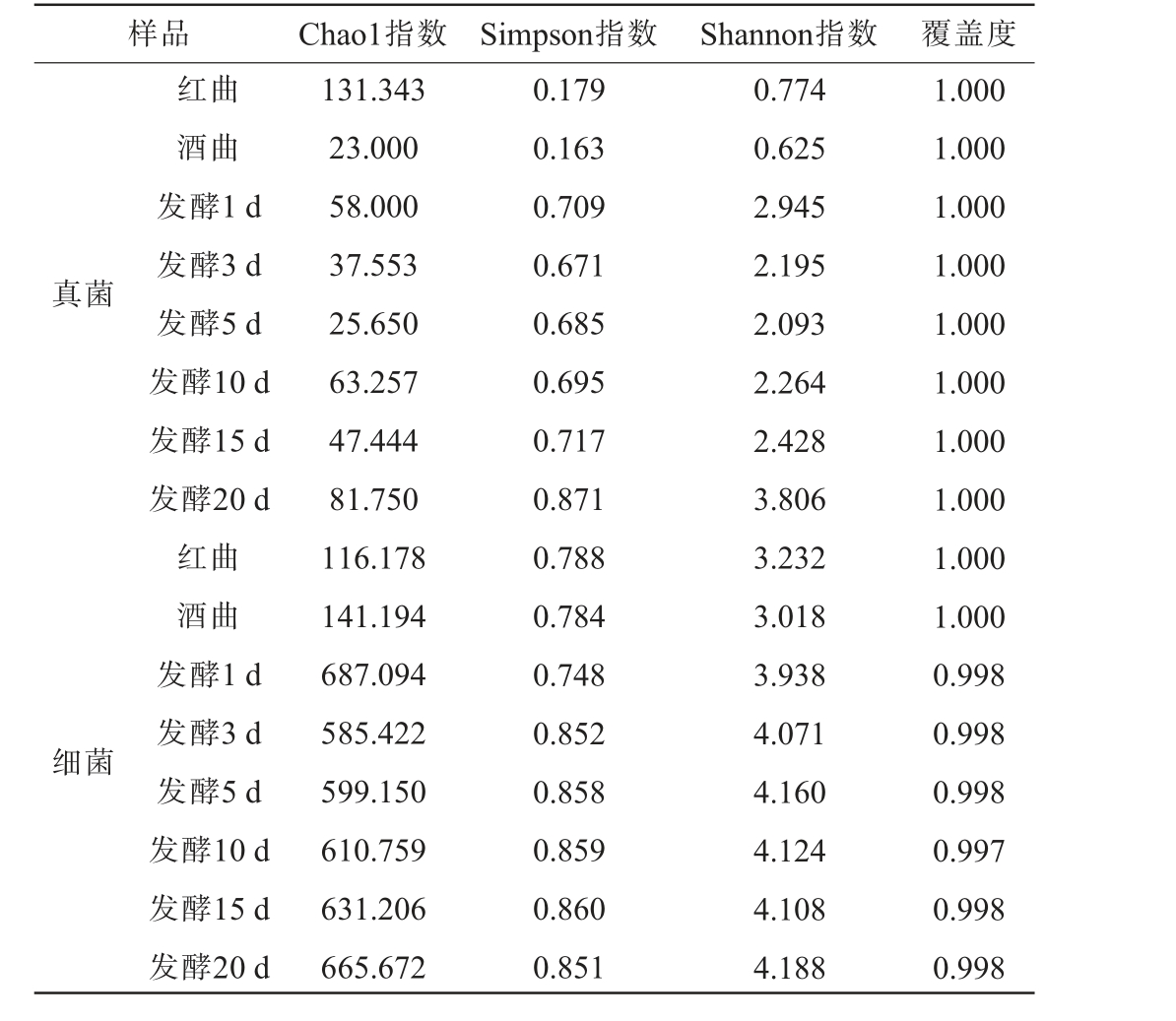
样品 Chao1指数 Simpson指数 Shannon指数 覆盖度真菌细菌红曲酒曲发酵1 d发酵3 d发酵5 d发酵10 d发酵15 d发酵20 d红曲酒曲发酵1 d发酵3 d发酵5 d发酵10 d发酵15 d发酵20 d 131.343 23.000 58.000 37.553 25.650 63.257 47.444 81.750 116.178 141.194 687.094 585.422 599.150 610.759 631.206 665.672 0.179 0.163 0.709 0.671 0.685 0.695 0.717 0.871 0.788 0.784 0.748 0.852 0.858 0.859 0.860 0.851 0.774 0.625 2.945 2.195 2.093 2.264 2.428 3.806 3.232 3.018 3.938 4.071 4.160 4.124 4.108 4.188 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 1.000 0.998 0.998 0.998 0.997 0.998 0.998
红曲酒酿造过程中真菌、细菌Chao1指数呈先下降后升高的趋势,而Shannon指数和Simpson指数无明显变化,说明其丰富度先减少后增加,物种多样性趋于稳定。因此,在红曲酒发酵过程中,真菌及此菌细菌物种的丰富度有所变化,而物种多样性及丰富度较稳定。
2.2 红曲、酒曲及红曲酒发酵过程中微生物菌群结构分析
基于属水平红曲、酒曲及红曲酒发酵过程中真菌(A)及细菌(B)群落结构分析见图1。由图1A可知,在红曲、酒曲及红曲酒发酵过程中共注释到12个优势真菌属(相对丰度≥1%),分别为红曲霉属(Monascus)、根霉菌属(Rhizopus)、酿酒酵母菌属(Saccharomyces)、Mycothermus、未分类的子囊菌门(unclassified_p_Ascomycota)、毛霉菌属(Mucor)、未分类的酵母目(unclassified_o_Saccharomycetales)、毕赤酵母属(Pichia)、假丝酵母属(Candida)、曲霉菌属(Aspergillus)、链格孢菌属(Alternaria)和德克酵母属(Dekkera);构成红曲、酒曲的菌群具有明显差异,在真菌菌群结构中,红曲中的主要真菌属为红曲霉属,相对丰度最高,达90.79%,其次是嗜热链球菌属(4.18%),酒曲中的根霉菌属的相对丰度最高,为91.96%,其次是酵母菌属(4.58%)。在红曲酒发酵过程中,微生物群落主要由根霉菌属(4.58%~51.96%)、未分类的酵母菌目(8.94%~54.26%)及酿酒酵母菌属(7.97%~23.63%)组成。 发酵3~15 d时,未分类的酵母菌目、Saccharomyces相对丰度逐渐增加,而根霉菌属相对丰度逐渐下降,发酵结束时,Pichia及Candida相对丰度较高,分别为34.26%和21.39%。根霉菌属具有快速繁殖的特性,能够分解环境中的淀粉和蛋白质,释放出可发酵性还原糖及氨基酸,从而有利于酵母的生长和繁殖[15]。
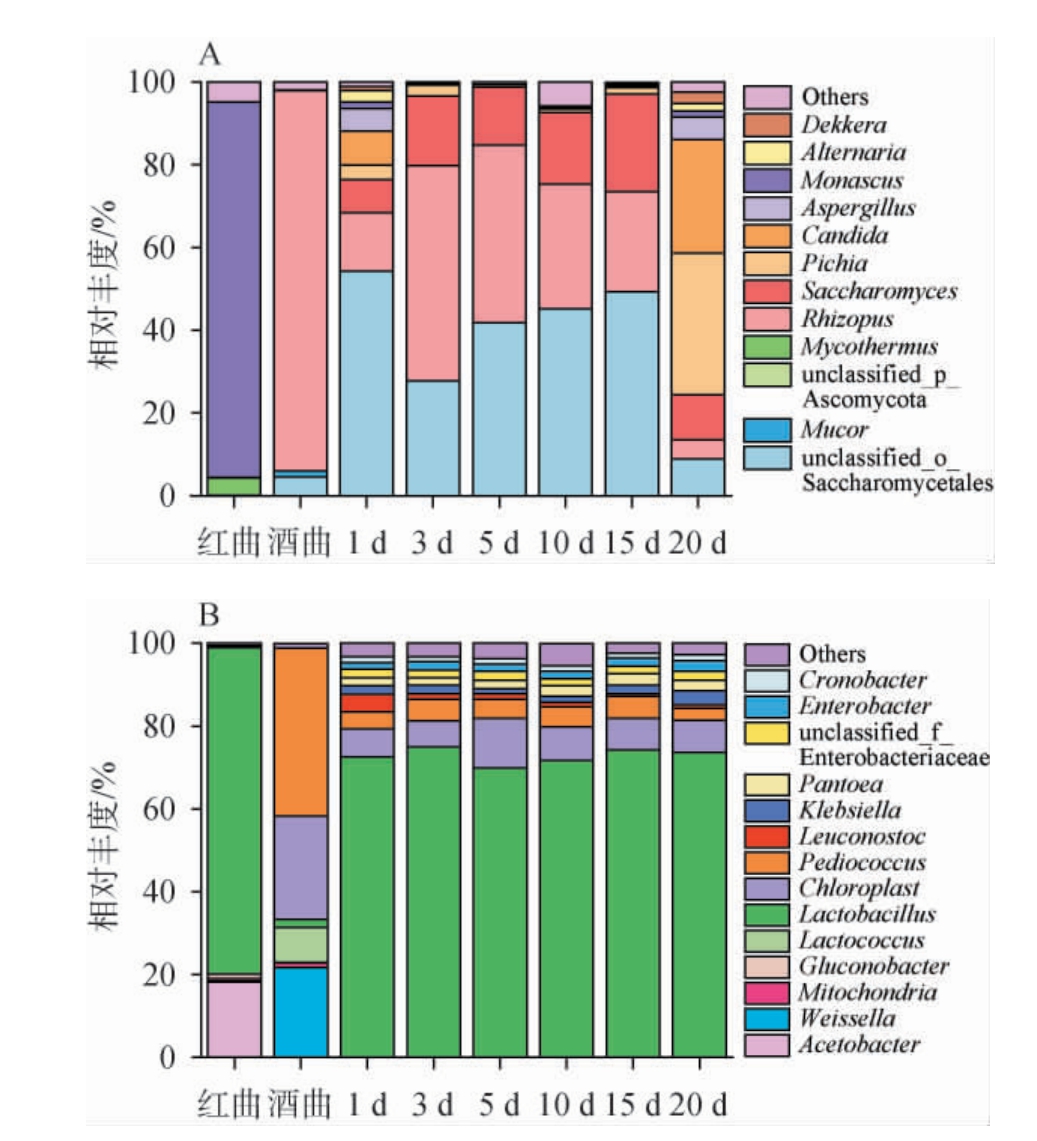
图1 基于属水平红曲、酒曲及红曲酒发酵过程中细菌(A)及真菌(B)群落结构分析
Fig.1 Community structure analysis of bacteria (A) and fungi (B) of Hongqu, Jiuqu and Hongqu rice wine during fermentation process based on genus level
在红曲酒酿造用曲及发酵过程中共注释到12种细菌菌属(相对丰度≥1%),分别为乳酸杆菌属(Lactobacillus)、片球菌属(Pediococcus)、魏斯氏菌属(Weissella)、醋酸杆菌属(Acetobacter)、乳球菌属(Lactococcus)、葡糖杆菌属(Gluconobacter)、明串珠菌属(Leuconostoc)、克雷伯氏菌属(Klebsiella)、未分类的肠杆菌科(unclassified_f_Enterobacteriaceae)、肠 杆 菌 属(Enterobacter)、泛 生 菌 属(Pantoea)和克罗诺杆菌属(Cronobacter)。 红曲以乳酸杆菌属(78.76%)、醋酸杆菌属(18.23%)和葡糖杆菌属(1.04%)为主,红曲霉生长最适pH为3.5~5.0[16],乳酸杆菌属与醋酸杆菌属并存可为红曲霉生长提供良好的酸性环境,使红曲霉更好的生长附着,同时,酸性环境亦可抑制部分杂菌生长。酒曲主要以片球菌属(40.50%)、魏斯氏菌属(21.61%)、乳球菌属(8.00%)和乳酸杆菌属(1.98%)为主。红曲酒发酵过程中主要优势菌为乳酸杆菌属,相对丰度为69.91%~74.95%,在整个发酵时保持稳定,片球菌属相对丰度在发酵过程中整体呈上升趋势,发酵1~15 d时,相对丰度由17%上升至27%,整体菌群演替变化不明显。
在红曲酒发酵过程中,真菌菌属以酒曲中的根霉菌属和酵母菌属为主,红曲中的红曲霉属在发酵过程中相对丰度降低,生长活性相对较弱;红曲酒发酵过程中出现了一些酒曲中未检测出的主要微生物(如曲霉菌属、毕赤酵母属等真菌属、明串珠菌属和克雷伯氏菌属等细菌属及假丝酵母属等酵母菌属),其原因可能是由于红曲酒的生产酿造方式为开放式,易带入酿造环境中的自然微生物[17]。
2.3 红曲酒发酵过程中理化指标分析结果
红曲酒发酵过程中理化指标测定结果见表2。由表2可知,在整个发酵过程中,总糖逐渐下降,总酸及酒精度逐渐增加,而氨基酸态氮先增加后趋于稳定。发酵前期(1~3 d)总糖含量急剧下降,总糖含量由85.17 g/L下降至9.90 g/L,发酵结束时下降至1.97 g/L,其原因可能是,根霉菌属及酵母菌属在发酵前期占主导地位,根霉菌含有丰富的淀粉酶[18],可将糯米饭中淀粉酶解成可发酵性糖,酵母菌可通过呼吸作用将糖转化为酒精[19]。酒精度由6.17%vol逐渐增加至16.77%vol,总酸含量由5.42 g/L增加至11.30 g/L,总酸含量的升高可能由乳酸杆菌代谢产生,在整个发酵时期乳酸杆菌属为优势细菌属,其可代谢产生酸性物质,提高发酵环境中的酸度[36]。天台红曲酒发酵类型属于“前急后缓”型[18]。
表2 红曲酒发酵过程中理化指标测定结果
Table 2 Detection results of physicochemical indexes of Hongqu rice wine during fermentation process
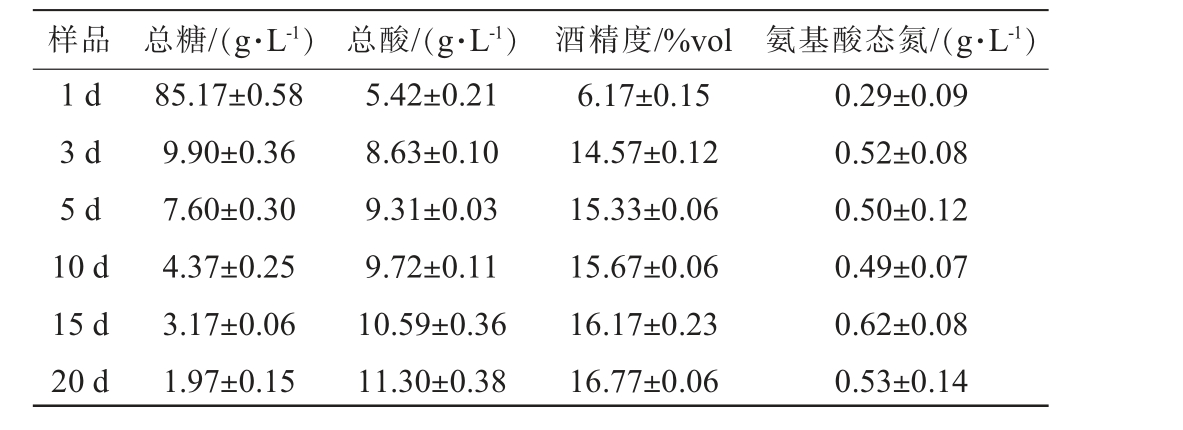
样品 总糖/(g·L-1) 总酸/(g·L-1) 酒精度/%vol 氨基酸态氮/(g·L-1)1 d 3 d 5 d 10 d 15 d 20 d 85.17±0.58 9.90±0.36 7.60±0.30 4.37±0.25 3.17±0.06 1.97±0.15 5.42±0.21 8.63±0.10 9.31±0.03 9.72±0.11 10.59±0.36 11.30±0.38 6.17±0.15 14.57±0.12 15.33±0.06 15.67±0.06 16.17±0.23 16.77±0.06 0.29±0.09 0.52±0.08 0.50±0.12 0.49±0.07 0.62±0.08 0.53±0.14
2.4 红曲酒发酵过程中挥发性风味物质含量及气味活度值分析
红曲酒发酵过程中挥发性风味物质含量及气味活度值见表3。 由表3可知,共检出挥发性风味成分17种,其中醇类8种,酯类6种,醛类2种和酮类1种。 醇类物质是红曲酒含量最高的挥发性风味物质,在发酵过程中,总含量呈先上升后下降再上升的趋势,发酵3 d时总含量达到最大值552.80 mg/L,发酵结束时达532.44 mg/L。 其中正丙醇、异丁醇、异戊醇和2,3-丁二醇含量较高,发酵结束时,其含量分别为101.87 mg/L、102.70 mg/L、97.72 mg/L、137.47 mg/L,正丙醇具有醚臭味和苦味,异丁醇具有可可香和苹果香[20],异戊醇具有明显涩味和刺激感[21],2,3-丁二醇具有甜香、奶油香[22],亦可延长酒体后味。除此之外,当异戊醇含量超过6.5 mg/L、异丁醇含量超过75 mg/L时则带有较重苦味[23]。β-苯乙醇具有玫瑰花香味,是黄酒的主要香气成分之一[24],其在红曲酒发酵过程中含量为44.10~59.18 mg/L。醇类物质由发酵液中的糖类或氨基酸经酵母代谢生成[20],其中正丙醇、异丁醇、异戊醇等属于高级醇,是酵母繁殖生长产生的次级代谢产物,主要在发酵前期产生[25],且在发酵后期逐步与酸类物质结合酯化生成酯类物质。
表3 红曲酒发酵过程中挥发性风味物质含量及气味活度值
Table 3 Contents of volatile flavor substances of Hongqu rice wine during fermentation process and odor activity values

注:“—” 表示该物质未检出。
序号 化合物 香气描述[23,31]香气阈值[13,29-30]/(mg·L-1)含量/(mg·L-1)1 d 3 d 5 d 10 d 15 d 20 d OAV 1 d 3 d 5 d 10 d 15 d 20 d 1 2 3 4 5 6 7 8 9 1<1<1<1 14.67<1<1—11.03<1 1.98 1.45 32.21 1.72<1<1 14.80<1 2.07 1.46 34.15 1.82<1<1 13.23<1 1.84 1.35 30.63 1.61<1—13.24<1 1.89 1.37 30.78 1.63<1—13.49 0 4.78±0.11 43.42±1.59 62.40±2.14 17.60±0.40 49.69±1.11 48.44±1.01—44.10±0.12 270.43±3.09—5.07±0.12——<——<1——<1——<1——<1 11 12 13 14——5.94±1.25 107.08±1.60 109.06±2.02 38.65±1.58 103.48±3.10 128.32±1.40 1.09±0.03 59.18±3.10 552.80±4.43—17.63±0.50 11.77±0.31<1甲醇正丙醇异丁醇活性戊醇异戊醇2,3-丁二醇1,2丙二醇β-苯乙醇小计甲酸乙酯乙酸乙酯乳酸乙酯丁二酸二乙酯苯乙酸乙酯乙酸苯乙酯小计乙醛乙缩醛3-羟基-2-丁酮总计苦味、草木刺激、苦味溶剂味似醇香、带汗臭味杂醇油味、刺激香水果香甜香果香、蜜香、玫瑰花香—桃香、果香奶酪、水果香味果香果香蜜香、花香花香、甜香—花香、味甜带涩水果香奶香、茶香—500.00 53.96 75.00 1.20 60.00 150.00 1400.00 4.00—2.70 32.55 128.08 353.19 0.41 0.91—1.20 2.09 150.00———6.08±1.02 102.47±1.05 108.33±1.11 38.50±0.35 101.78±1.16 108.84±1.49 0.93±0.03 48.72±0.98 515.65±2.83 1.05±0.01 22.85±0.10 48.92±2.52 2.90±0.13<1 1.90 1.44 32.08 1.70<1<1 12.18—<1<1<1<1 4.43±0.09 111.74±2.61 109.31±1.26 40.98±0.10 109.33±1.00 111.91±1.28 1.21±0.01 52.90±0.98 541.81±3.27—22.02±0.16 19.68±0.14 1.29±0.01 1.06±0.01 1.70±0.03 45.75±0.22 19.13±0.31 0.95±0.01—607.64±3.49 5.88±0.24 99.19±3.01 100.89±2.37 36.75±0.87 96.79±1.76 100.69±1.43—52.96±1.62 493.15±4.24—22.69±0.55 44.03±1.10 3.96±0.40—1.07±0.09 71.75±1.30 23.80±1.01 1.46±0.02—590.16±5.10——1——————15 16 17 5.07±0.12 75.47±1.74—22.29±0.51 373.26±3.58 29.4±0.59 42.67±0.11 2.10±0.04—626.97±5.68 75.72±2.53 21.86±0.66 6.78±0.84 101.87±3.25 102.70±2.36 36.94±1.02 97.72±2.00 132.47±2.65—53.96±1.02 532.44±5.47—22.83±0.66 85.84±1.78 8.01±1.01—1.52±0.06 118.20±2.15 14.57±1.07 18.22<1<1—1.67—12.14————35.56 1.00<1<1 2.59 1.87—15.94<1<1<1—1.18—19.83<1 613.23±3.85 665.21±5.98 62.89—<1———————————
酯类物质是红曲酒中重要的风味物质之一,赋予黄酒丰富的花香和果香味,在红曲酒发酵过程中共检出6种酯类物质,分别为乳酸乙酯、乙酸乙酯、丁二酸二乙酯、乙酸苯乙酯、苯乙酸乙酯和甲酸乙酯。在发酵过程中,总含量呈上升趋势,总酯含量由发酵起始5.07 mg/L上升至发酵结束118.20 mg/L,发酵起始,仅检出乙酸乙酯,发酵3 d时检出乳酸乙酯,含量由11.77 mg/L上升至发酵结束85.84 mg/L,乳酸乙酯是黄酒酯香中的一种特征香[26],具有奶油、水果香,且具有甜味,可以增加酒体的醇甜感、提高酒体协调性以及延长酒体味感。 乙酸乙酯在发酵过程中含量较低(5.07~22.85 mg/L),但其亦是黄酒的主要酯香物质之一,发酵过程中含量较为稳定。
醛类物质中,乙醛是使黄酒产生辛辣口感的主要物质之一,在红曲酒发酵过程中呈逐渐下降的趋势,其含量由发酵初始75.47 mg/L下降至发酵结束14.57 mg/L,这与谷晓东等[27]的研究结果一致,其认为乙醛在发酵过程中含量逐渐降低来自于酒醪中微生物降解,刘华[28]研究结果表明,黄酒中的乙醛由酿酒酵母通过丙酮酸脱羧酶产生,随着发酵的进行,其含量降低。乙缩醛由乙醛经酶缩合而成[29],常被视为白酒中的老化标志物之一[30]。3-羟基-2-丁酮亦称乙偶姻,是合成四甲基吡嗪和2,3-丁二醇的重要前体物质,四甲基吡嗪在白酒中较为常见,具有烘烤坚果香气,有利于白酒形成酱香风味,同时其还是活性生物碱成分,具有一定保健作用[31]。
根据OAV≥1,在红曲酒发酵过程中共筛选出9种关键挥发性风味物质;其中,在红曲酒发酵前期(1~3 d),共筛选出7种关键挥发性风味物质,分别为正丙醇、异丁醇、异戊醇、活性戊醇、β-苯乙醇、乙缩醛和乙醛;发酵中后期(3~21 d)共有8种关键挥发性风味物质,分别为苯乙酸乙酯、正丙醇、异丁醇、活性戊醇、异戊醇、β-苯乙醇、乙酸苯乙酯和乙醛。发酵结束时,OAV≥10的挥发性风味物质为活性戊醇(OAV=30.78)、β-苯乙醇(OAV=13.49)、乙醛(OAV=12.14),其对香气形成有显著影响。
2.5 红曲酒中微生物菌群与挥发性风味物质相关性分析
红曲酒中真菌、细菌菌群与挥发性风味物质之间的相关性分析结果见图2。 红色表示正相关,蓝色表示负相关,圆形越大表示相关性越强。 由图2A可知,链格孢菌属与正丙醇、异丁醇、活性戊醇及异戊醇呈显著负相关(P<0.05),根霉菌属与乙缩醛呈显著正相关(P<0.05),毕赤酵母属与丁二酸二乙酯呈显著正相关(P<0.05)。

图2 红曲酒中真菌(A)及细菌(B)菌群与挥发性风味物质的相关性分析热图
Fig.5 Correlation analysis heat map between fungal (A) and bacterial(B) flora and volatile flavor components of Hongqu rice wine
“*”表示显著相关(P<0.05),“**”表示极显著相关(P<0.01)。
由图2B可知,明串珠菌属与乙醛、3-羟基-2-丁酮呈极显著正相关(P<0.01),与正丙醇、异丁醇、活性戊醇、异戊醇和乙酸乙酯呈极显著负相关(P<0.01),与2,3-丁二醇呈显著负相关(P<0.05)。而乳酸菌属与挥发性风味物质相关性不强,与CHEN G M等[32]研究结果不一致,其研究结果表明耐酸乳杆菌(Lactobacillus acetotolerans)和面包乳杆菌(Lactobacillus crustorum)与大多数挥发性风味成分呈正相关,这可能与天台红曲酒发酵液中乳酸菌所含类型不同有关;此外,YUAN Y J等[33]对红曲酒酿造过程微生物研究结果表明,链球菌属、魏斯氏菌属与异丁醇和异戊醇呈正相关,泛生菌属与异丁醇呈负相关。
3 结论
本研究通过高通量测序技术对红曲、酒曲及红曲酒发酵过程中微生物菌群结构进行分析。 结果表明,红曲主要由红曲霉菌属、乳酸杆菌属和醋酸杆菌属等微生物组成,酒曲主要由根霉菌属、片球菌属、蓝细菌和魏斯氏菌属组成。 在红曲酒的发酵过程中,根霉菌属和酵母菌属为优势真菌属,发酵初期以根霉菌属为优势菌属,随着发酵时间的延长,酵母菌属的相对丰度逐渐上升。 乳酸杆菌属在整个发酵过程中均为优势菌属。 理化指标检测结果表明,红曲酒发酵过程中总糖含量快速下降,酒精度和总酸含量上升。 红曲酒发酵过程中共检出17种挥发性风味物质,基于OAV≥1共筛选出9种关键风味物质。 相关性分析结果表明,正丙醇、异丁醇、活性戊醇及异戊醇与链格孢菌属(Alternaria)呈显著负相关(P<0.05),与明串珠菌属(Leuconostoc)呈极显著负相关(P<0.01)。
本研究揭示了红曲、酒曲及红曲酒酿造过程中微生物群落演替规律,解析其挥发性风味物质,并对挥发性风味物质与微生物菌群之间的相关性进行分析,为红曲酒的产业化生产提供了科学依据。
[1]毛健.黄酒酿造关键技术与工程应用[M].北京:化学工业出版社,2020:13-14.
[2]ZHOU W B,GUO R,GUO W L,et al.Monascus yellow,red and orange pigments from red yeast rice ameliorate lipid metabolic disorders and gut microbiota dysbiosis in Wistar rats fed on a high-fat diet[J].Food Funct,2019,10(2):1073-1084.
[3]ZHANG W M,YANG J Q,LIU J,et al.Red yeast rice prevents chronic alcohol-induced liver disease by attenuating oxidative stress and inflammatory response in mice[J].J Food Biochem,2021,45(4):e13672
[4]郭伟灵,周文斌,蒋雅君,等.不同类型红曲黄酒中挥发性风味组分比较分析[J].福州大学学报(自然科学版),2018,46(4):586-592.
[5]陈伟明.元代饮食文化散论[M].广州:暨南大学出版社,2022:166.
[6]梁方.台州特产志[M].杭州:浙江人民出版社,1994:141-142.
[7]郑巳芳,程驰新笑,龙树瑺,等.基于理化指标和MiSeq高通量测序技术红曲品质及微生物类群的解析[J].食品工业科技,2023,44(18):131-138.
[8] 王智耀,卞丹,何理琴,等.红曲黄酒酿造用曲真菌菌群分析[J].中国食品学报,2019,19(1):200-206.
[9]王蒙,周志磊,姬中伟,等.红曲黄酒风味特征及其曲香参照样的研究[J].食品与发酵工业,2023,49(20):45-50.
[10]洪家丽,李秋艺,潘雨阳,等.红曲黄酒传统酿造过程挥发性风味组分及微生物菌群多样性分析[J].食品科学,2019,40(12):137-144.
[11]王智耀,卞丹,何理琴,等.红曲黄酒酿造用曲真菌菌群分析[J].中国食品学报,2019,19(1):200-206.
[12]江伟,兰玉倩,黄毅,等.固相微萃取与气相色谱-质谱联用法对不同酒龄黄酒的微量风味分析与应用[J].食品与发酵工业,2011,37(2):144-150.
[13]郝飞龙,范莹,延莎,等.山西清香型宗酒原酒与成品酒香气成分及其感官分析[J].食品科技,2018,43(3):255-261.
[14]李斌,陈亚楠,孙旭,等.Illumina MiSeq高通量测序分析红谷黄酒酒曲微生物菌群多样性[J].中国酿造,2022,41(9):86-92.
[15]郑江,伍时华,赵东玲,等.酿造糯米酒优良根霉与酵母菌株的筛选[J].中国酿造,2012,31(6):87-90.
[16]LI W,XING Y,LI A,et al.Effects of phytochrome gene from Monascus on cell development and pigment metabolism[J].Biophysical J,2022,121(3):61a-62a.
[17]PENG Q,CHEN X,ZHENG H,et al.Spatial and temporal distribution of environmental microbiota in Chinese rice wine(Huangjiu)natural fermentation wineries[J].Food Biosci,2023,55:102929.
[18]贠建民.酿造工艺学[M].兰州:甘肃科学技术出版社,2001:157.
[19]冯军,冯晓红,李可,等.酵母及其衍生物在果酒酿造中的特性及应用进展[J].中国酿造,2025,44(1):26-34.
[20]黄晓媛,钱敏,阮凤喜,等.黄酒中醇类物质的研究进展[J].食品工业,2022,43(1):237-240.
[21]王栋,经斌,徐岩,等.中国黄酒风味感官特征及其风味轮的构建[J].食品科学,2013,34(5):90-95.
[22]邓永建,陆震鸣,张晓娟,等.不同乳酸菌对液态发酵米醋总酸及风味物质的影响[J].食品科学,2020,41(22):97-102.
[23]陈文颖.黄酒苦味主要影响因素及其控制技术的研究[D].广州:华南理工大学,2022.
[24]芦智远,张耀武,李雪娟,等.固相萃取-气相色谱法测定黄酒中β-苯乙醇含量[J].食品科学,2017,38(24):213-217.
[25]孙中贯,刘琳,王亚平,等.酿酒酵母高级醇代谢研究进展[J].生物工程学报,2021,37(2):429-447.
[26]赵培城,蔡际豪,顾赛麒,等.不同酒龄传统绍兴黄酒的特征风味物质分析[J].食品科学,2020,41(22):231-237
[27]谷晓东,李素萍,杨柳青,等.红谷黄酒发酵过程中微生物多样性与理化指标、挥发性风味的相关性分析[J].食品工业科技,2022,43(23):133-143.
[28]刘华.绍兴黄酒酵母及发酵过程中乙醛的初步研究[D].无锡:江南大学,2016.
[29]刘丽丽,杨辉,荆雄,等.不同贮酒容器对凤香型白酒风味物质的影响[J].食品科学,2022,43(16):285-293.
[30]朱梦旭,范文来,徐岩.我国白酒蒸馏过程及原酒、成品酒中乙醛的研究[J].食品与发酵工业,2016,42(4):6-11.
[31]万雨薇,林琛,闫子恒,等.酱醪贝莱斯芽胞杆菌四甲基吡嗪高产菌的选育及其发酵优化[J].中国食品学报,2023,23(8):175-185.
[32]CHEN G M,LI W L,YANG Z Y,et al.Insights into microbial communities and metabolic profiles in the traditional production of the two representative Hongqu rice wines fermented with Gutian Qu and Wuyi Qu based on single-molecule real-time sequencing[J].Food Res Int, 2023,173:113488.
[33]YUAN Y J, YANG Z Y, LIANG Z H, et al.The regulatory effects of microbial community on the formation of higher alcohols and volatile flavor components in Hongqu rice wine brewing[J].Food Biosci,2023,56:103142.