酱香型白酒酒醅中的糖类物质主要有葡萄糖、果糖、麦芽糖、阿拉伯糖等,糖类物质在发酵过程中不仅是为酿酒微生物提供营养成分的重要物质,还是产生酒精等最终产物的决定性物质,糖类物质的种类和数量在一定程度上决定着白酒的产量和风味。 此外,糖类物质的变化能够在一定程度反映出酒醅中淀粉糖化与发酵速度的关系[1]。 因此对酒醅中糖类物质含量的检测有助于控制白酒生产过程和提高产品质量。
目前,糖类物质的检测方法有毛细管电泳法、电化学方法、生物传感器法、拉曼光谱法、气相色谱-质谱法、离子交换色谱法、高效液相色谱法[2-3]。其中,毛细管电泳法消耗样品量少,但分离性能差,毛细管使用寿命短,仪器易污染和损坏[4];电化学法简单、快速,但检出限较高,无法同时测定多种糖类物质[5];生物传感器法稳定性好[6],但响应时间长,灵敏度低[7];拉曼光谱法选择性差、灵敏度低、结果易受环境干扰[8-9];硅烷衍生化气相色谱-质谱联用法快速、准确[10],但碳水化合物衍生物制备困难[11-12];国标GB 5009.8—2023《食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》中采用离子交换色谱法和高效液相色谱法检测糖类物质[3],虽然灵敏、准确度高,但离子交换色谱法机械强度低,易膨胀,传质速度慢,柱效低,不耐高压[13-15],高效液相色谱法存在液相扩散系数低、固定相扩散速度慢,效率低等缺点[16-17]。
本研究采用超高效液相色谱-三重四级杆串联质谱(ultra-high performance liquid chromatogram triple quadrupole tandem mass spectrometry,UPLC-MS/MS)技术分析酱香型白酒酒醅中糖类物质(葡萄糖、果糖、麦芽糖、麦芽三糖),以期为酒醅的理化检测提供更具体的指标分析,为酱香型白酒的生产质量监控提供技术支撑。
1 材料与方法
1.1 材料与试剂
酱香型白酒酒醅:贵州省仁怀市茅台镇某酒厂提供;葡萄糖、果糖、麦芽糖、麦芽三糖标准品(纯度≥99%):美国Sigma公司;乙腈、甲醇(均为色谱级):德国默克公司;聚四氟乙烯(polytetrafluoroethylene,PTFE)微孔滤膜(0.22 μm):美国Agilent公司。
1.2 仪器与设备
Agilen 1290 Infinity II超高效液相色谱-6470B三重四极杆串联质谱仪:美国Agilent公司;Mass Hunter工作站:美国惠普公司;ACQUITY UPLC BEH Amide色谱柱(2.1×100 mm,1.7 μm):美国Waters公司;ME802E精密天平:梅特勒-托利多仪器有限公司;Master-Q去离子纯水机:上海和泰仪器有限公司;Dynamica Velocity18R台式冷冻离心机:天美仪拓实验室设备(上海)有限公司。
BEH Amide色谱柱(2.1×100 mm,1.7 μm):美国Waters公司;ME802E精密天平:梅特勒-托利多仪器有限公司;Master-Q去离子纯水机:上海和泰仪器有限公司;Dynamica Velocity18R台式冷冻离心机:天美仪拓实验室设备(上海)有限公司。
1.3 方法
1.3.1 标准溶液配制
糖类化合物标准储备溶液:分别准确称取1 g葡萄糖、果糖、麦芽糖、麦芽三糖标准品,用超纯水稀释并定容至100 mL,得到质量浓度分别为10 g/L的葡萄糖、果糖、麦芽糖、麦芽三糖储备液。
糖类化合物混合标准储备溶液:准确量取质量浓度为10g/L的单标储备液1mL于10mL容量瓶中,用乙腈/水(75∶25,V/V)定容,得到质量浓度为1 000 mg/L的混合标准工作液。用乙腈/水(75∶25,V/V)稀释混合工作液,得到质量浓度分别为0.1 mg/L、0.2 mg/L、0.4 mg/L、0.8 mg/L、1.0 mg/L、2.0 mg/L、4.0mg/L、8.0mg/L、10.0 mg/L、20.0 mg/L、40.0mg/L、80.0mg/L、100 mg/L的混合工作溶液。
1.3.2 样品预处理
精密量取2 g酱香型白酒酒醅于50 mL离心管中,加入20 mL去离子水,用匀浆机搅拌均匀,室温下振荡10 min后离心(6 000 r/min、5 min),取上清液0.4 mL于1.5 mL离心管中,加入1.2 mL乙腈/水(75∶25,V/V),离心(4 ℃、12 000 r/min)10 min后取上清液,稀释适当倍数后过0.22 μm滤膜,备用。
1.3.3 酱香型白酒酒醅中4种糖类化合物的测定
UPLC条件:选用ACQUITY UPLC BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm);柱温60 ℃,流速0.6 mL/min;流动相为含有0.1%氨水的乙酸铵(A)和乙腈(B);进样量为1 μL。 梯度洗脱条件为0~2 min,20%~15%A;2~8 min,15%~25%A;8~10 min,25%~20%A;10~12 min,20%A。
BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm);柱温60 ℃,流速0.6 mL/min;流动相为含有0.1%氨水的乙酸铵(A)和乙腈(B);进样量为1 μL。 梯度洗脱条件为0~2 min,20%~15%A;2~8 min,15%~25%A;8~10 min,25%~20%A;10~12 min,20%A。
MS条件:采用电喷雾离子(electrospray ionization,ESI)源,多重反应监测(multiple reaction monitoring,MRM)模式,在负离子扫描模式,干燥器温度(Gas Temp)200 ℃,干燥器流量(Gas Flow)10 L/min,雾化气压力(Nebulizer)40 psi,鞘气温度(Sheath Gas Temp)350 ℃,鞘气流量(Sheath Gas Flow)12 L/min,毛细管电压(Capillary)4 000 V,喷嘴电压(Nozzle Voltage)2 000 V。4种化合物的质谱参数见表1。
表1 葡萄糖、果糖、蔗糖、麦芽糖及麦芽三糖的质谱参数
Table 1 Mass spectrometry parameters of glucose, fructose,sucrose, maltose and maltotriose
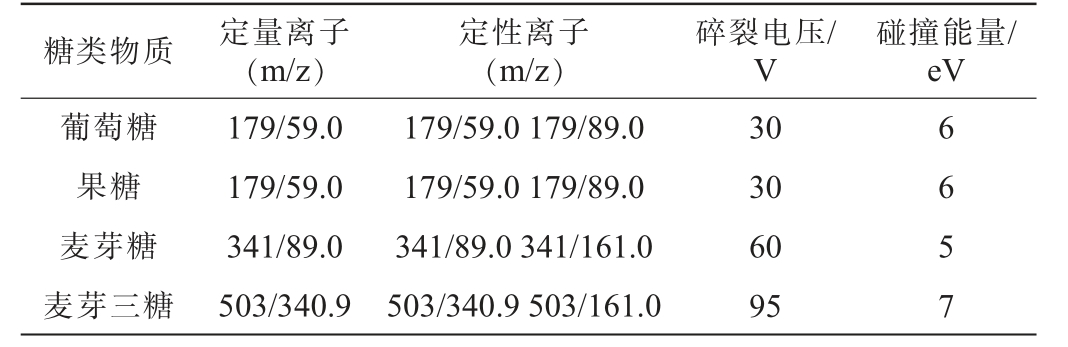
糖类物质 定量离子(m/z)定性离子(m/z)碎裂电压/V碰撞能量/eV葡萄糖果糖麦芽糖麦芽三糖179/59.0 179/59.0 341/89.0 503/340.9 179/59.0 179/89.0 179/59.0 179/89.0 341/89.0 341/161.0 503/340.9 503/161.0 30 30 60 95 6 6 5 7
定性定量分析:定性要求待测物质的色谱峰保留时间与标准溶液中相应物质的保留时间一致,变化范围在±2.5%以内[17]。采用外标方法定量,糖类化合物计算公式如下[18]:
式中:X为糖类化合物含量,mg/kg;c为标准曲线计算得到的试液中待测物质的质量浓度,mg/L;V为试液的定容体积,L;f为试液稀释倍数;m为试样的质量,kg。
1.3.4 样品前处理条件优化
在方法1.3.2的基础上,考察振荡提取时间(5 min、10 min、15 min、20 min)对响应值的影响[19]。
1.3.5 色谱条件优化
在方法1.3.3的基础上,分别考察流动相:乙腈-水、乙腈-5 mmol/L乙酸铵、乙腈-5 mmol/L乙酸铵(0.1%的氨水)对响应值的影响。
1.3.6 基质效应
酱香型白酒酒醅中含有丰富多样的基质成分,这些复杂基质成分一定程度会干扰糖类物质的检测分析,对分析物检测信号起到增强或抑制的作用,对检测结果的准确性造成不良影响,这些作用被称为基质效应[20-22]。
(1)基质标准溶液配制
称取不含目标物的空白酱香型白酒酒醅样品,按方法1.3.2处理,得到空白基质溶液,按空白基质溶液与水的体积比为1∶1混合并充分混匀,得到50%空白基质溶液。 精确量取一定质量浓度的标准溶液,用50%空白基质溶液配制成质量浓度分别为0.1 mg/L、0.2 mg/L、0.4 mg/L、0.8 mg/L、1.0 mg/L、2.0 mg/L、4.0 mg/L、8.0 mg/L、10.0 mg/L、20.0 mg/L、40.0 mg/L、80.0 mg/L、100.0 mg/L的基质标准工作溶液[20]。
(2)基质效应评估
采用斜率对比法评估基质效应(matrix effect,ME),即用基质标准溶液获得的标准曲线斜率与标准溶液(1.3.1)获得的标准曲线斜率的比值进行评估[20-22]。基质效应(ME)计算公式为酒醅基质标准溶液的线性曲线斜率及标准溶液的线性曲线斜率的比值:
ME值>1代表有基质增强作用,ME值<1代表有基质抑制作用。
1.3.7 方法学考察
(1)线性范围、检出限及定量限
配制糖类物质标准溶液,采用方法1.3.3检测,以糖类物质质量浓度(x)为横坐标,峰面积(y)为纵坐标,绘制标准曲线,得到标准曲线回归方程。分别以3倍信噪比(signal to noise ratio,S/N)和10倍信噪比(S/N)确定4种糖类物质的检出限(limit of detection,LOD)及定量限(limit of quantitation,LOQ)[23-24]。
(2)加标回收率及精密度试验
称取2 g酱香型白酒酒醅试样9份,按照样品4种待测物质含量的50%、100%和200%添加标准品进行加标回收试验,各水平重复测定6次,按照方法1.3.2 制备样品溶液,考察方法的准确度和精密度,计算平均回收率及精密度试验结果相对标准偏差(relative standard deviation,RSD)[24]。
2 结果与分析
2.1 样品前处理条件优化
酒醅中糖的常规提取方法有浸提法、振荡提取法、超声辅助提取法,浸提法利用水对植物组织的穿透性强的特点,以水做溶剂对糖类物质浸提,此法安全、经济,但耗时较长;振荡提取法是通过快速振荡使细胞壁破裂,细胞内有效成分释放出来被溶剂溶解,该法具有效率高、时间短,易操作的特点[18]。超声辅助提取法是利用超声波产生的“空化作用”对细胞膜进行破坏,有利于植物有效成分的释放,此法具有效率高、时间短、耗能低的特点[19]。振荡提取方式对糖类物质响应值的影响见图1。
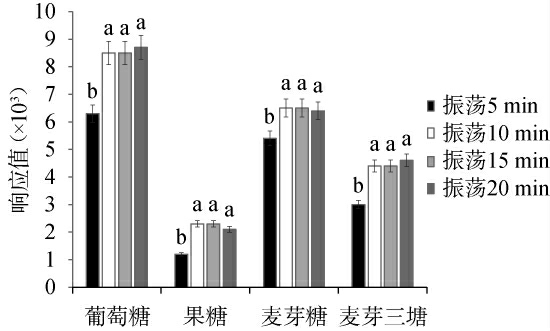
图1 振荡提取时间对糖类物质响应值的影响
Fig.1 Effects of oscillation extraction time on the response values of saccharides
同组数据不同小写字母表示数据之间具有显著性差异(P<0.05)。
由图1可知,振荡时间为5 min时,4种糖类物质的响应值最低,说明提取不完全,提取效果差;振荡时间为10 min、15 min和20 min时,4种糖类物质的响应值无显著差异(P>0.05),说明提取效果已达稳定,提取效果好。 综合考虑,选择振荡提取10 min。
2.2 色谱条件优化
不同流动相条件下4种糖类物质的超高液相色谱图见图2。由图2可知,以乙腈-水作为流动相时,果糖和葡萄糖同分异构体难以分离。在水溶液中加入5 mmol/L乙酸铵进行试验发现,乙腈-乙酸铵流动相一定程度改善了峰形和分离度,其原因可能是乙酸铵在超高效液相色谱中可用作抑制剂,防止分离物质的峰对定量的异常影响,但果糖和葡萄糖峰形仍有分叉。进一步在5 mmol/L乙酸铵流动相中加入0.1%的氨水,4种糖类物质的峰型更好、无分叉。 结果表明,当流动相加入碱性调节剂时,糖的旋光异构体会消失,有助于糖的离子化[25]。因此,选择乙腈-5 mmol/L乙酸铵(0.1%氨水)作为流动相。
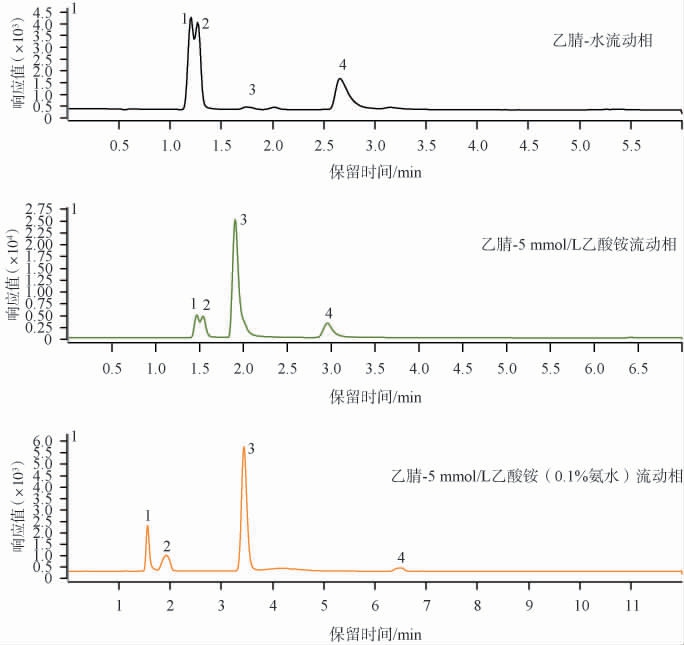
图2 不同流动相条件下4种糖类物质的超高效液相色谱图
Fig.2 Ultra-performance liquid chromatograms of four saccharides under different mobile phase conditions
1.果糖;2葡萄糖;3.麦芽糖;4.麦芽三糖。
2.3 基质效应
分别配制酒醅基质标准曲线和溶剂标准曲线,采用标准曲线斜率对比法来进行基质效应评价,结果表明,在0.1~100 mg/L范围内,两组标准工作液的标准曲线线性关系均良好。基质标准曲线斜率对溶剂标准曲线斜率的比值分别为葡萄糖1.05、果糖0.93、麦芽糖0.83、麦芽三糖0.90,均在0.8~1.2范围内,基质效应不明显,说明酒醅基质对糖类物质含量检测结果的影响较小[20-22]。
2.4 方法学验证
2.4.1 线性范围、线性方程、相关系数、检出限及定量限
4种糖类物质的线性范围、线性回归方程、相关系数、检出限和定量限见表2。 由表2可知,4种糖类物质在0.1~100 mg/L质量浓度范围内线性关系良好,相关系数(R2)均>0.998,检出限(LOD)为0.003 0~0.022 5 mg/L、定量限(LOQ)为0.010~0.075 mg/L,符合方法学要求。
表2 4种糖类物质的线性范围、线性回归方程、相关系数、检出限和定量限
Table 2 Linear range, linear regression equation, correlation coefficient, limit of detection and limit of quantification of four saccharides

序号 化合物 线性范围/(mg·L-1) 线性回归方程 相关系数(R2) LOD/(mg·L-1) LOQ/(mg·L-1)1 2 3 4葡萄糖果糖麦芽糖麦芽三糖0.1~100 0.1~100 0.1~100 0.1~100 y=3 552.9x+9 263 y=3 783.7x+11 717 y=7 311.2x+15 108 y=2 471.8x+2 870.2 0.998 1 0.998 4 0.998 9 0.999 3 0.007 5 0.007 5 0.003 0 0.022 5 0.025 0.025 0.010 0.075
2.4.2 加标回收率及精密度试验结果
4种糖类物质的加标回收率及精密度试验结果见表3。由表3可知,4种糖类物质的平均加标回收率为82%~118%,精密度试验结果相对标准偏差为0.11%~1.98%,结果符合GB/T 27404—2008《实验室质量控制规范食品理化检测》要求,表明该方法精密度和准确度良好[26-28]。
表3 4种糖类物质的加标回收率及精密度试验结果
Table 3 Spike recovery rates and precision tests results of four saccharides
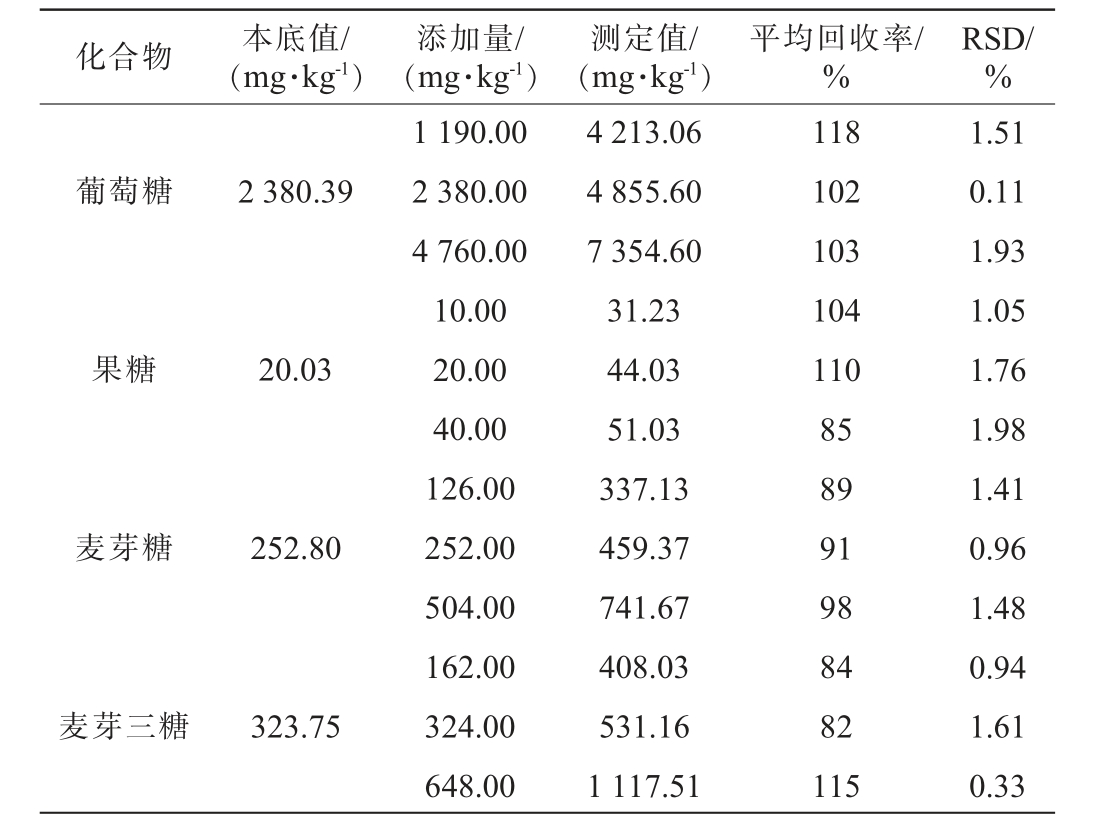
化合物 本底值/(mg·kg-1)添加量/(mg·kg-1)测定值/(mg·kg-1)平均回收率/%RSD/%葡萄糖2 380.39果糖20.03麦芽糖252.80麦芽三糖323.75 1 190.00 2 380.00 4 760.00 10.00 20.00 40.00 126.00 252.00 504.00 162.00 324.00 648.00 4 213.06 4 855.60 7 354.60 31.23 44.03 51.03 337.13 459.37 741.67 408.03 531.16 1 117.51 118 102 103 104 110 85 89 91 98 84 82 115 1.51 0.11 1.93 1.05 1.76 1.98 1.41 0.96 1.48 0.94 1.61 0.33
2.5 实际样品分析
随机抽取同一轮次不同班组堆积发酵的10个酒醅样品,将其按上述试验条件进行葡萄糖、果糖、麦芽糖和麦芽三糖含量的测定,每组样品平行取样测定3次,取平均值。结果见表4。由表4可知,在4种糖类物质中,葡萄糖含量最高(1 127~4 913.78 mg/kg),果糖在2个样品中未检出,其余样品中果糖含量为11.87~146.50 mg/kg,麦芽糖、麦芽三糖含量分别为72.96~799.49 mg/kg、76.02~828.71 mg/kg,说明葡萄糖在酒醅发酵产生酒精的过程中起主要作用,其他3种糖类物质起辅助作用。
表4 酱香型白酒酒醅样品中4种糖类物质含量检测结果
Table 4 Detection results of four saccharides contents in the fermented grains of sauce-flavor Baijiu
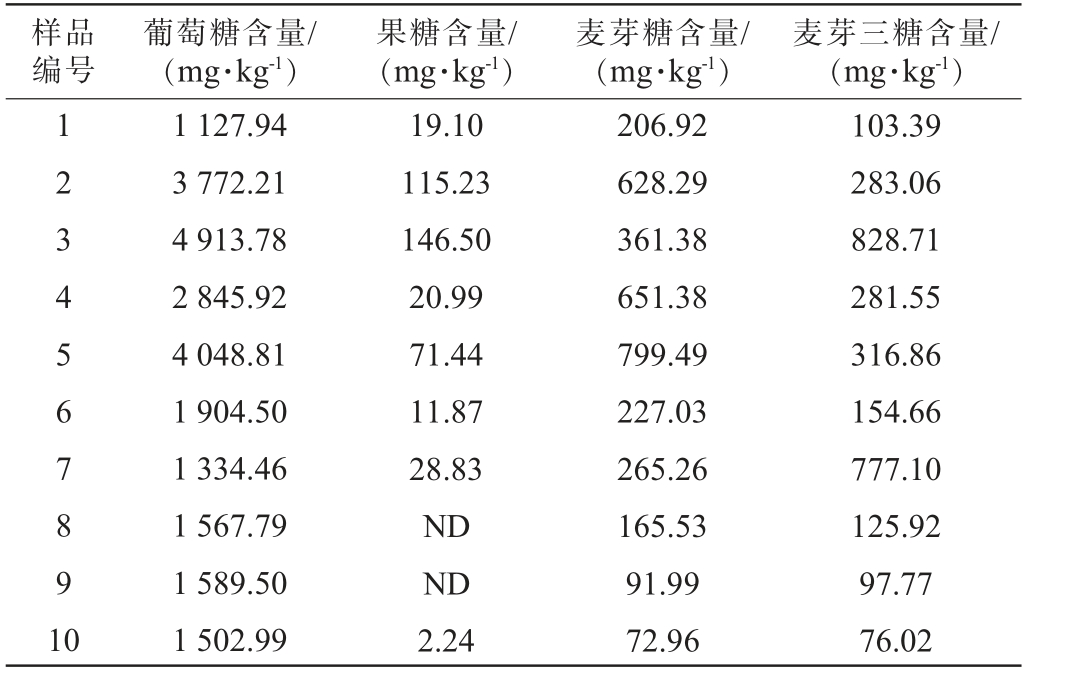
注:“ND”表示未检出。
样品编号葡萄糖含量/(mg·kg-1)果糖含量/(mg·kg-1)麦芽糖含量/(mg·kg-1)麦芽三糖含量/(mg·kg-1)1 234567891 0 1 127.94 3 772.21 4 913.78 2 845.92 4 048.81 1 904.50 1 334.46 1 567.79 1 589.50 1 502.99 19.10 115.23 146.50 20.99 71.44 11.87 28.83 ND ND 2.24 206.92 628.29 361.38 651.38 799.49 227.03 265.26 165.53 91.99 72.96 103.39 283.06 828.71 281.55 316.86 154.66 777.10 125.92 97.77 76.02
3 结论
采用UPLC-MS/MS技术对酱香型酒醅中葡萄糖、果糖、麦芽糖、麦芽三糖等糖类物质进行检测。 结果表明,采用水为提取溶剂,振荡提取10 min,加入乙腈沉淀蛋白质等干扰物质,通过细颗粒填充色谱柱(2.1 mm×100 mm,1.7 μm)分离,流动相为乙腈-乙酸铵(0.1%的氨水),采用多反应监测(MRM)模式对各糖类物质进行测定,并用标准溶液外标法进行定量分析。4种糖类物质在各自质量浓度范围内线性关系良好,相关系数(R2)均>0.998。 平均加标回收率为82%~118%,精密度试验结果标准偏差(RSD)<2.0%,检出限(LOD)为0.003 0~0.022 5 mg/L,定量限(LOQ)为0.010~0.075 mg/L。该方法操作简便快捷、准确度高、稳定性好、用时短,满足酒醅中糖类物质的分析测定,可为酱香型白酒发酵过程中不易挥发性物质检测提供技术参考。
[1]黄治国,侯海波,罗惠波,等.浓香型白酒酒醅发酵过程中淀粉和还原糖的变化规律研究[J].中国酿造,2012,31(7):107-110.
[2]唐泽坤.生物体系中痕量糖化合物液质定量方法的建立[D].大连:大连理工大学,2022.
[3]国家卫生健康委员会,国家市场监督管理总局.GB 5009.8—2023 食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定[S].北京:中国标准出版社,2023.
[4]YU B, ZHANG S, LI G, et al.Light-assisted preparation of vancomycin chiral stationary phase based on diazotized silica and its enantioseparation evaluation by high-performance liquid chromatography[J].Talanta,2018,182:171-177.
[5]中华人民共和国国家卫生和计划生育委员会.GB/T 5009.7—2016 食品中还原糖的测定[S].北京:中国标准出版社,2016.
[6]毕春元,杜祎,张金玲,等.生物传感器法检测葡萄汁中葡萄糖含量[J].中国酿造,2018,37(10):167-170.
[7]BADEA M,CURULLI A,PALLESCHI G,et al.Oxidase enzyme immobilisation through electropolymerised films to assemble biosensors for batch and flow injection analysis[J].Biosens Bioelectron,2003,18(5-6):689-698.
[8]李梅梅.基于拉曼光谱生物样品中乳糖的检测及其应用[D].上海:上海师范大学,2015.
[9]TIAN E Z, LU S Y.Research of surface-enhanced Raman scattering on Ag@PMBA@C@Au hybrid nanoparticles[J].Optoelectron Lett, 2024,20(2):65-69.
[10]邹琳,王云龙,刘茜,等.硅烷衍生化GC-MS检测香精中糖类物质成分[J].粮食与油脂,2024,37(8):122-126,131.
[11]RUIZ-MATUTE A I, HERNÁNDEZ-HERNÁNDEZ O, RODRÍGUEZSÁNCHEZ S,et al.Derivatization of carbohydrates for GC and GC-MS analyses[J].J Chromatogr B,2011,879(17-18):1226-1240.
[12]ROGATSKY E,JAYATILLAKE H,GOSWAMI G,et al.Sensitive LC MS quantitative analysis of carbohydrates by Cs+attachment[J].J Am Soc Mass Spectr,2005,16(11):1805-1811.
[13]于丽,王婷,周健南,等.超声提取-离子色谱法检测市售常见15种蔬菜中7种单糖和双糖[J].食品安全质量检测学报,2016,7(1):372-377.
[14]刘晓玲,李东刚,史娟,等.离子色谱-脉冲安培检测器分析饮料中单糖和二糖[J].光谱实验室,2010,27(2):441-445.
[15]柴银,王虹,刘雅萌,等.离子色谱测定多糖的单糖组成的方法学研究及其应用[J].药物生物技术,2016,23(4):332-336.
[16]DENG P,CHEN X,ZHONG D.Quantification of polar drugs in human plasma with liquid chromatography-tandem mass spectrometry[J].Bioanal,2009,1(1):187-203.
[17]IWASAKI Y, NAKANO Y, MOCHIZUKI K, et al.A new strategy for ionization enhancement by derivatization for mass spectrometry[J].J Chromatogr B,2011,879(17-18):1159-1165.
[18]刘松,赵振宇,江锋,等.超高效液相色谱-四极杆/静电场轨道阱高分辨质谱测定白酒中16种甜味剂[J].中国酿造,2019,38(10):166-170.
[19]周元龙,宋年年,易宇欣,等.不同提取方法对罗布麻多糖理化性质及抗氧化活性的影响[J].食品工业科技,2024,45(19):40-48.
[20]张周莉,黎东,罗斯,等.超高效液相色谱-三重四极杆质谱法测定黄瓜中双炔酰菌胺残留[J].食品与机械,2023,39(11):72-78.
[21]尹艳艳,杨军林,田栋伟,等.超高效液相色谱-高分辨质谱法同时测定白酒中19种氨基酸[J].分析测试学报,2023,42(3):330-336.
[22]茹歌,许勇,韩晶,等.超高效液相色谱-串联质谱法测定化妆品中13种α-羟基酸[J].上海预防医学,2024,36(4):399-408.
[23]生态环境部.HJ 168—2020 环境监测分析方法标准制订技术导则[S].北京:中国标准出版社,2020.
[24]贾茹,黄学者,贾光群,等.超高效液相色谱-蒸发光散射检测法测定蜂蜜中12种糖组分[J].分析测试学报,2022,41(6):851-857.
[25]孙周莉,黎东,罗斯,等.超高效液相色谱-三重四极杆质谱法测定黄瓜中双炔酰菌胺残留[J].食品与机械,2023,39(11):72-78.
[26]曹燕妮,华蓉,游金坤,等.超高效液相色谱-三重四级杆串联质谱法(UHPLC-MS/MS)测定松茸中麦角甾醇含量[J].中国食用菌,2023,42(6):69-73.
[27]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 27404—2008 实验室质量控制规范食品理化检测[S].北京:中国标准出版社,2008.
[28]陈燕秋,林浩,肖全伟,等.QuEChERS-超高效液相色谱-串联质谱法测定牛乳中的氟吡呋喃酮及其代谢物[J].食品科学,2024,45(12):285-291.