花青素是一类天然的水溶性类黄酮化合物,易溶于水和乙醇等极性溶剂,基本结构单元为3,5,7-三羟基-2-苯基苯并吡喃型阳离子。 由于苯环中取代基位置的不同,可形成多种花青素单体,主要为矢车菊素、飞燕草素、锦葵素、天竺葵素、芍药素和矮牵牛素6大类[1](图1)。自然界中游离态的花青素单体较不稳定,易通过糖苷键与葡萄糖、鼠李糖、木糖等单糖或双糖结合形成糖基化花色苷,或与芳香酸、脂肪酸通过酯键以酰基化形式存在[2],已经通过糖基化、酰基化等修饰生成了超过700种花青素[3]。pH、光照、温度和金属离子等环境因素都会对花青素的稳定性造成影响[4],如pH值升高会使花青素从黄盐阳离子形式转化为相对不稳定的醌型碱或查耳酮结构[5],温度升高会使花青素的糖苷和芘环水解生成查尔酮[6],金属离子会与花青素发生螯合作用,影响其稳定性[7]。 一般认为,花青素多葡萄糖苷的稳定性普遍高于单葡萄糖苷,酰基化花青素的稳定性高于非酰基化花青素,多酰基化花青素的稳定性高于单酰基化花青素[8-9]。因具备抗氧化[10]、抗炎[11]和抗癌[12]等多种生物活性,花青素在食品领域广受关注。
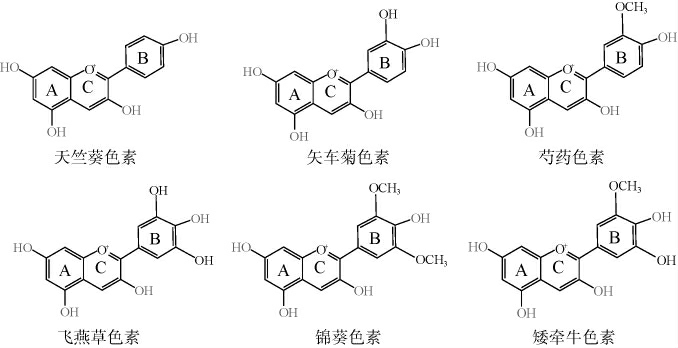
图1 6种常见花青素单体的结构
Fig.1 Structure of 6 kinds of common anthocyanins monomers
GB 2758—2012《发酵酒及其配制酒》中规定,发酵酒是以粮谷、水果、乳类等为主要原料,经发酵或部分发酵酿制而成的饮料酒。在发酵酒的众多原料中,各类浆果(葡萄、蓝莓、杨梅等)、红色和紫色蔬菜(紫薯等)以及有色稻米(黑米、紫米等)中均含有丰富的花青素,对发酵酒的颜色、口感特性和稳定性起着关键的作用。 采用富含花青素的原料酿制而成的酒,也可作为膳食抗氧化剂的重要来源之一[3]。
本文对常见富含花青素酿酒原料中的花青素组成及特性、酿造及贮藏中的花青素变化规律进行了归纳总结,并讨论了提高发酵酒中花青素稳定性的措施,以期为提升发酵酒中花青素的保留及稳定性提供参考。
1 常见富含花青素酿酒原料中花青素的种类及特性
原料中花青素的种类特性直接影响发酵酒中花青素的组成和稳定性[13-14]。在几种常见富含花青素的酿酒原料中,花青素的种类并不相同,如黑米中有18种[15]、紫米5种[16]、葡萄15种[17]、蓝莓14种[18]、杨梅18种[19]、黑枸杞37种[20]、紫甘薯37种[21-22]。其中,黑米、紫米和杨梅均以矢车菊素-3-葡萄糖苷为最主要的花青素,分别占其花色苷总含量的59.3%~82%[23]、69.87%~100%[16]和91.28%~92.93%[19]。黑米中花青素还包括芍药素、矮牵牛素、锦葵素和飞燕草素形成的葡萄糖苷[15]。黑枸杞中主要花青素为六大类单体花青素形成的糖基化、酰化花色苷[20],其中80%以上为矮牵牛素-3-芸香糖苷(反式对香豆酰)-5-葡萄糖苷[24]。葡萄中花青素主要为矢车菊素、芍药素、锦葵素形成的糖苷化、酰化花色苷[17],其中双糖苷花色苷占总花青素的37%~99%[25],酰化花色苷约占63%~77%[26-27]。 蓝莓中花青素主要为飞燕草素、锦葵素、矮牵牛素形成的单糖苷[18]。紫甘薯中花青素主要为矢车菊素和芍药素形成的糖基化、酰化花色苷,其中酰化花色苷高达34种[21-22],双酰化的花色苷含量是单酰化的3.3~54.5倍[28]。 研究表明,双酰化花色苷的稳定性强于单酰化和糖苷类花色苷[29]。 与其他酿酒原料相比,紫甘薯的双酰化花色苷占比更高,与其抗氧化活性和稳定性普遍高于其他植物原料的结果相对应[30]。 整体来看,多数紫红色酿酒原料(紫米、杨梅和紫甘薯)中主要为矢车菊素和芍药素形成的糖基化、酰化花青素;蓝色原料(蓝莓)中主要为飞燕草素、锦葵素和矮牵牛素形成的糖基化花青素;黑色原料(黑枸杞、黑米)中花青素种类丰富,包括6大类单体花青素糖基化、酰化形成的多种花青素。
在常见酿酒原料中花青素含量由高到低排序依次为黑枸杞(7~42.7 mg/g)[24,31]、黑米(0.80~27.15 mg/g)[32-33]、紫米(0.01~16.10 mg/g)[16,34]、紫甘薯(0.45~15.01 mg/g)[28,35]、蓝 莓(3.87~6.63 mg/g)[18,36]、葡 萄(0.38~5.34 mg/g)[37-38]和杨梅(0.08~2.95 mg/g)[19,39]。黑色原料中花青素含量整体高于其他原料;有色稻米的花青素含量整体高于几种水果。
2 花青素在发酵酒酿造发酵过程中的变化
2.1 花青素的溶出
采用带果肉或皮渣的原料酿造酒时,发酵初期由于果胶酶等物质的存在,原料细胞壁破裂,花青素不断溶出进入浆液中,导致发酵酒中花青素含量上升[40]。 张建萍等[41]研究表明,随着发酵的进行,乙醇浓度逐渐升高,花青素的溶出率和传质效率进一步增加。YAO X C等[42]研究表明,在酒精发酵阶段中,共有5种单体花青素、8种酰化花青素从葡萄皮中不断溶出进入葡萄汁,其中乙酰化和肉桂化形式的花青素平均浸出量分别为13.84%和8.26%。紫薯酒在酒精发酵期间的花青素含量也呈上升趋势[43]。因此,发酵初期和酒精发酵阶段花青素的不断溶出是部分酒发酵后花青素含量增加的主要原因。
2.2 花青素的转化
在酿造过程中,花青素可能与发酵液中的有机酸、酚酸类、糖类等物质发生糖基化、甲基化、酰基化反应或聚合反应,从而形成不同结构的衍生花青素,并对发酵酒的颜色产生影响[44]。 其中,吡喃花青素是由花青类与糖代谢产物(如乙醛、丙酮酸)或有机酸的脱羧产物通过加成聚合反应生成的衍生花青素,在葡萄酒和果酒中较为常见[45]。ZHANG H L等[17]研究表明,在葡萄酒的酒精发酵阶段,二甲花翠素-3-葡萄糖苷会与酵母代谢产物(丙酮酸、乙醛、丙酮)发生反应,导致Vitisin A、Vitisin B等吡喃花色苷类物质浓度不断增加,直至乳酸发酵阶段,酵母菌代谢减弱,部分吡喃类花青素的浓度有所下降,可能是由于乳酸发酵阶段的有机酸、多糖和蛋白质等多种物质协同作用,促使吡喃类花青素转化形成其他类花青素[17]。YAO X C等[42]研究表明,在葡萄酒发酵前,8种聚合锦葵素衍生物和5种黄烷基-吡喃花青素几乎不积累,但在酒精和苹果酸乳酸发酵过程中浓度持续增加,发酵结束时达到峰值,证实了花青素在发酵期间的转化反应。 据报道,在葡萄酒酒精发酵阶段,约有25%的花色苷与黄酮类化合物聚合[25]。 张新灿等[46]研究表明,桑葚酒发酵过程中游离型花青素从25.15%减少至11.39%,聚合型花青素从47.91%增加至62.93%,可能与桑葚果皮中的花色苷与果肉中的单宁酸等物质形成聚合色素有关[47]。葡萄酒中的花青素与葡萄原料中花青素的组成并不相同,主要为花翠素、二甲花翠素和甲基花翠素等[14],表明在葡萄酒的酿造过程中,花青素发生了更为复杂的转化反应。 因此,酿造过程中花青素与发酵液中各类物质发生转化反应是部分酒发酵后花青素组成及结构变化的主要原因之一。
2.3 花青素的降解
葡萄酒和蓝莓酒等在发酵过程中总花青素含量均有不同程度(21%~90%)的下降,这可能与发酵酒的发酵工艺、发酵菌种等有关[48-49]。
2.3.1 发酵工艺的影响
花青素不稳定,容易受到发酵工艺中pH值、温度、光照等因素的影响而发生降解。 酿酒工艺环节紧凑,且大多在密封避光的发酵罐中进行发酵,相较于其他因素,光照的影响较小。 张杰[50]研究表明,随着发酵温度在20~28 ℃范围内的升高,蓝莓酒中花青素含量不断降低(106.12~45.73 mg/L)。丁原春等[51]研究发现,发酵温度从20 ℃降低至5 ℃后,蓝莓酒花青素含量降低4 mg/L,可能是由于温度过低导致花青素的溶解度下降[52]。因此,发酵温度在20 ℃左右更有利于延缓花青素的降解。 李安等[53]研究表明,随着发酵时间在6~11 d的延长,蓝莓酒花青素含量不断下降(约510~450 mg/L),可能是由于发酵过程中微生物代谢产物的积累破坏了花青素的结构[53]。吴均等[54]研究表明,发酵时间由8 d缩短至6 d后,桑葚玫瑰果酒的花青素含量降低约75 mg/L,可能是由于发酵不充分导致花青素未完全溶出。因此,短期发酵(6~8 d)更有助于酒中花青素的积累。 赖剑峰[55]研究表明,随着初始pH值在3.0~5.5的增加,桑葚酒发酵过程中花青素的降解率从19.1%显著增加至69.6%,与李安等[53]研究结果相近。然而,pH过低(低于3.0)会导致酵母菌生长受抑制,影响发酵酒整体的品质[56]。因此,pH值略高于3.0有助于提高花青素的稳定性。整体来看,在低温(20 ℃左右)、较低pH值(3.0)条件下短期发酵(6~8 d),有助于延缓发酵酒中花青素的降解。
2.3.2 发酵菌种的影响
发酵菌种可通过微生物自身吸附和所产生的花青素降解酶影响发酵酒中花青素的含量。酵母菌和部分乳酸菌可以通过细胞壁吸附飞燕草素-3-葡萄糖苷、锦葵素-3-葡萄糖苷和芍药素-3-葡萄糖苷等花青素[57],所吸附的花青素含量约占葡萄酒中总花青素的6%~11.9%[44,58],酰化花青素比非酰化花青素更容易被吸附[59]。酵母菌株在发酵过程中吸附花青素的差异主要取决于酵母细胞活力的强弱,以及细胞壁和膜的完整性[60],根据吸附能力的强弱可分为低、中、高三类花青素吸附菌株[61]。与花青素降解有关的酶包括β-葡萄糖苷酶、多酚氧化酶和过氧化物酶[62]。 一般认为β-葡萄糖苷酶首先水解花青素的糖苷键,形成不稳定的花青素和游离糖苷元,随后花青素发生快速开环反应,产生查尔酮,分解成酚类,或被多酚氧化酶和过氧化物酶进一步氧化分解[63]。因此β-葡萄糖苷酶是花青素酶降解的先决条件。张杰[50]研究表明,随着β-葡萄糖苷酶加酶量的增加(0~2000U/L),蓝莓酒中花青素不断降低(136.05~124.17mg/L)。β-葡萄糖苷酶对果酒发酵中几种花青素的降解速率从高到低依次为:矢车菊素-3-葡萄糖苷(6.02×10-3 μmol/(L·min))、锦葵素-3-葡萄糖苷(1.44×10-3 μmol/(L·min))、芍药素-3-葡萄糖苷(0.77×10-3 μmol/(L·min))、飞燕草素-3-葡萄糖苷(0.27×10-3 μmol/(L·min))和矮牵牛素-3-葡萄糖苷(0.24×10-3 μmol/(L·min))[64]。 多种酵母(尤其是非酿酒酵母)可产生细胞外β-葡萄糖苷酶[65],这是导致酿酒中花青素降解的主要原因之一[61]。 MANZANARES P等[66]从葡萄和葡萄酒中分离出了53种具备β-葡萄糖苷酶活性的酵母,其中有9株酵母(毕赤酵母属、假丝酵母属和有孢汉逊酵母属)β-葡萄糖苷酶活性较高,发酵6 h后葡萄酒中花青素含量降低7.2%~33.2%。因此,选择吸附能力低、分泌β-葡萄糖苷酶活性弱的发酵菌种有助于减少发酵过程中花青素的降解。
3 花青素在发酵酒贮藏期间的变化
温度、光照、氧气以及多糖等化学成分均会引起花青素的结构变化。 发酵酒通常以陶罐或橡木桶保存在酒窖、酒库中,光照的影响相对较小,但温度、氧气和其他化学成分等仍可能使酒中花青素发生热降解、氧化裂解和聚合等化学反应,从而导致花青素含量的下降[67]。
3.1 花青素的热降解
热降解是发酵酒贮藏期花色苷降解最普遍的原因。加热会促进花色苷发生水合作用,通过开环反应生成查尔酮,最后降解为苯甲酸类和醛类等[6]。 已有研究表明[68],多数花青素的热降解终产物均为苯甲酸类和2,4,6-三羟基苯甲醛。TALCOTT S T等[69]的研究表明,随着贮藏温度在20~37 ℃范围内的升高,60 d后葡萄酒中总花青素降解率明显提高(47%~64%),芍药色素、天竺葵素、锦葵色素和矢车菊素的降解率从32%~43%增加至60%~62%,其中,37 ℃条件下飞燕草素和牵牛花素3,5-二葡萄糖苷的损失率最高,达66%~94%。 吕宁[70]研究表明,随着贮藏温度在4~36 ℃范围内的升高,6个月后黑枸杞果酒中总花青素降解率显著增加(9%~80%),各单体花青素降解率不同程度增加,酰化花青素(如矮牵牛素-3-芸香糖(反式-p-香豆酰)-5-葡萄糖苷)的热稳定性优于非酰化花青素(如锦葵素-3-葡萄糖苷)。 随着贮藏温度在4~37 ℃的升高,各发酵酒花青素的半衰期显著降低,紫薯酒中花青素的半衰期普遍高于葡萄酒和杨梅酒,与紫薯酒中酰化花青素高于其他发酵酒的结果相对应[71-73]。整体来看,在低温下(4 ℃)贮藏有利于维持发酵酒中花青素的稳定性,4~20 ℃条件下花青素含量降低不显著,高于35 ℃时花青素含量显著降低[74]。
3.2 花青素的氧化和裂解
贮藏期间,发酵酒液与氧接触会导致花青素发生氧化反应,生成邻位醌[75];或发生裂解反应,生成酚类物质(原儿茶酸等)和醛类物质(间苯三酚甲醛等)[6]。吕宁[70]研究表明,随着酒液上方包装氧浓度的升高,黑枸杞果酒中单体花青素(芍药素-3-葡萄糖苷、飞燕草素-3-葡萄糖苷和矢车菊素-3-葡萄糖苷)的降解率增加,推断酒中的花色苷发生了氧化反应[76]。张正伟[6]研究表明,随着酒液中溶解氧浓度的增加,杨梅酒贮藏过程中生成的原儿茶酸(矢车菊素-3-葡萄糖苷的主要裂解产物)与降解的花色苷的摩尔比不断增加,表明通过裂解途径导致花色苷降解的比例不断增加,氧气更有可能促进杨梅酒中花色苷的裂解而非氧化。 不同发酵酒中花青素的组成不同,贮藏期氧的作用效果和机理可能存在差异。因此,应尽量在密封条件下保存酒样,减少氧气对花青素的影响。
3.3 花青素的聚合
在发酵酒贮藏期间,单体花青素可能与酒中其他物质发生聚合反应形成聚合色素,导致花青素含量降低。LI X S等[77]研究表明,随着贮藏时间在0~4周的延长,蓝莓酒中游离型花青素含量不断减少,聚合色素的含量不断增高。BAI Y Y等[78]研究表明,葡萄酒贮藏期间花青素(飞燕草素、锦葵素、矢车菊素-3-葡萄糖苷等)的含量不断下降,花青素衍生色素(尤其是吡喃花青素)的占比不断增加,提示花青素与葡萄酒中单宁等物质在陈酿过程中发生了聚合反应。吕宁[70]研究显示,随着酒液上方包装氧浓度的升高,大分子和小分子聚合色素的生成速率均加快,推断高浓度氧环境可促进黑果枸杞果酒中花青素的聚合。总体来看,花青素随着贮藏时间的延长向聚合色素的不断转变,是发酵果酒中花色苷损失的主要原因之一[79]。
4 提高发酵酒中花青素稳定性的方法
4.1 共色素沉着
共色素沉着也称为辅色作用,是指花青素与无色的辅色素相结合,通过形成共色素复合物来阻断水分子对花青素的亲核攻击、保护花青素不被降解的一种方式[80-81]。通常情况下,共色素沉着会导致吸光度值增加(增色效应)和最大吸收波长延长(红移效应)[82],对于发酵酒的颜色产生积极影响。 共色素沉着包含分子内和分子间两种相互作用。分子内主要是由于花青素的自缔合。分子间则是指花青素和非花青素复合物之间形成氢键、疏水性、范德华力和离子相互作用,产生辅色效果。 研究表明,黄酮醇(槲皮素和芦丁)[83]、酚酸(咖啡酸、阿魏酸、没食子酸)[84]、羟基苯甲酸(丁香酸、植氧基苯甲酸、香草酸)[85]和氨基酸[84]等物质均能与花青素发生共色素沉着,目前已广泛用于提高各种发酵酒中花青素的稳定性。 SUN X Y等[48]研究表明,丁香酸、槲皮素和咖啡酸在添加量为0.2 g/L时,分别使蓝莓酒中花青素降解率下降8.77%、7.13%和11.69%,咖啡酸几乎能够稳定蓝莓酒中所有的花青素。CHUNG C等[86]向饮料中添加0.1%的L-色氨酸,使花青素的平均半衰期延长了3倍。LI Y W等[87]将矢车菊素-3-葡萄糖苷与丝素蛋白肽结合,提高了该花青素对碱的稳定性和耐热性。整体来看,咖啡酸和L-色氨酸的辅色效果较好,可提高发酵酒中多种花青素的稳定性[48]。
4.2 共价和非共价作用
蛋白质、多糖等生物聚合物可通过与花青素形成共价或非共价相互作用(氢键、疏水相互作用、静电相互作用等)的方式保护花青素免受水分子的攻击[88],提高花青素的光、热稳定性。 其中,甘露糖蛋白常常被用于酿酒中,以保持酒中花青素的稳定性。朱彤[89]研究表明,随着甘露糖蛋白的质量浓度在0.2~0.3 g/L范围内的升高,发酵后蓝莓酒中花青素的含量逐渐提高,最高可提高57.46%,锦葵类花青素含量最高提高42.46%。 YUE X F等[90]研究表明,在发酵前添加甘露糖蛋白比贮藏时添加更有助于提高葡萄酒中花青素含量和稳定性。此外,牛血清白蛋白、乳清蛋白和大豆蛋白等均可提高饮料和果酒中花青素的光、热稳定性。LANG Y等[91]观察到在光照、维生素C+光照和蔗糖+光照三种劣化处理下,牛血清白蛋白均能保持蓝莓酒花色苷的稳定性和抗氧化活性。QUAN W等[92]研究表明,随乳清蛋白、大豆蛋白添加量分别在50~200 mg/L、25~50 mg/L范围内的升高,100 ℃下紫甘薯饮料中花青素的降解率分别降低6%~17.4%、16.2%~27.3%。因此,添加较高浓度的蛋白质等生物聚合物有助于提高发酵酒中花青素的稳定性。
4.3 非热加工手段
脉冲电场、超声、超高压等非热加工手段可以促进花色苷自缔合、钝化多酚氧化酶和过氧化物酶(花青素降解的关键酶),对花色苷起到稳定和保护的作用。目前,3种非热加工技术均已广泛应用于花青素等酚类物质的提取和酒类品质提升领域[71]。脉冲电场技术可以改变细胞膜的通透性,提高花青素的溶出率,并能通过电化学效应影响多酚氧化酶和过氧化物酶的活性[71,93]。 郑志超[71]研究表明,随着电场强度在0~3 kV/cm范围内的增加,发酵126 h的葡萄酒中总花青素含量增加20 mg/L,葡萄酒在4 ℃条件下贮藏,花色苷半衰期延长135~198 d,羟自由基清除率提高10.84%~14.09%。DELSART C等[94]研究表明,随着电场强度(0~500 V/cm)和处理时间(0~40 ms)的增加,发酵240 d的葡萄酒中花青素含量分别增加120 mg/L、100 mg/L,然而,随着电场强度和处理时间的进一步增加,花青素含量略有降低。因此,应控制脉冲电场的场强及处理时间,防止过强电场对花青素结构的破坏。超声波技术主要通过产生空穴、磁缩效应来改变多酚氧化酶和花青素的结构,影响花青素的稳定性[77,93]。研究表明,适当的超声处理(功率90~180 W、时间20~30 min)可以提高蓝莓酒的抗氧化能力,且特定超声功率(180 W)和时间(20 min)处理条件下,矮牵牛素-3,5-二葡萄糖苷、锦葵素-3,5-二葡萄糖苷、锦葵素-3-香豆酰-5-二葡萄糖苷等花色苷含量显著增加[77],过高功率(300~500 W)会使花青素的半衰期降低(19.31~11.78 min)[95]。由璐等[96]对欧李果酒进行超声处理(350 W、10~40 min),其总花青素含量增加1.23%~33.95%,其中,超声30 min的欧李果酒中花青素含量最高(21.7 mg/L)。因此,在中低功率(<200 W)下超声20~30 min可能更有利于提高酒中花青素的稳定性。超高压处理(压力>100 MPa)可改变花青素与其他化合物之间非共价键(氢键、疏水键)的状态,使多酚氧化酶的分子构象发生变化,影响花青素的稳定性[93]。研究表明[97-98],超高压处理(400 MPa、2~10 min)可使果汁中多酚氧化酶活性降低6.67%~35.46%,降低效果与果蔬本身特性有关。贺阳[99]采用超高压手段(压力300 MPa、加压2 min)促进了葡萄中花青素与有机酸结合的稳定性,超高压处理后的花青素增色率为42.26%,较传统方法提高了12%,提高了花青素的光热稳定性。整体来看,3种非热加工技术提高花青素稳定性的原理略有不同,作用效果均与操作参数有关,应根据不同发酵酒的特性选择合适的处理方式。
5 总结
在常用酿酒原料中,多数紫红色酿酒原料中主要为矢车菊素和芍药素形成的糖基化、酰化花青素,蓝色原料中主要为飞燕草素、锦葵素和矮牵牛素形成的糖基化花青素,黑色原料中花青素种类丰富,含量普遍更高,紫甘薯中花青素稳定性更强。 在发酵酒的酿造过程中,花青素在发酵过程中从原料中不断溶出,与发酵液中的有机酸、糖类等物质发生糖基化、甲基化、酰化和聚合等转化反应导致其结构发生变化,并在发酵工艺和发酵菌种的影响下发生降解。 选择吸附花青素能力低、分泌β-葡萄糖苷酶活性弱的发酵菌种,在低温(20 ℃左右)、较低pH值(略高于3.0)条件下短期发酵(6~8 d),有助于延缓发酵酒酿造过程中花青素的降解。 在贮藏阶段,发酵酒中花青素容易受到贮藏温度和氧气等环境因素的影响而发生热降解、氧化裂解和聚合反应,含量不断降低,低温密闭条件有助于维持发酵酒中花青素的稳定性。 利用共色素沉着、共价与非共价作用以及非热加工手段处理花青素,可提高发酵酒中花青素的稳定性,但应注意控制非热加工手段的操作参数。
[1]SU X, XU J, RHODES D, et al.Identification and quantification of anthocyanins in transgenic purple tomato[J].Food Chem,2016,202:184-188.
[2]KAPOOR L, SIMKIN A J, GEORGE P D C, et al.Fruit ripening: Dynamics and integrated analysis of carotenoids and anthocyanins[J].BMC Plant Biol,2022,22(1):27.
[3]RUTA L L, FARCASANU I C.Anthocyanins and anthocyanin-derived products in yeast-fermented beverages[J].Antioxidants (Basel), 2019,8(6):182.
[4]张丽,范维娟,郑臻颖,等.花青素糖基化、甲基化和酰基化修饰的研究现状[J].分子植物育种,2023,21(7):2378-2387.
[5]徐青,王代波,刘国华,等.花青素稳定性影响因素及改善方法研究进展[J].食品研究与开发,2020,41(7):218-224.
[6]张正伟.杨梅酒颜色劣变与花色苷降解机理的研究[D].无锡:江南大学,2021.
[7]CORTEZ R,LUNA-VITAL D A,MARGULIS D,et al.Natural pigments:Stabilization methods of anthocyanins for food applications[J].Compr Rev Food Sci Food Saf,2017,16(1):180-198.
[8]YANZE-APAM J, DOMINGUEZ-USCANGA A, HERRERA-GONZALEZ A,et al.Pharmacological activities and chemical stability of natural and enzymatically acylated anthocyanins:A comparative review[J].Pharmaceuticals,2023,16(5):638.
[9]TANG R, HE Y, FAN K.Recent advances in stability improvement of anthocyanins by efficient methods and its application in food intelligent packaging:A review[J].Food Biosci,2023,56:103164.
[10]ZHOU L,ZHANG C,QIANG Y,et al.Anthocyanin from purple sweet potato attenuates lead-induced reproductive toxicity mediated by JNK signaling pathway in male mice[J].Ecotoxicol Environ Saf,2021,224:112683.
[11]DONG G, XU N, WANG M, et al.Anthocyanin extract from purple sweet potato exacerbate mitophagy to ameliorate pyroptosis in Klebsiella pneumoniae infection[J].Int J Mol Sci,2021,22(21):11422.
[12]TANG C,HAN J Q,CHEN D,et al.Recent advances on the biological activities of purple sweet potato anthocyanins[J].Food Biosci,2023,53:102670.
[13]李小乐.重庆不同品种葡萄酿酒过程中原花青素含量变化[J].园艺与种苗,2014(6):3-5.
[14]卢浩成,魏巍,贾倩倩,等.玛纳斯产区四个酿酒葡萄品种酒质特征的初步研究[J].中国酿造,2019,38(12):25-30.
[15]张玉婷.黑米花色苷含量QTL定位及SA处理下相关基因表达[D].福州:福建农林大学,2024.
[16]ZHENG R,REN T,NIU C,et al.Anthocyanins composition and antioxidant activity of purple rice and color degradation under sunlight exposure of purple rice wine[J].J Food Meas Charact,2022,16(3):1889-1900.
[17]ZHANG H L,XIA N Y,YAO X C,et al.Effects of phenolic evolution on color characteristics of single-cultivar Vitis vinifera L.Marselan and merlot wines during vinification and aging[J].Foods,2024,13(3):494.
[18]HOSSEINIAN F S,BETA T.Saskatoon and wild blueberries have higher anthocyanin contents than other Manitoba berries[J].J Agr Food Chem,2007,55(26):10832-10838.
[19]LIN Q, ZHONG Q, ZHANG Z.A comparative metabolomics study of anthocyanins and taste components in Chinese bayberry(Morella rubra)with different flesh colors[J].Peer J,2022,10:e13466.
[20]WANG H, LI J, TAO W, et al. Lycium ruthenicum studies: Molecular biology,phytochemistry and pharmacology[J].Food Chem,2018,240:759-766.
[21]GE J, HU Y, WANG H, et al.Profiling of anthocyanins in transgenic purple-fleshed sweet potatoes by HPLC-MS/MS[J].J Sci Food Agr,2017,97(14):4995-5003.
[22]靳艳玲,丁凡,刘国强,等.紫甘薯花青素的成分特点及产品研发[J].粮食与饲料工业,2020(4):38-43.
[23]赵珊,席清清,李曦,等.超高效液相色谱法测定有色稻米中花色苷的含量[J].食品与发酵工业,2018,44(11):301-306.
[24]VIDANA GAMAGE G C,LIM Y Y,CHOO W S.Black goji berry anthocyanins:Extraction, stability, health benefits, and applications[J].ACS Food Sci Technol,2021,1(8):1360-1370.
[25]朱磊,李新月,胡禧熙,等.葡萄花色苷的组成及生物合成研究进展[J].黑龙江八一农垦大学学报,2021,33(5):59-66.
[26]OH Y S,LEE J H,YOON S H,et al.Characterization and quantification of anthocyanins in grape juices obtained from the grapes cultivated in Korea by HPLC/DAD, HPLC/MS, and HPLC/MS/MS[J].J Food Sci,2008,73(5):C378-C389.
[27]RYU D,KOH E.Stability assessment of anthocyanins from black soybean,grape, and purple sweet potato under in vitro gastrointestinal digestion[J].Food Sci Biotechnol,2022,31(8):1053-1062.
[28]张毅,孔秀林,王洪云,等.不同品种紫甘薯花色苷含量与组分分析[J].江苏师范大学学报(自然科学版),2019,37(2):26-30.
[29]彭非,邓洁红,于桐,等.花色苷酶促酰化反应研究进展[J].包装与食品机械,2018,36(1):44-50.
[30]FROND A D,IUHAS C I,STIRBU I,et al.Phytochemical characterization of five edible purple-reddish vegetables:Anthocyanins,flavonoids,and phenolic acid derivatives[J].Molecules,2019,24(8):1536.
[31]CHENG H,WU W,CHEN J,et al.Establishment of anthocyanin fingerprint in black wolfberry fruit for quality and geographical origin identification[J].LWT-Food Sci Technol,2022,157:113080.
[32]ZHANG M W,ZHANG R F,ZHANG F X,et al.Phenolic profiles and antioxidant activity of black rice bran of different commercially available varieties[J].J Agr Food Chem,2010,58(13):7580-7587.
[33]CHEN X Q,NAGAO N,ITANI T,et al.Anti-oxidative analysis,and identification and quantification of anthocyanin pigments in different coloured rice[J].Food Chem,2012,135(4):2783-2788.
[34]李轶,卢岚,李帮锐,等.紫米中花青素和矿质元素的测定及评价[J].中国卫生检验杂志,2022,32(24):2966-2971.
[35]黄彪,韦航,李国良,等.不同品种紫薯抗氧化物质及体外抗氧化活性比较[J].食品工业科技,2020,41(24):226-231.
[36]WU Y,ZHOU Q,CHEN X Y,et al.Comparison and screening of bioactive phenolic compounds in different blueberry cultivars: Evaluation of anti-oxidation and alpha-glucosidase inhibition effect[J].Food Res Int,2017,100(Pt 1):312-324.
[37]SILVA L R,QUEIROZ M.Bioactive compounds of red grapes from Dão region (Portugal): Evaluation of phenolic and organic profile[J].Asian Pac J Trop Bio,2016,6(4):315-321.
[38]GONCALVES A C,NUNES A R,FALCAO A,et al.Dietary effects of anthocyanins in human health:A comprehensive review[J].Pharmaceuticals,2021,14(7):690.
[39]DUAN W,JIN S,ZHAO G,et al.Microwave-assisted extraction of anthocyanin from Chinese bayberry and its effects on anthocyanin stability[J].Food Sci Technol,2015,35(3):524-530.
[40]李红雨,曾令文,吉姆·哈迪.蓝莓酒渣不同提取方法对花青素含量的影响[J].南昌大学学报(理科版),2024,48(5):447-454.
[41]张建萍,江润生,巫永华,等.紫薯酒低温发酵工艺及酚类物质动态变化分析[J].食品工业,2020,41(1):167-171.
[42]YAO X C,ZHANG H L,MA X R,et al.Leaching and evolution of anthocyanins and aroma compounds during Cabernet Sauvignon wine fermentation with whole-process skin-seed contact[J].Food Chem,2024,436:137727.
[43]向欣,吴正云,刘霞雨,等.3种商业酿酒酵母发酵紫薯酒的动力学及抗氧化特性研究[J].食品科技,2022,47(5):43-48.
[44]MORATA A,LOIRA I,HERAS J M,et al.Yeast influence on the formation of stable pigments in red winemaking[J].Food Chem,2016,197(Pt A):686-691.
[45]王二雷,刘彦君,刘静波.吡喃型花青素类化合物的研究进展[J].食品工业科技,2018,39(12):325-333.
[46]张新灿,郭浩然,张静,等.桑葚干和桑葚酒中花青素稳定性分析[J].食品研究与开发,2022,43(24):51-57.
[47]KILMISTER R L,MAZZA M,BAKER N K,et al.A role for anthocyanin in determining wine tannin concentration in Shiraz[J].Food Chem,2014,152:475-482.
[48]SUN X Y,SHOKRI S,GAO B H,et al.Improving effects of three selected co-pigments on fermentation, color stability, and anthocyanins content of blueberry wine[J].LWT-Food Sci Technol,2022,156:113070.
[49]HORNEDO-ORTEGA R,ALVAREZ-FERNANDEZ M A,CEREZO A B,et al.Influence of fermentation process on the anthocyanin composition of wine and vinegar elaborated from strawberry[J].J Food Sci,2017,82(2):364-372.
[50]张杰.蓝莓酒主发酵工艺优化及酶促增香、树脂降酸工艺研究[D].雅安:四川农业大学,2022.
[51]丁原春,范文广,韩双,等.不同发酵工艺对蓝莓酒中花青素含量的影响[J].保鲜与加工,2014,14(6):47-50.
[52]胡佳星,袁文艳,满都拉,等.野生蓝莓保健果酒的工艺优化[J].中国酿造,2019,38(7):136-140.
[53]李安,刘小雨,张惟广.发酵及贮藏条件对蓝莓果酒花色苷稳定性的影响及其抗氧化性研究[J].中国酿造,2020,39(2):146-151.
[54]吴均,吴俊葶,黄传书,等.桑葚玫瑰果酒发酵工艺优化及体外抗氧化活性测定[J].食品研究与开发,2023,44(22):93-100.
[55]赖剑峰.桑椹酒发酵过程中花青素的生物转化研究[D].南昌:江西农业大学,2013.
[56]刘兴艳.低pH对酿酒酵母酒精发酵的影响及酵母应答酸胁迫机制初探[D].北京:中国农业大学,2015.
[57]DEVI A,AIYAPPAA A K,WATERHOUSE A L.Adsorption and biotransformation of anthocyanin glucosides and quercetin glycosides by Oenococcus oeni and Lactobacillus plantarum in model wine solution[J].J Sci Food Agr,2020,100(5):2110-2120.
[58]MORATA A,LOIRA I,HERAS J M,et al.Yeast influence on the formation of stable pigments in red winemaking[J].Food Chem,2016,197:686-691.
[59]严红光,曾田,梁正坤,等.酵母菌发酵过程对果酒色泽变化影响研究进展[J].酿酒科技,2017(12):105-108.
[60]ECHEVERRIGARAY S, SCARIOT F J, MENEGOTTO M, et al.Anthocyanin adsorption by Saccharomyces cerevisiae during wine fermentation is associated to the loss of yeast cell wall/membrane integrity[J].Int J Food Microbiol,2020,314:108383.
[61]TOFALO R, SUZZI G, PERPETUINI G.Discovering the influence of microorganisms on wine color[J].Front Microbiol,2021,12:790935.
[62]ENARU B,DRETCANU G,POP T D,et al.Anthocyanins: Factors affecting their stability and degradation[J].Antioxidants, 2021, 10(12):1967.
[63]MARSZALEK K,WOZNIAK L,KRUSZEWSKI B,et al.The effect of high pressure techniques on the stability of anthocyanins in fruit and vegetables[J].Int J Mol Sci,2017,18(2):277.
[64]YUAN K, WU G, LI X, et al.Anthocyanins degradation mediated by β-glycosidase contributes to the color loss during alcoholic fermentation in a structure-dependent manner[J].Food Res Int,2024,175:113732.
[65]CLAUS H, MOJSOV K.Enzymes for wine fermentation: Current and perspective applications[J].Fementation,2018,4(3):52.
[66]MANZANARES P,ROJAS V,GENOVES S,et al.A preliminary search for anthocyanin-β-D-glucosidase activity in non-Saccharomyces wine yeasts[J].Int J Food Sci Technol,2000,35(1):95-103.
[67]陈绍依,曾稳稳,赵漫漫,等.贮存条件对蓝莓酒酚类物质、风味成分和感官指标的影响[J].食品与发酵工业,2024,50(8):154-160.
[68]FURTADO P,FIGUEIREDO P,DASNEVES H C,et al.Photochemical and thermal-degradation of anthocyanidins[J].J Photoch Photobio A,1993,75(2):113-118.
[69]TALCOTT S T,LEE J H.Ellagic acid and flavonoid antioxidant content of muscadine wine and juice[J].J Agr Food Chem,2002,50(11):3186-3192.
[70]吕宁.黑果枸杞果酒贮藏过程中的品质变化规律研究[D].银川:宁夏大学,2023.
[71]郑志超.脉冲电场强化浸渍调控葡萄酒品质研究[D].广州:华南理工大学,2020.
[72]吴文丽.紫薯酒发酵工艺优化及紫薯酒花色苷贮藏稳定性研究[D].武汉:华中农业大学,2016.
[73]ZHANG Z,ZHANG J,FAN L,et al.Degradation of cyanidin-3-O-glucoside induced by antioxidant compounds in model Chinese bayberry wine:Kinetic studies and mechanisms[J].Food Chem,2022,373(Pt A):131426.
[74]吉俊臣.蓝莓果酒快速陈酿及花青素护色研究[D].成都:西华大学,2020.
[75]SINELA A M,MERTZ C,ACHIR N,et al.Exploration of reaction mechanisms of anthocyanin degradation in a roselle extract through kinetic studies on formulated model media[J].Food Chem,2017,235:67-75.
[76]李欣宇.黑果腺肋花楸果酒陈酿中生理活性物质及风味变化[D].无锡:江南大学,2021.
[77]LI X S,ZHANG L,PENG Z Y,et al.The impact of ultrasonic treatment on blueberry wine anthocyanin color and its in vitro anti-oxidant capacity[J].Food Chem,2020,333:127455.
[78]BAI Y Y,ZHAO P,DU Y T,et al.Effect of postharvest grape dehydration on the phenolic composition of'Marselan'rose wine during aging[J].J Food Compos Anal,2023,123:105630.
[79]HOWARD L R,PRIOR R L,LIYANAGE R,et al.Processing and storage effect on berry polyphenols:Challenges and implications for bioactive properties[J].J Agr Food Chem,2012,60(27):6678-6693.
[80]ZHU Y,CHEN H,LOU L,et al.Copigmentation effect of three phenolic acids on color and thermal stability of Chinese bayberry anthocyanins[J].Food Sci Nutr,2020,8(7):3234-3242.
[81]ZHAO X, DING B W, QIN J W, et al.Intermolecular copigmentation between five common 3-O-monoglucosidic anthocyanins and three phenolics in red wine model solutions:The influence of substituent pattern of anthocyanin B ring[J].Food Chem,2020,326:126960.
[82]LV X,LI L,LU X,et al.Effects of organic acids on color intensification,thermodynamics,and copigmentation interactions with anthocyanins[J].Food Chem,2022,396:133691.
[83]KLISUROVA D,PETROVA I,OGNYANOV M,et al.Co-pigmentation of black chokeberry (Aronia melanocarpa) anthocyanins with phenolic co-pigments and herbal extracts[J].Food Chem,2019,279:162-170.
[84]TROUILLAS P, SANCHO-GACIA J C, DE F V, et al.Stabilizing and modulating color by copigmentation: Insights from theory and experiment[J].Chem Rev,2016,116(9):4937-4982.
[85]YOU Y,LI N,HAN X,et al.The effects of six phenolic acids and tannic acid on colour stabilityand the anthocyanin content of mulberry juice during refrigerated storage[J].Int J Food Sci Technol,2019,54(6):2141-2150.
[86]CHUNG C,ROJANASASITHARA T,MUTILANGI W,et al.Stability improvement of natural food colors: Impact of amino acid and peptide addition on anthocyanin stability in model beverages[J].Food Chem,2017,218:277-284.
[87]LI Y W,YAO L,ZHANG L W,et al.Enhanced physicochemical stabilities of cyanidin-3-O-glucoside via combination with silk fibroin peptide[J].Food Chem,2021,355:129479.
[88]DAS A B,GOUD V V,DAS C.Degradation kinetics of anthocyanins from purple rice bran and effect of hydrocolloids on its stability[J].J Food Process Eng,2020,43(4):e13360.
[89]朱彤.辅色素及甘露糖蛋白对蓝莓酒发酵过程中花色苷稳定性的比较研究[D].沈阳:沈阳农业大学,2018.
[90]YUE X F,JING S S,NI X F,et al.Anthocyanin and phenolic acids contents influence the color stability and antioxidant capacity of wine treated with mannoprotein[J].Front Nutr,2021,8:691784.
[91]LANG Y,LI E,MENG X,et al.Protective effects of bovine serum albumin on blueberry anthocyanins under illumination conditions and their mechanism analysis[J].Food Res Int,2019,122:487-495.
[92]QUAN W,HE W,QIE X,et al.Effects of beta-cyclodextrin,whey protein,and soy protein on the thermal and storage stability of anthocyanins obtained from purple-fleshed sweet potatoes[J].Food Chem,2020,320:126655.
[93]李喜宏,杨梦娇,梁富浩,等.非热加工技术调控果蔬产品内源酶活性研究进展[J].轻工学报,2023,38(4):11-19.
[94]DELSART C,GHIDOSSI R,POUPOT C,et al.Enhanced extraction of phenolic compounds from merlot grapes by pulsed electric field treatment[J].Am J Enol Viticult,2012,63:205-211.
[95]YAO G L, MA X H, CAO X Y, et al.Effects of power ultrasound on stability of cyanidin-3-glucoside obtained from blueberry[J].Molecules,2016,21(11):1564.
[96]由璐,赵艳雪,隋茜茜,等.预处理对欧李酒品质及抗氧化的影响[J].食品研究与开发,2019,40(14):13-19.
[97]DARS A G, HU K, LIU Q, et al.Effect of thermo-sonication and ultra-high pressure on the quality and phenolic profile of mango juice[J].Foods,2019,8(8):298.
[98]冯若怡,王晓钰,杨云舒,等.超高压处理对复合苹果泥微生物和品质的影响[J].食品工业科技,2020,41(17):37-44.
[99]贺阳.山葡萄花青素提取、结构鉴定及稳态化机理研究[D].长春:吉林农业大学,2017.