黄酒是我国特色发酵酒中最具民族特征的低度原味饮料酒,已有几千年的酿造历史,被纳入我国重点扶持饮料酒范畴[1]。传统黄酒以黍米、糯米等谷物为原料,拌入酒曲糖化发酵而成,酒中富含多种氨基酸、微量元素、生物活性肽等营养成分[2-4]。随着消费者健康意识的不断提升,黄酒功能性开发已成为研究的热点方向,尤其以具有特定保健功效的发酵型黄酒产品的研发呈持续上升趋势[5]。 程旺开等[6]以决明子和糯米为主要原料,研制决明子保健黄酒;黄和升等[7]利用铁皮石斛和糯米为原料,酿造铁皮石斛黄酒;顾逸菲[8]采用两步发酵法制备枳椇子黄酒;王楠等[9]以党参黍米为原料,酿制黄芪黄酒。
甘草(Glycyrrhiza uralensis)作为我国传统中草药,药食同源,具有补脾益气、清热解毒、调节免疫等功效,有“十方九草”之称,国家卫生部颁布的《新资源食品管理办法》中将甘草列为可用于保健食品的药品[10-11]。甘草富含多种功效成分,其中三萜类、黄酮类、多糖类化合物为重要活性物质,与抗炎、抗病毒、抗癌、抗氧化等药理特性有关[12]。三萜类化合物具有显著的抗炎活性,能够起到保护肝脏、抗过敏及抗肿瘤等作用;黄酮类化合物抗氧化能力强,可以清除自由基,减缓细胞老化,保护细胞免受氧化损伤的功效;多糖类化合物能够增强和调节人体免疫功能,修复自身免疫系统,具有抗病毒的活性[13-15]。国标GB 2760—2014《食品安全国家标准食品添加剂使用标准》规定甘草可作为功能抗氧化剂添加至食品中,而以甘草为原料的发酵型保健黄酒尚鲜见报道。现代消费者越来越关注黄酒产品的功能性与健康价值,更倾向于无添加、低酒精度的产品类型,因此本研究将甘草融入传统黄酒酿造中,能够满足消费者对健康需求的多样化,以及提高黄酒产品的市场竞争力。
目前对黄酒抗氧化性能的分析评价主要以体外抗氧化活性为主,具有一定的局限性,无法直接反映人体消化过程中抗氧化物质的有效性。体外模拟肠胃消化能够更加贴近人体内的实际消化过程,从而更准确地评估抗氧化物质在人体内的有效吸收和利用情况[16]。 郭佳垚等[17]通过体外模拟胃消化对小米黄酒的抗氧化活性研究发现,消化2 h后1,1-二苯基-2-苦基苯肼自由基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、羟自由基(·OH)、超氧阴离子自由基(O2-·)的清除率和还原能力(OD700nm值)均显著提高。 赵勇等[18]对富硒蓝莓果酒模拟胃肠液消化的多酚物质及抗氧化活性进行研究,结果表明富硒蓝莓果酒总酚含量、1,1-二苯基-2-苦基苯肼(DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、超氧阴离子(O2-)自由基清除率较对照均有明显升高。
本研究以甘草和黍米为酿造原料,在传统黄酒发酵工艺基础上制备甘草黄酒,以单因素试验和响应面试验设计优化甘草黄酒发酵工艺,通过体外模拟胃肠消化对甘草黄酒消化特性及抗氧化活性分析评价,旨在开发具有保健功效的甘草黄酒,进一步丰富保健黄酒产品种类,提供理论依据及技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株甘草、黍米:市售;大曲:山西雁门山酒业有限公司;黄酒活性干酵母:安琪酵母股份有限公司。
1.1.2 化学试剂
纤维素酶(10 000 U/g)、果胶酶(100 000 U/g)、福林酚试剂(分析纯)、没食子酸(纯度>98%)、胃蛋白酶(3 000 U/g)、胰蛋白酶(250 U/g)、2,2'-联氮双-3-乙基苯并噻唑啉-6-磺酸二铵(ABTS)、1,1-苯基-2-三硝基苯肼(DPPH):上海麦克林生化科技有限公司;牛胆盐(纯度>98%):上海源叶生物科技有限公司;其他试剂为国产分析纯或生化试剂。
1.2 仪器与设备
KO-400KDE型超声波清洗仪:宁波新芝生物科技有限公司;LFP-800T粉碎机:永康市红太阳机电有限公司;304型不锈钢酒糟压榨机:诸城市正康食品机械有限公司;78HW-1恒温磁力搅拌器:常州金坛良友仪器有限公司;UX-1601紫外可见分光光度计:北京瑞利分析仪器公司;TG16-WS型高速台式离心机:长沙湘智离心机仪器有限公司;PHSJ-5型pH计:上海精密科学仪器有限公司;HH-6型数显恒温水浴锅:常州国华电器有限公司。
1.3 方法
1.3.1 甘草黄酒的酿造工艺流程及操作要点
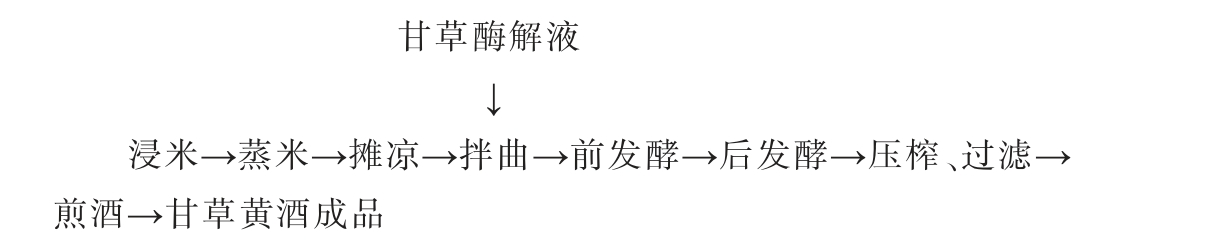
操作要点:
甘草酶解液的制备:将清洗后的甘草40 ℃烘干至恒质量,粉碎后过40目筛,准确称取10.0 g甘草粉,加入100 mL蒸馏水,制得甘草粉溶液,备用。50 ℃、功率300 W条件下超声10 min。 将纤维素酶和果胶酶按照8∶3质量配制复合酶,按添加量3%加至甘草粉溶液中,加入10%柠檬酸,调pH至4.0,放入水浴锅中,26 ℃、水浴90 min后,升温至90 ℃,灭酶10 min,即得甘草酶解液。
浸米:选取颗粒饱满无霉变黍米,准确称取300.0 g,加水浸泡24 h,过滤去除水分。
蒸米:浸泡后的黍米置于蒸锅中,冒气后开始计时,分别于20 min、40 min用无菌玻棒在黍米表面划开数道,加入30~40 ℃的纯水,20 min时加水量为300 mL,40 min时加水量为100 mL,充分搅拌混匀,防止黍米夹生,以确保发酵过程充分糖化,蒸60 min结束。
摊凉:蒸好黍米温度降至30 ℃以下,备用。
黄酒活性干酵母活化:将体积为5%的酵母添加至2%葡萄糖溶液中,35 ℃活化20 min,备用。
拌曲:在摊凉后的黍米中,加入30 ℃、300 mL的纯水后,加入10%的大曲和17%的甘草酶解液混匀,25 ℃糖化发酵24 h,再加入活化后的黄酒活性干酵母,添加量为0.1%。
前发酵:发酵温度25 ℃,敞口发酵,期间每天搅拌3次,观察气泡的产生,在发酵第4天时补加300.0 g的黍米(充分浸泡24 h后放入-20 ℃冰箱保藏24 h备用),及补加质量分数10%的大曲,发酵7 d时产气基本停止,结束前发酵。
后发酵:发酵温度20 ℃,密封静置发酵30 d。
压榨、过滤:将后发酵结束的甘草黄酒,榨取后去除残渣,加入0.2%的活性炭与甘草黄酒混合,静置24 h,用布氏漏斗抽滤,获得滤液。
煎酒:将抽滤所得滤液置于恒温水浴锅中,60 ℃水浴30 min,即为甘草黄酒成品。
1.3.2 普通黄酒的酿造工艺流程及操作要点
浸米→蒸米→摊凉→拌曲→前发酵→后发酵→压榨、过滤→煎酒→普通黄酒成品
操作要点:
浸米、蒸米、摊凉、黄酒活性干酵母活化方法同1.3.1。
拌曲:在摊凉后的黍米中,加入30 ℃、300 mL的纯水后,加入质量分数10%的大曲混匀,25 ℃发酵24 h,再加入活化后的黄酒活性干酵母,添加量为0.1%。
前发酵:发酵温度25 ℃,敞口发酵,期间每天搅拌3次,观察气泡的产生,在发酵第3d时补加300.0g的黍米(充分浸泡24 h后放入-20 ℃冰箱保藏24 h备用),及补加质量分数10%的大曲,发酵6 d时产气基本停止,结束前发酵。
后发酵:发酵温度20 ℃,密封静置发酵30 d。
压榨、过滤:将后发酵结束的黄酒,榨取后去除残渣,加入0.2%的活性炭与黄酒混合,静置24 h,用布氏漏斗抽滤,获得滤液。
煎酒:将抽滤所得滤液置于恒温水浴锅中,60 ℃水浴30 min,即为普通黄酒成品。
1.3.3 甘草黄酒发酵工艺优化
(1)单因素试验
选择甘草酶解液添加量(5%、9%、13%、17%、21%),酒曲添加量(5%、10%、15%、20%、25%),前发酵时间(4 d、5 d、6 d、7 d、8 d),前发酵温度(21 ℃、23 ℃、25 ℃、27 ℃、29 ℃)作为考察因素,以酒精度、感官评分为考察指标进行单因素试验。
(2)响应面试验设计
在单因素试验基础上,以甘草酶解液添加量(X1)、酒曲添加量(X2)、前发酵温度(X3)为自变量,以酒精度(Y)为响应值,根据Box-Behnken中心组合设计(central composite design,CCD)原理,进行3因素3水平响应面试验,确定甘草黄酒的最佳发酵工艺参数,Box-Behnken试验设计因素与水平见表1。
表1 甘草黄酒发酵工艺优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments for fermentation process optimization of licorice Huangjiu

水平 X1甘草酶解液添加量/% X2酒曲添加量/% X3前发酵温度/℃-1 5 0 1 13 17 21 10 15 23 25 27
1.3.4 分析检测
(1)理化指标测定
酒精度测定:参考GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》;总糖、总酸测定:参考GB/T 13662—2018《黄酒》。
(2)感官分析
选取10名经过专业培训的人员,组成感官评价小组对甘草黄酒成品的色泽、香气、口感、风格进行评分,总分100分,每组样品3份平行,结果取平均值,甘草黄酒感官评分标准见表2[19]。
表2 甘草黄酒感官评分标准
Table 2 Sensory evaluation standards of licorice Huangjiu

项目 评分标准 评分/分色泽(25分)香气(25分)口感(25分)色泽澄清透明,无沉淀、杂质色泽较为澄清,无沉淀、杂质微浑、透明、光泽差、略带黄色浑浊、失光、缺乏黄酒应有的光泽浑浊、失光、有沉淀、有杂质有黄酒的纯正、优雅、和谐的香气、无异香有黄酒应有的香气,醇香不浓郁、无异香有黄酒应有的香气,醇香不明显、无异香缺乏黄酒应有的香气、微有异香缺乏黄酒应有的香气、有异香鲜美或甜美,醇香、柔和、爽口、无异味鲜美、醇厚、爽口,但不够柔和,无异味鲜美、尚爽口,有一定醇厚感、无异味酒体淡薄,略带涩味,略有异味有酸败、异味、杂味同时具有典型的清酒和黄酒的风格,酒体极为协调柔和具有典型的清酒和黄酒之一的风格,成分较为协调风格(25分) 酒体成分尚协调,风味明显酒体成分不协调,风味尚明显酒体不协调、风格不突出24~25 16~20 11~15 6~10 0~5 24~25 16~20 11~15 6~10 0~5 24~25 16~20 11~15 6~10 0~5 24~25 16~20 11~15 6~10 0~5
(3)抗氧化活性测定
总酚的测定:参考WU L F等[20]的方法,以没食子酸标准品质量浓度(x)为横坐标,波长765 nm处的吸光度值(y)为纵坐标,绘制没食子酸标准曲线,得到标准曲线回归方程为:y=0.411 7x+0.125 5,相关系数R2=0.999 5。 按照回归方程计算样品总酚含量,结果以没食子酸当量表示。
总黄酮的测定:参考李丹青等[21]的方法,以芦丁标准品质量浓度(x)为横坐标,波长510 nm处的吸光度值(y)为纵坐标,绘制芦丁标准曲线,得到标准曲线回归方程为:y=3.74 3 9x+0.124 9,R2=0.997 4,按照回归方程计算样品总黄酮含量,结果以芦丁当量表示。
DPPH·清除率的测定[22]:配制100 μmol/L的DPPH-甲醇溶液,取甲醇稀释50倍的样品1.0 mL与3 mL DPPH-甲醇溶液混合,室温避光反应30 min,于波长517nm处测吸光度值,以1.0 mL甲醇溶液代替样品操作,平行测定3次。DPPH·清除率计算公式如下:
式中:A0为甲醇与DPPH-甲醇溶液的吸光度值;A为样品与DPPH-甲醇溶液的吸光度值。
ABTS+自由基清除率的测定[23]:配制7 mmol/L的ABTS-甲醇溶液,与2.45 mmol/L的过硫酸钾溶液等体积混合避光反应12 h,得ABTS溶液,吸取适量的ABTS溶液,甲醇稀释后,在波长734 nm处测得吸光度值为0.700±0.050,即得ABTS工作液。准确吸取ABTS工作液4.9 mL与0.1 mL样品溶液混合,摇匀,室温避光反应10 min,波长734 nm处测吸光度值。对照组以0.1 mL甲醇溶液代替样品操作,平行测定3次。ABTS+自由基清除率计算公式如下:
式中:A0为对照组吸光度值;A为样品吸光度值。
1.3.5 体外模拟胃肠消化试验(1)模拟胃消化试验
取盐酸3.84 mL,加入800 mL蒸馏水,再加入胃蛋白酶10.0 g,混匀,蒸馏水定容至1 000 mL,即得胃消化模拟液[24]。
胃消化模拟[24]:将11.25 mL的胃消化模拟液与15.0 mL样品混合,加入0.75 mg 胃蛋白酶和0.5 mL盐酸溶液,调至pH为2.0,37 ℃预热15 min后在37 ℃厌氧避光环境下振荡孵育2.0 h,消化过程中每隔30 min取样。
(2)模拟肠消化试验
取磷酸二氢钾6.8 g,加入50 mL蒸馏水,0.1 mol/L氢氧化钠溶液调pH至6.8;另取胰蛋白酶1.0 g,加入蒸馏水适量使其溶解,将两液混匀,蒸馏水定容至100 mL,即得肠消化模拟液[25]。
肠消化模拟[25]:在胃消化模拟振荡孵育2.0 h的混合物中取15 mL样品,加入8.25 mL肠消化模拟液,再与1.875 mg猪胆盐混匀,并使用1 mol/L碳酸氢钠溶液将混合后消化物pH调至7.5,在37 ℃避光环境下振荡孵育2.0 h,消化过程中每隔30 min取样。
所取消化混合物样品以8 000 r/min离心15 min,取上清液并立即置于-20 ℃冰箱中,后续测定胃肠道消化过程中甘草黄酒的总酚含量、DPPH和ABTS+自由基清除率。
1.3.6 数据处理
采用SPSS 22.0软件对数据进行统计分析,应用Duncan氏新复极差法进行差异显著性检验,Microsoft Excel 2019软件作图,Design-Expert 13.0 进行响应面试验设计及结果分析。
2 结果与分析
2.1 甘草黄酒发酵工艺优化单因素试验
2.1.1 甘草酶解液添加量对甘草黄酒品质的影响
复合酶制剂可将甘草中的纤维素、半纤维素、果胶质等水解为可溶性糖,补充酵母代谢所需的碳源[26],提高产酒率。 甘草中的甘草甜素可增加黄酒的甘甜味道,能够平衡酒体的苦涩感,使酒体更柔和,口感更佳[27]。甘草酶解液添加量对甘草黄酒品质影响结果见图1。
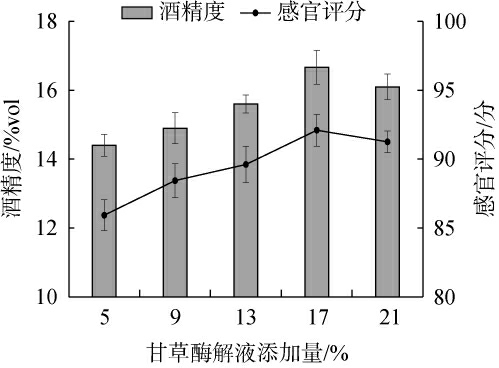
图1 甘草酶解液添加量对甘草黄酒品质的影响
Fig.1 Effect of liquorice enzyme solution addition on the quality of liquorice Huangjiu
由图1可知,当甘草酶解液添加量在5%~17%时,酒精度和感官评分随甘草酶解液添加量的增加呈上升趋势;当甘草酶解液添加量为17%时,酒精度和感官评分均达到最大值,分别为(16.72±0.49)%vol、(92.1±1.16)分;当甘草酶解液添加量为17%~21%时,酒精度和感官评分均略有下降。 可能由于甘草酶解液的过量添加,造成酚酸类化合物积累对酵母活性产生抑制作用,影响乙醇的生成[28],药草味过浓及苦味物质溶出的增加,破坏了酒体的风味协调性。因此,最适甘草酶解液添加量为17%。
2.1.2 酒曲添加量对甘草黄酒品质的影响
酒曲作为糖化发酵剂,丰富的酶系可水解淀粉类、纤维素类物质,为酵母代谢生成乙醇提供充足的碳源。 酒曲添加量对甘草黄酒品质影响结果见图2。
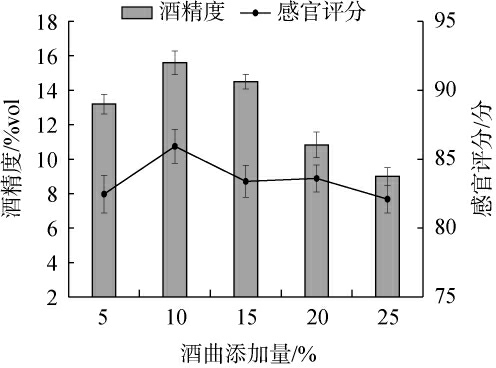
图2 酒曲添加量对甘草黄酒品质的影响
Fig.2 Effect of Jiuqu addition on the quality of licorice Huangjiu
由图2可知,酒精度随酒曲添加量在5%~25%范围内的增加呈先上升后下降的趋势。当酒曲添加量在5%~10%时,感官评分和酒精度随之增高。随着酒曲添加量的增大,能够促进酵母的生长繁殖,使其不断代谢产生更多的乙醇;当酒曲添加量为10%时,感官评分和酒精度最高,分别为(15.6±0.69)%vol、(85.93±1.24)分;当酒曲添加量>10%之后,酵母繁殖速度加快,发酵液中的糖分被大量消耗,碳源供应不足进而导致产酒率下降[29]。感官评分有所下降,可能与酸类物质过量,产生酸涩味,及杂醇含量过高有关[30]。因此,最适酒曲添加量为10%。
2.1.3 前发酵时间对甘草黄酒品质的影响
甘草黄酒前发酵过程中,酵母将黍米和甘草中酶解后的可发酵性糖转化为酒精和二氧化碳。前发酵时间越长,酵母就有更多的时间消耗糖分,产生更多的酒精。前发酵时间还直接影响黄酒的风味复杂度和色泽,但前发酵时间过长会导致发酵液中糖分耗尽,无法为酵母的正常代谢提供足够的碳源,使得产酒率下降;不良风味物质开始生成或积累,同时酵母菌活性下降,导致酒体风味平衡被破坏[31]。前发酵时间对甘草黄酒品质影响结果见图3。
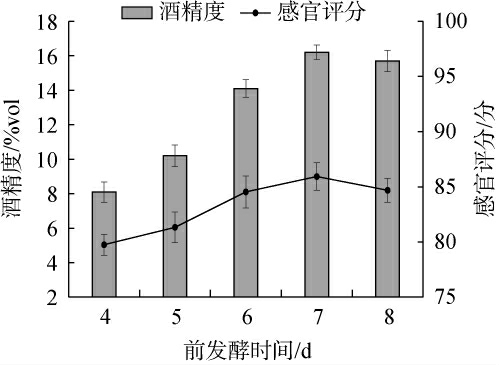
图3 前发酵时间对甘草黄酒品质的影响
Fig.3 Effect of pre-fermentation time on the quality of licorice Huangjiu
由图3可知,当前发酵时间在4~7 d范围,随着前发酵时间的延长,酒精度和感官评分呈明显上升趋势。当前发酵时间为7 d时,酒精度和感官评分为最高,分别为(16.2±0.42)%vol、(85.93±1.26)分;当发酵时间>7 d之后,酒精度和感官评分有所降低。因此,最适前发酵时间为7 d。
2.1.4 前发酵温度对甘草黄酒品质的影响
前发酵温度较低的环境,酵母代谢缓慢,随着温度升高,酵母代谢活动加快,产酒率增加,而温度继续上升,会导致酵母提前衰亡,发酵不能正常进行,酒精度下降[32]。随着前发酵温度的升高,能够促进不同微生物代谢产物的生成,赋予酒体独特的色泽、香气和口感,而前发酵温度过高某些微生物的代谢活动受到抑制,导致风味物质的生成减少,易引起美拉德反应产生褐变,色泽变差[33]。前发酵温度对甘草黄酒品质影响结果见图4。
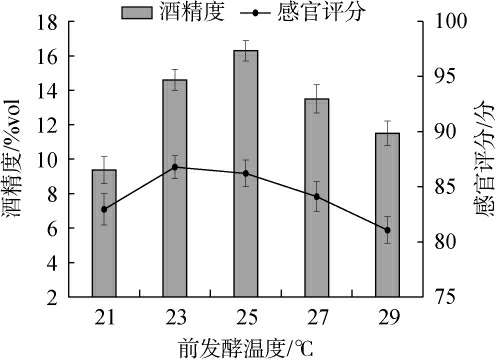
图4 前发酵温度对甘草黄酒品质的影响
Fig.4 Effect of pre-fermentation temperature on the quality of licorice Huangjiu
由图4可知,当前发酵温度在21~25 ℃时,酒精度随发酵温度升高而上升;当前发酵温度为25 ℃时,酒精度达最大值,为(16.3±0.59)%vol;当前发酵温度>25 ℃之后,酒精度有所下降。当前发酵温度在21~23 ℃时,感官评分呈明显上升趋势;当前发酵温度为23 ℃时,感官评分达最大值,为(86.78±1.26)分;当前发酵温度>25 ℃之后,感官评分逐渐下降。因此,综合考虑,最适前发酵温度为25 ℃。
2.2 响应面试验优化
2.2.1 Box-Behnken响应面试验优化
酒精度是判断黄酒品质的重要指标之一,通过单因素试验结果分析得到甘草酶解液添加量、酒曲添加量、前发酵温度对酒精度的影响较显著。 因此,固定前发酵时间为7 d,以酒精度(Y)为响应值,甘草酶解液添加量(X1)、酒曲添加量(X2)、前发酵温度(X3)为自变量,对甘草黄酒发酵工艺进行响应面试验优化,Box-Behnken试验设计与结果见表3,方差分析结果见表4。
表3 甘草黄酒发酵工艺优化Box-Behnken试验设计与结果
Table 3 Design and results Box-Behnken experiments for fermentation process optimization of licorice Huangjiu
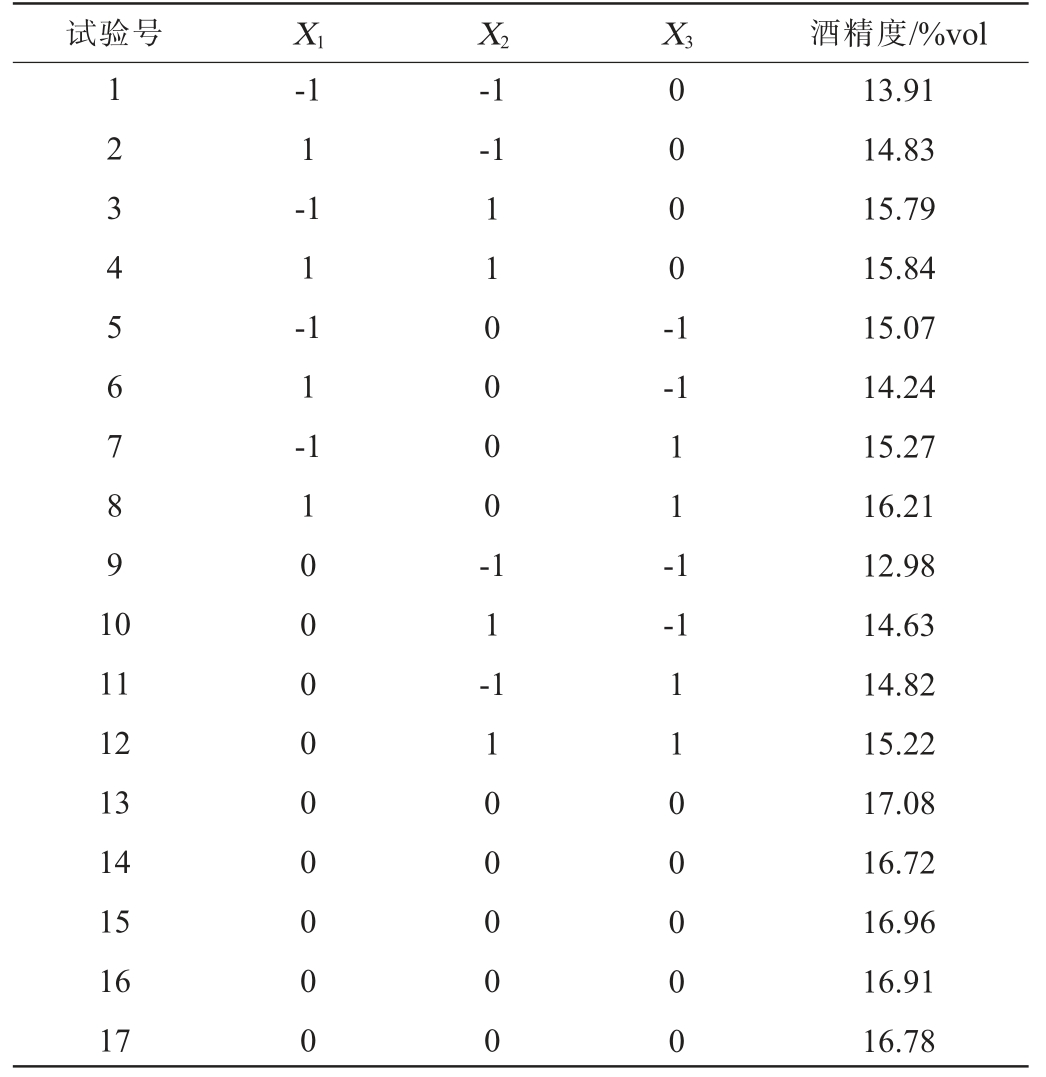
试验号 X1 X2 X3 酒精度/%vol 1 2 3 4 5 6 7 8 9 1 0-1 1-1 1-1 1-1-1-1 1 1 0 0 0 0 -0 0 0 0 -1-1 1 1 -1-1 11 12 13 14 15 16 17 1 0 0 0 0 0 0 0 0 0 1 1 -1 1 0 0 0 0 0 1 1 0 0 0 0 0 13.91 14.83 15.79 15.84 15.07 14.24 15.27 16.21 12.98 14.63 14.82 15.22 17.08 16.72 16.96 16.91 16.78
表4 回归模型方差分析
Table 4 Variance analysis of regression model
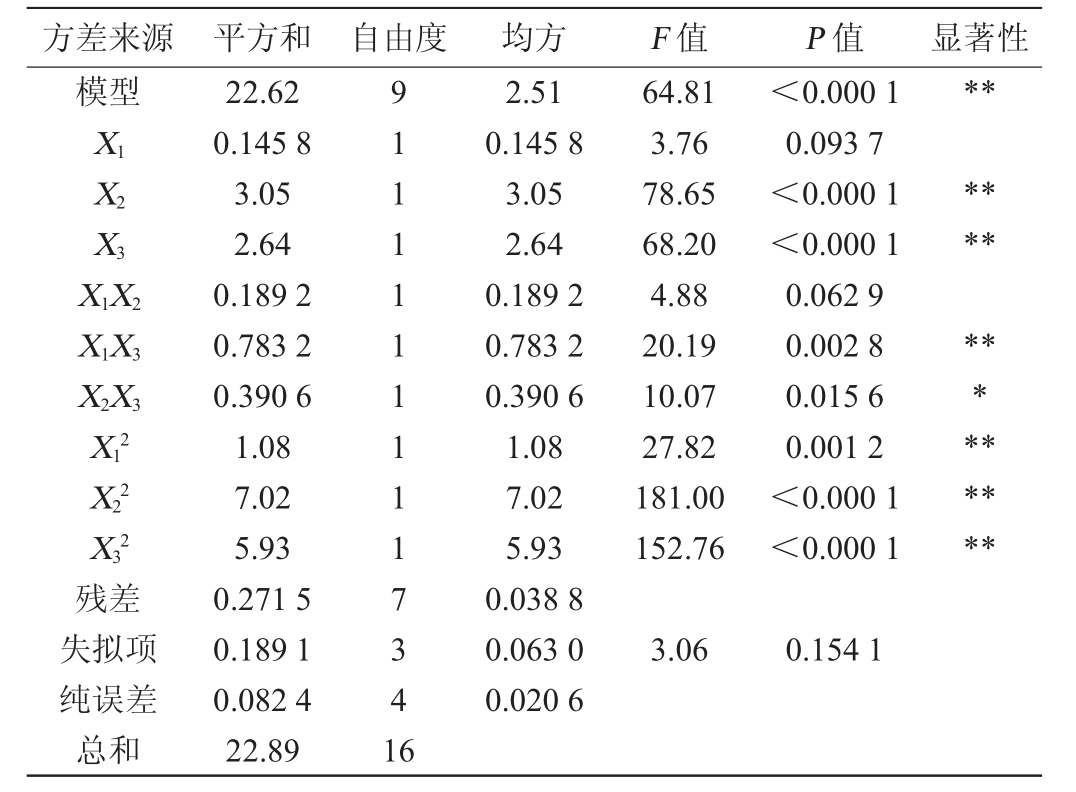
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型**X1X2X3****X1X2 X1X3 X2X3 X12 X22 X32 64.81 3.76 78.65 68.20 4.88 20.19 10.07 27.82 181.00 152.76<0.000 1 0.093 7<0.000 1<0.000 1 0.062 9 0.002 8 0.015 6 0.001 2<0.000 1<0.000 1*********残差失拟项纯误差总和22.62 0.145 8 3.05 2.64 0.189 2 0.783 2 0.390 6 1.08 7.02 5.93 0.271 5 0.189 1 0.082 4 22.89 91111111117341 6 2.51 0.145 8 3.05 2.64 0.189 2 0.783 2 0.390 6 1.08 7.02 5.93 0.038 8 0.063 0 0.020 6 3.06 0.154 1
根据响应面试验结果,利用Design-Expert13.0软件进行回归拟合分析,可得到二次多项式拟合回归方程:Y=16.89+0.135 0X1+0.617 5X2+0.575 0X3-0.217 5X1X2+0.442 5X1X3-0.312 5X2X3-0.506 3X12-1.29X22-1.19X32。
由表4可知,回归模型F值=64.81,P值<0.000 1,说明模型极显著,失拟项P值=0.154 1>0.05,不显著,说明模型在研究的整个回归区域内拟合较好,在回归模型中,决定系数R2=0.988 1,调整决定系数R2adj=0.972 9,预测决定系数R2pred=0.862 2,且R2adj与R2pred比较接近,说明甘草黄酒发酵工艺的优化具有可行性,变异系数(coefficient of variation,CV)=1.27<10%,表明试验可信度和精确度高。由P值可知,一次项X2、X3,交互项X1X3,二次项X12、X22、X32对结果影响极显著(P<0.01);交互项X2X3对结果影响显著(P<0.05)。由F值可知,对甘草黄酒酒精度影响次序为酒曲添加量(X2)>前发酵温度(X3)>甘草酶解液添加量(X1)。
2.2.2 因素间交互作用对甘草黄酒酒精度的影响
由图5可知,甘草酶解液添加量(X1)和酒曲添加量(X2)响应曲面较平缓,等高线呈圆形,表明甘草酶解液添加量和酒曲添加量交互作用对酒精度无显著影响;甘草酶解液添加量(X1)和前发酵温度(X3)响应曲面较陡峭,等高线呈椭圆形,表明甘草酶解液添加量和前发酵温度对酒精度的影响较大;酒曲添加量(X1)和前发酵温度(X3)响应曲面最陡峭,等高线偏椭圆形,表明酒曲添加量和前发酵温度对酒精度的影响显著。这与方差分析结果一致。
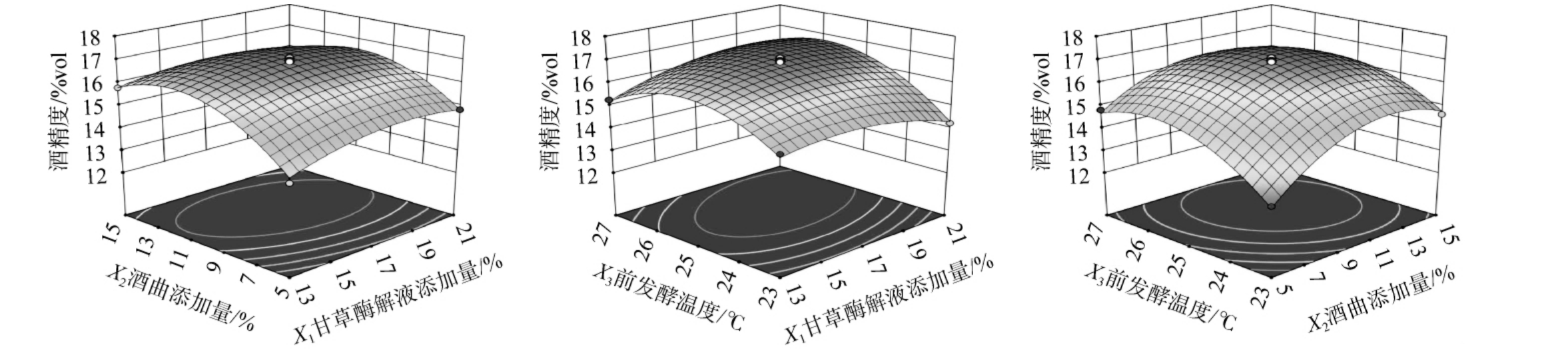
图5 甘草酶解液添加量、酒曲添加量、前发酵温度间交互作用对甘草黄酒酒精度影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effect of interaction between licorice enzymatic hydrolysate addition, Jiuqu addition and pre-fermentation temperature on alcohol content of licorice Huangjiu
2.2.3 最佳发酵工艺的确定及验证试验
利用Design-Expert13.0软件对回归方程取一阶偏导,得甘草黄酒发酵最佳工艺参数为甘草酶解液添加量17.8154%、酒曲添加量10.955 1%、前发酵温度25.509 3 ℃。在此条件下,酒精度预测值为17.0361%vol。为实际操作方便,将上述最优发酵工艺参数修正为甘草酶解液添加量17.8%、酒曲添加量11.0%、前发酵温度26 ℃。 在此优化条件下进行3次平行验证试验,酒精度平均实际值为17.0%vol,与预测值拟合度良好,吻合率可达95.5%,说明此回归模型有效可靠。
2.3 甘草黄酒品质评价
发酵工艺优化后的甘草黄酒与未加甘草的普通黄酒,理化指标和感官评分结果见表5。 由表5可知,甘草黄酒和普通黄酒理化指标和感官评分符合国标GB/T 13662—2018《黄酒》中特型黄酒和传统型半干黄酒要求。甘草黄酒总酸、总糖、总酚、总黄酮、酒精度、感官评分等指标显著增加(P<0.05),能够使酒体风味协调,风味口感提升。
表5 不同黄酒理化指标和感官评分测定结果
Table 5 Determination results of physicochemical indexes and sensory scores of different Huangjiu

注:“*”表示两种黄酒指标差异显著(P<0.05)。
样品 总酸/(g·L-1) 总糖/(g·L-1) pH值 总酚/(mg·mL-1) 总黄酮/(mg·mL-1) 酒精度/%vol 感官评分/分普通黄酒甘草黄酒5.1±0.06 6.8±0.05*15.07±0.05 33.58±0.04*3.53±0.14 3.55±0.18 0.64±0.03 1.32±0.02*0.62±0.03 1.04±0.02*14.4±0.11 17.0±0.05*83.65±0.45 91.44±0.64*
2.4 模拟胃肠体外消化过程中总酚含量及抗氧化活性的变化
模拟人体消化过程分为胃、肠消化两个阶段,第一阶段胃消化0~2.0 h和第二阶段肠消化2.0~4.0 h[35]。普通黄酒和甘草黄酒在模拟胃肠消化过程中总酚含量及抗氧化活性变化结果见图6。
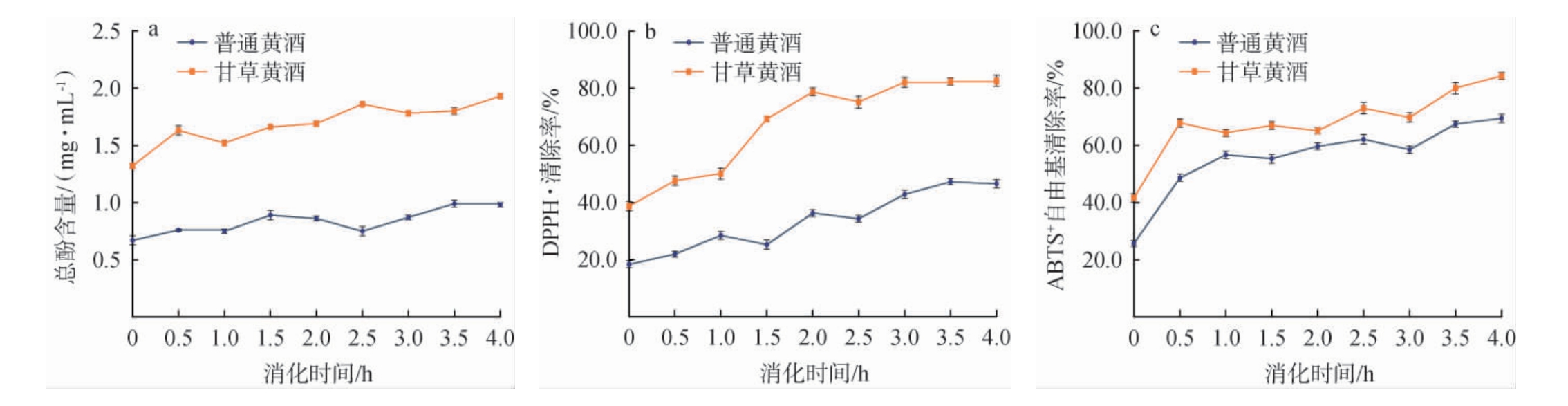
图6 不同黄酒在模拟胃肠消化过程中总酚含量(a)、DPPH(b)及ABTS+(c)自由基清除率的变化
Fig.6 Changes of total phenolic contents (a), DPPH (b) and ABTS+(c) free radical scavenging rates of different Huangjiu during simulation of gastrointestinal digestion process
由图6a可知,普通黄酒和甘草黄酒在整个消化过程中,总酚含量均呈整体缓慢上升趋势,甘草黄酒在消化各阶段的总酚含量明显高于普通黄酒。胃消化阶段(0~2.0 h),普通黄酒总酚含量缓慢升高,胃消化至1.5 h总酚含量达最大值(0.89±0.01)mg/mL,随后缓慢下降,普通黄酒原料主要为黍米,在胃酸中部分降解为低聚糖,能够增强总酚的溶解性,使得胃消化初期总酚含量上升,但随着时间延长,部分总酚可能因酸性水解或结构降解而略有减少[34]。甘草黄酒中的黄酮类化合物,能够通过抗氧化作用保护总酚的稳定性,同时其皂苷成分可促进总酚与基质的解离,增强释放效率[35],因此甘草黄酒在胃消化结束期(2.0 h),总酚含量达最大值,为(1.69±0.02)mg/mL。 肠消化阶段(2.0~4.0 h)中的胰蛋白酶在消化初期可能会迅速分解与普通黄酒中总酚结合的蛋白质或脂质载体,导致游离多酚暴露于碱性环境中,引发氧化或降解,导致普通黄酒总酚的含量小幅下降[36];随着肠消化时间延长,总酚含量又呈现持续上升的趋势,可能由于部分多酚以结合态形式存在,后期水解进一步释放,含量增多。而甘草黄酒总酚含量在肠消化阶段,仍保持持续增长的趋势,肠消化至4.0 h时,总酚含量达最大值,为(1.93±0.02)mg/mL。
由6b可知,甘草黄酒DPPH自由基清除率在胃肠消化阶段,均明显高于普通黄酒,且不同黄酒的清除率整体呈逐渐上升趋势。胃消化阶段(0~2.0 h),普通黄酒的DPPH自由基清除率在消化至2.0 h时,较初始提高了17.94%,表明胃酸环境能促进黄酒中抗氧化成分的释放或激活,而甘草黄酒则提高了39.98%,增幅明显高于普通黄酒,可能与甘草黄酒中抗氧化物质的多样性有关,甘草中的黄酮类化合物和皂苷在酸性条件下能够通过螯合自由基或增强电子传递能力,协同提升甘草黄酒的抗氧化活性[37]。肠消化阶段(2.0~4.0 h),普通黄酒DPPH自由基清除率增长了10.28%,甘草黄酒增幅较小,为3.83%,但对比消化4.0 h的DPPH自由基清除率,甘草黄酒比普通黄酒高35.94%。肠消化过程中,由于甘草黄酒的总酚含量高于普通黄酒,在胰蛋白酶的作用下,总酚与蛋白质的共价键断裂,能够释放更多的抗氧化物质[38],因而DPPH自由基清除率提升。
由图6c可知,不同黄酒的ABTS+自由基清除率与DPPH·清除率变化趋势较一致,整体仍呈现持续升高,且甘草黄酒各阶段均高于普通黄酒。胃消化阶段的初期0~0.5 h,甘草黄酒和普通黄酒的ABTS+自由基清除率迅速升高,之后随消化时间延长,普通黄酒升高缓慢,甘草黄酒变化较稳定,较初始消化,普通黄酒和甘草黄酒分别提高了33.91%、23.42%,但消化4.0 h时,甘草黄酒高于普通黄酒3.44%。胃消化环境pH2.0左右,能够促进部分多酚和抗氧化肽的释放,但由于普通黄酒缺乏保护机制,某些抗氧化成分在酸性条件下发生水解或氧化,导致ABTS+自由基清除率低于甘草黄酒。 肠消化阶段(2.0~4.0 h),普通黄酒和甘草黄酒分别提高了9.77%、19.12%,甘草黄酒增幅高于普通黄酒,且在消化至4.0 h时甘草黄酒ABTS+自由基清除率比普通黄酒高14.79%。肠消化环境pH升高,多酚化合物芳香环酚性羟基能够去质子化,自由基清除能力增强,因而不同黄酒ABTS+自由基清除率升高。 甘草酸能够调节肠道的pH,缓解抗氧化成分对碱敏感性,降低氧化应激损伤,因此甘草黄酒的ABTS+自由基清除率更强。
3 结论
在考察甘草酶解液添加量、酒曲添加量、前发酵温度、前发酵时间对甘草黄酒酒精度及感官评分的单因素试验基础上,以酒精度为响应值,进行Box-Behnken试验优化甘草黄酒发酵工艺。 结果表明,甘草黄酒最优发酵工艺条件为甘草酶解液添加量17.8%、酒曲添加量11.0%、前发酵温度26 ℃。在此条件下,甘草黄酒酒精度为17.0%vol。优化后的甘草黄酒与未添加甘草的普通黄酒的理化指标进行对比,总酸、总糖、总酚、总黄酮、酒精度及感官评分均有明显升高。 体外模拟胃肠消化阶段,甘草黄酒的总酚、DPPH和ABTS+自由基清除率从胃消化开始至肠消化结束,均呈整体上升趋势,且在胃肠消化各阶段总酚含量和抗氧化活性均明显高于普通黄酒。本研究结果为甘草黄酒的开发提供了理论基础和技术支持。
[1]张江宁,丁卫英,张玲,等.黄酒酿造技术的研究进展及发展态势[J].农产品加工,2019(18):61-62.
[2]WANG X Y, TIAN R G, YANG H Y, et al.Effect of baking technique for rice wine production and the characteristics of baked rice wine[J].J Sci Food Agr,2022,102(4):1498-1507.
[3]马琳娜,邱树毅,王啸.不同黄酒酒曲的酿造微生物与风味物质之间的关系[J].食品与发酵科技,2021,57(3):81-89.
[4]YANG Y,REN Q X,ZHOU Z L,et al.Structural elucidation of a highly branched α-D-glucan from Huangjiu and its hepatoprotective activity via gut microbiome regulation and intestinal barrier repairment[J].Carbohyd Polym,2024,324:121423.
[5]邢爽,丁斌,蒲顺昌,等.发酵型保健黄酒的研究进展[J].酿酒科技,2020(1):65-70,74.
[6]程旺开,华文博,张冬冬,等.决明子保健黄酒的酿造工艺研究[J].宜春学院学报,2023,45(12):85-89.
[7]黄和升,王海平,陶书中,等.铁皮石斛保健黄酒发酵工艺优化及成分变化规律[J].中国酿造,2023,42(3):84-88.
[8]顾逸菲,李江,赵福权,等.发酵型枳椇子黄酒抗氧化能力及活性成分的分析[J].食品工业科技,2022,43(7):368-375.
[9]王楠,徐巧红,高颖瑞,等.党参黄酒的酿造工艺优化及体外抗氧化活性研究[J].中国酿造,2023,42(6):178-185.
[10]韩维维,方东军,李陆军,等.甘草化学成分及生物活性研究进展[J].化学工程师,2022,36(2):56-58,67.
[11]韩磊,贾娟,岳亚锋.药食同源甘草的生物活性及其在食品中应用的研究[J].粮食与食品工业,2024,31(6):53-55,61.
[12]李伟,张东向,刘丽杰,等.甘草细胞总黄酮提取及抗氧化活性研究[J].饲料研究,2022,45(24):68-72.
[13]ZHANG E X, YIN S T, ZHAO C, et al.Involvement of activation of PLIN5-Sirtl axis in protective effect of glycycoumarinon hepatic lipotoxicity[J].Biochem Bioph Res Co,2020,528(1):7-13.
[14]黄蓉,李晴霞,何秀娟,等.基于UPLC-LTQ-Orbitrap MS探究生、炙甘草黄酮类成分及其抗氧化活性差异[J].中国现代中药,2023,25(12):2471-2478.
[15]于霖淼.甘草多糖提取动力学、理化特性及生物活性研究[D].兰州:兰州理工大学,2021.
[16]张卿.体外人胃肠模拟系统的研究进展[J].生物化工,2016,2(4):65-68.
[17]郭佳垚,张伟,李倩倩,等.基于模拟胃消化对小米黄酒抗氧化活性的影响[J].中国酿造,2021,40(6):109-112.
[18]赵勇,雷湘兰,蔡仁教,等.富硒蓝莓全果果酒体外消化特性研究[J].中国酿造,2022,41(10):100-105.
[19]孙彦敏.白首乌保健黄酒的制作工艺与质量研究[D].济南:山东中医药大学,2015.
[20]WU L F, WU W H, CAI Y Z, et al.HPLC fingerprinting-based multivariate analysis of phenolic compounds in mango leaves varieties: Correlation to their antioxidant activity and in silico α-glucoidase inhibitory ability[J].J Pharmaceut Biomed,2020,191:113616.
[21]李丹青,徐园若,成超超,等.苦荞黄酒发酵过程中功能性物质含量与体外抗氧化活性分析[J].酿酒科技,2023(6):65-70.
[22]张文刚,张杰,党斌,等.藜麦黄酒发酵工艺优化及抗氧化特性研究[J].食品与机械,2019,35(12):174-178,226.
[23]黄清铧,胡彪,王丽宁,等.客家黄酒发酵过程活性成分及抗氧化能力分析[J].食品科技,2024,49(1):72-77.
[24]汪江波,薛超越,朱嘉璐,等.板枣发酵酒的生产工艺优化及体外消化[J].食品工业科技,2024,45(8):143-150.
[25]王静,韩莹,罗茜,等.体外模拟胃肠消化过程中猕猴桃抗氧化成分及活性的变化[J].食品与生物技术学报,2020,39(11):49-55.
[26]李亚新.两种复合菌剂及酶制剂发酵四种中草药药渣的效果研究[D].杨凌:西北农林科技大学,2018.
[27]MORA M R,DANDO R.The sensory properties and metabolic impact of natural and synthetic sweeteners[J].Compr Rev Food Sci Food Safety,2021,20(2):1554-1583.
[28]刘洋.葡萄汁有孢汉逊酵母降酸发酵对山楂浆功效成分及抗氧化性影响研究[D].秦皇岛:河北科技师范学院,2024.
[29]王春艳,于海彦,乔志航,等.红小米黄酒发酵过程中风味物质与细菌菌群分析[J].食品研究与开发,2022,43(11):102-108.
[30]张晶,刘双平,周志磊,等.麦曲添加量对黄酒酿造及其风味的影响[J].食品与机械,2020,36(4):56-61.
[31]WANG J,ZHANG B,WU Q,et al.Sensomics-assisted flavor decoding of coarse cereal Huangjiu[J].Food Chem,2022,381:132296.
[32]刘朋肖,刘玉春,李晨语,等.酿酒酵母Y3401产乙醇条件优化及其产香特性[J].中国食品学报,2021,21(4):168-178.
[33]吕雅娟,盖青青.四种保健黄酒中的挥发性组分分析[J].酿酒,2024,51(5):81-87.
[34]王旭辉,钟方丽,王晓林,等.体外模拟胃肠消化过程中黑果腺肋花楸果提取物活性成分及其抗氧化作用变化规律[J].食品研究与开发,2024,45(4):89-95.
[35]韩维维,方东军,李陆军,等.甘草化学成分及生物活性研究进展[J].化学工程师,2022,36(2):56-58,67.
[36]王静,韩莹,罗茜,等.体外模拟胃肠消化过程中猕猴桃抗氧化成分及活性的变化[J].食品与生物技术学报,2020,39(11):49-55.
[37]尹慧慧.甘草酸及黄酮的生物转化与甜叶菊成分分析研究[D].南京:南京师范大学,2018.
[38]郑云枫,孙捷,段伟萍,等.光果甘草三萜皂苷类化学成分研究[J].药学学报,2021,56(1):289-295.