短乳杆菌(Lactobacillus brevis)作为一种兼性厌氧的革兰氏阳性菌,是一种专性异型发酵的乳杆菌,能通过代谢产生乳酸、乙酸、二氧化碳等[1]。 短乳杆菌不仅与其他乳杆菌一样,能产酸抑制有害菌群滋生,维持肠道微生态平衡、促进消化吸收,大量研究表明,其还能有效缓解Ⅱ型糖尿病和通过谷氨酸脱羧酶催化产生γ-氨基丁酸[2-3]。短乳杆菌作为果蔬发酵中的常见微生物,是公认安全的食品级微生物,能改善食品风味、抑制杂菌生长和具有较强的降亚硝酸盐能力等[4]。 FAN X等[5]使用短乳杆菌发酵酸奶,产品富含γ-氨基丁酸的同时质构、风味、营养成分显著提升。
为实现高密度培养,首先需要合格的种子液作为基础,控制发酵温度、pH值等核心参数,并对培养基碳源、氮源、无机盐等营养成分和缓冲盐等发酵助剂的种类和添加量进行优化。李娜[6]通过优化植物乳杆菌ZJ316的培养温度、pH值、转速、培养基碳源、氮源、无机盐、缓冲盐和吐温等培养条件,菌株生长对数期延长、OD值增加超过1倍,效果显著。因此,培养条件对于高密度培养十分关键,直接影响着发酵的成本和质量。
发酵动力学是一种研究微生物在发酵过程中菌体生长、底物消耗和产物生成随发酵时间变化动态定量规律的方法。建立发酵动力学模型可以有效地控制发酵过程、预测发酵变化、优化发酵工艺,常用Logistic、Luedeking-Pire等方程模型进行拟合。TAN X等[7]通过优化发酵温度、接种量、时间,并建立发酵动力学模型,掌握发酵规律的同时生物量显著提升。 林一[8]建立并根据片球菌发酵动力学模型,调整初始糖浓度和补料策略,使菌体和细菌素的产量明显提升。
本研究以短乳杆菌(Lactobacillus brevis)PC206为研究对象,通过设计单因素和响应面试验,对培养基组成和培养条件以及种子液(种龄和贮藏时间)进行优化,并建立菌体生长、葡萄糖消耗和总酸生成发酵动力学模型,以期为工业化生产短乳杆菌奠定基础和提供理论依据。
1 材料与方法
1.1 材料与试剂
短乳杆菌(Lactobacillus brevis)PC206:四川省食品发酵工业研究设计院有限公司菌种保藏实验室。
蔗糖、果糖、乳糖、海藻糖、葡萄糖(均为分析纯)、牛肉膏、牛肉膏粉、大豆肽、玉米肽、蛋白胨、酵母浸粉(均为生化试剂):北京奥博星生物技术有限责任公司。 其余化学试剂均为分析纯:成都市科隆化学品有限公司。
MRS培养基:蛋白胨10 g/L、酵母粉5 g/L、牛肉膏10 g/L,磷酸氢二钾2 g/L、柠檬酸氢二铵2 g/L、乙酸钠5 g/L、葡萄糖20 g/L、吐温-80 1 g/L、七水合硫酸镁0.58 g/L、四水合硫酸锰0.25 g/L,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SPX-150B-4生化培养箱:上海博讯实业有限公司医疗设备厂;TG-16高速离心机:四川蜀科仪器有限公司;SW-CJ-1F洁净工作台:苏州安泰空气技术有限公司;752G紫外可见分光光度计、PHSJ-3FpH计:上海仪电分析仪器有限公司;BLBIO-5GJ全自动发酵罐:上海百仑生物科技有限公司;YN12-0.7-D全自动电加热蒸汽发生器:上海扬诺锅炉制造有限公司;ESJ200-4A电子天平:沈阳龙腾电子有限公司;LDZF-75L-II立式压力蒸汽灭菌器:上海申安医疗器械厂。
1.3 实验方法
1.3.1 菌种活化与培养
(1)菌种活化
将-80℃冰箱中保藏的短乳杆菌PC206甘油管置于37 ℃培养箱中解冻,按5%(V/V)的接种量接种到无菌MRS培养基中,37 ℃培养24 h,备用。
(2)种子液制备
取上述活化后的菌种,按2%(V/V)的接种量接种到无菌MRS培养基中,37 ℃培养24 h,置于4 ℃冰箱中备用。
(3)菌种基础培养条件
取上述种子液,按2%(V/V)的接种量接种到50mL/150mL装液量的无菌MRS培养基中,37 ℃培养24 h,作为待测样品。
1.3.2 发酵培养基组成优化试验
在MRS培养基的基础上,改变单一变量碳源(蔗糖、果糖、乳糖、海藻糖、葡萄糖)及最佳碳源添加量(10 g/L、15 g/L、20 g/L、25 g/L、30 g/L),氮源(蛋白胨、草酸铵、牛肉膏粉、硫酸铵、酵母浸粉、大豆肽、玉米肽)及最佳氮源添加量(15 g/L、20 g/L、25 g/L、30 g/L、35 g/L),无机盐(硫酸镁、硫酸锰、氯化钾、氯化钠)及最佳无机盐添加量(0、0.25 g/L、0.50g/L、0.75g/L、1.00g/L),生长因子(赖氨酸、精氨酸、半胱氨酸、抗坏血酸、维生素B1)及精氨酸添加量(0、0.25g/L、0.50g/L、0.75 g/L、1.00 g/L),缓冲盐(磷酸二氢钾、柠檬酸氢二铵和乙酸钠)及其添加量(按照MRS培养基中的添加量(即分别为2 g/L、2 g/L和5 g/L) 的0%、50%、100%、150%和200%),乳化剂(吐温-80)及其添加量(0、0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L),37 ℃培养24 h,根据OD620nm确定发酵培养基组成。
1.3.3 发酵培养基组成优化响应面试验
在单因素试验的基础上,以葡萄糖添加量(A)、酵母浸粉添加量(B)和硫酸锰添加量(C)为自变量,以短乳杆菌生物量(OD620 nm值)为响应值(Y),设计3因素3水平Box-Behnken中心组合试验对发酵培养基组成进行优化,响应面试验因素与水平见表1。
表1 培养基组成优化Box-Behnken响应面试验因素和水平
Table 1 Factors and levels of Box-Behnken response surface tests for medium composition optimization

水平 A 葡萄糖添加量/(g·L-1)C 硫酸锰添加量/(g·L-1)-1 B 酵母浸粉添加量/(g·L-1)0 01 15 20 25 10 15 20 0.25 0.50
1.3.4 培养条件优化
分别设置培养基不同初始pH值(5.5、6.0、6.5、7.0、7.5、8.0、8.5)、发酵温度(30 ℃、35 ℃、37 ℃、40 ℃、45 ℃)、装液量(25mL/150mL、50mL/150mL、75mL/150mL、100mL/150mL、125mL/150mL、150mL/150mL)、接种量(0.5%、1%、2%、4%、8%),除研究因素外,在不同接种量条件和100 mL/150 mL的装液量、37 ℃培养30 h,根据短乳杆菌生物量(OD620 nm值)确定发酵培养条件。
1.3.5 优化效果验证
为直观对比优化前后对菌生长的影响,优化前后发酵液每隔2 h测定OD620 nm值和活菌数,并以时间作为横轴,OD620 nm值和活菌数作为纵轴,绘制生长曲线。
1.3.6 发酵动力学模型建立
基于上述试验优化的结果,发酵液每隔2 h取样并测定发酵过程中菌体干质量、总酸和葡萄糖含量,参照吕明珊等[10-11]的方法拟合发酵动力学模型并计算速率,菌体生长、还原糖消耗和总酸生成曲线均为S型,可运用Logistic模型进行非线性拟合。Logistic方程微分形式如下:
将(1)求积分得积分式如(2)

式中:X为因变量(菌体干质量、总酸和葡萄糖量),g/L;t为时间,h;μm为最大比生长速率,h-1;Xm为发酵终止因变量,g/L;X0为发酵初始因变量(菌体干质量、总酸和葡萄糖量),g/L。
为验证模型,发酵液每隔5 h取样并测定发酵过程中菌体干质量、总酸和葡萄糖含量,模型预测值与试验值对比,计算误差。
1.3.7 数据处理
所有试验数据进行3次重复,结果采用平均值±标准差表示。用IBM SPSS Statistics 26.0软件进行单因素方差分析和Duncan多重比较,P<0.05表明存在统计学上的差异,用不同的字母表示。部分数据采用Origin 2022b进行绘图和拟合,采用Design Expert 8.0.6软件进行响应面试验的设计和分析。
2 结果与分析
2.1 培养基组成优化单因素试验结果
由图1A可知,葡萄糖最利于菌体的生长,其作为单糖能快速进入细胞被利用,以葡萄糖为培养基碳源时,短乳杆菌生物量(OD620 nm值)最高为2.14,显著高于其他碳源(P<0.05),因此选择培养基最佳碳源为葡萄糖。氮源根据种类被分为微生物类(酵母浸粉等)、植物类(大豆蛋白胨等)、动物类(牛肉膏等)、无机类(硫酸铵等)等[17]。由图1B可知,以酵母浸粉为培养基氮源时,短乳杆菌生物量(OD620 nm值)最高为2.39,显著高于其他氮源(P<0.05),因此选择培养基最佳氮源为酵母浸粉。由图1C可知,以硫酸锰为培养基无机盐时,短乳杆菌生物量(OD620nm值)为2.13,较空白组增加17.7%,与MRS培养基无显著性差异(P>0.05),因此选择培养基无机盐为只添加硫酸锰。由图1D可知,在培养基添加生长因子精氨酸时,短乳杆菌生物量(OD620 nm值)最高为2.62,显著高于其他生长因子。 陈园园[18]添加不同的生长因子培养德氏乳杆菌,研究也发现添加维生素B1、天冬氨酸和尿嘧啶等对菌株生长存在抑制现象。才恒[19]研究证明了精氨酸能够通过精氨酸脱亚胺酶途径迅速产生大量腺嘌呤核苷三磷酸(adenosine triphosphate,ATP),从而促进短乳杆菌的生长。 因此选择培养基最佳生长因子为精氨酸。
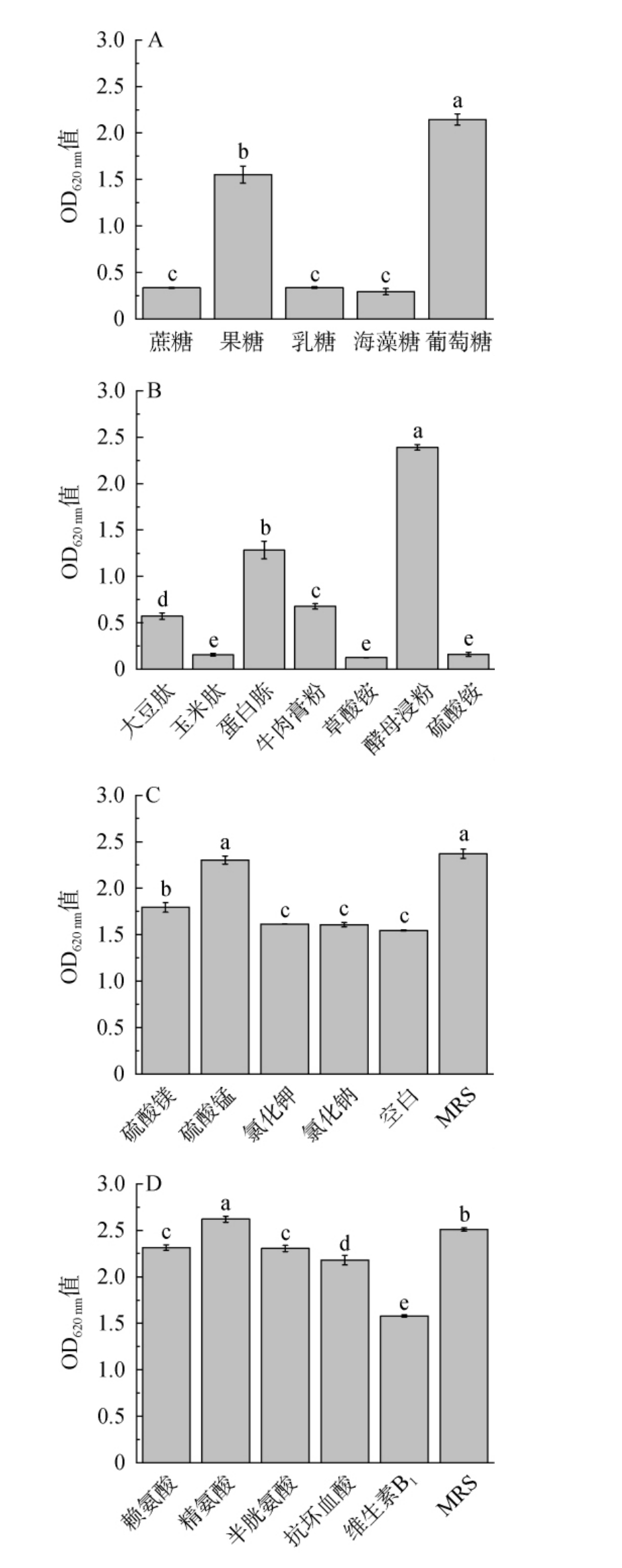
图1 不同培养基碳源(A)、氮源(B)、无机盐(C)和生长因子(D)种类对短乳杆菌生长的影响
Fig.1 Effects of different carbon sources (A), nitrogen sources (B),inorganic salts (C) and growth factors (D) types in medium on the growth of Lactobacillus brevis
不同小写字母表示数据差异显著(P<0.05)。下同。
微生物的高密度培养会受到底物和代谢物质的制约。底物浓度太低会导致营养不足限制微生物的生长,而底物浓度过高则会导致渗透压增加,这对微生物的生长也是不利的。由图2A~2C可知,随着葡萄糖、酵母浸粉和硫酸锰添加量的逐渐增加,短乳杆菌生物量(OD620nm值)均呈现先增加后趋于平稳的趋势,因此选择培养基葡萄糖、酵母浸粉和硫酸锰添加量分别为20 g/L、15 g/L和0.25 g/L。在发酵过程中,短乳杆菌会代谢产生酸性物质,这会导致发酵液的pH值降低,从而会影响细胞的活性,从而抑制菌的生长[20]。添加缓冲盐可以中和酸性物质,增加培养基稳定性,还可以补充部分无机盐[18]。由图2D可知,随着培养基缓冲盐添加量的增加,短乳杆菌生物量(OD620 nm值)呈现先增加后减少的趋势,培养基缓冲盐(磷酸二氢钾、柠檬酸氢二铵和乙酸钠)添加量分别为2 g/L、2 g/L、5 g/L时,短乳杆菌生物量(OD620nm值)最高为1.95,综合考虑,培养基中缓冲盐为磷酸二氢钾2 g/L、柠檬酸氢二铵2 g/L和乙酸钠5 g/L。 朱孔亮等[21]在研究短乳杆菌高密度培养条件时,发现缓冲盐对菌体生长存在显著影响,随着缓冲盐的增加,生物量呈现先增加后减少的趋势。由图2E可知,随着吐温-80添加量的增加,短乳杆菌生物量(OD620 nm值)变化无显著性差异(P>0.05),因此选择吐温-80添加量为0。 与贾梦雅[16]研究结果不同,发现吐温-80对短乳杆菌生长存在促进作用。由图2F可知,随着精氨酸添加量的增加,短乳杆菌生物量(OD620 nm值)呈先增加后减少的趋势,精氨酸的添加量为0.25 g/L时,短乳杆菌生物量(OD620 nm值)较高,达到2.56,与精氨酸的添加量为0.75 g/L时无显著性差异(P>0.05),从成本考虑选择精氨酸添加量为0.25 g/L。
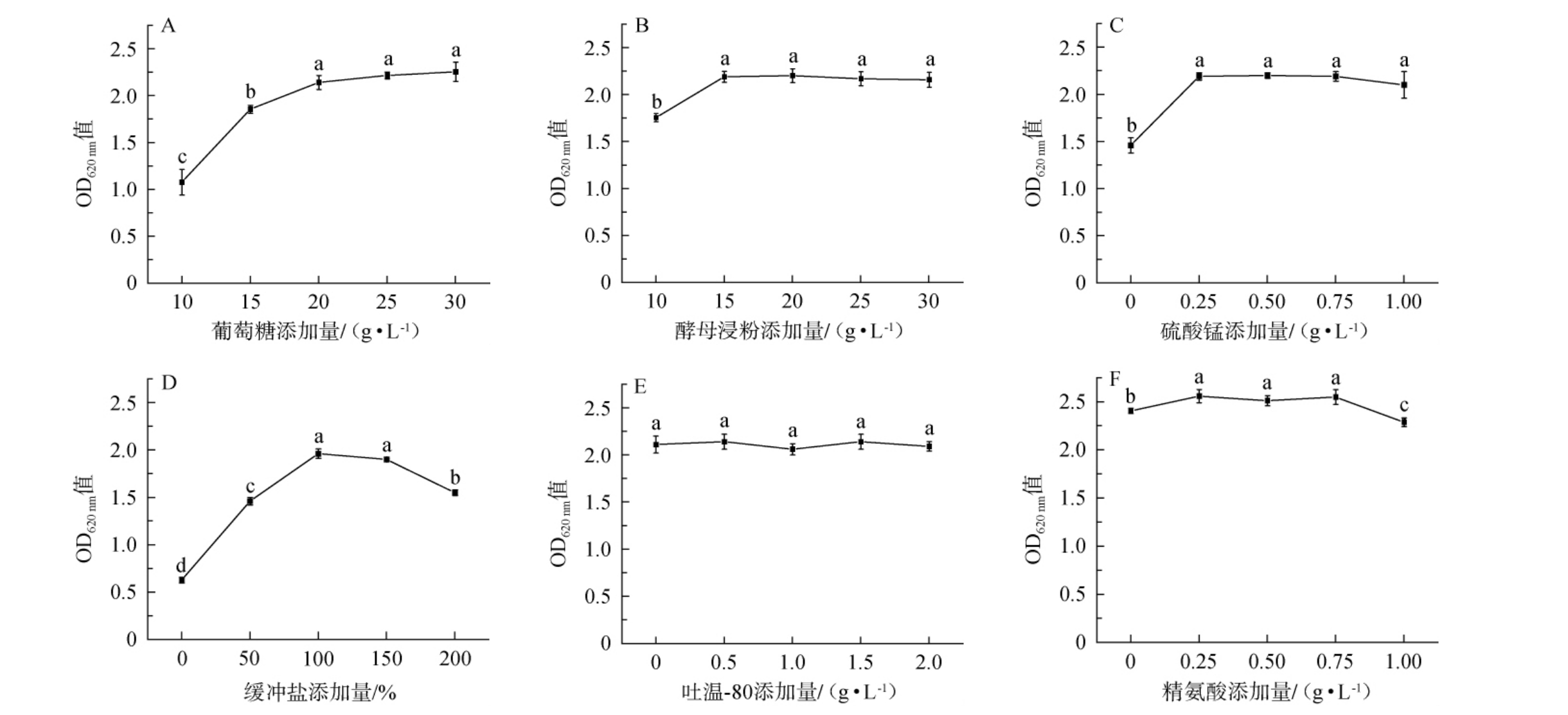
图2 葡萄糖(A)、酵母浸粉(B)、硫酸锰(C)、缓冲盐(D)、吐温-80(E)及精氨酸(F)添加量对短乳杆菌生长的影响
Fig.2 Effects of different glucose (A), yeast extract (B), manganese sulfate (C), buffer salt (D), Tween-80 (E), and arginine (F) addition on the growth of Lactobacillus brevis
2.2 培养基组成优化响应面试验结果
在单因素试验结果的基础上,对具有交互作用且最为重要的培养基碳源、氮源和无机盐的添加量进一步优化,进行Box-Behnken中心组合3因素3水平试验,试验设计与结果见表2,方差分析见表3。
表2 培养基组成优化响应面试验设计与结果
Table 2 Design and results of response surface tests for medium composition optimization
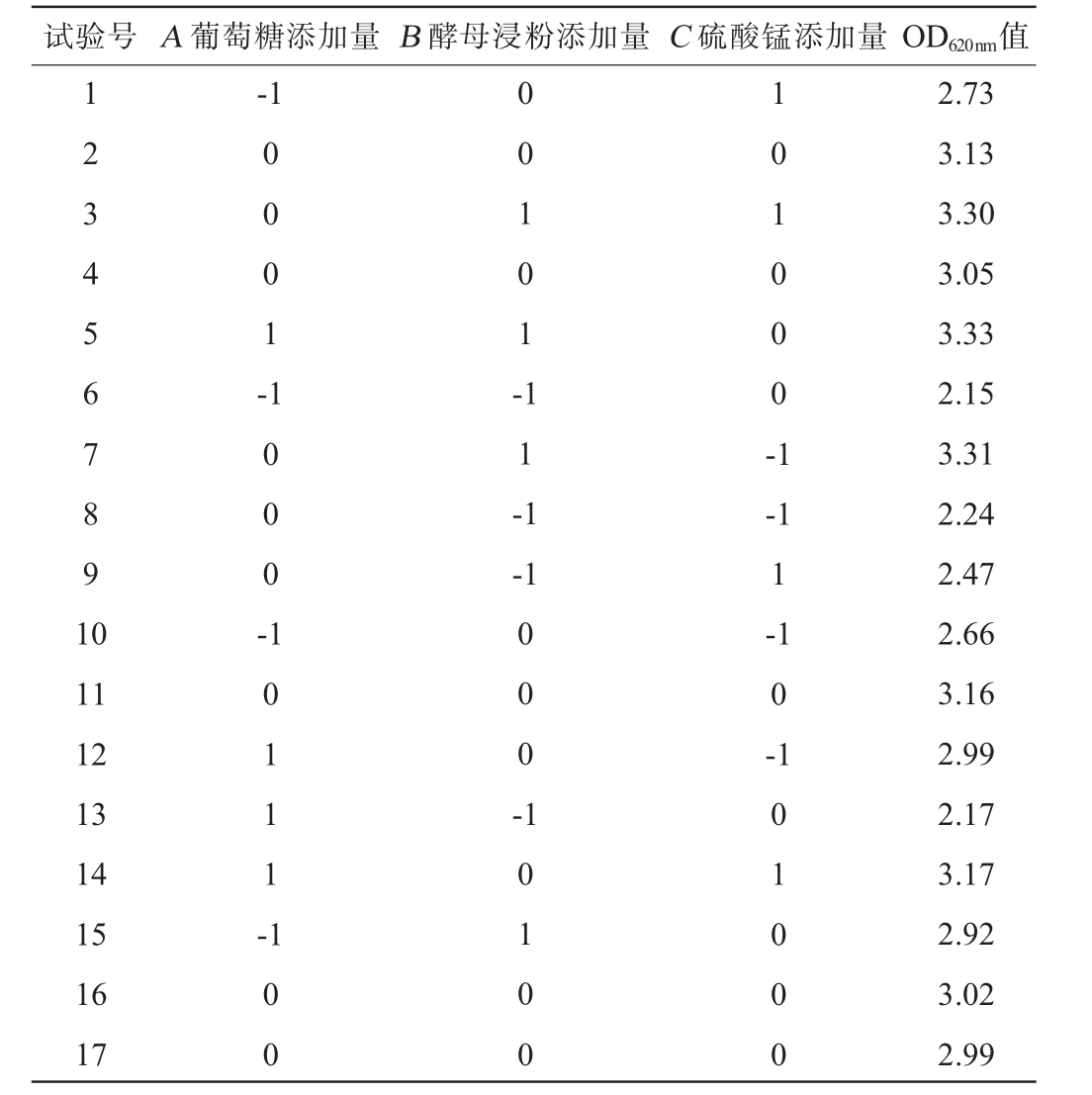
试验号 A 葡萄糖添加量B 酵母浸粉添加量C 硫酸锰添加量OD620nm值1 2 3 4 5 6 7 8 9 1 0-1 0 0 0 1 -1 0 0 0 -0 0 1 0 1 -1 1 -1 1 0 1 0 0 0 -1-1 11 12 13 14 15 16 17 1 0 1 1 1 -0 0 0 --1 1-1 0-1 1 0 0 1 0 1 0 0 0 1 0 0 0 2.73 3.13 3.30 3.05 3.33 2.15 3.31 2.24 2.47 2.66 3.16 2.99 2.17 3.17 2.92 3.02 2.99
表3 响应面试验结果方差分析
Table 3 Analysis of variance of response surface tests results
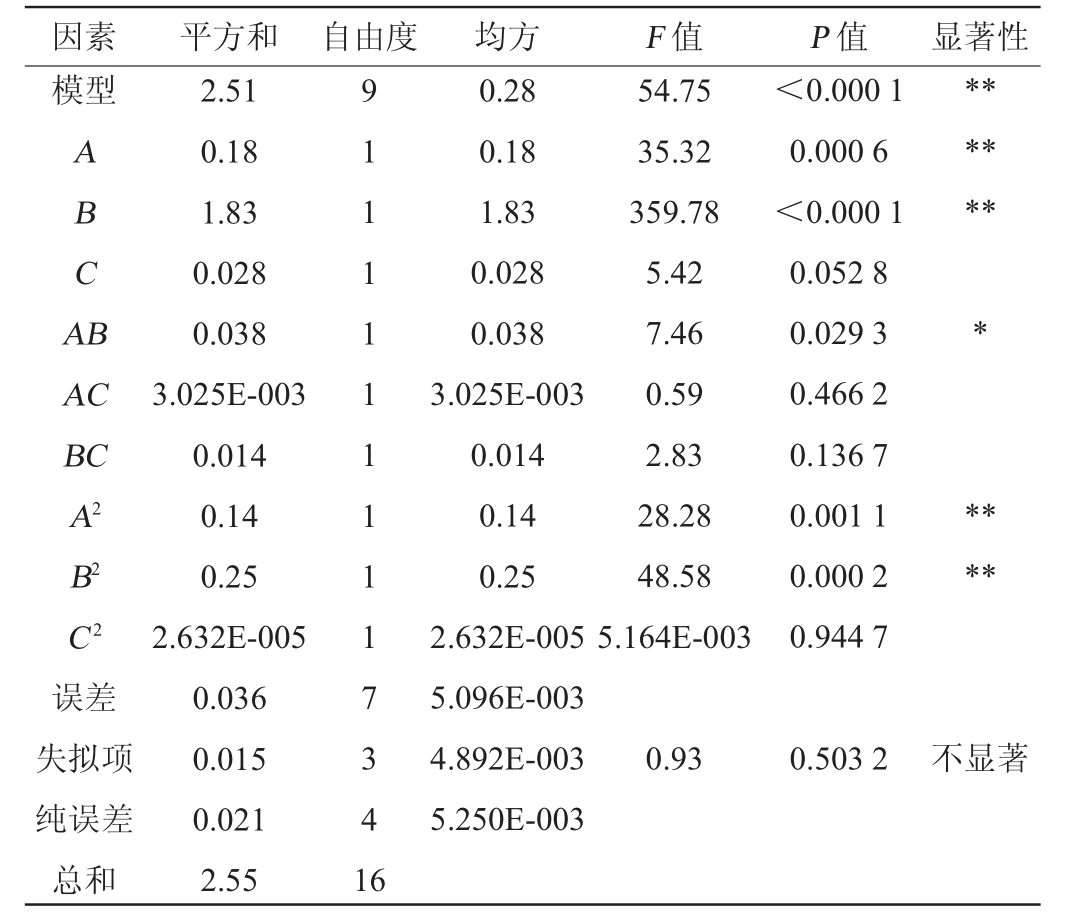
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
因素 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B*******AC BC A2 B2****C2 54.75 35.32 359.78 5.42 7.46 0.59 2.83 28.28 48.58 5.164E-003<0.000 1 0.000 6<0.000 1 0.052 8 0.029 3 0.466 2 0.136 7 0.001 1 0.000 2 0.944 7误差失拟项纯误差总和2.51 0.18 1.83 0.028 0.038 3.025E-003 0.014 0.14 0.25 2.632E-005 0.036 0.015 0.021 2.55 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 0.28 0.18 1.83 0.028 0.038 3.025E-003 0.014 0.14 0.25 2.632E-005 5.096E-003 4.892E-003 5.250E-003 0.93 0.503 2不显著
对表2数据进行回归分析和拟合,得到回归方程:Y=3.07+0.15A+0.48B+0.059C+0.097AB+0.027AC-0.060BC-0.19A2-0.24B2+0.002 5C2。该试验模型的P值<0.01,表明各因素的高水平和低水平对响应值有极显著影响。失拟项P值=0.503 2>0.05,不显著,表明该模型拟合较好,并能进行有效的分析和预测。 从F值来看,影响OD620 nm值的因素从大到小依次为酵母浸粉添加量、葡萄糖添加量、硫酸锰添加量。从P值来看,一次项A、B,二次项A2、B2影响极显著(P<0.01);交互项AB影响显著(P<0.05)。模型的相关系数R2为0.986,具有良好的相关性,校正系数R2Adj为0.968,变异系数(coefficient of variation,CV)为2.49%<10%,代表数据可信度和精确度较好,信噪比(adeq precision)为23.0>4是符合要求的。二次项系数为负值,说明该模型具有最大值,通过对回归方程最大值进行求解,得到各因素理论值为葡萄糖添加量21.432 g/L、酵母浸粉添加量19.851 g/L、硫酸锰添加量0.491 g/L,此条件下预测发酵液OD620 nm值最大值为3.32[23]。为方便实际操作,修改条件为葡萄糖添加量21 g/L、酵母浸粉添加量20 g/L、硫酸锰添加量0.5 g/L,通过试验验证,此条件下发酵液OD620nm值实际达到3.41,与理论值相近。
通过对比响应曲面与等高线图,可以分析各种因素交互对响应值产生的影响程度,曲面越陡或等高线越密集时,影响越显著;等高线越趋近于椭圆而非圆形时,则两个因素相互影响,交互作用越强[22]。 由图3可知,AB交互作用对响应值的影响显著(P<0.05),这与方差分析结果一致。

图3 各因素间交互作用对短乳杆菌生长影响的响应面及等高线
Fig.3 Response surface plots and contour lines of effect of interaction between various factors on the growth of Lactobacillus brevis
2.3 短乳杆菌生长培养条件优化
温度作为影响微生物生长最为关键的物理因素,不仅影响生物酶的活性,还会对细胞的流动性和物质传输的能力产生影响[14]。不同种类的微生物均有适合自身生长代谢的最适和耐受pH值范围,主要影响着微生物细胞的原生质膜的电荷以及生物酶的活性[20]。短乳杆菌作为一种兼性厌氧的微生物,能够在有氧和无氧的环境中通过多种代谢途径生长繁殖,适宜的溶氧量环境可以加速其代谢过程并促进其生长,随着装液量的增加,溶氧逐渐减少[14]。接种量为种子液与培养基的体积比,决定着生长繁殖空间,若接种量过大,会导致培养基中有害代谢物质增加,也会增加种子液制备成本;但过低会延长发酵周期[24]。
由图4A、4B可知,随着培养温度和培养基初始pH值的逐渐增加,短乳杆菌的生物量(OD620nm值)呈现先增加后下降的趋势,当培养温度35 ℃、培养基初始pH值为6.5时,短乳杆菌的生物量(OD620 nm值)分别达到最高3.73、3.58,因此选择培养温度35 ℃、培养基初始pH值为6.5。由图4C可知,随着装液量的逐渐增加,短乳杆菌的生物量(OD620nm值)降低,因此选择装液量为25 mL/150 mL。朱孔亮等[21]同样通过改变装液量探究不同溶氧对短乳杆菌生长的影响,研究发现不同装液量存在显著性差异,其中40 mL/250 mL最佳,推测短乳杆菌生长需要微量氧气,较少的装液量可以维持一定的溶氧量,较适合菌体生长。由图4D可知,随着接种量的增加,短乳杆菌生长速度明显加快,更快到达生长稳定期,从生长曲线可观察到,当接种量为4%~8%(V/V)时,培养20 h到达稳定期,接种量为0.5%~2%(V/V)时,培养24 h到达稳定期。种子液为酸性,接种量的增加会引入过多的酸性物质使培养基pH值降低,从而不利于生长。由图4E可知,当接种量为8%(V/V)时,短乳杆菌的生物量(OD620 nm值)下降了11.7%,为3.25。周宁萍等[25]研究发现,植物乳杆菌接种量超过2%(V/V)时,发酵终点活菌数下降,推测可能是接种量增大,菌体生长和营养物质消耗过快,导致代谢产物快速增加,并且营养物质不能满足菌同时生长所致[6]。综合考虑发酵速度和发酵终点生物量,选择接种量为2%(V/V)。
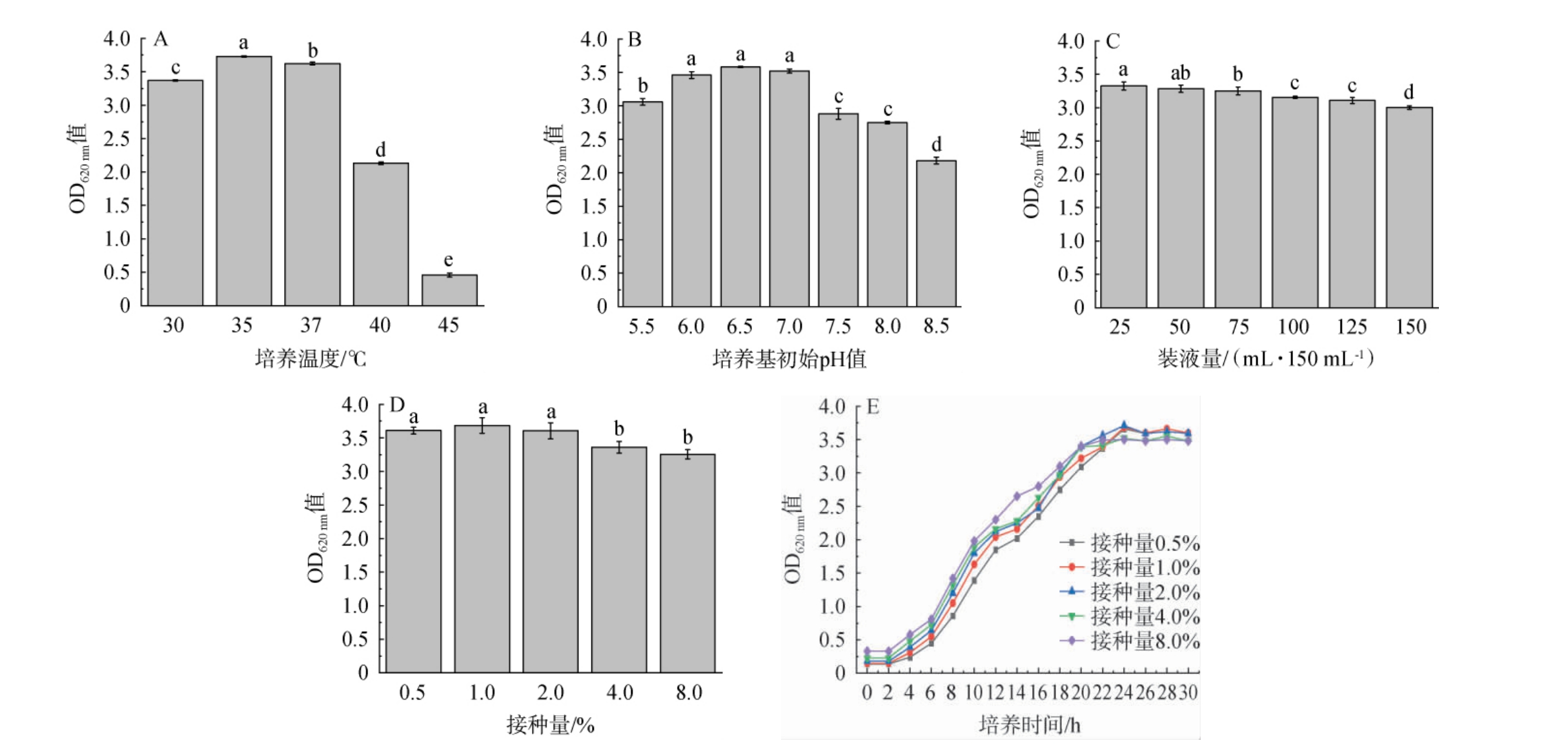
图4 不同培养条件对短乳杆菌生长的影响
Fig.4 Effect of different culture conditions on the growth of Lactobacillus brevis
2.4 生长曲线
培养条件优化前后菌株生物量及活菌数测定结果见图5。
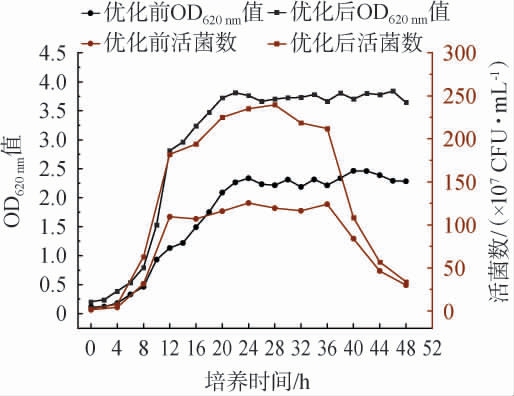
图5 短乳杆菌优化前后生长曲线
Fig.5 Growth curve of Lactobacillus brevis before and after optimization
由图5可知,培养24 h后,短乳杆菌的生物量(OD620nm值)和活菌数几乎不再增长,培养36 h后发酵液的活菌数出现大幅度下降,到达衰亡期,应在此时之前储存菌液或进行后续离心补料操作。通过本实验优化发酵条件、培养基及种子液,短乳杆菌的生物量(OD620nm值)从2.47增加至3.84,增加了55.47%;活菌数从1.26×109CFU/mL增加至2.40×109CFU/mL,增加了90.48%,优化效果显著。
2.5 发酵动力学模型
由图6可知,发酵过程中,菌体干质量和总酸量呈现S型曲线且高度相关,最高分别达到1.77 g/L和7.43 g/L;还原糖为培养基中葡萄糖含量,呈现反S型,最终残糖含量0.44 g/L,几乎耗尽。由于短乳杆菌为异型发酵可代谢产生多种有机酸,参照国标对发酵液总酸含量测定以乳酸计,酸的换算系数有一定差异,会造成误差。使用Logistic方程模型对数据进行非线性拟合,结果见表4。
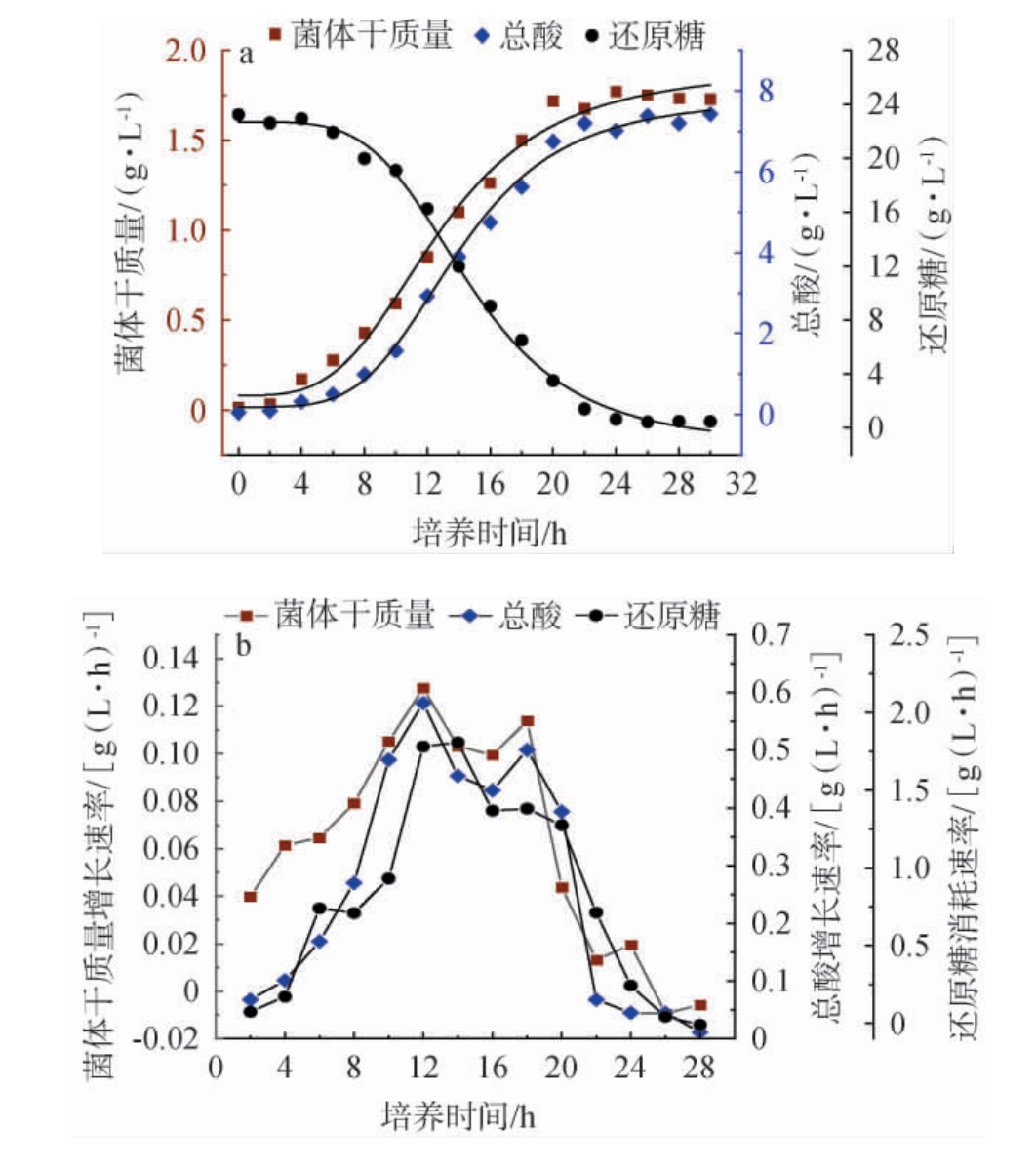
图6 短乳杆菌发酵过程菌体干质量、总酸和还原糖含量及拟合曲线(a)与变化速率(b)
Fig.6 Dry weight of bacteria, total acid and reducing sugar content and their fitting curves (a) and change rates (b) during Lactobacillus brevis fermentation
表4 Logistic模型拟合菌体生长、还原糖消耗和总酸生成方程及相关系数
Table 4 Equations and correlation coefficients fitted with Logistic model for bacterial growth, reducing sugar consumption and total acid production

拟合对象 拟合模型 方程 相关系数R2菌体干质量Logistic方程f(x)=1.90+ -1.82 1+( x 12.7 0.992 6 )3.74总酸生成Logistic方程f(x)=7.82+ -7.64 1+( x 13.9 0.996 4 )4.17葡萄糖消耗Logistic方程f(x)=-1.25+ 23.94 1+( x 14.6 0.996 6 )4.32
由表4可知,菌体干质量、总酸生成、还原糖消耗Logistic方程的相关系数R2均>0.99,说明方程拟合效果较好。
由表5可知,菌体干质量、总酸生成、还原糖消耗动力学模型各时间预测值与验证试验值的相对误差均<15%,并且相对误差平均值分别为8.04%、9.00%和9.09%,均<10%,表明实验值与预测值相近,能够很好的描述预测变化[26]。菌体干质量和总酸增加速率在培养12 h时都达到最高,分别为0.13 g/(L·h)和0.58 g/(L·h),说明此时生长最为旺盛。发酵培养8~20 h都保持着较高的变化速率,随后由于酸性物质积累或葡萄糖减少,变化速率放缓。由于培养20 h后速率快速降低,此时总酸含量6.75 g/L、葡萄糖含量3.50 g/L,因此后续补充中和剂和葡萄糖以此为参照,控制发酵液总酸含量少于和葡萄糖含量多于此时的含量。周亚男[27]在对鲁氏酵母生长动力学分析的基础上,确定补料时间与营养物质含量,建立半数分批补料,生物量大幅度提升。赖长龙等[9]基于发酵动力学模型,对植物乳杆菌的培养基、发酵条件和补料策略进行了优化,生物量大幅提升。
表5 短乳杆菌发酵动力学模型验证结果
Table 5 Verification results of Lactobacillus brevis fermentation kinetics model
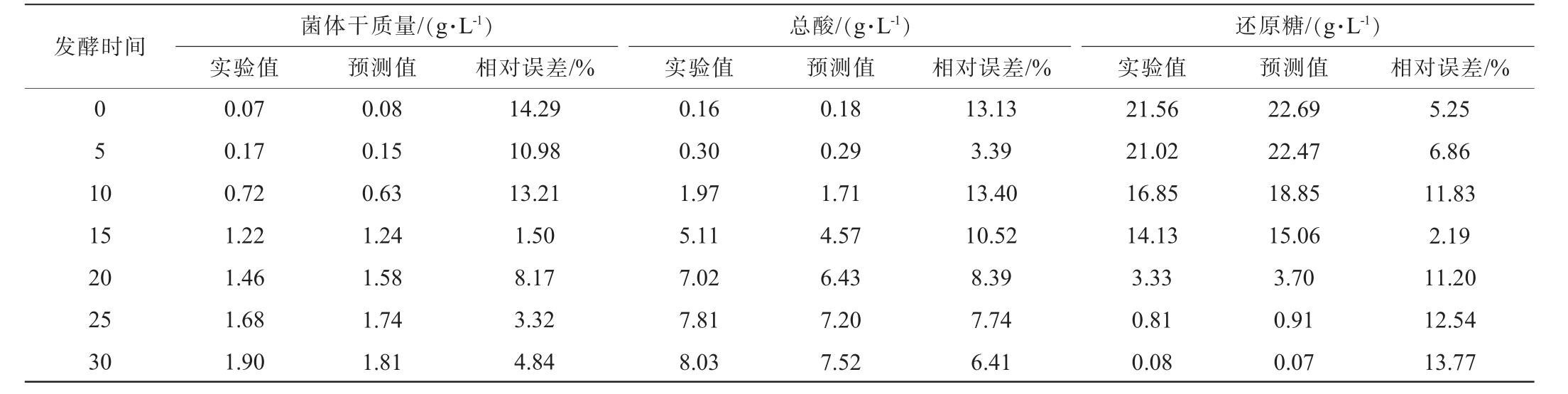
发酵时间菌体干质量/(g·L-1)实验值 预测值总酸/(g·L-1)实验值 预测值相对误差/% 相对误差/%还原糖/(g·L-1)实验值 预测值 相对误差/%0 5 1 0 15 20 25 30 0.07 0.17 0.72 1.22 1.46 1.68 1.90 0.08 0.15 0.63 1.24 1.58 1.74 1.81 14.29 10.98 13.21 1.50 8.17 3.32 4.84 0.16 0.30 1.97 5.11 7.02 7.81 8.03 0.18 0.29 1.71 4.57 6.43 7.20 7.52 13.13 3.39 13.40 10.52 8.39 7.74 6.41 21.56 21.02 16.85 14.13 3.33 0.81 0.08 22.69 22.47 18.85 15.06 3.70 0.91 0.07 5.25 6.86 11.83 2.19 11.20 12.54 13.77
3 结论
本试验以一株泡菜源短乳杆菌PC206为研究对象,以MRS培养基为基础,通过设计单因素和响应面试验,对培养基成分(碳源、氮源、无机盐、生长因子、缓冲盐和吐温-80)的种类及添加量、培养条件(培养温度、初始pH值、装液量、接种量)以及种子液(种子液培养时间和储存时间)进行优化,并建立发酵动力学模型。 结果表明,培养基为葡萄糖21 g/L、酵母浸粉20 g/L和硫酸锰0.5 g/L、磷酸二氢钾2 g/L、柠檬酸氢二铵2 g/L、乙酸钠5 g/L、精氨酸0.25 g/L;培养温度35 ℃、初始pH值6.5、装液量25 mL/150 mL、接种量2%(V/V);并基于Logistic方程对发酵过程菌体干质量、总酸、还原糖含量非线性拟合,相关系数R2均>0.99,平均相对误差<10%,能够较好的描述预测变化。此条件下发酵液OD620nm值达到3.84,增加了55.47%;活菌数达到2.40×109 CFU/mL,增加了90.48%。 后续可进一步使用发酵罐放大培养,并基于发酵动力学进行补料策略研究,使生物量进一步提升。该研究可为工业化高密度培养短乳杆菌提供实验依据和奠定理论基础。
[1]林泽永,梁倩雯,苏燧,等.一株短乳杆菌烈性噬菌体的分离鉴定与生化特性研究[J].食品与发酵工业,2022,48(12):226-232.
[2]CHEN S, HAN P, ZHANG Q, et al. Lactobacillus brevis alleviates the progress of hepatocellular carcinoma and type 2 diabetes in mice model via interplay of gut microflora, bile acid and NOTCH 1 signaling[J].Front Immunol,2023,14:1179014.
[3]WU Q,SHAH N P.High gamma-aminobutyric acid production from lactic acid bacteria:emphasis on Lactobacillus brevis as a functional dairy starter[J].Crit Rev Food Sci,2017,57(17):3661-3672.
[4]田辉,马卓,陈嘉祎,等.短乳杆菌与植物乳杆菌的发酵特性[J].微生物学通报,2023,50(2):802-814.
[5]FAN X, YU L, SHI Z, et al.Characterization of a novel flavored yogurt enriched in γ-aminobutyric acid fermented by Levilactobacillus brevis CGMCC1.5954[J].J Dairy Sci,2023,106(2):852-867.
[6]李娜.植物乳杆菌ZJ316的高密度发酵及高活性菌制剂的初步研究[D].南宁:广西大学,2020.
[7]TAN X,CHEN F,HU W,et al.Response surface optimisation of technological parameters for producing Ganoderma lucidum by solid-state fermentation from Panax notoginseng residues and kinetics[J].Int Food Res J,2023,3(30):709-722.
[8]林一.片球菌素高产菌株C23221的诱变与发酵动力学研究[D].上海:上海海洋大学,2023.
[9]赖长龙,曹余,杨玉,等.植物乳杆菌发酵动力学及高密度培养研究[J].食品与发酵工业,2022,48(20):137-144.
[10]吕明珊,袁艺洋,邢军,等.新疆药桑葚酵素发酵动力学模型及其发酵比速率的研究[J].中国调味品,2022,47(3):39-43.
[11]王旭光,茹先古丽·买买提依明,徐晓培,等.库车小白杏混菌乳酸发酵工艺优化及其发酵动力学模型[J].食品工业科技,2021,42(9):194-200.
[12]GOMES R J,DE SOUSA F P,TISCHER C A,et al. Komagataeibacter intermedius v-05:an acetic acid bacterium isolated from vinegar industry,with high capacity for bacterial cellulose production in soybean molasses medium[J].Food Technol Biotech,2021,59(4):432-442.
[13]SHENDEROV B A, MIDTVEDT T.Epigenomic programing: a future way to health?[J].Microb Ecol Health Dis,2014,25:24145.
[14]左梦楠,刘伟,张菊华,等.发酵乳杆菌BLHN3的高密度培养优化[J].食品与机械,2022,38(12):181-189.
[15]范洪臣,柴利平,郑惠丹,等.一株清酒乳杆菌的分离、鉴定及培养基优化[J].食品研究与开发,2023,44(6):204-210.
[16]贾梦雅.短乳杆菌CD0817高产γ-氨基丁酸生物过程优化及gadA无痕敲除初探[D].南昌:南昌大学,2021.
[17]潘子怡,毛丙永,唐鑫,等.耐高渗青春双歧杆菌的筛选及发酵工艺优化[J].食品与发酵工业,2024,50(3):30-37.
[18]陈园园.德氏乳杆菌保加利亚亚种QH38-1高密度发酵工艺的优化[D].呼和浩特:内蒙古农业大学,2023.
[19]才恒.烟酸与精氨酸促进短乳杆菌合成γ-氨基丁酸[D].天津:天津科技大学,2022.
[20]ZHANG C,WANG J,XIE J.Effect on the quality of Larimichthys crocea pretreated with dual-frequency orthogonal ultrasonic-assisted immersion with different powers during refrigerated storage at 4 ℃[J].Foods,2023,12(17):3259.
[21]朱孔亮,吴丹,吴敬.泡菜发酵专用短乳杆菌的高密度培养[J].食品与生物技术学报,2015,34(8):828-834.
[22]YANG Y,LAN G,TIAN X,et al.Effect of fermentation parameters on natto and its thrombolytic property[J].Foods,2021,10(11):2547.
[23]刘栋.罗伊氏乳杆菌LT018高密度培养及其冻干技术的研究[D].南宁:广西大学,2017.
[24]陈欢.秀珍菇液体菌种发酵工艺优化及应用研究[D].长沙:湖南农业大学,2019.
[25]周宁萍,蒋雪,裴琪,等.红酸汤源植物乳杆菌NCU001929的高密度培养条件研究[J].食品与发酵工业,2024,50(21):36-44.
[26]雷霜江,吕青遥,王文杰,等.屎肠球菌R40产胆盐水解酶发酵动力学及底物特异性分析[J].中国酿造,2021,40(11):144-148.
[27]周亚男.鲁氏酵母高密度培养制备及产呋喃酮条件优化研究[D].大庆:黑龙江八一农垦大学,2018.