红树莓(Rubus idaeus L.)是悬钩子属(Rubus spp.)植物,红树莓果中含有酚类化合物、类黄酮和花青素等多种生物活性物质,具有抗氧化、抗菌、抗炎以及调节代谢的多重功效[1-2],在食品加工、医药及保健领域具有广泛的应用潜力。 然而红树莓果易腐烂,储存困难,容易造成浪费,因此将其加工成果汁是一种更稳定和高效的贮存方式[3]。但红树莓果汁中较高的柠檬酸含量导致其酸感较强,不仅影响产品的口感,也制约了其深加工应用[4],所以进行降酸处理显得尤为重要。目前应用在果汁方面的降酸方法包括物理降酸、化学降酸及生物降酸法[5],其中物理降酸法和化学降酸法会对果汁的品质产生不利影响,而生物降酸法通过微生物发酵或酶促反应[6-7],能够有效减少有机酸含量,保留果汁中的活性成分,同时改善其风味和口感[8-9]。非酿酒酵母在发酵中展现出良好的降解柠檬酸的潜力[10]。其中陆生伊萨酵母(Issatchenkia terricola)WJL-G4菌株能在柠檬酸(20 g/L)培养基中生长,发酵2 d时柠檬酸利用率达到90%以上[11]。 LIU B等[12]将陆生伊萨酵母WJL-G4接种至柠檬汁中,可有效降低柠檬汁中的柠檬酸含量,改善柠檬汁的风味。 HE H Y等[13]将陆生伊萨酵母与酿酒酵母(Saccharomyces cerevisiae)顺序发酵酿造红树莓酒,改善口感,提升果酒的品质。
发酵动力学模型能通过描述微生物的生长、底物消耗,为发酵过程优化提供理论支持[14-15],张琪等[16]运用Logistic模型对黑加仑果酒进行拟合,结果能较好反映黑加仑果酒发酵过程中酵母菌数、酒精度和还原糖含量的变化情况。潘丽妮等[17]运用Logistic模型、Boltzmann模型和DoseResp模型进行非线性拟合,能较好反映樱桃果酒发酵过程中各项指标变化。然而,目前将非酿酒酵母运用于红树莓果汁发酵,并进行发酵动力学模型研究较少。本研究以红树莓作为原料,选用陆生伊萨酵母(Issatchenkia terricola)WJL-G4作为发酵菌种,制备红树莓发酵果汁。采用Logistic模型、Boltzmann模型、DoseResp模型对红树莓果汁发酵中的酵母菌数、总糖、总酸消耗量及pH变化量进行非线性拟合,建立红树莓果汁发酵动力学模型,评估模型的准确性,并对各时间段的红树莓发酵果汁进行感官评价。为优化红树莓发酵果汁生产工艺提供理论依据,对促进红树莓深加工产业的发展具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
红树莓原料:黑龙江高泰食品有限责任公司,冻藏于东北林业大学食品科学与工程实验室。 陆生伊萨酵母(Issatchenkia terricola)WJL-G4:由本实验室前期在红树莓鲜果上筛选获得,并经形态学和分子生物学鉴定命名,保藏号:CGMCC No.18712。
1.1.2 试剂
柠檬酸、葡萄糖、果糖、蔗糖、氯化钠、硫酸镁(均为分析纯)、酵母浸粉、琼脂、蛋白胨(均为生化试剂):天津市光复科技发展有限公司;柠檬酸标品、甲醇、磷酸二氢钾、磷酸(均为色谱纯):上海源叶生物科技有限公司;果胶酶(酶活100 000 U/g):河南万邦实业有限公司;葡萄糖-果糖-蔗糖试剂盒:苏州格锐思生物科技有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:胰蛋白胨20 g/L,酵母粉5 g/L,葡萄糖20 g/L,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
YPD固体培养基:YPD液体培养基添加琼脂25 g/L。
1.2 仪器与设备
1260 InfinityII型高效液相色谱(high performance liquid chromatography,HPLC)仪、Agilent Poroshell 120 EC-C18色谱柱(4.6 mm×150 mm,2.7 μm):美国Agilent公司;BS 200SWEI电子天平:北京赛多利斯仪器系统有限公司;SW-CJ-1FD净化工作台:南京晓晓仪器设备有限公司;5030-PVL手提式压力蒸汽灭菌锅:上海博迅实业有限公司医疗设备厂;CenLee 16K台式离心机:湖南湘立科学仪器有限公司;PHS-3C pH酸度计:上海精密科学仪器有限公司;KQ-500DE振荡培养箱:昆山市超声仪器有限公司。
1.3 方法
1.3.1 红树莓发酵果汁加工工艺流程及操作要点
红树莓果→预处理→灭菌→接种发酵→红树莓发酵果汁
预处理:红树莓果自然解冻破碎后,打浆3 min,加入0.04%的果胶酶,50 ℃酶解2 h。 酶解后,85 ℃灭酶10 min,再经过6层纱布过滤取果汁。
灭菌:将过滤后的果汁在80 ℃巴氏杀菌20 min,冷却至室温备用。
接种发酵:陆生伊萨酵母WJL-G4种子液的制备参照梅佳佳[18]的方法稍微修改,将种子液在6 000 r/min条件下离心3 min,弃上清液,加入0.9%生理盐水,摇匀,重复冲洗3次,以去除种子液的代谢物。将冲洗后的菌液按1%(V/V)的接种量分别接种于红树莓果汁中,于培养温度28 ℃、装液量40 mL/250 mL、转速180 r/min条件下连续发酵72 h,当总糖含量在24 h内无变化,则终止发酵,分别在0、4 h、8 h、12 h、16 h、20 h、24 h、36 h、48 h、60 h、72 h取样供后续试验使用。
1.3.2 分析检测
总糖含量:采用苯酚-硫酸法测定[19];总酸含量:按照GB 12456—2021《食品安全国家标准食品中总酸的测定》[20]测定;酵母菌数:按照GB 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》[21]测定;pH:用pH酸度计测定;葡萄糖、果糖和蔗糖含量:按照葡萄糖-果糖-蔗糖试剂盒法(己糖激酶法)测定。
柠檬酸含量:参照蒋莹[22]的方法,采用HPLC对柠檬酸含量进行测定。流动相条件:流动相A为0.5%(V/V)KH2PO4溶液(用磷酸调节pH至2.3),流动相B为甲醇,微孔滤膜过滤,脱气后使用;A相与B相体积比为97∶3。HPLC条件:等度洗脱10 min,流速0.7 mL/min,进样量10 μL,柱温35 ℃,紫外检测波长为210 nm。 采用外标法通过标准品的出峰时间及峰面积建立的标准曲线回归方程计算样品中柠檬酸含量。
1.3.3 发酵动力学模型的构建
参照孙文等[23]方法,稍作修改。 参照模型方程见表1,测定红树莓果汁发酵过程中陆生伊萨酵母酵母菌数、总糖含量、总酸含量及pH,通过Origin 2025软件进行非线性拟合曲线的绘制,并计算相应的动力学模型参数,建立红树莓果汁发酵动力学模型,随机在8 h、15 h、24 h、30 h、50 h取样,并测定相应指标,将试验值与所得模型的拟合值进行误差分析,结果以绝对值表示,其计算公式如下:
表1 三种经典的发酵动力学模型方程
Table 1 Three classical equations of fermentation kinetics models

模型类型 模型方程Logistic y= A1-A2 1+ X X0()P +A2 DoesResp y=A1+ A2-A1 1+10(logx0-x)p Boltzmann y= A1-A2 1+eX-X0+A2 dx
1.3.4 感官评价
红树莓发酵果汁感官评价参照JIANG Y等[24]的方法稍作修改,在感官评价之前,对所取红树莓发酵果汁进行巴氏杀菌。共对7组红树莓发酵果汁(0、12 h、24 h、36 h、48 h、60 h、72 h)进行感官评价,由食品科学与工程系内20名经过培训的人员进行感官评价。感官评价标准见表2。
表2 红树莓发酵果汁感官评价标准
Table 2 Sensory evaluation standards of fermented red raspberry juice
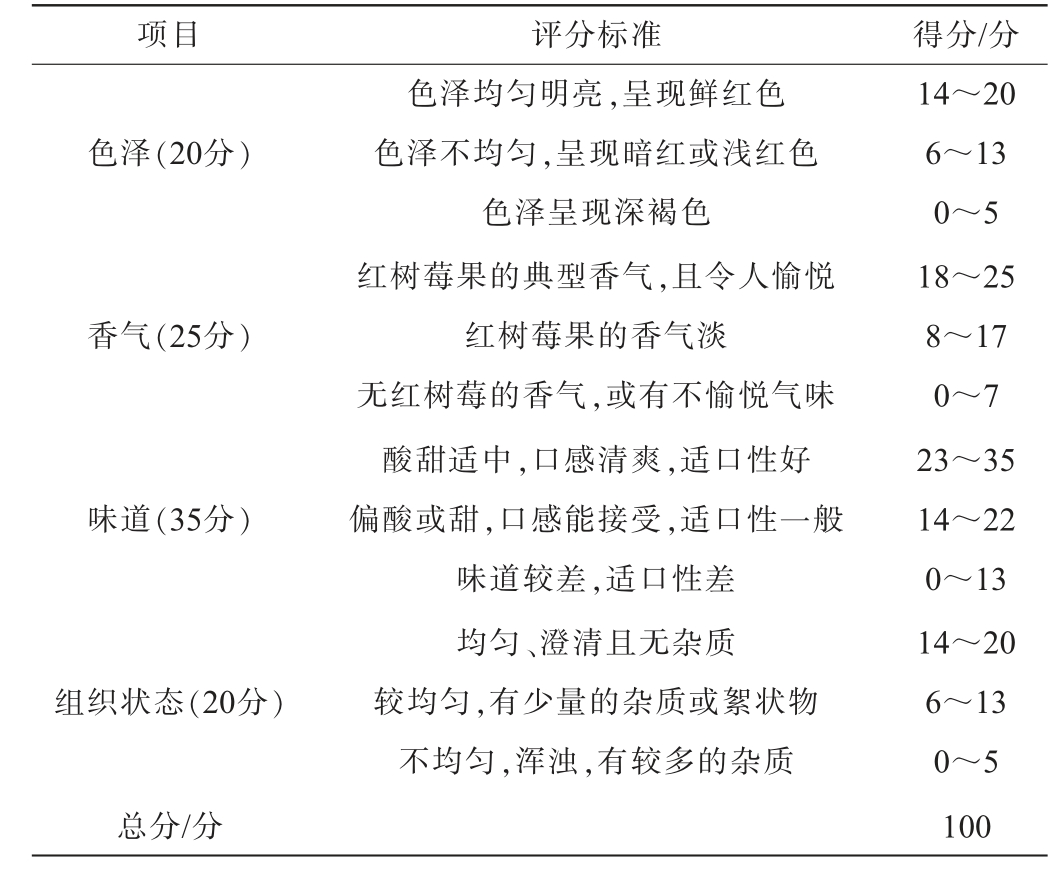
项目 评分标准 得分/分色泽(20分)香气(25分)味道(35分)组织状态(20分)色泽均匀明亮,呈现鲜红色色泽不均匀,呈现暗红或浅红色色泽呈现深褐色红树莓果的典型香气,且令人愉悦红树莓果的香气淡无红树莓的香气,或有不愉悦气味酸甜适中,口感清爽,适口性好偏酸或甜,口感能接受,适口性一般味道较差,适口性差均匀、澄清且无杂质较均匀,有少量的杂质或絮状物不均匀,浑浊,有较多的杂质总分/分14~20 6~13 0~5 18~25 8~17 0~7 23~35 14~22 0~13 14~20 6~13 0~5 100
1.3.5 数据处理与统计分析
所有试验均重复3次,结果以“平均值±标准差”表示。使用SPSS 26.0进行多重比较检验和单因素方差分析。使用OriginPro 2025作图。
2 结果与分析
2.1 酵母菌数、总糖含量、总酸含量及pH值变化
将陆生伊萨酵母WJL-G4接种在红树莓果汁中连续发酵72 h,测定其发酵过程中的酵母菌数、总糖、总酸含量和pH值变化情况,结果见图1。由图1可知,当发酵时间为0~72 h时,随着发酵时间的延长,总糖和总酸含量逐渐下降,酵母菌数和pH值则逐渐升高。当发酵时间在0~24 h时,陆生伊萨酵母WJL-G4数量迅速增加,从0.04×108 CFU/mL增加至2.19×108 CFU/mL;总糖含量快速下降,从61.50 g/L下降至12.73 g/L;总酸含量小幅度下降,从20.72 g/L下降至16.03 g/L,而pH值基本不变。总糖含量下降是因为在发酵过程中,碳水化合物产生的能量对酵母的生长和繁殖至关重要[25],说明在此阶段,酵母主要消耗糖类物质,以满足自身生长需求。当发酵时间>24 h之后,果汁中的总糖含量基本保持不变,总酸含量快速下降,pH值上升,说明该酵母能消耗酸类物质,以维持正常的生长。 当发酵时间为24~48 h,酵母菌数从2.19×108 CFU/mL增加至3.84×108 CFU/mL,总酸含量从16.03 g/L下降至6.96 g/L,pH值从2.91上升至3.61。当发酵时间>48 h,酵母菌数量保持不变,说明陆生伊萨酵母WJL-G4进入稳定期。
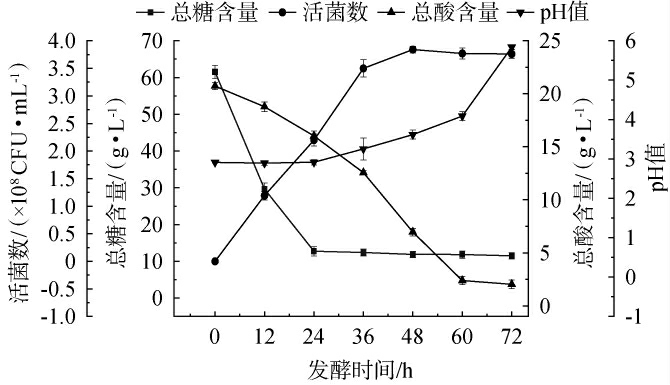
图1 红树莓果汁发酵过程中酵母菌数、总糖、总酸及pH值变化
Fig.1 Changes of yeast counts, total sugar, total acid and pH values during fermentation process of red raspberry juice
2.2 葡萄糖、果糖、蔗糖含量的变化
红树莓果汁发酵过程中葡萄糖、果糖及蔗糖含量变化情况见图2。由图2可知,未发酵时,红树莓果汁中的果糖的含量最高为25.13 g/L,其次是葡萄糖为19.87 g/L,蔗糖的含量最低为8.65 g/L。当发酵时间为0~24 h时,随着发酵时间的延长,葡萄糖及果糖含量下降,而蔗糖含量基本不变,说明在总糖快速下降的过程中,陆生伊萨酵母WJL-G4消耗的是葡萄糖和果糖,基本不消耗蔗糖,这一现象与蔗糖同化实验的结果相一致[26],可能是因为陆生伊萨酵母WJL-G4中不含蔗糖酶,无法将蔗糖分解为葡萄糖和果糖。 当发酵时间为0~8 h时,红树莓果汁中的葡萄糖含量快速降低,果糖含量仅小幅度下降,从25.12 g/L下降至23.00 g/L;当发酵时间为8~16 h时,果汁中的葡萄糖和果糖含量均快速下降;当发酵时间为16~24 h时,葡萄糖消耗殆尽,果糖含量继续下降;当发酵时间为24 h时,葡萄糖和果糖基本消耗完毕。当发酵体系中同时存在葡萄糖、果糖及蔗糖时,陆生伊萨酵母WJL-G4会优先利用葡萄糖、其次是果糖,而不利用蔗糖维持自身的生长和代谢。
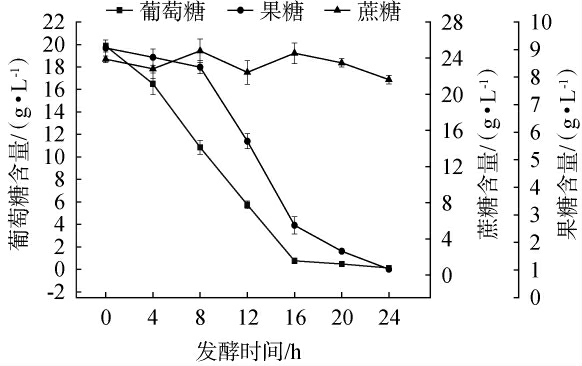
图2 红树莓果汁发酵过程中葡萄糖、果糖及蔗糖含量变化
Fig.2 Changes of glucose, fructose and sucrose contents during fermentation process of red raspberry juice
2.3 柠檬酸含量变化
红树莓果汁发酵过程中柠檬酸含量变化情况见图3。当发酵时间为0~24 h时,柠檬酸含量呈现缓慢下降的趋势,从18.21 g/L下降至14.50 g/L;当发酵时间为24~60 h时,柠檬酸含量则快速下降,在发酵时间为72 h体系中的柠檬酸被消耗殆尽。当果汁中存在糖类物质和酸类物质时,陆生伊萨酵母WJL-G4会优先消耗糖类物质,再消耗酸类物质。在发酵的初始阶段,红树莓果汁中含有丰富的葡萄糖和果糖,葡萄糖在Snf1/Mig1通路中发挥重要的作用[27],具体来说,高浓度的葡萄糖会抑制Snf1激酶,促使Mig1蛋白进入细胞核,进而抑制替代碳代谢基因的转录,当葡萄糖含量下降时,Snf1激酶变得活跃,抵消Mig1的抑制作用并允许替代底物的基因表达,开始利用其他碳源物质[28]。这种机制使陆生伊萨酵母WJL-G4在发酵过程中,会优先利用葡萄糖和果糖,待糖类物质降低到较低水平后,再利用柠檬酸。柠檬酸会对陆生伊萨酵母WJL-G4的生长产生胁迫作用,为了应对柠檬酸胁迫,陆生伊萨酵母WJL-G4会通过提高细胞内的pH、不饱和脂肪酸含量及超氧化物歧化酶(superoxide dismutase,SOD)活性来应对胁迫,同时,通过三羧酸循环(tricarboxylic acid cycle,TCA)途径代谢柠檬酸,从而有效利用柠檬酸,完成发酵过程[29-30]。
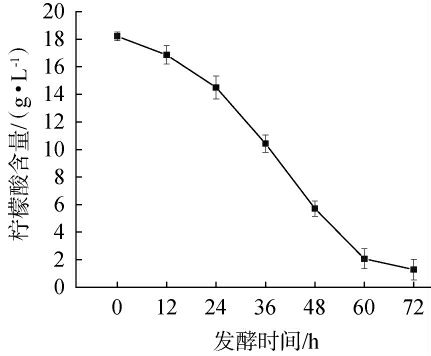
图3 红树莓果汁发酵过程中柠檬酸含量变化
Fig.3 Changes of citric acid contents during fermentation process of red raspberry juice
2.4 发酵动力学模型的构建
2.4.1 酵母菌生长动力学模型
由图1可知,陆生伊萨酵母WJL-G4在红树莓果汁中的酵母菌数量变化趋势为“S”型,故采用Logistic、DoseResp及Boltzmann模型进行非线性拟合,拟合方程及其相关系数见表3。由表3可知,上述三个模型的相关系数均>0.96。其中Boltzmann模型和DoesResp模型的拟合系数十分接近,这可能是因为两个模型在数学结构上具有相似性,都是由常数项+指数函数的形式,主要用于描述指数型增加或衰退的非线性关系。其中DoesResp的相关系数最高为0.982 5,且DoesResp模型更容易计算,因此选择DoesResp模型进行非线性拟合,结果见图4。 由图4可知,酵母菌数量在48 h时达到最大值,为3.84×108 CFU/mL。这与潘立妮等[17]研究樱桃果酒发酵中酵母菌数量的生长趋势系相似。试验值和拟合曲线基本吻合,说明该模型能较好预测发酵过程中酵母菌数的变化情况。此外,酵母菌数量的变化趋势与总糖、总酸的变化趋势相反。
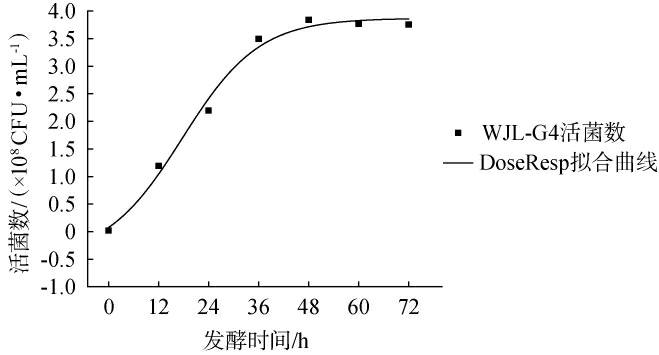
图4 DoseResp模型下酵母菌生长拟合曲线
Fig.4 Fitting curve of yeast growth under DoseResp model
表3 酵母菌数量生成动力学模型方程及相关系数
Table 3 Kinetic model equations and correlation coefficients for yeast quantity generation

注:x为发酵时间,h;y为对应时间红树莓果汁中酵母菌数量,CFU/mL。
模型 模型方程 相关系数Logistic y=4.115 15+ 4.0911 1 1+e x ( )2.21823 20.1132 0.965 5 DoesResp y= 4.35169 1+10(17.70591-x)×0.0471 0.982 5 Boltzmann 8 -0.479 96 y=3.871 73+ -4.351 69 1+ex-17.70594 9.204 77 0.982 3
2.4.2 总糖消耗动力学模型
总糖含量的Logistic,DoseResp及Boltzmann非线性拟合模型及相关系数见表4。三个模型的相关系数均>0.997,其中Boltzmann模型和DoseResp模型的拟合系数相同,均为0.999 56,说明两模型都能很好拟合总糖含量的变化趋势,然而,考虑到DoseResp模型相对Boltzmann模型更容易计算,故选择DoseResp模型拟合红树莓发酵果汁的总糖消耗量,拟合结果见图5。 由图5可知,总糖在发酵时间为0~24 h时快速下降,这一变化趋势与酵母菌数的生长动力学趋势相对应,当发酵时间>24 h之后,总糖含量趋于稳定。试验值与拟合曲线基本吻合,说明该模型能较好地描述总糖的消耗变化过程,基于该模型可以准确预测发酵过程中任意时间点的总糖浓度,这与郝丽粉等[31]研究百香果果汁中总糖消耗趋势的研究结果相类似。
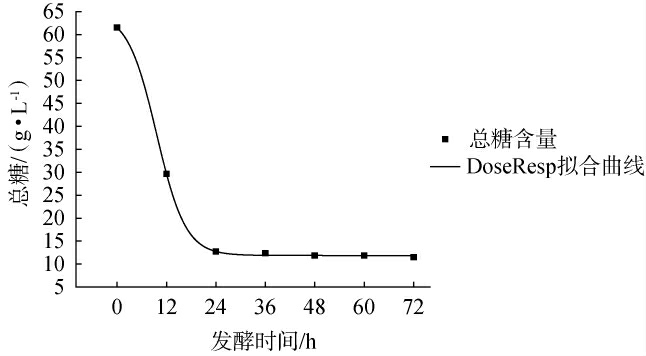
图5 DoseResp模型下总糖消耗拟合曲线
Fig.5 Fitting curve of total sugar consumption under DoseResp model
表4 总糖消耗动力学模型方程及相关系数
Table 4 Total sugar consumption kinetic model equations and correlation coefficients

注:x为发酵时间,h;y为对应时间红树莓果汁中总糖含量,g/L。
模型 模型方程 相关系数Logistic y= 49.671 28 1+( x 10.627 6 5 +11.828 36 0.997 72 1 )4.7782 DoseResp y= 52.866 05 1+10(9.60115-x)×(-0.12325 0.999 56 Boltzmann) +11.885 91 y= 52.866 05 1+ex-9.60155+11.885 91 3.523 71 0.999 56
2.4.3 总酸消耗动力学模型
总酸含量的Logistic,DoseResp及Boltzmann非线性拟合模型及相关系数见表5。 三个模型的相关系数均>0.97,其中DoseResp模型的拟合系数最高为0.989 81,因此选择DoseResp模型红树莓发酵果汁的总酸含量进行非线性拟合,拟合结果见图6。 由图6可知,当发酵时间为0~24 h,总酸含量下降趋势较为平缓,在此阶段,酵母主要利用体系中的葡萄糖和果糖,葡萄糖和果糖作为优势碳源,酸类物质作为劣势碳源,这种代谢的优先顺序可以导致陆生伊萨酵母WJL-G4对酸类物资的代谢速率下降或被延迟[29]。当发酵时间>24 h,此时体系中的葡萄糖和果糖被消耗殆尽,“糖抑制”效应解除,陆生伊萨酵母WJL-G4开始快速利用酸类物质(柠檬酸),该模型的试验值和拟合曲线基本吻合,说明该模型能较好地描述体系中总酸的消耗变化过程,为精确控制发酵节点提供有力支持。
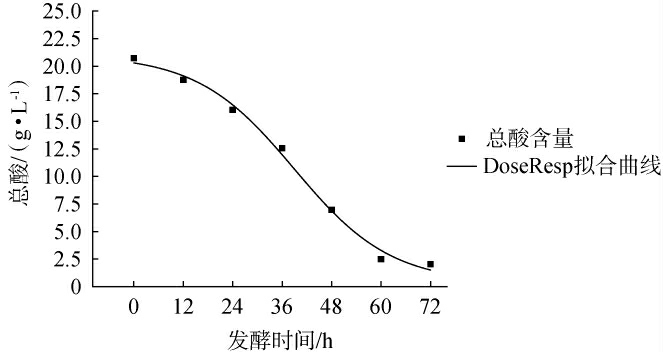
图6 DoseResp模型下总酸消耗拟合曲线
Fig.6 Fitting curve of total acid consumption under DoseResp model
表5 总酸消耗动力学模型方程及相关系数
Table 5 Total acid consumption kinetic model equations and correlation coefficients

注:x为发酵时间,h;y为对应时间红树莓果汁中总酸含量,g/L。
模型 模型方程 相关系数Logistic y= 23.589 75 1+( x 44.530 6 6 -3.565 71 0.977 92 6 )2.816 DoseResp y= 20.689 97 1+10(38.92393-x)×(-0.03695 0.989 81 Boltzmann) +0.327 85 y= 20.689 77 1+ex-38.92396+0.327 85 11.754 12 0.989 78
2.4.4 pH值变化动力学模型
pH值的Logistic,DoseResp及Boltzmann非线性拟合模型及相关系数见表6。
表6 pH值变化动力学模型方程及相关系数
Table 6 Kinetic model equations of pH value change and correlation coefficients

注:x为发酵时间,h;y为对应时间红树莓果汁的pH值。
模型 模型方程 相关系数Logistic y=18.055 37+ -15.160 25 1+( x 106.053 9 0.996 69 1 )3.67209 DoseResp y= 5.082 3 1+10(67.94083-x)×0.0369 1 +2.862 83 y=7.941 53+ -5.082 3 1+ex-67.94082 0.996 66 Boltzmann 11.766 15 0.996 66
由表6可知,三个模型的相关系数均>0.99,说明三种模型均能较好预测发酵过程中pH值的变化情况,其中Logistic模型的相关系数最高为0.996 69,并且在三个模型相比较中,Logistic模型的计算最为简便,故选择Logistic模型拟合pH值变化量,拟合结果见图7。
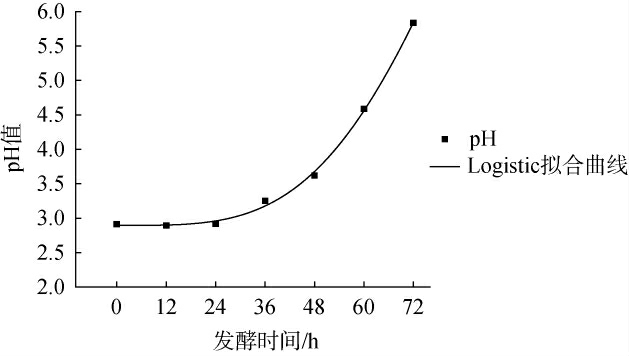
图7 Logistic模型下pH值变化拟合曲线
Fig.7 Fitting curves of pH changes under the logistic model
由图7可知,发酵时间为0~24 h时,体系中pH值未发生明显变化,这表明在此阶段中,红树莓果汁中电离出的H+保持相对稳定。 当发酵时间为36~72 h时,pH值快速上升,并最终在发酵72 h达到5.83,这一变化与总糖消耗曲线和总酸消耗曲线相对应。当红树莓果汁中的葡萄糖、果糖及柠檬酸被大量被消耗,导致pH值升高,该模型的试验值和拟合曲线基本吻合,说明该模型能较好地描述pH值的变化过程。
2.5 模型验证
陆生伊萨酵母WJL-G4酵母菌数生长量、总糖及总酸消耗量均选择DoseResp模型,pH值变化量由Logsitic模型进行拟合值与实验值的误差分析,结果见表7。由表7可知,模型的酵母菌数、总糖含量、总酸含量及pH值的预测值和试验值之间的误差基本<15%,这充分证明所选模型的可靠性[23]。 因此,可以用DoseResp模型准确预测发酵过程中酵母菌数、总糖含量及总酸含量的变化情况,同时借助Logsitic模型预测pH值的变化情况。 这表明构建的发酵动力学模型能准确预测红树莓果汁发酵过程中各项关键指标变化。
表7 酵母菌数、总糖、总酸含量及pH值的拟合值与实验值比较
Table 7 Comparison of the fitting values and the experimental values of yeast counts, total sugar content, total acid content and pH value
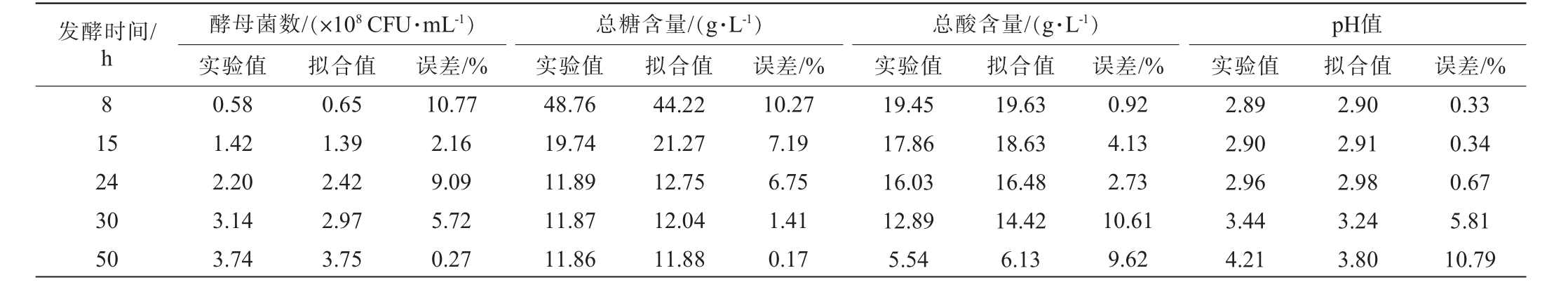
发酵时间/h 81 5酵母菌数/(×108 CFU·mL-1)实验值 拟合值总糖含量/(g·L-1)实验值 拟合值总酸含量/(g·L-1)实验值 拟合值误差/% 误差/% 误差/%pH值实验值 拟合值 误差/%24 30 50 0.58 1.42 2.20 3.14 3.74 0.65 1.39 2.42 2.97 3.75 10.77 2.16 9.09 5.72 0.27 48.76 19.74 11.89 11.87 11.86 44.22 21.27 12.75 12.04 11.88 10.27 7.19 6.75 1.41 0.17 19.45 17.86 16.03 12.89 5.54 19.63 18.63 16.48 14.42 6.13 0.92 4.13 2.73 10.61 9.62 2.89 2.90 2.96 3.44 4.21 2.90 2.91 2.98 3.24 3.80 0.33 0.34 0.67 5.81 10.79
2.6 红树莓发酵果汁感官评价
对发酵过程中红树莓发酵果汁进行感官评价,从而确定红树莓发酵果汁的整体满意度和可接受度,结果见表8。由表8可知,红树莓发酵果汁的感官评分随着发酵时间的延长呈先上升后下降的趋势,在发酵时间0~36 h时,红树莓发酵果汁的感官评分随着发酵时间的延长而增加,感官评分从67.20分提升至79.50分,在发酵的初始阶段,红树莓果汁中的总酸(主要为柠檬酸)含量过高,导致红树莓果汁的口感酸,导致感官评分低,随着发酵时间的延长,红树莓果汁中总酸含量的下降,红树莓果汁的感官评分上升。而当发酵时间为36~72 h时,感官评分随着发酵时间的延长而降低,红树莓发酵果汁的感官评分从79.50分下降至58.10分。当发酵时间>48 h之后,红树莓果汁的感官评分迅速下降,造成的原因可能是随着发酵时间的延长,红树莓果汁中的柠檬酸含量越来越低,导致糖酸比失衡,进而导致发酵果汁的口感与香气迅速下降。 柠檬酸是一种食品调味剂,提供酸度,糖酸比在果汁的风味中起到重要作用[32],此外,随着发酵时间的延长,红树莓果汁中的酚类化合物、矿物质及花青素等生物活性物质也迅速下降,而酚类化合物与花青素与果汁的色泽、风味密切相关[33-34]。
表8 发酵过程中红树莓果汁感官评价结果
Table 8 Sensory evaluation results of red raspberry juice during fermentation process
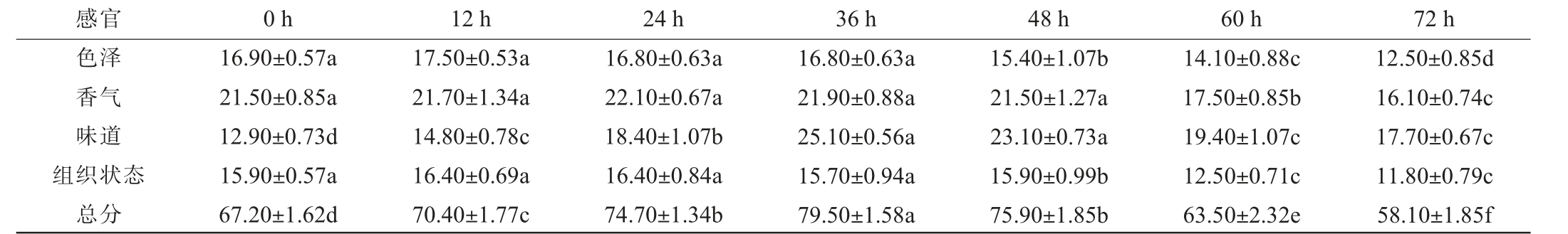
注:每行不同小写字母表示差异显著(P<0.05)。
感官 0 h 12 h 24 h 36 h 48 h 60 h 72 h色泽香气味道组织状态总分16.90±0.57a 21.50±0.85a 12.90±0.73d 15.90±0.57a 67.20±1.62d 17.50±0.53a 21.70±1.34a 14.80±0.78c 16.40±0.69a 70.40±1.77c 16.80±0.63a 22.10±0.67a 18.40±1.07b 16.40±0.84a 74.70±1.34b 16.80±0.63a 21.90±0.88a 25.10±0.56a 15.70±0.94a 79.50±1.58a 15.40±1.07b 21.50±1.27a 23.10±0.73a 15.90±0.99b 75.90±1.85b 14.10±0.88c 17.50±0.85b 19.40±1.07c 12.50±0.71c 63.50±2.32e 12.50±0.85d 16.10±0.74c 17.70±0.67c 11.80±0.79c 58.10±1.85f
由图1和表8亦可知,当红树莓果汁中的总酸含量为 6.96~12.56 g/L,柠檬酸含量为5.71~10.42 g/L,pH在3.25~3.61范围内时,红树莓发酵果汁的感官评分较高,而低于或高于该范围,红树莓果汁的感官质量都不佳,说明陆生伊萨酵母WJL-G4短期发酵(0~36 h)红树莓果汁,能迅速提升红树莓果汁的可接受度,解决红树莓果汁口感酸的问题,而当发酵时间>36 h,红树莓果汁的品质。因此,红树莓果汁的最佳发酵时间为36 h。
3 结论
本研究通过红树莓果汁发酵动力学模型构建与验证,深入分析红树莓果汁的发酵过程。在红树莓果汁发酵过程中,酵母菌生长量、总糖和总酸消耗量均采用DoseResp模型,而pH值变化量则采用Logistic模型。发酵过程可分为两个阶段:糖消耗阶段(0~24 h)和酸消耗阶段(24~72 h)。在糖消耗阶段,葡萄糖和果糖被优先消耗,而蔗糖未被利用;进入酸消耗阶段后,酵母加速消耗果汁中的柠檬酸。感官评价结果显示,红树莓果汁的感官评分随发酵时间变化呈现先升高后下降的趋势。 短期发酵(36 h)能显著改善红树莓果汁的口感,提升消费者的接受度。 本研究为红树莓果汁的优化提供了理论依据,未来研究可聚焦发酵罐放大试验,进一步验证模型在实际生产中的适用性。
[1]GABRIELLA G,SARA L,SUSANNA B.Effects of new packaging solutions on physico-chemical,nutritional and aromatic characteristics of red raspberries(Rubus idaeus L.)in postharvest storage[J].Postharvest Biol Tec,2014,98:72-81.
[2]YU Y P,YANG G,SUN L Y,et al.Comprehensive evaluation of 24 red raspberry varieties in Northeast China based on nutrition and taste[J].Foods,2022,11:3232.
[3]张海军,王彦辉,张清华,等.国内外树莓产业发展现状研究[J].林业实用技术,2010(10):54-56.
[4]陈思睿,唐莹,董丹,等.红树莓果汁降酸发酵过程中活性成分的变化[J].食品科学,2021,42(10):241-248.
[5]黄鹭强.降酸酵母菌株的构建及其在枇杷酒酿造中的应用研究[D].福州:福建农林大学,2013.
[6]宫祥博,延海莹,田迎樱,等.红树莓发酵果酒及其抗氧化活性[J].食品工业,2020,41(12):236-240.
[7]曹颖,耿瑶,韩乃瑄,等.果酒中的有机酸及降酸策略研究[J].食品工业科技,2023,44(14):457-464.
[8]周枫,曹蒙,范玉飞,等.酿酒酵母与毕赤酵母协同作用对山楂酒发酵的影响[J].食品科技,2023,48(8):1-6.
[9]许玉然,吕英池,文连奎.生物降酸红树莓果汁饮料的研制[J].饮料工业,2023,26(5):62-66.
[10]CAPOZZI V,GAROFALO C,CHIRIATTI M A,et al.Microbial terroir and food innovation:The case of yeast biodiversity in wine[J].Microbiol Res,2015,181:75-83.
[11]陈思睿,唐琳琳,冯建文,等.高效降解柠檬酸酵母菌的筛选鉴定及其在红树莓果汁中降酸特性[J].食品科学,2020,41(22):133-139.
[12]LIU B,YUAN D X,WANG J L,et al.Changes in organic acids,phenolic compounds, and antioxidant activities of lemon juice fermented by Issatchenkia terricola[J].Molecules,2021,26:6712.
[13]HE H Y, YAN Y C, DONG D, et al.Effect of Issatchenkia terricola WJL-G4 on deacidification characteristics and antioxidant activities of red raspberry wine processing[J].J Fungi (Basel),2021,8(1):17.
[14]ELIODÓRIO K P,CUNHA G C,MÜLLER C,et al.Advances in yeast alcoholic fermentations to produce bioethanol, beer and wine[J].Adv Appl Microbiol,2019,109:61-119.
[15]GROFF M C, SCAGLIA G, ORTIZ, O A, et al.Modification of the Luedeking and Piret model with a delay time parameter for biotechnological lactic acid production[J].Biotechno Lett,2022,44:415-427.
[16]张琪,朱立斌,朱丹,等.黑加仑果酒发酵动力学研究[J].中国酿造,2020,39(2):125-128.
[17]潘立妮,周家华,潘雯,等.樱桃果酒发酵动力学及抗氧化能力研究[J].中国酿造,2024,43(10):199-204.
[18]梅佳佳.基于代谢流和转录组研究陆生伊萨酵母降解柠檬酸途径[D].哈尔滨:东北林业大学,2024.
[19]王秋丹,赵凯迪,林长青.葛根多糖抗氧化性及其降血糖作用研究[J].食品工业科技,2022,43(5):381-388.
[20]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 12456—2021 食品安全国家标准 食品中总酸的测定[S].北京:中国标准出版社,2021.
[21]国家卫生和计划生育委员会.GB 4789.15—2016 食品安全国家标准食品微生物学检验霉菌和酵母计数[S].北京:中国标准出版社,2016.
[22]蒋莹.陆生伊萨酵母菌降解柠檬酸代谢途径初探[D].哈尔滨:东北林业大学,2023.
[23]孙文,李宝磊,侯保朝,等.嗜热链球菌JM108发酵动力学模型的建立[J].食品工业科技:2025,46(3):159-165.
[24]JIANG Y,LUO T,TANG Y,et al.Isolation of a novel characterized Issatchenkia terricola from red raspberry fruits on the degradation of citric acid and enrichment of flavonoid and volatile profiles in fermented red raspberry juice[J].Food Science Human Wellness,2022,11(4):1018-1027.
[25]WAHAUWOUÉLÉ H C, KOFFI J B, ALFRED K, et al.Use of non-Saccharomyces yeast strains as starter cultures to enhance fermented mango juice production[J].Sci Afr,2020,7:e00226.
[26]王金玲,陈思睿,唐莹.一株陆生伊萨酵母菌及其在柠檬酸降解中的应用:CN20191133167[P].2021-11-05.
[27]SIMPSON-LAVY K,KUPIEC M.Carbon catabolite repression in yeast is not limited to glucose[J].Sci Rep,2019,9(1):6491.
[28]SUNDER S,BAUMAN J S,DECKER S J,et al.The yeast AMP-activated protein kinase Snf1 phosphorylates the inositol polyphosphate kinase Kcs1[J].J Biol Chem,2024,300(2):105657.
[29]LIU X Y,TANG Y,NING W,et al.Responses of Issatchenkia terricola WJL-G4 upon citric acid stress[J].Molecules,2022,27(9):2664.
[30]MEI J J, LIU X Y, WANG J L et al.Metabolomics analysis of the metabolic effects of citric acid on Issatchenkia terricola WJL-G4[J].J Biosci Bioeng,2023,136(6):452-461.
[31]郝丽粉,叶晓芳,张静进,等.百香果酒发酵动力学及抗氧化活性研究[J].中国酿造,2023,42(12):219-225.
[32]冯建文,栾北辰,韩秀梅,等.不同苹果种质资源果实糖酸品质特征研究[J].中国南方果树,2024,53(5):169-177.
[33]HÈLÈNE F,JEAN-MICHEL L Q,GILDAS L B,et al.Polyphenol profile,PPO activity and pH variation in relation to colour changes in a series of red-fleshed apple juices[J].LWT-Food Sci Technol,2017,85:353-362.
[34]TIAN Y, KARHU S, VIRTANEN M, et al.Variation of chemical and sensory profiles of blackcurrant (Ribes nigrum) juices produced from differentcultivarsofEuropeanorigins[J].LWT-Food Sci Technol,2023,173:114353.