紫薯是旋花科番薯属的一种草本植物,其薯肉颜色从紫色到深紫色不等,也被称作黑薯[1]。紫薯不仅含有蛋白质、维生素、氨基酸、纤维素和多种矿物质元素,还富含硒元素和花青素[2-3],经常食用能够促进健康和预防多种慢性疾病[4-5]。新鲜紫薯水分含量高,在贮藏过程中易发生霉变、腐烂[6],因此紫薯产品的研发对紫薯行业的进步至关重要。随着公众对健康和营养重视程度的提高,营养丰富的低度酒逐渐受到人们的青睐,消费量逐年增加[7]。紫薯酒是由紫薯作为核心原料,采用果酒加工技术,并借助微生物发酵作用制成的一种酒精饮品,酒精度较低,并且具有降血压、抗氧化、抗衰老、抗肿瘤等保健功效[7-8],符合消费者对健康、低度酒类产品的需求。然而目前发酵紫薯酒存在香气淡、缺乏典型性的问题,限制了紫薯酒行业的发展。因此,解决此问题将有利于紫薯精深加工产业的发展,丰富酒市场。
酵母菌在果酒发酵过程中起关键性作用,直接关系到果酒的产量与品质[9]。酵母在厌氧发酵过程中将葡萄糖转化为乙醇,并通过特定的代谢途径将氨基酸等底物转化为醇类和酯类等挥发性化合物,从而提升果酒的香气和滋味[10]。袁杰彬等[11]采用安琪高活性酿酒干酵母发酵紫薯酒,优化发酵工艺并运用顶空固相微萃取-气相色谱-质谱联用(headspace solid-phase microextraction-gas chromatographymass spectrometry,HS-SPME-GC-MS)法对酒中香气组分进行分析,共鉴定出40余种香气化合物。刘彩婷等[12]以8种国内外商业酵母为发酵菌株,通过分析不同菌株发酵果酒的理化指标、感官评分、香气成分,筛选出酵母JK10是最适发酵蓝莓苹果复合果酒的酵母菌。赵永梅等[13]研究了DV10、EC1118、D254三种不同的酵母对香茶藨子果酒发酵的影响,发现不同酵母发酵的果酒的风味存在显著差异。目前,针对发酵紫薯酒的酵母筛选研究尚显不足。鉴于此,本研究选用可提高发酵效率、增强香气的PE酵母,具有良好果香释放特性的BV818酵母,能产生丰富酯类化合物的DV10酵母,可提升酒体丰满度的RW酵母及具备独特香气特征和耐酒精性的FR酵母为发酵菌株,以紫薯为原料进行紫薯酒发酵,筛选出最适发酵紫薯酒的酵母菌,并对其发酵工艺进行优化,旨在增强紫薯酒的香气和滋味,为高品质紫薯酒的生产提供技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
紫薯:云南省市售。PE、FR酵母:烟台帝伯仕自酿机有限公司;BV818、RW酵母:安琪酵母股份有限公司;DV10酵母:法国拉曼公司。
1.1.2 化学试剂
α-淀粉酶(酶活力4 000 U/g)、糖化酶(酶活力10万U/g)、3,5-二硝基水杨酸溶液:上海源叶生物科技有限公司;氢氧化钠、柠檬酸、酚酞、氯化钾、盐酸、无水乙酸钠、乙酸、氯化钠(均为分析纯):西陇科学股份有限公司;蔗糖(分析纯):国药集团化学试剂有限公司;葡萄糖标准溶液(1 mg/mL)、氢氧化钠标准溶液(0.05 mol/L):Codow氪道-广州和为医药科技有限公司。
1.2 仪器与设备
GNP-9060隔水式恒温培养箱:上海精宏试验设备有限公司;TD32手持式糖度仪:上海一恒科学仪器有限公司;FE28-Standard pH计:上海梅特勒-托利多仪器有限公司;NANODROP 2000C超微量紫外分光光度计:赛默飞世尔科技有限公司;RV8旋转蒸发仪:德国IKA集团;QP2010气相色谱-质谱联用仪:日本岛津公司;DB-5MS毛细管色谱柱:美国Agilent公司;57328-U SPME萃取头:美国Supelco公司。
1.3 方法
1.3.1 紫薯酒制备工艺流程及操作要点

操作要点:挑选无病虫害霉变的鲜紫薯,清洗、去皮、切丁,高温蒸煮20 min使其蒸熟,冷却至室温,按照料液比1∶1(g∶mL)比例添加去离子水打浆。用氢氧化钠将紫薯浆pH调为6.5,添加25 U/g α-淀粉酶,在60 ℃水浴锅液化70 min。液化完成后,用柠檬酸调节pH为4.5,添加80 U/g糖化酶,在55 ℃水浴锅糖化1.5 h。将糖化后的紫薯浆灭菌,添加蔗糖调节糖度至20°Bx,调酸至pH值为4.0,接种0.15%的活化酵母(酵母于10倍体积5 g/100 mL葡萄糖溶液中35 ℃水浴溶解30 min),将样品置于25 ℃恒温培养箱中发酵,采用二氧化碳质量损失法对发酵过程进行监测[14],直至CO2质量损失降至0.2 g以下,终止发酵。 经尼龙纱布过滤、7 500 r/min离心20 min、灭菌(65 ℃恒温保持30 min),得到紫薯酒成品。
1.3.2 紫薯酒酵母筛选
选取PE、BV818、DV10、RW及FR这五种酵母,依据1.3.1的方法分别进行紫薯酒的制备,综合酵母发酵速率、紫薯酒理化指标、挥发性香气成分及感官评价,筛选出最适合紫薯酒发酵的酵母菌。
1.3.3 紫薯酒发酵工艺优化单因素试验[15-16]
设定发酵工艺基础条件:发酵温度25 ℃、初始pH值4.0、酵母接种量0.15%、初始糖度20°Bx、发酵时间7 d。通过改变单一条件,分别考察发酵温度(15 ℃、20 ℃、25 ℃、30 ℃、35 ℃)、初始pH值(3.0、3.5、4.0、4.5、5.0)、酵母接种量(0.05%、0.10%、0.15%、0.20%和0.25%)、初始糖度(16°Bx、18°Bx、20°Bx、22°Bx、24°Bx)对紫薯酒酒精度和花青素含量的影响。
1.3.4 紫薯酒发酵工艺优化响应面试验
基于单因素试验结果,以发酵温度(A)、初始pH值(B)、初始糖度(C)为自变量,以紫薯酒酒精度(Y)为响应值,应用Box-Behnken(BBD)设计方法对紫薯酒发酵工艺进行优化[17-18],响应面试验因素与水平见表1。
表1 紫薯酒发酵工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for fermentation process optimization of purple sweet potato wine
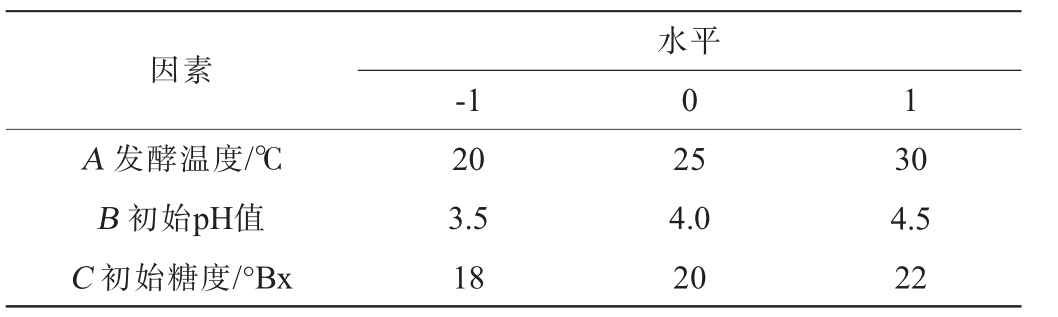
因素-1水平0 1 A 发 酵 温 度/℃B 初始pH值C 初始糖度/°Bx 20 3.5 18 25 4.0 20 30 4.5 22
1.3.5 测定方法
(1)酵母发酵速率的测定
采用二氧化碳质量损失法[14]。在紫薯酒的发酵过程中,每24 h对样品进行一次称质量,以监测酒样中CO2的质量损失。通过计算总CO2质量损失,来评估不同酵母的发酵速率。
(2)理化指标的测定
可溶性固形物:采用手持式糖度仪测定;pH值:采用pH计测定;还原糖:采用3,5-二硝基水杨酸比色法[19];总酸:依据GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的指示剂法[20];酒精度:依据GB 5009.225—2023《食品安全国家标准酒和食用酒精中乙醇浓度的测定》中的酒精计法[21];花青素含量:采用pH示差法[22]。
(3)挥发性香气成分分析
参照田争福等[23]的方法并进行适当调整,具体如下:
HS-SPME条件:取紫薯酒5 mL于20 mL萃取瓶中,加入1.0 g NaCl,置于45 ℃的水浴中平衡10 min,再将经过老化处理的萃取针插入样品瓶的顶空部分,吸附40 min。 吸附完成后,将萃取针置于GC的进样口,热解吸3 min,随后取出萃取头进行GC-MS分析。
GC条件:DB-5MS色谱柱(30 m×0.25 mm×0.25 μm),载气为高纯氦气(He),流速1.0mL/min,进样口温度250℃,不分流进样。 升温程序:初始温度40 ℃保持2 min,5 ℃/min上升至160 ℃,保持3 min,再以10 ℃/min上升至230 ℃,保持5 min。
MS条件:电子电离(electronic ionization,EI)源;电子能量70 eV;离子源温度230 ℃;扫描范围35~550 amu。
定性定量分析:利用GC-MS分析所得的样品质谱图经计算机与美国国家标准技术研究所(national institute of standards and technology,NIST)谱库对比进行定性,筛选相似度指数(similarity index,SI)>80试验样品中的化合物作为测得目标组分,采用面积归一化法进行定量。
(4)感官评价
由食品科学与工程专业学生10人组成感官评定小组,依据GB/T 15038—2006《葡萄酒、果酒通用分析方法》[20]从色泽、澄清度、香气、滋味、典型性5个方面进行感官评分,满分100分,取10人的平均分。紫薯酒感官评分标准见表2。
表2 紫薯酒感官评分标准
Table 2 Sensory score standards of purple sweet potato wine

项目 评分标准 评分/分色泽(10分)澄清度(10分)呈紫红色,光泽度好呈玫瑰红,略有光泽呈浅红色,光泽差呈暗红色,光泽暗哑澄清透亮,无悬浮物,无沉淀澄清透明,少量悬浮物,无沉淀较澄清透明,少许悬浮物及沉淀较多悬浮物及沉淀9~10 6~8 3~5 0~2 9~10 6~8 3~5 0~2
续表
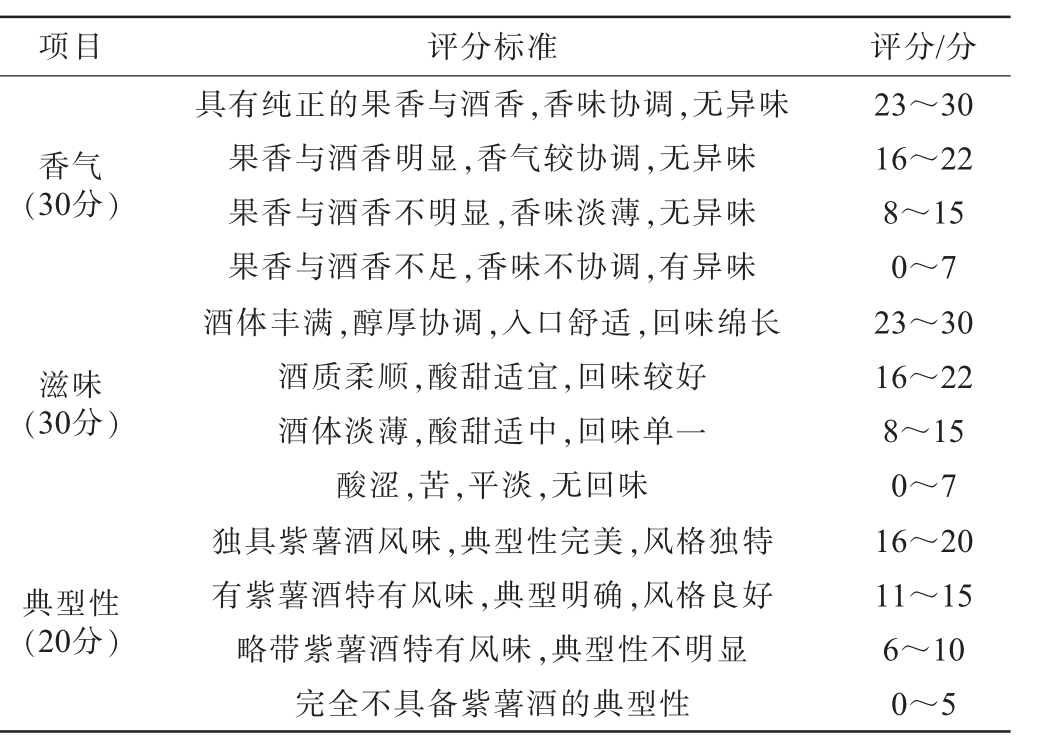
项目 评分标准 评分/分香气(30分)滋味(30分)典型性(20分)具有纯正的果香与酒香,香味协调,无异味果香与酒香明显,香气较协调,无异味果香与酒香不明显,香味淡薄,无异味果香与酒香不足,香味不协调,有异味酒体丰满,醇厚协调,入口舒适,回味绵长酒质柔顺,酸甜适宜,回味较好酒体淡薄,酸甜适中,回味单一酸涩,苦,平淡,无回味独具紫薯酒风味,典型性完美,风格独特有紫薯酒特有风味,典型明确,风格良好略带紫薯酒特有风味,典型性不明显完全不具备紫薯酒的典型性23~30 16~22 8~15 0~7 23~30 16~22 8~15 0~7 16~20 11~15 6~10 0~5
1.3.6 数据处理
所有试验重复3次,采用SPSS 27进行方差显著性分析,P<0.05表示差异性显著,试验结果表示为“平均值±标准偏差”;利用Design-Expert 13.0软件对响应面试验的数据进行分析与处理、Origin 2024软件绘图。
2 结果与分析
2.1 酵母筛选
2.1.1 不同酵母发酵速率比较
酵母菌株的发酵速率是评价其优劣的关键指标,通过监测发酵过程中发酵液质量的减少,可以推断酵母的发酵速率[24]。由图1可知,5种酵母的CO2累计质量损失随发酵时间呈现出相似的增长趋势,初期快速上升,随后增速逐渐减缓。其中,使用PE酵母时CO2质量损失最大,其次是BV818和DV10。结果表明,这3种酵母菌具有更强的发酵速率。
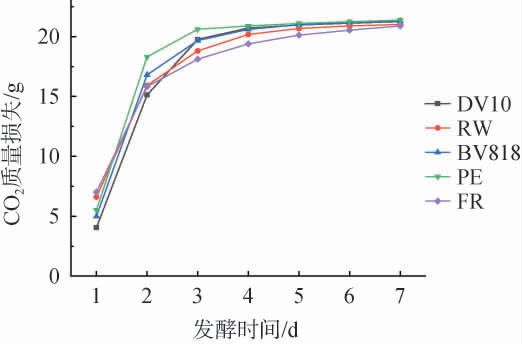
图1 不同酵母发酵过程中CO2质量损失
Fig.1 Mass loss of CO2 during different yeasts fermentation process
2.1.2 不同酵母对紫薯酒理化指标的影响
残糖通常可以反映酵母的发酵力大小,发酵结束后残糖量低说明其发酵能力强[25]。由表3可知,5种酵母发酵的紫薯酒还原糖含量为6.98~7.80 g/L,符合NY/T 1508—2017《绿色食品果酒》要求,均属于半干型果酒,其中酵母RW发酵的紫薯酒还原糖含量最高,且与其他酵母之间存在显著差异(P<0.05),酵母DV10发酵的紫薯酒还原糖含量最低。5种酵母发酵的紫薯酒酒精度为9.32%vol~12.20%vol,均符合NY/T 1508—2017《绿色食品果酒》要求,其中酵母DV10产酒精能力最强,显著高于其他酵母(P<0.05),其次是PE、BV818、FR,酵母RW的产酒精能力最弱,显著低于其他酵母(P<0.05)。5种酵母发酵的紫薯酒可溶性固形物含量为6.60~7.27°Bx,其中BV818、DV10和RW酵母发酵的紫薯酒可溶性固形物显著低于PE和FR这两种酵母(P<0.05)。5种酵母发酵的紫薯酒pH值为3.66~3.96,与发酵前相比,pH值均下降。NY/T 1508—2017《绿色食品果酒》规定果酒的总酸含量为4.00~9.00 g/L(以酒石酸计),PE、BV818发酵的紫薯酒总酸含量低于规定,DV10、RW和FR发酵的紫薯酒总酸含量符合规定,随着总酸含量的上升,pH值下降。酵母RW发酵的紫薯酒的花青素含量显著低于PE、BV818、DV10、FR酵母(P<0.05)。 综上可知,DV10酵母发酵紫薯酒效果最佳。
表3 不同酵母发酵紫薯酒的理化指标检测结果
Table 3 Determination results of physicochemical indexes of purple sweet potato wine by different yeasts
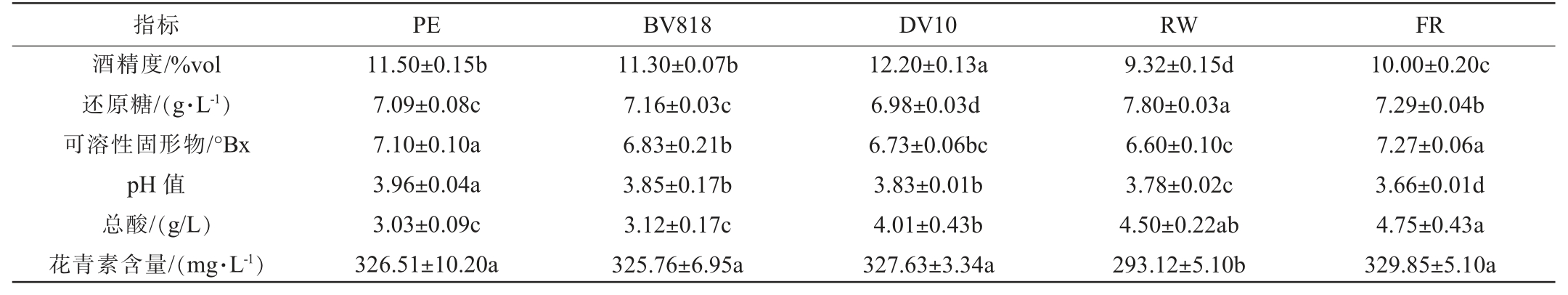
注:同行不同小写字母表示差异显著(P<0.05)。
指标 PE BV818 DV10 RW FR酒精度/%vol还原糖/(g·L-1)可溶性固形物/°Bx pH 值总酸/(g/L)花青素含量/(mg·L-1)11.50±0.15b 7.09±0.08c 7.10±0.10a 3.96±0.04a 3.03±0.09c 326.51±10.20a 11.30±0.07b 7.16±0.03c 6.83±0.21b 3.85±0.17b 3.12±0.17c 325.76±6.95a 12.20±0.13a 6.98±0.03d 6.73±0.06bc 3.83±0.01b 4.01±0.43b 327.63±3.34a 9.32±0.15d 7.80±0.03a 6.60±0.10c 3.78±0.02c 4.50±0.22ab 293.12±5.10b 10.00±0.20c 7.29±0.04b 7.27±0.06a 3.66±0.01d 4.75±0.43a 329.85±5.10a
2.1.3 不同酵母对紫薯酒香气的影响
通过HS-SPME-GC-MS得到五株酵母发酵紫薯酒产生的挥发性风味物质结果见图2,颜色强度归一化范围从最大值1.79(红色)到最小值-1.79(蓝色)。
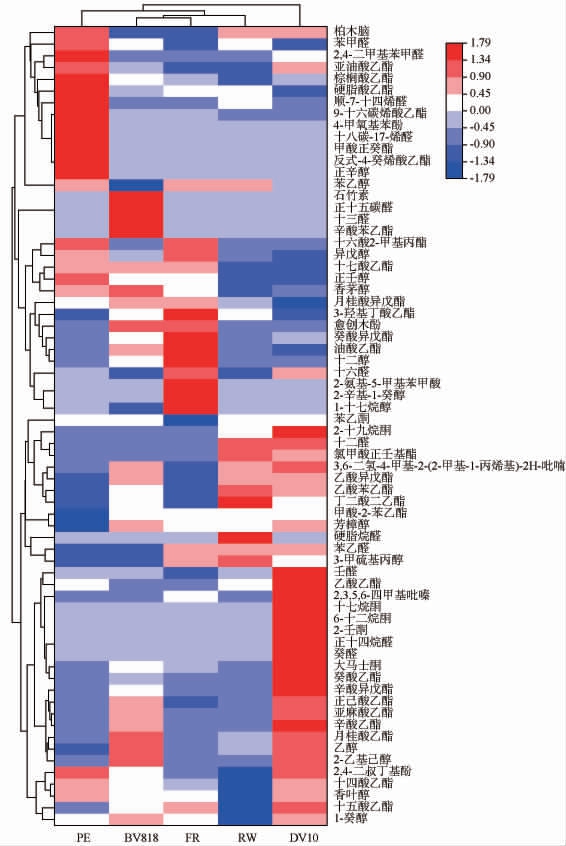
图2 不同酵母发酵紫薯酒的挥发性风味物质相对含量聚类分析热图
Fig.2 Cluster analysis heatmap of relative contents of volatile substances in purple sweet potato wine fermented by different yeasts
由图2可知,不同酵母菌株发酵紫薯酒产生的挥发性香气物质在种类和含量上存在显著差异,通过HS-SPMEGC-MS分析,5株酵母发酵的紫薯酒样品中共检测出68种香气化合物,包括醇类14种、酯类27种、醛类13种、酮类6种、酚类3种、酸类1种以及其他类4种。 DV10所发酵紫薯酒中挥发性香气物质种类最多,达到了48种;PE、BV818所发酵紫薯酒中挥发性香气物质均为45种;RW酵母所发酵紫薯酒中挥发性香气物质有44种;FR酵母所发酵紫薯酒中挥发性香气物质有43种。
醇类化合物是紫薯酒样品挥发性香气物质中含量最高的一类,FR酵母发酵的紫薯酒挥发性香气物质中醇类化合物的相对含量最高,为71.60%。其中,异戊醇、苯乙醇含量占比相对较大,赋予紫薯酒浓郁的花香和蜂蜜香气[26-27]。酯类物质是发酵酒中主要的呈味和呈香化合物,可赋予紫薯酒花香和果香[28],是紫薯酒中的第二大类挥发性香气物质。DV10酵母发酵的紫薯酒挥发性香气物质中酯类化合物的相对含量最高,为21.61%,尤其是辛酸乙酯、月桂酸乙酯、正己酸乙酯和癸酸乙酯相对含量均高于其他酵母发酵酒,这些成分赋予紫薯酒花香和菠萝、葡萄、梨等果香,使其具有典型性特征。此外,在13种醛类物质和6种酮类化合物中,DV10酵母发酵的紫薯酒的醛酮类化合物相对含量和种类均高于其他样品,主要为紫薯酒贡献了水果香、坚果香和花香。2,3,5,6-四甲基吡吡嗪(2,3,5,6-tetramethylpyrazine,TTMP)具有独特的坚果香和烘焙香,是构成酱香型大曲白酒复杂风味的关键香气物质之一[29]。本研究中,DV10酵母发酵的紫薯酒中TTMP的相对含量显著高于其他酵母。由于TTMP能够提升酒的香气复杂性和愉悦感,因此,DV10酵母发酵的紫薯酒香气更为丰富和协调,这可能是其在感官评价中获得最高评分的原因之一。
综上所述,DV10 酵母发酵的紫薯酒在挥发性香气成分的种类和丰度上均表现最佳,能够赋予紫薯酒更丰富协调的香气。
2.1.4 感官评价
对5种酵母发酵的紫薯酒进行感官评价,结果见图3。
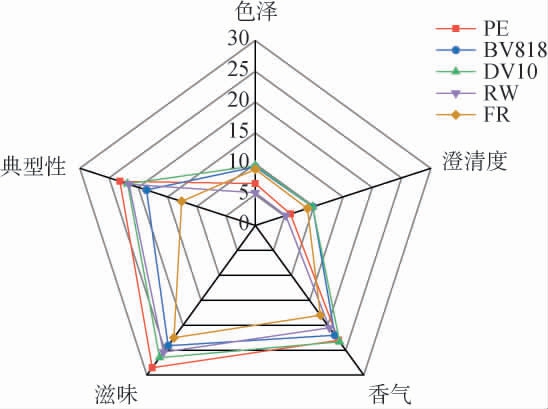
图3 不同酵母发酵紫薯酒的感官评分雷达图
Fig.3 Radar chart of sensory score of purple sweet potato wine fermented by different yeasts
由图3可知,DV10酵母发酵的紫薯酒色泽得分明显高于其他酵母,酒体呈紫红色,光泽度好;DV10、BV818酵母发酵的紫薯酒澄清度得分最高,酒体澄清透亮;DV10酵母发酵的紫薯酒香味协调,香气评分最高;在滋味方面,PE酵母发酵的紫薯酒入口舒适,酒体丰满协调,滋味最佳;在典型性方面,PE酵母发酵的紫薯酒得分最高,典型性完美。 综上,DV10酵母发酵的紫薯酒感官评分最高,总分为87.5分。因此,选择酵母DV10进行紫薯酒发酵。
2.2 紫薯酒发酵工艺优化单因素试验结果
由图4A可知,发酵温度从15 ℃升高至25 ℃的过程中,紫薯酒酒精度逐渐升高,并在25℃时达到最高值,为12.17%vol。随着发酵温度进一步升高至35 ℃,紫薯酒酒精度呈现降低趋势。 而花青素含量则随着发酵温度的升高而逐渐降低,这可能与温度升高对紫薯酒中花青素稳定性的不利影响有关[30]。因此选择25 ℃为最佳发酵温度。
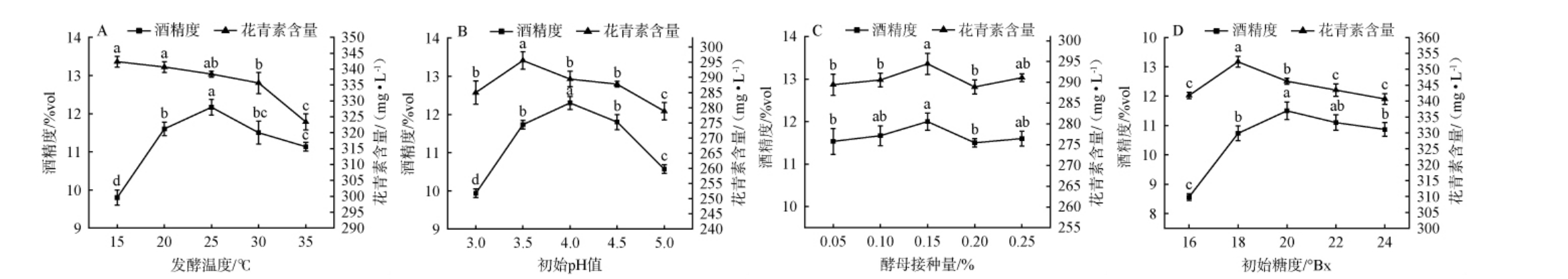
图4 各因素对紫薯酒酒精度和花青素含量的影响
Fig.4 Effects of various factors on alcohol content and anthocyanin contents of purple sweet potato wine
不同小写字母表示差异显著(P<0.05)。
由图4B可知,紫薯酒的酒精度随着初始pH值的升高先上升后下降,当初始pH值为4.0时,紫薯酒的酒精度最高,为12.30%vol,可能是因为该条件最适宜酵母菌生长代谢[31]。花青素含量也随初始pH值的升高先上升后下降,在初始pH值为3.5时,紫薯酒的花青素含量达到最大值,为295.57 mg/L。因此选择4.0为最佳初始pH值。
由图4C可知,紫薯酒的酒精度和花青素含量随着酵母接种量的增加,呈现出先增加后减少的趋势。 在酵母接种量为0.15%的条件下,紫薯酒的酒精度和花青素含量均达到最高值,分别为12%vol、294.46 mg/L。这可能是因为在较低的接种量下,糖分转化为酒精的速率较慢,进而影响酒精度[32];相对地,高接种量可能因酵母菌的增殖过快,导致糖分的过度消耗及代谢副产物的累积,从而降低了乙醇的转化效率[33]。因此选择0.15%为最佳酵母接种量。
糖作为酵母菌生长繁殖及酒精发酵的碳源和底物,对紫薯酒的品质具有显著影响。由图4D可知,紫薯酒的酒精度随着初始糖度的增加先上升后下降,当初始糖度为20 °Bx时,紫薯酒的酒精度最高,为11.50%vol。 花青素含量同样随初始糖度的增加先上升后下降,当初始糖度为18°Bx时,紫薯酒的花青素含量最高,为352.35 mg/L。 因此选择20°Bx为最佳初始糖度。
2.3 响应面试验结果与分析
2.3.1 模型的建立与显著性检验
根据单因素试验的结果,确定了发酵温度(A)、初始pH值(B)和初始糖度(C)作为关键自变量,将酒精度(Y)作为响应值,进一步通过Box-Behnken响应面试验,进行发酵工艺优化,结果见表4。
表4 紫薯酒发酵工艺优化响应面试验设计及结果
Table 4 Design and results of response surface experiments for fermentation process optimization of purple sweet potato wine
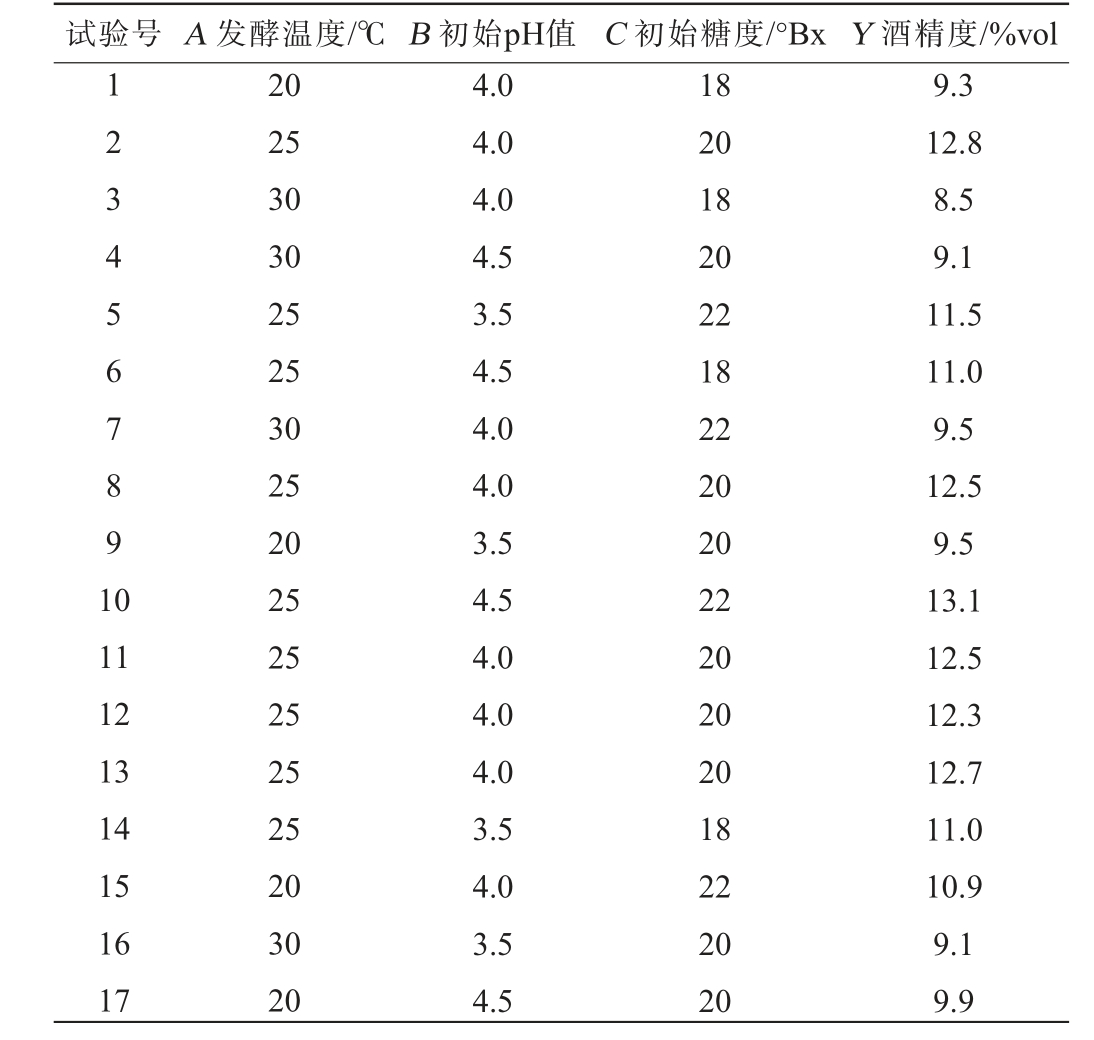
试验号 A 发酵温度/℃ B 初始pH值 C 初始糖度/°Bx Y 酒精度/%vol 123 4567891 0 11 12 13 14 15 16 17 20 25 30 30 25 25 30 25 20 25 25 25 25 25 20 30 20 4.0 4.0 4.0 4.5 3.5 4.5 4.0 4.0 3.5 4.5 4.0 4.0 4.0 3.5 4.0 3.5 4.5 18 20 18 20 22 18 22 20 20 22 20 20 20 18 22 20 20 9.3 12.8 8.5 9.1 11.5 11.0 9.5 12.5 9.5 13.1 12.5 12.3 12.7 11.0 10.9 9.1 9.9
使用Design-Expert 13.0软件对表4的数据进行分析,得到影响紫薯酒酒精度(Y)的3个关键因素的回归方程:
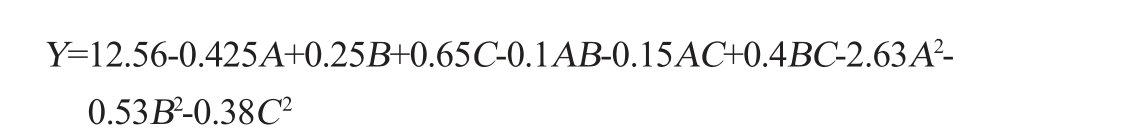
根据表5可知,决定系数R2=0.988 2、调整决定系数R2Adj=0.973 1、变异系数(CV)为2.35%。 此外,模型P值<0.01(模型极显著),而失拟项P值为0.182 8>0.05(不显著),证明该回归模型具有较好的拟合度和较高的可行性,因此可以利用此模型来有效地预测和分析酒精度。一次项A、C及二次项A2、B2对酒精度的影响极显著(P<0.01),一次项B,交互项BC及二次项C2对酒精度的影响显著(P<0.05)。各因素对酒精度影响的大小排序为:C(初始糖度)>A(发酵温度)>B(初始pH值)。
表5 回归模型方差分析
Table 5 Variance analysis of regression model
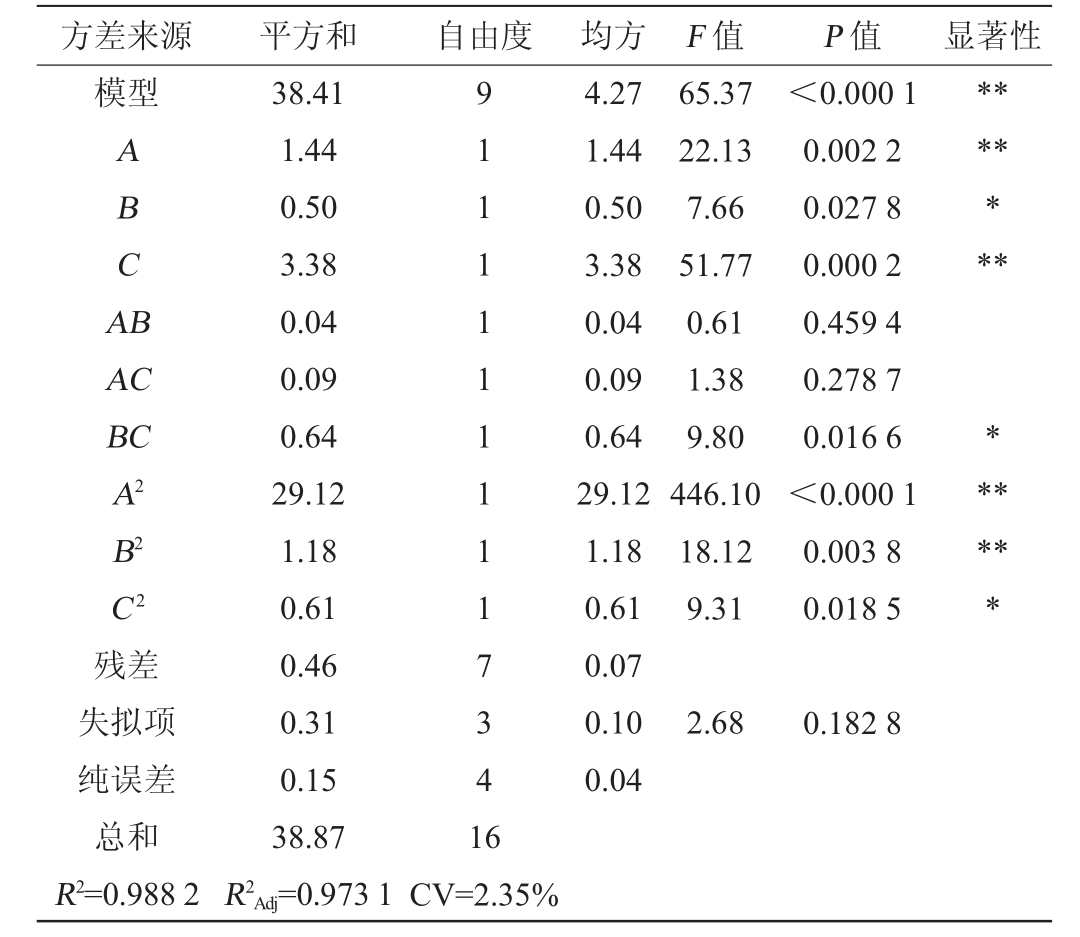
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B*******AC BC A2 B2 C2 65.37 22.13 7.66 51.77 0.61 1.38 9.80 446.10 18.12 9.31<0.000 1 0.002 2 0.027 8 0.000 2 0.459 4 0.278 7 0.016 6<0.000 1 0.003 8 0.018 5******残差失拟项纯误差总和R2=0.988 2 38.41 1.44 0.50 3.38 0.04 0.09 0.64 29.12 1.18 0.61 0.46 0.31 0.15 38.87 R2Adj=0.973 1 911111 1111 7341 6 4.27 1.44 0.50 3.38 0.04 0.09 0.64 29.12 1.18 0.61 0.07 0.10 0.04 2.68 0.182 8 CV=2.35%
2.3.2 响应面分析
响应面图能够直观展示各个因素之间的交互作用对紫薯酒酒精度的影响程度。响应曲面的陡峭程度是衡量影响大小的关键指标,其中曲面的陡峭程度越高,表示影响越大;相反,曲面越平缓,则影响越小[34]。此外,等高线的形状也是评估因素间交互作用显著性的一个重要工具,椭圆形的等高线表明显著的交互作用,而圆形的等高线则表明交互作用不显著[35]。
图5显示,B(初始pH值)和C(初始糖度)交互作用的响应曲面较陡峭且等高线呈现微椭圆形,这表明BC交互作用对紫薯酒酒精度产生了显著影响(P<0.05),与表5的方差分析结果相符。
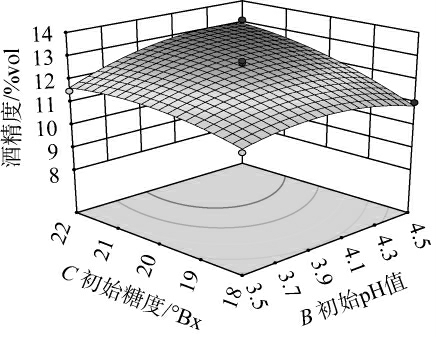
图5 初始pH值与初始糖度间交互作用对酒精度影响的响应曲面及等高线
Fig.5 Response surfaces plots and contour lines of effect of interaction between initial pH and initial sugar content on alcohol content
2.3.3 验证试验
通过Design-Expert 13.0软件对回归方程进行最优求解,确定了紫薯酒最佳的发酵工艺条件为发酵温度24.39 ℃,初始pH值4.31,初始糖度22 °Bx,紫薯酒酒精度预测值为13.07%vol。为确保工艺的可操作性,调整最佳发酵条件为发酵温度24 ℃,初始pH值4.3,初始糖度22°Bx。在此条件下,进行3次重复试验,得到酒精度实际值为(12.93±0.18)%vol,实际值和预测值拟合度高,证明该模型可靠,具有实际意义。
3 结论
本研究通过对五株酵母发酵紫薯酒进行发酵速率测定、理化指标测定、挥发性香气成分分析和感官评价,筛选出DV10酵母为发酵紫薯酒的最优菌株。DV10酵母发酵能力强,发酵的紫薯酒各理化指标均符合NY/T 1508—2017《绿色食品果酒》要求。 五个酒样共检测出68种挥发性香气物质,其中DV10酵母发酵的紫薯酒挥发性香气物质种类最多且丰度更高,特别是TTMP含量显著高于其他酵母(P<0.05),该化合物为紫薯带来了独特的坚果和烘焙香,提升了酒体的香气丰富度和协调性。此外,DV10酵母发酵的紫薯酒中酯类化合物相对含量最高,尤其是辛酸乙酯、月桂酸乙酯、正己酸乙酯和癸酸乙酯,这些物质赋予紫薯酒以花香和果香,增强了其典型性特征。DV10酵母发酵的紫薯酒中醛酮类化合物也更为丰富,贡献了水果香、坚果香和花香。 在感官评价中,DV10酵母发酵的紫薯酒得分最高。通过单因素试验和响应面分析,得到紫薯酒发酵的最佳工艺条件:酵母接种量0.15%,发酵温度24 ℃,初始pH值4.3,初始糖度22°Bx,发酵时间7 d。在上述条件下,所酿造的紫薯酒的酒精度为(12.93±0.18)%vol,有效提高了酒精度。本研究对提高紫薯酒风味品质有一定的参考价值,为紫薯酒的工业化生产提供了科学依据。 后续可筛选非酿酒酵母进行混菌发酵,进一步丰富紫薯酒的香气,提升其市场竞争力。
[1]樊小静,任广跃,段续,等.不同干燥方式下紫薯全粉的物性品质及花青素含量[J].食品与发酵工业,2022,48(21):160-166.
[2]SUN H J,ZHANG P P,ZHU Y S,et al.Antioxidant and prebiotic activity of five peonidin-based anthocyanins extracted from purple sweet potato(Lpomoea batatas(L.)Lam.)[J].Sci Rep,2018,8(1):5018.
[3]TORRES A,AGUILAR-OSORIO G,CAMACHO M,et al.Characterization of polyphenol oxidase from purple sweet potato(Lpomoea batatas L.Lam) and its affinity towards acylated anthocyanins and caffeoylquinic acid derivatives[J].Food Chem,2021,356:129709.
[4]GUO L, LIU J, YANG Y, et al.Purple sweet potato anthocyanins elicit calcium overload-induced cell death by inhibiting the calcium-binding protein S100A4 in acute lymphoblastic leukemia[J].Food Biosci,2021,42:101214.
[5]ALAM M K.A comprehensive review of sweet potato(Lpomoea batatas[L.]Lam):Revisiting the associated health benefits[J].Trends Food Sci Technol,2021,115:512-529.
[6]杨双盼,冉旭.回填-微波干燥生产紫薯全粉工艺研究[J].食品科技,2019,44(12):224-227.
[7]岳瑞雪,钮福祥,孙健,等.干型紫薯酒的发酵工艺研究[J].江苏师范大学学报(自然科学版),2020,38(1):42-46.
[8]陈丽潇,王晓梅,李靓靓,等.紫薯营养与加工研究进展[J].农产品加工,2023(20):74-77,82.
[9]刘沁源,吴祖芳,翁佩芳.水蜜桃酒速酿酵母菌的筛选、鉴定及发酵条件优化[J].核农学报,2020,34(7):1480-1490.
[10]韩保林,张淑凡,邹玉锋,等.低醇桑葚酒酵母的筛选及果酒发酵工艺优化[J].中国酿造,2024,43(9):170-176.
[11]袁杰彬,孙琳,李茂.紫薯酒酿造工艺优化及挥发性香味成分分析[J].酿酒科技,2019(7):69-77.
[12]刘彩婷,周鸿翔,王晓丹,等.八种商业酵母制备蓝莓苹果复合果酒的品质对比[J].中国酿造,2019,38(3):51-58.
[13]赵永梅,郑万财,谢惠春,等.不同酵母对香茶藨子果酒品质及挥发性成分的影响[J].食品与发酵工业,2024,50(12):142-150.
[14]郑凤锦,陈赶林,蒙艳红,等.不同干酵母对甘蔗汁酿酒特性的影响[J].食品工业科技,2018,39(24):30-34.
[15]吴海霞,马国刚.紫薯糯米酒酿制工艺优化及其品质分析[J].农产品加工,2021(20):49-53.
[16]张瑶,唐凤仙,单春会,等.桑葚葡萄复合果酒发酵工艺响应面法优化[J].中国酿造,2024,43(9):157-163.
[17]CARDINALE M, TRINCHERA R, NATRELLA G, et al.Dynamics of the fermentation process and chemical profiling of pomegranate(Punica granatum L.)wines obtained by different cultivar×yeast combinations[J].Foods,2021,10(8):1913.
[18]TCHABO W,MA Y K,KWAW E,et al.Influence of fermentation parameters on phytochemical profile and volatile properties of mulberry(Morus nigra)wine[J].J I Brewing,2017,123(1):151-158.
[19]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[20]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[21]中华人民共和国国家卫生和健康委员会,国家市场监督管理总局.GB 5009.225—2023 食品安全国家标准酒和食用酒精中乙醇浓度的测定[S].北京:中国标准出版社,2023.
[22]郭浩然,郑心怡,张静,等.桑葚酒中花青素含量的测定方法优化[J].食品工业科技,2020,41(9):255-259.
[23]田争福,申鹏森,赵璐,等.类胡萝卜素降解对枸杞酒特征香气的影响[J].食品与生物技术学报,2022,41(9):78-84.
[24]胡小琴,刘伟,许弯,等.不同酵母对脐橙果酒品质的影响[J].食品工业科技,2021,42(5):1-10,25.
[25]DEL BARRIO-GALÁN R,ORTEGA-HERAS M,SÁNCHEZ-IGLESIAS M,et al.Interactions of phenolic and volatile compounds with yeast lees,commercial yeast derivatives and non toasted chips in model solutions and young red wines[J].Eur Food Res Tech,2012,234(2):231-244.
[26]陶祥婕,胡萍.复合菌种发酵黄浆水的风味品质分析[J].食品与发酵工业,2024,50(11):308-318.
[27]WANG J, YUAN C J, GAO X L, et al.Characterization of key aroma compounds in Huangjiu from northern China by sensory-directed flavor analysis[J].Food Res Int,2020,134:109238.
[28]HUANG D,ZHONG Y,LIU Y L,et al.Reducing higher alcohols by integrating indigenous Saccharomyces cerevisiae,nitrogen compensation,and chaptalization methods during fermentation of kiwifruit wine[J].LWT-Food Sci Technol,2023,184:115059.
[29]FAN W L,XU Y,ZHANG Y H.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].J Agr Food Chem,2007,55(24):9956-9962.
[30]AKTHER S,SULTANA F,BADSHA M R,et al.Anthocyanin stability profile of mango powder:temperature,pH,light,solvent and sugar content effects[J].Turk J Agr-Food Sci Tech,2020,8(9):1871-1877.
[31]卫春会,郑自强,郭燕,等.橄榄果酒的研制及其风味物质分析[J].现代食品科技,2020,36(12):234-242,313.
[32]方裕理,张雨,李彦中,等.桑葚酒发酵工艺条件优化及其品质分析[J].中国酿造,2023,42(12):137-142.
[33]王启慧,张婧靖,李晓晓,等.基于响应面法优化库德毕赤酵母Y1酿造高黄酮山楂酒工艺[J].中国酿造,2024,43(7):184-189.
[34]ZHANG L,JIANG Y H,PANG X N,et al.Simultaneous optimization of ultrasound-assisted extraction for flavonoids and antioxidant activity of Angelica keiskei using response surface methodology (RSM)[J].Molecules,2019,24(19):3461.
[35]陈娟,喻仕瑞,郑华艳,等.酱香蜂蜜酒发酵工艺优化及其品质分析[J].中国酿造,2024,43(4):231-238.