纳豆是日本典型的发酵类食品,大多是大豆经灭菌后接种枯草芽孢杆菌(Bacillus subtilis)发酵而成[1]。纳豆的营养成分颇多,其不仅具有大豆的全部营养,还含有多种生物活性物质,如纳豆激酶、蛋白酶、维生素等[2]。 其中,纳豆中所含的纳豆激酶具有较好的溶栓作用[3]。但是传统发酵的纳豆多以大豆为主,具有比较浓郁的氨臭味、类似臭鸡蛋的气味等异味,氨臭味主要由蛋白质分解产生的氨类物质所致;类似臭鸡蛋的气味主要由含硫氨基酸产生硫化氢、甲硫醇等所致;酸臭味主要由发酵过程中产生的乙酸、丙酸、丁酸等物质所致。这些特殊的风味物质限制了纳豆在我国消费市场的接受程度[4]。近年来有不少专家学者尝试优化纳豆的发酵工艺来进行纳豆风味改良[5-8],如采用混菌或改变发酵底物制作纳豆、开发水果风味纳豆饮品、研发纳豆酱料或纳豆酸奶等,这些手段可以使纳豆风味便于国人接受,进而打开国内的纳豆消费市场。
花生是中国的重要油料经济作物之一,富含蛋白质、钙、磷、铁和脂肪酸[9],且花生中含氮量比黄豆低,而有研究表明含氮量高更易产生氨臭味[10]。目前,虽然有不少学者对花生发酵进行研究,但其主要是聚焦于畜禽饲料等副产品上[11]。市面上的花生类食品种类众多,但发酵的花生类食品却很少见。近几年内,单纯以花生为原料,研究花生纳豆制备工艺及风味变化规律的相关研究鲜见报道。
本研究以东北四粒红老品种花生为原料,枯草芽孢杆菌为菌种,发酵生产花生纳豆。以感官评分和纳豆激酶活性的综合评分为指标,通过单因素和响应面试验优化花生纳豆的发酵工艺,并采用顶空固相微萃取-气相色谱-质谱(headspace solid phase microextraction-gas chromatographymass spectrometry,SPME-GC-MS)对花生纳豆的挥发性风味物质进行分析,以期为改善纳豆不良风味,开拓纳豆市场提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
花生:黑龙江仓天然生态农业有限公司;枯草芽孢杆菌(Bacillus subtilis)(CICC 10023):中科院微生物研究所。
1.1.2 试剂
纤维蛋白原、尿激酶(50000 U/g)、凝血酶(2 000U/mg):上海源叶生物科技有限公司;牛肉浸粉(生化试剂)、胰蛋白胨(生化试剂)、氯化钠(分析纯):国药集团化学试剂有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
营养肉汤(nutrient broth,NB)培养基[12]:蛋白胨5 g,牛肉浸粉3 g,氯化钠5 g,蒸馏水1 000 mL。115 ℃高压蒸汽灭菌30 min。NB固体培养基:NB培养基中添加琼脂15 g。
1.2 仪器与设备
ZXSR-1270生化培养箱:上海智城分析仪器制造有限公司;DK-320S三用恒温水槽:上海精宏实验设备有限公司;CT15RE台式高速冷冻离心机:日立工机株式会社;RODI物联网智慧型超纯水系统:厦门锐思捷水纯化技术有限公司;SPME手动进样器、75 μm CAR-100 μm PDMS萃取头:美国Supelco公司;7890A/5975C气相色谱-质谱联用仪:美国安捷伦公司。
1.3 方法
1.3.1 花生纳豆发酵工艺流程

操作要点[13]:
筛选、浸泡:选取颗粒饱满、大小均一、无破损的花生,进行清洗后,按质量比1∶3加入纯净水,在室温下浸泡18 h。
蒸煮灭菌:将浸泡好的花生脱去红衣,分成两瓣,置于121 ℃高压蒸汽灭菌锅中蒸煮30 min。
接种:将枯草芽孢杆菌菌种接至NB固体培养基,在30 ℃条件下活化培养24 h;挑取一环活化的菌株接种于NB培养基,并在30 ℃、200 r/min条件下培养16 h作为种子液。 以花生的质量为基准,接种15%的种子液。
发酵:将接种后的花生放入37℃恒温培养箱中发酵30h。
后熟:将发酵结束的花生放入4 ℃冰箱后熟20 h得到成品花生纳豆。
1.3.2 花生纳豆发酵工艺优化单因素试验
以感官评分与纳豆激酶的综合评分为响应值,分别考察发酵温度(29 ℃、33 ℃、37 ℃、41 ℃、45 ℃)、发酵时间(22 h、26 h、30 h、34 h、38 h)、枯草芽孢杆菌接种量(5%、10%、15%、20%、25%)对花生纳豆感官评分、纳豆激酶活性的影响。
1.3.3 花生纳豆发酵工艺优化响应面试验
在单因素试验结果的基础上,根据Box-Behnken原理,以发酵温度(A)、发酵时间(B)、接种量(C)为考察因素,以感官评分及纳豆激酶活性的综合评分为响应值,采用Design-Expert 8.0.6软件设计3因素3水平的响应面试验,试验因素与水平见表1。
表1 花生纳豆发酵工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for
fermentation process optimization of peanut natto

因素-1水平0 1 A 发酵温度/℃B 发酵时间/h C 枯草芽孢杆菌接种量/%37 30 5 41 34 10 45 38 15
1.3.4 测定方法
(1)感官评价
由10名经过训练的专业评定员组成感官评价小组,小组成员依次评价纳豆的外观、气味、菌苔转黏液程度及口感,总分100分,具体评价标准见表2。
表2 花生纳豆感官评价标准
Table 2 Sensory evaluation standards of peanut natto

项目 菌苔外观 气味 菌苔搅拌转化粘液 口感 得分/分21~25评价标准菌苔较多有质感菌苔较多菌苔稀薄无质感几乎无菌苔有花生油脂香,无明显氨味有花生油脂香,少量氨味有花生油脂香,明显氨味无花生油脂香,少量氨味全部转粘液,粘性好几乎全部转粘液,粘性好部分转粘液,粘性一般少部分转粘液,粘性差绵密湿润,无硬芯较绵密湿润,略有硬芯软,硬芯小14~20 7~13干,硬芯大0~6
(2)纳豆激酶酶活的测定
采用纤维蛋白平板法测定纳豆激酶酶活[14-16]。 纳豆激酶单位酶活力定义:每分钟溶解纤维蛋白平板上的纤维蛋白, 产生1 mm2透明圈面积所需要的酶量为一个酶活力单位,U。
(3)综合评价
参考付文静等[17]计算综合评分,其计算公式如下:
综合评分=0.5×[感官评分+(纳豆激酶酶活/纳豆激酶酶活最大值)×100]
(4)挥发性风味物质的测定
样品预处理:参考杨柳等[18]的方法并改进。取10 g花生纳豆样品,放入50 mL样品瓶中,在60 ℃条件下水浴保温20min。将经老化的75μmCAR-100μmPDMS萃取头插入样品瓶,顶空吸附40 min,然后将萃取头插入进样口进行解吸。
色谱条件:HP-5ms毛细管色谱柱(30 m×250 μm×0.25 μm),载气为高纯氦气(He),载气流速4 mL/min,不分流;进样口温度240 ℃,传输线温度280 ℃;升温程序为初始温度40 ℃,恒温1 min,以5 ℃/min升至120 ℃,再以20 ℃/min升至240 ℃,保持5 min。
质谱条件:电离方式为电子电离(electron ionization,EI)源,电离能量70 eV,离子源温度230 ℃,四级杆温度150 ℃,扫描质量范围10~500 amu。
定性定量方法:采用美国国家标准技术研究所(National Institute of Standards and Technology,NIST)14标准谱库,参考标准谱图及保留指数进行定性分析;采用面积归一化法定量。
1.3.5 数据处理与统计分析
采用IBM SPSS Statistics 26.0软件、Origin 2022软件和Design Expert 8.0.6软件对数据进行分析处理和可视化。
2 结果与分析
2.1 花生纳豆发酵工艺优化单因素试验
2.1.1 发酵温度对花生纳豆品质的影响
发酵温度对花生纳豆品质的影响见图1。 由图1可知,随着发酵温度的升高,花生纳豆的纳豆激酶酶活、感官评分及综合评分均呈先升高后下降的趋势,当发酵温度达到41 ℃时,综合评分最高,达到84.93分,此时,感官评分为69.86分,纳豆激酶活力1 193.436 U/g。分析原因可能是,枯草芽孢杆菌在高温和低温环境下都无法正常生长,发酵温度过低,枯草芽孢杆菌活跃度过低,不利于产生纳豆激酶;发酵温度过高,抑制了菌体的正常生命活动[19-20]。 因此,确定最佳发酵温度为41 ℃。
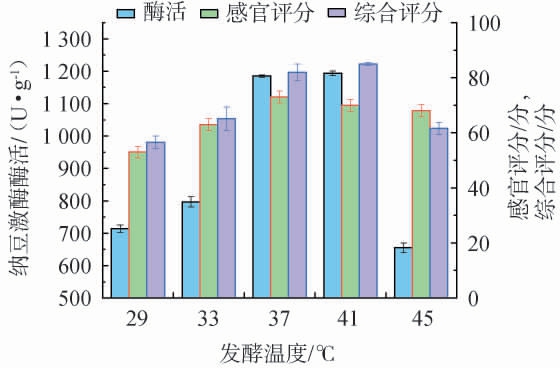
图1 发酵温度对花生纳豆品质的影响
Fig.1 Effect of fermentation temperature on the quality of peanut natto
2.1.2 发酵时间对花生纳豆品质的影响
发酵时间对花生纳豆品质的影响见图2。 由图2可知,随着发酵时间的延长,花生纳豆的纳豆激酶酶活、感官评分及综合评分均呈先升高后下降的趋势,当发酵时间为34 h时,花生纳豆的综合评分最高,为84.00分,此时,感官评分为68.00分,纳豆激酶酶活为1 259.35 U/g。分析原因可能是,发酵时间过短,枯草芽孢杆菌活跃度不够,影响产酶量[21],花生纳豆表面黏液较少,纳豆风味偏花生原本风味;发酵时间过长,底物剩余量少,纳豆菌的生长繁殖受到抑制,纳豆激酶酶活下降。因此,确定最佳发酵时间为34 h。
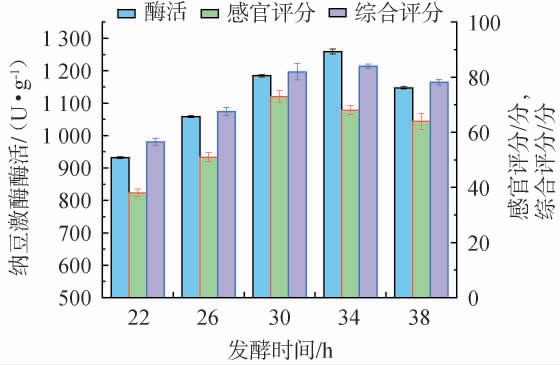
图2 发酵时间对花生纳豆品质的影响
Fig.2 Effect of fermentation time on the quality of peanut natto
2.1.3 接种量对花生纳豆品质的影响
接种量对花生纳豆品质的影响见图3。 由图3可知,随着接种量的增大,花生纳豆的纳豆激酶酶活、感官评分及综合评分均呈先升高后下降的趋势。当接种量为10%时,综合评分达到最大值,为83.43分,此时,感官评分为75分,纳豆激酶酶活为1 156.84 U/g。 分析原因可能是,接种量过低,导致菌液不能均匀附着在花生表面,从而影响花生纳豆的品质;而接种量过高,过多的纳豆激酶阻碍了体系的氧气传递,同时也会阻碍菌体获得营养物质[22],影响花生纳豆的品质。因此,确定最佳接种量为10%。
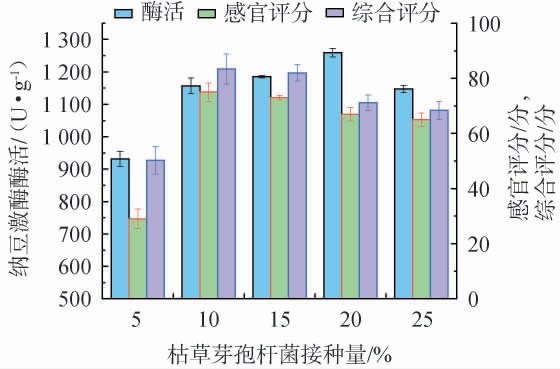
图3 接种量对花生纳豆品质的影响
Fig.3 Effect of inoculum on the quality of peanut natto
2.2 花生纳豆发酵工艺优化响应面试验
在单因素试验的基础上,根据Box-Behnken原理,以发酵温度(A)、发酵时间(B)、接种量(C)为考察因素,以感官评分及纳豆激酶活性的综合评分为响应值,采用Design-Expert 8.0.6软件设计3因素3水平的响应面试验,试验设计及结果见表3,方差分析见表4。
表3 花生纳豆发酵工艺优化响应面试验设计及结果
Table 3 Design and results of response surface tests for fermentation process optimization of peanut natto
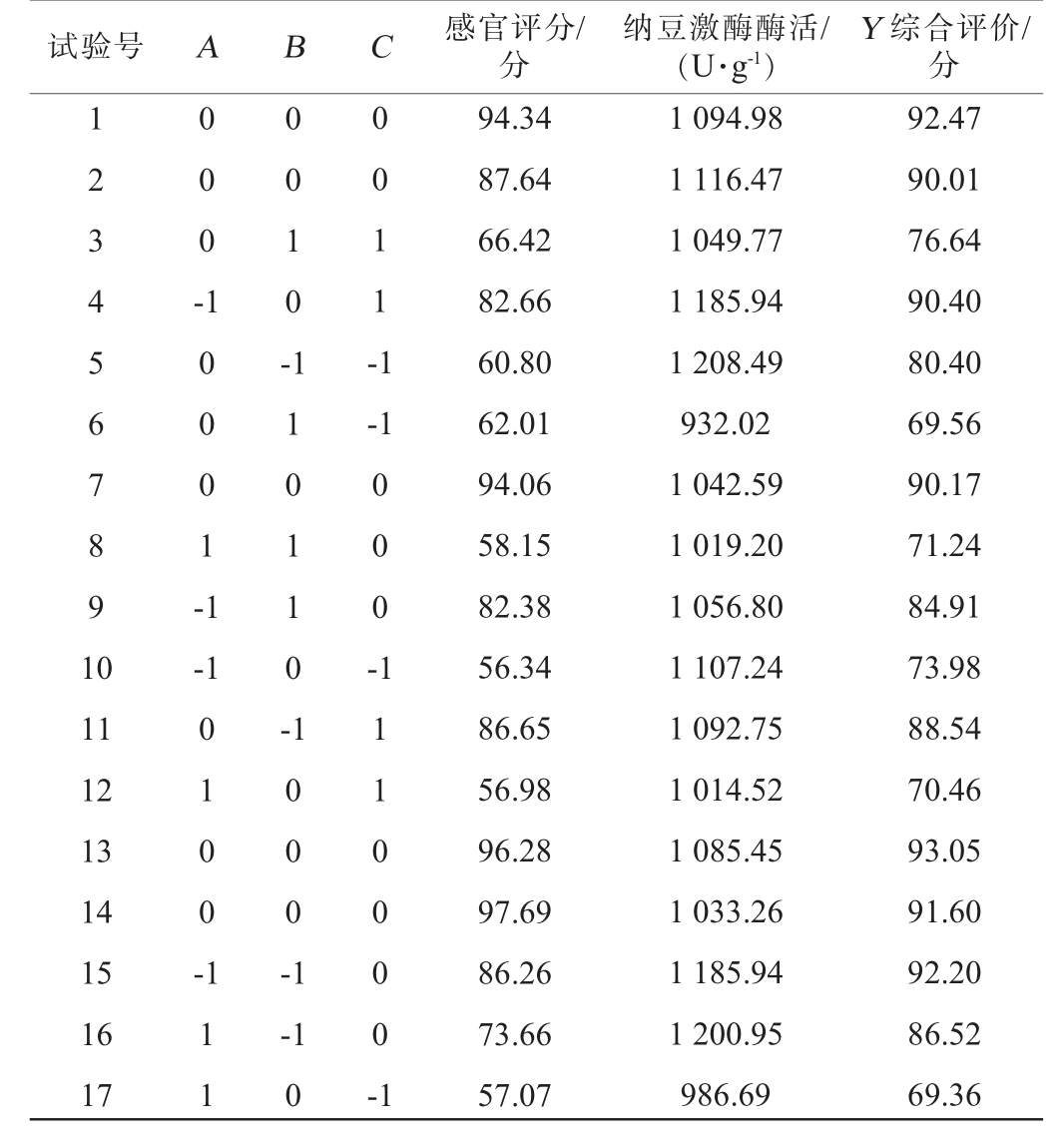
试验号 A B C 感官评分/分纳豆激酶酶活/(U·g-1)Y 综合评价/分1 2 3 4 5 6 7 8 9 1 0 0 0 0 -1 0 0 0 1 -1 0 0 1 0 -0 0 1 1 -1-1-1 0 0 0 -11 12 13 14 15 16 17 0 1 0 0 -1 1 0 1 1 0 -1 1 1 1 0 0 0 -1-1 0 1 1 1 0 0 0 0 -1 94.34 87.64 66.42 82.66 60.80 62.01 94.06 58.15 82.38 56.34 86.65 56.98 96.28 97.69 86.26 73.66 57.07 1 094.98 1 116.47 1 049.77 1 185.94 1 208.49 932.02 1 042.59 1 019.20 1 056.80 1 107.24 1 092.75 1 014.52 1 085.45 1 033.26 1 185.94 1 200.95 986.69 92.47 90.01 76.64 90.40 80.40 69.56 90.17 71.24 84.91 73.98 88.54 70.46 93.05 91.60 92.20 86.52 69.36
表4 回归模型方差分析
Table 4 Variance analysis of regression model
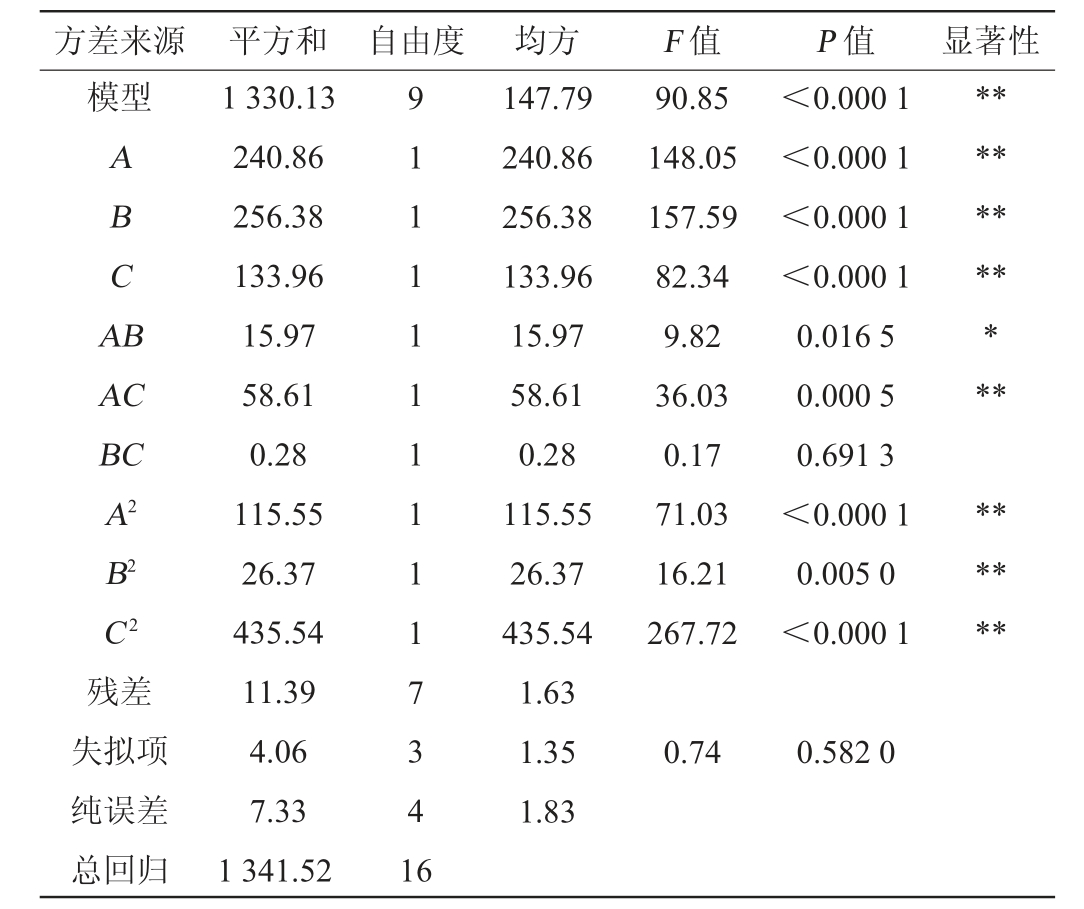
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B AC BC A2 B2 C2残差失拟项纯误差总回归1 330.13 240.86 256.38 133.96 15.97 58.61 0.28 115.55 26.37 435.54 11.39 4.06 7.33 1 341.52 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 147.79 240.86 256.38 133.96 15.97 58.61 0.28 115.55 26.37 435.54 1.63 1.35 1.83 90.85 148.05 157.59 82.34 9.82 36.03 0.17 71.03 16.21 267.72<0.000 1<0.000 1<0.000 1<0.000 1 0.016 5 0.000 5 0.691 3<0.000 1 0.005 0<0.000 1*****************0.74 0.582 0
采用Design-Expert 8.0.6软件对表3数据进行多元二次回归拟合,得到以感官评分及纳豆激酶活性的综合评分(Y)与发酵温度(A)、发酵时间(B)、接种量(C)的多元二次回归方程为:Y=91.46-5.49A-5.66B+4.09C-2.00AB-3.83AC-0.26BC-5.24A2-2.50B2-10.17C2。
由表4可知,模型的P值<0.000 1,极显著,失拟项的P值=0.582 0>0.05,不显著,说明模型拟合度较好。决定系数R2=0.991 5,调整决定系数R2Adj=0.980 6,预测决定系数R2Pre=0.943 1,说明此模型和实际试验拟合较好。由F值可知,对花生纳豆综合评分的影响因素主次顺序为发酵时间(B)>发酵温度(A)>接种量(C)。由P值可知,一次项A、B、C、交互项AC及二次项A2、B2、C2对结果影响极显著(P<0.01),交互项AB对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
发酵温度与接种量、发酵时间间交互作用对花生纳豆综合评分影响的响应面及等高线见图4。曲面越陡峭,交互作用的影响越大;曲面越平缓,交互作用的影响越小[23-25]。由图4可知,发酵温度与接种量、发酵时间交互作用对花生纳豆综合评分影响的响应面均呈凸面,曲面陡峭,且等高线均呈椭圆形,说明发酵温度与接种量、发酵时间间交互作用对花生纳豆综合评分的影响较大,这与方差分析结果一致。
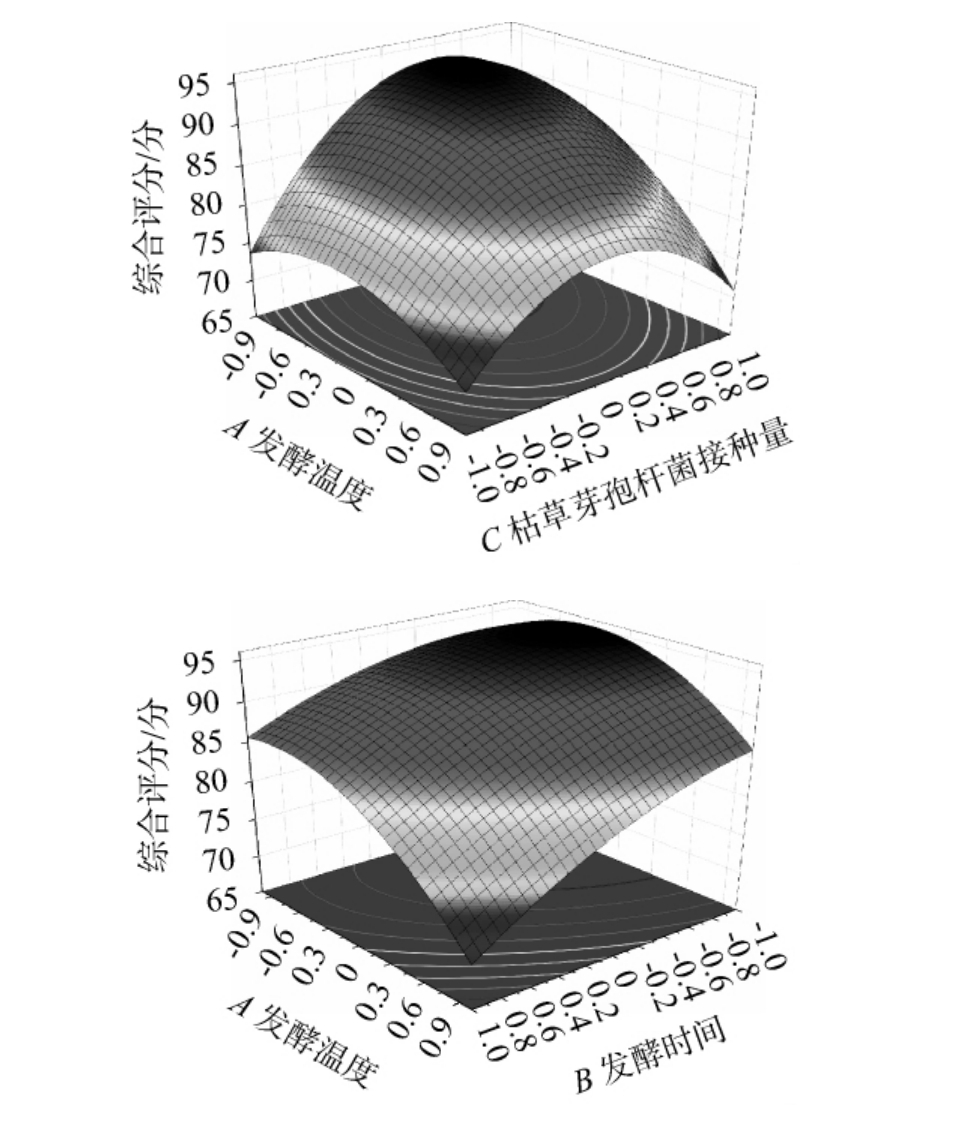
图4 发酵温度与接种量、发酵时间间交互作用对花生纳豆综合评分影响的响应曲面及等高线
Fig.4 Response surface plots and contour lines of effect of interaction between fermentation temperature, inoculum and fermentation time on the comprehensive score of peanut natto
采用Design-Expert 8.0.6软件对回归模型进行最优求解,得到花生纳豆的最优发酵工艺条件为:枯草芽孢杆菌接种量12.05%,发酵温度38.72 ℃,发酵时间33.79 h,在此条件下,花生纳豆的综合评分预测值为93.99分。为了方便实际操作,将最优工艺条件调整为枯草芽孢杆菌接种量12%,发酵温度39 ℃,发酵时间34 h。在此条件下,进行3次平行验证试验,最终得到感官评分为88.12分,纳豆激酶活力为1 127.32 U/g,综合评分实际值为90.70分,预测值和实际值较接近,表明该模型可靠,可用于花生纳豆实际生产工艺条件的预测。
2.3 花生纳豆的挥发性风味物质分析
采用SPME-GC-MS检测花生纳豆中的挥发性风味物质,结果见表5。由表5可知,从花生纳豆中共检出38种主要挥发性风味物质,包括酸类物质7种、醇类物质4种、烯烃类物质10种、醛类物质6种、酮类物质2种、酯类物质1种、吡嗪类物质4种、其他类化合物4种。
表5 花生纳豆中挥发性风味物质GC-MS分析结果
Table 5 Results of volatile flavor compounds in peanut natto analyzed by GC-MS
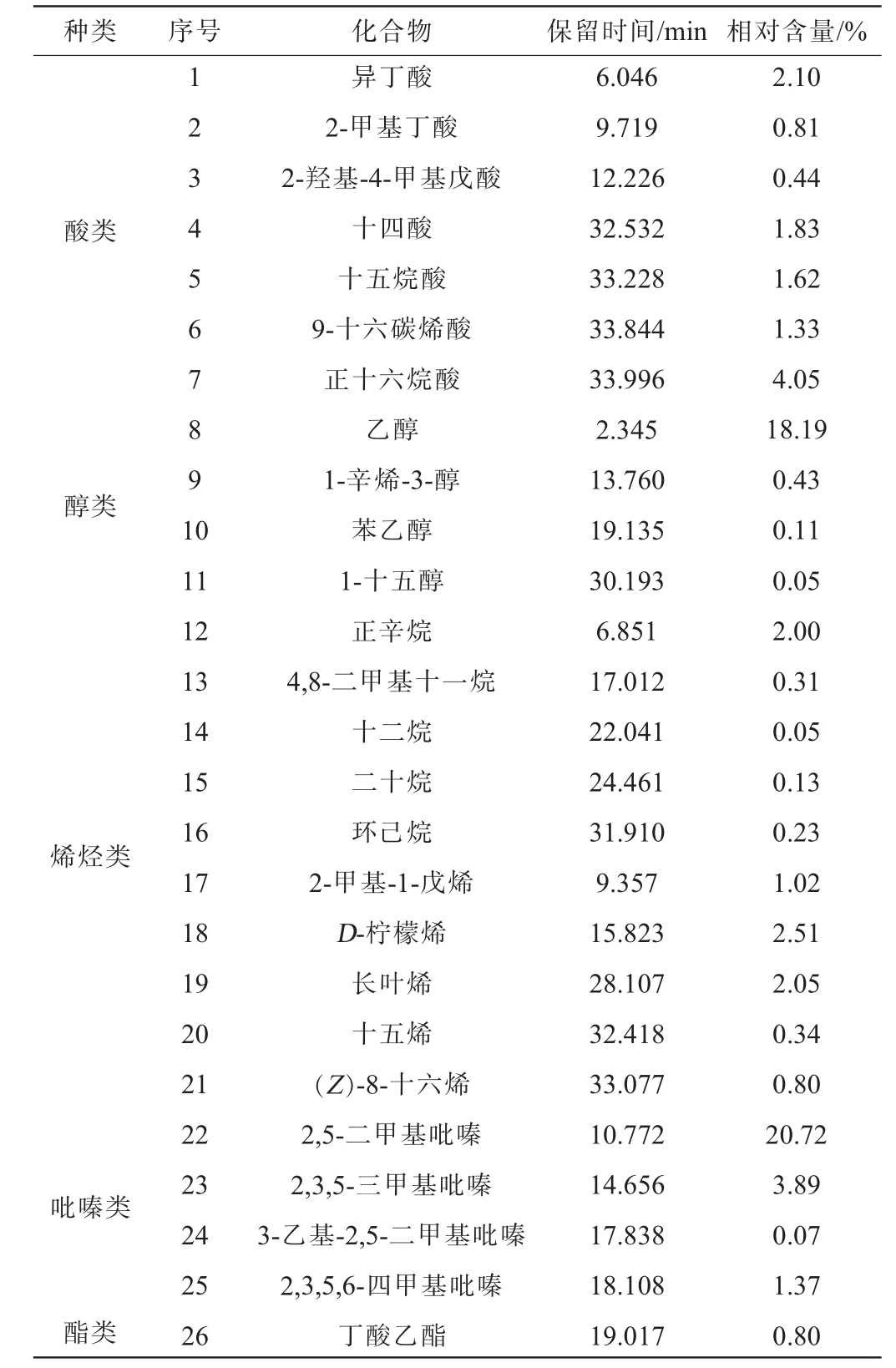
种类 序号 化合物 保留时间/min 相对含量/%酸类醇类1 2 3 4 5 6 7 8 9 1 0烯烃类吡嗪类酯类11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26异丁酸2-甲基丁酸2-羟基-4-甲基戊酸十四酸十五烷酸9-十六碳烯酸正十六烷酸乙醇1-辛烯-3-醇苯乙醇1-十五醇正辛烷4,8-二甲基十一烷十二烷二十烷环己烷2-甲基-1-戊烯D-柠檬烯长叶烯十五烯(Z)-8-十六烯2,5-二甲基吡嗪2,3,5-三甲基吡嗪3-乙基-2,5-二甲基吡嗪2,3,5,6-四甲基吡嗪丁酸乙酯6.046 9.719 12.226 32.532 33.228 33.844 33.996 2.345 13.760 19.135 30.193 6.851 17.012 22.041 24.461 31.910 9.357 15.823 28.107 32.418 33.077 10.772 14.656 17.838 18.108 19.017 2.10 0.81 0.44 1.83 1.62 1.33 4.05 18.19 0.43 0.11 0.05 2.00 0.31 0.05 0.13 0.23 1.02 2.51 2.05 0.34 0.80 20.72 3.89 0.07 1.37 0.80
续表
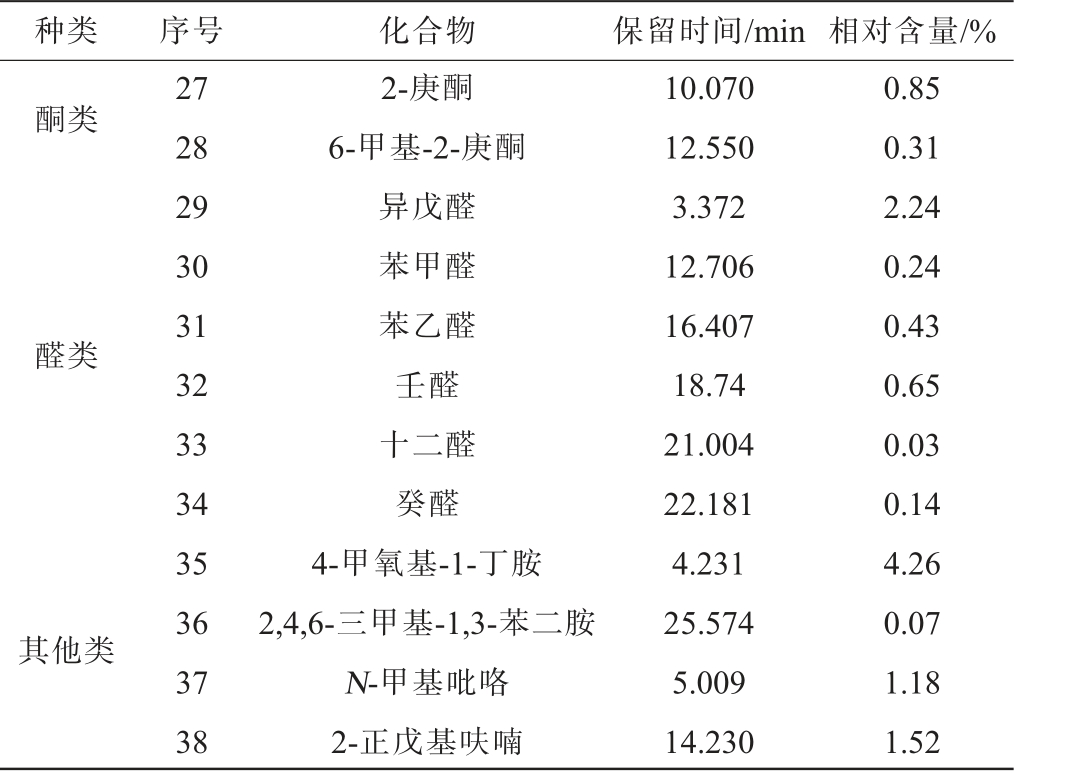
其他类种类 序号 化合物 保留时间/min 相对含量/%27 28 29 30 31 32 33 34 35 36 37 38酮类醛类2-庚酮6-甲基-2-庚酮异戊醛苯甲醛苯乙醛壬醛十二醛癸醛4-甲氧基-1-丁胺2,4,6-三甲基-1,3-苯二胺N-甲基吡咯2-正戊基呋喃10.070 12.550 3.372 12.706 16.407 18.74 21.004 22.181 4.231 25.574 5.009 14.230 0.85 0.31 2.24 0.24 0.43 0.65 0.03 0.14 4.26 0.07 1.18 1.52
在所检测到的挥发性风味物质中,相对含量较高的有2,5-二甲基吡嗪(20.72%)、2,3,5-三甲基吡嗪(3.89%)、乙醇(18.19%)、D-柠 檬 烯(2.51%)、长 叶 烯(2.05%)、异 戊 醛(2.24%)。其中,2,5-二甲基吡嗪和2,3,5-三甲基吡嗪是吡嗪化合物,在美拉德反应中产生,具有强烈坚果香和焦糖香[26-27],且有相关研究表明吡嗪类化合物是纳豆香味物质的主要物质,其具有使血液不易凝固的作用[28]。乙醇和苯乙醇具有“助香”作用[28],带有玫瑰香气与蜂蜜香[29],其产生和氨基酸的代谢以及脂肪的降解和氧化紧密相关[30],赋予了花生纳豆一定的风味。D-柠檬烯和长叶烯是烯烃类物质中的主体香味成分,D-柠檬烯具有橙子香及柠檬香味,长叶烯具有琥珀香气[31]。异戊醛可以为花生纳豆提供麦芽香和蜂蜜香味[32]。
有研究发现,传统的纳豆中的不良挥发性风味物质主要是异丁酸甲酯、氨、2-甲基丁酸、乙酸、丙酸、吡嗪、有机硫和无机硫等物质[33-35]。与传统纳豆中主要不良风味物质相比,花生纳豆中未检测出含硫物质;花生纳豆中虽然检出了2-甲基丁酸,但其含量比一般的传统纳豆(1.05%~2.24%)[24,26,36]低,说明花生纳豆降低了不良风味[26];花生纳豆中的酸类物质和烃类物质种类较多,且其酸类物质中未检测到乙酸和丙酸等酸臭类物质,只有少量的丁酸类物质,这也赋予了花生纳豆不同于传统发酵纳豆的风味。
3 结论
以东北四粒红老品种花生为原料,枯草芽孢杆菌为菌种研制花生纳豆。通过单因素和响应面试验得到的花生纳豆的最佳发酵工艺条件为:枯草芽孢杆菌接种量12%,发酵温度39 ℃,发酵时间34 h。在该条件下得到的花生纳豆感官评分为88.12分,纳豆激酶活性为1 127.32 U/g,综合评分为90.70分,产品本身呈现棕黄色,表面覆盖一层米黄色菌膜,具有纳豆风味,且豆粒较完整,口感绵密。 利用HS-SPMEGC-MS从花生纳豆中共检出38种挥发性风味物质,其中2,5-二甲基吡嗪(20.72%)、2,3,5-三甲基吡嗪(3.89%)、乙醇(18.19%)、D-柠 檬 烯(2.51%)、长 叶 烯(2.05%)、异 戊 醛(2.24%)的相对含量较高。相较于传统发酵纳豆,花生纳豆中未检测到含硫类化合物、乙酸及丙酸等酸臭味物质,具有较好的感官品质。本研究结果可以为改善纳豆不良风味及开拓纳豆市场提供新思路。
[1]南芝润,侯磊,任莹,等.纳豆及其产物的研究与应用[J].山西农业科学,2017,45(10):1721-1724,1736.
[2]张凯淇,于泽,孔祥佳,等.纳豆的保健作用及应用前景[J].农产品加工,2022(14):77-80.
[3]杨艳莉,吴雪玲,余知和.纳豆及纳豆芽孢杆菌研究进展[J].中国调味品,2022,47(5):201-205.
[4]高雅鑫,张蒙冉,侯丽真,等.纳豆不良风味的研究进展[J].食品工业科技,2022,43(1):445-450.
[5]杨立娜,曹淑芳,解梦汐,等.纳豆制备工艺的改良及其溶栓、整肠功能的研究进展[J].食品与发酵科技,2023,59(1):134-139.
[6]任锡雯,宋爽,韦恃怡,等.响应面法优化果味纳豆饮品制备工艺的研究[J].食品研究与开发,2022,43(17):113-119.
[7]杨传慧,何晓雯,徐林通,等.纳豆大蒜酱工艺研究与分析[J].农产品加工,2022(8):24-29.
[8]周艳华,李涛,黄小波,等.富含纳豆激酶抹茶纳豆酸奶的发酵工艺研究[J].中国酿造,2022,41(1):167-171.
[9]尹可宏,杨茜,赵秀飞,等.羟自由基氧化对花生球蛋白结构和功能性质的影响[J].食品与发酵工业,2022,48(4):24-31.
[10]张树明,唐伟林.降低纳豆氨味研究进展[J].黑龙江中医药,2016,45:75-76.
[11]解梦汐,孙玉,张良晨,等.微生物发酵技术在花生及其副产物中的应用[J].中国酿造,2023,42(2):10-15.
[12]杜斌,汪肖,张敏,等.枯草芽孢杆菌发酵薏仁米糠制备多肽条件优化及其体外抗氧化活性研究[J].中国酿造,2024,43(2):146-151.
[13]于江淼,王家林,张海粟.黑纳豆固态发酵工艺优化的研究[J].中国调味品,2020,45(5):101-106.
[14]钱泽栋,张佑红,卢育兵,等.纳豆菌的分离筛选与鉴定[J].化学与生物工程,2018,35(8):41-44.
[15]SINGH R,GAUTAM P,SHARMA C,et al.Fibrin and fibrinolytic enzyme cascade in thrombosis:Unravelling the role[J].Life,2023,13(11):2196.
[16]洪奕,夏海华,田洁萍,等.响应面法优化豆粕固体发酵产纳豆激酶培养条件[J].中国调味品,2022,47(8):41-45.
[17]付文静,王家林,张杰.赤小豆纳豆发酵工艺的研究[J].食品研究与开发,2018,39(2):109-113.
[18]杨柳,陈子怡,乔晨,等.鹰嘴豆纳豆发酵过程中挥发性成分分析[J].中国酿造,2021,40(8):32-36.
[19]SINGH B,KUMAR G,KUMAR V,et al.Enhanced phytase production byBacillus subtilis subsp.subtilis in solid state fermentation and its utility in improving food nutrition[J].Protein Pept Lett,2021,28(10):1083-1089.
[20]董平,赵彩霖,刘阳,等.燕麦纳豆制作工艺优化及其抗氧化性研究[J].中国食品添加剂,2023,34(8):205-213.
[21]GUO N,JIANG Y W,SONG X R,et al.Effect of Bacillus natto solidstate fermentation on the functional constituents and properties of Ginkgo seeds[J].J Food Biochem,2019,43(5):e12820.
[22]IRFAN M, ASGHAR U, NADEEM M, et al.Optimization of process parameters for xylanase production by Bacillus sp.in submerged fermentation[J].J Radiat Res Appl Sci,2016,9(2):139-147.
[23]孙娜,朱秀娟,何九军,等.核桃粕纳豆发酵工艺优化及其品质分[J].中国酿造,2023,42(9):156-162.
[24]孙于庆,贾懿敏,朱雅欣,等.响应面法优化苦瓜红枣酸奶的工艺研究[J].农产品加工,2024(15):37-40.
[25]NOIDEEC,NINCHANB.Investigationofoptimized microbial oligofructans production by Bacillus subtilis TISTR 001 using response surface methodology[J].Sugar Tech,2024,26:585-594.
[26]高雅鑫,倪楠,许斌,等.枯草芽孢杆菌BSNK-5发酵豆乳特有风味物质研究[J].食品与发酵工业,2020,46(15):258-264.
[27]杨杨,曾剑华,王冰,等.中国传统发酵豆制品风味物质的研究进展[J].大豆科学,2018,37(6):969-974.
[28]孙娜,王林林,朱秀娟,等.固态纳豆调味品的制备及其挥发性物质分析[J].中国调味品,2023,48(8):143-149.
[29]王琴,文安燕,秦礼康,等.传统发酵豆豉粑特征风味物质研究[J].食品与发酵科技,2023,59(1):62-72.
[30]周宇科,郑传洋,任汐月,等.不同产地花生酱的挥发性风味成分比较分析[J].现代食品科技,2023,39(4):297-310.
[31]何维,安天星,余玲,等.不同菌种对太和豆豉的品质及其挥发性风味化合物变化的研究[J].中国调味品,2022,47(5):43-49.
[32]ZHAO G Z, DING L L, HADIATULLAH H, et al.Characterization of the typical fragrant compounds in traditional Chinese-type soy sauce[J].Food Chem,2020,312:126054.
[33]汪立君,李里特,齐藤昌义,等.大豆发酵食品风味物质的研究[J].食品科学,2004,25(S1):66-69.
[34]刘野,苏杭,宋焕禄,等.8种纳豆挥发性香气成分的比较研究[J].食品工业科技,2016,37(5):302-307.
[35]刘琪,陈静,张佩娜,等.不同黄豆自制纳豆与市购纳豆差异性比较分析[J].食品工业科技,2018,39(20):1-5.
[36]谢兰心,樊晓博.顶空固相微萃取法对两种大豆发酵豆豉挥发性成分的比较[J].中国调味品,2018,43(4):85-89.