甜菜(Beta vulgaris L.)是藜科甜菜属二年生草本植物,是世界上重要的糖料作物,大约提供了全球35%的糖分[1]。甜菜是重要的经济作物,也是中国主要糖料作物之一[2],具有生产成本低、产量高、价格低廉等优势。主要分布在内蒙古、新疆、黑龙江及邻近省区[3]。 甜菜块根含有高浓度的蔗糖,是目前主要的制糖原料之一[4]。甜菜的含糖量高达16%,而甘蔗的含糖量只有12%~13%。作为一种优良的非粮糖类提供者,甜菜已广泛应用于发酵领域用于氢气[5]、生物乙醇[6]、甜菜浆[7]、丙二醇[8]等产物的发酵之中。
L-乳酸作为一种重要的有机酸,在食品、医药、化工等诸多领域有着广泛应用[9]。与常见的发酵微生物相比,利用大肠杆菌发酵甜菜生产L-乳酸具有得天独厚的优势。经基因改造和实验室驯化获得的大肠杆菌W株系,能够快速利用发酵原料中的蔗糖或果糖[10]。此外,相较于酵母、运动单胞杆菌等微生物,大肠杆菌(Escherichia coli)对五碳糖具有更强的利用能力[11]。这使得大肠杆菌在发酵甜菜时,能够更充分地利用其中的五碳糖,进而实现对各种碳源的高效利用。
尽管利用大肠杆菌通过液体发酵方式已能够高效利用蔗糖[12]、木糖[13]、糖蜜[14]发酵产生L-乳酸,但对于甜菜这种富含纤维及蔗糖的原料而言,半固态发酵是更为理想的选择。在液态发酵过程中,首先需要对原料进行糖化处理。为确保糖化效率,通常会加入大量的酸碱物质进行预处理,然而这一操作往往会降低预处理后可溶性糖的浓度,进而需要额外的浓缩步骤来保证发酵液中的糖浓度。 相比之下,少量添加预处理试剂并配合同步糖化进行半固态发酵的优势便凸显出来。 其一,预处理后的初始糖浓度得以相应提高;其二,未完全糖化的原料会在后续糖化进程中逐步释放糖分,从而避免了高糖浓度所导致的高渗透压以及碳代谢阻遏现象;其三,在半固态发酵体系中,不溶性固体基质具有相对较高的水活度,且富含微生物可利用的碳水化合物、氮源和矿物养分,这些成分能够被微生物充分利用[15]。除了液体发酵和半固态发酵方式外,还有固态发酵方式可选用,固态发酵具备产品终浓度高、产品稳定性良好[16]、污染物排放较少[17]以及原料来源广泛等优点[18]。但该方法也存在着传质效率低和产物检测难度大等问题。
本研究以工程大肠杆菌(Escherichia coli)HBUT-L为发酵菌株,利用甜菜作为碳源,结合磷酸钾(K3PO4)和复合纤维素酶处理,以分步糖化发酵(separate hydrolysis and fermentation,SHF)为对照,采用半固态同步糖化发酵(semisolid simultaneous saccharification and fermentation,SS-SSF)促进甜菜高效利用发酵生产L-乳酸。旨在为低成本L-乳酸工业化生产提供参考,也为解决甜菜资源过剩等问题提供新途径,同时为生物发酵产业提供技术创新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种和原料大肠杆菌(Escherichia coli)HBUT-L:由本实验室构建并保藏于-80 ℃冰箱。甜菜(糖用甜菜):新疆库尔勒市。
1.1.2 化学试剂
磷酸钾(K3PO4)(分析纯):国药集团化学试剂有限公司;甲醇(分析纯):天津市富宇精细化工有限公司;蛋白胨(生化试剂):上海盛思生化科技有限公司;酵母粉(生化试剂):安琪酵母股份有限公司;牛肉浸膏(生化试剂):北京双旋科技有限公司;碳酸钙(分析纯):天津华盛化学试剂有限公司;纤维素复合酶(比活力15 FPU/g):宁夏和氏璧生物技术有限公司。
1.1.3 培养基
液体种子培养基[19]:无机盐5 g/L,酵母粉2 g/L,蔗糖或葡萄糖20 g/L。121 ℃灭菌20 min。
固体种子培养基:液体种子培养基中添加1.8 g/L琼脂粉,pH值自然。121 ℃灭菌20 min。
甜菜发酵培养基:1.5 g/L甜菜粉末,30 mL 10 g/L K3PO4,酵母粉0.06 g/L,蛋白胨0.15 g/L,使用3 mol/L HCl将其pH调至6.5。90 ℃灭菌15 min。
1.2 仪器与设备
DNP-9052生化培养箱、PKB-5015电热恒温水浴锅:上海精宏实验设备有限公司;Waters e2695高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Waters 公司;5417R高速冷冻离心机:德国Eppendorf 公司;DFT-50A粉碎机:浙江温岭林达机械制造有限公司;ZHJH-1214B超净工作台:苏州净化设备有限公司;ZHWY-2102恒温摇床:上海智诚分析仪器有限公司;YXO-LS高压蒸汽灭菌锅:上海博迅实业有限公司;PH-030电热恒温鼓风干燥箱:上海一恒科学仪器有限公司。
1.3 方法
1.3.1 甜菜粉的制备
将甜菜去皮、切成2 cm×2 cm块状,将块状甜菜放置烘箱,于50 ℃干燥48 h,除去水分,将烘干后的甜菜用高速粉碎机粉碎,过40目筛,制得发酵前的甜菜固体粉末,封装于铝箔袋,置于4 ℃冰箱储存备用。
1.3.2 甜菜粉的磷酸钾及纤维素酶处理
K3PO4预处理:称取1.5 g甜菜样品粉末,加入30 mL质量浓度为4 g/100 mL K3PO4溶液,于110 ℃、200 r/min条件下振荡2 h,冷却至室温,即得甜菜粉碱处理液。
纤维素酶处理:甜菜粉碱处理液使用3 mol/L HCl将溶液pH调至6.5,加入15 FPU/g纤维素复合酶[20](用pH 4.8的磷酸缓冲液配制),于50 ℃酶解48 h,即得甜菜粉酶处理液。
1.3.3 种子液的制备
将保藏在-80 ℃冰箱中的大肠杆菌(Escherchia coli)HBUT-L菌种划线接种于蔗糖添加量2%固体种子培养基中,每24 h划线传代。在平板上挑选单菌落接种至装液量为50 mL/250 mL的液体种子培养基中,于40 ℃、200 r/min条件下振荡培养10~12 h,即得种子液。
1.3.4 甜菜分步糖化发酵
种子液按2%(V/V)接种量接入已灭菌甜菜发酵培养基中,并加入2%CaCO3作为发酵中和剂,于37 ℃、200 r/min摇床中发酵72 h(葡萄糖含量趋于稳定时,可认为发酵结束)。 分别于8 h、16 h、24 h、32 h、40 h、48 h、56 h、72 h取样测定发酵液中乳酸含量和葡萄糖含量。
1.3.5 甜菜半固态同步糖化发酵
种子液按2%(V/V) 接种量接入已灭菌甜菜发酵培养基中,并添加2%CaCO3作为发酵中和剂,于37 ℃、200 r/min摇床中发酵72 h(当乳酸含量达到预期值,且葡萄糖含量趋于稳定时,可认为发酵结束)。分别于8 h、16 h、24 h、32 h、40h、48h、56h、72h取样测定发酵液中的乳酸和葡萄糖含量。
1.3.6 分析与检测
(1)甜菜中纤维素、半纤维素及总木质素的测定
纤维素、半纤维素测定:采用酸水解-离心分离法[21];总木质素测定:采用两步酸水解法[22]。
(2)木糖和葡萄糖含量测定
木糖和葡萄糖含量测定:分别用苔黑酚比色定糖法和蒽酮比色法进行测定[23-24]。
将碱预处理和酶处理后的甜菜粉样品分别于3000r/min离心5 min后取1 mL上清液置于10 mL装有塞子的玻璃试管内,随后加入适量的去离子水,直至总体积达到1 mL,测定木糖和葡萄糖含量。
(3)蔗糖、果糖及有机酸含量测定
蔗糖、果糖及有机酸含量测定:高效液相色谱法[25]。
用6%的硫酸水溶液按体积比1∶1处理发酵液,静置数分钟,以10 000 r/min条件下离心10 min,用超纯水稀释后,用0.22 μm 滤膜过滤备用。蔗糖、葡萄糖、果糖含量检测时使用示差折光检测器(refractive index detector,RID),HPLC检测条件为:Welch Xtimate Sugar-H色谱柱(7.8 mm×300 mm,8 μm),流动相5 mmol/L H2SO4,流速1 ml/L,柱温45 ℃。L-乳酸含量检测使用二极管阵列检测器(photo-diode array,PDA),HPLC检测条件为:Xtimate SugarHl色谱柱,流动相5 mmol/L H2SO4,流速0.5 mL/min,柱温45 ℃,检测波长210 nm。进样量均为10 μL。
SugarHl色谱柱,流动相5 mmol/L H2SO4,流速0.5 mL/min,柱温45 ℃,检测波长210 nm。进样量均为10 μL。
1.3.7 糖利用率、糖化效率、乳酸产率及糖酸转化率计算公式

1.3.8 数据处理
使用Excel 2016对实验数据进行整理;使用IBM SPSS Statistics 19.0软件进行数据统计分析,两组数据间差异采用独立样本t检验进行分析,P<0.05和P<0.01分别表示差异显著和极显著。图表由Origin 2021软件制作。
2 结果与分析
2.1 甜菜粉碱处理对其降解的影响
由于细胞壁成分差异直接影响木质纤维素的降解速率,对木质纤维素的预处理尤其时木质素的预处理尤为重要。相较于传统的酸处理[26]、碱处理[27]及热水预处理手段[28],无机FeCl3、Na2CO3和ZnCl2处理等[29],这些方案中碱预处理技术能选择性去除木质素及半纤维素的乙酰基和糖醛酸取代基,展现出独特优势。 K3PO4作为碱性物质,近些年来在木质纤维素处理中已有一定应用。 付延松[30]运用K3PO4对甘蔗渣实施预处理后,其木质素成分降低了58%及63%,而纤维素的比例则相应上升了33%和30%。 不同浓度的K3PO4对甜菜粉碱处理液中蔗糖、葡萄糖及果糖含量的影响,结果见图1。
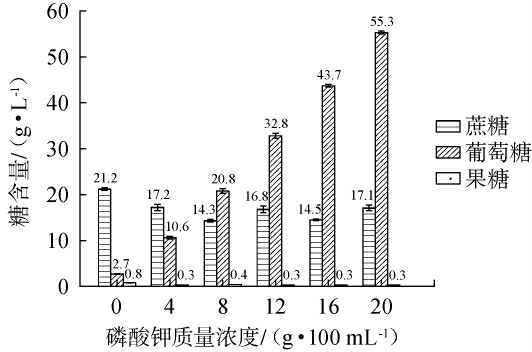
图1 不同浓度磷酸钾(K3PO4)预处理对甜菜粉碱处理液中蔗糖、葡萄糖及果糖含量的影响
Fig.1 Effects of pretreatment with different concentrations of potassium phosphate (K3PO4) on the contents of sucrose, glucose and fructose in the beet powder alkali treatment solution
由图1可知,随着K3PO4质量浓度在0~20 g/100 mL范围内增加,甜菜粉中果糖含量先下降后平稳,分析当K3PO4质量浓度增加到一定程度后,体系中能参与消耗果糖的反应或物质达到相对平衡状态,果糖的消耗与合成达到动态平衡;葡萄糖含量随之逐步增加,在K3PO4质量浓度为20 g/100 mL时,葡萄糖含量达到峰值,为55.3 g/L。这一结果可能归因于碱性条件下蔗糖的水解反应,促进了葡萄糖的生成[31]。当K3PO4质量浓度>20 g/100 mL之后,一方面底物可能已大量消耗殆尽,另一方面过高浓度的盐可能会抑制相关酶的活性或干扰反应体系,进而导致葡萄糖含量不再上升,甚至可能下降;蔗糖含量随之先下降后上升、再下降后上升,蔗糖含量呈双降双升趋势。初始下降是碱处理与K3PO4加速水解;首次上升分析可能是因中间产物缩合再生蔗糖;二次下降是反应持续引发进一步分解或其他反应;最终上升源于后期物质转化积累蔗糖。 这表明碱处理时,一部分蔗糖可能会发生水解反应,促进葡萄糖含量的持续增加,最终形成高的葡萄糖含量[32]。同时,K3PO4浓度的增加并未对果糖含量产生显著影响。 这可能是因为在碱性环境中,果糖容易发生差相异构化[33],转化为葡萄糖。 预处理后产生较少的果糖,对后续发酵将有助益,因为果糖和葡萄糖同时存在时由于葡萄糖阻遏效应,微生物发酵会优先利用葡萄糖,然后再利用果糖,这样会增加发酵周期[34]。在4 g/100 mL质量浓度下,果糖含量稳定在0.3 g/L,表明其酶促水解与后续代谢消耗已达到动态平衡,保证了果糖的无效积累。葡萄糖含量达到10.6 g/L,不仅能满足微生物发酵的碳源需求,且尚未抑制代谢,有利于后续产物的持续积累。蔗糖含量维持在17.2 g/L,既保留了适量可利用的底物,又防止了过量积累可能导致的渗透压失衡或代谢抑制。与20g/100mL高浓度相比,4 g/100 mL和8 g/100 mL质量浓度能有效避免蔗糖和葡萄糖的代谢抑制,同时防止过高糖浓度导致的副产物积累[35]。综合来看,K3PO4浓度是影响糖类转化与含量的关键因素,保证糖类转化效率的同时,优化经济性与工艺可行性。为进一步确定K3PO4最适宜的添加浓度,将对其进行进一步的降解。
2.2 甜菜粉碱处理及酶处理对其降解的影响
经过K3PO4处理后,理论上木质素去除增加,而纤维素有待进一步降解,因此甜菜粉在经K3PO4处理后进一步进行纤维素酶处理,提高糖化效率。不同浓度磷酸钾(K3PO4)对甜菜粉碱、酶处理液中木糖、葡萄糖、总糖含量及糖化效率的影响,结果见表1。
表1 不同浓度磷酸钾(K3PO4)对甜菜粉碱、酶处理液中木糖、葡萄糖、总糖含量及糖化效率的影响
Table 1 Effects of different concentration of K3PO4 on the contents of xylose, glucose, total sugar and saccharification efficiency of beet powder alkali and enzyme treatment solution
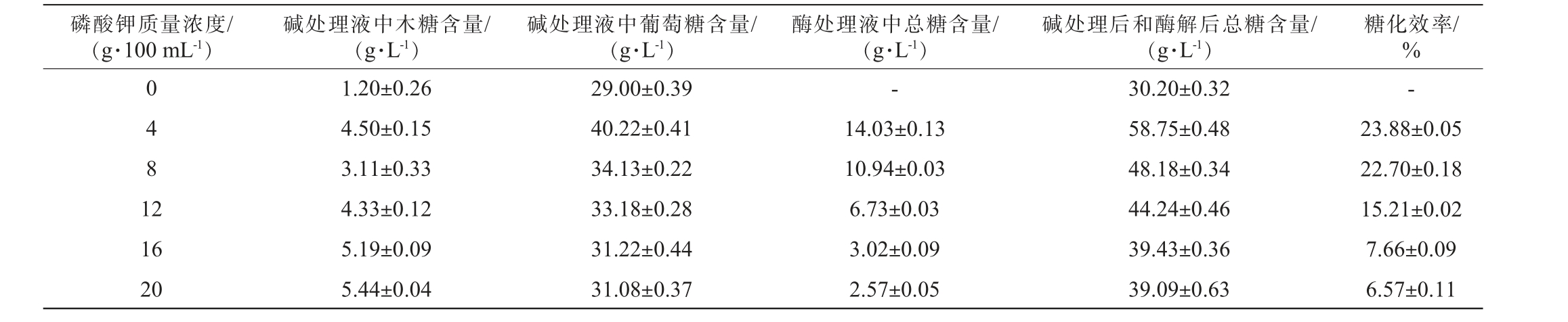
磷酸钾质量浓度/(g·100 mL-1)碱处理液中木糖含量/(g·L-1)碱处理液中葡萄糖含量/(g·L-1)酶处理液中总糖含量/(g·L-1)碱处理后和酶解后总糖含量/(g·L-1)糖化效率/%0 4 8 1 2--16 20 1.20±0.26 4.50±0.15 3.11±0.33 4.33±0.12 5.19±0.09 5.44±0.04 29.00±0.39 40.22±0.41 34.13±0.22 33.18±0.28 31.22±0.44 31.08±0.37 14.03±0.13 10.94±0.03 6.73±0.03 3.02±0.09 2.57±0.05 30.20±0.32 58.75±0.48 48.18±0.34 44.24±0.46 39.43±0.36 39.09±0.63 23.88±0.05 22.70±0.18 15.21±0.02 7.66±0.09 6.57±0.11
由表1可知,在4~20 g/100 mL K3PO4预处理的基础上,添加3 FPU/g的纤维素复合酶,均能提升甜菜的总糖含量与糖化效率。 分析原因可能是由于木质素的去除,纤维素酶与纤维素的接触面积得以扩大,进而促进了纤维素的更高效水解,糖化效率增加[36]。 4 g/100 mL K3PO4碱处理上清液中葡萄糖和木糖含量最高,分别为40.22 g/L和4.5 g/L;酶处理上清液中的总糖(葡萄糖+木糖)、碱处理后和酶解后的总糖(葡萄糖+木糖)、糖化效率最高,分别为14.03 g/L、58.75 g/L、23.88%。而当K3PO4质量浓度>4 g/100 mL之后,糖化效率逐渐降低。 推测有一部分原因可能与K3PO4预处理过程中产生的高含量的可发酵糖(葡萄糖)有关,葡萄糖浓度升高可抑制纤维素复合酶的活性。 因此,预处理试剂K3PO4的质量浓度4 g/100 mL为宜。
甜菜粉碱和酶处理前后纤维素,半纤维素、总木质素及果胶含量测定结果见表2。由表2可知,甜菜粉经过碱和酶处理后,纤维素占比大幅提升了53%,分析碱处理可能破坏了细胞壁中束缚纤维素的结构,使原本与半纤维素、木质素等紧密结合的纤维素得以暴露,同时酶处理中纤维素酶可特异性地作用于纤维素,进一步促进其溶出与分离。半纤维素含量则显著减少了近半,分析可能是由于碱液破坏了半纤维素与木质素之间的酯键等连接,而酶处理进一步将其降解。 果胶含量锐减了约73%,碱处理可使果胶发生水解等反应,破坏其结构,酶处理中果胶酶则直接作用于果胶,将其分解,导致含量大幅降低。总木质素含量明显降低,降幅达到了70%,分析碱处理可能皂化木质素中的酯键,使其结构变得松散,更易被后续的酶或提取过程去除,而酶处理加速其含量下降。半纤维素和纤维素含量的降低印证了在纤维素酶酶解开始前就已经很高的葡萄糖含量(见表1),而木质素的减少,也为后续纤维素酶提升糖化率提供了支撑。
表2 甜菜粉碱和酶处理前后甜菜中纤维素、半纤维素、总木质素及果胶含量测定结果Table 2 Determination results of cellulose, hemicellulose, total lignin and pectin contents in beet before and after beet powder alkali and enzyme treatment
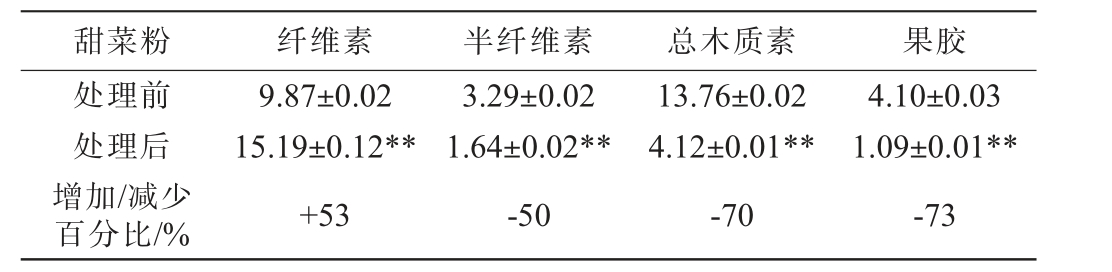
注:“**”表示差异极显著(P<0.01)。
甜菜粉 纤维素 半纤维素 总木质素 果胶处理前处理后增加/减少百分比/%9.87±0.02 15.19±0.12**+53 3.29±0.02 1.64±0.02**-50 13.76±0.02 4.12±0.01**-70 4.10±0.03 1.09±0.01**-73
2.3 甜菜半固态同步糖化发酵生产L-乳酸
采用甜菜发酵培养基进行半固态分步糖化发酵,发酵结果与同步糖化、未处理原料、经过4 g/100 mL K3PO4处理原料发酵效果进行比较,结果见图2。
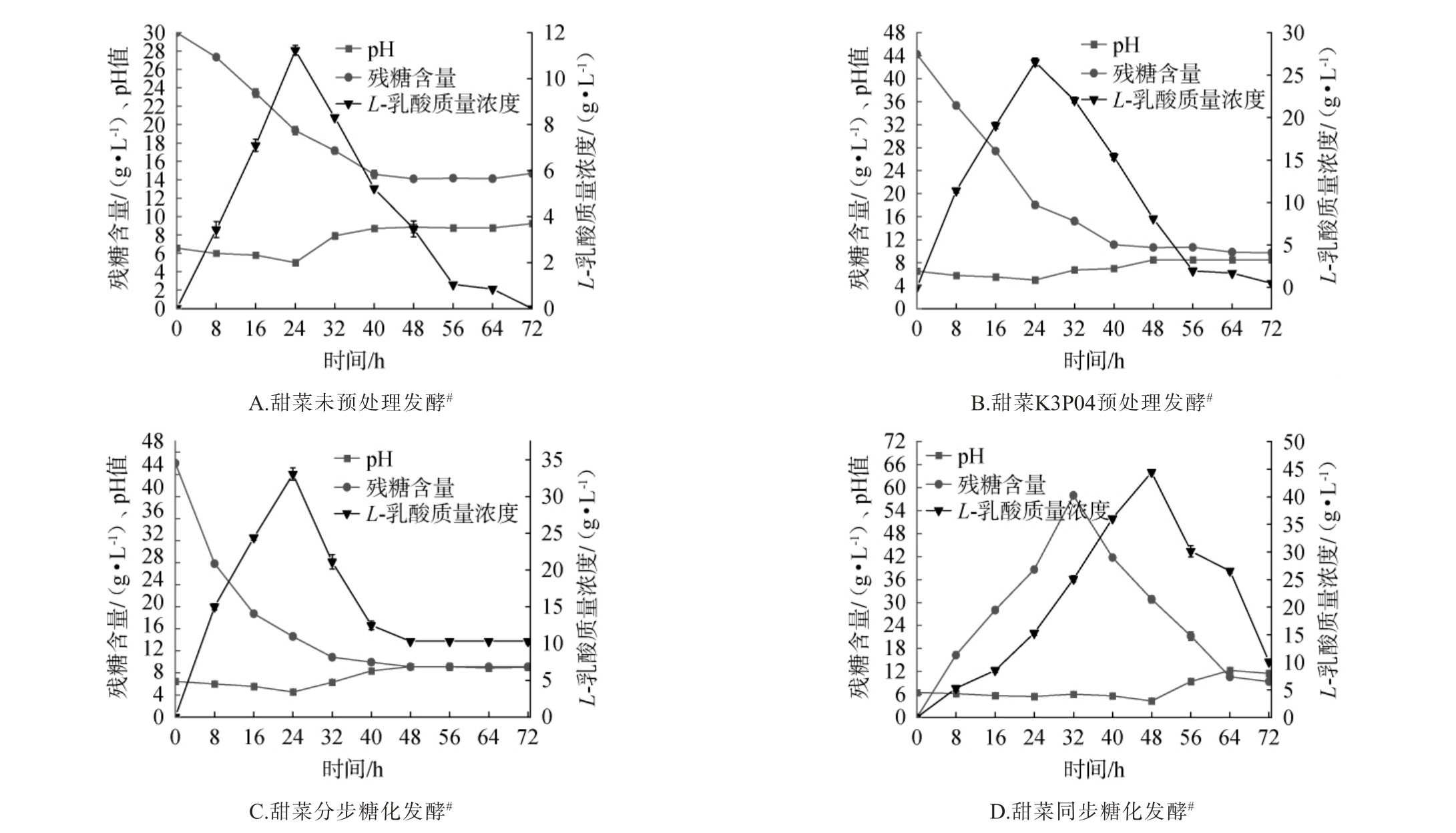
图2 半固态分步糖化发酵产L-乳酸的结果
Fig.2 Results of L-lactic acid production by semi-solid staged saccharification fermentation
“#”表示均补加2%中和剂CaCO3进行发酵。
由图2A可知,未经预处理样品在24 h内乳酸产量达到峰值,为11.09 g/L,同时蔗糖和葡萄糖的残糖含量分别为8.4 g/L和6.03 g/L。由图2B可知,经过K3PO4预处理的样品在相同时间内乳酸产量提升至26.9 g/L,且残糖含量明显降低,蔗糖和葡萄糖的残糖量分别降至5.1 g/L和4.6 g/L。 由图2C可知,采用分步糖化发酵工艺时,乳酸产量在72 h(酶解糖化48 h后发酵24 h)达到峰值,为33.2 g/L,蔗糖和葡萄糖的残糖量分别为3.6 g/L和5.5 g/L。 由图2D可知,在同步糖化发酵工艺时,乳酸产量在48 h达到最高,为44.51 g/L,蔗糖和葡萄糖的残糖量分别为2.5 g/L和7.1 g/L。 考虑到分步糖化发酵相对于半固态同步糖化发酵多了一步酶解糖化过程,额外消耗了48 h,所以达到乳酸最大浓度总共耗费了72 h。 因此,同步糖化达到最高乳酸浓度仅需48 h,而分步糖化总需72 h,发酵周期缩短约33%。 结果表明,预处理和不同发酵方式的优化能够在不同程度提高乳酸产量,其中同步糖化发酵方式的效果最为显著。
不同发酵方式对甜菜半固态发酵生产L-乳酸的影响结果见表3。由表3可知,甜菜通过多级处理(原料未预处理、原料经碱处理、分步糖化、同步糖化)发酵后,逐步提高了糖化效率和蔗糖利用率。
表3 不同发酵方式对甜菜半固态发酵生产L-乳酸的影响
Table 3 Effects of different fermentation methods on production of L-lactic acid with semi-solid state fermentation of sugar beet
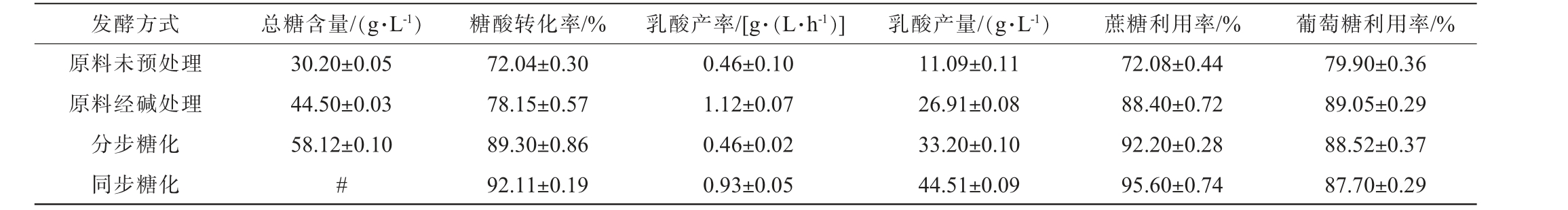
注:#表示同步糖化是一个动态过程,糖类(如葡萄糖)的浓度会随着时间不断变化,导致难以实时精确测定,故设定同步糖化总糖含量与分步糖化总糖含量相同为58.12 g/L。
发酵方式 总糖含量/(g·L-1) 糖酸转化率/% 乳酸产率/[g·(L·h-1)] 乳酸产量/(g·L-1) 蔗糖利用率/% 葡萄糖利用率/%原料未预处理原料经碱处理分步糖化同步糖化30.20±0.05 44.50±0.03 58.12±0.10#72.04±0.30 78.15±0.57 89.30±0.86 92.11±0.19 0.46±0.10 1.12±0.07 0.46±0.02 0.93±0.05 11.09±0.11 26.91±0.08 33.20±0.10 44.51±0.09 72.08±0.44 88.40±0.72 92.20±0.28 95.60±0.74 79.90±0.36 89.05±0.29 88.52±0.37 87.70±0.29
由表3可知,与未预处理的甜菜发酵相比,原料经碱处理显著提升发酵性能,糖酸转化率从72.04%提高至78.15%(提升了7%),乳酸产率从0.46 g/(L·h)提高至1.12 g/(L·h)(提升了143%)。预处理后总糖含量从30.20提高至44.5 g/L(提升了47%),蔗糖和葡萄糖利用率从72.08%、79.90%分别提高至88.40%、89.05%(分别提升了22%和11%),表明原料经碱处理能够促进糖分释放和优化代谢途径显著提高发酵效率[37]。
在糖化发酵方式对比中,同步糖化发酵糖酸转化率(92.11%)较分步糖化糖酸转化率(89.30%)提升了3%;乳酸产率(0.93 g/(L·h)较分步糖化酸产率(0.46 g/(L·h))提升了102%;乳酸产量(44.51 g/L)较分步糖化乳酸产量(33.20 g/L)提升了34%。分步糖化的酶解温度为50 ℃,而同步糖化在37 ℃下进行,且未抑制酶解与乳酸生成效果。 综上,同步糖化通过整合酶解与发酵步骤,在低温(37 ℃)下实现糖分高效转化,显著缩短生产周期,并提升乳酸产量、乳酸产率及糖酸转化率,是甜菜生产L-乳酸的更优选择。
3 结论
半固态同步糖化发酵的L-乳酸产率达0.93 g/(L·h),较分步糖化发酵L-乳酸产量提升34%、产率提高102%,同时蔗糖利用率和糖酸转化率也显著提高。该研究通过糖化与发酵过程结合,有效减轻了产物抑制效应,缩短了发酵周期,为甜菜纤维素资源高效转化为L-乳酸提供了创新路径,在生物基化学品绿色制造领域具有重要应用潜力。
[1]LIU H,WANG Q Q,YU M M,et al.Transgenic salt-tolerant sugar beet(Beta vulgaris L.)constitutively expressing an Arabidopsis thaliana vacuolar Na+/H+antiporter gene,AtNHX3,accumulates more soluble sugar but less salt in storage roots[J].Plant Cell Environ,2008,31(9):1325-1334.
[2]吴子毅,赵抒娜,陈海军,等.甜菜纤维及果胶的应用浅析[J].中国糖料,2024,46(3):97-104.
[3]王荣华,李守明,艾依肯,等.新疆甜菜产业发展现状与展望[J].中国糖料,2022,44(1):81-86.
[4]MCGRATH J M,TOWNSEND B J.Sugar beet,energy beet,and industrial beet[J].Ind Crops Bioen Biopr,2015,9(1):81-99.
[5]UYAR B,GÜRGAN M,ÖZGÜR E,et al.Hydrogen production by hup(-)mutant and wild-type strains of Rhodobacter capsulatus from dark fermentation effluent of sugar beet thick juice in batch and continuous photobioreactors[J].Bioprocess Biosyst Eng,2015,38(10):1935-1942.
[6]BERŁOWSKA J, PIELECH-PRZYBYLSKA K, BALCEREK M, et al.Simultaneous saccharification and fermentation of sugar beet pulp for efficient bioethanol production[J].Biomed Res Int,2016,2016:3154929.
[7]BERLOWSKA J, CIECIURA-WŁOCH W, KALINOWSKA H, et al.Enzymatic conversion of sugar beet pulp:A comparison of simultaneous saccharification and fermentation and separate hydrolysis and fermentation for lactic acid production[J].Food Technol Biotechnol,2018,56(2):188-196.
[8]BERLOWSKA J, CIECIURA W, BOROWSKI S, et al.Simultaneous saccharification and fermentation of sugar beet pulp with mixed bacterial cultures for lactic acid and propylene glycol production[J].Molecules,2016,21(10):1380.
[9]刘汝婷.利用混合糖产L-乳酸大肠杆菌工程菌的构建及其对小麦秸秆发酵研究[D].武汉:湖北工业大学,2021.
[10]王健,张栋,赵抒娜,等.利用糖蜜和甜菜粕开发固态发酵饲料的初步探索[J].中国糖料,2021,43(3):75-80.
[11]伍陆.混合糖条件下酵母双菌发酵制备SCP研究[D].南京:南京林业大学,2019.
[12]赵筱,李坤朋,赵锦芳,等.高光学纯度L-乳酸工程菌的构建及其蔗糖发酵[J].食品与发酵科技,2012,48(5):40-45.
[13]邱炜玥,李敏,陈思宇,等.构建大肠杆菌合成生物群落利用混合糖同步发酵生产L-乳酸[J].中国食品学报,2024,24(7):208-218.
[14]赵锦芳,薛葳蕤,张晓敏,等.大肠杆菌工程菌利用甘蔗糖蜜发酵产L-乳酸研究[J].湖北农业科学,2016,55(24):6541-6545.
[15]金李玲,孙丽霞,陈思婷,等.鼠李糖乳杆菌半固态发酵法生产L-乳酸及发酵动力学分析[J].食品工业科技,2015,36(19):195-201.
[16]SINGHANIA R R,PATEL A K,SOCCOL C R,et al.Recent advances in solid-state fermentation[J].Biochem Eng J,2009,44(1):13-18.
[17]ZHUANG L,ZHOU S G,WANG Y Q,et al.Cost-effective production of Bacillus thuringiensis biopesticides by solid-state fermentation using wastewater sludge: Effects of heavy metals[J].Bioresource Technol,2011,102(7):4820-4826.
[18]DEVI P V, RAVINDER T, JAIDEV C.Cost-effective production of Bacillus thuringiensis by solid-state fermentation[J].J Invertebr Pathol,2005,88(2):163-168.
[19]VIJAYAKUMAR J,ARAVINDAN R,VIRUTHAGIRI T.Lactic acid and its potential applications in industries[J].Bioprod Biosyst Eng, 2007,42(9):101-103.
[20]XU J L,LI H H,ALAM M A,et al.Employing cationic kraft lignin as additive to enhance enzymatic hydrolysis of corn stalk[J].Polymers,2023,15(9):1991.
[21]PENG L, HOCART C H, REDMOND J W, et al.Fractionation of carbohydrates in Arabidopsis root cell walls shows that three radial swelling loci are specifically involved in cellulose production[J].Planta, 2000,211(3):406-414.
[22]WU Z L,ZHANG M L,WANG L Q,et al.Biomass digestibility is predominantly affected by three factors of wall polymer features distinctive in wheat accessions and rice mutants[J].Biotechnol Biofuels,2013,6(1):183.
[23]张颖,高泽萍,王旭,等.蚯蚓肠道铁还原过程对活性氧形成的影响[J].中国环境科学,2025,45(4):2053-2062.
[24]贾银花,靳春平,文永平,等.不同木屑对四川烟熏腊肉中挥发性物质的影响[J].肉类研究,2024,38(11):34-40.
[25]姜琳琳,王静,杨洋,等.干旱胁迫对‘赤霞珠’葡萄品质的影响[J].经济林研究,2025,43(1):154-160.
[26]SOLARTE-TORO J C,ROMERO-GARCÍA J M,MARTÍNEZ-PATIÑO J C,et al.Acid pretreatment of lignocellulosic biomass for energy vectors production:a review focused on operational conditions and techno-economic assessment for bioethanol production[J].Renew Sust Energ Rev,2019,107:587-601.
[27]CHEN Y,STEVENS M A,ZHU Y M,et al.Understanding of alkaline pretreatment parameters for corn stover enzymatic saccharification[J].Biotechnol Biofuels,2013,6:1-10.
[28]刘芬,朱顺妮,徐忠斌,等.超声辅助热水浸提小球藻多糖及抗氧化活性测定[J].中国酿造,2020,39(2):177-181.
[29]UM J, KIM D G, JUNG M Y, et al.Metabolic engineering of Enterobacter aerogenes for 2,3-butanediol production from sugarcane bagasse hydrolysate[J].Bioresource Technol,2017,245:1567-1574.
[30]付延松.优化K3PO4预处理促进甘蔗渣高效酶解产醇分子机理及渣液利用的研究[D].武汉:华中农业大学,2023.
[31]LI J H,LI S Z,HAN B,et al.A novel cost-effective technology to convert sucrose and homocelluloses in sweet sorghum stalks into ethanol[J].Biotechnol Biofuels,2013,6:1-12.
[32]RABELO S C,ANDRADE R R,MACIEL FILHO R,et al.Alkaline hydrogen peroxide pretreatment,enzymatic hydrolysis and fermentation of sugarcane bagasse to ethanol[J].Fuel,2014,136:349-357.
[33]朱福莉,王蕾,李思宇,等.碱性铌酸钾催化单糖异构化的研究[J].现代化工,2024,44(11):110-115.
[34]TULLMAN J,MARINO J P,KELMAN Z.Leveraging nature's biomolecular designs in next-generation protein sequencing reagent development[J].Appl Microbiol Biot,2020,104:7261-7271.
[35]许雪晨,王浩淼,陈修来,等.代谢工程改造大肠杆菌底物利用途径促进L-赖氨酸生产[J].生物工程学报,2024,40(8):2513-2527.
[36]李乔丹,刘彬,庄倩倩,等.糠醛渣的预处理、酶解优化及同步糖化发酵[J].中国酿造,2018,37(4):115-120.
[37]ASHOOR S,SUKUMARAN R K.Mild alkaline pretreatment can achieve high hydrolytic and fermentation efficiencies for rice straw conversion to bioethanol[J].Prep Biochem Biotech,2020,50(8):814-819.